0 引 言
生物炭是一种新型吸附材料,是生物质(秸秆、木屑、动物粪便等)经过高温热解碳化形成的一种含碳量丰富、性质稳定的物质。由于生物炭孔隙发达,比表面积较高,且具有丰富的表面官能团,因此对水中重金属如As(Ⅲ)、Cr(Ⅵ)、Pb(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)、Cu(Ⅱ)等具有良好的去除效果[1-3]。表1列举出国内外几种生物炭改性后对水中重金属的吸附效果。可知,不同生物质制得的生物炭及其改性后对重金属的吸附能力均有差异。
目前生物炭改性面临着诸多问题,如改性成本高、改性工艺复杂、对水体造成二次污染等,且对生物炭改性方法单一(单一增加比表面积、增加表面官能团等)。因此,本研究选用稻壳生物质作为原料,探讨CaCl2改性与CaCl2与H2O2混合改性对其结构及吸附性能的影响。经CaCl2改性可增加生物炭的比表面积,经H2O2改性可增加表面官能团含量或生成羧酸盐,增加了生物炭的化学吸附能力,且改性后不会对环境造成二次污染。混合改性方法为生物炭在环境领域的应用提供技术支撑。
表1 国内外生物炭改性后对水中重金属吸附效果
Table 1 Adsorption of heavy metals in water by modified biochar at home and abroad
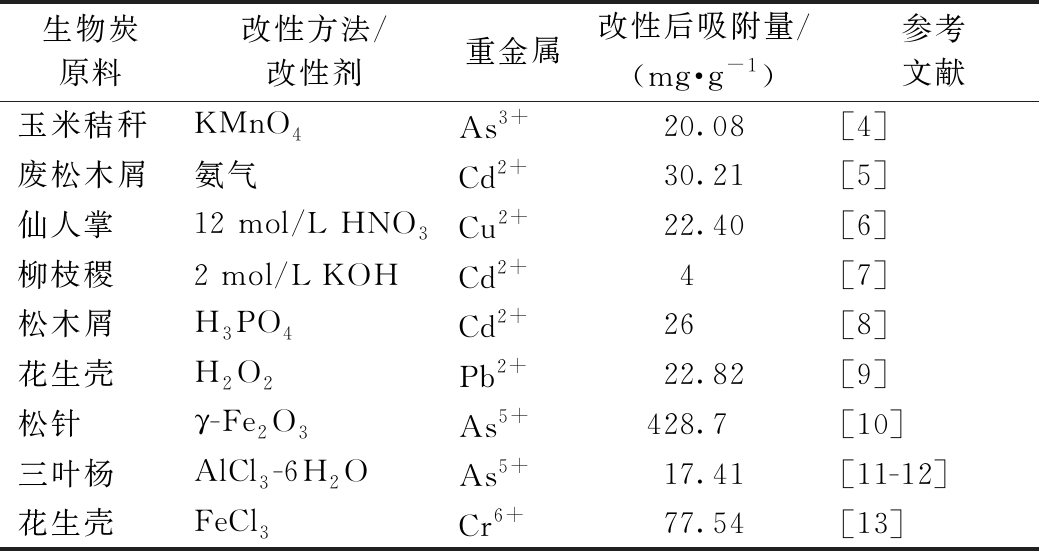
生物炭原料改性方法/改性剂重金属改性后吸附量/(mg·g-1)参考文献玉米秸秆KMnO4As3+20.08[4]废松木屑氨气Cd2+30.21[5]仙人掌12 mol/L HNO3Cu2+22.40[6]柳枝稷2 mol/L KOHCd2+4[7]松木屑H3PO4Cd2+26[8]花生壳H2O2Pb2+22.82[9]松针γ-Fe2O3As5+428.7[10]三叶杨AlCl3-6H2OAs5+17.41[11-12]花生壳FeCl3Cr6+77.54[13]
1 试验部分
1.1 试验原料及试剂
稻壳取自某稻谷加工厂,NaOH、Cd(NO3)2、CaCl2、30% H2O2、硝酸、镉标准溶液均购自国药集团化学试剂有限公司。
1.2 生物炭及改性生物炭的制备
1.2.1 生物炭的制备
稻壳经自来水冲洗后置于70 ℃烘箱中烘干,经烘干后的材料置于马弗炉中,在N2的保护下,控制马弗炉以10 ℃/min的升温速率至500 ℃后保温 3 h,继续通入N2,自然冷却至室温后研磨过100目筛备用。
1.2.2 改性生物炭的制备
CaCl2改性:配制30 g/L的CaCl2溶液,称取30 g稻壳生物质置于1 L CaCl2溶液中,浸渍24 h后置于烘箱中烘干。热解过程与制备生物炭相同,自然冷却研磨后过100目筛备用。
CaCl2与H2O2混合改性:配制20%H2O2溶液,称取1 g CaCl2改性生物炭置于10 mL H2O2溶液中充分反应2 h后抽滤,并用去离子水对改性生物炭进行多次洗涤,洗去多余的H2O2,后置于70 ℃烘箱烘干,自然冷却后备用。
1.3 生物炭的表征
采用美国麦克公司ASAP2020 M+C型全自动比表面积、微孔孔隙仪分析生物炭孔隙结构。采用荷兰帕纳科公司生产的X’Pert Pro型X射线衍射仪(XRD)进行材料晶体结构分析。采用赛默飞世尔科技公司的iS10型傅里叶红外光谱仪分析样品表面官能团。采用日本日立公司S4800型场发射扫描电子显微镜来观察样品的样貌。
1.4 吸附试验
1.4.1 pH对吸附性能的影响
控制生物炭的投加量为0.75 g/L,ρ(Cd2+)的初始值为10 mg/L,吸附温度为25 ℃,吸附时间为24 h,分别在pH为3、4、5、6、7、8的条件下进行吸附,24 h后离心取上清液测定溶液浓度,每个pH设3个平行样,取结果平均值。
1.4.2 吸附动力学试验
控制生物炭的投加量为0.75 g/L,ρ(Cd2+)的初始值为10 mg/L,吸附温度为25 ℃,pH为6。分别在吸附10 min、0.5 h、1 h、2 h、4 h、6 h、12 h、24 h时离心取上清液测定溶液中Cd2+浓度,每个时间段做3个平行样,取结果平均值。利用Langergren动力学方程:准一级动力学方程(式(1))和准二级动力学方程(式(2))来描述生物炭吸附Cd2+的动力学过程。方程如下:
ln(qe-qt)=lnqe-k1t
(1)
(2)
式中:qe为吸附平衡时单位质量吸附剂的吸附量,mg/g;qt为t时刻单位质量吸附剂的吸附质量,mg/g;k1为一级动力学吸附速率常数,t-1;k2为二级动力学吸附速率常数,g/(mg·min)。
1.4.3 吸附等温线试验
控制生物炭的投加量为0.75 g/L,吸附温度为25 ℃,pH为6,吸附时间为24 h。分别在Cd2+的初始质量浓度为30,40,50,60,70,80,90 mg/L的条件下吸附,24 h后离心取上清液测定溶液浓度,每个初始浓度设3个平行样,取结果平均值。采用Langmuir方程和Freundlich方程对结果进行拟合,方程如下:
(3)
lgqe=lgKf+nlgCe
(4)
式中:qe为平衡时的吸附量,mg/g;qm为最大吸附量,mg/g;b为常数,可表征吸附材料表面的吸附位点对重金属离子亲和力的大小,L/mg;Ce为吸附平衡时溶液浓度,mg/L;Kf为与吸附容量有关的参数,mg·L1/n·g-1·mg-1/n;n为吸附质分子与吸附剂表面作用强度有关的参数;1/n为反应吸附等温线的非线性程度。
2 结果与讨论
2.1 改性处理对生物炭的比表面积、孔径和表面性质的影响
改性前后生物炭的扫描电镜图如图1所示。未改性生物炭(a)表面粗糙、断面不整且孔径小,经CaCl2改性后的生物炭(b)和CaCl2与H2O2混合改性后的生物炭(c)均呈现出多孔炭架结构,且孔道轮廓更加清晰明显,孔径也较生物炭(a)更大,是由于生成的CaCO3起到了支撑作用[18]。经CaCl2与H2O2混合改性后的生物炭(c)出现了孔道坍塌、腐蚀现象,是H2O2的强氧化作用导致。

图1 改性前后生物炭的表面扫描电镜
Fig.1 SEM images of surface section of the biochars before and after modification
改性前后生物炭的比表面积和孔结构参数如表2所示。可知:改性后,生物炭的比表面积和孔容均大于未改性生物炭,其中CaCl2改性生物炭的比表面积最大,相较于未改性生物炭比表面积增大了8.15倍,总孔容积增大了4.67倍。经CaCl2与H2O2混合改性后,生物炭比表面积与总孔容积较CaCl2改性有所下降,这是因为在20% H2O2的强氧化作用下,生物炭的表面发生氧化反应,孔道腐蚀坍塌,堵塞了微孔甚至中孔,导致比表面积和孔容减小[9, 14]。同时,含氧官能团连接在孔的表面,致使部分孔被堵塞,孔隙狭窄,这也是比表面积变小的原因[15]。由表2还可以看出:CaCl2改性比表面积明显增大,原因在于CaCl2的存在可以形成许多中孔使生物炭孔隙度增大[16]。
表2 改性前后生物炭的比表面积及孔结构参数
Table 2 Specific surface area and porosity parameters of biochar before and after surface modification

生物炭比表面积/(m2·g-1)总孔容积/(cm3·g-1)C3.500.006Ca-C32.040.034CaH-C15.900.021
利用FTIR对改性前后生物炭表面官能团进行分析,结果如图2所示。可知:Ca-C与CaH-C的红外谱图基本相似。改性后生物炭在880 cm-1处的峰为R2C![]() CH2的吸收峰;Ca-C在1330~1430 cm-1与1550~1610 cm-1的峰为R—COO(羧酸盐)的吸收峰,再经H2O2改性峰强度进一步增强,说明有更多羧酸盐生成。
CH2的吸收峰;Ca-C在1330~1430 cm-1与1550~1610 cm-1的峰为R—COO(羧酸盐)的吸收峰,再经H2O2改性峰强度进一步增强,说明有更多羧酸盐生成。
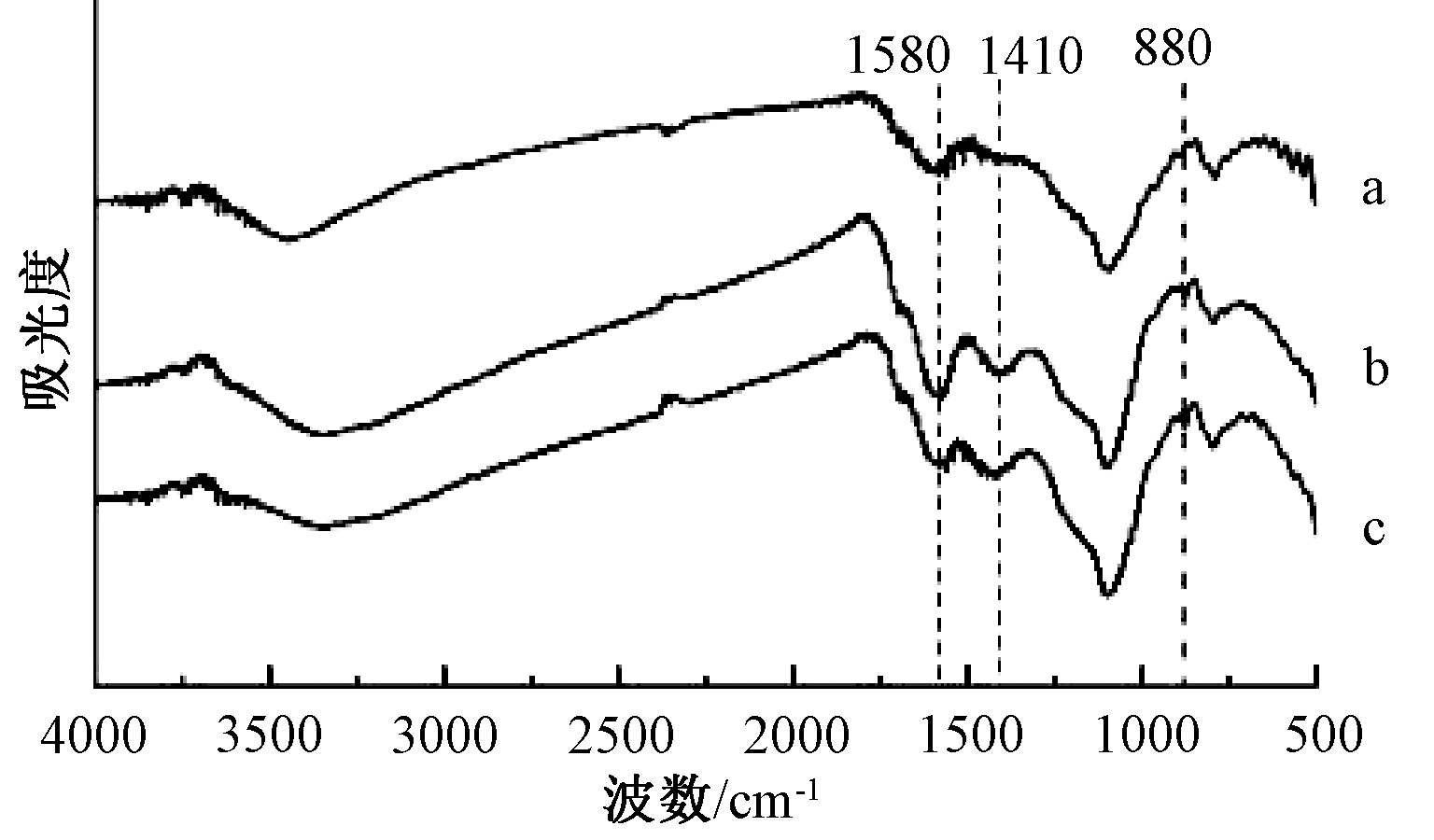
a—C; b—CaH-C; c—Ca-C。
图2 生物炭的红外谱图
Fig.2 FTIR spectrogram of biochars
改性前后生物炭的XRD谱图如图3所示。可知:经CaCl2改性后在2θ=28°时出现了尖而强的CaCO3衍射峰,这与赵明静等[17]用CaCl2改性生物炭结果一致。加入H2O2后,CaCO3的衍射峰减弱,是H2O2氧化生成的羧基与CaCO3反应导致CaCO3的量减少,改性后的红外谱图也表明R-COO的含量有所增加,印证了这一可能。
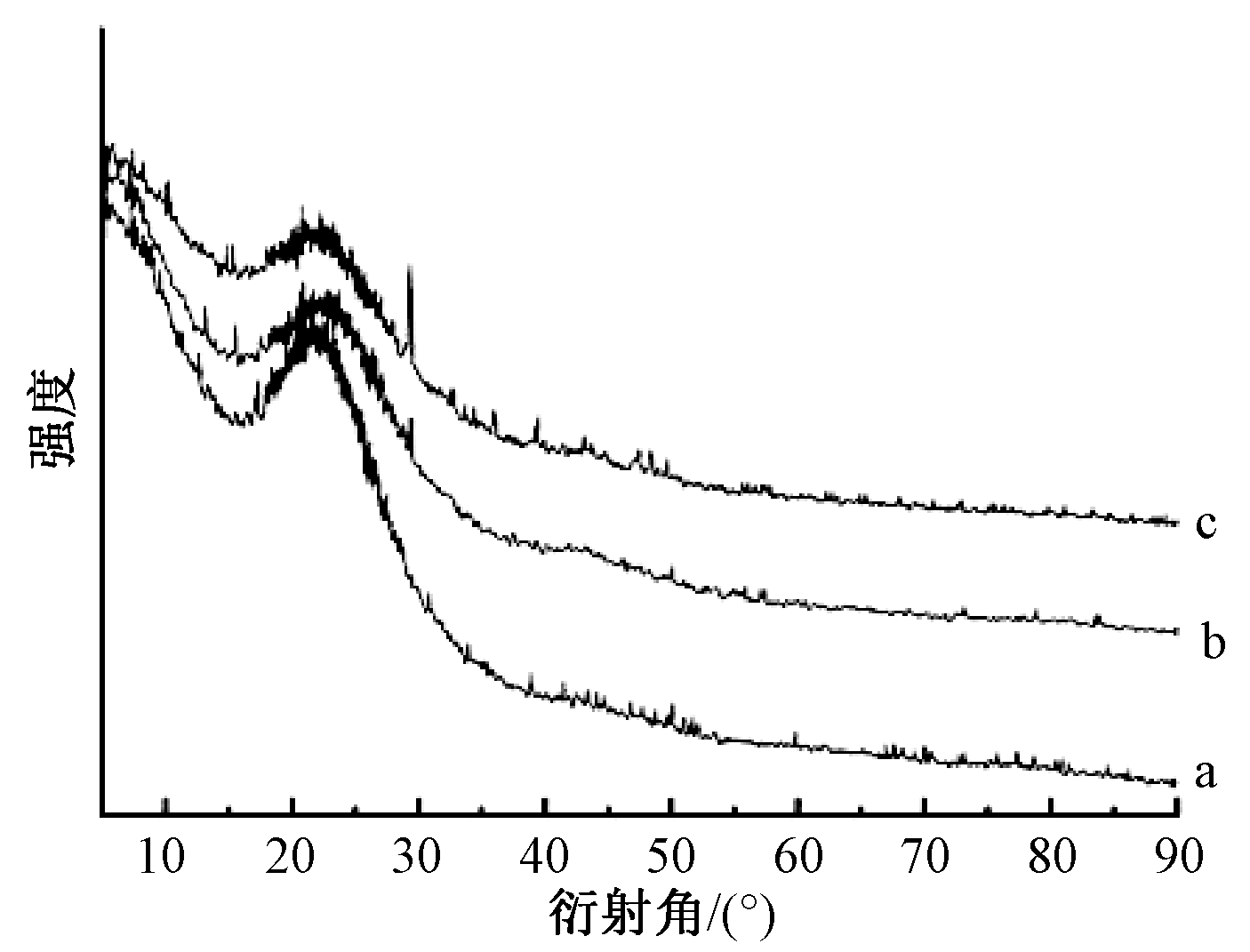
a—C; b—CaH-C; c—Ca-C。
图3 生物炭的XRD谱图
Fig.3 XRD spetrogram of biochars
经CaCl2改性后出现了Ca元素如图4b所示,证明改性后Ca添加到生物炭中,且C元素含量明显上升,是CaCO3的生成导致。再经H2O2改性(图4c),Ca元素含量基本不变,表明改性并未导致Ca的流失,而C含量减少,分析是H2O2氧化生成的R-COOH与CaCO3反应生成R-COOCa的结果,这也与红外谱图中R—COO的含量增加相对应。
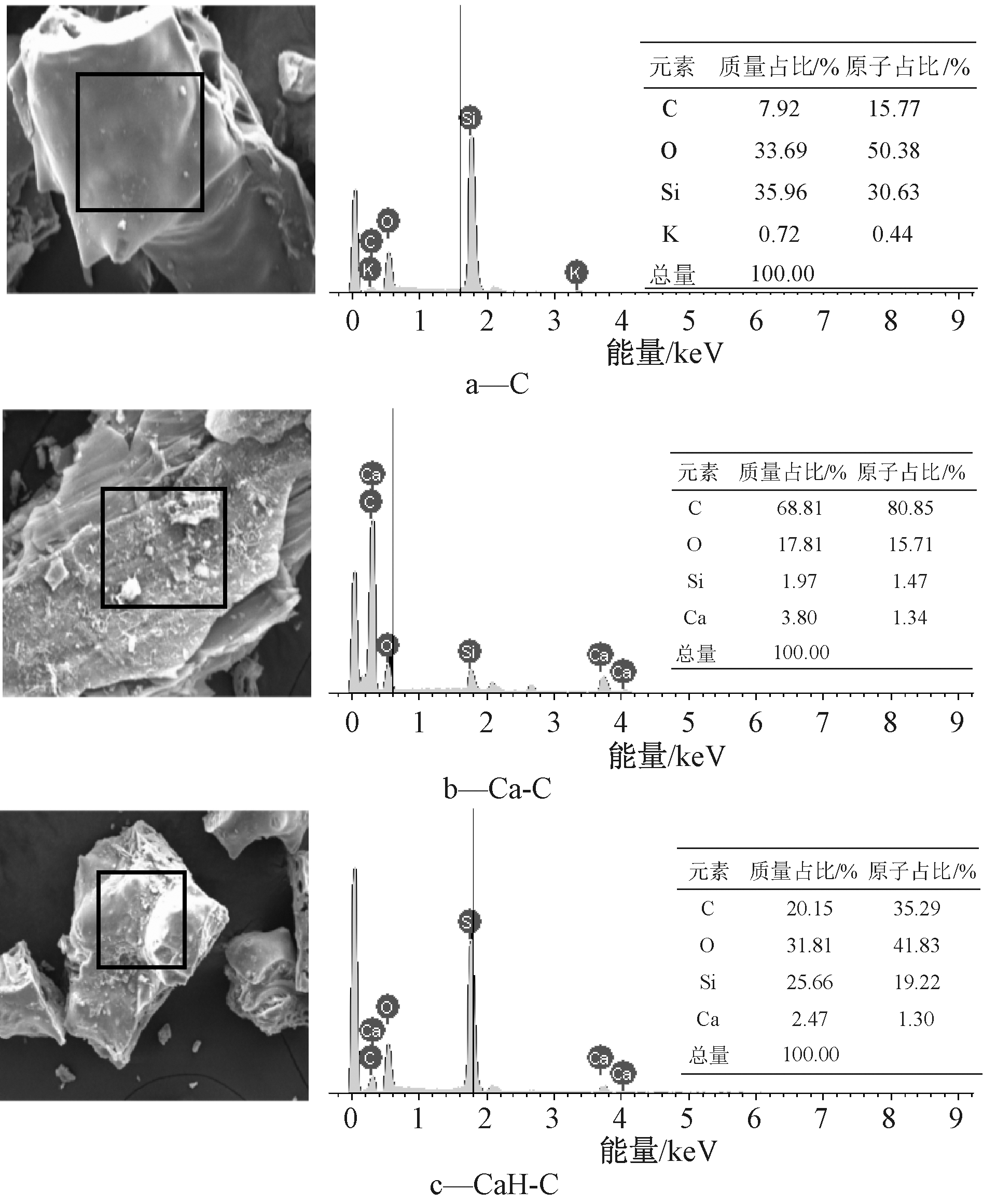
图4 生物炭的电镜分析和元素分析
Fig.4 Photos and elements analysis results of the biochars by SEM-EDS
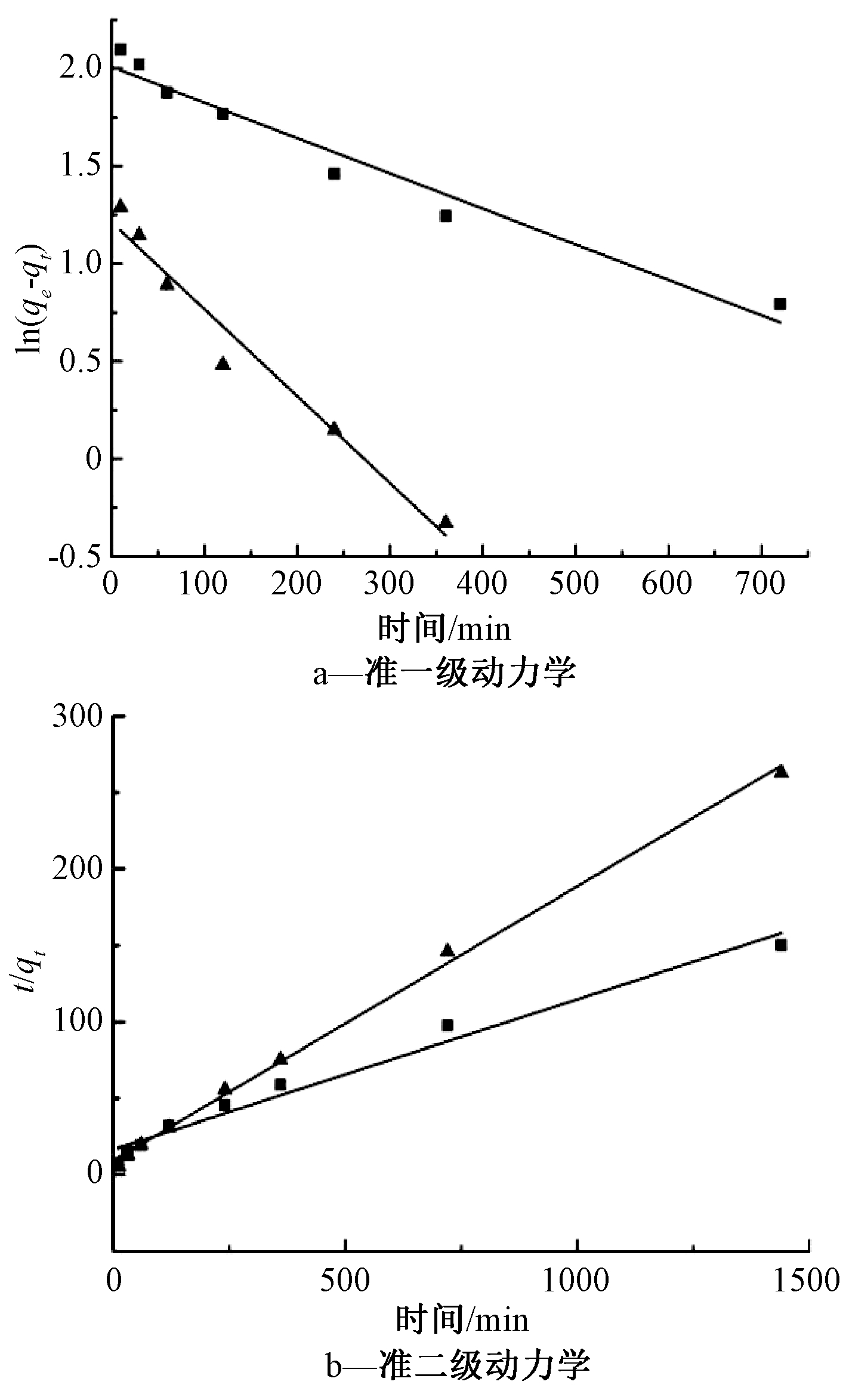
2.2 吸附动力学模型
分别采用准一级动力学方程和准二级动力学方程进行拟合,改性生物炭的动力学曲线如图5所示,拟合结果见表3。由表3可知:准二级动力学方程的R2明显高于准一级动力学方程,并且准二级动力学方程拟合出的平衡吸附量更接近实测吸附量。所以,准二级动力学方程更适合描述Cd2+在生物炭上的吸附,主要是由于Cd2+与生物炭之间存在电子对共用、离子交换和表面络合等相互作用。
![]() —Ca-C;
—Ca-C; ![]() —CaH-C。
—CaH-C。
图5 生物炭的吸附动力学曲线
Fig.5 Adsorption kinetic curves of the biochars
表3 改性生物炭吸附Cd2+的吸附动力学方程参数
Table 3 Adsorption kinetic parameters of Cd2+ on modified biochar
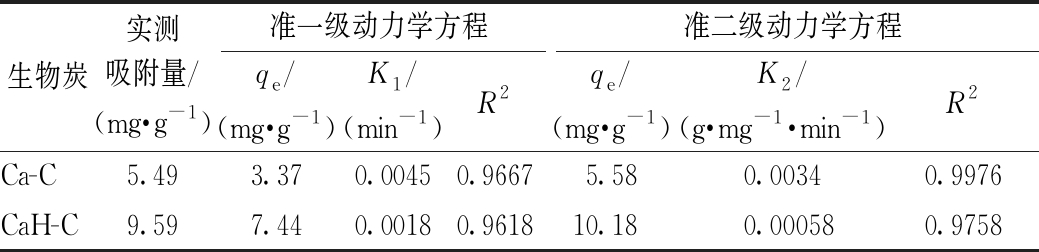
生物炭实测吸附量/(mg·g-1)准一级动力学方程准二级动力学方程qe/(mg·g-1)K1/(min-1)R2qe/(mg·g-1)K2/(g·mg-1·min-1)R2Ca-C5.493.370.00450.96675.580.00340.9976CaH-C9.597.440.00180.961810.180.000580.9758
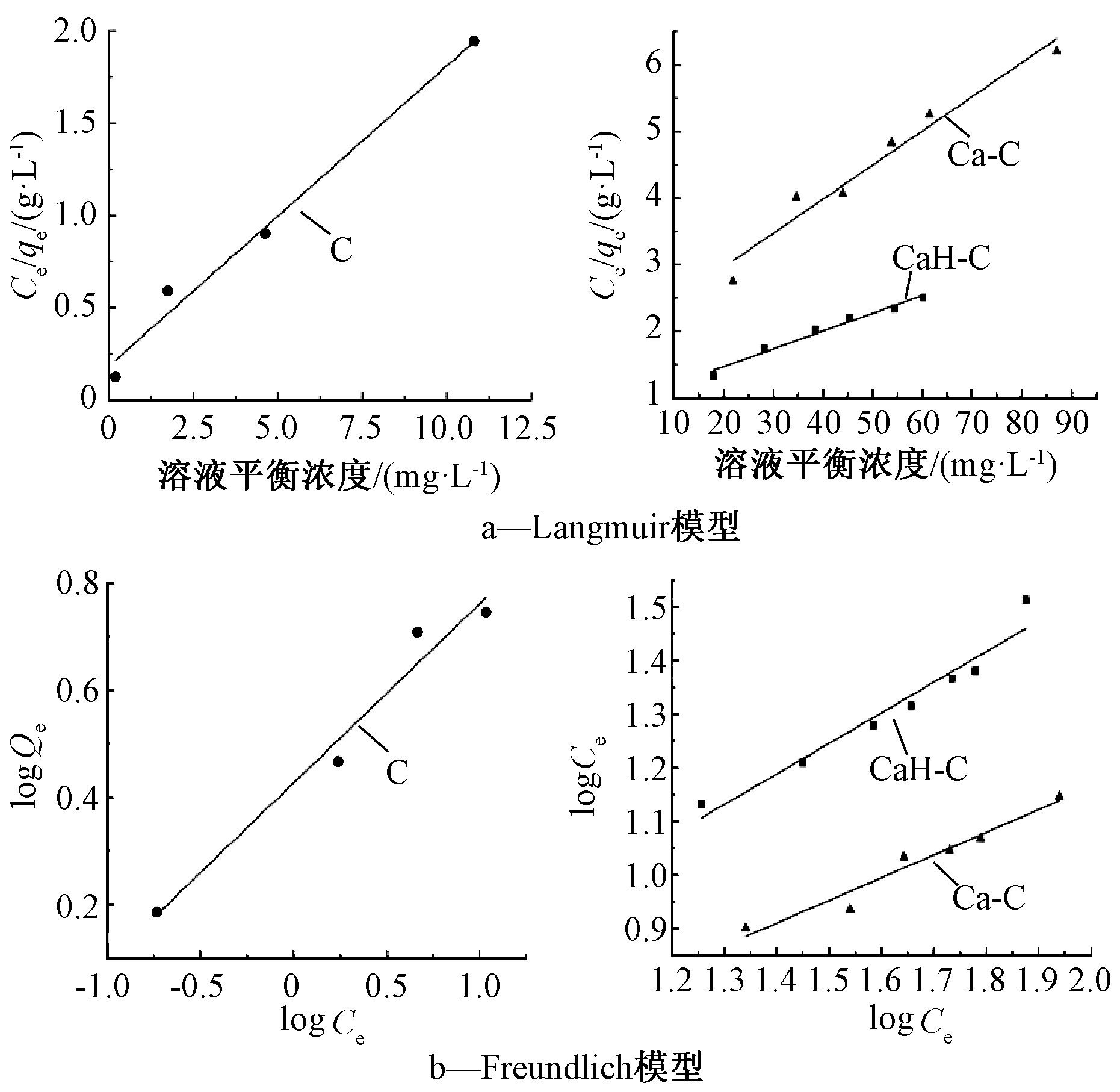
图6 生物炭的吸附等温线
Fig.6 Adsorption isotherms of the biochars
2.3 吸附等温模型
将生物炭对Cd2+的吸附等温线分别按Langmuir方程与Freundlich方程进行拟合,所得线性关系如图6所示,拟合结果见表4。由拟合结果可知:Langmuir方程和Freundlich方程均能较好地描述生物炭对Cd2+的吸附,但Langmuir方程更符合C、Ca-C和CaH-C对Cd2+的吸附,饱和吸附量分别达到6.14,19.53,37.45 mg/g,改性生物炭明显提高了对Cd2+的吸附,吸附量分别是原生物炭的3.2,6.4倍。Freundlich模型的相关系数也较高,且n值与吸附体系的性质有关。Ca-C的1/n值>2,说明吸附比较难以进行,而CaH-C的1/n值为0~1,说明吸附较易进行,进一步表明CaCl2与H2O2混合改性生物炭作为重金属吸附剂具有一定优势。
表4 生物炭的等温吸附参数
Table 4 Isothermal adsorption parameters of the biochars
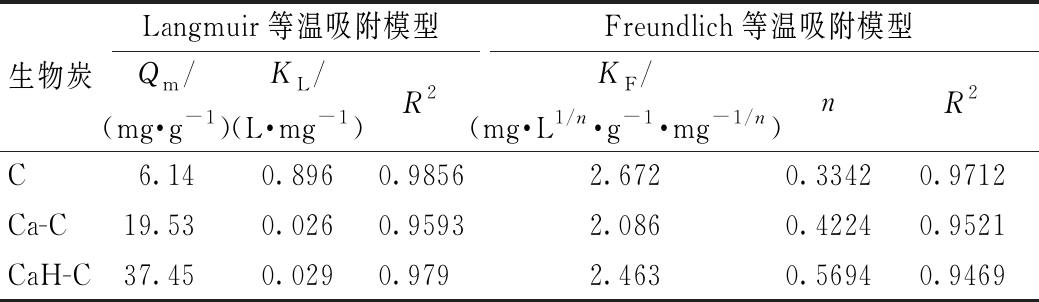
生物炭Langmuir等温吸附模型Freundlich等温吸附模型Qm/(mg·g-1)KL/(L·mg-1)R2KF/(mg·L1/n·g-1·mg-1/n)nR2C6.140.8960.98562.6720.33420.9712Ca-C19.530.0260.95932.0860.42240.9521CaH-C37.450.0290.9792.4630.56940.9469
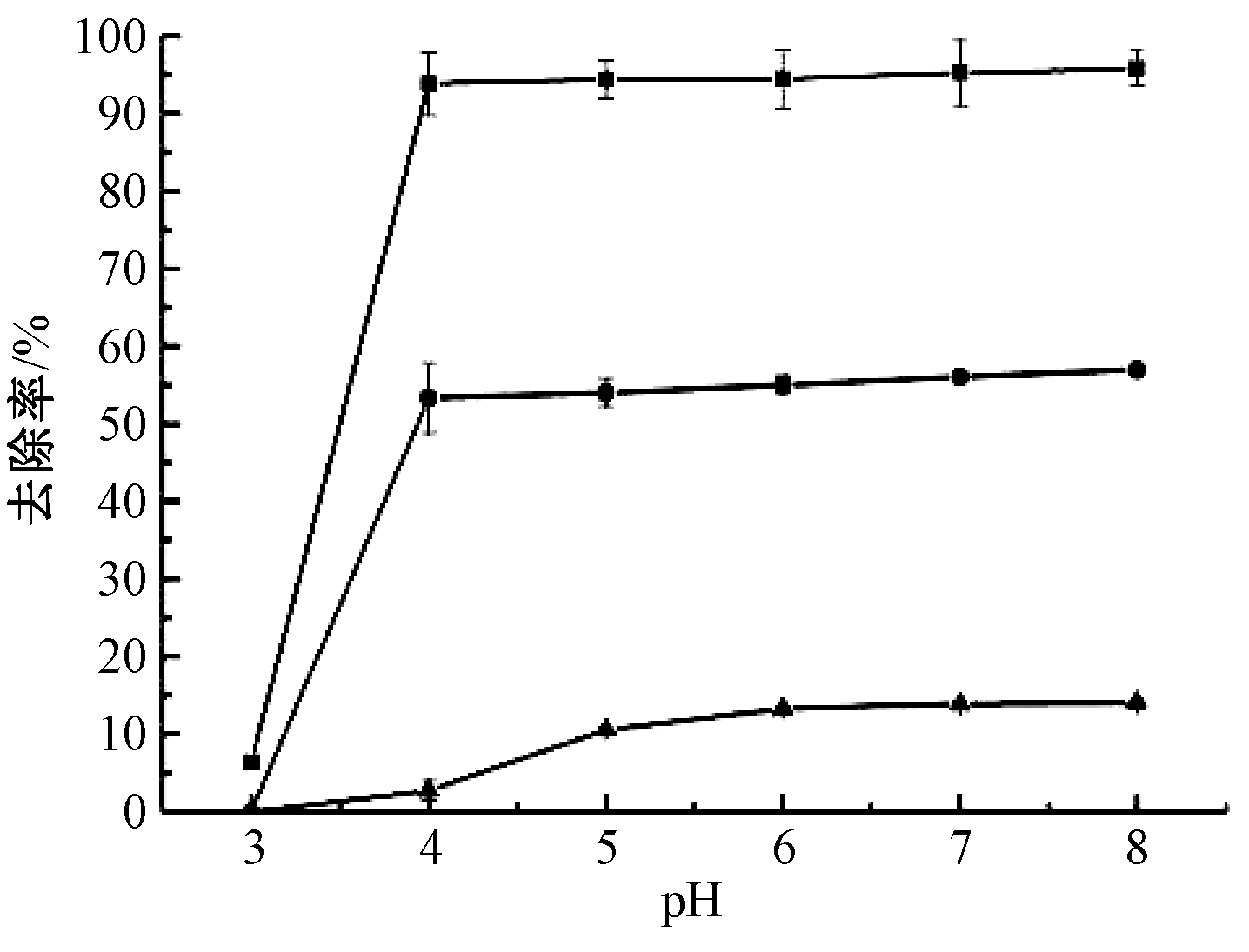
2.4 pH对生物炭去除率的影响
如图7所示:Ca-C和CaH-C对Cd2+的去除率明显高于C。pH为3时,3种生物炭都表现出对Cd2+的不吸附或者吸附量少,原因在于当pH较低时,溶液中存在大量的H+,导致没有足够的吸附点位供Cd2+发生吸附反应。随着pH增大,溶液中H+浓度降低,大量的生物炭结合位点暴露在外,使得Cd2+吸附量上升。当pH≥4时,改性生物炭对Cd2+的吸附趋于稳定,但过高的pH会导致Cd2+沉淀,不利于吸附去除。
![]() —C;
—C; ![]() —Ca-C;
—Ca-C; ![]() —CaH-C。
—CaH-C。
图7 pH值对Cd去除率的影响
Fig.7 Effect of pH value on Cd removal rate
2.5 吸附机理初步分析
吸附后SEM-EDS谱图如图8所示。Ca-C在吸附Cd2+之后钙元素含量没有明显变化,说明钙未参与其中的化学吸附,可能是生成的CaCO3对Cd2+形成一个表面的物理吸附[18-19]。CaH-C在吸附Cd2+之后钙元素含量明显降低,是由于H2O2氧化生成的酸性官能团与CaCO3反应生成的钙盐(这与FTIR谱图中R—COO基团的增加和XRD谱图中加入H2O2后CaCO3表现出的结果一致)与Cd2+发生离子交换作用,使得溶液中的Cd2+被生物炭吸附。
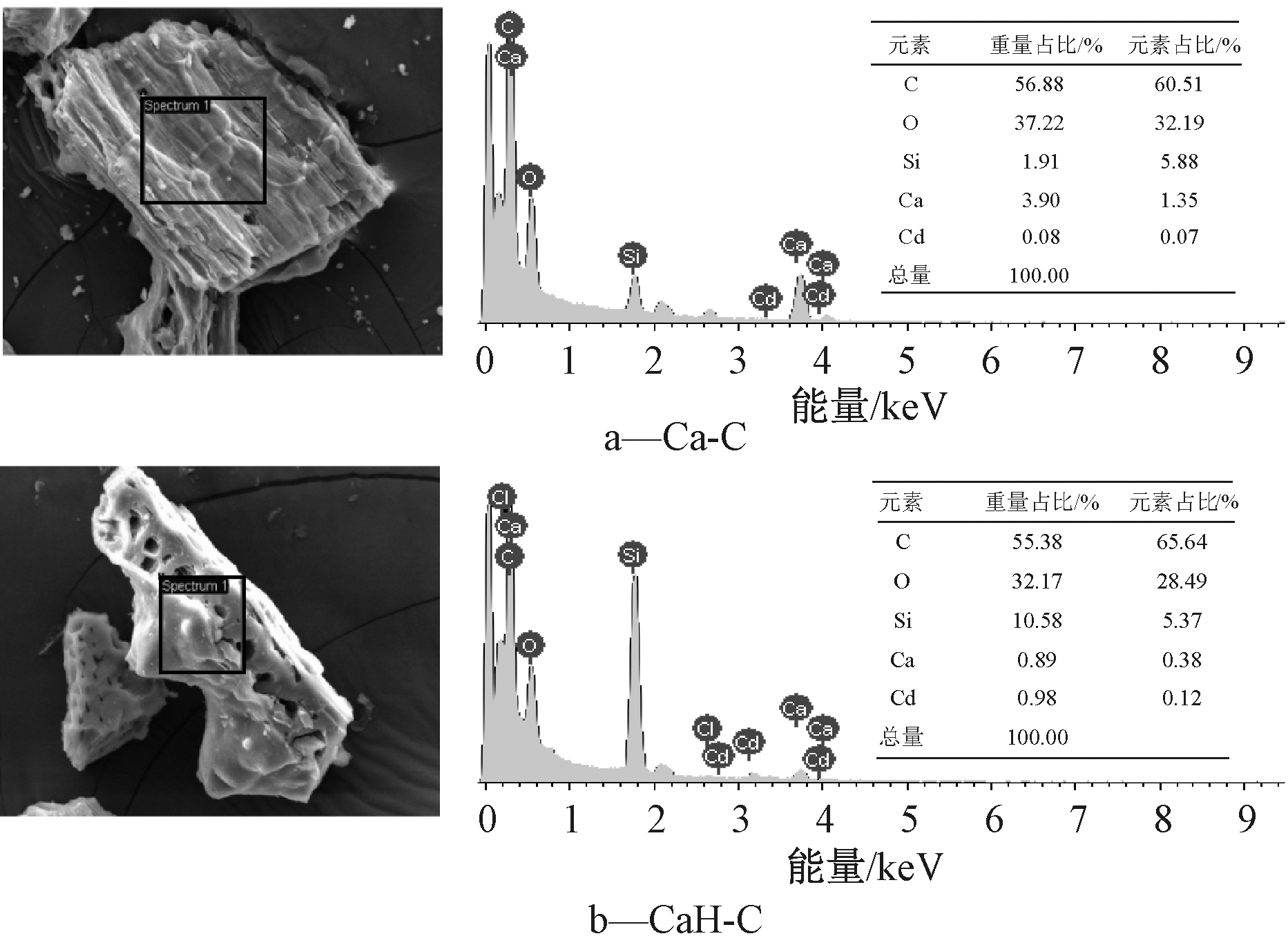
图8 吸附后生物炭的电镜分析和元素分析
Fig.8 Photos and elements analysis results of biochars after adsorption by SEM-EDS
3 结 论
1)改性生物炭比原始生物炭具有更高的比表面积和总孔容积,更有利于对重金属的吸附。
2)Ca-C和CaH-C对Cd2+的吸附动力学过程遵循准二级动力学方程。
3)Ca-C和CaH-C对Cd2+的吸附符合Langmuir等温吸附模型,对Cd2+的饱和吸附量分别达到19.53,37.45 mg/g,分别是改性前的3.2,6.1倍。
4)当溶液pH接近中性时,生物炭及改性生物炭对重金属的去除率更高。SEM-EDS谱图和FTIR谱图等显示其主要吸附机理为化学吸附。
[1] Mohan D, Jr P C, Bricka M, et al. Sorption of arsenic, cadmium, and lead by chars produced from fast pyrolysis of wood and bark during bio-oil production[J]. Journal of Colloid and Interface Science, 2007,310(1):57-73.
[2] Dong X L, Ma L Q, Li Y C. Characteristics and mechanisms of hexavalent chromium removal by biochar from sugar beet tailing[J]. Journal of Hazardous Materials, 2011,190(1/2/3):909-915.
[3] Dong X L, Ma L Q, Zhu Y J, et al. Mechanistic investigation of mercury sorption by brazilian pepper biochars of different pyrolytic temperatures based on X-ray photoelectron spectroscopy and flow calorimetry[J]. Environmental Science & Technology, 2013,47(21): 12156-12164.
[4] 于志红. 锰氧化物-生物炭复合材料对砷的生物有效性的影响[D]. 北京:中国农业科学院, 2015.
[5] 张越,林珈羽,刘沅,等. 改性生物炭对镉离子吸附性能研究[J]. 武汉科技大学学报,2016,39(1):48-52.
[6] Hadjittofi L, Prodromou M, Pashalidis I. Activated biochar derived from cactus fibres-Preparation, characterization and application on Cu(Ⅱ) removal from aqueous solutions[J]. Bioresource Technology, 2014,159(5):460-464.
[7] Regmi P, Garcia J M, Kumar S, et al. Removal of copper and cadmium from aqueous solution using switchgrass biochar produced via hydrothermal carbonization process[J]. Journal of Environmental Management, 2012,109(17):61-69.
[8] Peng H, Gao P, Chu G, et al. Enhanced adsorption of Cu(Ⅱ) and Cd(Ⅱ) by phosphoric acid-modified biochars[J]. Environmental Pollution, 2017,229(2):846-853.
[9] Xue Y W, Gao B, Yao Y, et al. Hydrogen peroxide modification enhances the ability of biochar (hydrochar) produced from hydrothermal carbonization of peanut hull to remove aqueous heavy metals: batch and column tests[J]. Chemical Engineering Journal, 2012,200/202(34):673-680.
[10] Wang S S, Gao B. Removal of arsenic by magnetic biochar prepared from pinewood and natural hematite[J]. Bioresource Technology, 2015,175:391-395.
[11] Zhang M, Gao B, Varnoosfaderani S, et al. Preparation and characterization of a novel magnetic biochar for arsenic removal[J]. Bioresource Technology, 2013,130(1):457-462.
[12] Zhang M, Gao B. Removal of arsenic, methylene blue, and phosphate by biochar/AlOOH nanocomposite[J]. Chemical Engineering Journal, 2013,226(24):286-292.
[13] Han Y T, Xi C, Xin O Y, et al. Adsorption kinetics of magnetic biochar derived from peanut hull on removal of Cr(Ⅵ) from aqueous solution: effects of production conditions and particle size[J]. Chemosphere, 2016,145(9):336-341.
[14] 吴光前,孙新元,张齐生. 活性炭表面氧化改性技术及其对吸附性能的影响[J]. 浙江农林大学学报, 2011,28(6):955-961.
[15] 韩鹏,任爱玲,郭斌,等. 过氧化氢改性活性炭对三甲胺废气的吸附[J]. 河北科技大学学报, 2013,34(2):159-165.
[16] Fang C, Zhang T, Li P, et al. Phosphorus recovery from biogas fermentation liquid by Ca-Mg loaded biochar[J]. Journal of Environmental Sciences, 2015,29(3):106-114.
[17] 赵明静,杜霞,郭萌,等. CaCl2改性生物炭的制备及其对Pb2+的吸附作用[J]. 环境污染与防治, 2016,38(10):84-88,93.
[18] 吴绍吟,练恩生. 纳米碳酸钙的特点与应用[J]. 橡胶工业, 1999(3):18-23.
[19] 汪洪, 周卫,林葆. 碳酸钙对土壤镉吸附及解吸的影响[J]. 生态学报, 2001,21(6):932-937.