0 引 言
镉作为一种有害重金属,易在人类和动物的主要内脏器官内积聚,对人体健康危害极大[1]。目前,国内外多采用离子交换、吸附、混凝和膜过滤等方法去除水中Cd2+,其中,吸附技术具有操作简便、运行成本低等优点[2]。在各类吸附材料中,基于农业废弃物制备的吸附材料具有丰富的来源、低廉的价格、易于操作等特点,制备高效生物质吸附材料以及探究其特性的相关研究已成为国内外研究的热点[3]。稻壳年产量高达数百万吨,大部分作为农业废弃物丢弃,甚至直接焚烧,给环境带来污染[4]。然而,稻壳含有丰富的羟基,可在碱性介质中与二硫化碳(CS2)反应接入含硫基团黄原酸酯,进而对水中重金属进行有效吸附[5],废弃物稻壳的资源化有待研究。通过对稻壳以及改性稻壳吸附去除重金属的文献分析可知:目前改性材料的制备时间普遍较长,考虑到微波可对稻壳中极性分子选择性快速加热且热损失少等优点[6-7],在制备改性材料设计中,可利用微波辅助接枝反应,快速制备改性稻壳。本文的主要目标:1)在微波辅助下合成黄原酸酯改性稻壳,通过扫描电镜和傅里叶红外光谱对改性稻壳进行表征,探测改性稻壳是否接枝黄原酸酯基团;2)探究初始pH、温度、时间等因素对改性稻壳吸附Cd2+的影响;3)通过吸附动力学、吸附等温线模型对改性稻壳吸附行为进行探讨,评估其吸附再生能力。通过以上步骤获得改性稻壳去除水体中Cd2+的吸附特性以及最大吸附容量,为有效去除水体中Cd2+以及突发Cd2+污染的应急处置提供参考。
1 实验部分
1.1 试剂与仪器
原材料及试剂:原材料为农业废弃物稻壳;试剂主要包括浓硫酸、NaOH、浓硝酸、CS2、CdCl2等,均为分析纯。
主要仪器:SHA-CA型数显恒温水浴振荡器、LFP-800T型高速粉碎机、Optima 5300DV型电感耦合等离子体原子发射光谱(ICP -OES)、COOLPEX型微波化学反应仪。
1.2 微波辅助制备黄原酸化改性稻壳
在微波辅助条件下,制备改性稻壳步骤如下:
1)清洗。将原材料稻壳冲洗干净,80 ℃下烘干。烘干稻壳用粉碎机粉碎,收集过100目筛的稻壳粉末,得到原始稻壳(RH)。
2)碳化。将稻壳以1 g∶3 mL的比例缓缓加入浓硫酸中,边加边快速搅拌后放置24 h。过滤洗至中性,烘干并过100目筛,得到碳化稻壳(RH-C)。
3)碱化、黄化。取3 g碳化稻壳于100 mL具塞螺口瓶中,以1 g∶3 mL的比例加入9 mL 13.75%的NaOH溶液,混合后放入微波反应器中,反应一定时间(碱化)。然后加入一定比例的CS2,继续在微波反应器中反应一段时间(黄化)。
4)过滤稻壳混合液,反复冲洗至洗出液为中性,在80 ℃下烘干,研磨后过100目筛得改性稻壳(RH-M)。
1.3 吸附实验
称取0.05 g的改性稻壳加入100 mL具塞螺口瓶中,倒入Cd2+溶液后立即放在200 r/min的恒温水浴振荡器中,控制Cd2+溶液的pH值在(3.0~7.0)±0.2。用0. 22 μm 滤膜过滤后,采用ICP-OES测定Cd2+浓度,计算其吸附量qe,吸附材料平衡吸附量的计算公式为:
qe=V(C0-Ce)/m×100%
(1)
式中:qe为平衡吸附量,mg/g;V为溶液的体积,L;Ce为Cd2+的平衡浓度,mg/L;m为吸附材料用量,g;C0为Cd2+的初始浓度,mg/L。
1.3.1 pH对吸附效果的影响
分别配制初始浓度为10,50,200 mg/L的Cd2+溶液,各浓度下调节溶液pH分别为3、4、5、6、7,稻壳吸附剂投量均为0.5 g/L,在20 ℃下进行吸附实验。
1.3.2 吸附动力学实验
称取0.25 g的改性稻壳倒入250 mL具塞螺口瓶中,ρ(Cd2+)为200 mg/L,20 ℃下分别在1,3,5,10,15,20,30,45,60 min取样,测出剩余Cd2+质量浓度,得到不同吸附时间的吸附量。
1.3.3 吸附热力学实验
为了探究改性吸附材料对不同Cd2+浓度区间的吸附能力,将Cd2+溶液初始浓度设定在1~300 mg/L,稻壳吸附剂投量均为0.5 g/L,分别在20,35,50 ℃下反应1 h取样,测定并计算达到吸附平衡时改性稻壳对Cd2+的吸附量。
1.3.4 脱附实验
稻壳吸附剂投量为1.0 g/L,用以吸附初始浓度为50 mg/L的Cd(Ⅱ)溶液,把吸附后的改性稻壳放入0.5 mol/L的硝酸溶液中,20 ℃下反应30 min,过滤后冲洗至洗出液为中性,烘干完成再生。
再生后的改性稻壳继续吸附Cd2+,重复“吸附-再生”,测定每个周期改性稻壳对Cd2+的吸附量。
2 结果和讨论
2.1 改性稻壳吸附前后扫描电镜表征及红外光谱分析
2.1.1 扫描电镜分析
图1为原始稻壳、碳化稻壳和改性稻壳的扫描电镜图。如图1a所示,原始稻壳表面具有致密木质素,少孔平滑;而图1b显示稻壳表面出现许多孔洞结构,说明通过碳化作用稻壳表面的木质素遭到破坏,比表面积增大;而比较图1b、c发现,黄化未对碳化稻壳的表面形貌产生明显影响。可知:原始稻壳经过一系列的改性,表面由致密平滑变得多孔破碎,增大了表面积,为金属离子提供了更多的吸附位点。
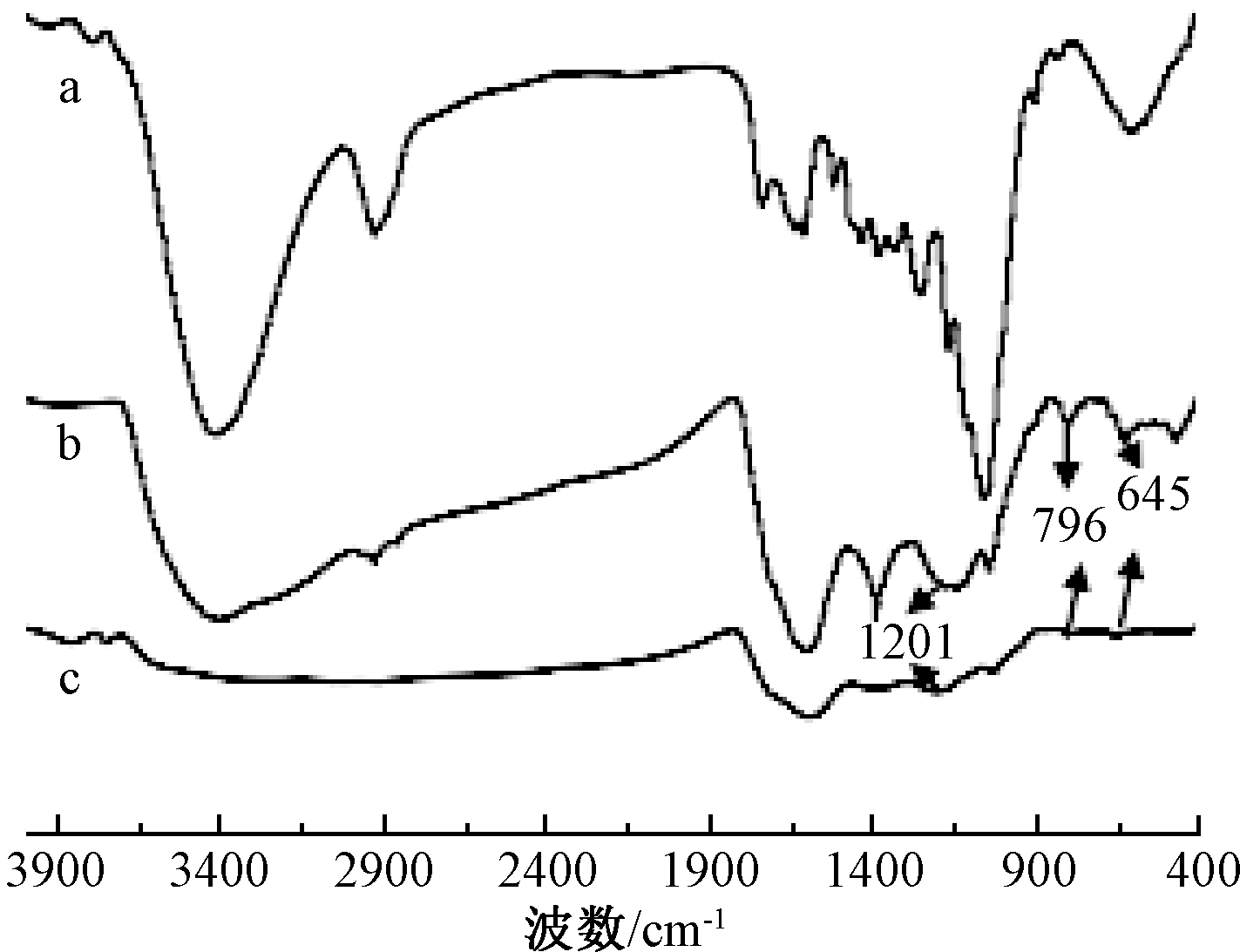
2.1.2 红外光谱分析
图2为原始稻壳、碳化稻壳和改性稻壳的红外光谱图。可知:相对于原始稻壳(图2a),改性稻壳吸附前(图2b)出现了位于1201,796,645 cm-1的吸收峰,对应C![]() S、C—O和C—S吸收峰明显变宽减弱,推测说明稻壳已成功接枝黄原酸酯基,即ROC
S、C—O和C—S吸收峰明显变宽减弱,推测说明稻壳已成功接枝黄原酸酯基,即ROC![]() SSM(R代表C6H9O4,M代表金属离子)[8]。然而改性稻壳吸附Cd(Ⅱ)后C
SSM(R代表C6H9O4,M代表金属离子)[8]。然而改性稻壳吸附Cd(Ⅱ)后C![]() S、C—O和C—S吸收峰明显变宽减弱(图2c),推测原因可能是黄原酸酯基团中的S与Cd(Ⅱ)生成配位键,从而导致吸收峰减弱。
S、C—O和C—S吸收峰明显变宽减弱(图2c),推测原因可能是黄原酸酯基团中的S与Cd(Ⅱ)生成配位键,从而导致吸收峰减弱。

图1 原始稻壳、碳化稻壳和改性稻壳的扫描电镜图
Fig.1 SEM photos of RH, RH-C and RH-M
a—原始稻壳; b—改性稻壳吸附前; c—改性稻壳吸附后。
图2 原始稻壳、改性稻壳吸附前及吸附后的红外光谱图
Fig.2 FT-IR spectra of RH, RH-M and RH-M-Cd
2.2 改性稻壳吸附性能研究
2.2.1 pH对吸附效果的影响
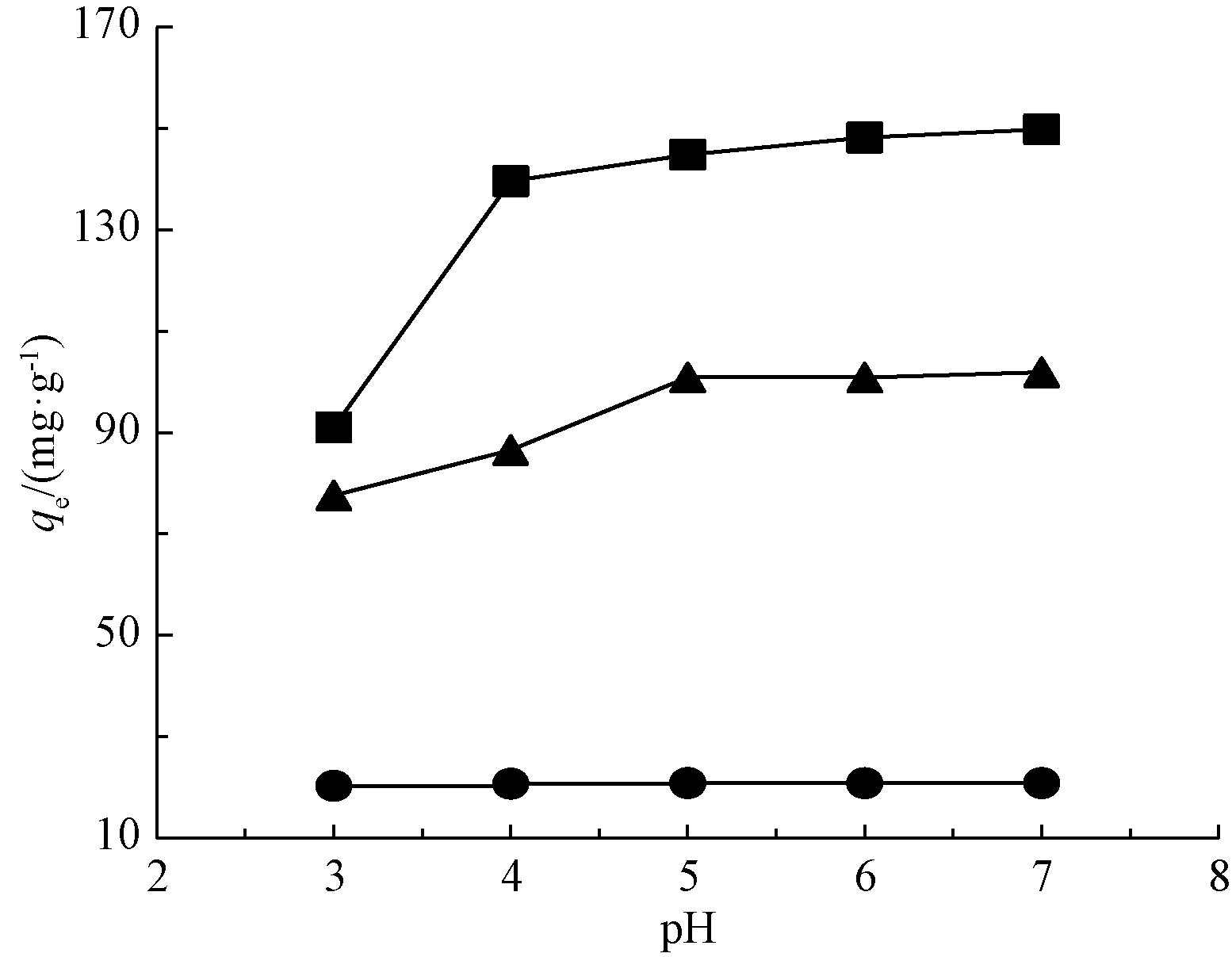
图3为pH对改性稻壳Cd(Ⅱ)的效果影响。不同Cd2+初始浓度下,Cd2+吸附量随着溶液的初始pH值的增加而增加,但对低初始浓度的影响不明显。此外,Cd2+溶液的初始浓度越大,pH对吸附效果的影响也越明显。ρ(Cd2+)初始为50,200 mg/L时,pH从3.0提高至4.0,改性稻壳的吸附容量都明显增加。pH为4.0~7.0,吸附容量基本不变,保持稳定。当pH>7.0时,溶液中OH-与Cd2+发生沉淀反应,会影响其吸附性能的评估准确性,故本研究未进行相关研究。pH值低时,改性稻壳对Cd2+的吸附量低,是因为此时H+浓度较高,与Cd2+产生吸附竞争。随着pH增加,H+离子浓度降低,Cd2+与活性位点接触的机会增加,改性稻壳对Cd(Ⅱ)的吸附容量相应增加。
![]() —200 mg/L;
—200 mg/L; ![]() —50 mg/L;
—50 mg/L; ![]() —10 mg/L。
—10 mg/L。
图3 pH对改性稻壳吸附Cd(Ⅱ)的效果影响
Fig.3 Effect of pH on the adsorption capacity of RH-M for Cd(Ⅱ)
2.2.2 吸附平衡时间和吸附动力学
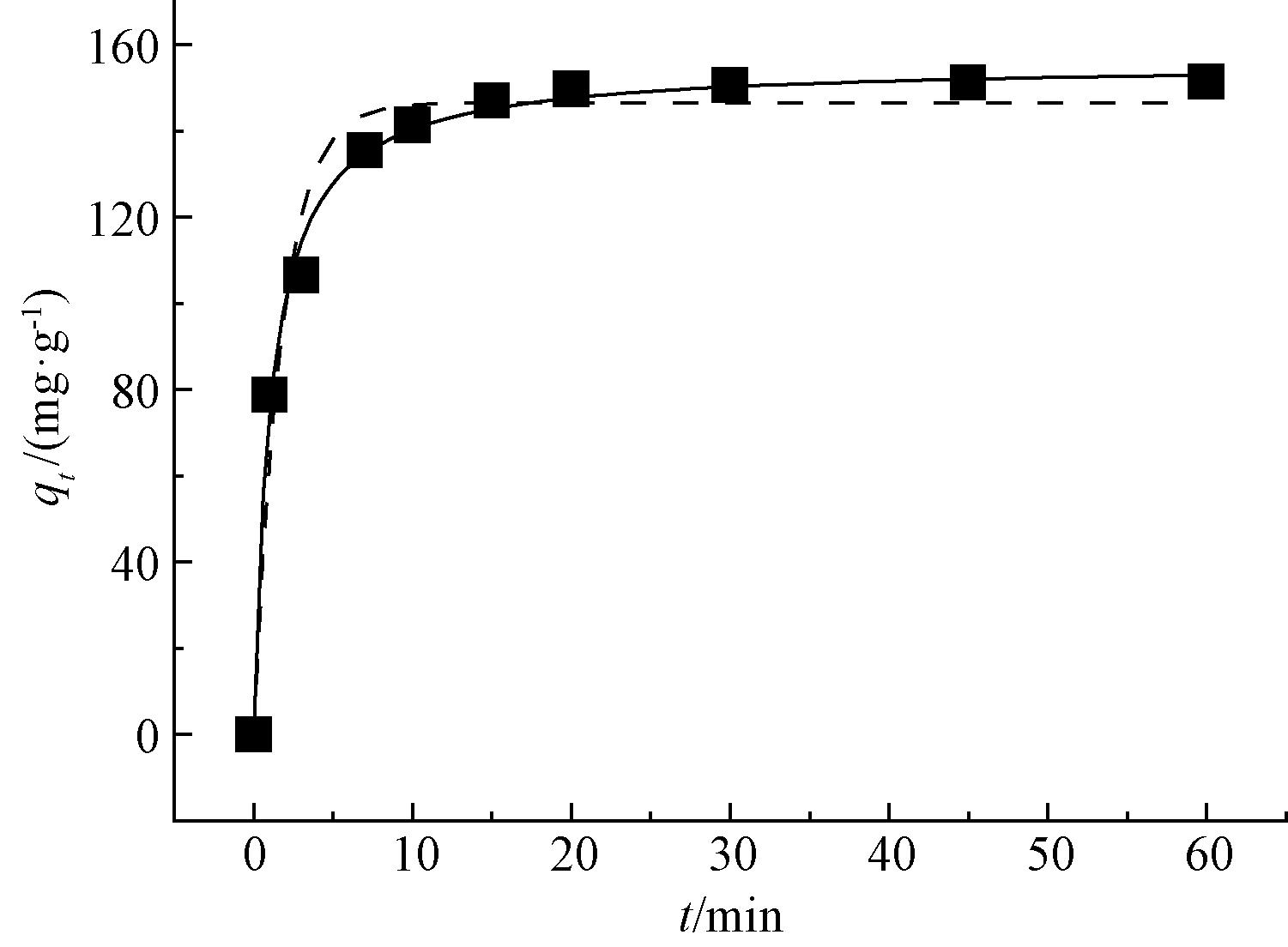
图4为吸附时间对改性稻壳吸附容量的影响。可知,改性稻壳迅速吸附溶液中的Cd2+,20 min内即达到平衡。为探索改性稻壳吸附Cd(Ⅱ)的动力学机制,采用准一级动力学模型和准二级动力学模型拟合实验数据。准一级动力学模型的线性方程为:
ln(qe1-qt)=lnqe1-k1t
(2)
式中:qe1为平衡吸附量,mg/g;qt为t时刻的吸附量,mg/g;k1为吸附速率常数,min-1;t为吸附时间,min。
--准一级动力学线性拟合; ——准二级动力学线性拟合。
图4 吸附时间对改性稻壳吸附容量的影响
Fig.4 Effect of contact time on RH-M
准二级动力学模型假定吸附过程为化学吸附,其线性方程为:
(3)
式中:k2为准二级模型的吸附速率常数,g/(mg·min)。
如表1所示:改性稻壳的准一级动力学模型R2为0.8906,相对误差为22.84%,而准二级动力学模型R2为0.9999,相对误差为0.34%,显然准二级动力学模型线性拟合度更好,且平衡吸附量的模型计算值和实验数据更接近,说明准二级动力学模型可以更好地描述其吸附动力学特性,推测改性稻壳对Cd2+的吸附主要是化学吸附[9]。
表1 原始稻壳和改性稻壳吸附Cd2+的动力学模型参数
Table 1 Kinetics model parameters for the adsorption of RH and RH-M toward Cd2+

材料准一级动力学模型准二级动力学模型k1/min-1qe1/(mg·g-1)δ1/%R2k2/(g·mg-1·min-1)qe2/(mg·g-1)qe-exp/(mg·g-1)δ2/%R2原始稻壳0.0115.8354.480.54020.023312.8010.9914.990.9941改性稻壳0.271116.4822.840.89060.0078151.51151.000.340.9999
注:qe-exp为实验测得的平衡吸附量;δ1、δ2分别为qe1、qe2与qe-exp的相对误差。
2.2.3 吸附热力学
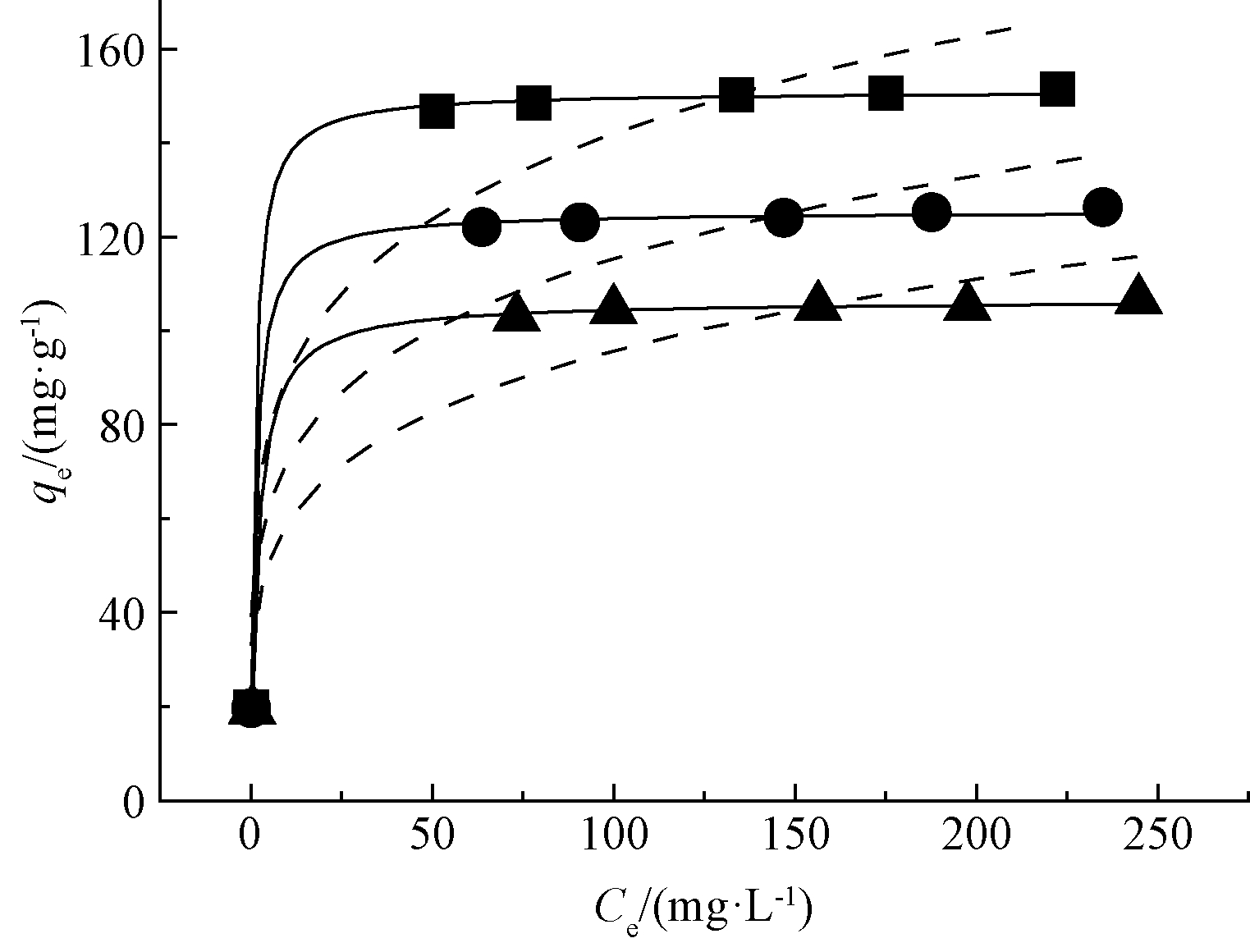
同一温度下,随着Cd2+初始浓度增加,平衡吸附量先增加后趋于稳定(图5)。此外,改性稻壳对Cd2+平衡吸附量随着温度的升高而逐渐下降,表明其对Cd2+的吸附是放热过程。
![]() 20 ℃;
20 ℃;![]() 35 ℃;
35 ℃;![]() 50 ℃; ——Langmuir拟合曲线; --Freundlich拟合曲线。
50 ℃; ——Langmuir拟合曲线; --Freundlich拟合曲线。
图5 改性稻壳对Cd2+的吸附等温线
Fig.5 Isotherm plots for Cd2+ adsorption onto RH-M
为了进一步描述吸附过程,需要利用吸附等温线模型对吸附结果进行拟合,本文主要研究Langmuir和Fruendlich吸附等温线模型,结果如表2所示。其中,Langmuir吸附等温线模型假设吸附材料表面的吸附中心有相同的吸附能并分布均匀,每个吸附中心只能吸附1个吸附质分子,且被吸附的分子之间不产生相互作用,认为吸附质在吸附材料表面呈单分子层吸附[10]。
Langmuir吸附等温线模型表达式为:
qe=(KLqmCe)/(1+KLCe)
(4)
式中:Ce为平衡浓度,mg/L;qe为平衡时的吸附量,mg/g;KL为Langmuir吸附平衡常数,L/mg;qm为最大吸附量,mg/g。
表2 改性稻壳除镉过程的吸附等温线模型参数
Table 2 Adsorption isotherm parameters for the adsorption of Cd(Ⅱ) on RH-M
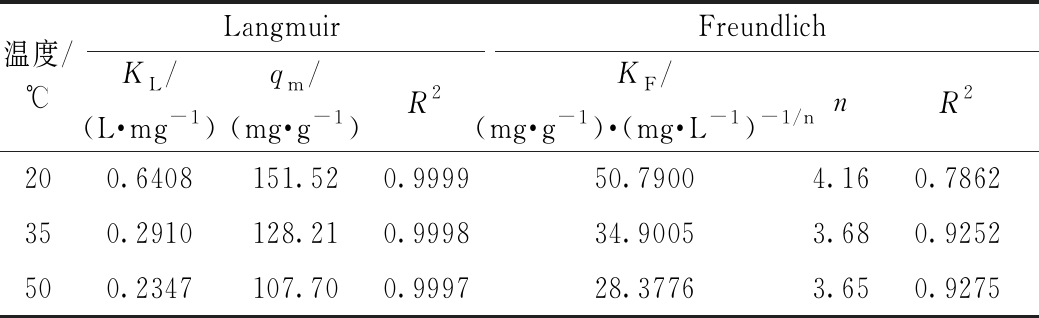
温度/℃LangmuirFreundlichKL/(L·mg-1)qm/(mg·g-1)R2KF/(mg·g-1)·(mg·L-1)-1/nnR2200.6408151.520.999950.79004.160.7862350.2910128.210.999834.90053.680.9252500.2347107.700.999728.37763.650.9275
Freundlich吸附等温线模型认为吸附是多分子层的,假设吸附材料表面是有非均质[11],其模型表达式为:
(5)
式中:KF、n为Freundlich吸附常数;qe为平衡时的吸附量,mg/g。
由表2可知:20,35,50 ℃下,Langmuir模型的线性决定系数R2(>0.999)均大于Freundlich模型的线性决定系数R2,表明其线性拟合度比Freundlich模型更好,说明改性稻壳对Cd(Ⅱ)的吸附作用更多发生在材料表面,是单分子层均匀吸附。同时,实验所得20,35,50 ℃下最大吸附容量分别为151.4,126.2,106.6 mg/g,与由Langmuir模型得到的最大吸附量相对误差分别为0.30%、0.59%、0.17%,远低于Freundlich模型。因此,Langmuir模型能更好地描述改性稻壳对Cd2+的吸附过程。
此外,改性稻壳的最大平衡吸附量高于原始稻壳(10.99 mg/g)、碳化稻壳(60.2 mg/g)及所报道的同类生物质材料 (表3),利用其处理水体中Cd2+的潜力巨大。
表3 改性稻壳与其他农业废物来源吸附剂对Cd(Ⅱ)的吸附效果
Table 3 Comparison of Cd(Ⅱ) adsorption capacity of RH-M with other modified agricultural waste
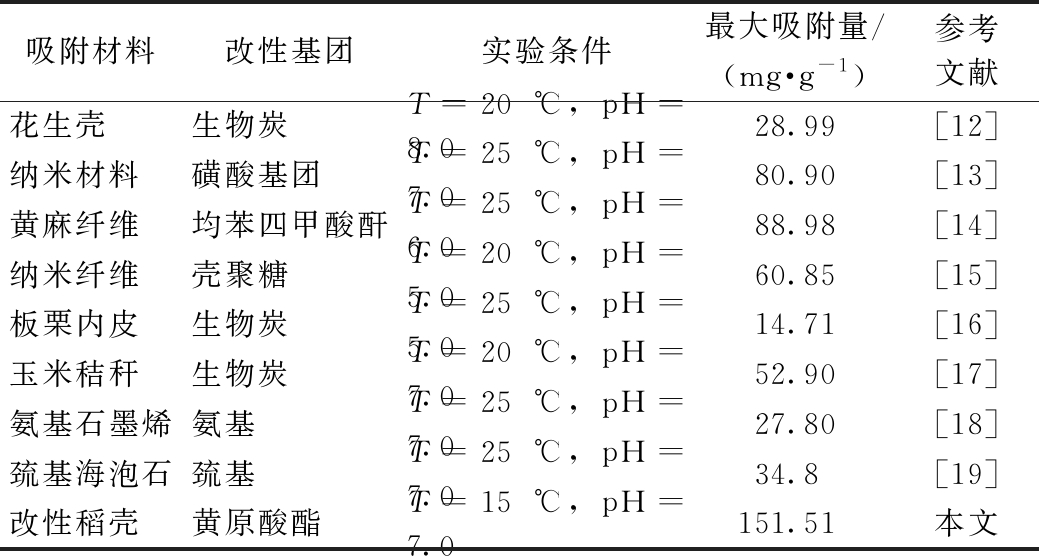
吸附材料改性基团实验条件最大吸附量/(mg·g-1)参考文献花生壳生物炭T=20 ℃, pH=8.028.99[12]纳米材料磺酸基团T=25 ℃, pH=7.080.90[13]黄麻纤维均苯四甲酸酐T=25 ℃, pH=6.088.98[14]纳米纤维壳聚糖T=20 ℃, pH=5.060.85[15]板栗内皮生物炭T=25 ℃, pH=5.014.71[16]玉米秸秆生物炭T=20 ℃, pH=7.052.90[17]氨基石墨烯氨基T=25 ℃, pH=7.027.80[18]巯基海泡石巯基T=25 ℃, pH=7.034.8[19]改性稻壳黄原酸酯T=15 ℃, pH=7.0151.51本文
2.2.4 吸附再生
为避免改性稻壳吸附重金属后污染环境,提高其利用率,可对改性稻壳进行吸附后再生,恢复吸附重金属功能,使其得以重复利用[20]。改性稻壳吸附再生结果如图6所示,经过5次“吸附-再生”周期,改性稻壳对Cd2+的去除率仍然保持在96%以上。这可能是因为在再生过程中,过量硝酸使Cd2+从吸附位点上脱附下来,改性稻壳表面的黄原酸酯基团可以继续吸附Cd2+。结果表明,改性稻壳作为由农业废物改造而成的吸附剂,可有效去除水体Cd2+。
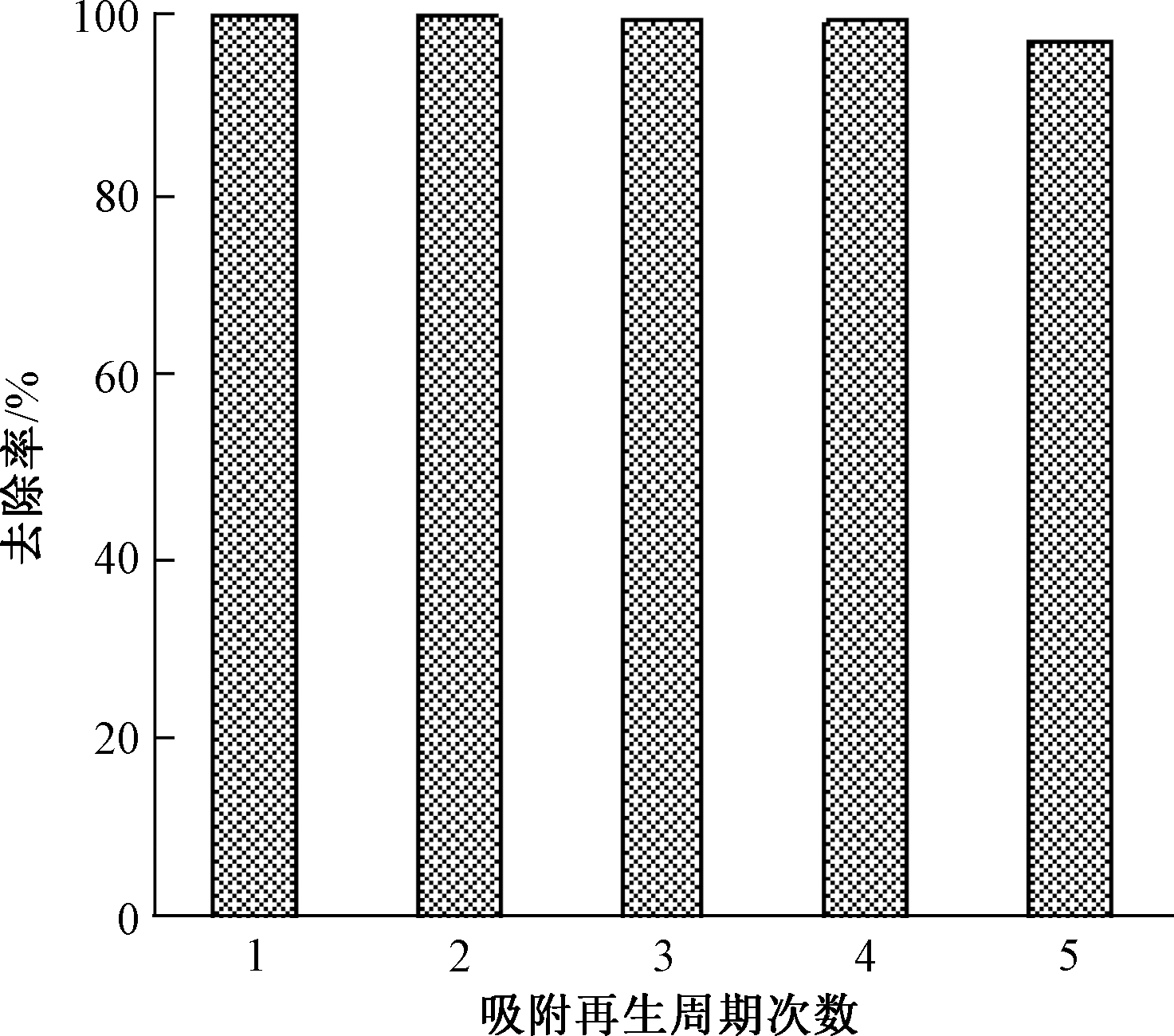
图6 改性稻壳再生效果
Fig.6 The desorption efficiency of Cd(Ⅱ) by RH-M
3 结 论
1)稻壳是一种无毒、可生物降解的农业废弃物。本研究在微波辅助条件下对其进行改性,合成的黄原酸酯改性稻壳具有极大的吸附容量(高达150.95 mg/g),并且吸附速度快,20 min内即可达到平衡。
2)改性稻壳对Cd2+的吸附行为与溶液初始pH值有关,当pH<4时,会降低吸附容量,改性稻壳对Cd2+吸附过程符合Langmuir吸附等温线模型和准二级动力学模型,且吸附容量随着反应温度的升高而降低,表明该吸附过程为放热反应。
3)经过5次循环再生,改性稻壳对Cd2+的吸附量仍为初始吸附容量的96.98%。
4)黄原酸酯改性稻壳作为潜在的低成本吸附剂,具有优良的Cd2+去除性能,可以作为应对水体突发Cd(Ⅱ)污染的有效应急吸附材料。
[1] Nawrot T S, Staessen J A, Roels H A, et al. Cadmium exposure in the population: from health risks to strategies of prevention[J]. Biometals, 2010, 23(5):769-782.
[2] Jiang T Y, Jiang J, Xu R K, et al. Adsorption of Pb(Ⅱ) on variable charge soils amended with rice-straw derived biochar[J]. Chemosphere, 2012, 89(3):249-256.
[3] Li D W, Ke Y, Meng F. Research progress on heavy metal pollution control and remediation[J]. Cheminform, 2014, 45(13).
[4] 刘振东, 李贵春, 杨晓梅,等. 我国农业废弃物资源化利用现状与发展趋势分析[J]. 安徽农业科学, 2012, 40(26): 13068-13070.
[5] Qu J H, Meng X L, You H, et al. Utilization of rice husks functionalized with xanthates as cost-effective biosorbents for optimal Cd(Ⅱ) removal from aqueous solution via response surface methodology [J]. Bioresource Technology, 2017, 241:1036-1042.
[6] Akhtar M, Iqbal S, Kausar A, et al. An economically viable method for the removal of selected divalent metal ions from aqueous solutions using activated rice husk[J]. Colloids & Surfaces B Biointerfaces, 2010, 75(1): 149-155.
[7] Shirzad K, Boris M,Sharon S, et al. Quantum chemical model of an SN2 reaction in a microwave field[J]. Journal of Physical Chemistry A, 2013, 106(37):8516-8524.
[8] Zhu G C, Liu J F, Yin J, et al. Functionalized polyacrylamide by xanthate for Cr(Ⅵ) removal from aqueous solution[J]. Chemical Engineering Journal, 2016, 288:390-398.
[9] Romero-Cano L A, GarcíA-Rosero H, GonzáLez-GutiéRrez L V, et al. Functionalized adsorbents prepared from fruit peels: equilibrium, kinetic and thermodynamic studies for copper adsorption in aqueous solution[J]. Journal of Cleaner Production, 2017, 162:195-204.
[10] Kazemi S Y, Biparva P, Ashtiani E. Cerastoderma lamarcki shell as a natural, low cost and new adsorbent to removal of dye pollutant from aqueous solutions: equilibrium and kinetic studies[J]. Ecological Engineering, 2016, 88:82-89.
[11] Asuquo E D, Martin A D. Sorption of cadmium (Ⅱ) ion from aqueous solution onto sweet potato (Ipomoea batatas L) peel adsorbent: characterisation, kinetic and isotherm studies[J]. Journal of Environmental Chemical Engineering, 2016, 4(4):4207-4228.
[12] 程启明, 黄青, 刘英杰,等. 花生壳与花生壳生物炭对Cd(Ⅱ)离子吸附性能研究[J]. 农业环境科学学报, 2014, 33(10):2022-2029.
[13] Chen K, He J Y, Li Y L, et al. Removal of cadmium and lead ions from water by sulfonated magnetic nanoparticle adsorbents[J]. Journal of Colloid & Interface Science, 2017, 494:307-316.
[14] Du Z L, Zheng T, Wang P, et al. Fast microwave-assisted preparation of a low-cost and recyclable carboxyl modified lignocellulose-biomass jute fiber for enhanced heavy metal removal from water[J]. Bioresource Technology, 2016, 201:41-49.
[15] Liu D G, Li Z H, Zhu L, et al. Recycled chitosan nanofibril as an effective Cu(Ⅱ), Pb(Ⅱ) and Cd(Ⅱ) ionic chelating agent: adsorption and desorption performance[J]. Carbohydrate Polymers, 2014, 111(1):469-476.
[16] 丁洋, 靖德兵, 周连碧,等. 板栗内皮对水溶液中镉的吸附研究[J]. 环境科学学报, 2011, 31(9):1933-1941.
[17] 李力, 陆宇超, 刘娅,等. 玉米秸秆生物炭对Cd(Ⅱ)的吸附机理研究[J]. 农业环境科学学报, 2012,31(11):2277-2283.
[18] Liang X F, Xu Y M, Sun G H, et al. Preparation and characterization of mercapto functionalized sepiolite and their application for sorption of lead and cadmium [J]. The Chemical Engineering Journa, 2011, 174(1):436-444.
[19] Guo X Y, Du B, Wei Q, et al. Synthesis of amino functionalized magnetic graphenes composite material and its application to remove Cr(Ⅵ), Pb(Ⅱ), Hg(Ⅱ), Cd(Ⅱ) and Ni(Ⅱ) from contaminated water[J]. Journal of Hazardous Materials, 2014, 278:211.
[20] Shen C S, Shen Y, Wen Y Z, et al. Fast and highly efficient removal of dyes under alkaline conditions using magnetic chitosan-Fe(Ⅲ) hydrogel[J]. Water Research, 2011, 45(16):5200-5210.