0 引 言
目前公认甲醛是对人体有严重危害的一种室内空气污染物,不仅对人体产生不良刺激,而且会引起呼吸系统疾病甚至引起癌变[1-2]。如何高效地去除甲醛引发了广泛关注。其中,在催化剂的作用下,利用空气中的O2将甲醛氧化为CO2和H2O的催化氧化技术是研究热点之一。众所周知,催化剂的结构是影响催化反应活性的重要因素,大量文献也已经表明催化剂的结构与催化活性之间有强烈的构效关系[3-4]。
银(Ag)催化剂作为一种贵金属催化剂,具有活性高、寿命长、稳定性好等优点,在很多反应中表现出良好的催化反应活性[5-7]。多孔材料如MCM-41和SBA-15因具有高比表面积、较大孔径(2.0~10.0 nm)等优点经常被用于催化反应中的载体来分散活性组分[8-9]。更重要的是,多孔材料结构允许VOC分子进入反应物活性位上,使之迅速氧化而提高氧化活性。
在前期研究中发现,Ag/MCM-41催化剂具有良好的甲醛低温催化氧化效果[10-11]。红外机理研究结果表明:银催化剂表面羟基的存在为甲醛氧化中间产物甲酸盐的形成提供更多的反应活性位点,从而提高了催化氧化反应活性[12]。因此,本文采用等体积浸渍法制备Ag/MCM-41催化剂,通过直接加入羟基源——NaOH溶液对银催化剂进行羟基改性,以期提高催化剂对甲醛的吸附能力,最终提高甲醛低温催化反应活性。本文考察了不同羟基含量的Ag/MCM-41催化剂上甲醛催化氧化反应的活性变化规律,并通过一系列表征手段研究催化剂结构与甲醛催化活性之间的构效关系。
1 实验部分
1.1 催化剂的制备
用等体积浸渍法,称取一定量的AgNO3使其溶于去离子水,加入MCM-41载体搅拌均匀后在室温下放置12 h,再放于80 ℃的烘箱中干燥过夜,得到的催化剂经过研磨,过筛处理为20~40目的细小颗粒状样品。制成质量分数8%的Ag/MCM-41催化剂。
配制0,0.05,0.075,0.1,0.25,0.5 mol/L的NaOH溶液,分别加入研磨好的Ag/MCM-41催化剂0.126 g,完全溶解后,在25 ℃的磁力搅拌器中各搅拌1 h,静置过夜,放入80 ℃的烘箱中干燥12 h,再放入马弗炉中在400 ℃下煅烧2 h。冷却取出后研磨过筛处理,得到0,0.05,0.075,0.1,0.25,0.5 mol/L的经NaOH改性的Ag/MCM-41催化剂,分别记为0,0.05,0.075,0.1,0.25,0.5。
1.2 催化剂的表征
1)比表面积。
采用Autosorb IQ3比表面分析及孔径综合分析仪(美国Quantachrome Instruments公司)进行分析。物理吸附中的气体分压可达10-8p/p0(N2/77 K)。比表面积≥0.0005 m2/g。孔径为0.35~50 nm(N2为探针)。
2)X射线衍射测试(XRD)。
D8 Super Speed X射线衍射仪(Bruker-AXS company),采用Cu的Kα射线源(γ=0.154 nm),管压为40 kV,管流为200 mA。广角扫描范围为10°~80° (扫描速率为10°/min),小角扫描范围为0~6°。
3)透射电镜(TEM)。
采用Tecnai 12透射电子显微镜(荷兰Philips公司)对样品进行分析,最高放大倍数为65万倍。点分辨率为0.24 nm;线分辨率为0.14 nm。最高加速电压为120 kV。
4)傅里叶变换红外系统(FT-IR)。
使用670-IR+610-IR型(美国Varian公司)傅里叶变换红外系统,根据吸收峰值的显示来判断材料中的基团数量,性能优劣。
1.3 催化剂的活性评价
催化剂的活性评价过程是在固定床反应装置(图1)上进行的。N2携带三聚甲醛蒸汽进入解聚炉, 解聚成单体甲醛,与O2混合后进入固定床反应器。反应尾气由气相色谱(GC)在线分析。其中,甲醛的初始浓度可通过调节载气流量或水浴温度控制。本实验所用催化剂用量为0.2 g, 反应气总流量为50 mL/min。甲醛转化率为50%时的反应温度计为T50。
甲醛转化率计算见式(1):
(1)
式中:ρ(HCHOin)为反应前甲醛的浓度,mg/m3;ρ(HCHOout)为反应后甲醛的浓度,mg/m3。
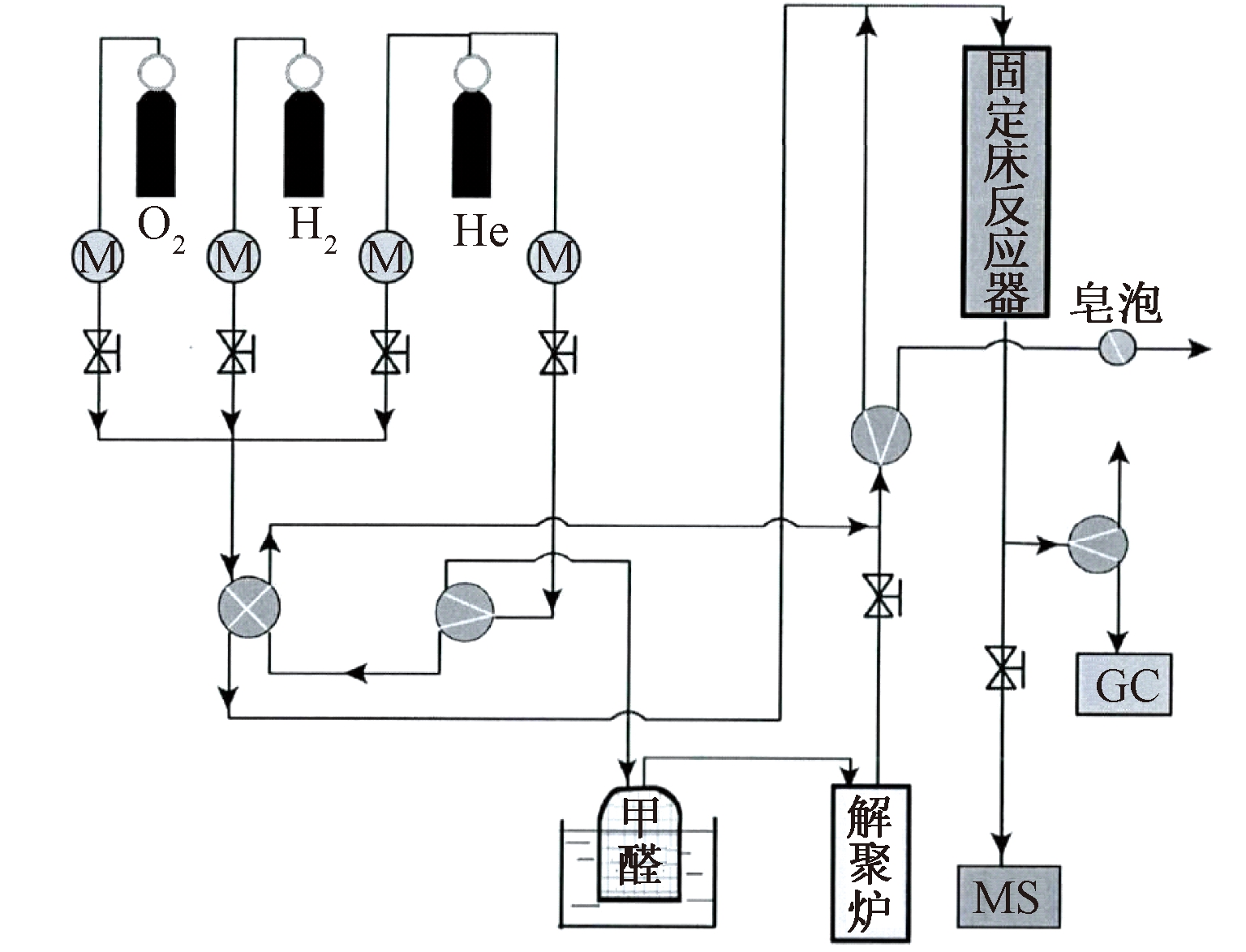
图1 甲醛催化氧化固定床反应装置
Fig.1 The fixed bed HCHO catalytic oxidation reactor
2 结果与讨论
2.1 HCHO催化氧化的活性
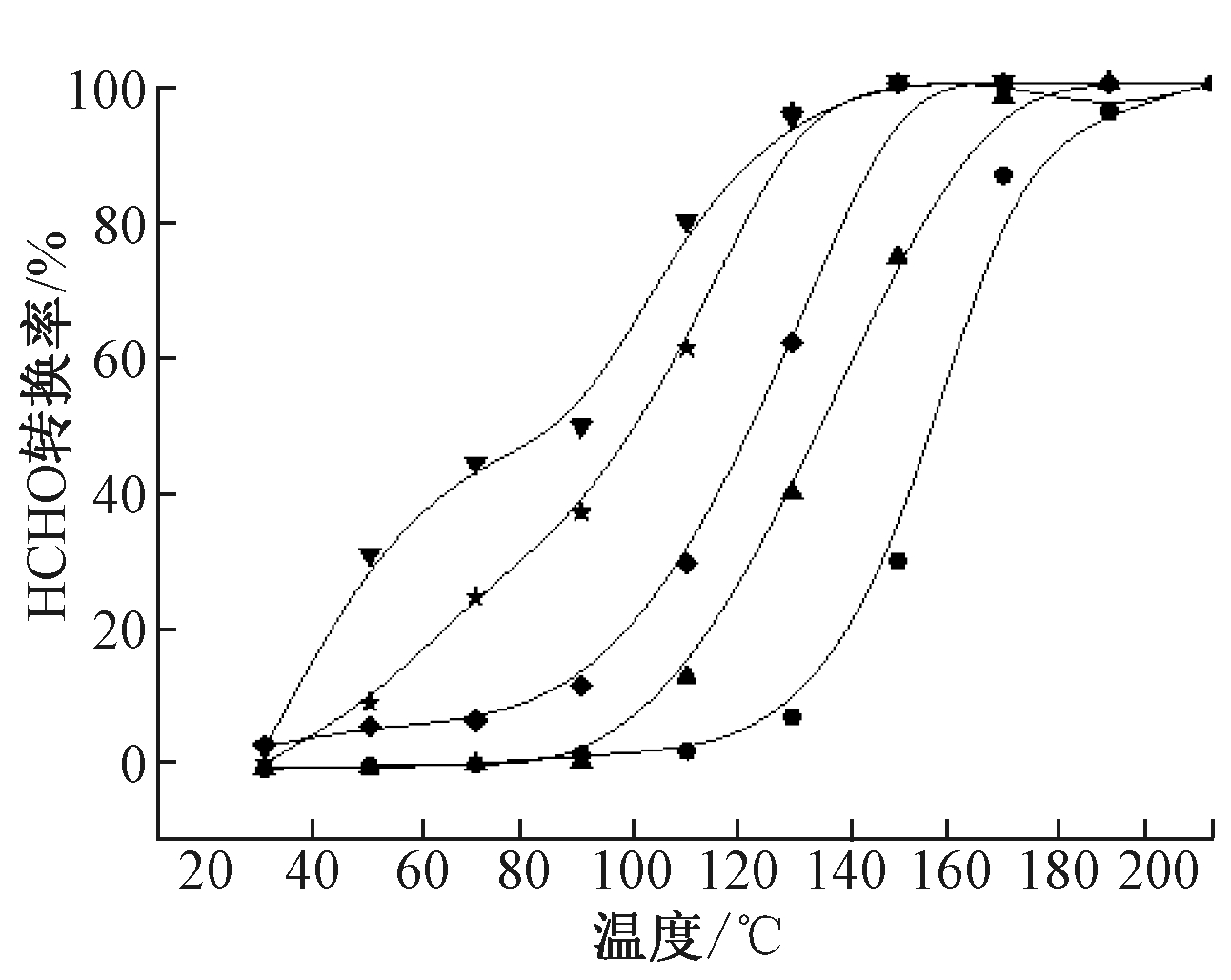
图2为经不同浓度羟基改性得到的催化剂上甲醛催化氧化反应活性随反应温度的变化结果。可知:随着羟基浓度的增加,Ag/MCM-41催化剂上甲醛的完全转化温度不断降低。羟基浓度增加到0.25 mol/L和0.5 mol/L时,甲醛完全转化温度只有小幅度的升高(150~170 ℃,T50温度从90 ℃升高至120 ℃),但这两个高浓度羟基改性催化剂仍然比低浓度(0.05 mol/L和0.075 mol/L)改性催化剂的甲醛催化反应活性有明显提高。甲醛反应活性结果表明:Ag/MCM-41催化剂经过NaOH羟基改性后,甲醛催化反应活性,尤其是低温催化反应活性有明显提高。但不同浓度的羟基改性后的催化剂上甲醛反应性能差异较大,其T50顺序为0.05>0.075>0>0.5>0.25>0.1。其中,经0.1 mol/L NaOH改性的Ag/MCM-41催化剂具有最好的甲醛催化反应性能,在150 ℃时可将甲醛完全转化。
![]() —0.05;
—0.05; ![]() —0.075;
—0.075; ![]() —0.1;
—0.1; ![]() —0.25;
—0.25; ![]() —0.5。
—0.5。
图2 不同浓度羟基改性催化剂上甲醛催化氧化反应活性曲线
Fig.2 HCHO catalytic oxidation conversion curves of Ag/MCM-41 catalysts with different amount of —OH
2.2 催化剂BET表征结果
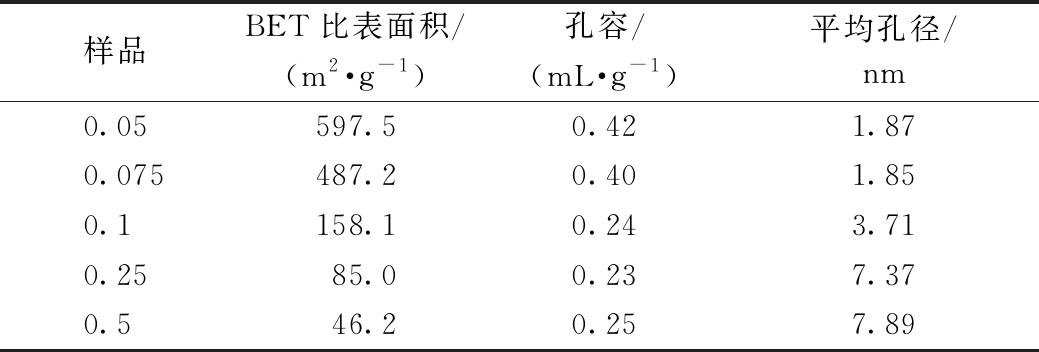
图3a、3b分别为不同浓度羟基改性催化剂的N2吸附-脱附等温曲线和粒径分布。可知:当羟基浓度为0.05, 0.075, 0.1, 0.25 mol/L时,根据IUPAC分类方法可知,吸附-脱附等温线属于Ⅳ型,且具有H1型回滞环,是典型的介孔材料的吸附脱附等温线,说明羟基改性并没有破坏MCM-41高度有序的介孔结构[13]。但随着羟基浓度的继续升高,当羟基浓度为0.5 mol/L时,样品的脱附支向高压区移动,此时吸附-脱附等温线归类于Ⅴ型曲线且具有H3型滞后环,说明样品有狭缝型孔的存在,并且样品的孔径也在不断增大(图3b)[14]。由图3b可知:Ag/MCM-41催化剂经过少量NaOH羟基改性后,当羟基浓度为0.05 mol/L时,样品主要以载体MCM-41的双孔形式存在,含有少量微孔(<2 nm)和小尺寸的介孔(2~5 nm),平均孔径为1.87 nm(表1)。当继续升高羟基浓度到0.075 mol/L后,双孔开始消失,催化剂样品仍然以少量微孔形式存在,平均孔径为1.85 nm。此时,由于孔径较小,微孔易被堵塞,甲醛分子不易进入孔道中,降低了反应活性。继续升高羟基浓度至0.1 mol/L时,样品的微孔逐渐消失,样品孔径增大,主要以介孔为主,平均孔径为3.71 nm。这种介孔孔径可以顺利地使反应物分子甲醛和氧气进入孔道内与催化剂活性组分反应,最终提高了此催化剂上的甲醛催化反应活性。当羟基浓度为0.25 mol/L和0.5 mol/L时,样品的平均孔径分别为7.37 nm和7.89 nm。此时,由于孔径增大,甲醛分子从样品表面脱附的概率增加,从而使反应活性降低。

图3 不同浓度羟基改性催化剂的N2吸附-脱附等温曲线和粒径分布
Fig.3 N2 adsorption-desorption isotherms and corresponding pore size distribution curves of Ag/MCM-41 catalysts with different amount of —OH
表1列出了所有样品的孔结构参数。可知:随着羟基浓度的提高,样品的比表面积、孔容有明显下降,平均孔径逐渐升高。这表明由于羟基负载,Ag/MCM-41催化剂样品表面的微孔被堵塞,样品内部孔结构坍塌,从而影响了样品的比表面积以及平均孔径。
表1 不同浓度羟基改性催化剂的的孔结构参数
Table 1 The pore structure parameters of Ag/MCM-41 catalysts with different amount of —OH
样品BET比表面积/(m2·g-1)孔容/(mL·g-1)平均孔径/nm0.05597.50.421.870.075487.20.401.850.1158.10.243.710.2585.00.237.370.546.20.257.89
2.3 催化剂XRD表征结果
X射线衍射分析可以用来表征样品的物质组成和相结构。图4所示为不同浓度羟基改性催化剂的XRD谱图。可知:经过羟基改性后的Ag/MCM-41催化剂,其结晶性与相结构并未发生明显改变,与未经过羟基改性催化剂相比,主峰位置基本无变化,但羟基浓度的变化导致样品表面银粒子尺寸发生改变。当羟基浓度较低(0.05, 0.075, 0.1 mol/L)时,样品没有发现明显金属银粒子特征衍射峰,此时样品表面银粒子的粒径很小或者分散性很高,大部分银粒子可能已经整合到MCM-41介孔分子筛的孔道中[16]。继续升高羟基浓度至0.25 mol/L,可以发现在2θ值为38.1°、44.3°、64.4°和77.4° 4个特征衍射峰明显出现,其分别归属于金属银的(111)、(200)、(220)和(311)晶面的特征衍射峰[15],该催化剂表面银粒子尺寸变大,导致银粒子不能进入孔道内,而聚集在载体的表面。 XRD结果表明:NaOH的添加对银纳米粒子的尺寸和分散度有明显的影响,过量NaOH的添加可能引起银纳米粒子的聚集,使得催化剂表面活性金属银粒子粒径增大。结合催化剂甲醛催化活性评价结果可知:当NaOH浓度为0.1 mol/L时,催化剂表面活性金属银粒子高度分散,此时银粒子粒径最小,从而最有利于甲醛催化转化。

图4 不同浓度羟基改性催化剂的XRD谱图
Fig.4 XRD patterns of Ag/MCM-41 catalysts with different amounts of OH
2.4 催化剂TEM表征结果
TEM谱图能更直观地反映银粒子的尺寸和分布情况,因此对不同浓度羟基改性Ag/MCM-41催化剂进行TEM表征,结果如图5所示。可知:所有的Ag/MCM-41催化剂经过NaOH羟基改性后,MCM-41载体结构基本无变化,但是载体表面负载8%Ag后形成的银粒子的尺寸和分布情况有明显差异。当NaOH浓度较低(0.05,0.075 mol/L)时,同样负载8%Ag的催化剂表面基本没有观测到银粒子的存在。随着NaOH浓度的升高,银催化剂表面银粒子明显增多,形成较大的晶粒。当NaOH浓度升高到0.1 mol/L时,载体表面的银颗粒(粒径约为30 nm)大小均一而且分散均匀,这有助于增加甲醛分子和活性金属粒子之间的接触概率,从而提高了催化剂的甲醛催化反应性能。但是继续升高NaOH浓度(0.25, 0.5 mol/L)后发现,银粒子颗粒尺寸变大并且颗粒分散不均,这可能会导致甲醛分子与银粒子之间的接触概率下降,最终降低催化剂的反应活性。该结果与催化剂XRD表征结果一致。因此,综合XRD结果与甲醛活性评价结果可以得出,当NaOH浓度为0.1 mol/L时,催化剂表面活性金属银粒子高度分散且粒径均一,有助于增加反应物分子与活性金属组分之间的接触与活化,从而提高了甲醛催化转化活性。

图5 不同浓度羟基改性催化剂的TEM谱图
Fig.5 TEM images of Ag/MCM-41 catalysts with different amounts of OH
2.5 催化剂FT-IR表征结果
图6所示为不同浓度羟基改性Ag/MCM-41催化剂的FT-IR表征结果。可知:未经NaOH羟基改性后的催化剂样品与经不同浓度羟基改性后的催化剂样品在3505 cm-1、1643 cm-1、1300~900 cm-1波峰处均出现了不同程度的红外吸收峰。其中,3505 cm-1出现的红外吸收峰可归属于水分子或者是交换离子产生的—OH基团伸缩振动峰[17],1643 cm-1波数范围归属于催化剂样品表面吸附水的—OH键伸缩振动峰[17]。1235 cm-1和1101 cm-1存在2个强吸收峰为载体MCM-41的Si—O键伸缩振动峰和Si—O键不对称伸缩振动峰[18]。分析结果表明:当羟基浓度较低(0.05,0.075 mol/L)时,相同金属负载量的Ag/MCM-41催化剂上的表面官能团与未经NaOH羟基改性后的Ag/MCM-41催化剂相比有较大差异,载体结构Si—O键被破坏,并且催化剂表面交换离子形成的羟基基本消失。继续升高羟基浓度到0.1 mol/L,可以发现该催化剂表面有明显羟基特征吸收峰,并且其峰值在所有催化剂里最大。随着羟基浓度继续升高至0.25,0.5 mol/L后,发现催化剂Si—O键基本结构未改变,但是催化剂表面交换离子形成的羟基浓度与0.1 mol/L NaOH改性后的催化剂相比有明显下降。这说明,Ag催化剂经过NaOH改性后催化剂表面交换离子产生羟基,并且加入NaOH浓度不同,导致催化剂表面形成的活性羟基基团浓度也不同。当NaOH添加量为0.1 mol/L时,催化剂表面形成了更多的活性羟基基团,从而促进了活性金属银粒子的分散,最终提高了催化剂样品的甲醛催化反应活性。
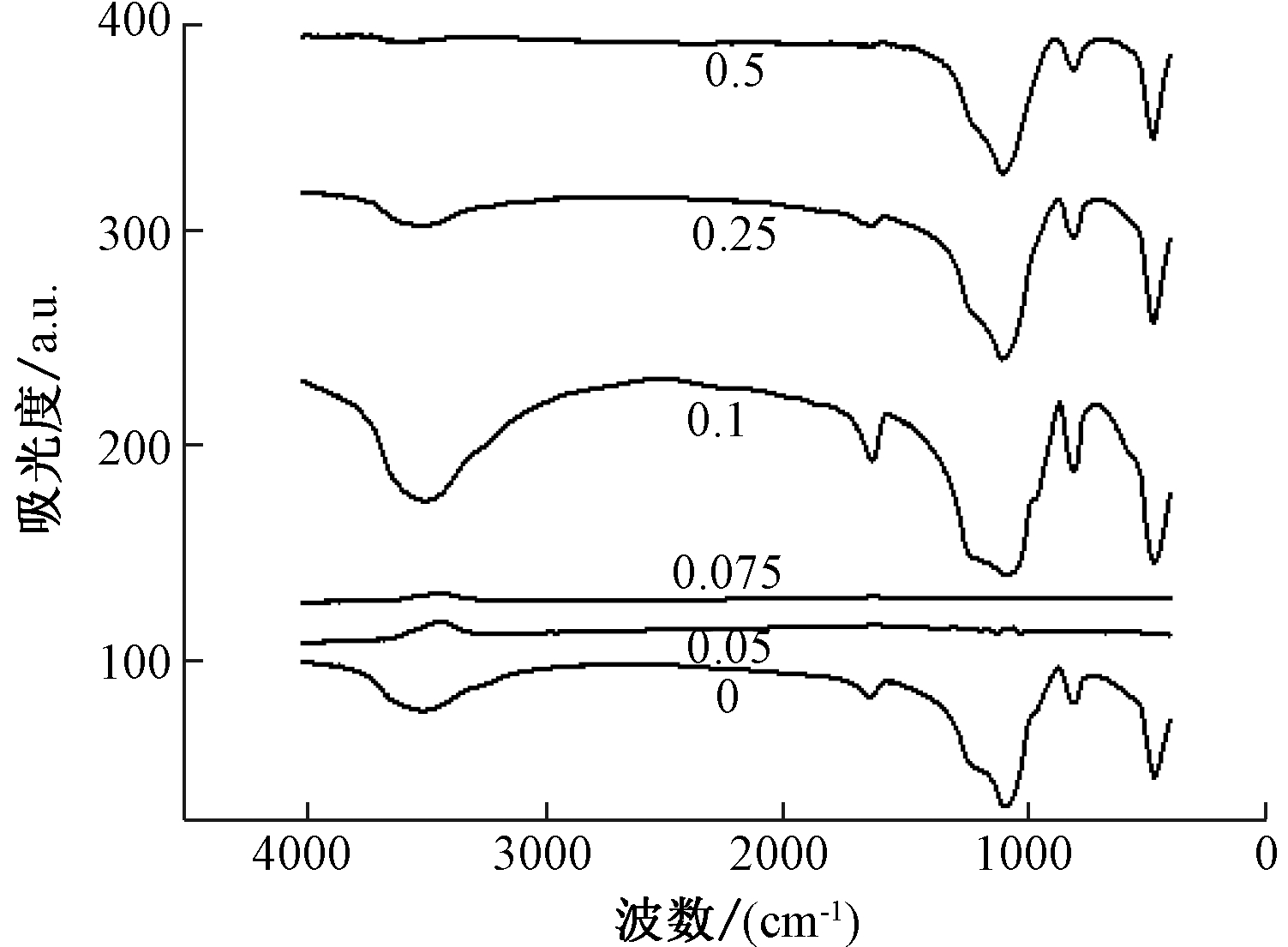
图6 不同浓度羟基改性催化剂的FT-IR谱图
Fig.6 FT-IR patterns of Ag/MCM-41 catalysts with different amount of —OH
3 结 论
1) 采用等体积浸渍法制备Ag/MCM-41催化剂,经过不同浓度NaOH溶液羟基改性处理后,催化剂表面交换形成的羟基浓度有较大差异。当NaOH溶液浓度为0.1 mol/L时,催化剂表面形成最多活性羟基基团。
2) 甲醛固定床催化活性评价结果表明:0.1 mol/L NaOH改性后的Ag/MCM-41催化剂表现出最佳的甲醛催化氧化活性,在150 ℃时能够将甲醛完全催化转化。
3) 氮气物理吸附、X射线衍射、透射电镜、红外光谱分析表征结果表明:当NaOH添加量为0.1 mol/L时,催化剂样品表面形成了高度有序的介孔结构,并且产生了更多的活性羟基基团,从而促进了活性金属银粒子的分散,最终提高甲醛催化反应活性。
[1] Zhang L, Chen L, Li Y, et al. Complete oxidation of formaldehyde at room temperature over an Al-rich Beta zeolite supported platinum catalyst[J]. Applied Catalysis B: Environmental,2017,219:200-208.
[2] Mei J, Shao Y, Lu S, et al. Synthesis of Al2O3 with tunable pore size for efficient formaldehyde oxidation degradation performance[J]. Journal of Materials Science,2018,53(5):3375-3387.
[3] Wang H, Qu Z, Xie H, et al. Insight into the mesoporous FexCe1-xO2-δ catalysts for selective catalytic reduction of NO with NH3: regulable structure and activity[J]. Journal of Catalysis,2016,338:56-67.
[4] Ge S, Geng W, He X, et al. Effect of framework structure, pore size and surface modification on the adsorption performance of methylene blue and Cu2+ in mesoporous silica[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,2018,539:154-162.
[5] Ma L, Wang D, Li J, et al. Ag/CeO2 nanospheres: efficient catalysts for formaldehyde oxidation[J]. Applied Catalysis B: Environmental, 2014,148/149:36-43.
[6] Qu Z, Cheng M, Huang W, et al. Formation of subsurface oxygen species and its high activity toward CO oxidation over silver catalysts[J]. Journal of Catalysis,2004,229(2):446-458.
[7] Zhang X, Yang Y, Song L, et al. High and stable catalytic activity of Ag/Fe2O3 catalysts derived from MOFs for CO oxidation[J]. Molecular Catalysis,2018,447:80-89.
[8] Han Y, Wen B, Zhu M, et al. Lanthanum incorporated in MCM-41 and its application as a support for a stable Ni-based methanation catalyst[J]. Journal of Rare Earths,2018,36(4):367-373.
[9] Zhu T, Song H, Dai X, et al. Preparation of Ni2P/Al-SBA-15 catalyst and its performance for benzofuran hydrodeoxygenation[J]. Chinese Journal of Chemical Engineering,2017,25(12):1784-1790.
[10] Chen D, Qu Z, Lv Y, et al. Effect of oxygen pretreatment on the surface catalytic oxidation of HCHO on Ag/MCM-41 catalysts[J]. Journal of Molecular Catalysis A: Chemical,2015,404/405:98-105.
[11] Qu Z, Chen D, Sun Y, et al. High catalytic activity for formaldehyde oxidation of AgCo/APTES@MCM-41 prepared by two steps method[J]. Applied Catalysis A: General,2014,487:100-109.
[12] Chen D, Qu Z, Sun Y, et al. Identification of reaction intermediates and mechanism responsible for highly active HCHO oxidation on Ag/MCM-41 catalysts[J]. Applied Catalysis B: Environmental,2013,142/143:838-848.
[13] Zhao D, Feng J, Huo Q, et al. Triblock copolymer syntheses of mesoporous silica with periodic 50 to 300 angstrom pores[J]. Science (New York, N.Y.),1998,279(5350):548-52.
[14] Sing K S W. Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity (Recommendations 1984)[J]. Pure and Applied Chemistry,2013,57(4):603-619.
[15] Kondarides D I, Verykios X E. Interaction of Oxygen with Supported Ag-Au Alloy Catalysts[J]. Journal of Catalysis,1996,158(2):363-377.
[16] Zhang X D, Li H X, Lv X T, et al. Facile synthesis of highly efficient amorphous Mn-MIL-100 catalysts: formation mechanism and structure changes during application in CO oxidation[J]. Chemistry-A European Journal,2018,24 (35):8822-8832.
[17] Maira A J, Coronado J M, Augugliaro V, et al. Fourier transform infrared study of the performance of nanostructured TiO2 particles for the photocatalytic oxidation of gaseous toluene[J]. Journal of Catalysis,2001,202(2):413-420.
[18] Morey M S, O’Brien S, Schwarz S, et al. ChemInform abstract: hydrothermal and postsynthesis surface modification of cubic, MCM-48, and ultralarge pore SBA-15 mesoporous silica with titanium[J]. ChemInform,2000,12(4):898-911.