0 引 言
随着燃煤机组氮氧化物超低排放的逐步完成,在执行相同排放标准的前提下,燃气机组的度电氮氧化物排放量已达燃煤机组的约1.5倍[1],因此对燃气机组氮氧化物超低排放技术的需求越发迫切[2]。但由于燃气机组在烟气条件、负荷变化速率、安装空间等方面显著区别于燃煤机组,这要求燃气脱硝催化剂活性更高,且性能更加稳定[3]。现有初步研究表明:高钒催化剂是一种较为理想的燃气脱硝催化剂[4-5],但关于其性能的研究很少。
前人对钒基脱硝催化机理的阐述可大致概括为Eley-Rideal机理和Langmuir-Hinshelwood机理两种[6]。Eley-Rideal机理认为,NH3-SCR反应发生在V—OH和相邻的V![]() O物种组成的双重点位上,强吸附的氨还原游离或弱吸附的NO[7-8]。而Langmuir-Hinshelwood机理提出催化过程中是吸附并活化的
O物种组成的双重点位上,强吸附的氨还原游离或弱吸附的NO[7-8]。而Langmuir-Hinshelwood机理提出催化过程中是吸附并活化的![]() 与吸附的NO2发生反应[7,9]。两种机理都说明了催化剂对NH3的吸附活化作用。对NH3的吸附活化主要发生在催化剂表面的酸性位,即Lewis酸和Brønsted酸位点。多数文献认为Lewis酸是主要的活性中心[6-10],而Brønsted酸不参加反应或在低温下参加反应[11-12]。文献中关于V2O5-TiO2催化剂的脱硝机理研究通常认为V2O5是主要的Lewis酸位和Brønsted酸位提供点[6]。但上述结论一般仅局限于低钒含量(<1%)催化剂[6,13-15],对于高钒含量催化剂,其表面酸性将随钒含量的增加而发生改变。由于关于高钒催化剂的性能研究较少,其表面酸性的改变对催化活性和反应历程的影响还不够明确,不利于高钒燃气脱硝催化剂的继续研发。同时WO3常用于改性钒基催化剂,由于能有效提高V2O5在载体表面的分散性,从而提供更多催化剂表面的酸性位点[13-14],所以尝试通过添加WO3来进一步提高脱硝催化活性。
与吸附的NO2发生反应[7,9]。两种机理都说明了催化剂对NH3的吸附活化作用。对NH3的吸附活化主要发生在催化剂表面的酸性位,即Lewis酸和Brønsted酸位点。多数文献认为Lewis酸是主要的活性中心[6-10],而Brønsted酸不参加反应或在低温下参加反应[11-12]。文献中关于V2O5-TiO2催化剂的脱硝机理研究通常认为V2O5是主要的Lewis酸位和Brønsted酸位提供点[6]。但上述结论一般仅局限于低钒含量(<1%)催化剂[6,13-15],对于高钒含量催化剂,其表面酸性将随钒含量的增加而发生改变。由于关于高钒催化剂的性能研究较少,其表面酸性的改变对催化活性和反应历程的影响还不够明确,不利于高钒燃气脱硝催化剂的继续研发。同时WO3常用于改性钒基催化剂,由于能有效提高V2O5在载体表面的分散性,从而提供更多催化剂表面的酸性位点[13-14],所以尝试通过添加WO3来进一步提高脱硝催化活性。
本文采用浸渍法制备了一系列高V2O5和WO3含量的脱硝催化剂,评价了不同WO3含量对催化剂的改性作用,以及运用比表面积测定(BET)、X射线衍射(XRD)、程序升温还原(H2-TPR)、原位红外(DRIFTS)等表征方法研究了高V2O5含量脱硝催化剂的反应历程,为下一步配方改进提供了研究基础。
1 实验方法
1.1 催化剂的制备
本实验采用共浸渍法制备钨改性高钒催化剂。实验步骤为:称取6 g TiO2(200 m2/g,Anatase)、偏钒酸铵(1%~5%,间隔为0.5%)和钨酸铵(4%~8%,间隔为1%)加入烧杯,30 mL去离子水溶解,使用转子搅拌机常温搅拌1.5 h,60 ℃搅拌2 h;其后真空干燥箱60 ℃烘干10 h;经马弗炉以5 ℃/min的速率升温至500 ℃煅烧5 h;最后压片、筛分获得40~60目的催化剂样品。
1.2 催化剂的活性评价
量取2 mL 40~60目的催化剂,模拟烟气的组成为:NO浓度为0.05%,O2占15%(体积分数),氨氮比为1.2,载气为N2。气体中NO含量由烟气分析仪(南京国电环保科技有限公司,ASP-01)实时在线检测。
1.3 催化剂的表征
1.3.1 比表面积测定(BET)
NOVA-4000e型BET比表面分析仪(美国康塔仪器公司)。取样量0.1 g;回填气与吸附质气体为N2;脱气温度为300 ℃;脱气时间6 h;测试压力范围(P/P0)0.05~0.35。
1.3.2 X射线衍射(XRD)
D2 PHASER型X射线衍射仪(德国布鲁克AXS公司)。采用Cu靶,扫描角度范围10°~90°,扫描速度4°/min。
1.3.3 扫描电子显微镜(SEM)
德国卡尔蔡司公司,EVO10型。
1.3.4 程序升温还原(H2-TPR)
浙江泛泰仪器有限公司FINSORB3010型。检测器为热导检测器(TCD),200 ℃下N2预处理110 min后温度降至室温,切换H2至5 mL/min,温度以10 ℃/min缓慢升至900 ℃。
1.3.5 NH3吸附(NH3-DRIFTS)
Nicolet 6700型傅立叶变换红外光谱仪(美国赛默飞世尔公司)。将催化剂在常温下N2预处理1 h后,通入NH3(0.05%体积分数)处理1 h,在50~300 ℃下用N2吹扫处理;将催化剂在常温下N2预处理1 h后,在280~360 ℃和400~460 ℃持续通入NH3(0.05%体积分数)。
1.3.6 原位红外(In-situ DRIFTS)
将催化剂在常温下N2预处理1 h后,升温至420 ℃,通入NH3(0.05%体积分数)处理60 min,断开NH3,同时通入NO(0.05%体积分数)和O2(15%)。
2 结果与讨论
2.1 催化剂的SCR脱硝活性测试
2.1.1 空速对单位催化剂活性组分单位时间转化的反应物的量(TOF)的影响
图1所示为3%V2O5/TiO2催化剂在380 ℃时不同空速(GHSV)条件下的SCR脱硝反应TOF值。随着空速升高,催化剂TOF值逐渐增大,当空速升高至1×105 h-1时,TOF达到最大值,其后基本稳定。这说明当空速高于1×105 h-1时,SCR脱硝反应可消除扩散影响,有利于反应平衡,得到催化剂本征活性[16]。因此,本实验空速定为1×105 h-1。
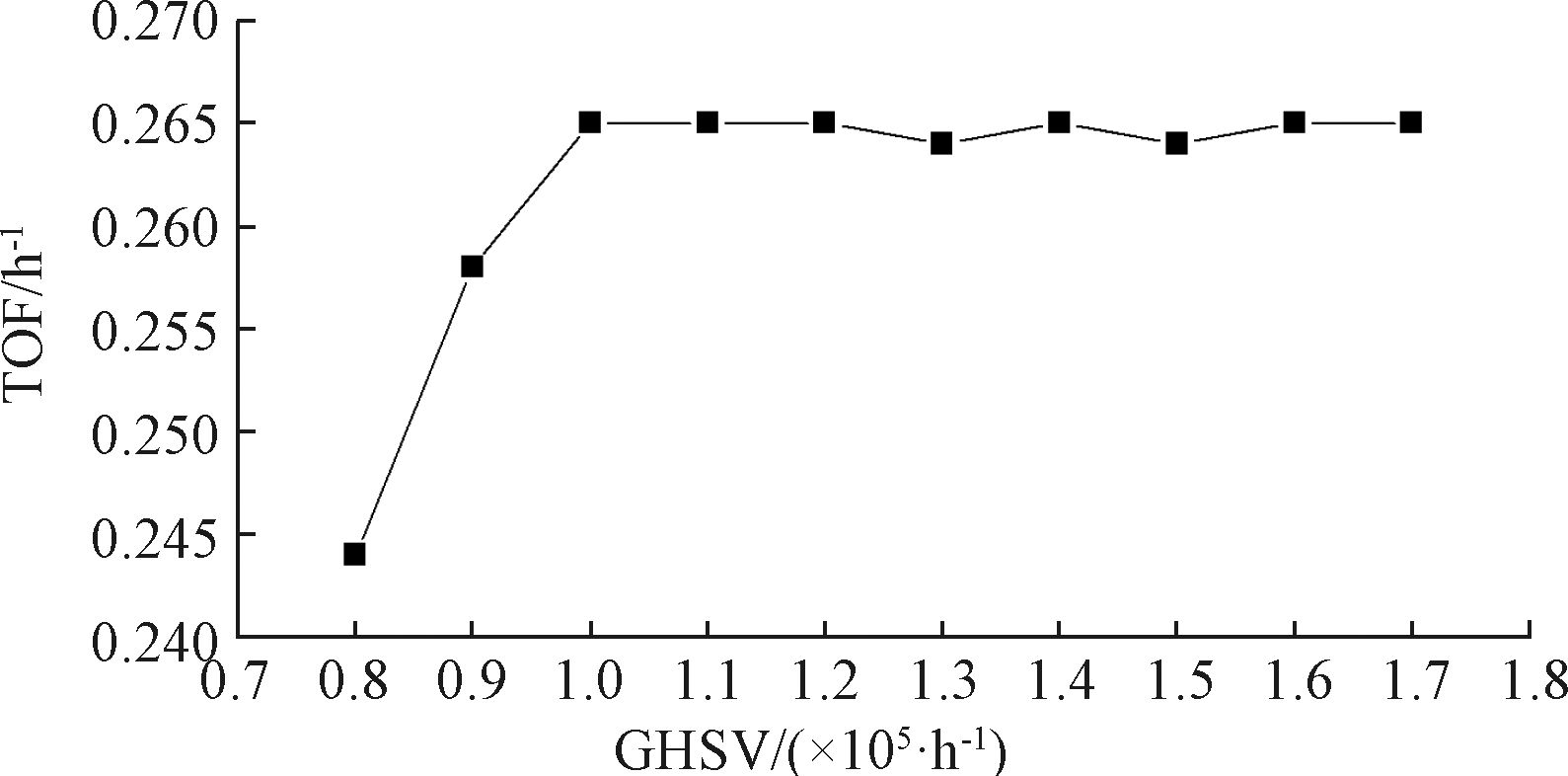
图1 不同空速条件下3%V2O5/TiO2催化剂的TOF(380 ℃)
Fig.1 TOF value of 3%V2O5/TiO2 catalyst at different space velocity(380 ℃)
2.1.2 V2O5含量对效率的影响
图2所示为不同钒含量V2O5/TiO2催化剂在380 ℃下的SCR脱硝效率曲线。随着V2O5含量增大,催化剂的效率缓慢升高,在V2O5质量分数为3.0%时,效率达到最大值93%,其后逐渐下降。这可能是因为当V2O5含量<3.0%时,其在TiO2表面能被较好地分散,而当V2O5含量>3.0%时,增多的V2O5物质在TiO2表面更易于团聚[17-18],导致催化剂表面活性中心数量减少和活性下降。因此,本实验催化剂V2O5含量选取3.0%。
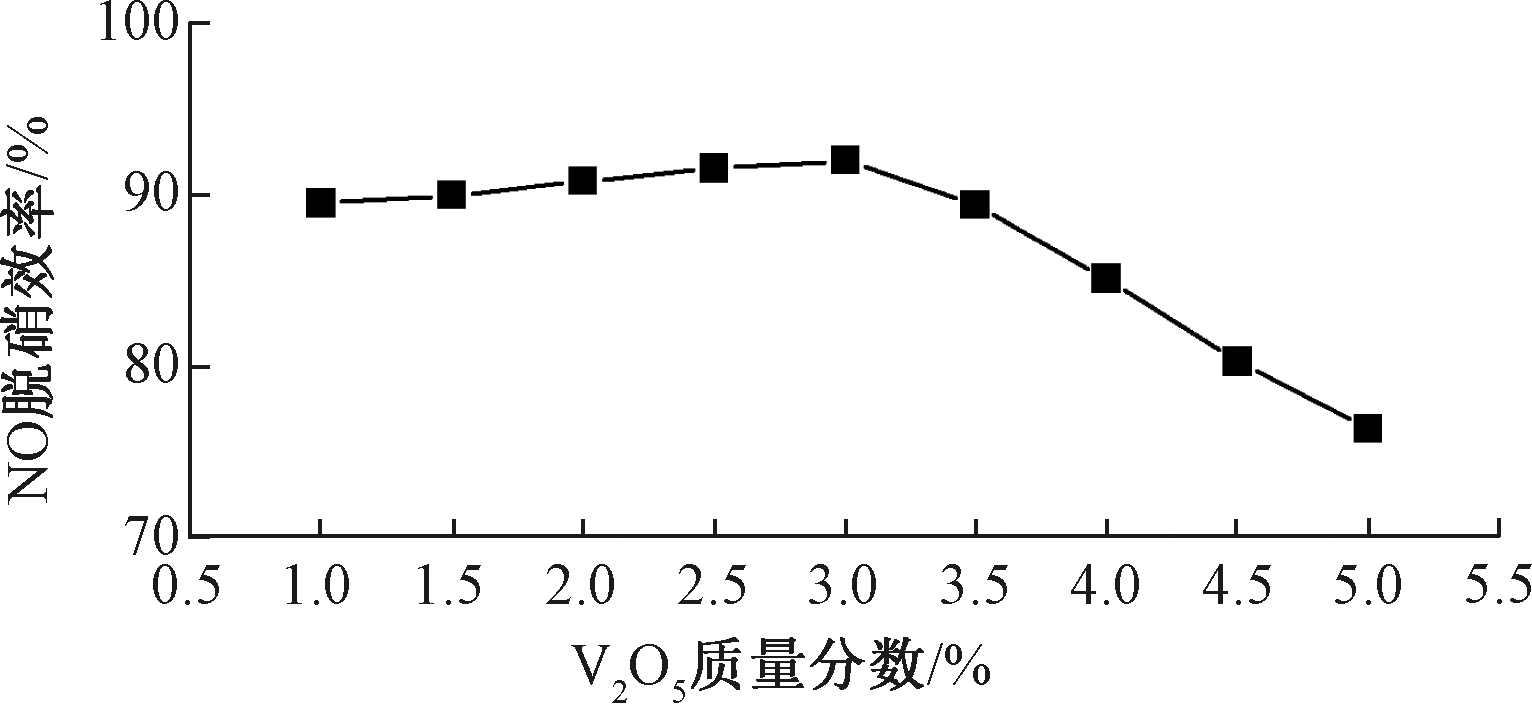
图2 V2O5质量分数对V2O5/TiO2催化剂SCR脱硝
效率的影响(380 ℃)
Fig.2 Effect of V2O5 contents on SCR denitration efficiency of V2O5/TiO2 catalysts (380 ℃)
2.1.3 WO3对V2O5/TiO2催化剂效率的影响
图3所示为掺杂不同WO3含量的3%V2O5/TiO2催化剂在不同温度条件下的SCR脱硝效率曲线。当不含WO3时,3%V2O5/TiO2催化剂的效率随温度升高快速升高,在380 ℃时达到最大值93%,其后效率快速下降。当掺杂WO3(WO3含量>4%)后,虽然催化剂在380 ℃时的效率未有明显变化,但在280~380 ℃内催化剂效率显著升高,催化剂脱硝活性向低温方向明显拓宽。当温度>380 ℃时,高WO3含量(WO3含量>5%)的催化剂效率明显高于低WO3含量的催化剂效率,在420~440 ℃时达到最大值95%。总体而言,WO3掺杂后,虽然未能大幅提高3%V2O5/TiO2催化剂的最佳脱硝效率值,但显著拓宽了催化剂的活性区间,对低温段脱硝活性的提升尤为明显。
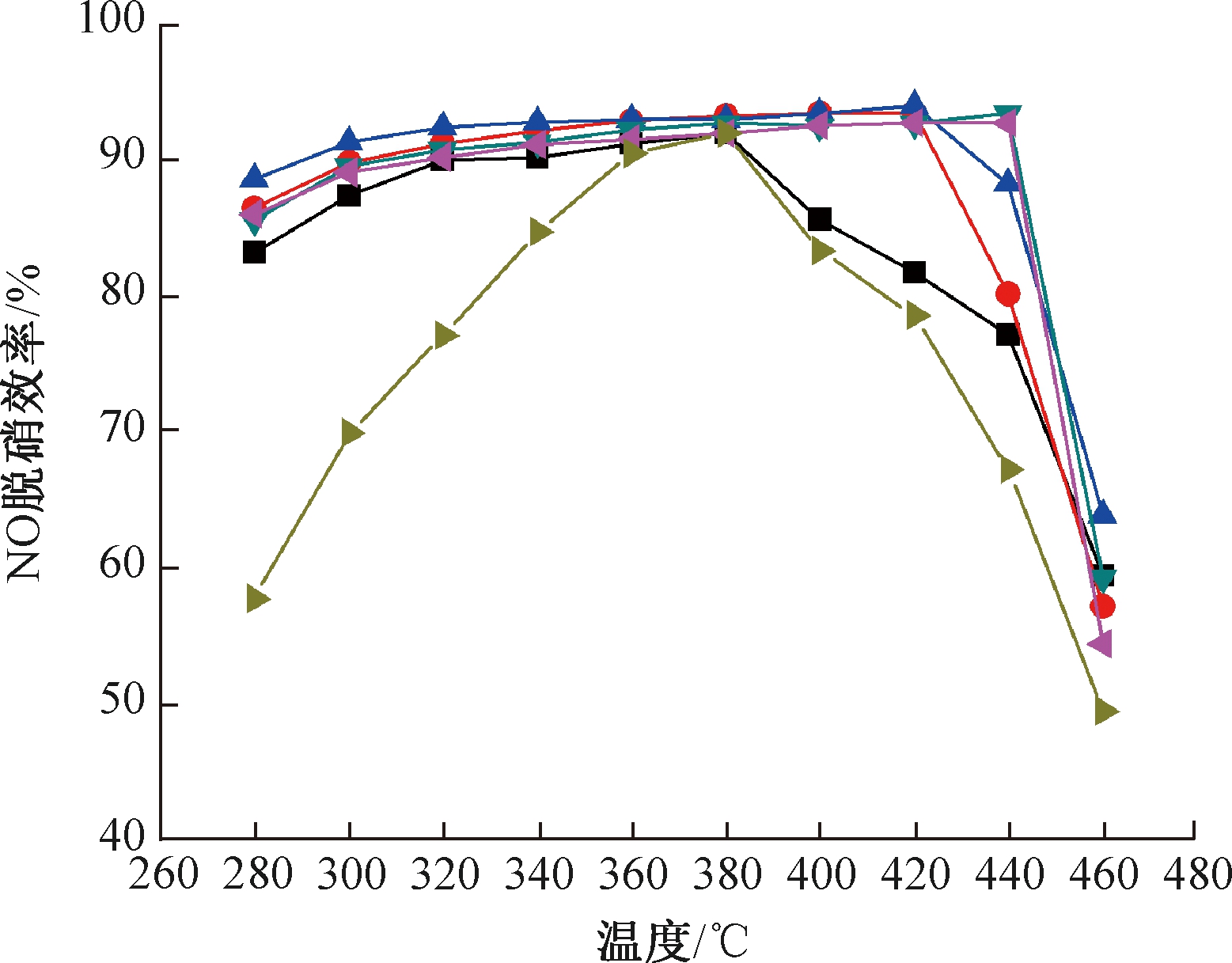
![]() —3% V2O5-4% WO3/TiO2;
—3% V2O5-4% WO3/TiO2; ![]() —3% V2O5-5% WO3/TiO2;
—3% V2O5-5% WO3/TiO2; ![]() —3% V2O5-6% WO3/TiO2;
—3% V2O5-6% WO3/TiO2; ![]() —3% V2O5-7% WO3/TiO2;
—3% V2O5-7% WO3/TiO2; ![]() —3% V2O5-8% WO3/TiO2;
—3% V2O5-8% WO3/TiO2; ![]() —3% V2O5/TiO2。
—3% V2O5/TiO2。
图3 WO3含量对3%V2O5/TiO2催化剂SCR脱硝效率的影响
Fig.3 Effect of WO3 contents on SCR denitration efficiency of 3% V2O5/TiO2 catalysts
有文献报道[18-19],当V2O5含量较低(约1%)时,WO3的掺杂可提高V2O5在载体表面的分散度,从而增加活性位数量提高活性。然而,如图3所示:当V2O5含量较高(3%)时,WO3掺杂未能明显提高3%V2O5/TiO2催化剂的整体活性,这可能是因为TiO2载体表面空位数量的局限,对于较高V2O5含量的催化剂,WO3掺杂后已无法进一步提高其分散度。因此,掺杂WO3对高V2O5含量催化剂活性区间的拓宽作用可能与WO3对V2O5氧化还原能力或酸性位活化NH3能力的改性有关。
2.2 催化剂的表征
2.2.1 XRD分析
SCR脱硝反应前后,3%V2O5-WO3/TiO2催化剂的XRD谱图(图4)中仅有TiO2衍射峰,未见WO3或V2O5的衍射峰。这说明WO3和V2O5在TiO2表面分散较好,且SCR脱硝反应过程未明显改变WO3和V2O5在载体表面的分散度。
2.2.2 BET和SEM分析
WO3的掺杂可提高V2O5/TiO2催化剂的比表面积如表1所示,且随着WO3含量的增大,V2O5-WO3/TiO2催化剂的比表面积略有提高。这可能是因为WO3掺杂后与V2O5形成了较强的相互作用,改变了V2O5在TiO2载体表面的分散状态。但经过SCR脱硝反应之后,催化剂的比表面积略有下降,根据催化剂样品SCR脱硝反应前后的SEM对比图(图5)可知:在SCR脱硝反应过程中,以球形颗粒状存在的催化剂样品粒径略有增大,产生团聚,这可能是导致反应之后催化剂样品比表面积下降的主要原因。
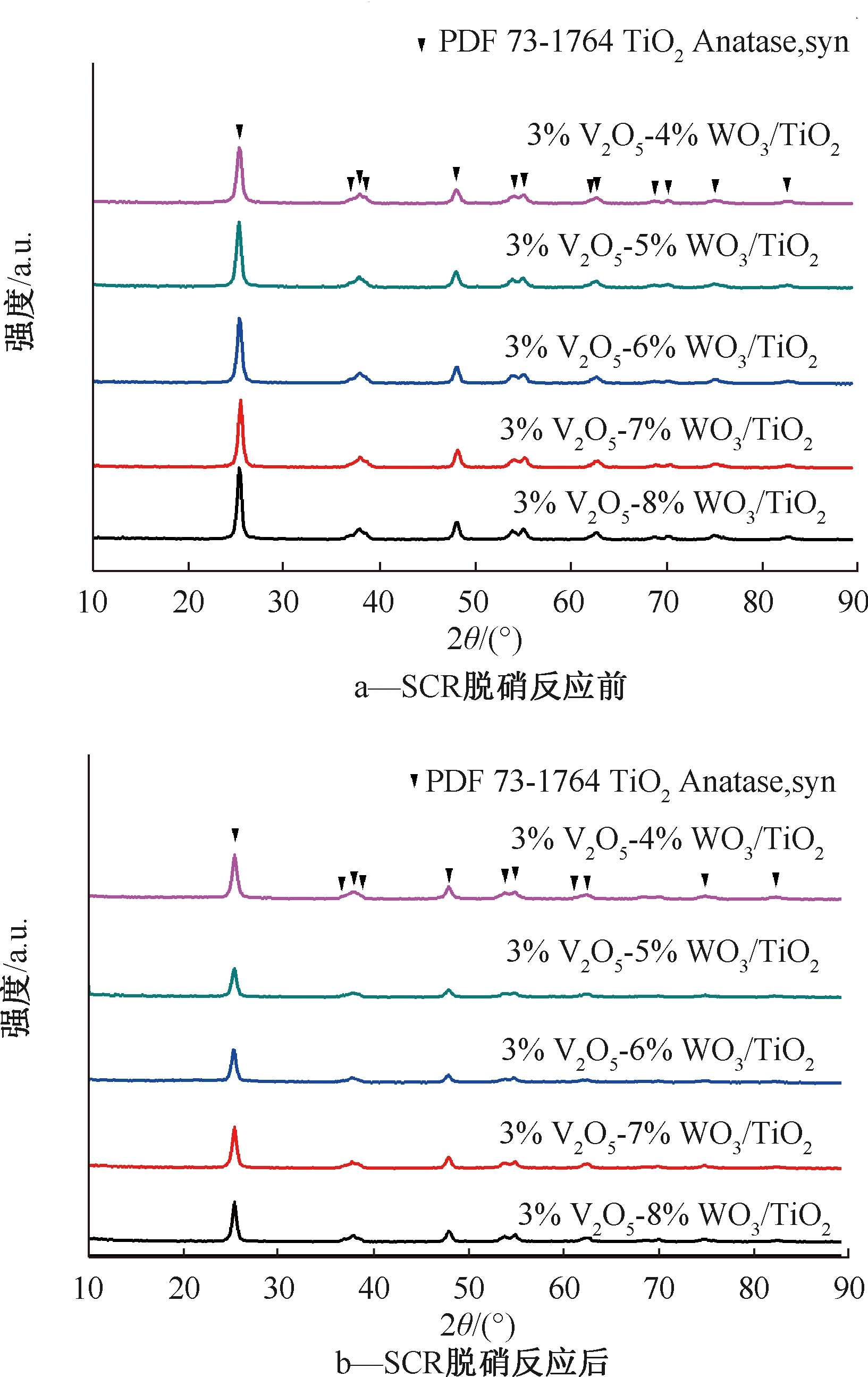
图4 3%V2O5/TiO2催化剂的XRD谱图
Fig.4 XRD spectrum of 3%V2O5/TiO2 catalyst
表1 SCR脱硝反应前后V2O5-WO3/TiO2催化剂
比表面积对比
Table 1 Comparison of specific surface area of V2O5-WO3/TiO2 catalyst before and after SCR denitration

催化剂BET比表面积/(m2·g-1)活性测试前活性测试后3%V2O5/TiO276653%V2O5-4%WO3/TiO287843%V2O5-5%WO3/TiO290793%V2O5-6%WO3/TiO295643%V2O5-7%WO3/TiO297723%V2O5-8%WO3/TiO29984
2.2.3 H2-TPR分析
各组V2O5-WO3/TiO2催化剂的H2-TPR曲线见图6。可知:3%V2O5/TiO2催化剂的还原区间大致位于300~700 ℃,第1个还原峰位置大约在500 ℃属于V5+→V3+的还原,第2个还原峰较弱,大约位于600 ℃之后,归属于V2O5与WO3所形成聚合物的还原[20-21]。WO3掺杂之后,V2O5-WO3/TiO2催化剂的还原峰显著升高,特别是位于600 ℃之后的还原量显著增大,但还原峰位置未有明显改变,且未出现WO3在800 ℃附近的还原峰[22]。这说明所掺杂的WO3与V2O5形成了较强的相互作用,WO3的掺杂不仅提高了V5+在总V含量中的比例,并形成了大量V—O—W结构,催化剂还原容量得以提高,但其还原能力未有明显变化。

图5 V2O5-WO3/TiO2催化剂的SEM图
Fig.5 SEM images of V2O5-WO3/TiO2 catalyst

图6 V2O5-WO3/TiO2催化剂H2-TPR曲线
Fig.6 H2-TPR curve of V2O5-WO3/TiO2 catalyst
2.2.4 NH3-DRIFTS分析
图7所示为2%V2O5/TiO2、2%V2O5-4%WO3/TiO2、2%V2O5-6%WO3/TiO2以及3%V2O5/TiO2、3%V2O5-4%WO3/TiO2和3%V2O5-6%WO3/TiO2催化剂吸附NH3后在50~250 ℃下的红外谱图。其中,1450 cm-1和1650 cm-1处的吸收峰归属于Brønsted(B)酸[23-24],1220 cm-1和1600 cm-1处的吸收峰归属于Lewis(L)酸[15,23]。由图7a、7d可知:V2O5/TiO2催化剂表面吸附NH3的酸性位主要有B酸和L酸,分别位于1450 cm-1和1220 cm-1处。WO3掺杂后,V2O5-WO3/TiO2催化剂表面B酸和L酸量显著升高,且在1650 cm-1和1600 cm-1处出现新的B酸和L酸吸收峰。对比V2O5-WO3/TiO2催化剂表面酸量的增多将能显著提高催化剂活化NH3的能力,从而提高活性。根据催化剂H2-TPR分析结果,WO3掺杂后,在催化剂表面形成了更多的V5+和V—O—W,这不仅使得L酸位数量增多,且催化剂表面易于形成更多的—OH位,从而大量增加B酸位。对比图7a和7d可知:当催化剂V2O5含量由2.0%增加到3.0%时,催化剂表面酸量略有升高;WO3掺杂后,3%V2O5-6%WO3/TiO2催化剂表面酸量明显高于2%V2O5-6%WO3/TiO2,这表明催化剂V2O5含量<3.0%时,难以充分与WO3掺杂,形成更多表面酸位。
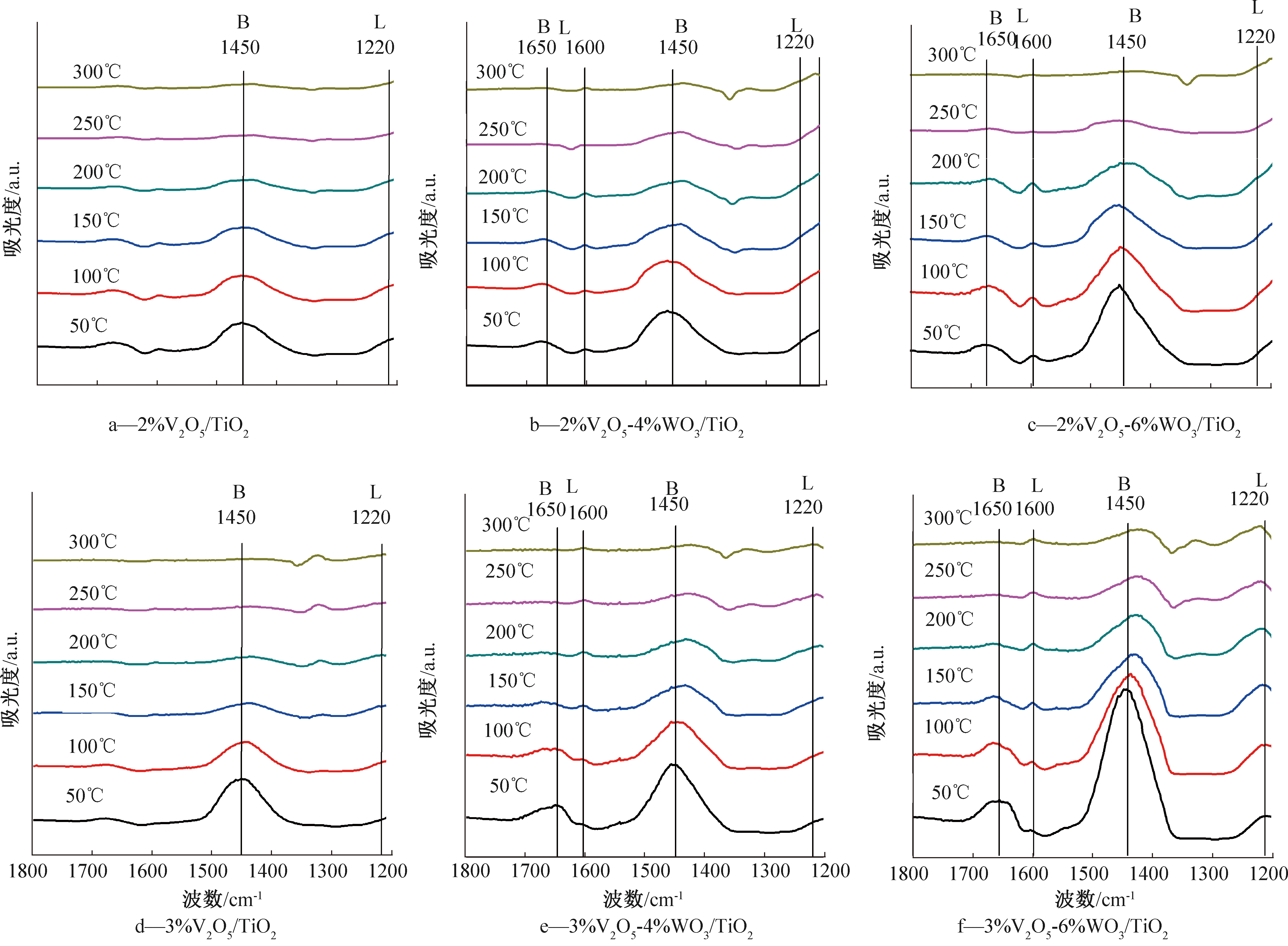
图7 V2O5-WO3/TiO2催化剂的NH3-DRIFTS谱图(50~300 ℃)
Fig.7 NH3-DRIFTS spectrum of V2O5-WO3/TiO2 catalyst (50~300 ℃)
图8所示为2%V2O5/TiO2、2%V2O5-4%WO3/TiO2、2%V2O5-6%WO3/TiO2以及3%V2O5/TiO2、3%V2O5-4%WO3/TiO2和3%V2O5-6%WO3/TiO2催化剂在280~460 ℃的NH3吸附红外谱图。可知:除了B酸(1450 cm-1)和L酸(1220 cm-1和1600 cm-1)的吸收峰以外,1340 cm-1处的吸收峰归属于吸附NH3经活化后的中间物质[23]。对比图8a—c和图8d—f可知,当催化剂V2O5含量由2.0%增加到3.0%时,B酸(1450 cm-1)和L酸(1220 cm-1)的吸收峰略有增强,这是3%V2O5/TiO2催化剂脱硝性能略高于2%V2O5/TiO2的原因。由图8a、8d可知:V2O5/TiO2催化剂在1340 cm-1处的吸收峰强度随着温度升高逐渐增大,在360 ℃附近达到最大值,其后随温度升高而减小。这与V2O5/TiO2催化剂的脱硝效率曲线基本一致(图3)。这说明,对于V2O5/TiO2催化剂,其活化NH3的能力是催化剂SCR脱硝反应的决速步骤,即催化剂活化NH3的能力越强,活性越高。
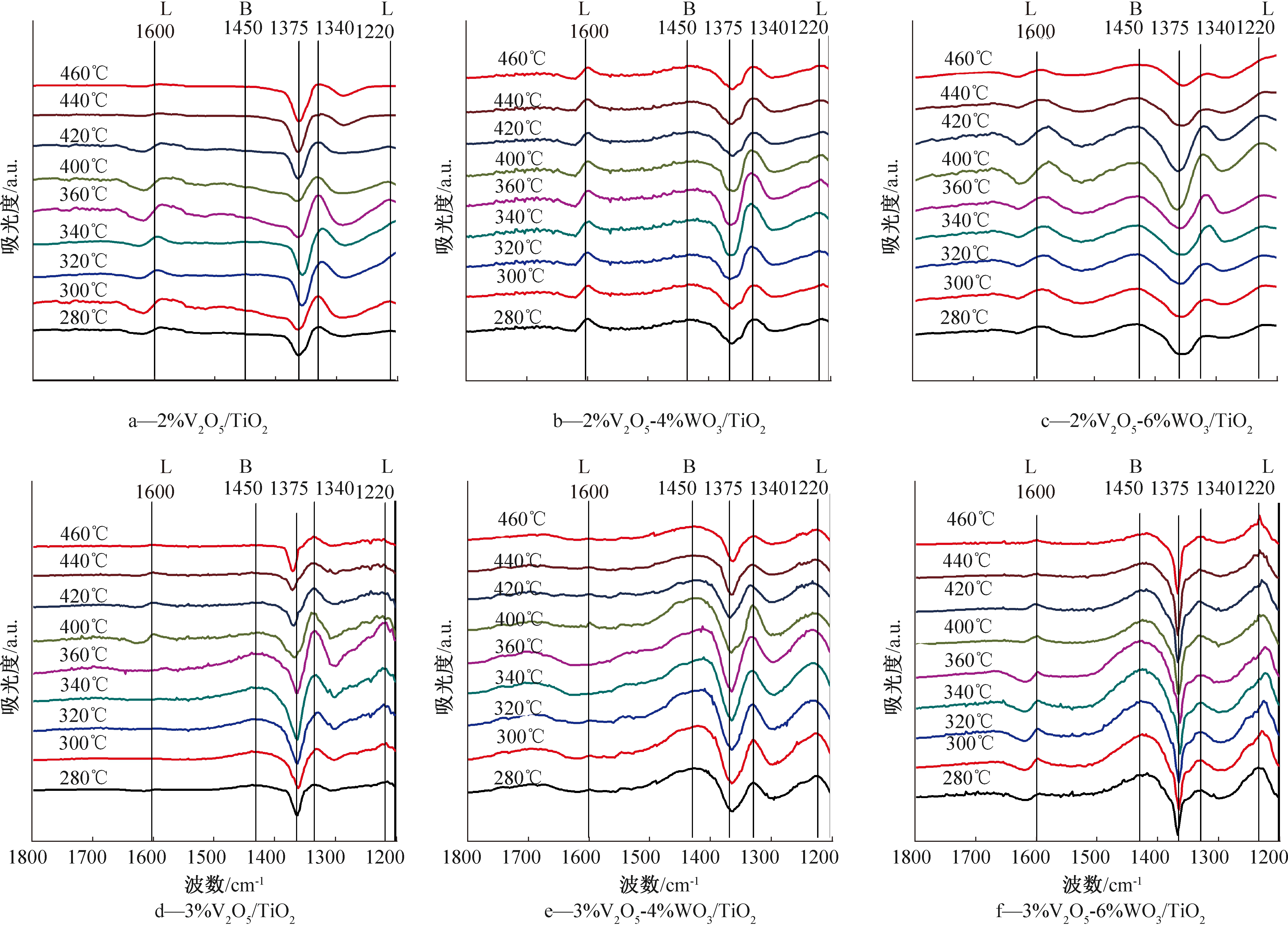
图8 V2O5-WO3/TiO2催化剂的NH3-DRIFTS谱图(280~460 ℃)
Fig.8 NH3-DRIFTS spectrum of V2O5-WO3/TiO2 catalyst (280~460 ℃)
如图8b和8c所示:WO3掺杂后,即使在SCR脱硝反应温度条件下,V2O5-WO3/TiO2催化剂表面B酸和L酸位的吸附NH3量也显著高于V2O5/TiO2催化剂,有效保证了可被活化的吸附NH3源。3%V2O5-4%WO3/TiO2催化剂在1340 cm-1处的吸收峰强度明显高于V2O5/TiO2催化剂,但当温度高于360 ℃后,其强度逐渐减弱。而3%V2O5-6%WO3/TiO2催化剂在1340 cm-1处的吸收峰强度始终比较稳定,在280~460 ℃提供了较好的活化NH3能力。这与V2O5-WO3/TiO2催化剂的脱硝效率曲线基本一致(图3)。
另外,图8a—c在1375 cm-1附近皆出现负峰,且随着WO3含量增大,负峰明显增强。根据文献[9]报道,SCR脱硝反应中催化剂表面有2个活性位,分别为酸性位(V5+—OH)和还原位(V![]() O),反应中由外源氧向晶格氧传递,两活性位之间构成循环变化。由此推测,负峰的出现主要是因为催化剂表面晶格氧或—OH氧参与了NH3活化,活化中催化剂表面形成了O缺失,因此催化剂基体的红外特征振动形式发生改变,从而改变了催化剂基体的红外谱图。而V2O5-WO3/TiO2催化剂在1375 cm-1处更强的负峰说明其具有更多的可用于活化NH3的O物种,从而提升其活化NH3的能力。
O),反应中由外源氧向晶格氧传递,两活性位之间构成循环变化。由此推测,负峰的出现主要是因为催化剂表面晶格氧或—OH氧参与了NH3活化,活化中催化剂表面形成了O缺失,因此催化剂基体的红外特征振动形式发生改变,从而改变了催化剂基体的红外谱图。而V2O5-WO3/TiO2催化剂在1375 cm-1处更强的负峰说明其具有更多的可用于活化NH3的O物种,从而提升其活化NH3的能力。
2.2.5 In-situ DRIFTS分析
图9所示为3%V2O5-6%WO3/TiO2催化剂的原位红外谱图。催化剂在420 ℃条件下经吸附NH3处理后,表面出现了B酸位(V—O—W—OH、V—OH)、L酸位(V—O—W、V![]() O)、活化NH3中间态和O缺失空位。当断开NH3并通入NO和O2后,SCR脱硝反应开始进行,活化NH3与NO反应生成N2,吸附的NH3继续被活化,O缺失空位由外源氧补充恢复,在20 min以后催化剂表面NH3物种耗尽并恢复原始状态。20 min以后,气相中的NO开始在催化剂表面吸附,形成弱吸附的硝酸根(1380 cm-1)[18]。
O)、活化NH3中间态和O缺失空位。当断开NH3并通入NO和O2后,SCR脱硝反应开始进行,活化NH3与NO反应生成N2,吸附的NH3继续被活化,O缺失空位由外源氧补充恢复,在20 min以后催化剂表面NH3物种耗尽并恢复原始状态。20 min以后,气相中的NO开始在催化剂表面吸附,形成弱吸附的硝酸根(1380 cm-1)[18]。
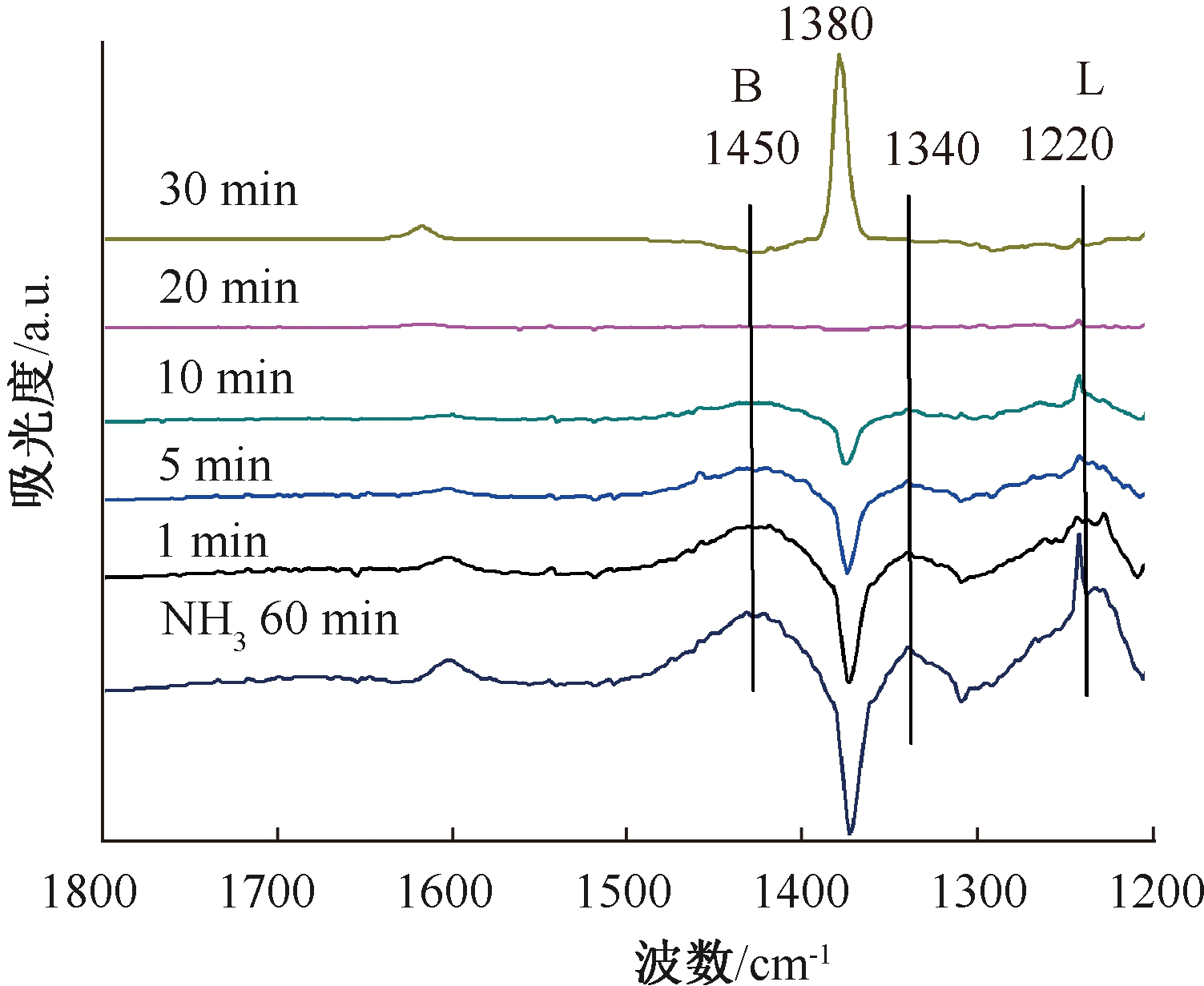
图9 3%V2O5-6%WO3/TiO2催化剂的In-situ NH3-DRIFTS谱图(420 ℃)
Fig.9 In-situ NH3-DRIFTS spectrum of 3%V2O5-6%WO3/TiO2 catalyst (420 ℃)
3 结 论
对于高V2O5含量的V2O5/TiO2催化剂,通过WO3的掺杂可显著拓宽SCR脱硝活性区间(由340~390 ℃扩展为280~440 ℃),但无法大幅提高V2O5/TiO2催化剂的最高SCR脱硝效率(仅由93%升高到95%)。该类型催化剂对NH3物质的吸附与活化能力是SCR脱硝反应的决速步骤。V2O5-WO3/TiO2催化剂具有更宽活性温度区间的主要原因是WO3掺杂后与V2O5间形成较强的相互作用,在催化剂表面形成更多的B酸和L酸位,从而提高了催化剂在温度区间内吸附和活化NH3的能力。
[1] 刘志坦,李玉刚,王凯. 中国燃气电厂烟气排放现状及政策趋势[J]. 中国电力,2018,51(1):147-153.
[2] 王飞. 环保新形势下燃机脱硝技术选择[J]. 能源与环境,2015(1):75-77.
[3] 江苏省燃气电厂环保现状调研[R]. 南京:国电环境保护研究院,2017.
[4] 黄素华,苏保兴,华宇东,等. 燃气轮机NOx排放控制技术[J]. 中国电力, 2012,45(6):100-103.
[5] 王五清,王旭,贺元启. 燃气电厂脱硝技术方案的选择与分析[J]. 华北电力技术,2013(4):38-41.
[6] Busca G, Lietti L, Ramis G, et al. Chemical and mechanistic aspects of the selective catalytic reduction of NOx,by ammonia over oxide catalysts:A review[J]. Applied Catalysis B Environmental,1998,18(1/2):1-36.
[7] Dumesic J A,Topsøe N Y,Slabiak T,et al. Microiunetic analysis of the selective catalytic reduction (SCR) of nitric oxide over vanadia/titania-based catalysts[J]. Studies in Surface Science & Catalysis,1993, 75:1325-1337.
[8] Dumesic J A,Topsøe N Y,Topsøe H. Kinetics of selective catalytic reduction of nitric oxide by ammonia over vanadia/titania[J]. Journal of Catalysis,1996,163(2):409-417.
[9] Takagi M,Kawai T,Soma M,et al. The mechanism of the reaction between NOx,and NH3,on V2O5,in the presence of oxygen[J]. Journal of Catalysis,1977,50(3):441-446.
[10] Zhang S,Zhong Q. Surface characterization studies on the interaction of V2O5-WO3/TiO2,catalyst for low temperature SCR of NO with NH3[J]. Journal of Solid State Chemistry,2015,221:49-56.
[11] 吴碧君,刘晓勤,肖萍,等. Mn-Fe/TiO2低温NH3选择性还原NO催化活性及其反应机制[J]. 中国电机工程学报,2007,27(17):51-56.
[12] 吴碧君,肖萍,刘晓勤. MnOx-WO3/TiO2NH3选择性还原NOx的催化性能与动力学[J]. 化工学报,2011,62(4):940-946.
[13] Alemany L J,Berti F,Ramis G,et al. Characterization and composition of commercial V2O5-WO3/TiO2 SCR catalysts [J]. Applied Catalysis B:Environmental,1996,10(4):299-311.
[14] Cheng K,Liu J,Zhao Z,et al. Direct synthesis of V-W-Ti nanoparticle catalysts for selective catalytic reduction of NO with NH3[J]. Rsc advances,2015,5(56):45172-45183.
[15] Chen J,Yang R. Role of WO3 in mixed V2O5-WO3/TiO2 catalysts for selective catalytic reduction of nitric oxide with ammonia [J]. Applied Catalysis A:General,1992,80(1):135-148.
[16] 廷亮,武旭增,刘庆. 新型HS-2钒催化剂本征活性评价[J]. 河南化工,1993(10):24-27.
[17] Nicosia D,Czekaj I,Kröcher O. Chemical deactivation of V2O5-WO3/TiO2 SCR catalysts by additives and impurities from fuels,lubrication oils and urea solution [J]. Applied Catalysis B:Environmental,2008,77(3/4):228-236.
[18] Amiridis M D,Duevel R V,Wachs I E. The effect of metal oxide additives on the activity of V2O5/TiO2,catalysts for the selective catalytic reduction of nitric oxide by ammonia[J]. Applied Catalysis B:Environmental, 1999,20(2):111-122.
[19] Schobing J,Tschamber V,Brilhac J F,et al. Simultaneous soot combustion and NOx,reduction over a vanadia-based selective catalytic reduction catalyst[J]. Comptes Rendus Chimie,2017.
[20] Yu W,Wu X,Si Z,et al. Influences of impregnation procedure on the SCR activity and alkali resistance of V2O5-WO3/TiO2,catalyst[J]. Applied Surface Science,2013,283(20):209-214.
[21] Wang C,Yang S,Chang H,et al. Dispersion of tungsten oxide on SCR performance of V2O5-WO3/TiO2:acidity,surface species and catalytic activity[J]. Chemical Engineering Journal,2013,225(6):520-527.
[22] Putluru S S R,Schill L,Godiksen A,et al. Promoted V2O5-WO3/TiO2,catalysts for selective catalytic reduction of NO with NH3,at low temperatures[J]. Applied Catalysis B Environmental,2016,183:282-290.
[23] Lietti L,Nova I,Ramis G,et al. Characterization and reactivity of V2O5-WO3/TiO2,De-NOx,SCR catalysts[J]. Journal of Catalysis,1999,187(2):419-435.
[24] Sun C,Dong L,Yu W,et al. Promotion effect of tungsten oxide on SCR of NO with NH3,for the V2O5-WO3/Ti0.5Sn0.5O2,catalyst:experiments combined with DFT calculations[J]. Journal of Molecular Catalysis A Chemical,2011,346(1):29-38.