0 引 言
近年来,中国畜禽养殖业迅猛发展,抗生素需求量激增。据统计中国的兽用抗生素年总产量约为84240 t[1-2]。畜禽对抗生素难以完全吸收和代谢,大量抗生素及其代谢产物随粪便或尿液排出体外[3]。2015年,中国畜禽粪便年产生量已达21.21亿t,粪便随意弃置现象严重,已成为环境中抗生素的主要来源。据统计,中国每年有超过5万t抗生素被排放进入水土环境中[4],导致环境中耐药菌的产生和增加,对生态环境和人类健康构成潜在威胁。
畜禽粪便直接作为肥料还田时,残留抗生素能够吸附并长期固定在土壤颗粒上[5-6]。有研究表明:四环素类、磺胺类和大环内酯类可在土壤中残留 8 个月以上[7]。土壤中的抗生素能够诱导环境微生物产生抗性基因(antibiotic resistant genes,ARGs),增强微生物对抗生素的适应能力[8]。抗性基因可由环境微生物转移至病原菌,导致耐药病原菌产生,使抗生素治疗效果下降,并最终危害人类健康[9]。抗生素还能够影响植物生长,可能造成农作物减产甚至粮食短缺等严重后果。Zhang等[10]研究表明,磺胺二甲嘧啶能够减少叶酸合成,并最终通过阻碍DNA的合成抑制拟南芥生长。Boxall 等[11]研究发现,恩诺沙星对胡萝卜和莴苣的生长有显著抑制作用。
随着中国畜禽养殖业的快速发展,畜禽粪便中抗生素残留已成为亟待解决的环境问题。好氧堆肥技术是利用微生物将畜禽粪便等废弃物转化为腐殖质,并腐熟为肥料的过程[12],具有温度高、腐熟速度快、快速杀灭病原微生物的特点,已广泛运用于畜禽粪便的资源化利用。同时,好氧堆肥技术还能够大幅降低畜禽粪便中抗生素浓度[13],也已成为国内外研究热点。但是目前更多的研究仅关注于好氧堆肥技术对畜禽粪便中抗生素的去除效果,对去除机理研究较少。本文从畜禽粪便中抗生素残留情况、影响抗生素降解的工艺条件、抗生素检测等方面对好氧堆肥降解抗生素的研究进展进行综述,探讨好氧堆肥降解抗生素的影响因素及机理,为畜禽粪便资源化利用提供参考和建议。
1 畜禽粪便中残留抗生素的污染概况
畜禽养殖业常使用亚治疗剂量的抗生素作为饲料添加剂,能够有效阻止畜禽肠道中病原微生物增殖,减少肠道内微生物对养分的消耗,达到促进畜禽健康生长的作用[14-15]。目前,研究者们已经在猪、牛、鸡等畜禽的粪便中检测到各类抗生素[16-17],其中,四环素类(tetracyclines,TCs)、磺胺类(sulfonamides,SAs)、氟喹诺酮类(fluoroquinolones,FQs)是最常检测到的抗生素种类,在畜禽粪便中的浓度变化幅度较大[18-19]。
国内众多学者对不同地域的畜禽粪便中抗生素的残留量做了详细调查,发现各地区畜禽粪便中抗生素检出率普遍较高,经济发达、人口密集地区的残留量更为显著,且使用最多的抗生素依次为四环素类、氟喹诺酮类和磺胺类。其中,禽类粪便中更易检出氟喹诺酮类抗生素,而猪、牛等大型牲畜粪便中更多检测出四环素类抗生素。张树清等[20]对中国7个地区养殖厂畜禽粪便中四环素类的残留做了系统调查,发现北京、浙江、江苏等经济发达地区的抗生素平均残留量高出其他地区3~5倍。Zhao等[21]对山东、浙江等八省的养殖厂进行采样检测,发现鸡粪中恩诺沙星(enrofloxacin)和诺氟沙星(norfloxacin)最高浓度分别为1421,225 mg/kg,高于国内报道的最高浓度。Pan等[22]从山东省21个养殖厂采集了126份猪粪样品,发现四环素类检出率高达84.9%~96.8%,其中残留的金霉素(chlortetracycline,CTC)最大浓度为764.4 mg/kg。Zhang等[23]分析了从山东等8个省份采集的33份畜禽粪便样品和17份堆肥样品中抗生素含量,发现土霉素(oxytetracycline,OTC)是最主要的抗生素,山东寿光的样品中检测出最高浓度达到417 mg/kg。与四环素类、氟喹诺酮类抗生素相比,畜禽粪便中磺胺类的残留浓度较低,这可能是由于磺胺类药物的生物毒性过强,使用剂量少的缘故。陈昦等[24]采集了江苏省不同养殖厂共178份畜禽粪便样品,发现8种磺胺类药物在猪、鸡、奶牛粪中的检出率仅为20%左右,浓度较高的磺胺胍(sulfaguanidine)的最高检出浓度为7.1 mg/kg。
总体来看,中国畜禽粪便中抗生素残留情况严重,而畜禽粪便常作为肥料施用于土地后,易造成土壤中的抗生素积累,易诱使土壤微生物产生抗性基因。许多学者也对土壤中抗生素残留做了调查,研究抗生素对土壤的污染情况(表1)。李彦文等[25]对珠江三角洲各城市共14处蔬菜基地的土壤进行调查,发现磺胺类和四环素类抗生素的检出率分别为96.77%、100%,其中,施用养殖厂粪尿的2处菜地土壤中抗生素残留量明显高于普通、绿色或无公害蔬菜基地。张慧敏等[26]对浙江北部地区施用畜禽粪便的农田进行采样检测并与未施用畜禽粪便的土地对比,发现施用粪肥的土壤中四环素、金霉素、土霉素的平均残留量是未施用土地的13,12,38倍。土壤中抗生素残留量通常为μg/kg级别,与畜禽粪便中相比低很多,但长期累积仍然会影响土壤中微生物和植物生长。张俊等[27]对苏北地区某养猪场周边长期施用猪粪的耕地土壤进行检测,结果显示,干土中四环素残留量为41.1~61.9 μg/kg,四环素抗性基因含量为 4.6×105~37.4 ×105 copies/g。可见,在畜禽粪便作为有机肥施用于土地之前,必须对其采取措施降解抗生素,而好氧堆肥则是减少抗生素污染的有效手段之一。
表1 畜禽粪便和土壤中残留的抗生素
Table 1 Literature data of residual antibiotics in livestock manures and soil

地区/年份样品类型和数量抗生素残留量(粪便或土壤中)/(mg·kg-1)文献北京/2005猪粪(n=15)土霉素OTC:4.34~134.75、四环素TTC:0~78.57、金霉素CTC:0~121.78[20]北京/2005鸡粪(n=13)土霉素OTC:3.96~23.43、四环素TTC:0~14.56、金霉素CTC:0~19.03[20]浙江/2005猪粪(n=4)土霉素OTC:1.05~15.2、四环素TTC:0~5.78、金霉素CTC:0~2.15[20]江苏/2005猪粪(n=2)土霉素OTC:2.25~20.01、四环素TTC:2.19~15.60、金霉素CTC:2.14~3.41[20]江苏/2005鸡粪(n=6)土霉素OTC:2.85~10.67、四环素:TTC:0~4.25、金霉素CTC:0~2.61[20]山东、浙江等8省/2007猪粪(n=61)恩诺沙星ENRO:0.48~33.26、诺氟沙星NOR:0.56~5.50、土霉素OTC:0.15~59.06、金霉素CTC:0.16~21.0[21]山东、浙江等8省/2007鸡粪(n=54)恩诺沙星ENRO:0.85~225.45、诺氟沙星NOR:0.33~1420.76、土霉素OTC:0.27 10.56、金霉素CTC: 0.16~17.68[21]山东、浙江等8省/2007牛粪(n=28)恩诺沙星ENRO:1.23~2.76、诺氟沙星NOR:1.72~46.70、土霉素OTC:0.32~59.59、金霉素CTC:0.24~27.59[21]山东/2009猪粪(n=126)土霉素OTC:0~172.9、金霉素CTC:0~764.4[22]山东等8省/2014鸡粪(n=18)恩诺沙星ENRO:0.01~8.58、诺氟沙星NOR:0.01~4.54、土霉素OTC:0.02~416.75、四环素TTC: 0.02~8.68[23]山东等8省/2014鸭粪(n=2)恩诺沙星ENRO:0.02~0.03、诺氟沙星NOR:0.02~0.38、土霉素OTC:0.02~7.15、四环素TTC: 0.13~0.52[23]山东等8省/2014猪粪(n=7)恩诺沙星ENRO:0.01~0.09、诺氟沙星NOR:0.01~0.11、土霉素OTC:0.02~43.43、四环素TTC: 0.02~30.94[23]山东等8省/2014牛粪(n=6)恩诺沙星ENRO:0.01~0.74、诺氟沙星NOR:0.02~0.23、土霉素OTC:0.13~1.94、四环素TTC: 0.02~2.50[23]江苏/2005鸡、猪、牛粪(n=178)磺胺胍SG:0~7.11、磺胺甲恶唑SMZ:0~6.48、磺胺间甲基嘧啶SMM:0~5.19[24]广州、惠州等/2008土壤(n=14)土霉素OTC:0~79.7、金霉素CTC:0~104.6、磺胺甲基嘧啶SM1∶0~85.5、磺胺二甲嘧啶SM2∶0~93.5[25]杭州、绍兴等/2008土壤(n=48)四环素TTC:0~553、土霉素OTC:0~5172、金霉素CTC:0~588[26]
2 好氧堆肥降解抗生素的研究概况
2.1 堆体温度
堆体温度是影响好氧堆肥物料中抗生素降解的主要因素。在堆肥的不同温度阶段,抗生素的降解速率不同。潘寻等[28]在水浴装置中利用2 L烧杯模拟实际堆肥,相应堆体最高温度分别为43,54,68 ℃,结果表明:堆体温度显著影响土霉素和金霉素的去除效果,堆肥结束时3个处理组对土霉素的最终去除率分别为83%、96%、96%,对金霉素的最终去除率分别为90%、97%、98%。沈颖等[29]采用正交实验研究了堆肥的温度、初始含水率和高温持续时间等因素对抗生素去除效果的影响,发现土霉素、四环素和金霉素的降解率随着堆体温度的升高而升高,堆体温度是影响土霉素和四环素降解的主要因素。
好氧堆肥通常会使用稻草、木屑以及玉米/小麦秸秆作为辅料,与畜禽粪便、污泥等混合以调节堆体碳氮比,优化堆肥升温过程,进而促进堆肥降解抗生素。Ramaswamy等[30]研究了添加稻草对堆肥去除盐霉素的效果,实验组添加稻草调节碳氮比为25,发现堆体升温较快,高温期持续时间较长,最高温度可达62.8 ℃,而未添加稻草的堆体最高温度仅为41.8 ℃,经过38 d堆肥,实验组堆体内盐霉素的去除率高达99.8%,且盐霉素降解速率更高,半衰期从对照组的4 d缩短为实验组的1.3 d。
2.2 微生物作用
目前,针对好氧堆肥过程中微生物降解抗生素的机理研究较少。Wu等[31]发现:堆体中金霉素、土霉素、四环素在堆肥1周后均能降解70%以上,由于四环素类抗生素的分解温度为170 ℃,而好氧发酵过程中堆体温度在55 ℃以上仅仅维持了5 d,堆体最高温度仅为60 ℃,因此认为堆肥过程中抗生素降解是微生物和高温协同作用的结果。Arikan等[32]试图分别研究微生物和温度对抗生素降解效果的影响,通过对比25 ℃、55 ℃条件下灭菌组和正常组的金霉素降解情况,发现25 ℃条件下灭菌组和正常组中金霉素及其异构体分别降解40%、49%,远小于55 ℃时98%、99%的降解率,同时发现灭菌组和正常组在相同温度下降解效果无明显差异,从而得出金霉素的降解更多依赖于高温而非微生物的结论,但该研究忽视了堆肥过程中微生物对堆体温度升高的促进作用。
2.3 抗生素种类和初始浓度
不同抗生素的降解难度不同,相较于磺胺类和氟喹诺酮类抗生素,四环素类抗生素通常更易在堆肥过程中降解,这可能是由于磺胺类和氟喹诺酮类是人工合成药物,而四环素类是微生物分泌的天然抗菌素,微生物更容易分解利用[33-35]。 Selvam等[36]针对好氧发酵过程中金霉素、环丙沙星的去除开展了研究,结果显示,金霉素在堆体高温阶段的前7 d去除了70%,直至21 d时完全降解,而对于初始浓度为10,1 mg/kg的环丙沙星(Ciprofloxacin),一直到堆肥至56 d仍分别残存31%、17%。孟磊等[37]通过向鸡粪堆体中添加不同浓度的氟喹诺酮类抗生素,发现各处理对氟喹诺酮类抗生素的去除率仅为48.4%~77.1%,未能实现高效去除。高浓度抗生素由于总量更多,对微生物的抑制效果更强,往往去除率更低。Qiu等[38]研究了好氧堆肥对鸡粪和猪粪中不同磺胺类抗生素的降解效果,4种抗生素添加浓度设置为10 mg/kg 和20 mg/kg,经过35 d堆肥,大部分实验组对磺胺甲基嘧啶(Sulfamerazine)、磺胺氯哒嗪(Sulfachlorpyridazine)、磺胺二甲氧嘧啶(Sulfadimoxine)、磺胺喹噁啉(Sulfaquinoxaline)在2种浓度下均能够降解90%以上,且低浓度的抗生素降解率更高,降解速率更快。
2.4 通风方式
良好的通风能够提供好氧发酵过程中微生物所需的氧气,进而调节堆体温度。好氧发酵通风方式包括自然通风、强制通风和翻刨通风,同时使用强制通风和翻刨通风促使抗生素降解的效果最好,自然通风效果最差。Munaretto等[39]比较了强制通风、翻刨通风、强制加翻刨通风和自然堆放的堆肥方式对莫能菌素的去除效果,结果表明:莫能菌素在强制通风、强制加翻刨通风的实验组中去除率分别为35.6%、39.9%,高于翻刨通风和自然堆放的去除率(分别为15.9%和19.8%)。Dolliver等[40]研究了金霉素、泰乐菌素和莫能菌素在自然通风、强制通风和翻刨通风3种通风方式下的去除情况,发现其对金霉素、泰乐菌素和莫能菌素的最终去除率相近,而强制通风和翻刨通风提高了堆体中抗生素的降解速率。
3 抗生素降解的动力学模型
一级动力学模型(式(1))可以较好地描述好氧堆肥过程中抗生素的降解规律,得到其降解半衰期(式(2)),以用于判断降解速度和难度[6,32,36]。Wu等[31]通过简单的一级动力学模型拟合计算得到好氧发酵过程中金霉素、土霉素、四环素3种抗生素的半衰期分别为16.95,2.66,22.36 d,但相关系数R2较低,可能是由于堆肥物料对抗生素的吸附作用导致抗生素提取量比实际残留量低,使得抗生素降解状况与一级动力学模型不吻合。为此,可对一级动力学模型进行矫正(式(3)),矫正后的抗生素降解半衰期见式(5):
C=C0e-kt
(1)
t1/2=ln(2/k)
(2)
C=C0e-kλt
(3)
λ=λ0e-at
(4)
t1/2=-ln(1-a(ln2-lnkλ0))/a
(5)
式中:C为好氧堆肥过程中t时刻测得的抗生素浓度;C0为堆肥物料中抗生素的初始浓度,mg/kg;k为抗生素降解速率常数,d-1;t为堆肥时间;t1/2为抗生素的半衰期;λ为可降解部分和总目标产物的浓度比;λ0为t=0时的λ值;a为可利用系数。
大量学者针对堆肥、土壤和粪便中抗生素的降解曲线进行一级动力学拟合,得到抗生素在3种环境下的降解效率(表3)。总体而言,由于畜禽粪便和土壤中微生物不活跃、温度不高、被土壤颗粒吸附等原因,好氧发酵过程中抗生素的降解速率>>粪便自然堆放和土壤中抗生素的降解速率。肖秋美等[41]发现,环丙沙星在土壤中的降解半衰期为18.3~43.9 d,降解90%所需要的时间则长达260~738 d。许静等[42]研究发现,磺胺嘧啶、磺胺甲恶唑、磺胺二甲嘧啶、磺胺甲基嘧啶和磺胺二甲氧嘧啶在江西红壤中的降解半衰期分别为 110,180,160,62,37.4 d。可见,在畜禽粪便施用于土地之前,使用堆肥技术可有效降解抗生素,减少抗生素对环境污染。
4 抗生素的检测
常用抗生素检测方法包括微生物法、酶联免疫法、高效毛细管电泳法、色谱法等,各自均有不同的优缺点和适用范围。微生物法操作简单,检测速度快,但是通常仅用于定性检测,不能定量[46-47]。酶联免疫法精度和灵敏度高,但是操作复杂,检测成本高,且容易受到杂质干扰[48-49]。高效毛细管电泳法的样品前处理简单,分离速度快,但是灵敏度不高,主要适用于牛奶、蜂蜜等液态食品[50-51]。色谱法可检测的样品种类丰富,且精度和灵敏度高,但是样品前处理过程烦琐,操作复杂,对设备要求较高[52-53]。目前,土
表2 抗生素在堆肥、粪便和土壤中的降解半衰期
Table 2 The half-life periods of antibiotics in composting,
manure and soil
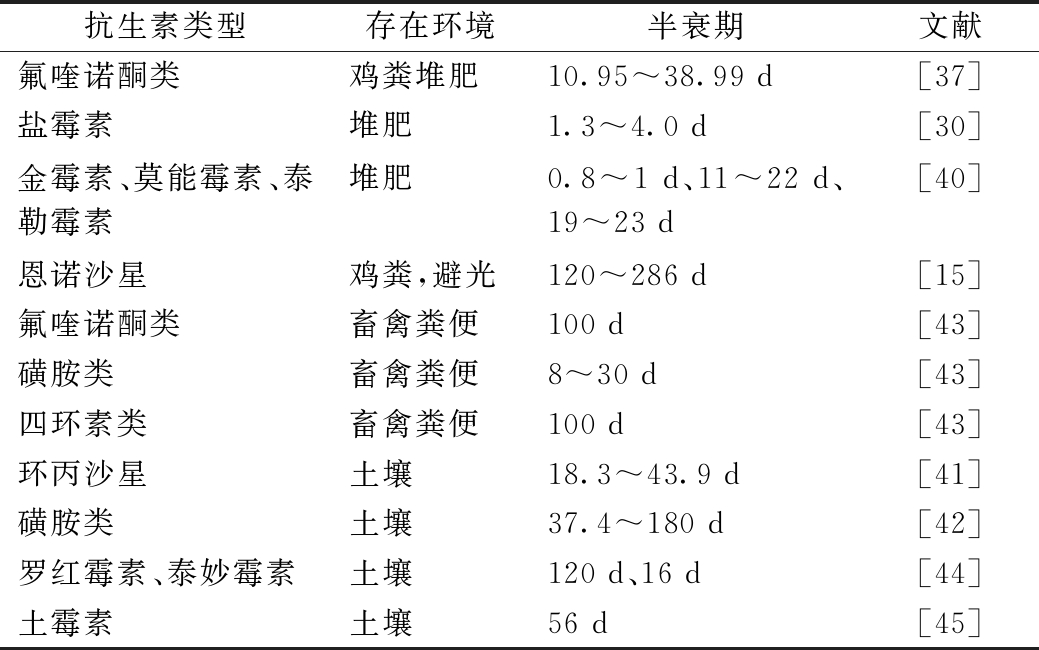
抗生素类型存在环境半衰期文献氟喹诺酮类鸡粪堆肥10.95~38.99 d[37]盐霉素堆肥1.3~4.0 d[30]金霉素、莫能霉素、泰勒霉素堆肥0.8~1 d、11~22 d、19~23 d[40]恩诺沙星鸡粪,避光120~286 d[15]氟喹诺酮类畜禽粪便100 d[43]磺胺类畜禽粪便8~30 d[43]四环素类畜禽粪便100 d[43]环丙沙星土壤18.3~43.9 d[41]磺胺类土壤37.4~180 d[42]罗红霉素、泰妙霉素土壤120 d、16 d[44]土霉素土壤56 d[45]
壤、畜禽粪便和堆肥样品中抗生素的检测普遍采用固相萃取-高效液相色谱法(solid phase extraction and high performance liquid chromatography,SPE-HPLC)。流程如图1所示。样品在冷冻干燥后使用缓冲溶液提取,然后通过萃取柱富集、浓缩、除杂,并使用甲醇或二氯甲烷洗脱,再进行高效液相色谱仪检测,通常以乙腈为流动相中的有机相,草酸或乙酸为流动相中的水相。检测结果通过外标法使用不同浓度的抗生素标准溶液进行标定,并且需要内标法反复试验,确定在提取过程中抗生素的损失,计算得回收率[54-56]。
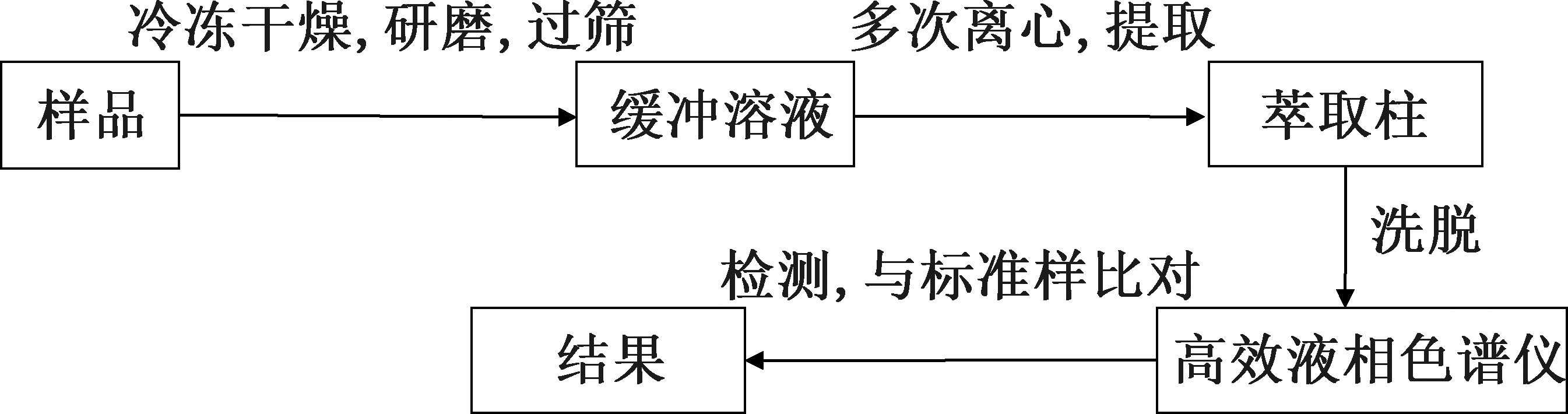
图1 固相萃取-高效液相色谱检测抗生素流程
Fig.1 Progress of antibiotics determination by solid phase extraction and HPLC
固态样品中抗生素的提取过程非常复杂,使用SPE-HPLC检测抗生素浓度时,采取不同的试剂进行洗脱和溶解提取效果不同。通常使用甲醇和乙酸乙酯配制的溶液洗脱最好[54-59]。Wu等[54]将0.1 mol/L柠檬酸溶液与0.2 mol/L磷酸氢二钠溶液混合,加入0.1 mol/L乙二胺四乙酸二钠盐(Na2EDTA),配制了Na2EDTA-McIlvaine溶液,每克样品加入10 mL Na2EDTA-McIlvaine缓冲液和5 mL乙腈,重复浸提3次,取上清液在真空条件下蒸发浓缩至10 mL,再加入超纯水稀释至100mL;固相萃取柱使用5 mL甲醇和5 mL Na2EDTA-McIlvaine缓冲液调节,再加入样品提取液过滤,一次用超纯水和5%甲醇冲洗,最后使用甲醇/乙酸乙酯溶液(体积比为1∶9)洗脱。洗脱液由氮气流风干,溶于0.1%甲酸/乙腈溶液(体积比为1∶9),通过0.22 μm尼龙膜过滤,再通过UPLC-MS/MS测定抗生素含量,该方法对四环素类抗生素的提取率为66%~94%(表3)。
表3 固相萃取-高效液相色谱法检测抗生素的不同处理
Table 3 Different treatment of antibiotics determination by solid phase extraction and HPLC

抗生素种类缓冲溶液萃取柱型号洗脱液流动相水相有机相提取率文献四环素类Na2EDTA-McIlvaine、乙腈Oasis HLB甲醇、乙酸乙酯甲酸乙腈66%~94%[54]四环素、青霉素G等Na2EDTA-McIlvaineStrata SDB-L甲醇、乙腈、乙酸乙酯甲酸乙腈63.1%~93.4%[55]四环素类Na2EDTA-McIlvaine、乙腈Oasis HLB甲醇、乙酸乙酯甲酸乙腈66%~94%[56]红霉素、环丙沙星等Na2EDTA-McIlvaine、甲醇LC-SAX、LC~18甲醇磷酸乙腈63%~95.4%[57]四环素类Na2EDTA-McIlvaineHLB甲醇、乙酸乙酯磷酸二氢钠乙腈89.7%~96.8%[58]磺胺类甲醇、柠檬酸HLB甲醇、二氯甲烷醋酸铵乙腈82.5%~90.5%[59]
5 总结和展望
抗生素降解途径包括微生物降解、氧化降解、水解、光降解等,降解过程非常复杂。好氧发酵技术具备资源化利用畜禽粪便、降解抗生素的优势,但好氧发酵过程中抗生素的降解效果受堆体温度、微生物活性、抗生素种类和初始浓度、通风方式等因素的影响,并不能高效完全去除抗生素,且好氧堆肥过程中抗生素的降解机理尚不清楚,相关研究尚需深入开展。
1) 利用微生物降解抗生素具有环保、廉价和操作方便等优点,应深入研究好氧发酵过程的微生物群落变化及其对抗生素的降解机理,筛选培育出高效降解抗生素的真菌或放线菌等功能菌种,提高好氧发酵过程抗生素降解效率。
2) 好氧发酵过程中影响抗生素降解效率的因素较多,应深入研究好氧发酵过程中抗生素的降解机理,优化好氧发酵工艺参数,实现抗生素降解效率最大化。
3) 目前更多的研究关注抗生素母体的降解,而忽视了抗生素降解产物的毒性和抗性诱导能力。为真正实现畜禽粪便中抗生素的高效降解,需要深入研究好氧发酵过程中抗生素降解产物及其环境效应。
4) 目前抗生素检测存在步骤烦琐、成本高昂等缺点,严重阻碍了抗生素去除工艺技术研发进度,故开发简单易行、经济实用的抗生素检测方法,满足快速、大样本量的抗生素检测要求,将有利于好氧发酵降解抗生素的技术研发,推动畜禽粪便资源化利用。
[1] Min Q, Guang G Y, Andrew C S, et al. Review of antibiotic resistance in China and its environment[J]. Environment International, 2018,110:160-172.
[2] 朱宁,马骥.中国畜禽粪便产生量的变动特征及未来发展展望[J].农业展望,2014(1):46-48.
[3] Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11):6772-6782.
[4] 梁忠. 中国抗生素52%为兽用[J]. 中国禽业导刊, 2015(12):75.
[5] Doretto K M, Rath S. Sorption of sulfadiazine on Brazilian soils[J]. Chemosphere, 2013, 90(6):2027-2034.
[6] 吴银宝, 汪植三, 廖新俤,等. 土壤对恩诺沙星的吸附和解吸特性研究[J]. 生态环境学报, 2005, 14(5):645-649.
[7] 刘伟, 王慧, 陈小军,等. 抗生素在环境中降解的研究进展[J]. 动物医学进展, 2009, 30(3):89-94.
[8] O′Brien, T F. Emergence, spread, and environmental effect of antimicrobial resistance: how use of an antimicrobial anywhere can increase resistance to any antimicrobial anywhere else. Clin. Infect. Dis,2002,34(Suppl. 3): S78-S84.
[9] Tasho R P, Cho J Y. Veterinary antibiotics in animal waste, its distribution in soil and uptake by plants: a review[J]. Science of the Total Environment, 2016, 563/564:366-376.
[10] Zhang H, Deng X, Miki D, et al. Sulfamethazine suppresses epigenetic silencing in Arabidopsis by impairing folate synthesis[J]. Plant Cell, 2012, 24(3):1230-1241.
[11] Boxall A B, Johnson P, Smith E J, et al. Uptake of veterinary medicines from soils into plants[J]. Journal of Agricultural & Food Chemistry, 2006, 54(6):2288-2297.
[12] 张海滨, 孟海波, 沈玉君,等. 好氧堆肥微生物研究进展[J]. 中国农业科技导报, 2017, 19(3):1-8.
[13] Wang J, Ben W, Zhang Y, et al. Effects of thermophilic composting on oxytetracycline, sulfamethazine, and their corresponding resistance genes in swine manure[J]. Environmental Science. Processes & Impacts, 2015, 17(9):1654-1660.
[14] 魏建英, 张然, 丁胜,等. 抗生素类饲料添加剂在畜牧业中的使用[J]. 内蒙古农业科技, 2004(4):52-53.
[15] Kumar K, Thompson A, Singh A K, et al. Enzyme-linked immunosorbent assay for ultratrace determination of antibiotics in aqueous samples[J]. Journal of Environmental Quality, 2004, 33(1):250-256.
[16] 吴银宝, 汪植三, 廖新俤,等. 恩诺沙星在鸡体中的排泄及其在鸡粪中的降解[J]. 畜牧兽医学报, 2005, 36(10):1069-1074.
[17] 王惠惠, 王淑平. 畜禽排泄物中抗生素残留与控制技术研究进展[J]. 土壤通报, 2011, 42(1):250-256.
[18] 王瑞, 魏源送. 畜禽粪便中残留四环素类抗生素和重金属的污染特征及其控制[J]. 农业环境科学学报, 2013, 32(9):1705-1719.
[19] Zhou L J, Ying G G, Liu S, et al. Excretion masses and environmental occurrence of antibiotics in typical swine and dairy cattle farms in China[J]. Science of the Total Environment, 2013, 444(2):183-195.
[20] 张树清, 张夫道, 刘秀梅,等. 规模化养殖畜禽粪主要有害成分测定分析研究[J]. 植物营养与肥料学报, 2005, 11(6):822.
[21] Ling Z, Dong Y H, Hui W. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J]. Science of the Total Environment, 2010, 408(5):1069-1075.
[22] Pan X, Qiang Z, Ben W, et al. Residual veterinary antibiotics in swine manure from concentrated animal feeding operations in Shandong Province, China[J]. Chemosphere, 2011, 84(5):695-700.
[23] Zhang H, Luo Y, Wu L, et al. Residues and potential ecological risks of veterinary antibiotics in manures and composts associated with protected vegetable farming[J]. Environmental Science & Pollution Research, 2015, 22(8):5908-5918.
[24] 陈昦, 董元华, 王辉,等. 江苏省畜禽粪便中磺胺类药物残留特征[J]. 农业环境科学学报, 2008, 27(1):385-389.
[25] 李彦文, 莫测辉, 赵娜,等. 菜地土壤中磺胺类和四环素类抗生素污染特征研究[J]. 环境科学, 2009, 30(6):1762-1766.
[26] 张慧敏, 章明奎, 顾国平. 浙北地区畜禽粪便和农田土壤中四环素类抗生素残留[J]. 生态与农村环境学报, 2008, 24(3):69-73.
[27] 张俊,杨晓洪,葛峰,等. 长期施用四环素残留猪粪对土壤中耐药菌及抗性基因形成的影响 [J]. 环境科学,2014(6): 2374-2380.
[28] 潘寻, 强志民, 贲伟伟. 高温堆肥对猪粪中多类抗生素的去除效果[J]. 生态与农村环境学报, 2013, 29(1):64-69.
[29] 沈颖, 魏源送, 郑嘉熹,等. 猪粪中四环素类抗生素残留物的生物降解[J]. 过程工程学报, 2009, 9(5):962-968.
[30] Ramaswamy J, Prasher S O, Patel R M, et al. The effect of composting on the degradation of a veterinary pharmaceutical[J]. Bioresource Technology, 2010, 101(7):2294-2299.
[31] Wu X, Wei Y, Zheng J, et al. The behavior of tetracyclines and their degradation products during swine manure composting[J]. Bioresource Technology, 2011, 102(10):5924-5931.
[32] Arikan O A, Mulbry W, Rice C. Management of antibiotic residues from agricultural sources: use of composting to reduce chlortetracycline residues in beef manure from treated animals[J]. Journal of Hazardous Materials, 2009, 164(2/3):483-489.
[33] 李伟明, 鲍艳宇, 周启星. 四环素类抗生素降解途径及其主要降解产物研究进展[J]. 应用生态学报, 2012, 23(8):2300-2308.
[34] 许静, 王娜, 孔德洋,等. 磺胺类药物在土壤中的降解性[J]. 环境化学, 2013(12):2349-2356.
[35] 管荷兰, 于海凤, 王嘉宇. 氟喹诺酮类抗生素在土壤中的归趋及其生态毒性研究进展[J]. 生态学杂志, 2012, 31(12):3228-3234.
[36] Selvam A, Zhao Z, Wong J W C. Composting of swine manure spiked with sulfadiazine, chlortetracycline and ciprofloxacin[J]. Bioresource Technology, 2012, 126(12):412-417.
[37] 孟磊, 杨兵, 薛南冬,等. 高温堆肥对鸡粪中氟喹诺酮类抗生素的去除[J]. 农业环境科学学报, 2015, 34(2):377-383.
[38] Qiu J, He J, Liu Q, et al. Effects of Conditioners on Sulfonamides Degradation during the Aerobic Composting of Animal Manures[J]. Procedia Environmental Sciences, 2012, 16(16):17-24.
[39] Munaretto J S, Yonkos L, Aga D S. Transformation of ionophore antimicrobials in poultry litter during pilot-scale composting[J]. Environmental Pollution, 2016, 212:392-400.
[40] Dolliver H, Gupta S, Noll S. Antibiotic degradation during manure composting[J]. Journal of Environmental Quality, 2008, 37(3):1245-1253.
[41] 肖秋美,王建武,唐艺玲. 土壤-蔬菜系统中环丙沙星的降解与生物累积特征[J]. 应用生态学报, 2012, 23(10):2708-2714.
[42] 许静, 王娜, 孔德洋,等. 有机肥源磺胺类抗生素在土壤中的降解规律及影响因素分析[J]. 环境科学学报, 2015, 35(2):550-556.
[43] Boxall A B A, Fogg L A, Blackwell P A, et al. Veterinary Medicines in the Environment[M]//Reviews of Environmental Contamination and Toxicology. Springer New York, 2004:1-91.
[44] Schlüsener M P, Bester K. Persistence of antibiotics such as macrolides, tiamulin and salinomycin in soil[J]. Environmental Pollution, 2006, 143(3):565-571.
[45] Wang Q, Yates S R. Laboratory study of oxytetracycline degradation kinetics in animal manure and soil[J]. Journal of Agricultural & Food Chemistry, 2008, 56(5):1683-1688.
[46] 丁志刚, 王静, 高红梅. 抗生素残留检测技术的研究进展[J]. 食品与发酵工业, 2005, 31(6):112-116.
[47] 翟云忠, 吴建敏, 徐俊,等. 鸡蛋中抗生素残留微生物法快速检测的研究[J]. 现代食品科技, 2008, 24(8):839-841.
[48] 邵辉, 吴瑕, 王剑飞,等. 酶联免疫法与乳及乳制品中抗生素残留的检测[J]. 中国乳品工业, 2011, 39(6):58-59.
[49] 姜侃, 陈宇鹏, 金燕飞,等. 应用酶联免疫法快速检测乳品中β-内酰胺类抗生素残留[J]. 中国乳品工业, 2010, 38(1):51-54.
[50] 梁佳, 张琳婧, 卢日刚. 高效毛细管电泳法测定牛奶中四环素类抗生素含量[J]. 广西科学院学报, 2010, 26(3):309-311.
[51] 李爱梅, 黄茁, 卢文平,等. 毛细管电泳法测定水体中四环素类抗生素的基质效应及场放大进样技术的应用[J]. 色谱, 2014, 32(8):897-903.
[52] 李瑞萍, 张艺, 黄应平. 环境样品中四环素类抗生素的检测技术[J]. 化学进展, 2008, 20(12):2075-2082.
[53] 李艳霞, 李帷, 张雪莲,等. 固相萃取-高效液相色谱法同时检测畜禽粪便中14种兽药抗生素[J]. 分析化学, 2012, 40(2):213-217.
[54] 夏天骄,夏训峰,徐东耀,等. 基于固相萃取-高效液相色谱法的畜禽粪便中四环素类抗生素残留量检测[J]. 安全与环境学报,2013(4):121-125.
[55] 史丽, 李昌伟, 赵鲁,等. 高效液相色谱-串联质谱同时测定有机肥料中9种抗生素药物残留[J]. 中国土壤与肥料, 2014(6):111-115.
[56] 吴晓凤, 郑嘉熹, 魏源送,等. 超高效液相色谱串联质谱法同时检测复杂基质中四环素类抗生素及其代谢产物[J]. 农业环境科学学报, 2013, 32(11):2293-2301.
[57] Lu X M, Li W F, Li C B. Characterization and quantification of antibiotic resistance genes in manure of piglets and adult pigs fed on different diets[J]. Environmental Pollution, 2017, 229:102-110.
[58] Wu X, Wei Y, Zheng J, et al. The behavior of tetracyclines and their degradation products during swine manure composting[J]. Bioresource Technology, 2011, 102(10):5924-5931.
[59] Liu B, Li Y, Zhang X, et al. Effects of composting process on the dissipation of extractable sulfonamides in swine manure[J]. Bioresource Technology, 2015, 175:284-290.