燃煤电厂CO2排放是导致温室效应的主要原因之一。近年来,富氧燃烧技术又称空气分离/烟气再循环燃烧技术,被认为是最具有发展前景的直接减排燃煤CO2的技术之一[1]。煤粉富氧燃烧技术可以有效降低单位质量燃料的NOx和SOx的排放量[2-3],并使烟气中的CO2浓度达到90%以上[4],但是烟气中的NOx和SOx浓度值较高,甚至高于空气燃烧排放值[5-6]。如果烟气中杂质气体未进行脱除,会对后续CO2的运输和埋存或者资源化利用有不利影响。因此,富氧燃烧烟气的净化十分重要。
在CO2压缩过程中,高压和低温的条件可以促进烟气中的NOx和SOx转化为硝酸和硫酸,从而使CO2气体得到纯化[7-8]。针对在CO2压缩过程中同时脱硫脱硝的问题,国内外研究者已经开展了大量的实验研究。阎维平等[4,9]对脱硫脱硝过程进行实验研究,结果表明:NO的转化率随压力的升高而增加,当压力达到2 MPa以上时,90%以上的NO均会转化为稀硝酸,烟气中初始NO浓度越高,NO的转化率越大,并且SO2和NO一体化脱除实验研究发现,只有少量的NO转化为稀硝酸,SO2先发生反应,NO起催化作用;国外学者的研究表明,提高压力、降低温度和合适的停留时间会促进NO和SO2分别转化为硝酸和硫酸[10-12]。
而针对高压下同时脱硫脱硝过程的模拟研究相对较少[13]。模拟研究发现,SO2和NO联合吸收过程主要生成硫酸和硝酸[14];pH对整个吸收过程有决定性作用;并且还会有大量N2O生成[15]。现有模拟研究主要关注HNO2、HNO3、H2SO3和H2SO4等成分的动态变化,但缺少对高压下SO2和NO单独吸收到水中的动态过程、NOx和SOx相互作用对SO2和NO吸收效率的影响,以及压力对NOx和SOx相互作用影响的研究。本文通过建立传质耦合化学反应的数学模型,揭示NOx和SOx相互作用机制,并探讨该作用机制对吸收过程的影响,为富氧燃烧高压联合脱硫脱硝技术的应用提供参考。
本文采用前项差分法和龙格-库塔迭代法求解一维非稳态方程组,为保证计算精度,并使反应模型接近实际过程,计算的时间步长设置为10-5 s,整个反应器离散为N个完全混合的间歇式反应器。不同压力所对应的SO2传质系数、气泡直径、反应区2的气液相体积和气液接触表面积,由文献中经验公式[16-18]获得。图1为高压鼓泡反应装置及相应的物理模型。
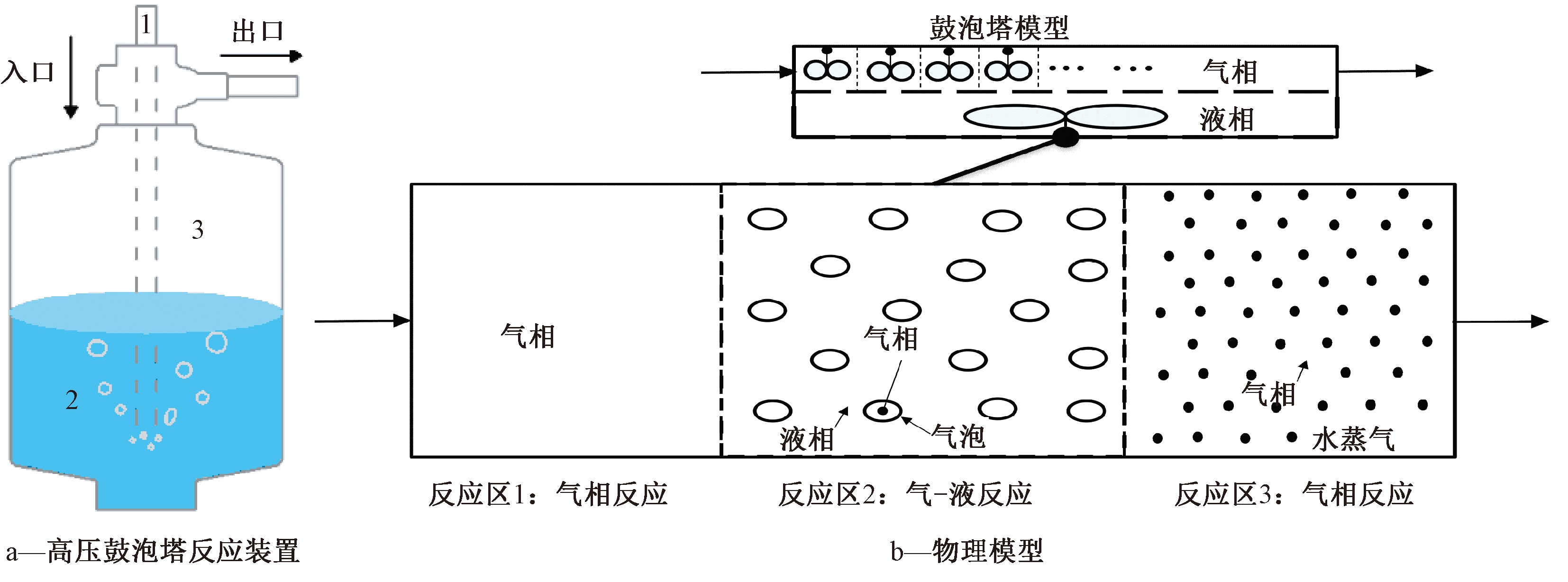
图1 高压鼓泡反应装置和物理模型
Fig.1 High pressure bubbling reaction device and its physical model
由图1可知:模拟烟气从高压鼓泡反应器的入口进入,依次经过反应区1、2和3,最后从出口排出。高压鼓泡反应器模型由3个反应区组成:反应区1为气相反应区(无水蒸气);反应区2为气-液反应区(有水蒸气);反应区3为气相反应区(有水蒸气)。结合前人研究[14-15],反应区2的气相假设为柱塞流反应区,其中气相区划分为N个(网格数)均等的气相区,液相为完全预混反应区。气相区的基本方程为式(1),液相区的基本方程为式(2)。
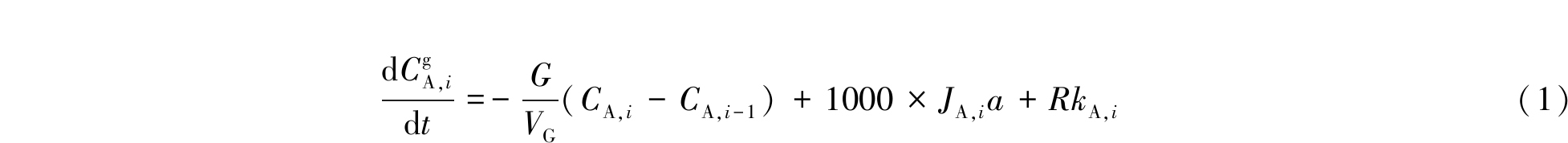
![]()
式中:C为浓度;mol/L;t为时间,s;G为体积流量,m3/s;VG为气相区体积,m3;a为比表面积,m-1;J为传质通量,mol/(m2·s);Rk为化学反应速率,mol/(L·s);A为气相成分;B为液相成分;N为气相反应区的网格个数;g为气相;l为液相。
本模型中所涉及的化学反应、动力学及平衡常数见表1。在气相反应区,NO首先被O2氧化生成NO2[19-20](R1),并且其速率随压力的增加和温度的降低而明显加快。在气相反应区,NO和NO2进一步与H2O发生反应生成HNO2(R2);在液相反应区,溶解到水中的NO2会与H2O反应生成HNO2和HNO3(R3),并且不稳定的HNO2会进一步分解成HNO3和NO(R4)。
表1 联合吸收过程中所涉及的化学反应和动力学表达式
Table 1 Chemical reactions and kinetic expressions in the simultaneous absorption process

反应方程式动力学速率表达式/(mol·m-3·s-1)参考文献R12NO+O2↔2NO2r1=1.197×103e(530.4/T)×C2NO×CO2[28]R2NO+NO2+H2O→2HNO2r2=1.6×10-4CNO×CNO2×CH2O-C2HNO2k2();k2=275[15]R32NO2+H2O→HNO2+HNO3r3=2.52×108e(-5830/T)×C2NO2×CH2O[29]R43HNO2→HNO3+2NO+H2Or4=13×10.267×10(-6200T+20.1978)×C4HNO2·H2NOC2NO[29]R5、R6SO2+H2O↔HSO-3+H+HSO-3↔H++SO2-3r5=kinst(CSO2-CHSO-3×CH+/k5)k5=CHSO-3×CH+CSO2e(26404.29/T)+160.3981ln(T)-0.275224×T-924.6255103r6=kinst(CHSO-3-CSO2-3×CH+/k6);k6=6.724×10-5kinst=106(用于瞬时反应)[29,22]R72SO2-3+O2→2SO2-4r7=1.2×10-4×C-0.16H+×CSO2-3[30]R82HSO-3+O2→2SO2-4+2H+r8=8.4×10-5/60×C2HSO-3[30]R9、R102NO2+HSO-3+H2O→SO2-4+3H++2NO-22NO2+SO2-3+H2O→SO2-4+2H++2NO-2pH<5,r9+r10=0;pH>5;r9+r10=kpH×CNO2(CHSO-3+CSO2-3)[31]R11HSO-4↔SO2-4+H+r11=kinst(CHSO-4-CSO2-4×CH+/k11);k11=12[32]R12HNO2+HSO-3→NOSO-3+H2Or12=2.4×CHNO2×CHSO-3[32]R13NOSO-3+H+(H2O)→HNO+HSO-4+H+r13=50×CNSS×CH+[32]R14NOSO-3+HSO-3→HNO(SO3)2-2r14=85×CNSS×CHSO-3[32]R15HNO+HNO→N2O+H2Or15=5×109×C2HNO[27]R16HNO(SO3)2-2+H2O→HNOHSO-3+HSO-4r16=1.9×10-2×CHADS×CH+[32]
SO2与H2O发生水解反应生成![]() 一部分
一部分![]() 会进一步电离成
会进一步电离成![]() 和
和![]() 可能被溶解于水中的O2和NO2氧化生成稳定的H2SO4(R9—R10)[24-25],液相中
可能被溶解于水中的O2和NO2氧化生成稳定的H2SO4(R9—R10)[24-25],液相中![]() 会部分电离成
会部分电离成![]() 在液相反应区,H2SO3还会与HNO2生成重要的中间氮硫产物,例如
在液相反应区,H2SO3还会与HNO2生成重要的中间氮硫产物,例如![]() 和
和![]() 的生成是通过反应(R12),并且NSS进一步水解生成H2SO4和HNO(R13),HNO会进一步发生反应生成稳定的温室气体N2O(R15)[27]。而HADS的生成是由于反应(R14),其水解反应产物为HAMS和H2SO4(R16)[26]。
的生成是通过反应(R12),并且NSS进一步水解生成H2SO4和HNO(R13),HNO会进一步发生反应生成稳定的温室气体N2O(R15)[27]。而HADS的生成是由于反应(R14),其水解反应产物为HAMS和H2SO4(R16)[26]。
图2为经不同数量完全混合的间歇式反应器吸收后出口气相中的SO2浓度变化的模拟与实验结果的对比。可知:当N=5时,其模拟与实验结果相差比较大,而随着N增加,模拟结果与实验结果更接近,这说明模拟结果的精确性与N有很大关系。当N>25后,N对水吸收SO2的影响不明显,这说明N达到一定数量后,就可以保证模拟过程所使用的反应模型接近实际的反应器。
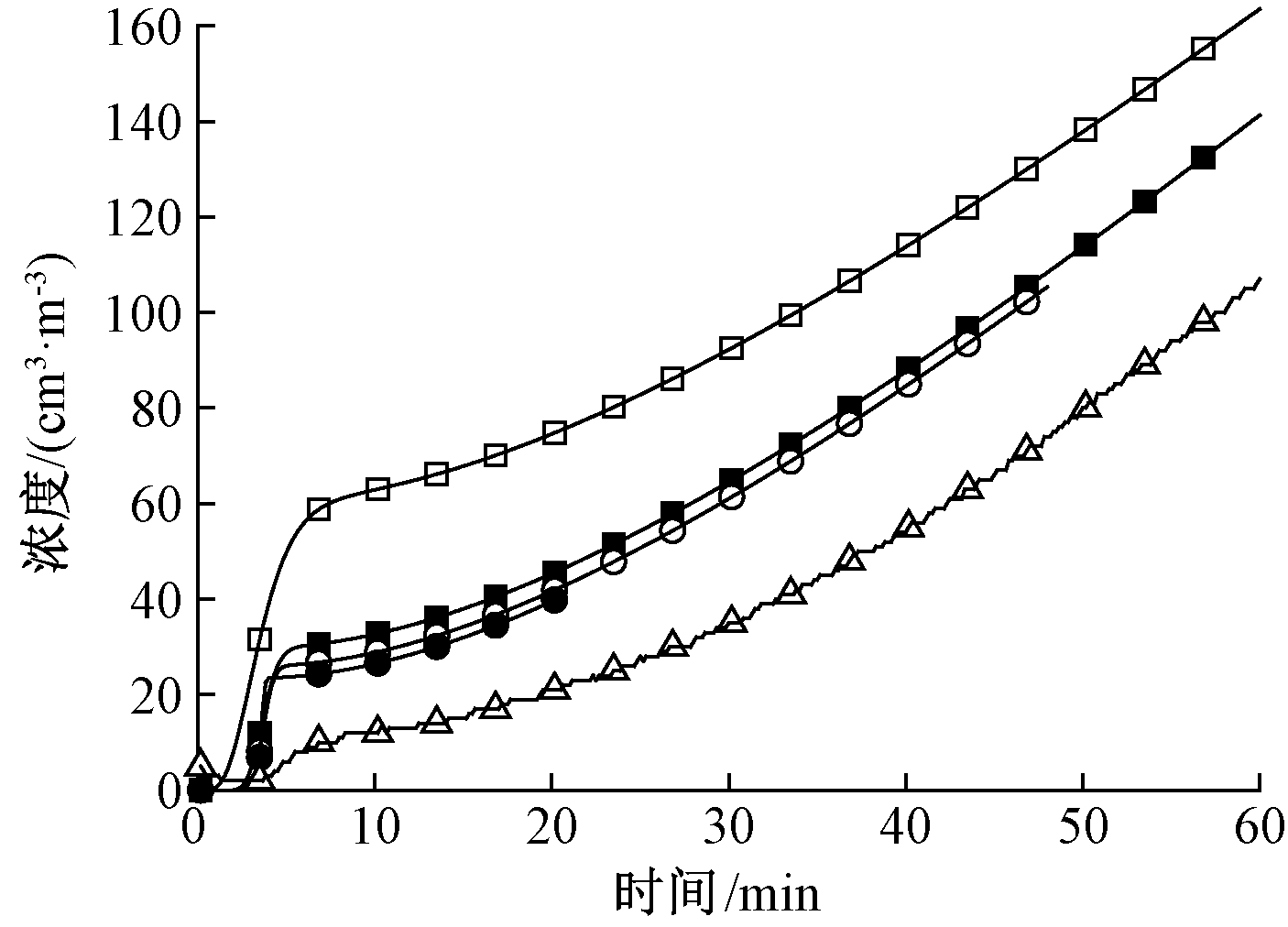
注:压力为1.5 MPa; φ(SO2)为994 cm3/m3,5% O2;水量为
0.5 L;气体流速为2 L/min。![]() —N=5;
—N=5; ![]() —N=25;
—N=25; ![]() —N=60;
—N=60; ![]() —N=600;
—N=600; ![]() —实验。
—实验。
图2 吸收到水中的SO2浓度变化模拟和实验对比
Fig.2 Comparison of the modeling and experimental results on SO2 concentration absorbed into water
图3为不同浓度的SO2吸收到水中的浓度变化的模拟与实验结果对比,其模拟结果和实验结果吻合度高,特别是当SO2的浓度为1500 cm3/m3时,其模拟结果与实验结果基本一致。由图3可知:出口气相中的SO2浓度随着SO2进口浓度的增加和吸收时间的推移而增加,这是因为SO2在水中的溶解度有限,随着水中溶解的SO2越接近其饱和溶解度,水吸收SO2的速率越来越小[33]。
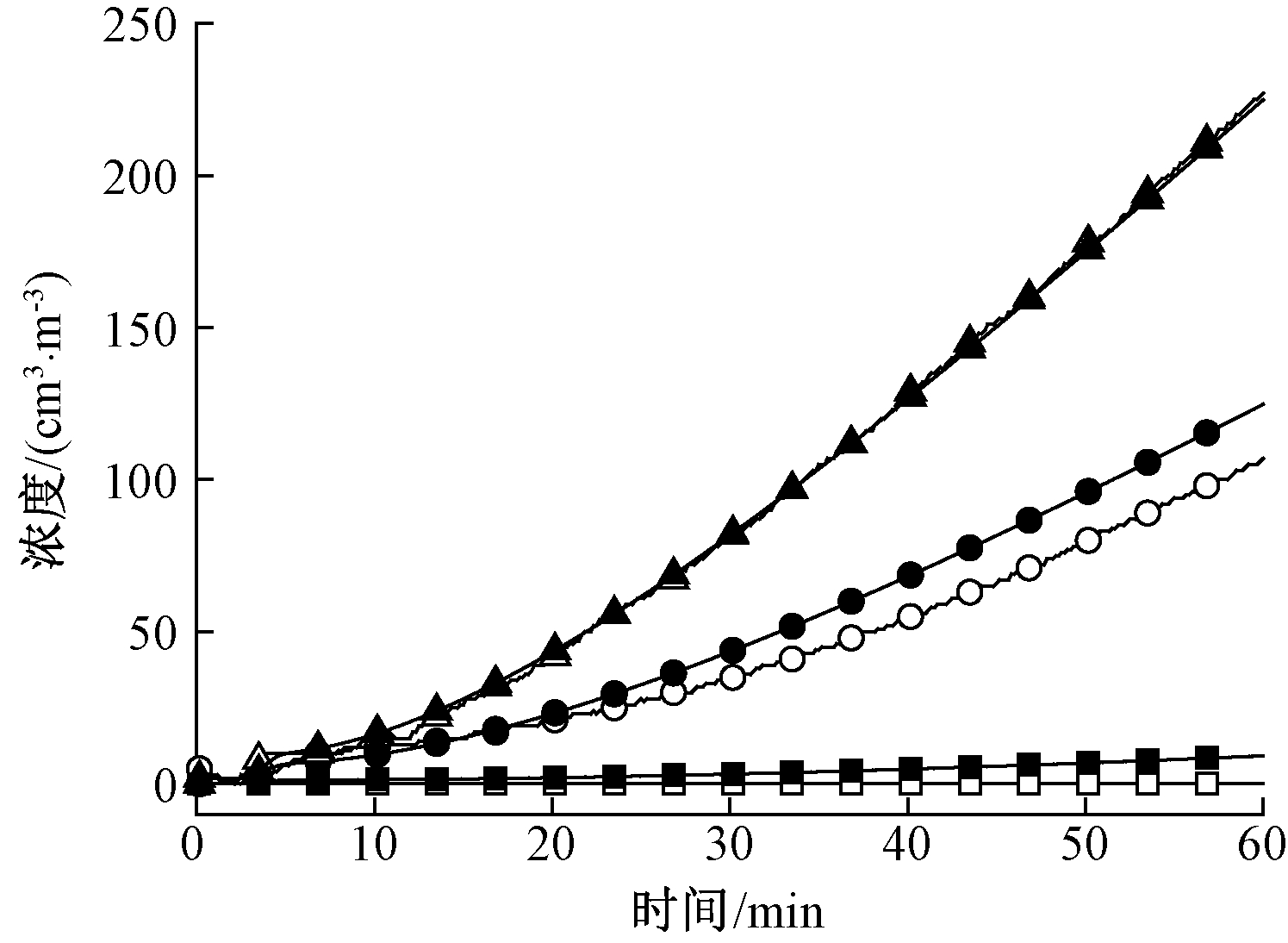
注:N=25;压力为1.5 MPa;φ(SO2)为199,994,1500 cm3/m3;5% O2;水量为0.5 L;气体流速为2 L/min。![]() —199-实验;
—199-实验; ![]() —199-模拟;
—199-模拟; ![]() —994-实验;
—994-实验; ![]() —994-模拟;
—994-模拟; ![]() —1500-实验;
—1500-实验; ![]() —1500-模拟。
—1500-模拟。
图3 不同浓度的SO2吸收到水中的浓度变化模拟和实验对比
Fig.3 Comparison of the modeling and experimental results of SO2
absorbed into water with different initial SO2 concentrations
通过进出口氮(或硫)元素的平衡计算,可以验证模拟本身的准确性。计算结果的准确度定义为:气体进口氮(或硫)相关成分的物质的量与气体出口和滞留在反应器中氮(或硫)相关成分物质的量之和的比值。通过计算,硫和氮元素在不同压力下的准确度均>99.0%。因此,计算结果是可靠的。
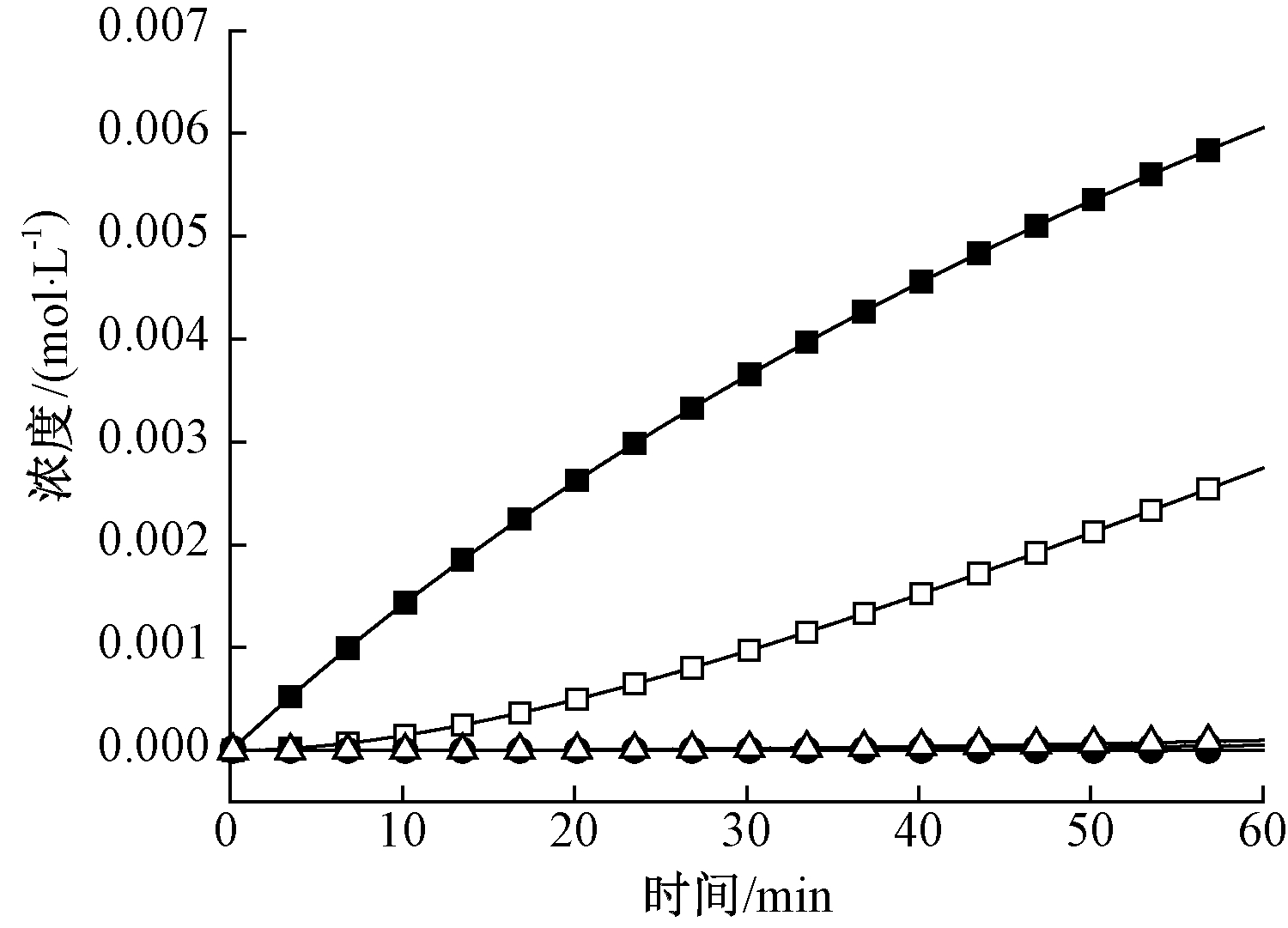
图4为SO2吸收到水中的液相产物变化。可知:液相中S(Ⅳ)主要以![]() 形式存在,而基本不存在
形式存在,而基本不存在![]() 和
和![]() 而其他研究结果显示,
而其他研究结果显示,![]() 也是主要产物[1],并占总硫的30%左右,这可能是由于在实验结束后,在吸收液的储存和检测过程中,溶液中的
也是主要产物[1],并占总硫的30%左右,这可能是由于在实验结束后,在吸收液的储存和检测过程中,溶液中的![]() 被氧化为H2SO4。
被氧化为H2SO4。
注:N=25;压力为1.5 MPa;φ(SO2)为994 cm3/m3,5% O2;水量为0.5 L;气体流速为2 L/min。![]()
![]()
图4 SO2吸收到水中的液相产物变化
Fig.4 Liquid composition changes for SO2 absorbed into water
溶液中的![]() 和SO2之间存在平衡。在初始阶段,溶液中的
和SO2之间存在平衡。在初始阶段,溶液中的![]() 浓度为0,所以SO2在初始阶段被迅速吸收;而随着水吸收SO2量的逐渐增加,溶液中的
浓度为0,所以SO2在初始阶段被迅速吸收;而随着水吸收SO2量的逐渐增加,溶液中的![]() 与H+浓度不断增加,导致反应(R5)的反应速率下降。
与H+浓度不断增加,导致反应(R5)的反应速率下降。
图5为NO吸收到水中的气液相产物变化的模拟结果。由图5a可知:当压力为1.5 MPa时,NO能被氧化为易溶于水的NO2[14],且随着时间的推移,出口气相中的NO2浓度逐渐增加,这是因为溶液中积累的HNO2分解的产物NO释放到气相中并迅速被氧化为NO2,从而导致出口气相中的NO2浓度增加[15]。由图5b可知:溶液中的![]() 浓度在初始阶段迅速上升,随后下降,而HNO2和
浓度在初始阶段迅速上升,随后下降,而HNO2和![]() 的浓度不断增加。溶液中的HNO2与其电离产物(H+和
的浓度不断增加。溶液中的HNO2与其电离产物(H+和![]() 之间存在平衡,随着反应的进行,H+浓度增加,导致HNO2的电离速率减小,使得溶液中的HNO2浓度增加,
之间存在平衡,随着反应的进行,H+浓度增加,导致HNO2的电离速率减小,使得溶液中的HNO2浓度增加,![]() 浓度下降。溶液中的
浓度下降。溶液中的![]() 浓度不断增加来自于HNO2分解产生HNO3,以及NO2与H2O反应生成HNO3,进而电离成
浓度不断增加来自于HNO2分解产生HNO3,以及NO2与H2O反应生成HNO3,进而电离成![]()
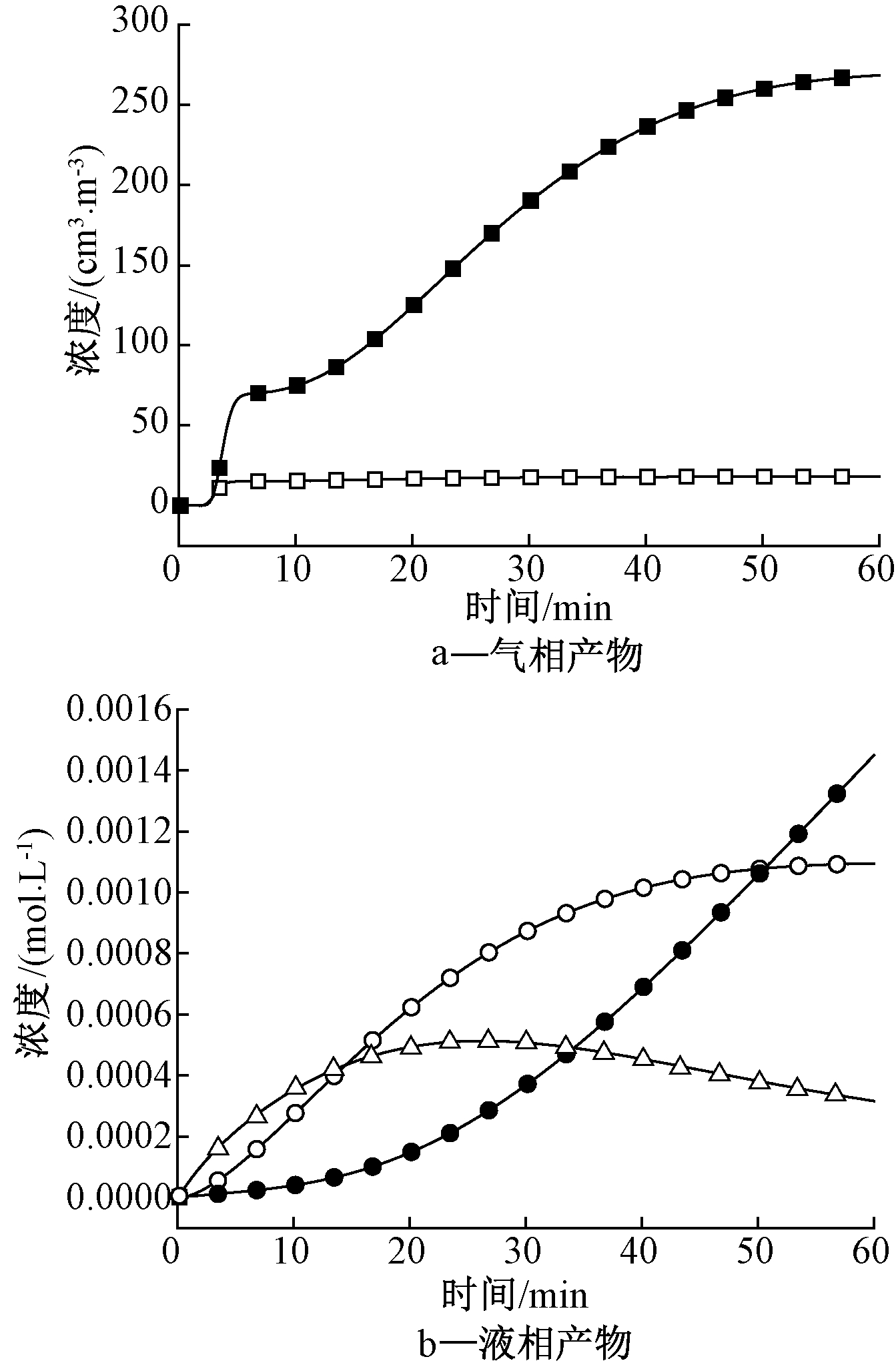
注:N=25;压力为1.5 MPa;NO浓度为450 cm3/m3,
5% O2;水量为0.5 L;气体流速为2 L/min。![]()
图5 NO吸收到水中的气液相产物变化的模拟
Fig.5 Dynamic gas and liquid composition change for NO absorbed into water
图6为SO2和NO联合吸收到水中的气液相产物变化。由图6a可知:SO2和NO单独吸收溶液的pH值均高于SO2和NO联合吸收溶液。联合吸收过程中,溶液的pH值迅速从7降到5以下,结束时溶液的pH值约为2。
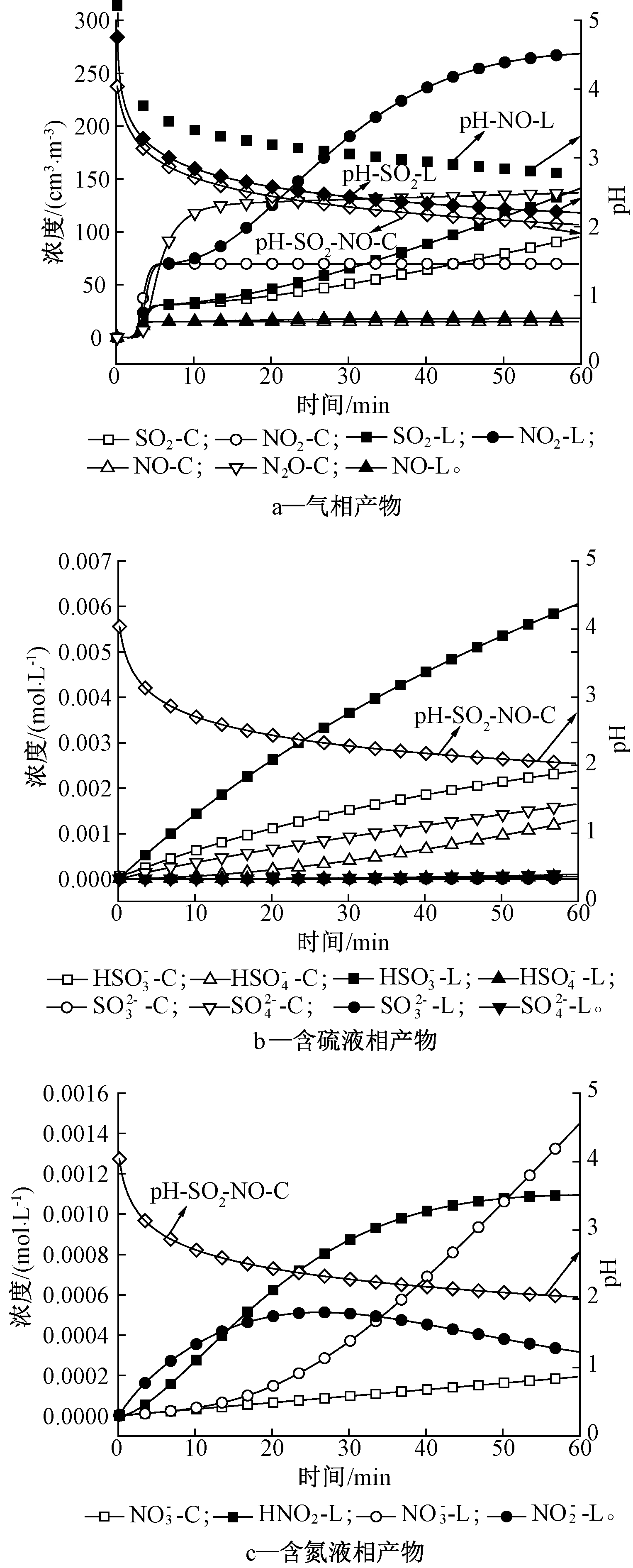
注:N=25;压力为1.5 MPa;φ(SO2)为994 cm3/m3,
φ(NO)为450 cm3/m3,5% O2;水量为0.5 L;气体流速为2 L/min。
其中“L”和“C”分别表示SO2、NO单独吸收和SO2、NO
联合吸收到水中的模拟结果。
图6 SO2和NO联合吸收到水中的气液相产物变化
Fig.6 Dynamic gas and liquid compositions change for simultaneous absorption of SO2 and NO into water
由图6a可知:SO2和NO联合吸收能促进水对SO2的吸收,这是因为液相中的![]() 与HNO2相互作用消耗了
与HNO2相互作用消耗了![]() 对反应(R5)有促进作用,从而促进了水对SO2的吸收。但随着pH值的降低,水对SO2的吸收效果逐渐减弱,这可能是因为溶液中的H+与
对反应(R5)有促进作用,从而促进了水对SO2的吸收。但随着pH值的降低,水对SO2的吸收效果逐渐减弱,这可能是因为溶液中的H+与![]() 发生反应并释放SO2到气相中。SO2和NO联合吸收能显著促进水对NO2的吸收,且随着pH值的降低,水对NO2的吸收效果基本不变,但会导致温室气体N2O的生成量越来越多,N2O的释放有悖CO2捕集的初衷。N2O的大量生成来源于HNO2。吸收过程中NO2与H2O反应生成HNO2,从而促进了水对NO2的吸收。溶液中的HNO2与
发生反应并释放SO2到气相中。SO2和NO联合吸收能显著促进水对NO2的吸收,且随着pH值的降低,水对NO2的吸收效果基本不变,但会导致温室气体N2O的生成量越来越多,N2O的释放有悖CO2捕集的初衷。N2O的大量生成来源于HNO2。吸收过程中NO2与H2O反应生成HNO2,从而促进了水对NO2的吸收。溶液中的HNO2与![]() 发生复杂的相互作用(R12、R13和R15),并导致大量N2O的生成。
发生复杂的相互作用(R12、R13和R15),并导致大量N2O的生成。
由图6b可知:SO2和NO联合吸收溶液中的![]() 和
和![]() 浓度大幅度增加,这说明NO的存在对反应(R9—R11)有促进作用。由图6c可知:SO2和NO联合吸收溶液中的
浓度大幅度增加,这说明NO的存在对反应(R9—R11)有促进作用。由图6c可知:SO2和NO联合吸收溶液中的![]() 浓度大幅度降低,这是因为反应(R2、R9和R10)消耗了大量的NO2,使得只有少量的NO2参与生成HNO3的反应(R3);同时溶液中不存在多余的HNO2参与反应(R4),也会进一步导致
浓度大幅度降低,这是因为反应(R2、R9和R10)消耗了大量的NO2,使得只有少量的NO2参与生成HNO3的反应(R3);同时溶液中不存在多余的HNO2参与反应(R4),也会进一步导致![]() 的生成量减少。HNO2主要通过反应(R12)消耗,结合图6b发现溶液中有足够的
的生成量减少。HNO2主要通过反应(R12)消耗,结合图6b发现溶液中有足够的![]() 来消耗HNO2,所以导致HNO2在整个反应过程中被全部消耗。
来消耗HNO2,所以导致HNO2在整个反应过程中被全部消耗。
图7为不同压力下SO2和NO联合吸收到水中的气液相产物变化的模拟结果。由图7a和7b可知:压力越高,越有利于反应(R1)的进行,以及水对NO2和SO2的吸收,但同时也导致N2O的生成量增多。由图7c可知:压力对![]() 的生成量影响较大,而对
的生成量影响较大,而对![]() 的生成量基本没有影响,即压力为0.5 MPa时,
的生成量基本没有影响,即压力为0.5 MPa时,![]() 的生成量最多;压力为1.5 MPa时,
的生成量最多;压力为1.5 MPa时,![]() 的生成量最少,这说明压力越高越有利于
的生成量最少,这说明压力越高越有利于![]() 转化为H2SO4和其他中间氮硫产物。由图7d可知:压力的升高,有利于
转化为H2SO4和其他中间氮硫产物。由图7d可知:压力的升高,有利于![]() 和
和![]() 的生成。由图7e可知:N-S复杂化合物主要为HADS和HAMS,随着压力的提高,HADS和HAMS的生成量略有提高,说明压力的提高对反应(R14)和(R16)有促进作用。
的生成。由图7e可知:N-S复杂化合物主要为HADS和HAMS,随着压力的提高,HADS和HAMS的生成量略有提高,说明压力的提高对反应(R14)和(R16)有促进作用。
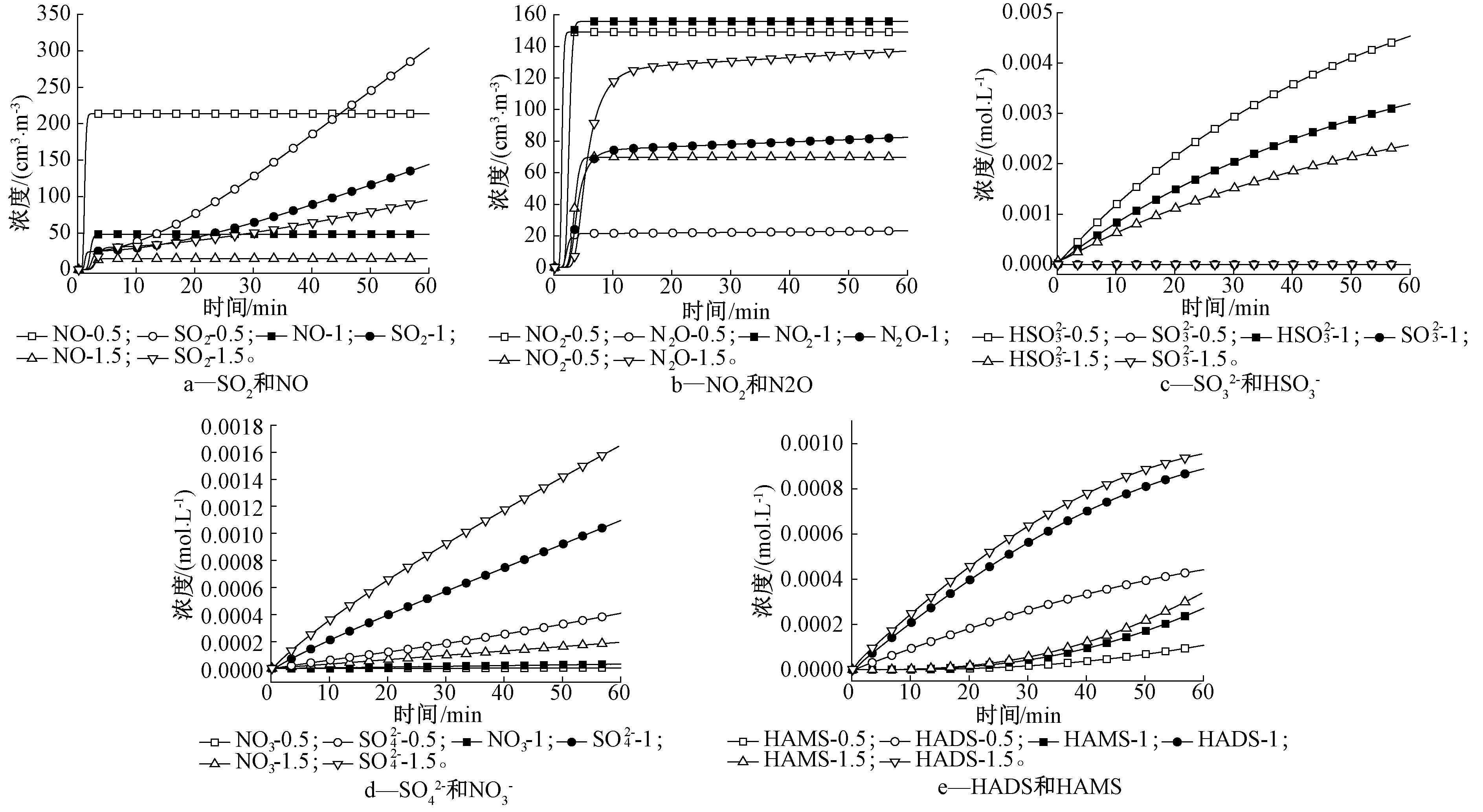
注:N=25;压力为0.5,1,1.5 MPa;φ(SO2)为994 cm3/m3,φ(NO)为450 cm3/m3,5% O2;水量为0.5 L;气体流速为2 L/min。
图7 不同压力下SO2和NO联合吸收到水中的气液相产物变化
Fig.7 Dynamic gas and liquid composition change for simultaneous absorption of SO2 and NO into water under different pressure
1)SO2和NO单独吸收模拟结果分别表明:含硫的液相产物主要为![]() 含氮的液相产物主要为HNO2和
含氮的液相产物主要为HNO2和![]()
2)SO2和NO联合吸收模拟结果表明:溶液的pH从7迅速降低到5以下,在结束时溶液的pH约为2;N-S的相互作用促进了SO2和NO2的吸收,同时也导致了大量温室气体N2O的生成;N-S的相互作用促进了液相中的![]() 和
和![]() 大量生成;N-S复杂化合物主要为HADS和HAMS。
大量生成;N-S复杂化合物主要为HADS和HAMS。
3)不同压力下SO2和NO联合吸收模拟结果表明:压力越高,越有利于![]() 和HAMS生成,同时也导致N2O的生成量增多。
和HAMS生成,同时也导致N2O的生成量增多。
[1] Buhre B J P, Elliott L K, Sheng C D, et al. Oxy-fuel combustion technology for coal-fired power generation[J]. Progress in Energy and Combustion Science, 2005, 31(4):283-307.
[2] Wall T F. Combustion processes for carbon capture[J]. Proceedings of the Combustion Institute, 2007, 31(1):31-47.
[3] Fleig D, Andersson K, Johnsson F, et al. Conversion of sulfur during pulverized oxy-coal combustion[J]. Energy & Fuels, 2011, 25(2):647-655.
[4] 阎维平,李海新,鲁晓宇.基于碳捕集的富氧燃煤烟气联合脱硫脱硝试验研究[J].环境科学学报,2013,33(5):1382-1388.
[5] Okazaki K, Ando T. NOx reduction mechanism in coal combustion with recycled CO2[J]. Energy, 1997, 22(2/3):207-215.
[6] Liu H, Shao Y J. Predictions of the impurities in the CO2 stream of an oxy-coal combustion plant[J]. Applied Energy, 2010, 87(10):3162-3170.
[7] Prationo W, Zhang L. Influence of steam on ignition of victorian brown coal particle stream in oxy-fuel combustion: in-situdiagnosis and transient ignition modeling[J].Fuel, 2016, 181:1203-1213.
[8] 黄强, 张立麒, 周栋,等. 富氧燃烧烟气压缩净化的研究进展[J]. 化工进展, 2018, 37(3):1152-1160.
[9] 阎维平,鲁晓宇.富氧燃烧锅炉烟气CO2捕集中回收NO的研究[J].动力工程学报,2011,31(4):294-299.
[10] Ting T, Stanger R, Wall T. Laboratory investigation of high pressure NO oxidation to NO2 and capture with liquid and gaseous water under oxy-fuel CO2 compression conditions[J]. International Journal of Greenhouse Gas Control, 2013, 18(7):15-22.
[11] White V, Wright A, Tappe S, et al. The air products-Vattenfall oxy-fuel CO2 compression and purification Pilot Plant at Schwarze Pumpe[J]. Energy Procedia, 2013, 37:1490-1499.
[12] Torrente-Murciano L, White V, Petrocelli F, et al. Study of individual reactions of the sour compression process for the purification of oxyfuel-derived CO2[J]. International Journal of Greenhouse Gas Control, 2011, 5S:S24-S30.
[13] Rayson M S, Mackie J C, Kennedy E M, et al. Accurate rate constants for decomposition of aqueous nitrous acid[J]. Inorganic Chemistry, 2012, 51(4):2178-2185.
[14] Ajdari S, Normann F, Andersson K, et al. Modeling the nitrogen and sulfur chemistry in pressurized flue gas systems[J]. Industrial & Engineering Chemistry Research, 2015, 54(4):1216-1227.
[15] Normann, Fredrik, Jansson, et al. Nitrogen and sulphur chemistry in pressurized flue gas systems: a comparison of modeling and experiments[J]. International Journal of Greenhouse Gas Control, 2013, 12(1):26-34.
[16] Akita K, Yoshida F. Bubble size, interfacial area, and liquid-phase mass transfer coefficient in bubble columns[J]. Industrial & Engineering Chemistry Process Design & Development, 1974, 13(1): 84-91.
[17] Cho J S, Wakao N. Determination of liquid-side and gas-side volumetric mass transfer coefficients in a bubble column[J]. Journal of Chemical Engineering of Japan, 1988, 21(6): 576-581.
[18] Akita K, Yoshida F. Gas holdup and volumetric mass transfer coefficient in bubble columns. effects of liquid properties[J]. Industrial & Engineering Chemistry Process Design & Development, 1973, 12(1):76-80.
[19] White V, Torrente-Murciano L, Sturgeon D, et al. Purification of oxyfuel-derived CO2[J]. International Journal of Greenhouse Gas Control, 2010, 4(2):137-142.
[20] 周栋, 张立麒, 黄强,等. 富氧燃烧烟气压缩脱硫脱硝的实验研究[J]. 工程热物理学报, 2017(12):2738-2744.
[21] Beyad Y, Burns R, Puxty G, et al. A speciation study of sulfur(Ⅳ) in aqueous solution[J]. Dalton Transactions (Cambridge, England:2003), 2014, 43(5):2147-2152.
[22] Siddiqi MA, Krissmann J, Peters-Gerth P, et al. Spectrophotometric measurement of the vapour-liquid equilibria of (sulphur dioxide+water)[J]. Journal of Chemical Thermodynamics, 1996, 28(7):685-700.
[23] Voegele A F, Tautermann C S, Loerting T, et al. About the stability of sulfurous acid (H2SO3) and its dimer[J]. Chemistry, 2002, 8(24):5644-5651.
[24] Connick R E, Zhang Y X, Lee S, et al. Kinetics and mechanism of the oxidation of ![]() by O2.1. The Uncatalyzed Reaction[J]. Inorganic Chemistry, 1995, 34(18):4543-4553.
by O2.1. The Uncatalyzed Reaction[J]. Inorganic Chemistry, 1995, 34(18):4543-4553.
[25] Siddiqi M A, Petersen J, Lucas K. Influence of nitrogen monoxide on the complex phase and chemical equilibria in wet flue gas cleaning processes[J]. Industrial & Engineering Chemistry Research, 2003, 42(7):1406-1413.
[26] Littlejohn D, Chang S G. Identification of species in a wet flue gas desulfurization and denitrification system by laser Raman spectroscopy[J]. Environmental Science & Technology, 1984, 18(5):305-310.
[27] Bonner F T, Hughes M N. ChemInformabstract: the aqueous solution chemistry of nitrogen in low positive oxidation states[J]. Comments on Inorganic Chemistry, 1989, 7(4):215-234.
[28] Atkinson R, Baulch D L, Cox R A, et al. Evaluated kinetic and photochemical data for atmospheric chemistry: volume I-gas phase reactions of Ox, HOx, NOx and SOx species[J]. Atmospheric Chemistry & Physics, 2004, 4(6):1461-1738.
[29] England C, Corcoran W H. Kinetics and mechanisms of the gas-phase reaction of water vapor and nitrogen dioxide[J]. Industrial & Engineering Chemistry Fundamentals, 1974, 13(4):373-384.
[30] Beilke S, Lamb D, Müller J. On the uncatalyzed oxidation of atmospheric SO2 by oxygen in aqueous systems[J]. Atmospheric Environment, 1975, 9(12):1083-1090.
[31] Clifton C L, Altstein N, Huie R E. Rate constant for the reaction of nitrogen dioxide with sulfur(Ⅳ) over the pH range 5.3-13[J]. Environmental Science & Technology, 1988, 22(5):586-589.
[32] Chang S G, Littlejohn D, Lin N H, et al. Kinetics of reactions in a wet flue gas simultaneous desulfurization and denitrification system[J]. Journal of Chromatography B, 1981, 816(S1/2):289-295.
[33] Murciano L T, White V, Petrocelli F, et al. Sour compression process for the removal of SOx and NOx from oxyfuel-derived CO2[J]. Energy Procedia, 2011, 4(1):908-916.