0 引 言
铀矿的开采中产生的放射性的含铀废水对生态环境构成了潜在危害。传统的处理方法有化学沉淀、离子交换和蒸发浓缩等,这些方法成本高昂、工艺复杂,且易造成二次污染[1-3]。研究表明,微生物法具有选择性好,成本低,易于实施的优点,是一种治理重金属污染的清洁处理技术[4]。近年来,研究人员对铀污染水体微生物多样性以及铀-细菌相互作用的性质进行研究[5-7]。微生物与铀的作用机理主要包括:生物还原,如硫酸盐还原菌、奥奈达希瓦氏菌、脱硫弧菌等[8-9];生物吸附,如枯草芽孢杆菌、大肠杆菌、耐辐射奇球菌等[10-11];生物矿化,如柠檬酸杆菌、不动杆菌属及假单胞菌属等[12-13]。假单胞菌作为革兰氏阴性菌,对于危害性重金属具有一定的富集能力,已被证明是1种具有潜在价值的环境处理微生物[14-15]。研究表明[14, 16],假单胞菌能够高效结合Cu、Cd、Pb、Zn、Cr等元素,且能耐受多种共存重金属。相关研究[16-17]发现,假单胞菌主要通过表面吸附结合(Cu2+、Cd2+、Pb2+等)重金属离子,而与铀的相互作用较为复杂且相关报道尚不够全面[18-19]。
本文采用从某铀尾矿库土壤分离出的1株洋葱假单胞菌株,探究其对U(Ⅵ)的抗性和累积水平,及其在干扰离子(Cu2+、Pb2+、Zn2+)存在下对U(Ⅵ)的结合能力变化,分析洋葱假单胞菌与U(Ⅵ)相互作用的机理,以期为含铀废水生物处理提供理论依据。
1 试验部分
1.1 主要材料与仪器
1.1.1 供试菌株
实验菌株系本课题组保存的1株洋葱假单胞菌(Pseudomonas cepacia,编号Y-37)。
1.1.2 主要试剂
按照GBW04201方法配制铀标准溶液(1 g/L),分别配制1 g/L的Cu(NO3)2、Zn(NO3)2、Pb(NO3)2溶液并根据需要稀释到指定浓度。
1.1.3 主要仪器
可见光分光光度计(Unic2000,上海尤尼柯);傅里叶红外光谱分析仪(Nicolet-460,美国赛默飞);X射线衍射分析仪(D8,德国布鲁克);SEM-EDX(X-max,牛津)。
1.2 培养基及菌悬液的制备
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1000 mL,调节pH至7.0~7.2,121 ℃高压蒸汽灭菌20 min,冷却至室温待用。
菌悬液的制备:挑取单个菌落接种于少量的LB培养基中,在30 ℃和150 r/min条件下活化24 h后移入新鲜的LB培养基中。在相同条件下富集培养24 h,将培养物在4 ℃和6000 r/min下离心10 min 获得菌体细胞,用无菌水清洗菌体细胞经2~3次离心获得较纯净的菌体。取适量菌体放置于恒温干燥箱中108 ℃,干燥8 h,称量菌体干重(DW),计算菌体的干湿比。
1.3 菌体投加量对去除U(Ⅵ)的影响
将一定体积初始铀浓度为10 mg/L的溶液放置在100 mL锥形瓶中,菌体投加量(DW)为25~400 mg/L时,用0.1 mol/L的HNO3和NaOH调节pH为6.0,于30 ℃条件下振荡6 h,考察菌体投加量(DW)对U(Ⅵ)去除率和吸附量,计算如式(1)、式(2)所示:
(1)
![]()
(2)
式中:R为吸附率,%;c0为溶液初始U(Ⅵ)浓度,mg/L;c1为反应结束时溶液中U(Ⅵ)浓度,mg/L;q为细菌对U(Ⅵ)吸附量,mg/g;ce为U(Ⅵ)初始浓度,mg/L;V为反应体积,L。
1.4 接触时间对菌体去除U(Ⅵ)的影响
将一定体积初始铀浓度为10 mg/L的溶液放置于100 mL锥形瓶中,菌体投加量(DW)为200 mg/L,用0.1 mol/L的HNO3和NaOH调节pH值为2.0~7.0,于30 ℃条件下分别振荡10,20,30,60,120,240,480,720 min,考察时间对菌体去除U(Ⅵ)的影响。
1.5 pH对菌体去除U(Ⅵ)的影响
将一定体积初始铀浓度为10 mg/L的溶液放置于100 mL锥形瓶中,菌体投加量(DW)为200 mg/L,用0.1 mol/L的HNO3和NaOH调节pH值为2.0~7.0,于30 ℃条件下振荡4 h,考察pH对菌体去除U(Ⅵ)的影响。
1.6 不同干扰离子对菌体去除U(Ⅵ)影响
将一定体积初始铀浓度为10 mg/L的溶液放置在100 mL锥形瓶中,分别单独添加干扰离子(Cu2+、Pb2+、Zn2+)浓度为0,50,100,200 mg/L;菌体投加量(DW)为200 mg/L,用0.1 mol/L的HNO3和NaOH调节pH值为6.0,于30 ℃条件下振荡4 h,考察不同干扰离子对菌体去除U(Ⅵ)效果的影响。
1.7 菌体去除U(Ⅵ)的机理分析
向100 mL 50 mg/L U(Ⅵ)溶液中加入1.5 g湿菌体,pH=6.0,30 ℃下振荡反应4 h。离心收集菌体取少量去除U(Ⅵ)前、后的细菌菌体,置于转速为6000 r/min条件下离心10 min,去掉上清液,用0.1 mol/L NaCl溶液洗涤细菌3次并保持其渗透压。用2.5%戊二醛固定收集到的菌体4 h,加入1/15 mol/L磷酸缓冲液洗涤3次。之后分别用30%、50%、80%、100%乙醇梯度脱水,然后用乙酸异戊酯置换乙醇2次,离心将所得样品放入-80 ℃的冰箱冷冻24 h。取出样品后立即放入冷冻干燥机中干燥24 h,研磨制样,供表征分析使用。
1.8 U(Ⅵ)的分析测定
采用HZHJSZ00127-TRPO-5-Br-PADAP分光光度法进行废水中微量U(Ⅵ)的测定。
1.9 数据分析
采用Excel 2013进行处理,试验数据为3次重复试验的平均值±标准差;采用Origin 2017软件作图;采用Jade 6.5软件分析矿化产物。
2 结果与分析
2.1 菌体投加量对U(Ⅵ)去除的影响
图1所示为不同菌体浓度对U(Ⅵ)去除的影响。可知:当菌体浓度从25 mg/L增加到100 mg/L时,U(Ⅵ)去除率显著增加,由40.1%增加到82.4%。之后随着菌体投加量的增加,U(Ⅵ)去除率增加较为缓慢,菌体浓度达到200 mg/L时,U(Ⅵ)去除率接近平稳,为93.8%;菌体浓度为400 mg/L时,U(Ⅵ)去除率略微增加,达到95.4%。菌体浓度从25 mg/L增加到400 mg/L时,U(Ⅵ)吸附量从160.4 mg/g降低为23.7 mg/g。由以上分析可以得出,菌体浓度为25~200 mg/L时,菌体投加量对U(Ⅵ)去除率影响较大。这表明U(Ⅵ)的去除可能主要依赖菌体表面的活性接触位点,随着活性位点的增加,菌体表面吸附大量铀酰离子;而菌体浓度的增加使得单个细胞吸收铀酰离子减少,导致吸附能力逐渐减弱[20]。综合考虑,确定后续试验菌体投加量为200 mg/L。
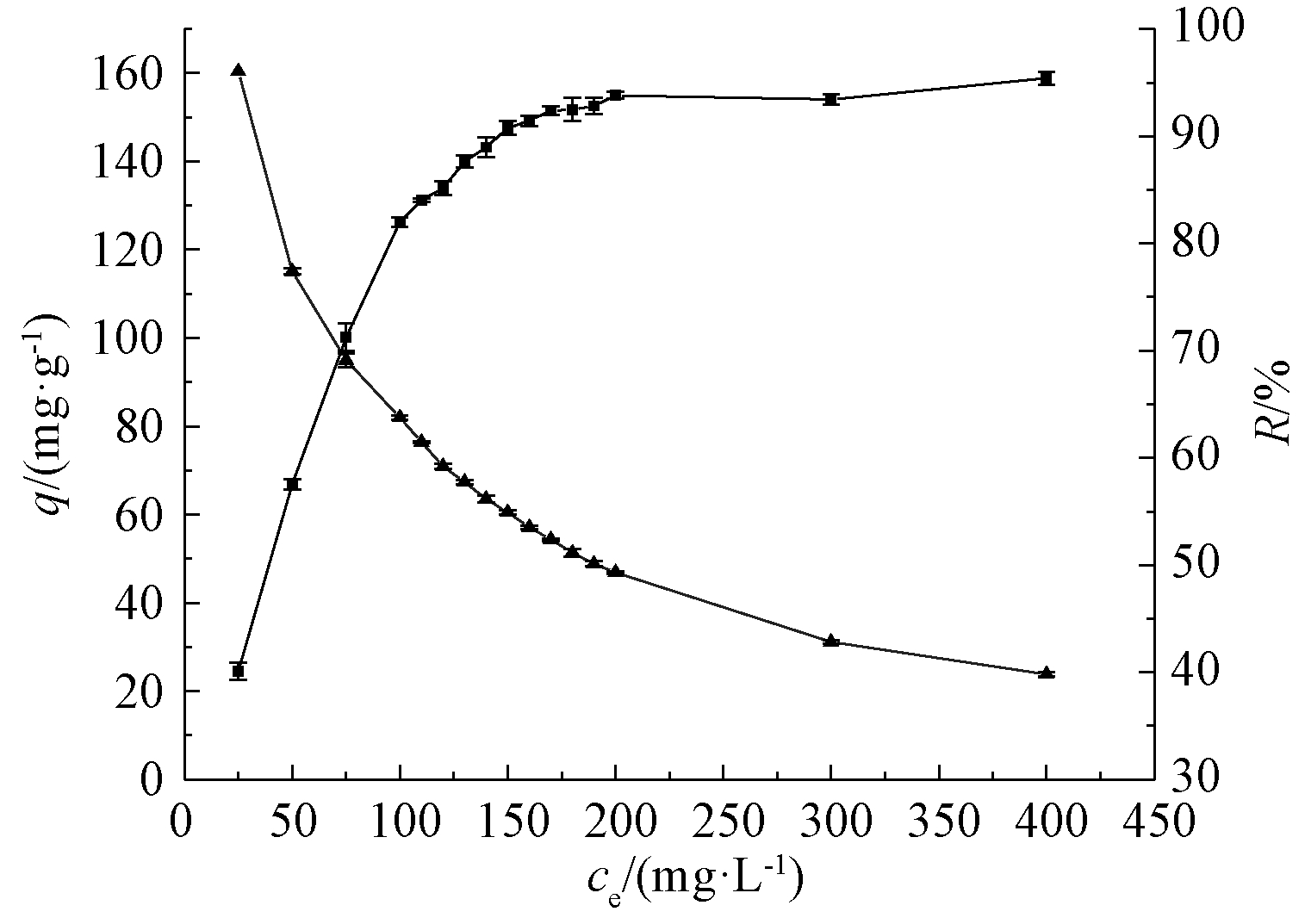
![]() —q;
—q; ![]() —R。
—R。
图1 菌体浓度对U(Ⅵ)的去除影响
Fig.1 Removal of U(Ⅵ) by different biomass concentration
2.2 接触时间对菌体去除U(Ⅵ)的影响
图2所示为接触时间对菌体去除U(Ⅵ)的影响。可知:接触前10 min,菌体去除U(Ⅵ)效果急剧增加,当接触时间达到4 h时,U(Ⅵ)去除率达到95.0%,之后趋于稳定。分析认为:第1阶段U(Ⅵ)浓度的快速下降可以推断为细胞表面的快速吸附或离子交换;第2阶段U(Ⅵ)去除率出现了缓慢增加,可能是细胞表面发生了络合和微量沉淀,且该过程中U(Ⅵ)经细胞代谢和扩散作用向胞内转移,形成稳定的化合物[21]。在12 h时,菌体对U(Ⅵ)去除率稳定在95%左右,这可能是由于细胞表面的活性位点达到饱和,U(Ⅵ)的胞内富集趋于平衡,因此U(Ⅵ)去除率达到稳定状态。
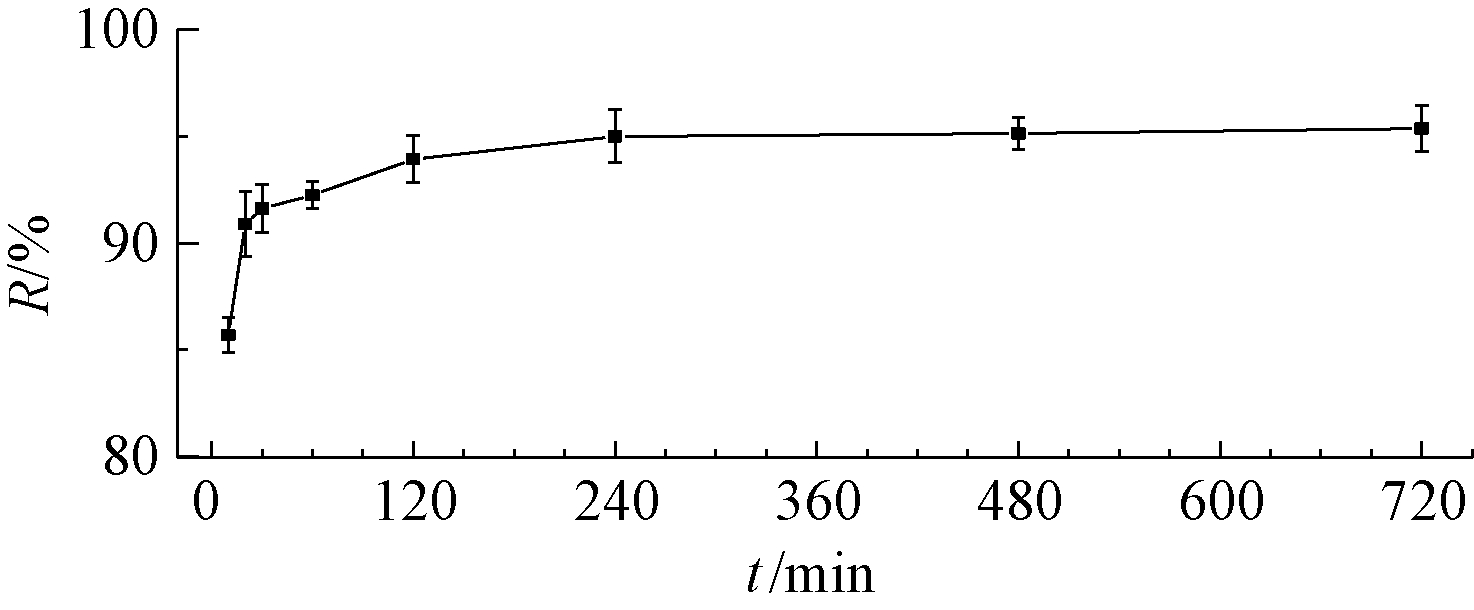
图2 接触时间对菌体除U(Ⅵ)的影响
Fig.2 Removal of U(Ⅵ) by bacteria with different contacting time
2.3 初始pH对菌体去除U(Ⅵ)影响
图3所示为初始pH对U(Ⅵ)去除的影响。可知:pH<4.0时,U(Ⅵ)去除率较低,且pH=2.0,仅为13.2%。pH=4.0~7.0时,U(Ⅵ)去除率保持在85%以上,pH=6.0,U(Ⅵ)去除率达最高,为95.6%,之后出现略微下降。有研究[13, 22]表明:低pH(pH<3.0)细胞表面质子化,H+与![]() 竞争吸附更有优势,pH>4.0,H+浓度降低,细胞表面去质子化作用使得U(Ⅵ)更加容易被累积,从而去除效果显著提升。
竞争吸附更有优势,pH>4.0,H+浓度降低,细胞表面去质子化作用使得U(Ⅵ)更加容易被累积,从而去除效果显著提升。
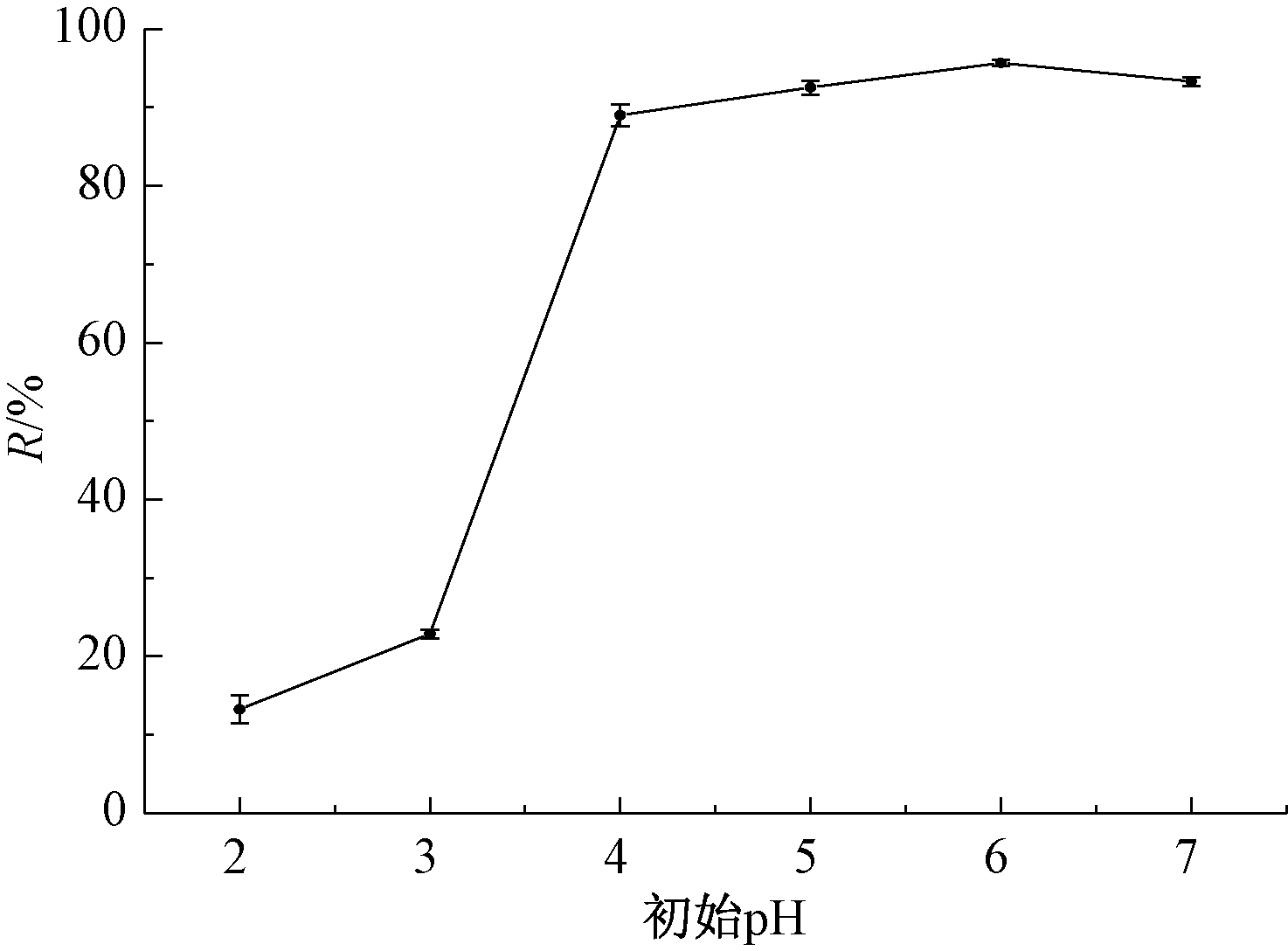
图3 不同初始pH下菌体对U(Ⅵ)的去除作用
Fig.3 Removal of U(Ⅵ) by bacteria in different pH values
2.4 不同干扰离子对菌体去除U(Ⅵ)影响
图4为不同干扰离子对U(Ⅵ)去除的影响。可知:当干扰离子浓度<100 mg/L时,干扰离子对洋葱假单胞菌去除U(Ⅵ)有一定的抑制作用,其中抑制效果表现为Cu2+>Pb2+>Zn2+。干扰离子浓度为200 mg/L时,加入Cu2+、Pb2+的实验中表现出生物毒性,菌体出现大量死亡,然而死菌体吸附重金属的能力强于活菌体,U(Ⅵ)去除率出现提高[17]。ρ(Zn2+)为200 mg/L时,U(Ⅵ)去除率有微弱降低,表明Zn2+对洋葱假单胞菌的生物活性抑制作用不明显。洋葱假单胞菌能够耐受一定浓度的重金属毒性,且Cu2+、Pb2+、Zn2+的存在对U(Ⅵ)的去除具有一定的拮抗作用[13, 15]。
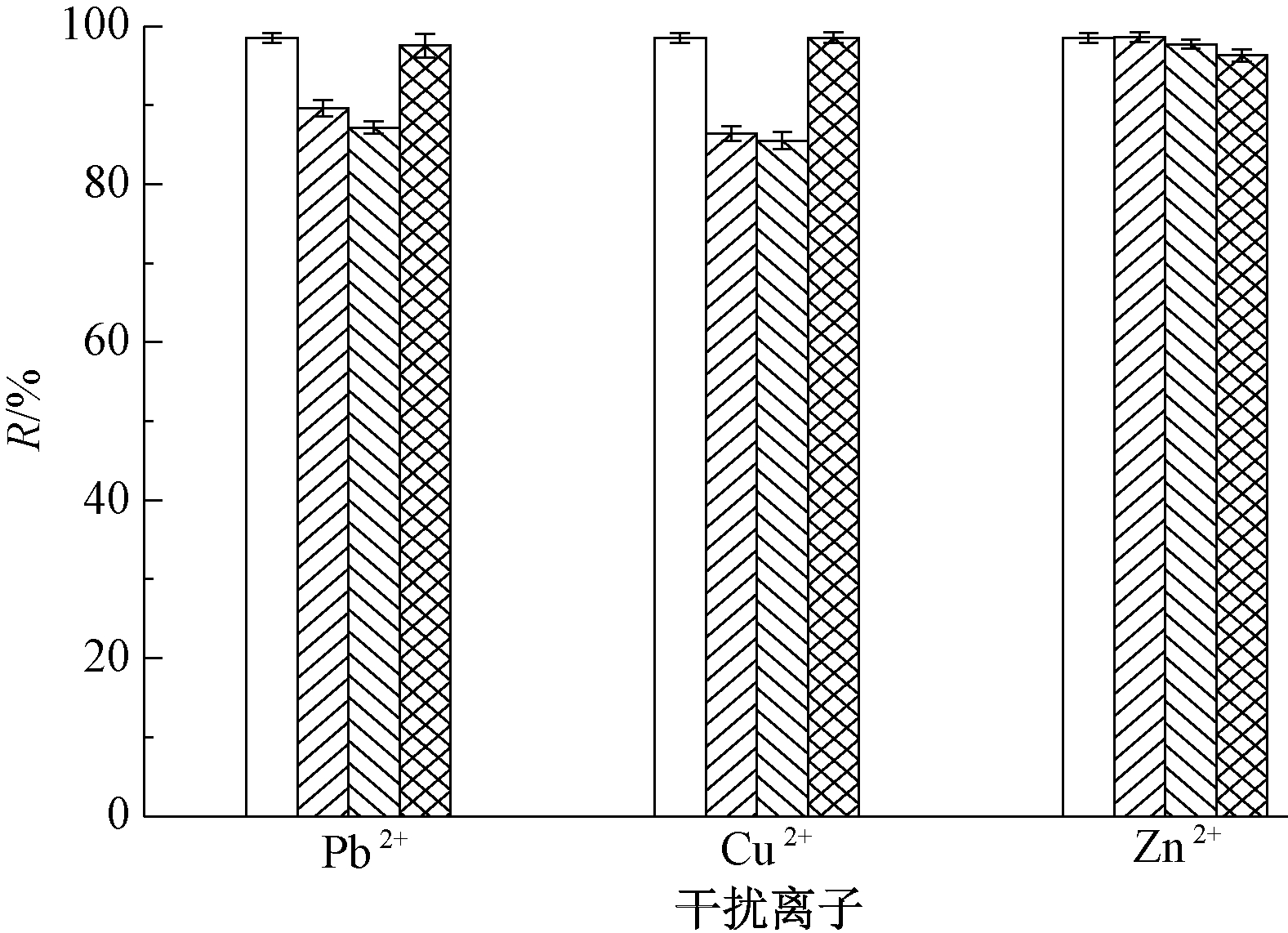
![]() 0 mg/L;
0 mg/L; ![]() 50 mg/L;
50 mg/L; ![]() 100 mg/L;
100 mg/L; ![]() 200 mg/L。
200 mg/L。
图4 不同干扰离子作用下菌体对U(Ⅵ)的去除效果
Fig.4 Removal of U(Ⅵ) by bacteria under different interference ions
2.5 菌体去除U(Ⅵ)机理分析
2.5.1 FTIR光谱分析
图5为对照组和负载U(Ⅵ)的细胞在4000 cm-1和400 cm-1之间的FTIR光谱,表1列出了相关峰的变化,以此分析细菌-U(Ⅵ)结合过程涉及的化学基团。由图5可知:去除U(Ⅵ)后,吸收峰从3424 cm-1偏移至3416 cm-1,这说明了细菌表面的羟基和氨基与铀发生了结合。对照组中,1239 cm-1 和1080 cm-1处出现了强峰,主要是羧基和磷酸基团![]() 中的P
中的P![]() O和P—O)的伸缩振动[23]。这些基团大多属于细胞成分,如肽聚糖、磷脂、多肽等,可络合不同的金属[24]。与U(Ⅵ)反应后,这些峰明显偏移至1238 cm-1和1077 cm-1,表明金属与羧基和磷酸酯基团发生相互作用。以上变化表明,细胞的羟基、酰胺和磷酸基团等官能团在与铀的结合中起重要作用。去除U(Ⅵ)后,916 cm -1处出现新的峰值被认为是铀酰离子的不对称伸缩振动[25]。
O和P—O)的伸缩振动[23]。这些基团大多属于细胞成分,如肽聚糖、磷脂、多肽等,可络合不同的金属[24]。与U(Ⅵ)反应后,这些峰明显偏移至1238 cm-1和1077 cm-1,表明金属与羧基和磷酸酯基团发生相互作用。以上变化表明,细胞的羟基、酰胺和磷酸基团等官能团在与铀的结合中起重要作用。去除U(Ⅵ)后,916 cm -1处出现新的峰值被认为是铀酰离子的不对称伸缩振动[25]。

图5 去除U(Ⅵ)前后细菌红外光谱
Fig.5 FTIR spectra of bacteria before and after removal of U(Ⅵ)
2.5.2 SEM-EDX分析
图6通过SEM-EDX表征分析铀的沉积特点,以探究铀与假单胞菌表面的相互作用。如图6d所示:
表1 细菌去除U(Ⅵ)前后FTIR变化
Table 1 FTIR change of bacteria before and after
removal of U(Ⅵ) cm-1
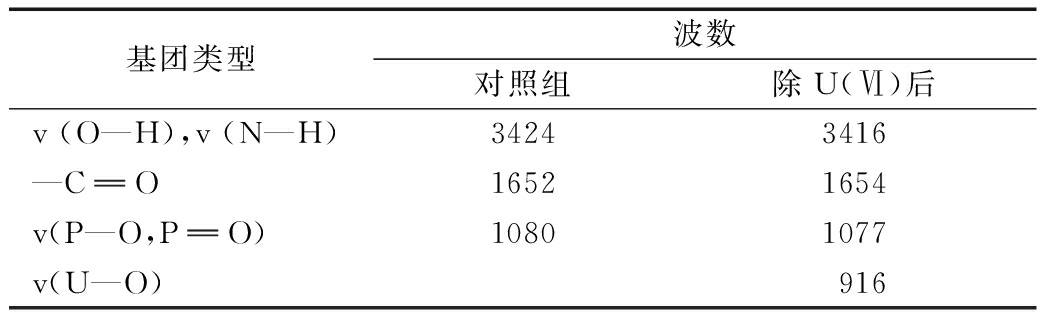
基团类型波数对照组除U(Ⅵ)后v (O—H),v (N—H)34243416—CO16521654v(P—O,PO)10801077v(U—O)916
菌种去除U(Ⅵ)后EDX中出现了U峰,表明细胞表面累积了铀。结合研究[19]表明:细胞表面存在高活性的位点,吸附铀的能力较强。图6a中对照组细胞呈椭球形、结构完整,表面呈现轻微的褶皱状。与U(Ⅵ)接触后(图6b)细胞表面的褶皱更加明显且有明显的絮状物,推测这是铀与细胞表面的官能团发生反应,生成一定量的沉淀,说明50 mg/L U(Ⅵ)对菌体表面及形态会产生一定影响。去除U(Ⅵ)后,EDX中出现明显的P峰,表明细胞表面的沉淀物可能是一种磷酸铀酰。
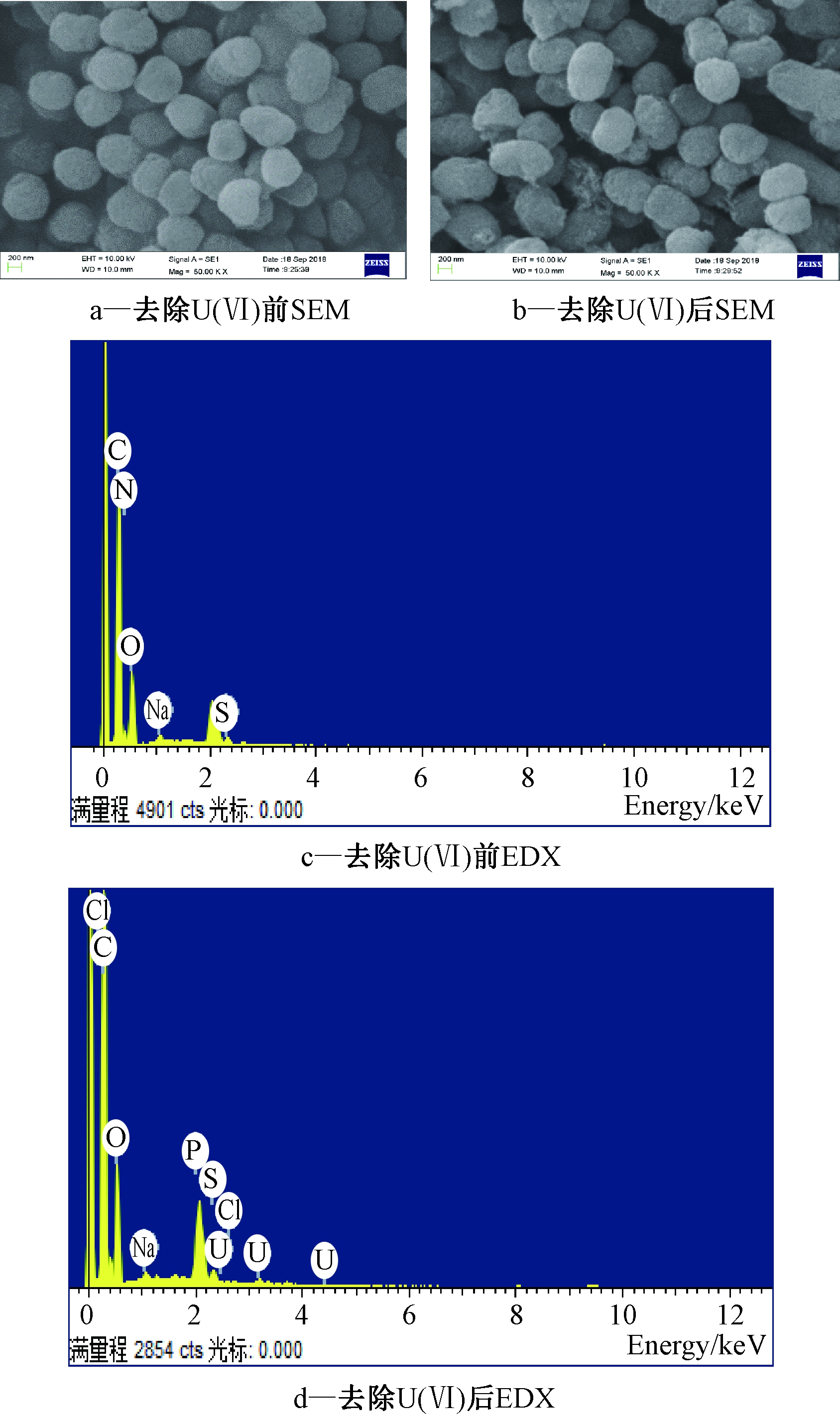
图6 细菌去除U(Ⅵ)前、后的SEM、EDX图
Fig.6 SEM-EDX of bacteria before and after removal of U(Ⅵ)
2.5.3 XRD分析
X射线衍射法测定了铀的化学特征,采用Jade 6.5软件分析相关结果。如图7所示,去除U(Ⅵ)后的光谱显示,在2θ为26.12°、36.85°、41.38°处有3个不同的峰,d-spacing值分别为3.47°A、2.44°A、2.18°A。将这些d-spacing值与已知化合物(JCPDS)的数据文件进行比较[26-27],发现与卡片89-1670、72-2427、36-0346相匹配,依次为磷铀氧化物(UO2P6O17)、磷酸氢铀化合物(UO2H(PO3)3)和磷酸氢铀水合物(UO2(H2PO4)2.3H2O)。pH的变化影响相关磷酸盐-铀化合物的形成,当pH=6.0时铀主要以磷酸铀化合物的形式存在[24]。
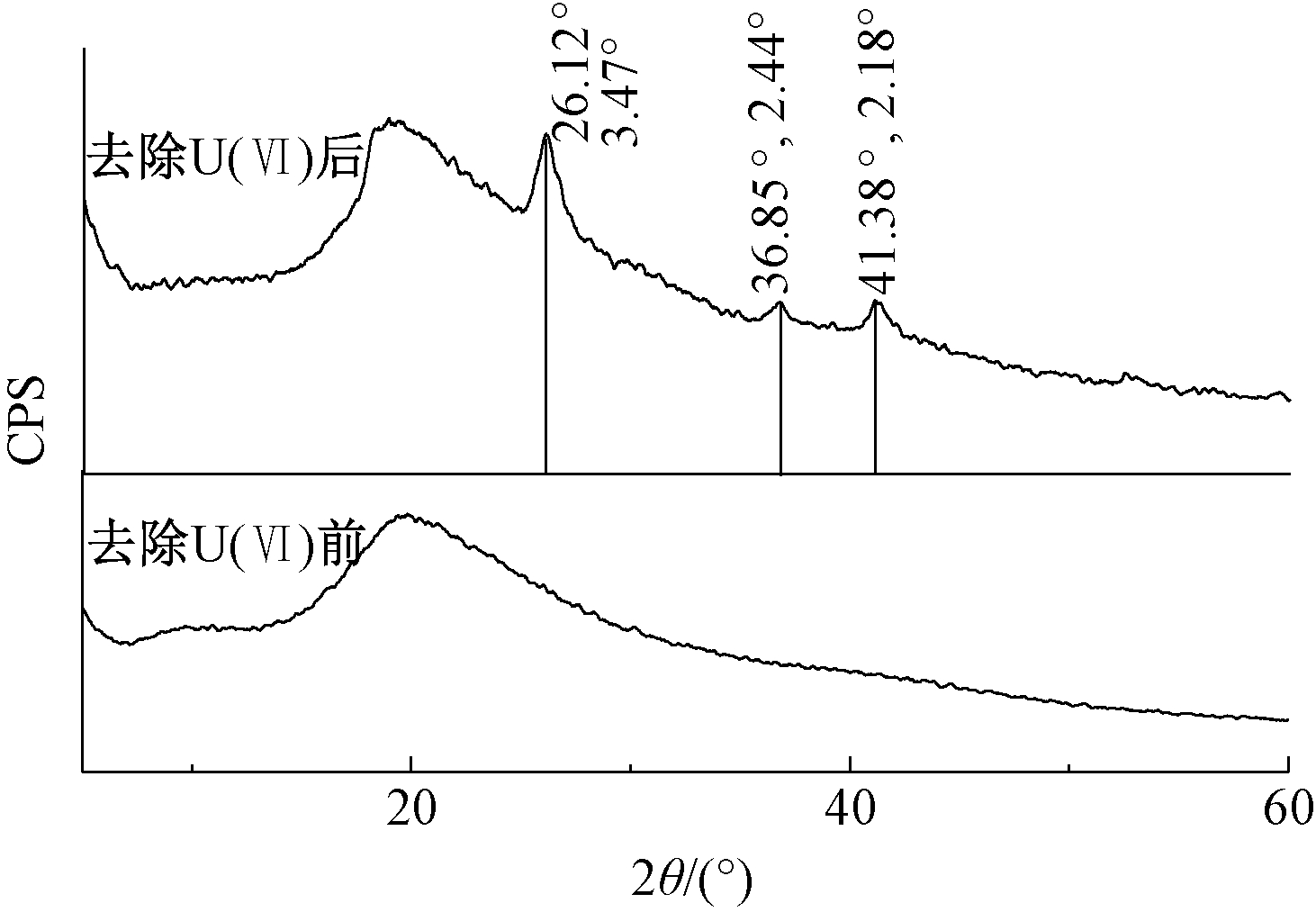
图7 细菌去除U(Ⅵ)前、后XRD光谱
Fig.7 XRD spectra of bacteria before and after treating U(Ⅵ)
3 结 论
1)利用洋葱假单胞菌进行含铀废水处理试验,在pH=6.0时,U(Ⅵ)的最大平衡累积量可达到160.4 mg/g。浓度为100 mg/L的干扰离子(Cu2+、Pb2+、Zn2+)对细菌的生物活性具有抑制作用,对U(Ⅵ)的去除表现一定的拮抗作用。
2)SEM-EDX、FTIR、XRD分析结果表明:铀以絮状磷酸铀沉淀物的形式黏附在细胞表面,且氨基、羧基和磷酸基团参与了铀的络合沉淀。
3)洋葱假单胞菌通过络合和生物矿化U(Ⅵ),是处理低浓度含铀废水的可行途径。
[1] Dmitriev S A, Karlin Y V, Maryakhin M A, et al. Liquid radwaste concentration by evaporation from porous plates [J]. Atomic Energy, 2009, 106(4): 266-271.
[2] Juliano, Swiergon, Clarke, et al. Effects of pilot plant-scale ultrasound on palm oil separation and oil quality [J]. Journal of the American Oil Chemists Society, 2013, 90(8): 1253-1260.
[3] 秦樊鑫, 魏朝富, 李红梅. 重金属污染土壤修复技术综述与展望 [J]. 环境科学与技术, 2015,38(增刊2):199-208.
[4] 张溪, 周爱国, 甘义群, 等. 金属矿山土壤重金属污染生物修复研究进展 [J]. 环境科学与技术, 2010, 33(3): 106-112.
[5] 蒋小梅, 曾涛涛, 谢水波, 等 土著细菌菌群除铀效能分析 [J]. 生物技术, 2018, 28(3): 290-295,306.
[6] 邓闻杨, 罗学刚, 罗蓝, 等. 混合接种3种微生物对凤眼莲吸附铀的影响 [J]. 核农学报, 2018, 32(9): 1864-1871.
[7] Suriya J, Chandra S M, Nathani N M, et al. Assessment of bacterial community composition in response to uranium levels in sediment samples of sacred Cauvery River [J]. Applied Microbiology & Biotechnology, 2017, 101(2): 1-11.
[8] 王永华, 谢水波, 刘金香, 等 奥奈达希瓦氏菌MR-1还原U(Ⅵ)的特性及影响因素 [J]. 中国环境科学, 2014, 34(11): 2942-2949.
[9] Roh C, Kang C K, Lloyd J R. Microbial bioremediation processes for radioactive waste [J]. Korean Journal of Chemical Engineering, 2015, 32(9): 1720-1726.
[10] 张露, 刘峙嵘. 微生物法处理低浓度含铀废水研究 [J]. 环境工程, 2017, 35(12): 36-40,62.
[11] 肖方竹, 何淑雅, 彭国文, 等. 功能化磁性载体固定耐辐射奇球菌及其对铀的吸附行为与机理 [J]. 中国有色金属学报, 2016, 26(7): 1568-1575.
[12] Sowmya S, Rekha P D, Arun A B. Uranium(Ⅵ) bioprecipitation mediated by a phosphate solubilizing Acinetobacter sp. YU-SS-SB-29 isolated from a high natural background radiation site [J]. International Biodeterioration & Biodegradation, 2014, 94:134-140.
[13] Choudhary S, Sar P. Identification and characterization of uranium accumulation potential of a uranium mine isolated Pseudomonas strain [J]. World Journal of Microbiology & Biotechnology, 2011, 27(8): 1795-1801.
[14] 喻涌泉, 黄魏魏, 董建江, 等. 硝基还原假单胞菌吸附重金属镉的机理研究 [J]. 中国环境科学, 2017, 37(6): 2232-2238.
[15] Choudhary S, Sar P. Characterization of a metal resistant Pseudomonas sp. isolated from uranium mine for its potential in heavy metal (Ni2+, Co2+, Cu2+, and Cd2+) sequestration [J]. Bioresour Technol, 2009, 100(9): 2482-2492.
[16] 史广宇, 程媛媛, 史绮, 等. 铜绿假单胞菌对铜和铅的吸附 [J]. 环境科学学报, 2017, 37(6): 2107-2113.
[17] Choi J, Lee J Y, Yang J S. Biosorption of heavy metals and uranium by starfish and Pseudomonas putida [J]. J Hazard Mater, 2009, 161(1): 157-162.
[18] Lütke L, Moll H, Bernhard G. Insights into the uranium(Ⅵ) speciation with Pseudomonas fluorescens on a molecular level [J]. Dalton Transactions, 2012, 41(43): 13370-13378.
[19] Deng X Y, Feng Y L, Li H, et al. Adsorption properties of Pseudomonas monteilii for removal of uranium from aqueous solution [J]. Journal of Radioanalytical and Nuclear Chemistry, 2017, 315(2/3): 243-250.
[20] Wang T, Zheng X Y, Wang X Y, et al. Different biosorption mechanisms of Uranium(Ⅵ) by live and heat-killed Saccharomyces cerevisiae under environmentally relevant conditions [J]. Journal of Environmental Radioactivity, 2017, 167:92-99.
[21] 何颖, 沈先荣, 刘琼, 等. 微生物与铀的相互作用及其应用前景 [J]. 环境科学与技术, 2014,37(10): 62-68.
[22] Hu M Z, Norman J M, Faison B D, et al. Biosorption of uranium by Pseudomonas aeruginosa strain CSU: characterization and comparison studies [J]. Biotechnology & Bioengineering, 2015, 51(2): 237-247.
[23] Jiang W, Saxena A, Song B, et al. Elucidation of functional groups on gram-positive and gram-negative bacterial surfaces using infrared spectroscopy [J]. Langmuir, 2004, 20(26): 11433-11442.
[24] Merroun M L, Geipel G, Nicolai R, et al. Complexation of uranium (Ⅵ) by three eco-types of Acidithiobacillus ferrooxidans studied using time-resolved laser-induced fluorescence spectroscopy and infrared spectroscopy [J]. Biometals, 2003, 16(2): 331-339.
[25] Lu X, Zhou X J, Wang T S. Mechanism of uranium(Ⅵ) uptake by Saccharomyces cerevisiae under environmentally relevant conditions: batch, HRTEM, and FTIR studies [J]. J Hazard Mater, 2013, 262(8): 297-303.
[26] Choudhary S, Sar P. Uranium biomineralization by a metal resistant Pseudomonas aeruginosa strain isolated from contaminated mine waste [J]. J Hazard Mater, 2011, 186(1): 336-343.
[27] Kazy S K, D’souza S F, Sar P. Uranium and thorium sequestration by a Pseudomonas sp.: mechanism and chemical characterization [J]. J Hazard Mater, 2009, 163(1): 65-72.