内分泌干扰物(endocrine disrupting chemicals,EDCs) 是指能够干扰生物体内激素的合成、分泌、运输、结合、反应和代谢等,从而影响生殖、神经、免疫等功能的外源性化学物质,其毒理学阈值低、危害程度大[1-3]。其中,类固醇雌激素被认为是环境风险相对较高的EDCs,引起了广泛关注。类固醇雌激素可分为天然雌激素(如雌酮Estrone E1、雌二醇17 β-estradiol E2、雌三醇Estriol E3)和人工合成雌激素(如炔雌醇Ethinylestradiol,EE2)两类。污水处理厂是水环境中类固醇雌激素的主要来源之一,其潜在环境风险应引起重视[4-6]。
已有研究表明:天然雌激素E1极性较低,在水中溶解能力较弱,人工合成激素EE2极性高于E1,溶解能力比E1要好,二者在自然环境中含量较低,可以被污泥、河流底泥、土壤等固相介质所吸附,减缓了它们进入水体的速率[7-9]。污水处理过程中,E1和EE2主要通过污泥吸附和生物降解2种途径迁移转化和去除,这是一个吸附降解动态平衡的过程[10]。污泥吸附去除E1和EE2主要依靠物理吸附作用,且与污泥性质、温度、pH、离子强度等有关。研究两类EDCs在污泥中的吸附特性,有助于优化活性污泥工艺及运行条件,提高EDCs的去除率,从而降低其进入水环境的风险。
本文主要是研究内分泌干扰物中类固醇雌激素在污泥中的吸附特性,以E1与EE2为研究对象,探讨了初始浓度、吸附时间、温度、pH和离子浓度等因素对其在污泥中吸附特性的影响。
主要仪器:超高效液相色谱仪(Ultimate3000,Thermo Scientific)、气浴恒温振荡仪(2D-85)、分样筛(200目)、酸度计(PHS-3C)、电子天平、C18柱等。
主要试剂:雌酮E1(色谱纯)、炔雌醇EE2(色谱纯)、甲醇(色谱纯)、乙腈(色谱纯)、HCl(分析纯)、NaOH(分析纯)、CaCl2(分析纯)、NH4Cl(分析纯)等。
本研究所用的污泥取自徐州国祯水务运营有限公司,经真空冷冻干燥处理,研砵磨碎后过200目筛并置于阴凉干燥处保存待用。
采用避光恒温振荡实验,分别研究初始浓度、吸附时间、温度、pH、离子浓度对E1和EE2在污泥中吸附特征的影响。
1)初始浓度:设置E1初始浓度为2.0,5.0,8.0 mg/L,EE2初始浓度为4.0,5.0,8.0 mg/L。溶液体积与干燥污泥质量比为20 mL∶1 g,恒温振荡仪转速180 r/min,温度25 ℃,振荡吸附时间分别设为0.25,0.5,1,2,4,6,8 h,于避光条件下进行。在相应的时间内取样、过滤并保存于棕色玻璃瓶中待测。
2)温度:E1和EE2初始浓度均为5.0 mg/L。溶液体积与干燥污泥质量比为20 mL∶1 g,恒温振荡仪转速为180 r/min,温度分别控制在15,25,35 ℃,于避光条件下进行实验。恒温振荡8 h,分别在0.25,0.5,1,2,4,6,8 h时取样、过滤并保存于棕色玻璃瓶中待测。
3)pH:E1和EE2初始浓度均为5.0 mg/L。溶液体积与干燥污泥质量比为20 mL∶1 g,恒温振荡仪转速为180 r/min,温度为25 ℃。采用HCl和NaOH调节吸附前溶液pH值至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0。恒温振荡为8 h,分别在15 min和8 h时取样,过滤并保存于棕色玻璃瓶中待测。
4)离子浓度:E1和EE2初始浓度均为5.0 mg/L。溶液体积与干燥污泥质量比为20 mL∶1 g,恒温振荡仪转速为180 r/min,温度为25 ℃。调节溶液中Ca2+和![]() 的离子浓度分别为0.005,0.01,0.05,0.1,0.5 mol/L。恒温振荡时间为8 h,取样并保存于棕色玻璃瓶中待测。
的离子浓度分别为0.005,0.01,0.05,0.1,0.5 mol/L。恒温振荡时间为8 h,取样并保存于棕色玻璃瓶中待测。
采用超高效液相色谱(HPLC)法测定样品中E1与EE2的浓度。选用C18色谱柱,流动相为乙腈和水的混合液(体积比为7∶3),流速为1.00 mL/min,进样时间6 min,每次进样20 μL,柱温为25 ℃。其中,E1检测波长为280 nm,EE2检测波长为224 nm。
根据峰面积计算溶解于水中的样品浓度,方法如式(1)所示:
(1)
式中:C0为溶液中初始样品浓度,mg/L;A0为初始样品峰面积;Ai为溶解于水相的样品峰面积。
根据吸附前后溶液浓度差计算污泥中样品的吸附量,计算方法如式(2)所示:
(2)
式中:Cs为污泥中样品的吸附量,mg/kg;V为溶液体积,L;M为污泥质量,kg。
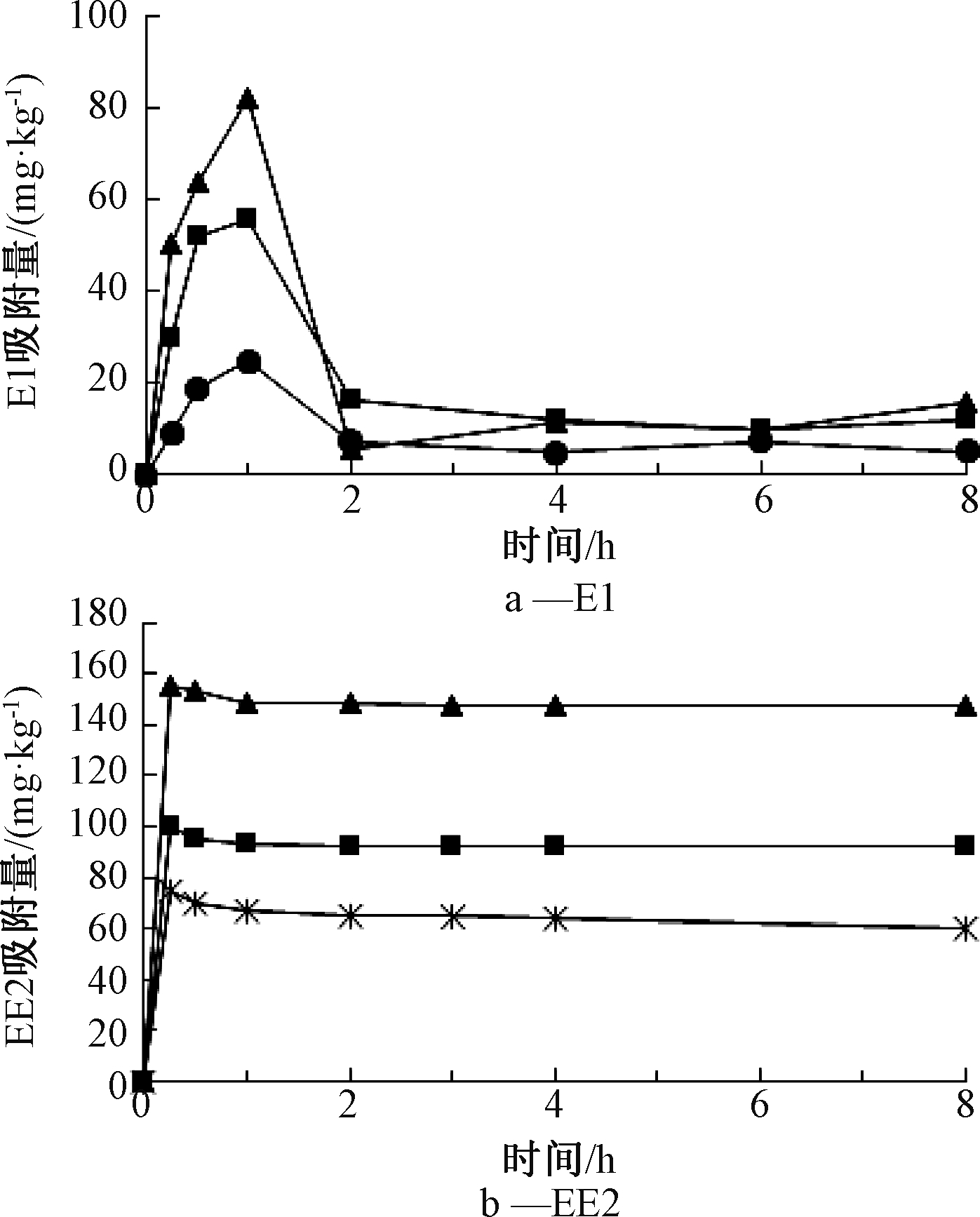
E1和EE2在污泥中的初始浓度与吸附量随时间的关系如图1所示。可知:在1 h时污泥中E1的吸附量达到最大值,而后在1~2 h内E1的吸附量显著下降,2 h后保持相对稳定,达到相对平衡。1 h时初始浓度2.0,5.0,8.0 mg/L溶液中的E1分别有61.7%、55.6%、55.1%被污泥所吸附,相应吸附量分别为24.66,55.63,81.79 mg/kg;相对稳定的状态时,2.0,5.0,8.0 mg/L溶液中被污泥所吸附的E1分别占12.6%、11.9%、9.7%。 初始浓度会对E1的吸附行为产生影响,污泥对于浓度较低的E1溶液吸附效果略好于浓度高的溶液。
污泥对EE2的吸附时间较短,在15 min左右对EE2的吸附量达到最大值,而后在15 min~1 h内有EE2少量解吸,1 h后保持相对稳定,达到平衡状态。15 min时4.0,5.0,8.0 mg/L溶液中EE2分别有94.0%、99.8%、97.0%被污泥所吸附,相应吸附量分别为75.19,99.84,155.13 mg/kg。平衡状态时,4.0,5.0,8.0 mg/L溶液中分别有85.9%、92.1%、92.2%的EE2被污泥所吸附。因此污泥对不同初始浓度的EE2吸附效果有明显差异。
![]() —2.0 mg/L;
—2.0 mg/L; ![]() —4.0 mg/L;
—4.0 mg/L; ![]() —5.0 mg/L;
—5.0 mg/L; ![]() —8.0 mg/L。
—8.0 mg/L。
图1 初始浓度与吸附量随时间的变化
Fig.1 Variation of initial concentration and adsorption amount with time
污泥对E1和EE2的吸附是一个动态变化过程,吸附和解吸是可逆的。E1在吸附1 h时达到最大吸附量,随后出现明显解吸,而EE2 的吸附过程在15 min~1 h即可达到平衡,解吸不明显。可见,污泥对E1和EE2吸附-解吸效果有显著差异,对EE2的吸附能力优于E1。EE2分子上的羟基和污泥表面的功能基团(如羧基等)之间的氢键可能在污泥吸附EE2的过程中发挥了作用[10],导致其更易于被污泥吸附。
温度变化会影响污泥对E1和EE2的吸附量,如图2所示。在1 h时,15,25,35 ℃溶液中E1分别有50.2%、55.6%、62.1%被污泥所吸附,相应吸附量分别为50.21,55.63,62.08 mg/kg;2 h后达到相对稳定的状态,15,25,35 ℃溶液中被污泥所吸附的E1占比为10.6%、11.9%、24.8%,即随着温度的升高,E1在污泥中的吸附量略有上升。EE2在15,25,35 ℃的反应条件下,15 min时溶液中EE2分别有90.5%、94.0%、94.7%被污泥所吸附,相应吸附量分别为72.37,75.19,75.73 mg/kg。达到相对稳定状态后,15,25,35 ℃溶液中被污泥所吸附的EE2分别占81.3%、75.9%、64.0%,因此,随着温度的升高,EE2在污泥中的吸附量有明显的下降趋势。

![]() —15 ℃;
—15 ℃; ![]() —25 ℃;
—25 ℃; ![]() —35 ℃。
—35 ℃。
图2 温度与吸附量随时间的变化
Fig.2 Variation of temperature and adsorption amount with time
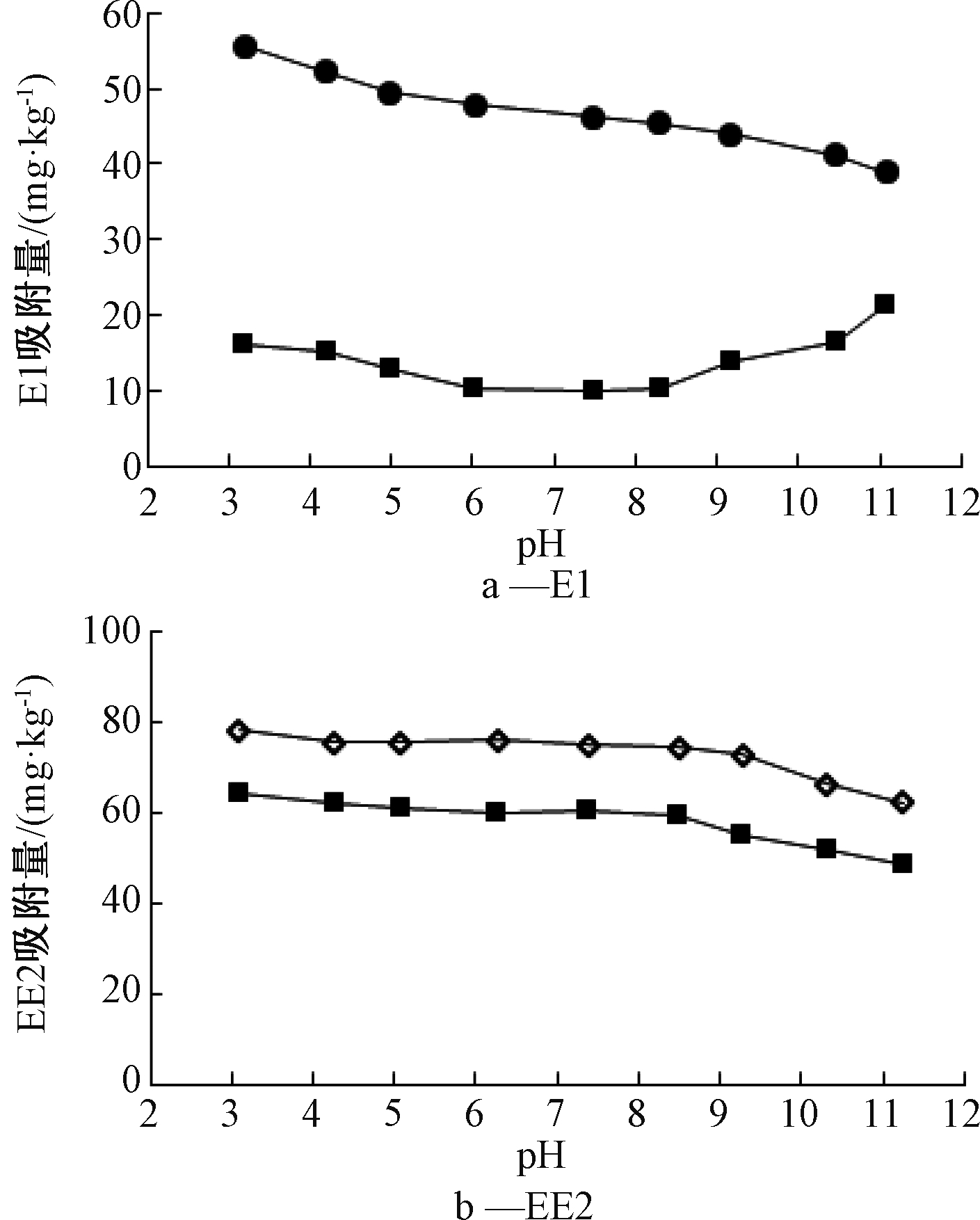
不同pH条件下对应的E1和EE2在污泥中的吸附量见图3。由图3a可知:在pH=3~11内,E1在污泥中的最大吸附量(1 h)随着pH的升高而降低,吸附量占比为69.4%~48.7%;而在吸附-解吸平衡时的吸附量(8 h),当pH值偏碱性时,E1在污泥中的吸附量随着pH的升高而增加,吸附量占比为20.1%~26.9%,这说明偏碱性的条件有利于污泥对E1的吸附。 如图3b所示,在pH=3~11时, EE2在污泥中的最大吸附量(15 min)和平衡吸附量(8 h)随着pH的升高而降低,吸附量分别为97.6%~78.0%和80.2%~60.4%。并且在偏碱性条件下,吸附量有明显下降,这是因为较高的pH导致EE2在溶液中的电离度增加,与污泥表面负电荷之间产生斥力而阻碍靠近,从而降低了污泥对EE2的吸附作用。
![]() —15 min;
—15 min; ![]() —1 h;
—1 h; ![]() —8 h。
—8 h。
图3 pH与E1、EE2吸附量的关系
Fig.3 Relation between pH and adsorption amount of E1, EE2
![]()
图4 离子![]() 与Ca2+)浓度与E1、EE2吸附量的关系
与Ca2+)浓度与E1、EE2吸附量的关系
Fig.4 Relation between ![]() and adsorption
and adsorption
amount of E1, EE2
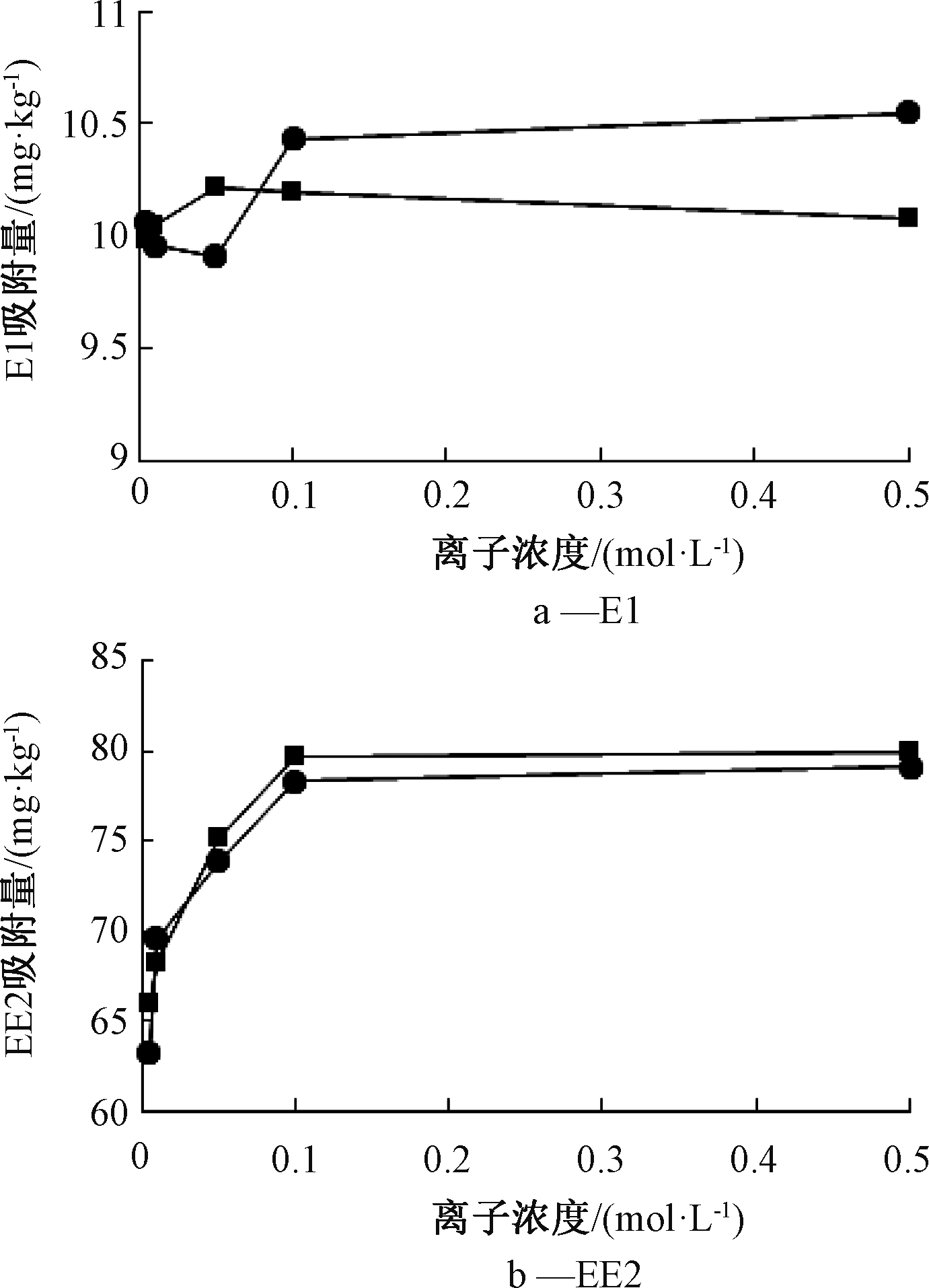
离子浓度对E1和EE2吸附量的影响如图4所示,在离子浓度为0.005~0.5 mol/L时,随着溶液中![]() 与Ca2+浓度的增大,E1在污泥中的吸附量变化趋势不大。由此可见,溶液中Ca2+和
与Ca2+浓度的增大,E1在污泥中的吸附量变化趋势不大。由此可见,溶液中Ca2+和![]() 的存在对E1在污泥中的吸附行为影响较小。而随着溶液中
的存在对E1在污泥中的吸附行为影响较小。而随着溶液中![]() 和c(Ca2+)的增大,EE2在污泥中的吸附量会有显著升高;当离子浓度>0.1 mol/L,EE2的吸附量保持在一个稳定的范围内,此时溶液中
和c(Ca2+)的增大,EE2在污泥中的吸附量会有显著升高;当离子浓度>0.1 mol/L,EE2的吸附量保持在一个稳定的范围内,此时溶液中![]() 和c(Ca2+)的变化对EE2在污泥中吸附量的影响不大,EE2在污泥中的吸附量保持稳定。由此可见,在一定范围内增大溶液中
和c(Ca2+)的变化对EE2在污泥中吸附量的影响不大,EE2在污泥中的吸附量保持稳定。由此可见,在一定范围内增大溶液中![]() 和Ca2+的浓度对EE2在污泥样品中的吸附具有较大的促进作用;超出此范围后,溶液中的
和Ca2+的浓度对EE2在污泥样品中的吸附具有较大的促进作用;超出此范围后,溶液中的![]() 和Ca2+离子浓度对EE2在污泥中的吸附影响较小。这可能是一方面阳离子
和Ca2+离子浓度对EE2在污泥中的吸附影响较小。这可能是一方面阳离子![]() 和Ca2+的加入能够中和部分污泥表面的负电荷,另一方面溶液中正离子浓度的增大可降低污泥中有机质的溶解,从而抑制了污泥对EE2的吸附[3,11]。
和Ca2+的加入能够中和部分污泥表面的负电荷,另一方面溶液中正离子浓度的增大可降低污泥中有机质的溶解,从而抑制了污泥对EE2的吸附[3,11]。
以E1与EE2为研究对象,考察了初始浓度、吸附时间、温度、pH和离子浓度等因素对其在污泥中吸附特性的影响,结论如下:
1)污泥对E1和EE2的吸附是一个动态变化的过程,E1和EE2分别在吸附1 h和15 min时达到最大吸附量,随后发生解吸,分别2 h和1 h后达到吸附-解吸平衡状态。污泥吸附的E1和EE2分别占总量的9.7%~12.6%和85.9~92.2%。污泥对不同初始浓度的E1和EE2吸附效果有明显差异,对EE2的吸附能力大于E1。
2)温度会影响E1和EE2在污泥中的吸附行为。当吸附-解吸平衡后,随着温度的升高,E1在污泥中的吸附量略有提高,而EE2的吸附量有明显的减少。
3)E1在污泥中的最大吸附量随着pH的升高而降低,而在偏碱性条件下,平衡吸附量随着pH的升高而增加。EE2在污泥中的最大吸附量和平衡吸附量随着pH的升高而降低,并且碱性条件下,吸附量有明显下降。
4)离子浓度对EE2在污泥中的吸附影响明显。当离子浓度为0.005~0.1 mol/L时,污泥对EE2的吸附量随着离子浓度的增大而显著升高;当离子浓度>0.1 mol/L时,随着离子浓度的继续增加,污泥对EE2的吸附量保持相对稳定。
[1] 姜鲁,王继华,李建忠,等.炔雌醇和壬基酚在土壤中的吸附-解吸特征[J].环境科学,2012,33(11): 3885-3892.
[2] 马伟芳,陈斌,曾凡刚,等.17β-雌二醇和炔雌醇在土壤中的吸附特性研究[J].环境工程,2014,32(9):109-114.
[3] 岳波,靳青,黄泽春,等. 雌酮在土壤中的吸附特性[J].环境科学研究,2013,26(2):208-213.
[4] 聂亚峰,强志民,张鹤清,等.内分泌干扰物在城市污水处理厂中的行为和归趋:综述[J].环境科学学报,2011,31(7):1352-1362.
[5] 隋倩,黄俊,余刚,等.中国城市污水处理厂内分泌干扰物控制优先性分析[J].环境科学,2009,30(2):384-390.
[6] Manfred C, Birgit S, Emis S, et al. Adsorption of bisphenol-A, 17β-estradiole and 17a-ethinylestradiole to sewage sludge[J]. Chemosphere, 2004, 56(9):843-851.
[7] Lima D L D, Schneider R J, Esteves V I. Sorption behavior of EE2 on soils subjected to different long-term organic amendments[J].Science of the Total Environment, 2012,423(8):120-124.
[8] Bradley P M, Barber L N, Chapelle F H. Biodegradation of 17β-estradiol, Estrone and Testosterone in Stream Sediments[J]. Environmental Science and Technology, 2009, 43(6):1902-1910.
[9] Soares A, Guieysse B, Jefferson B. Nonylphenol in the environment: a critical review on occurrence, fate, toxicity and treatment in wastewaters[J]. Environment International, 2008, 34(7):1033-1049.
[10] 杨莹,王洪臣,刘秀红,等.污水处理过程中17α-乙炔基雌二醇去除的影响因素[J].水处理技术,2016,42(9):22-27.
[11] Burton E D, Phillips I R, Hawker D W, Sorption and desorption behavior of tributyltin with natural sediments[J]. Environmental Science and Technology, 2004, 38(24):6694-6700.