0 引 言
尿液废水含高浓度的氮、磷[1],用鸟粪石(MgNH4PO4·6H2O)沉淀法处理尿液废水,可以实现氨氮和磷的同步回收[2],沉淀物可以作为一种良好的氮磷缓释肥,用于农业生产[3]。然而,尿液废水中仅含有极少量的镁,通常需要投加镁源以实现鸟粪石沉淀。常用的镁源主要是MgCl2、MgSO4等溶解性镁化合物,可以实现氮、磷的高效回收,但是这些镁源也成为鸟粪石沉淀法成本最主要的组成部分之一,不利于技术的推广应用。
很多学者在探索使用廉价镁源进行鸟粪石沉淀。白云石和菱镁矿等矿石可以作为镁源,但是其中的镁是溶解性较低的镁氧化物,利用率较低[4-6]。草木灰虽然可以促进鸟粪石沉淀,但是其重金属浓度较高,会影响鸟粪石农用的安全性[7]。海水是一种有效的廉价镁源,尤其容易在具备条件的海边地区进行使用[8],然而其中镁浓度较低,即便是使用纳滤浓缩后的海水[9]也仅能小幅提升海水浓度,导致使用量大。苦卤是盐场晒盐后的残余液,相比于海水,苦卤水中镁浓度更高,作为镁源可能会更具有技术和经济可行性,但目前尚缺乏相关研究和比较分析。
因此,本文首次比较了海水和苦卤水作为镁源对尿液中氨氮和磷的回收效果,探讨了pH、n(Mg)∶n(P)、反应时间、沉降时间和搅拌转速的影响,分析了鸟粪石产物的基本性质,并综合探讨了海水和苦卤水的回收效果和经济性,以期为鸟粪石沉淀法的发展提供技术支撑。
1 实验部分
1.1 实验材料
海水和苦卤水配制如表1所示,尿液废水详见本团队前期研究[10],因为冲洗水的影响,尿液废水被稀释,![]() 为
为![]() 为150 mg/L。
为150 mg/L。
表1 海水和苦卤水配制组成
Table 1 The composition of the employed seawater and bittern g/L
材料MgCl2·6H2OCaCl2·2H2O海盐NaClKCl海水7.30.9630.000苦卤水210.60.0370157.916.2
1.2 实验过程
设计单因子实验研究pH值(8~11)、n(Mg)∶n(P)(0.7~2)、搅拌速度(50~600 r/min)、反应时间(10~120 min)和沉降时间(10~120 min)对鸟粪石沉淀的影响。在50 mL尿液废水中分别投加2种镁源,调整不同pH值、镁磷比、搅拌转速、反应时间和沉降时间进行鸟粪石沉淀实验,开展单因素实验测定某一因素时,其余因素设定为默认值:pH值、镁磷比、搅拌转速、反应时间和沉降时间的默认值分别为9.5、1、200 r/min、20 min和0 min。
1.3 分析方法
离子强度的计算使用美国地质调查局授权的地质化学计算软件PHREEQC[11]。氨氮和磷酸盐的检测采用中国生态环境部的推荐方法,氨氮的检测采用纳氏试剂分光光度法,磷酸盐的检测采用钼锑抗分光光度法,使用连华科技多参数水质分析仪(5B-3B(V8),兰州连华环保科技有限公司)。使用实验室pH计(Phs-2C,上海智光仪器仪表有限公司)检测pH。采用场发射扫描电子显微镜(SEM,LYRA3,TESCAN,捷克)和X射线衍射仪(XRD,Rigaku TTR-Ⅱ,日本)对鸟粪石沉淀物进行分析。计算氨氮和磷酸盐的去除率时,考虑因为廉价镁源投加导致的体积变化,以便准确地衡量去除效果。
2 结果与讨论
2.1 各影响因素对P去除的影响
2.1.1 pH值
pH值对磷去除效果的影响如图1所示。可知:pH升高可显著提升磷去除率,但是pH过高则会降低磷的去除效果。使用海水为廉价镁源,pH为6时,磷去除率为51.5%,pH升高至11时,磷去除率可提高至98.3%,之后继续升高pH值会导致磷去除率显著下降。而以苦卤水为廉价镁源,pH为7时,磷去除率为46.8%,随着pH的升高磷的去除率显著升高,pH升高至10时,磷去除率为75.2%,之后pH继续升高同样导致磷去除率下降。过饱和度是鸟粪石沉淀的决定性因素[12-13],pH升高会促进![]() 的形成和提高鸟粪石的过饱和度,从而提高磷去除率[14],较为适宜的pH为9~9.5[15],pH过高时,
的形成和提高鸟粪石的过饱和度,从而提高磷去除率[14],较为适宜的pH为9~9.5[15],pH过高时,![]() 浓度降低而NH3浓度升高,降低了鸟粪石过饱和度,同时Mg2+可形成Mg(OH)2沉淀[16],不利于鸟粪石沉淀。
浓度降低而NH3浓度升高,降低了鸟粪石过饱和度,同时Mg2+可形成Mg(OH)2沉淀[16],不利于鸟粪石沉淀。

![]() —海水;
—海水; ![]() —苦卤水。
—苦卤水。
图1 以海水和苦卤水为鸟粪石沉淀法镁源时pH值对
磷去除率的影响
Fig.1 Effect of pH on removal efficiency of phosphate using seawater and bittern as magnesium sources for struvite precipitation
海水作为廉价镁源时,磷的去除效果更好,镁源利用率更高,为98%;而利用苦卤水中镁源时的利用率最高仅为75%。通过鸟粪石沉淀平衡时的离子积即溶度积公式分析其原因,如式(1)所示:
Ksp=γMgCMg·γNCN·γPCP
(1)
式中:γMg、γN、γP分别为![]() 的活度系数;CMg、CN、CP分别为
的活度系数;CMg、CN、CP分别为![]() 的浓度,mol/L。使用PHREEQC软件计算得出海水和苦卤水作为镁源时混合液的离子强度分别为0.658,0.717 mol/L。根据式(1),使用苦卤水时,离子强度增大,活度系数减小,化学平衡时的磷酸盐浓度增大,从而降低了磷的去除效果,导致了镁利用率降低。
的浓度,mol/L。使用PHREEQC软件计算得出海水和苦卤水作为镁源时混合液的离子强度分别为0.658,0.717 mol/L。根据式(1),使用苦卤水时,离子强度增大,活度系数减小,化学平衡时的磷酸盐浓度增大,从而降低了磷的去除效果,导致了镁利用率降低。
2.1.2 n(Mg)∶n(P)
n(Mg)∶n(P)对磷去除率的影响如图2所示。可知:n(Mg)∶n(P)升高有助于磷的去除。以海水为镁源时,镁磷比从0.7升高至1.1时,磷去除率从72.6%升高至96.3%,之后镁磷比继续升高,磷去除率可接近100%。以苦卤水为镁源时,镁磷比为0.7时,磷去除率仅为20.4%,镁磷比升高至1.5时,磷去除率为98.2%,同样继续升高镁磷比几乎可以去除全部磷酸盐。结果表明,去除等量的磷酸盐,需要的更多苦卤水镁源。鸟粪石中理论![]() 为1∶1∶1[12],n(Mg)∶n(P)>1之后,因为镁过量影响过饱和度[13],使得容易形成Mg3(PO4)2沉淀[16],不但会降低氨氮回收率,而且会导致沉淀产物中鸟粪石纯度降低[17],但是苦卤水中的镁利用率相对较低,仅约75%,反应体系中实际n(Mg)∶n(P)为1.1,因此不会生产大量的Mg3(PO4)2沉淀。
为1∶1∶1[12],n(Mg)∶n(P)>1之后,因为镁过量影响过饱和度[13],使得容易形成Mg3(PO4)2沉淀[16],不但会降低氨氮回收率,而且会导致沉淀产物中鸟粪石纯度降低[17],但是苦卤水中的镁利用率相对较低,仅约75%,反应体系中实际n(Mg)∶n(P)为1.1,因此不会生产大量的Mg3(PO4)2沉淀。
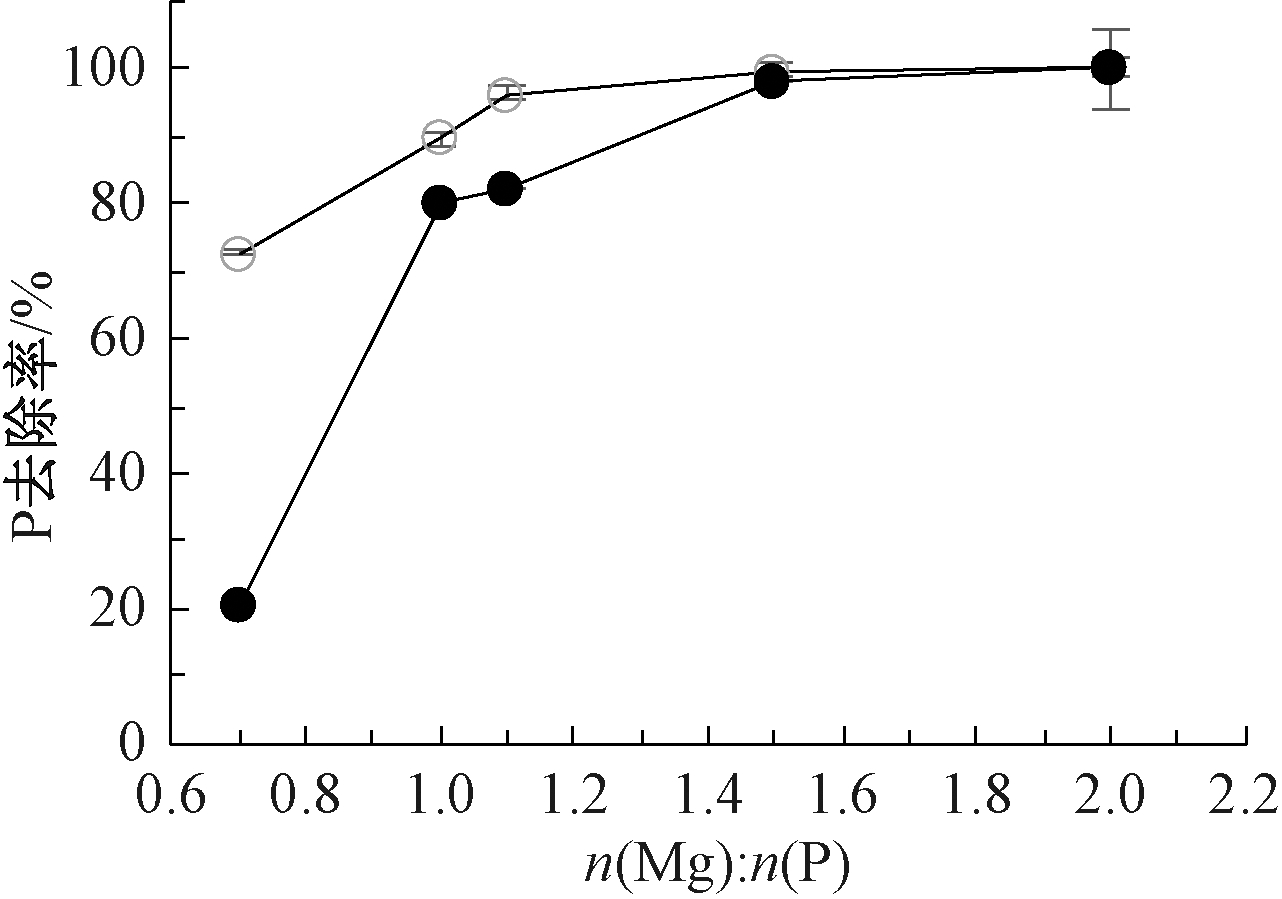
![]() —海水;
—海水; ![]() —苦卤水。
—苦卤水。
图2 以海水和苦卤水为鸟粪石沉淀法镁源时n(Mg)∶n(P)对磷去除率的影响
Fig.2 Effect of Mg∶P molar ratio on removal efficiency of phosphate using seawater and bittern as magnesium sources for struvite precipitation
2.1.3 搅拌转速
搅拌转速对磷去除效果的影响如图3所示。可知:海水作为镁源,转速为50 r/min时,磷去除率为32.3%,随着转速上升,磷去除率也显著增加,在200 r/min 时磷去除率达到97.9%,当转速继续升高,磷去除率略微下降。以苦卤水为镁源,转速从50 r/min 升高至100 r/min时,磷去除率由52.0%升高至74.2%,继续提高转速,磷去除率无显著变化。分析认为:搅拌可以加快溶液中离子的扩散速率,提高离子碰撞概率,增加成核和晶体生长速率[18],有利于鸟粪石沉淀的发生[19]。搅拌转速过高,不但会形成大量晶核,而且影响鸟粪石沉淀的团聚,不利于大尺寸鸟粪石的生成[18, 20],因此,海水和苦卤水作为镁源时,可以分别选择转速为200,100 r/min。
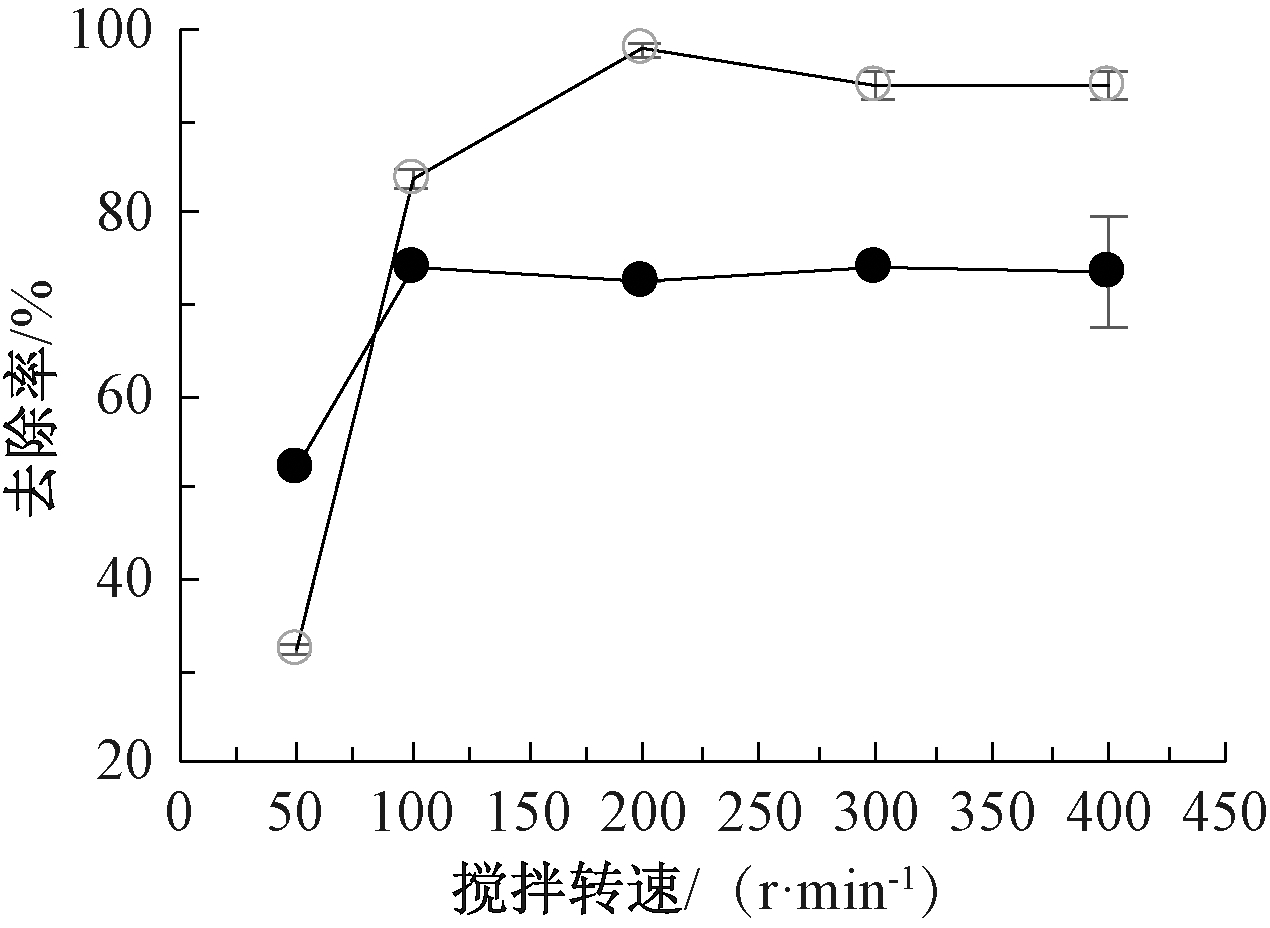
![]() —海水;
—海水; ![]() —苦卤水。
—苦卤水。
图3 以海水和苦卤水为鸟粪石沉淀法镁源时转速对
磷去除率的影响
Fig.3 Effect of stirring speed on removal efficiency of phosphate using seawater and bittern as magnesium sources for struvite precipitation
2.1.4 反应时间和沉降时间
鸟粪石沉淀过程中,不同反应时间对磷去除率如图4所示。可知:磷去除率随着反应时间的延长而逐渐升高,海水作为镁源时,40 min后磷去除率基本稳定,可达96%以上;苦卤水作为镁源时,磷去除率在20 min后稳定在70%以上。虽然使用苦卤水时磷去除率相对较低,但是反应达到平衡的时间更短,反应更快。反应时间即为鸟粪石沉淀达到化学平衡时的时间,取决于鸟粪石沉淀过程中的成核和晶体成长速率[20],受到过饱和度的影响,在较低的过饱和度时,甚至可能需要3个月才能达到化学平衡[21]。
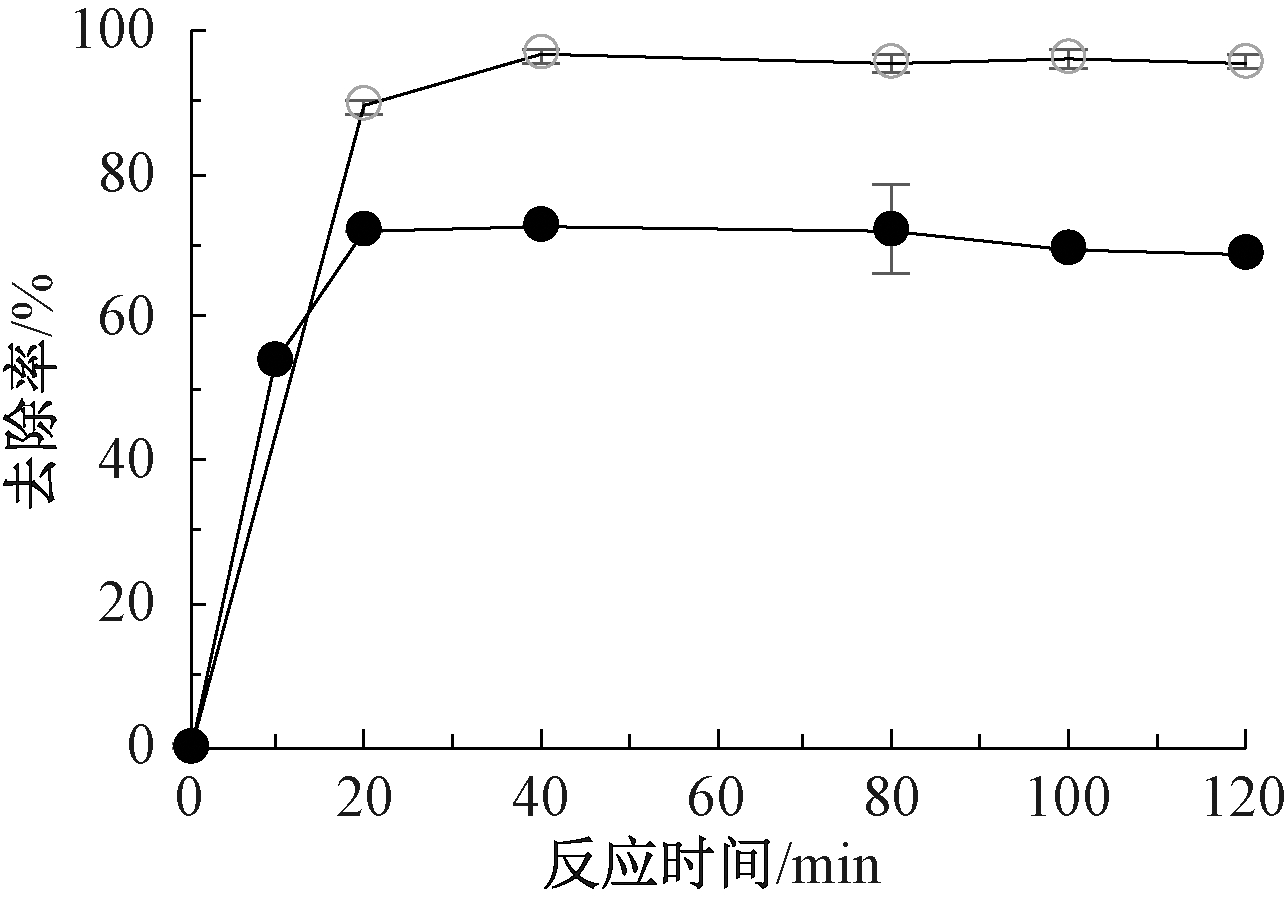
![]() —海水;
—海水; ![]() —苦卤水。
—苦卤水。
图4 以海水和苦卤水为鸟粪石沉淀法镁源反应时间对
磷去除率的影响
Fig.4 Effect of reaction time on removal efficiency of phosphate using seawater and bittern as magnesium sources for struvite precipitation
在沉降试验的4 h内,取样6次测试了磷去除率,海水和苦卤水分别作为镁源,磷去除率的平均值分别为96.2%和69.2%,虽然磷去除率略有变化,但是相对误差在5%以内,因此,沉降时间对磷去除率的影响可以忽略不计。取100 mL沉淀产物在量筒内进行沉降特性的分析,结果如图5所示。可知:以海水和苦卤水为镁源所得到的沉淀产物沉降特性没有显著差异,泥浆体积随着沉降时间的推进而逐渐缩小,在沉降初期的4 h内,沉淀产物以平均17~18 mL/h 的速率直线下降至约30 mL;之后,沉淀产物的下降速度降至0.25~0.35 mL/h,沉淀产物稳定在约26 mL。本实验中的鸟粪石体积系数较大,约为1733 mL/g,远低于文献[22]中鸟粪石的体积系数(44 mL/g),这表明无论是使用海水还是苦卤水作为镁源,其鸟粪石产物的沉降特性都不如使用溶解性镁源获得的鸟粪石。
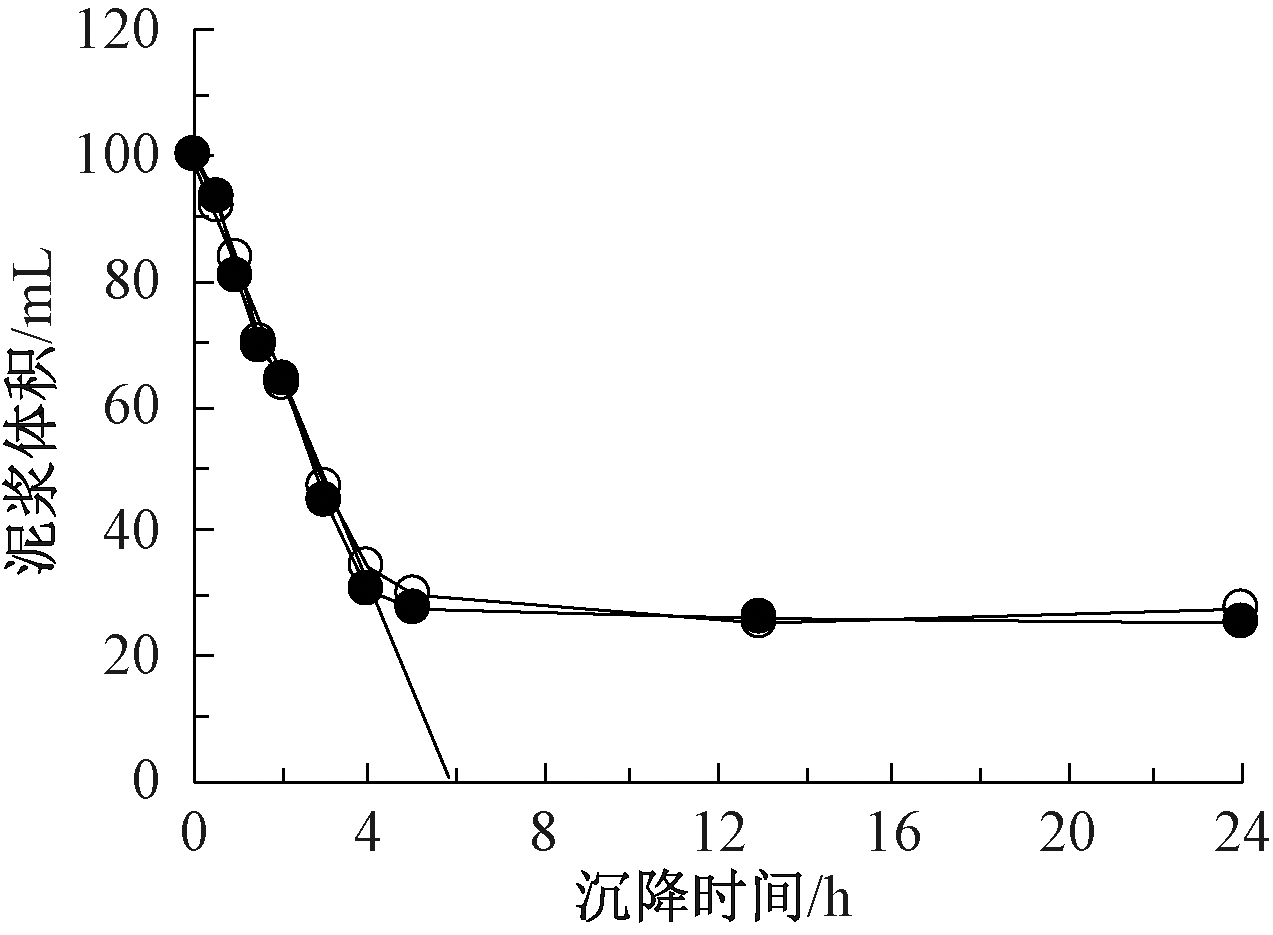
![]() —海水(y=-16.8370x+98.9200,R2=0.9906);
—海水(y=-16.8370x+98.9200,R2=0.9906); ![]() —苦卤水(y=-17.7605x+99.5180,R2=0.9928)。
—苦卤水(y=-17.7605x+99.5180,R2=0.9928)。
图5 海水和苦卤水为鸟粪石沉淀法镁源时沉淀产物的沉降特性
Fig.5 The settlement characteristics of precipitates by using seawater and bittern as magnesium sources for struvite precipitation
2.2 沉淀产物的特性分析
图6展示了pH值为9、n(Mg)∶n(P)为1、转速为200 r/min、反应时间为10 min和沉降时间为0时,以海水和苦卤水分别作为廉价镁源的沉淀产物电镜图,所得鸟粪石产物较为类似,主要为长10~20 μm的斜方状晶体,与文献[14]报道中的鸟粪石晶体相似,不同的是海水作为镁源时,沉淀产物中含有较多细晶,这种细晶可能是碳酸镁钙沉淀物[8],与反应体系中存在钙杂质和![]() 有关。沉淀产物的XRD衍射谱图(图6c—d)与鸟粪石标准谱图[23]相比,特征峰出峰角度相同,这表明沉淀产物主要成分为鸟粪石,但峰的强弱稍有差异,可能是因为沉淀产物中存在其他杂质。
有关。沉淀产物的XRD衍射谱图(图6c—d)与鸟粪石标准谱图[23]相比,特征峰出峰角度相同,这表明沉淀产物主要成分为鸟粪石,但峰的强弱稍有差异,可能是因为沉淀产物中存在其他杂质。
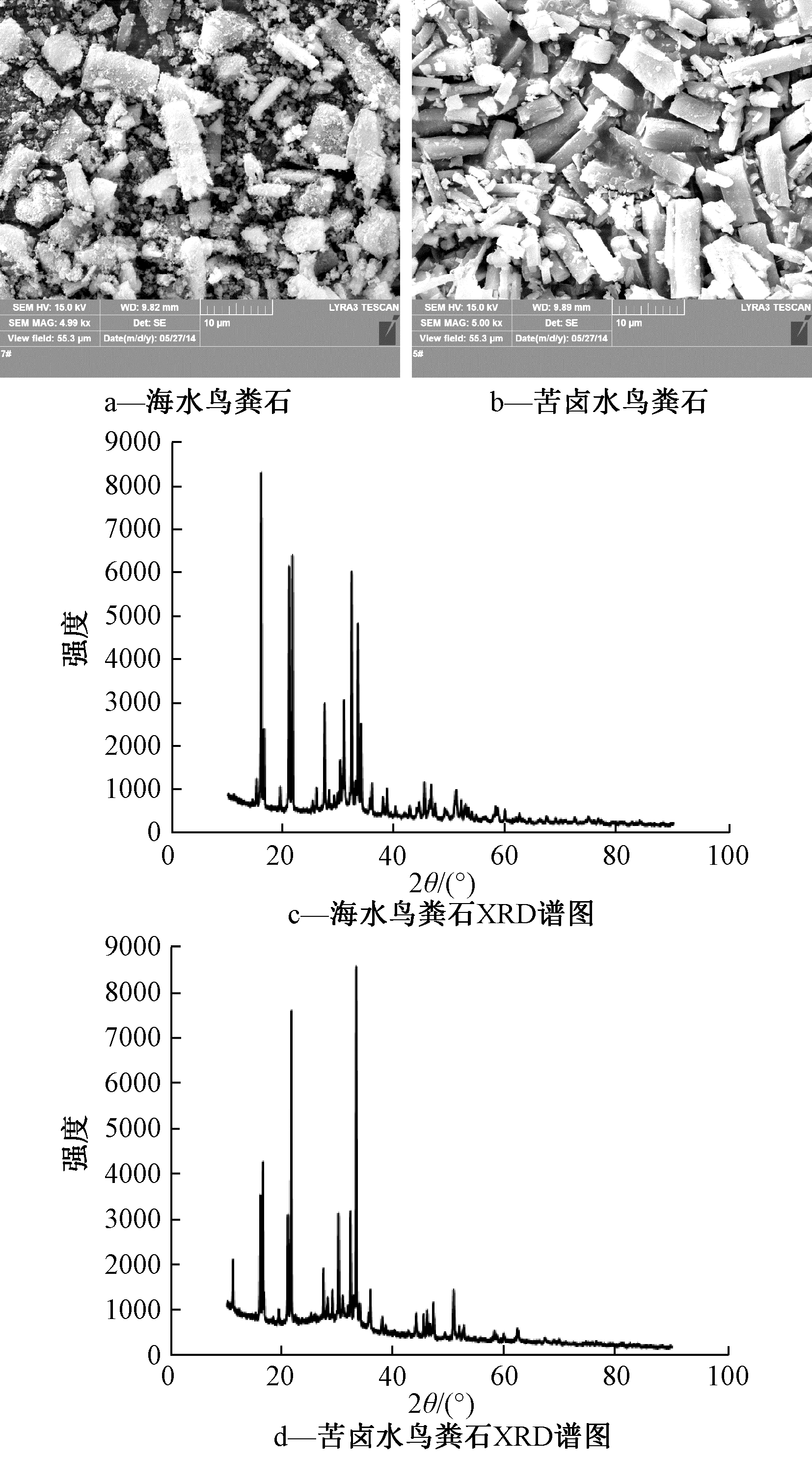
图6 海水和苦卤水为鸟粪石沉淀法镁源所产生的
沉淀物电镜图和XRD谱图
Fig.6 SEM photos and XRD patterns of precipitates using seawater and bittern as magnesium sources for struvite precipitation
2.3 廉价镁源比较分析
以磷去除率为95%计,常用的溶解性镁源(MgCl2·6H2O)、海水和苦卤水的投加量分别为4.3 kg/m3、0.59 m3/m3和0.03 m3/m3。根据中国化工网(www.china.chemnet.com)和中国化工产品网(www.chemcp.com)相关报价,市售工业MgCl2单价为330~950元/t,以平均值估算尿液废水中磷去除的氯化镁试剂购置成本为2.8元/m3。海水资源丰富,而苦卤水则是海盐工业中的废弃物,基本无购买成本,虽然海水作为镁源时镁的利用率较高,但是,海水投加量约为苦卤水的20倍,这将导致海水输送成本,也不利于鸟粪石沉淀法中的设备运行操作。相比较而言,苦卤水的投加量较小,在pH为9且n(Mg)∶n(P)为1.5条件下,可实现98%以上的磷去除,同时产物中鸟粪石纯度更高,因此,苦卤水是一种适宜的廉价镁源。
3 结 论
海水和苦卤水作为镁源均可实现尿液废水中磷的高效去除,去除率均可达到96%以上。沉淀产物主要是鸟粪石,海水作为镁源存在少量碳酸镁钙杂质,苦卤水作为镁源得到的产品杂质含量较少。海水作为镁源时反应体系中的离子强度较小,使得镁利用率可达到98%,相比之下,苦卤水中镁的利用率仅为75%,但是,苦卤水中镁浓度更高,投加量仅为海水的5%。因此,苦卤水作为一种廉价镁源可以实现尿液废水中磷的高效回收,这有助于降低鸟粪石沉淀法的运行成本,利于技术推广应用,今后需要进一步在中试规模上实现设备化,并开展全面的经济性分析。
[1] Larsen T A, Hoffmann S, Luthi C, et al. Emerging solutions to the water challenges of an urbanizing world[J]. Science, 2016, 352(6288): 928-933.
[2] 郝晓地,衣兰凯,仇付国. 源分离技术的国内外研发进展及应用现状[J]. 中国给水排水, 2010,26(12): 1-7.
[3] 郝晓地,王崇臣,金文标. 磷危机概观与磷回收技术[M]. 北京: 高等教育出版社, 2011.
[4] 魏金山,刘雪瑜,宋永会,等. 氧化镁与白云石石灰对不同来源废水中磷的回收效果[J]. 环境科学研究, 2015,28(11): 1734-1740.
[5] Yu R T, Ren H Q, Wu J C, et al. A novel treatment processes of struvite with pretreated magnesite as a source of low-cost magnesium[J]. Environmental Science and Pollution Research International, 2017,24(28):22204-22213.
[6] Krähenbühl M, Etter B, Udert K M. Pretreated magnesite as a source of low-cost magnesium for producing struvite from urine in nepal[J]. Science of the Total Environment, 2016, 542(SIB): 1155-1161.
[7] Sakthivel S R, Tilley E, Udert K M. Wood ash as a magnesium source for phosphorus recovery from source-separated urine[J]. Science of the Total Environment, 2012, 419(1): 68-75.
[8] Liu B X, Giannis A, Zhang J F, et al. Characterization of induced struvite formation from source-separated urine using seawater and brine as magnesium sources[J]. Chemosphere, 2013, 93(11): 2738-2747.
[9] Lahav O, Telzhensky M, Zewuhn A, et al. Struvite recovery from municipal-wastewater sludge centrifuge supernatant using seawater nf concentrate as a cheap Mg(Ⅱ) source[J]. Separation and Purification Technology, 2013, 108: 103-110.
[10] Xu K N, Wang C W, Wang X X, et al. Laboratory experiments on simultaneous removal of K and P from synthetic and real urine for nutrient recycle by crystallization of magnesium-potassium-phosphate-hexahydrate in a draft tube and baffle reactor[J]. Chemosphere, 2012, 88(2): 219-223.
[11] Parkhurst D L, Appelo C A J. User’s guide to phreeqc (version 2)-a computer program for speciation, batch-reaction, one-dimensional transport, and inverse geochemical calculations[M]. U.S. Geological Survey, 1999.
[12] Ronteltap M, Maurer M, Gujer W. Struvite precipitation thermodynamics in source-separated urine[J]. Water Research, 2007, 41(5): 977-984.
[13] Adnan A, Koch F A, Mavinic D S. Pilot-scale study of phosphorus recovery through struvite crystallization-ii: applying in-reactor supersaturation ratio as a process control parameter[J]. Journal of Environmental Engineering and Science, 2003, 2(6): 473-483.
[14] 郭五珍,王宇珊,叶挺进,等. 动态中温厌氧消化液进行鸟粪石回收磷的试验研究[J]. 中国给水排水, 2016, 32(15): 57-61.
[15] Tao W D, Fattah K P, Huchzermeier M P. Struvite recovery from anaerobically digested dairy manure: a review of application potential and hindrances[J]. Journal of Environmental Management, 2016, 169: 46-57.
[16] Xu K, Li J, Zheng M, et al. The precipitation of magnesium potassium phosphate hexahydrate for P and K recovery from synthetic urine[J]. Water Research, 2015, 80: 71-79.
[17] 仇付国,孙瑶,陈丽霞. 活性污泥促进尿液水解回收鸟粪石研究[J]. 中国给水排水, 2015, 31(13): 85-89.
[18] Zhang C, Xu K, Zheng M, et al. Factors affecting the crystal size of struvite-k formed in synthetic urine using a stirred reactor[J]. Industrial & Engineering Chemistry, 2018, 57: 17301-17309.
[19] 邓玉君,叶志隆,叶欣,等. 流化床造粒法回收猪场废水中氮磷:鸟粪石颗粒的形貌与组成[J]. 环境工程学报, 2016(6): 2933-2939.
[20] Ronteltap M, Maurer M, Hausherr R, et al. Struvite precipitation from urine-influencing factors on particle size[J]. Water Research, 2010, 44(6): 2038-2046.
[21] Hao X D, Wang C C, van Loosdrecht M C M, et al. Looking beyond struvite for P-recovery[J]. Environmental Science & Technology, 2013, 47(10): 4965-4966.
[22] Wilsenach J A, Schuurbiers C A H, van Loosdrecht M C M. Phosphate and potassium recovery from source separated urine through struvite precipitation[J]. Water Research, 2007, 41(2): 458-466.
[23] Xu K N, Wang C W, Liu H Y, et al. Simultaneous removal of phosphorus and potassium from synthetic urine through the precipitation of magnesium potassium phosphate hexahydrate[J]. Chemosphere, 2011, 84(2): 207-212.