0 引 言
挥发性有机物(volatile organic compounds,VOCs)种类繁多,包括烷烃、烯烃、醇、醛、酮、酯等,是形成PM2.5和近地表O3的重要前体物[1-3]。采用催化氧化技术,可在250~500 ℃内将VOCs分解为CO2、H2O等[4-5],适用于不具备回收价值的VOCs废气处理,具有能耗低、处理效率高的特点。催化剂是催化氧化法的核心,提高催化剂的活性、选择性和稳定性,同时降低催化剂成本,是VOCs催化研究领域的热点。
铂、钯等商用贵金属催化剂活性高[6-7],但其应用范围受限于高昂的成本。此外,贵金属催化剂在含氯VOCs(CVOCs)的催化氧化过程中会出现多氯代副产物,其毒性更大[8]。过渡金属d轨道不饱和,容易与反应物分子发生作用,具有较好的催化能力。大量研究表明,过渡金属,如Mn、Co、Cu、Ce、V等的氧化物,在VOCs的催化氧化中也有较好的表现[9-23]。其中,Mn、Co、Cu等过渡金属氧化物的氧化能力强,对于常见VOCs的完全转化温度(T100)通常<300 ℃[9-15];CeO2具备较好的储存晶格氧的能力,当与其他过渡金属组分掺杂时,可以提高催化剂的氧化还原性,进而提高催化剂的整体活性[24-26];V2O5抗氯中毒能力强,对CVOCs如氯苯的催化活性和稳定性较好[27-28]。在上述过渡金属氧化物催化剂中,锰氧化物氧化能力强,CO2选择性高,且晶型、价态、形貌可调,具备替代贵金属的潜力。
然而,锰氧化物作为VOCs催化氧化催化剂也存在一定的缺陷。例如,高温焙烧会明显减少催化剂的比表面积,使反应界面缩小,甚至改变锰氧化物结构[21]。在CVOCs催化氧化过程中,由于催化剂表面氯化,导致催化剂失活[29-30]。在这方面,也有一些研究提出了改善锰氧化物催化剂上述缺陷的方法。
目前,锰氧化物催化剂应用于VOCs催化氧化已有大量报道,但缺少对于研究结果的总结。因此,本文主要针对锰氧化物催化剂对VOCs的催化性质进行综述,包括单一锰氧化物催化剂和复合锰氧化物催化剂,分析了影响催化剂性能的主要因素及催化反应特点。此外,对于锰氧化物催化剂在CVOCs催化氧化过程中出现的失活现象及机制进行了探讨,并分析了提高其抗氯中毒能力的方法。
1 单一锰氧化物催化剂
锰元素具有+2、+3、+4、+7等多种价态,常见的锰氧化物为MnO、Mn3O4、Mn2O3、MnO2等[31]。其中,MnO容易被氧化,Mn3O4、Mn2O3、MnO2在VOCs催化氧化条件下可以稳定存在。
MnO2的基本结构单元是[MnO6]八面体,不同晶型MnO2中[MnO6]八面体通过共棱或共角的方式排布。常见的MnO2晶体结构有α、β、γ、δ、λ等,其结构如图1所示。可知:α-、β-、γ-MnO2具有一维孔道结构,δ-MnO2为二维层状结构,λ-MnO2为三维尖晶石结构,其中α-MnO2、δ-MnO2分别具有[2×2]和[2×1]孔道,而γ-MnO2层与层之间能够发生移动,均可以容纳阳离子。
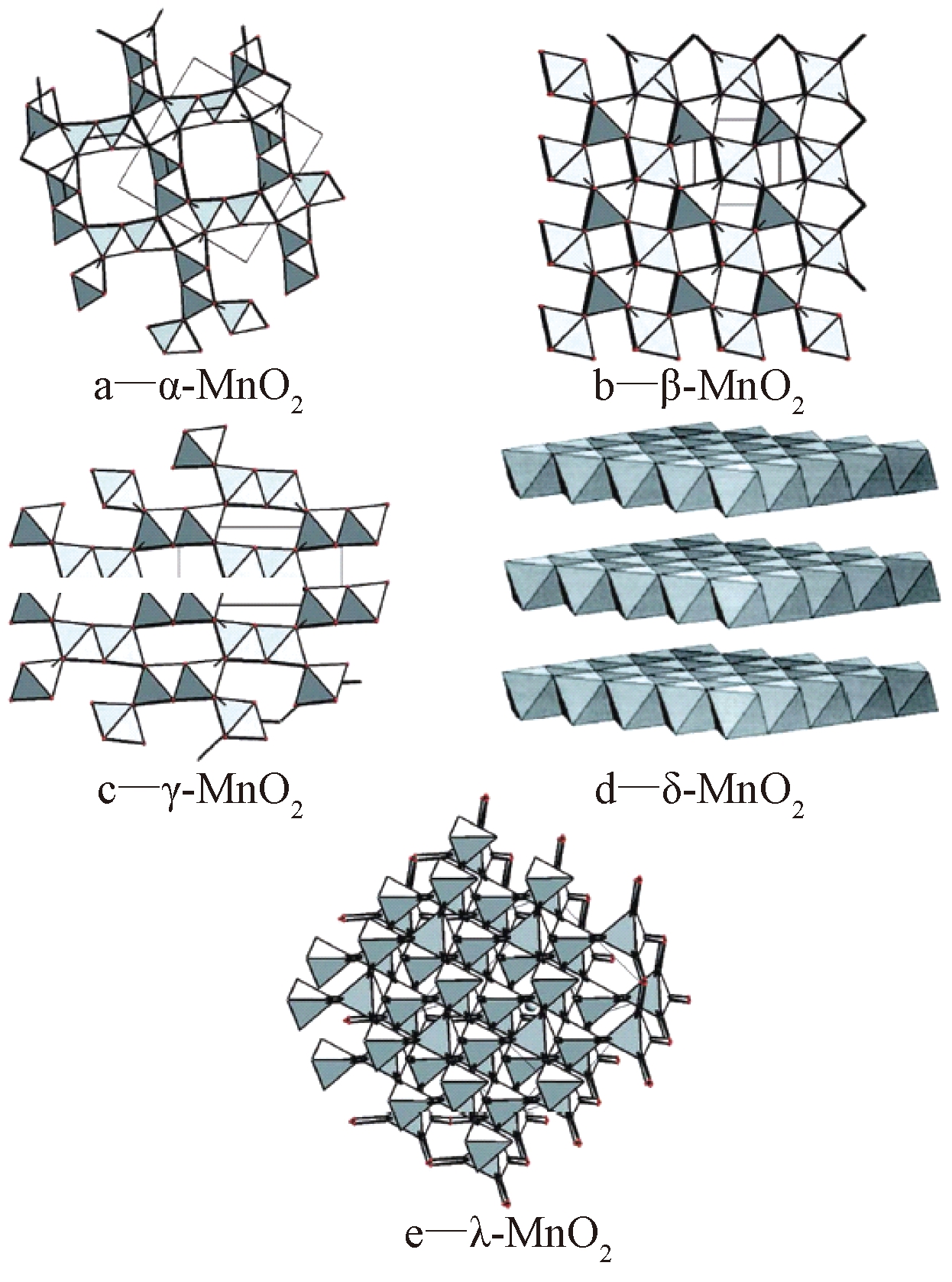
图1 MnO2晶体结构
Fig.1 Different crystal structures of MnO2
不同晶型MnO2的催化氧化性质不同。Xie等[32]采用水热法分别合成α-,β-,γ-,δ-MnO2,并研究其对于丙烷的催化氧化。结果表明:4种晶型MnO2对丙烷的催化活性顺序为α-MnO2≈γ-MnO2>β-MnO2>δ-MnO2,其中丙烷在α-MnO2、γ-MnO2上的90%转化温度(T90)<300 ℃。由于制备得到的MnO2比表面积显著不同(α-,β-,γ-,δ-MnO2分别为33.2,8.4,64.3,141 m2/g),而通过密度泛函数理论(DFT)计算得到的丙烷与MnO2表面吸附能的规律为α(310)>γ(120)>β(110)>δ(001),因此作者认为MnO2对丙烷吸附能力的强弱是影响其催化活性的重要因素。
Wang等[33]合成出棒状、线状、管状以及花状的锰氧化物(图2),并比较了这些结构对甲苯催化氧化活性的影响。不同形貌的锰氧化物催化氧化活性顺序为棒状α-MnO2>管状α-MnO2>花状Mn2O3>线状α-MnO2。作者认为催化剂的催化氧化活性与材料的晶体结构中缺陷位数量、表面吸附氧浓度、氧化还原性能、比表面积和形貌结构等因素有关,其中棒状α-MnO2表面吸附氧浓度高,低温还原性能好,因此其催化氧化活性高。
Hou等[20]采用水热氧化还原法制备了具有可调氧空位缺陷浓度的α-MnO2纳米棒,并对其进行了苯的催化氧化研究。结果表明:随着合成温度由70 ℃升高至180 ℃,α-MnO2纳米棒的比表面积逐渐下降,由76.8 m2/g下降至30.6 m2/g。同时表面Mn3+/Mn4+的比例逐渐由3.1下降至1.0,说明α-MnO2纳米棒中表面缺陷位减少。Raman表征结果表明,表面缺陷位可以弱化Mn—O键能,从而增强晶格氧的活

图2 棒状α-MnO2、线状α-MnO2、管状α-MnO2、花状Mn2O3的SEM图[33]
Fig.2 SEM images of rod-like MnO2, wire-like MnO2, tube-like MnO2 and flower-like Mn2O3[33]
性。α-MnO2纳米棒对于苯有良好的催化氧化性能,其中OMS-70(水热温度70 ℃得到的α-MnO2纳米棒)与0.5%Pt/Al2O3催化剂的活性接近。而OMS-70催化剂的单位比表面积上的催化氧化速率明显高于OMS-90和OMS-180,表明OMS-70催化剂的高活性是由于表面氧空位缺陷多,晶格氧活性强引起的。
Hou等[34]采用水热法制备了不同K+浓度掺杂的OMS-2催化剂(属于α-MnO2),并考察了其对苯的催化氧化性能,随着K+掺杂比例的升高,OMS-2的催化氧化活性逐渐升高,可与Pt贵金属的催化氧化活性相当。BET和XPS的结果表明,随着K+浓度升高,OMS-2催化剂比表面积增大,Mn3+/Mn4+比例升高。CO-TPR的结果(图3)显示,随着掺杂K+浓度的升高,最低温度峰值(TL)和最高温度峰值(TH)分别向低温区移动,表明K+掺杂进入OMS-2的孔道可以显著增强晶格氧的活性,从而增强OMS-2催化剂的催化氧化活性。
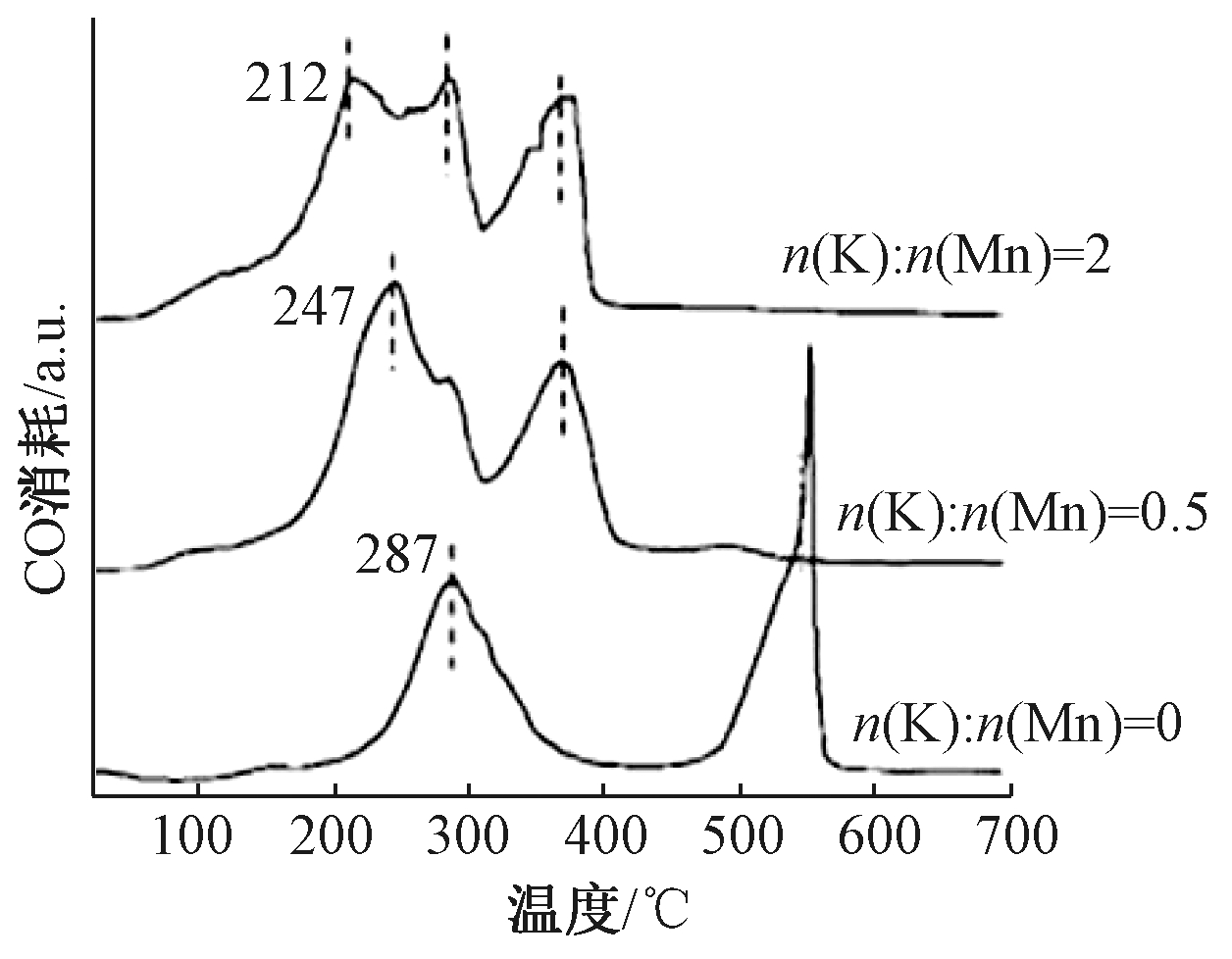
图3 OMS-2催化剂的CO-TPR谱图[34]
Fig.3 CO-TPR profiles of OMS-2 nanorods[34]
对于其他晶型的锰氧化物催化氧化VOCs也有研究报道。Kim等[19]采用Mn3O4、Mn2O3和MnO2对甲苯、苯的催化氧化结果得到Mn3O4>Mn2O3>MnO2的规律,认为主要是因为Mn3O4的氧移动性强、比表面积大。此外,MnO2的活性最差,可能是因为采用直接购买的试剂材料进行活性评价,其中MnO2的比表面积很小。Piumetti等[22]采用溶液燃烧法制备了Mn2O3、Mn3O4和MnxOy(Mn2O3和MnO2的混合物)3种介孔锰氧化物催化剂,研究表明:Mn3O4对乙烯、丙烯和甲苯及其混合物都具有良好的催化燃烧活性,对于以上3种VOCs的混合物,Mn3O4能在250 ℃时达到90%的转化率。此外,不同价态的锰氧化物具有不同的氧化还原性质,其中,Mn3O4表面具有较多的亲电氧以及表面缺陷,这些表面缺陷导致Mn3O4催化剂上存在大量的Brønsted酸性位点和Mnn+ Lewis酸性位点,这些酸性位点在催化氧化过程中起重要作用。
Li等[35]采用回流法制备了α-MnO2催化剂,研究晶格氧和Lewis酸对α-MnO2催化氧化乙醇的作用。结果表明:乙醇通过破坏O—H键,在催化剂的Lewis酸位形成乙醇盐物种,从而吸附在催化剂表面。α-MnO2在缺少O2的条件下,利用晶格氧可以将部分被吸附的乙醇氧化成乙醛和甲醛,即通过Mars-Van Krevelen机理进行,具体反应过程如图4所示。假设乙醇通过捐赠羟基中氧原子的单个电子对在OMS-2表面生成乙醇盐,从而吸附在Lewis酸位,吸附的乙醇盐物种经过α-C—H和β-C—H键断裂相继形成乙醛和甲醛。如果乙醇盐中α-C的氢原子被晶格氧攻击,β-C相对带负电,向邻近Lewis酸位聚集,这时电子云转移到Mn4+上,该过程能够弱化并破坏乙醇盐中的C—C键,生成中间产物甲醛。同理,若β-C的氢原子被晶格氧攻击,α-C相对带负电,电子云趋向转移到氧原子上,生成中间产物乙醛。
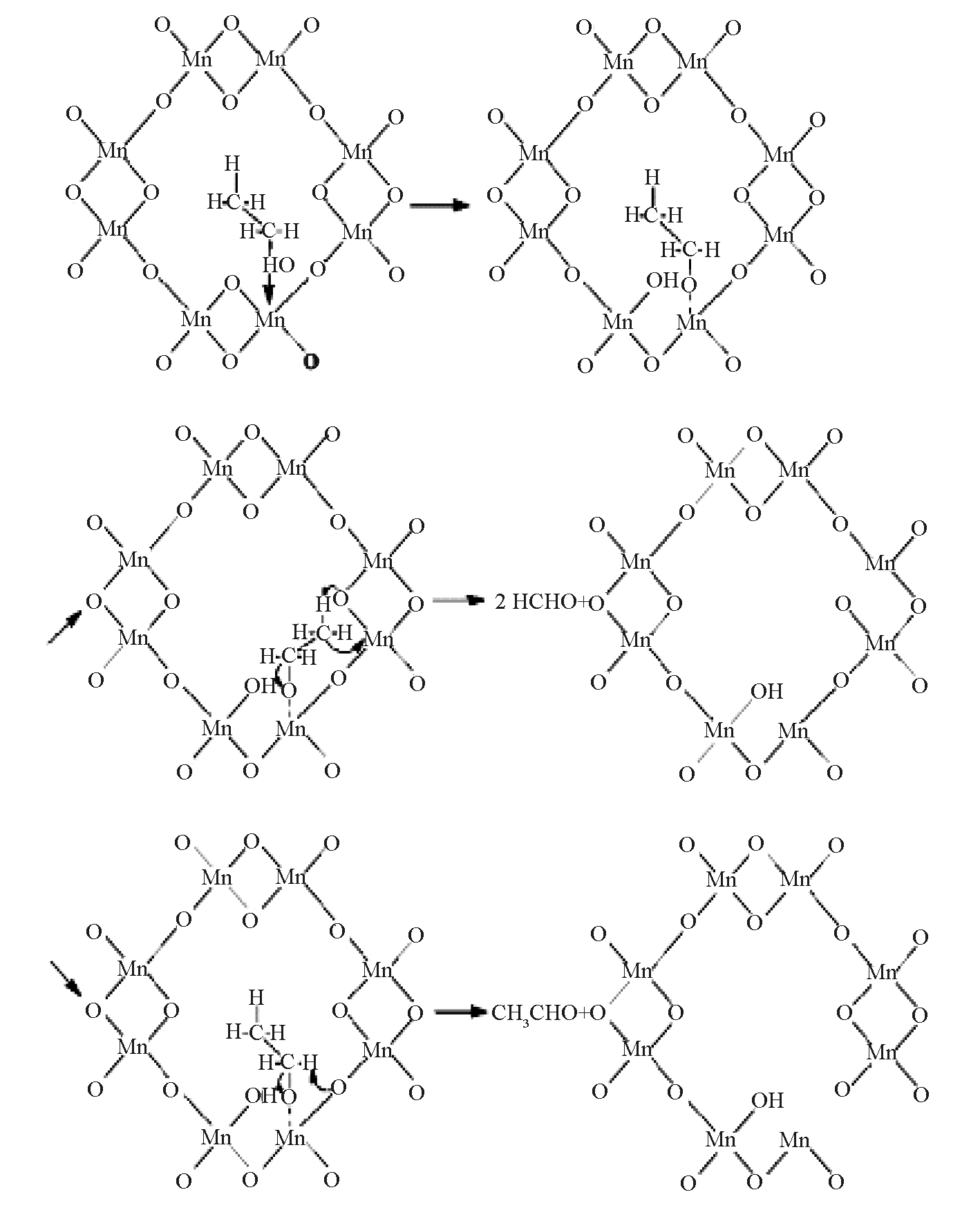
图4 OMS-2在O2缺少条件下的反应路径及化学结构[35]
Fig.4 Proposed reaction pathways in the absence of oxygen in terms of OMS-2 chemical structures[35]
文献报道的部分单一锰氧化物催化剂的研究成果如表1所示。整体来讲,影响单一锰氧化物活性的因素较多,但总体上MnO2的催化氧化活性更好。锰氧化物催化剂在催化氧化VOCs的过程中遵循Mars-Van Krevelen机理,即VOCs物种首先吸附在催化剂表面,被表面的晶格氧氧化,随后形成的氧空位被气相O2补充。总的来说,催化剂具有更大的比表面积、更多的缺陷位,以及更好的氧化还原性,通常意味着具有更高的催化氧化活性。
2 复合锰氧化物催化剂
2.1 MnMOx(M=Ce、Cu、Co)
Delimaris等[40]采用尿素燃烧法合成了MnOx-CeO2催化剂,并用于乙醇、乙酸乙酯和甲苯的催化氧化。结果表明:Mn原子可以均匀嵌入CeO2的晶格中,仅当Mn与Ce比例达到3∶1时催化剂表面出现Mn3O4,与MnOx相比,MnOx-CeO2催化剂可以在更低的温度下被H2还原,且Mn的存在促进了CeO2的还原。此外,MnOx-CeO2催化剂的比表面积较单一,MnOx和CeO2均显著增大(MnOx为10.3 m2/g,而MnOx-CeO2催化剂为30~60 m2/g),虽然单位比表面积活性低于MnOx,但催化剂的总体活性得到提高。
表1 单一锰氧化物催化剂催化氧化VOCs的近期研究成果[31]
Table 1 Recent research progress of catalytic oxidation of VOCs over single manganese oxide catalysts[31]

催化剂VOCs空速VOCs转化温度/℃来源γ-MnO2125×10-6n-hexane7200h-1180(100%)[36]Mn3O41000×10-6ethylene19100h-1265(100%)[22]Mn3O41000×10-6propylene19100h-1250(100%)[22]Mn3O41000×10-6toluene19100h-1280(100%)[22]α-MnO2700×10-6o-xylene8000h-1220(100%)[37]MnO21000×10-6toluene20000h-1270(100%)[38]Mn3O4100×10-6toluene15000mL/(g·h)270(90%)[19]Mn2O3100×10-6toluene15000mL/(g·h)295(90%)[19]MnO2100×10-6toluene15000mL/(g·h)375(90%)[19]MnOx1000×10-6ethanol16000h-1215(100%)[18]MnOx1000×10-6ethylace-tate16000h-1213(100%)[18]MnOx1000×10-6toluene16000h-1283(100%)[18]Mn/SBA-15315×10-6ethylacetate120000mL/(g·h)277(100%)[39]
Chen等[41]采用氧化还原共沉淀法合成了Mn3Ce1Ox催化剂(n(Mn)∶n(Ce)为3∶1),并将其与沉淀法、机械混合法以及单独MnOx和CeO2的催化性质进行了对比。结果表明:由于Mn和Ce的溶度积不同,沉淀法制备的Mn3Ce1Ox催化剂存在前驱体先后沉淀的问题,形成了Mn包覆Ce的结构;而氧化还原共沉淀法得到的Mn3Ce1Ox催化剂中Mn与Ce形成了固溶体,催化剂晶粒较小、比表面积更大,对甲苯的催化活性更高。
Zhang等[13]采用草酸作为沉淀剂,通过共沉淀法制备了不同Co、Mn原子比的CoMnOx催化剂,发现Co2Mn1Ox催化剂性能最好,继而在300~700 ℃内研究了焙烧温度对于Co2Mn1Ox催化剂性能的影响。结果表明:Co2Mn1Ox催化剂在<500 ℃焙烧时形貌为纳米片,当焙烧温度>600 ℃时为球状。提高焙烧温度使催化剂的晶粒尺寸增加、氧化还原性变差,且降低了催化剂的比表面积,对催化活性有不利影响。
Hu等[42]通过表面活性剂共沉淀法合成了CuMnCeOx催化剂,研究Cu掺杂对MnCeOx催化剂(n(Mn)∶n(Ce)为1∶1)的影响。Cu的引入促进Mn进入CeO2晶格形成固溶体,而Cu则倾向于以无定形态CuO形式存在,Cu掺杂增大了催化剂的比表面积,当Cu与Mn比例为1∶5时催化剂表面Mn4+和表面氧含量最多,且催化剂氧化还原性最好,同时也表现出最好的活性。
综上,采用其他过渡金属与Mn进行掺杂,催化剂的比表面积得到提高,且催化剂的氧化还原性得到增强。一般而言,上述性质的改变带来催化剂的总体活性的提升。但催化剂的构效关系是十分复杂的,对于Mn的掺杂改性可能涉及催化剂对反应物的吸附、氧化等过程的改变。例如,MnOx-CeO2催化剂虽然氧化还原性得到提高,但单位比表面积的活性反而出现了下降。目前尚未有研究对此进行报道,未来应对此开展研究,以为提出从催化反应角度提高催化剂活性的方法提供支撑。
2.2 钙钛矿和尖晶石型复合锰氧化物催化剂
钙钛矿的结构式为ABO3。A位离子通常是稀土或者碱土具有较大离子半径的金属元素,其与12个氧配位,形成最密立方堆积,主要起稳定钙钛矿结构的作用;B位一般为离子半径较小的元素(一般为过渡金属元素,如Mn、Co等),其与6个氧配位,占据立方密堆积中的八面体中心,其性质决定了钙钛矿的催化性能。钙钛矿中LaMnO3催化剂是一种被广泛报道具有良好催化氧化性能的催化剂[43-52]。
Miniajluk等[51]采用1,2-乙二醇、1,2-丙二醇、1,4-丁二醇作为溶剂,采用微波加热法合成了LaMnO3催化剂,并对丙烷的催化氧化进行了研究。结果表明:采用EG作为溶剂的催化剂活性最好,与1%的Pt/Al2O3催化剂相当,350 ℃可以实现丙烷的完全转化,其高活性与催化剂表面氧含量高、低温还原性好以及较大的比表面积有关。Zhang等[49]采用溶胶凝胶、溶剂燃烧、共沉淀等多种方法合成了LaMnO3催化剂,并研究了其对甲苯的催化氧化反应。结果表明:催化剂的活性与表面氧含量、低温氧化还原性、比表面积有关,通过溶胶凝胶法合成的LaMnO3催化剂活性更高,甲苯转化活化能最低。Spinicci等[45]采用溶胶凝胶法制备了LaMnO3和LaCoO3催化剂,并用于丙酮、苯和异丙醇的催化氧化。结果表明:LaMnO3催化剂中Mn4+占比为35%,LaCoO3催化剂中全部为Co3+,Mn4+的存在导致催化剂存在阳离子空位,LaMnO3催化剂的催化活性优于LaCoO3催化剂,3种VOCs中以丙酮最容易被降解,苯最难被降解,作者在VOCs的T50下通过测量催化剂电导率研究了LaMnO3和LaCoO3催化剂吸附和解吸氧的能力,发现LaMnO3催化剂解吸氧的能力高于吸附氧的能力,而LaCoO3催化剂吸附氧化的能力更强,这可能是由于LaMnO3催化剂中存在Mn4+的原因,同时说明催化剂给出活性氧的能力与催化活性密切相关。
Marchetti等[53]首先研究了Lal-xAxMnO3(A=Sr、Eu、Ce)中A位取代的影响,A位离子的引入导致阳离子空位减少,氧空位增加。但是氧空位增加并不代表活性的增加。在低温区(<400 ℃),Sr等离子掺杂可以有效地提高低温活性;但在高温区,活性最好的催化剂是LaMnO3。这表明,低价离子掺杂只对LaMnO3表面氧的活性有促进作用,对于甲烷的高温催化燃烧的反应,Sr、Ce的掺杂对活性提高并没有明显的效果。Wang等[50]研究了LaMnO3、LaCoO3和LaFeO3对于苯的催化氧化性质。结果表明:LaMnO3催化剂的活性更高,Sr掺杂后,650 ℃焙烧的LaSrMnO3催化剂比表面积增大,但活性基本没有改变,而850 ℃焙烧的LaSrMnO3催化剂明显较同样温度下焙烧的LaMnO3催化剂比表面积更大、活性更高。Deng等[47]采用柠檬酸结合水热法合成了Sr掺杂LaMnO3和LaCoO3催化剂对甲苯的催化氧化。结果表明:经过制备的催化剂形貌为球形,LaCoO3催化剂呈现氧缺陷,而LaMnO3呈现氧过量,Sr掺杂增加了LaCoO3催化剂的缺陷位数量,降低了LaMnO3催化剂氧过量程度,且Sr掺杂增加了Co3+和Mn4+比例,提高了催化剂的氧化还原能力,同时催化剂活性得到提高。
Blasin-Aubé等[54]采用Sr对LaMnO3中的La进行部分取代,得到了La0.8Sr0.2MnO3+x催化剂,考察了其对各类VOCs催化氧化的难易程度(图5)。结果表明:单一VOCs催化氧化活性顺序为乙醇>乙酸乙酯>乙酸异丙酯>丁酮>丙醛>丙酮>丙烯>甲基环己烷>甲苯>环己烷>正己烷>苯>丙烷;对双组分VOCs催化氧化的结果表明,2种VOCs存在混合效应,其低活性的有机物完全氧化温度会明显下降。并通过关联有机分子最弱C—H键能和T50的关系,发现烷烃类和芳烃类的有机物催化活性与其C—H键能存在一定的联系,C—H键越弱,越易被氧化。但含氧类有机物的C—H键能则不影响其催化氧化的难易程度。
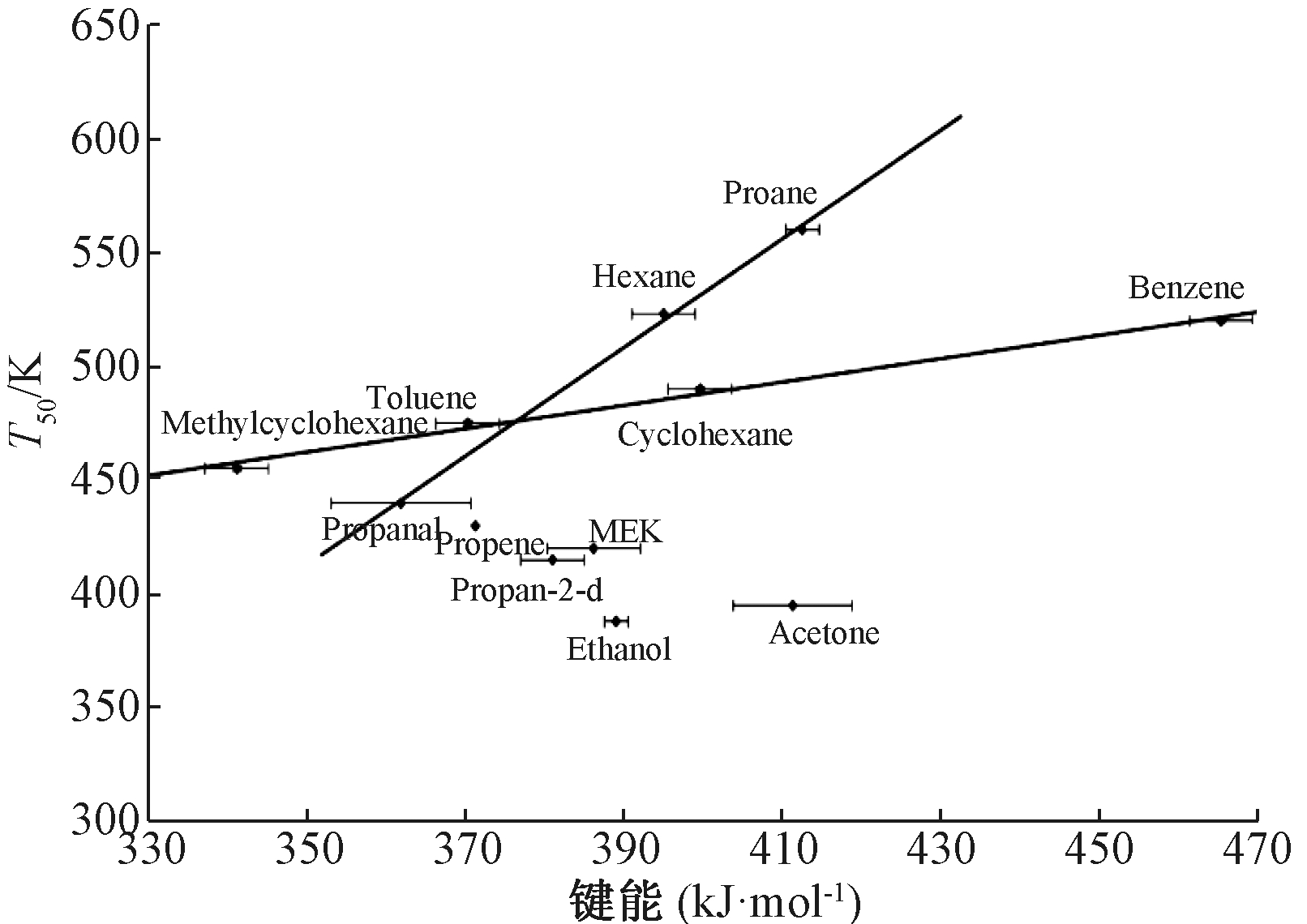
图5 有机物分子最弱C—H键能和T50(转化50%
所需的温度)的关系[54]
Fig.5 Relationship between the strength of the weakest C—H bond and T50 of the VOCs components[54]
尖晶石型催化剂的结构式为AB2O4。每个尖晶石单位晶胞中含有8个分子,其中32个氧离子组成64个四面体(A位)和32个八面体(B位),金属离子只占据其中的8个四面体与16个八面体。其中,A、B位活性组分可通过掺杂结构性质相近的其他金属离子对催化剂进行改性。尖晶石型催化剂具有较好的结构稳定性和机械强度,其晶格密度较大,水分子难以进入晶体内部,故水热稳定性高,常用于去除烷烃和苯系物等。
Tian等[10]发现:Mn掺杂可以增加Co3O4(尖晶石)催化剂氧空位数量,使得催化剂氧化还原性提高,显著增强了催化剂活性和CO2选择性,且催化剂的热稳定性提高。Benjamin等[55]研究发现:CoxMn3-xO4催化剂体系中,当x<0.9时,催化剂呈现无定型状态,当x≥0.9时,催化剂转变为尖晶石结构,活性最好的为Co2.3Mn0.7O4催化剂,较文献中报道最好的Co3O4催化剂活性提高50%以上。
Liu等[56]研究了Fe3-xMnxO4(x≤1)催化剂对甲醛的催化性能,发现催化剂可以维持尖晶石结构,Mn倾向于在催化剂表面富集,降低了催化剂的比表面积和吸附氧含量,但显著提高了催化剂的氧化还原性,使得催化剂活性明显提高。
部分文献报道的复合锰氧化物催化剂的研究成果如表2所示。整体来讲,通过Cu、Ce、Co等元素掺杂,复合锰氧化物的催化氧化活性较表1中单一锰氧化物有所提高。对于钙钛矿和尖晶石型复合锰氧化物,其特定的结构能够使中心原子充分发挥催化氧化作用;而混合掺杂的复合锰氧化物,催化剂的晶体结构无序度和比表面积变大,表面缺陷位增多,同时过渡金属原子之间存在协同作用,从而使得催化剂的催化氧化性能得到提高。
3 锰氧化物催化剂催化氧化CVOCs
与普通碳氢VOCs相比,CVOCs一般毒性更高,
表2 复合锰氧化物催化剂催化氧化VOCs的近期研究成果[31]
Table 2 Recent results of catalytic oxidation of VOCs by using composite manganese oxide catalysts[31]
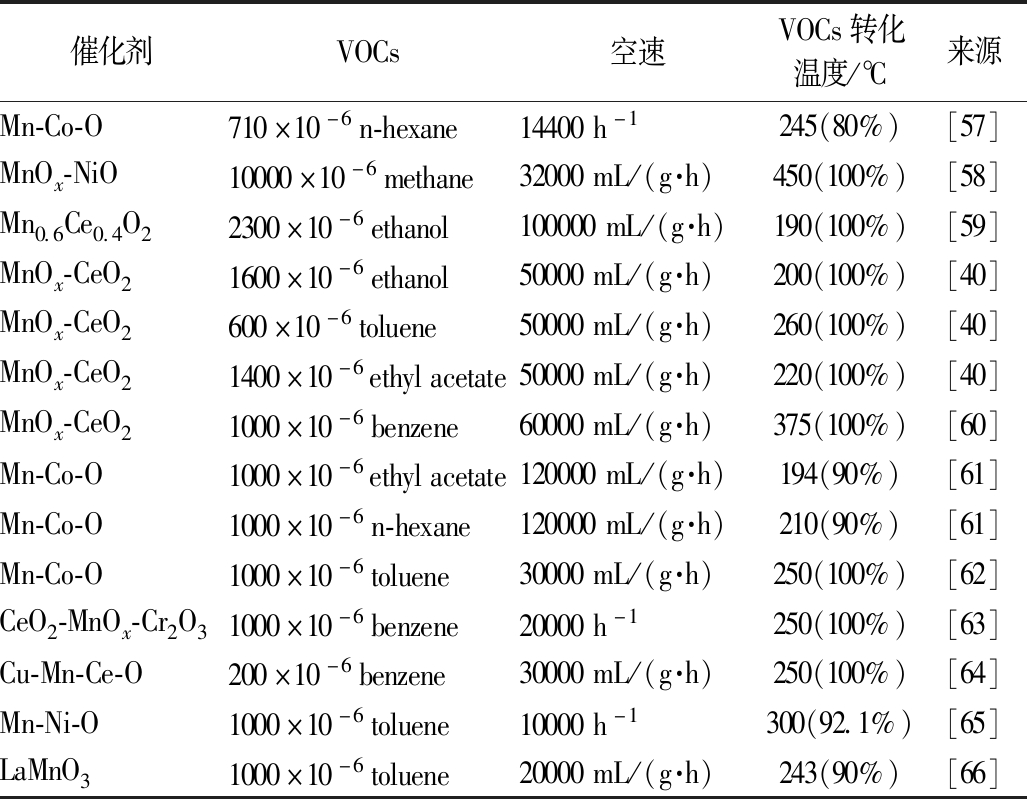
催化剂VOCs空速VOCs转化温度/℃来源Mn-Co-O710×10-6n-hexane14400h-1245(80%)[57]MnOx-NiO10000×10-6methane32000mL/(g·h)450(100%)[58]Mn0.6Ce0.4O22300×10-6ethanol100000mL/(g·h)190(100%)[59]MnOx-CeO21600×10-6ethanol50000mL/(g·h)200(100%)[40]MnOx-CeO2600×10-6toluene50000mL/(g·h)260(100%)[40]MnOx-CeO21400×10-6ethylacetate50000mL/(g·h)220(100%)[40]MnOx-CeO21000×10-6benzene60000mL/(g·h)375(100%)[60]Mn-Co-O1000×10-6ethylacetate120000mL/(g·h)194(90%)[61]Mn-Co-O1000×10-6n-hexane120000mL/(g·h)210(90%)[61]Mn-Co-O1000×10-6toluene30000mL/(g·h)250(100%)[62]CeO2-MnOx-Cr2O31000×10-6benzene20000h-1250(100%)[63]Cu-Mn-Ce-O200×10-6benzene30000mL/(g·h)250(100%)[64]Mn-Ni-O1000×10-6toluene10000h-1300(92.1%)[65]LaMnO31000×10-6toluene20000mL/(g·h)243(90%)[66]
更容易使催化剂氯中毒失活[30,67]。常见的CVOCs包括氯苯、1,2-二氯乙烯、二氯甲烷、三氯乙烯、1,2-二氯丙烷等,使用氯苯作为CVOCs的模型化合物的研究最多[29-30,52,67-79]。锰氧化物催化剂应用于CVOCs催化氧化过程中也会出现失活现象:Wang等[29]将MnOx催化剂应用于氯苯催化,发现260 ℃时氯苯转化率由80%逐渐下降到10%以下。过渡金属氧化物催化剂氯中毒有多种形式,例如,活性位点吸附氯导致无法有效吸附VOCs分子,或形成金属氯化物导致催化剂结构发生改变[30,67]。Bertinchamps等[30]研究了MnOx/TiO2催化剂对于氯苯的催化氧化性能,并采用XPS和ToF-SIMS对于反应后的催化剂进行了分析。结果表明:锰氧化物催化剂表面形成氯化锰(MnClx)和氯氧化物(MnClyOz)[80-81]。
提高催化反应温度可以有效避免锰氧化物催化剂氯中毒现象。Wang等[29]采用溶胶凝胶法制备了MnOx、MnCeOx催化剂,研究了其对氯苯的催化氧化反应。结果表明:这些催化剂在>350 ℃时可以保持催化活性稳定,过渡金属掺杂有效提高了催化剂对CVOCs的催化性能。如图6所示,当<300 ℃时,在MnOx、CeO2和MnCeOx催化剂上均无法实现氯苯的稳定催化,随着反应的进行催化剂活性显著下降;当>350 ℃时,同一温度下氯苯的转化率趋于稳定,且MnCeOx催化剂的活性较单一MnOx或CeO2催化剂得到显著提高。此温度区间与催化剂表面氯物种沉积密切相关,当催化反应温度>300 ℃时产物中的Cl2浓度明显增加,使得催化剂氯中毒减弱[75]。而过渡金属掺杂提高了催化剂的氧化还原性,增强催化剂活性的同时可加大催化剂表面氯元素的移除速率,进而提高催化剂的稳定性[75]。如图7所示,相对于MnOx和CeO2催化剂,MnCeOx催化剂的H2-TPR还原峰向低温区移动,说明催化剂更容易给出活性氧物种。
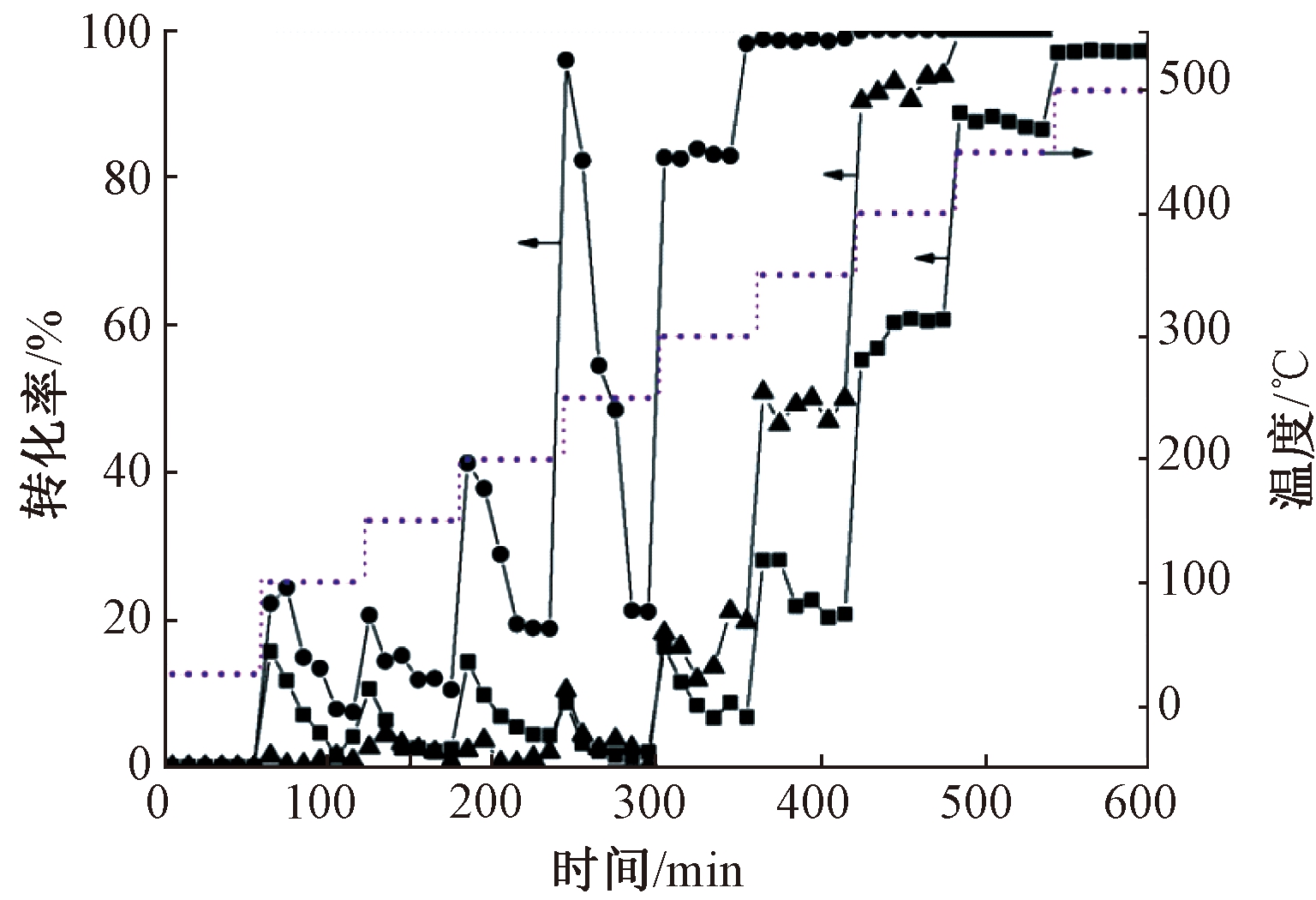
注:反应条件:1000×10-6氯苯/10% O2/N2,体积空速15000 h-1[29]。![]() —CeO2;
—CeO2; ![]() —MnOx;
—MnOx;![]() —0.86Mn。
—0.86Mn。
图6 不同温度下MnOx、CeO2、MnCeOx(0.86Mn,
Mn/(Mn+Ce)=0.86)催化剂催化氧化氯苯的活性
Fig.6 The stability of catalysts for CB catalytic combustion at different temperatures
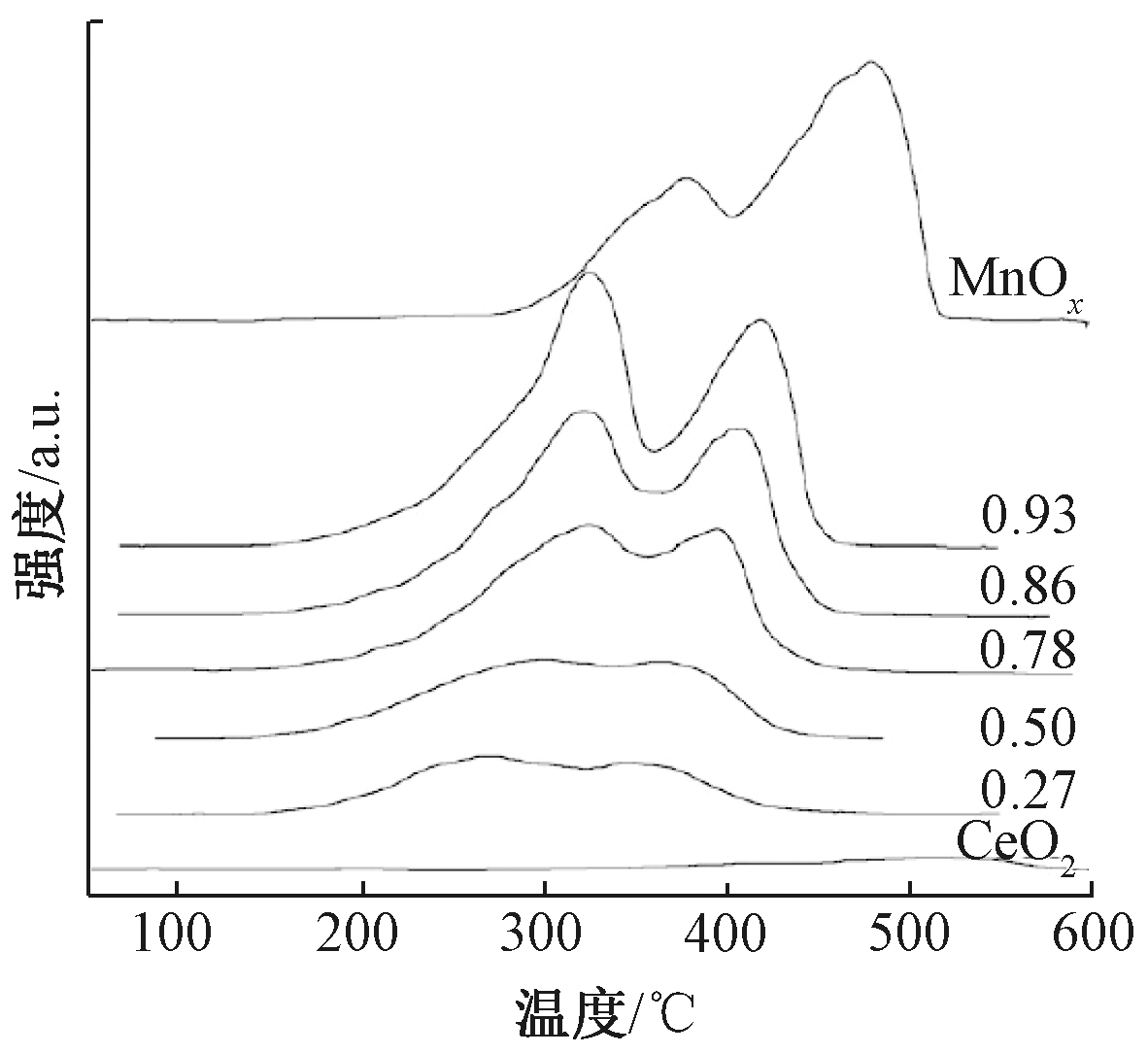
图7 不同n(Mn)/n(Mn+Ce)的MnCeOx催化剂H2-TPR表征[29]
Fig.7 TPR profiles of the MnOx-CeO2 catalysts with different ratios of Mn/(Mn+Ce)[29]
Dai等[73]研究结果表明:MnCeOx催化剂在高温下焙烧,不仅催化剂的比表面积明显降低,同时MnCeOx固溶体结构逐渐转变为Mn2O3和CeO2,催化剂的活性和稳定性下降。在MnCeOx体系中加入La(La替代MnCeOx催化剂中50%摩尔数的Ce),催化剂的热稳定性得到明显提升。如图8所示,MnCeOx催化剂随着焙烧温度的提高(550~750 ℃),达到稳态催化时氯苯转化率由接近100%下降至50%左右,而MnCeLaOx催化剂的活性则没有受到明显影响。

注:Mn-550为550 ℃焙烧得到的MnOx催化剂;反应条件:1000×10-6氯苯/10% O2/N2,体积空速15000 h-1[73]。![]() —MnCeLa-550;
—MnCeLa-550; ![]() —MnCeLa-750;
—MnCeLa-750; ![]() —MnCe-550;
—MnCe-550; ![]() —MnCe-650;
—MnCe-650; ![]() —MnCeLa-750;
—MnCeLa-750; ![]() —Mn-550;
—Mn-550; ![]() —Mn-650;
—Mn-650; ![]() —Mn-750。
—Mn-750。
图8 550 ℃时MnOx、MnCeOx、MnCeLaOx催化剂
催化氧化氯苯稳定性
Fig.8 The stability tests of MnOx, MnCeOx and MnCeLaOx catalysts for CB catalytic combustion with 550 ℃ calcined MnOx catalyst
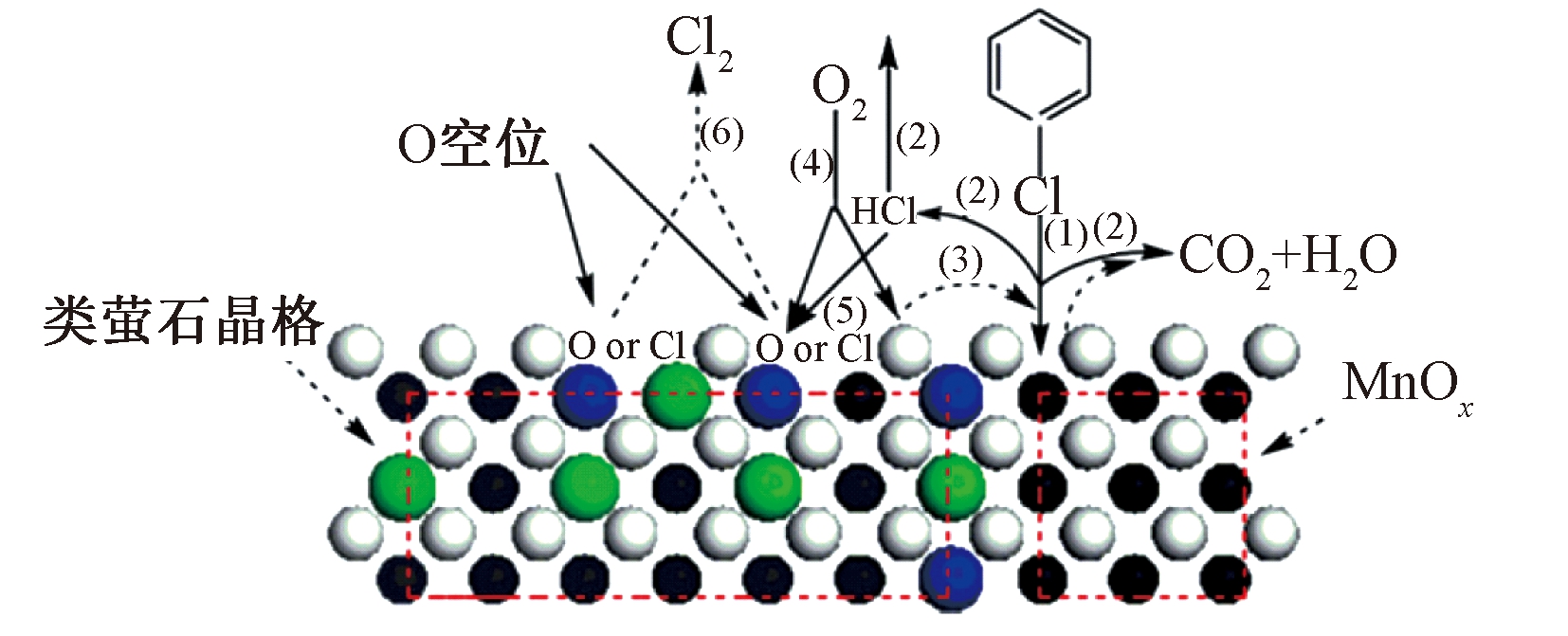
MnCeLaOx催化剂催化氧化氯苯的主要反应过程如图9所示,主要包括以下步骤[73]:1)活性锰物种(主要位于MnOx和MnCeOx界面处)和其邻近的晶格氧吸附氯苯;2)吸附态的氯苯与MnOx中的晶格氧反应生成CO2、H2O和HCl;3)CeO2中的晶格/吸附氧迁移至MnOx,补充消耗的氧;4)气相中的氧吸附在CeO2表面的氧空位处;5)生成的部分HCl返回催化剂表面,并吸附在氧空位或部分活性位点处代替氧;6)活性氧促进Cl-从催化剂表面解析,并生成Cl2。因此,强化锰氧化物催化剂的氧化还原性能,可有效促进催化剂表面沉积的氯元素。
 —O;
—O;  —Mn;
—Mn;  —Ce;
—Ce;  —La。
—La。
图9 MnCeLaOx催化剂催化氧化氯苯的反应机理[73]
Fig.9 Plausible mechanism for CB combustion on MnCeLaOx catalyst[73]
Li等[74]通过Ce、La、Ru和Sn掺杂对MnOx-TiO2催化剂进行改性,研究其对于氯苯催化氧化性质。结果表明:Sn、Ru、La掺杂提升了MnOx-TiO2催化剂的稳定性,以SnOx-MnOx-TiO2催化剂抗氯中毒能力提高最为明显;而Ce掺杂对催化剂的稳定性反而有不利作用。图10为MnOx-TiO2和SnOx-MnOx-TiO2催化剂的H2-TPR表征结果。如图10a所示,相比于Wang等[29]在实验中采用的MnOx催化剂(图7),MnOx-TiO2催化剂的还原温度明显更低,这可能与MnOx-TiO2催化剂存在掺杂组分或焙烧温度更低有关。因此,CeO2掺杂可能无法进一步提高催化剂的氧化还原性,进而增强催化剂的抗氯中毒能力。在175~250 ℃内,随着温度的升高,反应后的MnOx-TiO2催化剂还原峰位置不断向高温区移动,说明由于催化剂表面氯的作用,导致催化剂难以给出活性氧。而300 ℃时,由于反应后的催化剂表面氯物种含量降低,催化剂的氧化还原性有所恢复。如图10b所示,与MnOx-TiO2催化剂相比,SnOx掺杂后催化剂的氧化还原性反而更差。然而,对于在不同温度下反应后的SnOx-MnOx-TiO2催化剂,其还原峰位置温度并没有明显改变,说明催化剂表面沉积的氯更少(得到了XPS表征支持[74]),催化剂受到氯中毒影响更弱。因此,催化剂表面氯物种可能通过Sn移除。
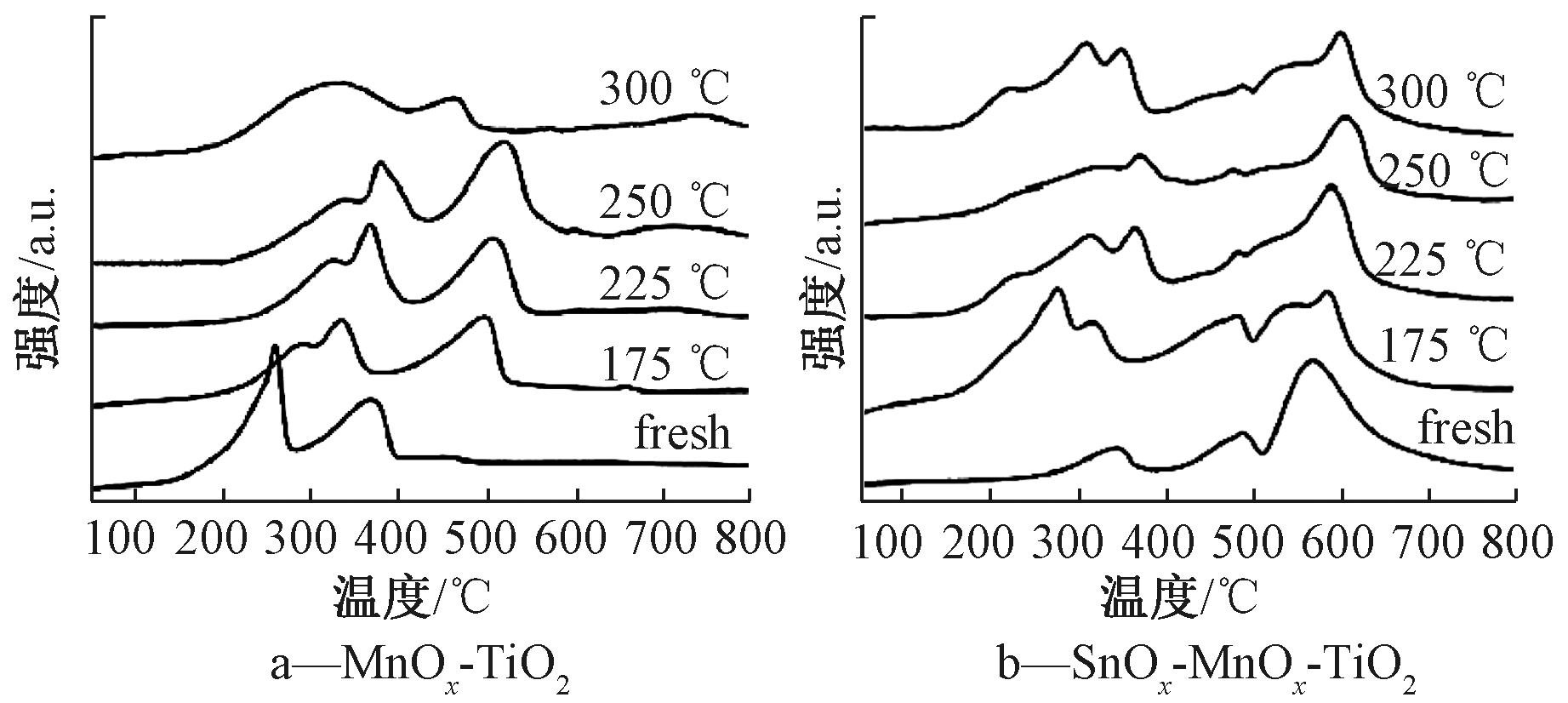
注:fresh代表新鲜催化剂,175 ℃、225 ℃、250 ℃、300 ℃代表在对应温度下反应100 h的催化剂[74]。
图10 MnOx-TiO2和SnOx-MnOx-TiO2催化剂H2-TPR表征
Fig.10 H2-TPR profiles of MnOx-TiO2 and SnOx-MnOx-TiO2 catalysts
综上,锰氧化物催化剂容易在CVOCs催化氧化过程中失活,原因主要是氯物种对催化剂活性位点具有毒害作用。通过增强催化剂的氧化还原性,或引入可以有效移除氯的活性组分,能够有效减少催化剂表面氯沉积,从而提高锰氧化物催化剂的活性和稳定性。
4 结论与建议
催化氧化技术是目前去除VOCs最有效的方法之一,开发以过渡金属氧化物为活性组分的催化体系在近年来受到极大关注,其中锰氧化物催化剂活性高、CO2选择性好,具有替代贵金属催化剂的潜力。锰氧化物催化剂的性能主要取决于催化剂的氧化还原性、表面缺陷位数量等,并与催化剂晶型、形貌、其他组分掺杂等因素密切相关。文献调研发现MnO2的活性通常高于Mn2O3和Mn3O4。通过其他过渡金属元素对锰氧化物催化剂进行掺杂改性,可以增加催化剂的不规则程度,并形成新的活性结构,有助于增强催化剂的活性。然而,锰氧化物催化剂在CVOCs催化氧化过程中容易氯中毒失活,目前提高催化剂的氧化还原性或引入能够有效移除氯的活性物种,可以有效提高催化剂的活性和稳定性。尽管锰氧化物催化剂对于VOCs的催化性质已有大量报道,但仍存在一定不足。主要表现在:1)缺乏对于催化机理的研究,包括VOCs分子在催化剂表面的转化过程,催化剂活性位点具体结构及其与VOCs分子的反应机制;2)缺乏锰氧化物催化剂与氯的作用过程的深入分析,以及提高催化剂抗氯中毒能力的普遍方法;3)锰氧化物催化剂对实际VOCs废气(如含多种VOCs组分、H2O等)催化报道较少。因此,下一步应加强对于催化机理的研究,包括催化剂与反应物的作用形式,并深入分析催化剂与氯的作用过程,以提高锰氧化物催化剂的活性和稳定性,推进其应用于实际VOCs废气处理。
[1] Shu Y J, Ji J, Xu Y, et al. Promotional role of Mn doping on catalytic oxidation of VOCs over mesoporous TiO2 under vacuum ultraviolet (VUV) irradiation[J]. Applied Catalysis B-Environmental, 2018, 220: 78-87.
[2] Tsang C H A, Li K, Zeng Y X, et al. Titanium oxide based photocatalytic materials development and their role of in the air pollutants degradation: overview and forecast[J]. Environment International, 2019, 125: 200-228.
[3] Shao M, Zhang Y H, Zeng L M, et al. Ground-level ozone in the Pearl River Delta and the roles of VOC and NOx in its production[J]. Journal of Environmental Management, 2009, 90(1): 512-518.
[4] Luo M M, Cheng Y, Peng X Z, et al. Copper modified manganese oxide with tunnel structure as efficient catalyst for low-temperature catalytic combustion of toluene[J]. Chemical Engineering Journal, 2019, 369: 758-765.
[5] Aziz A, Sajjad M, Kim M, et al. An efficient Co-ZSM-5 catalyst for the abatement of volatile organics in air: effect of the synthesis protocol[J]. International Journal of Environmental Science and Technology, 2018, 15(4): 707-718.
[6] Guo J H, Lin C X, Jiang C J, et al. Review on noble metal-based catalysts for formaldehyde oxidation at room temperature[J]. Applied Surface Science, 2019, 475: 237-255.
[7] Zhu A M, Zhou Y, Wang Y, et al. Catalytic combustion of VOCs on Pt/CuMnCe and Pt/CeY honeycomb monolithic catalysts[J]. Journal of Rare Earths, 2018, 36(12): 1272-1277.
[8] Kamal M S, Razzak S A, Hossain M M. Catalytic oxidation of volatile organic compounds (VOCs): a review[J]. Atmospheric Environment, 2016, 140: 117-134.
[9] Yao X, Gao M X, Wei Z D, et al. Removal of hexanal in cooking fume by combination of storage and plasma-catalytic oxidation on alkali-modified Co-Mn solid solution[J]. Chemosphere, 2019, 220: 738-747.
[10] Tian Z Y, Ngamou P H T, Vannier V, et al. Catalytic oxidation of VOCs over mixed Co-Mn oxides[J]. Applied Catalysis B:Environmental, 2012, 117/118: 125-134.
[11] Mei J, Xie J K, Sun Y N, et al. Design of Co3O4/CeO2-Co3O4 hierarchical binary oxides for the catalytic oxidation of dibromomethane[J]. Journal of Industrial and Engineering Chemistry, 2019, 73: 134-141.
[12] Kim J, Lee B K. Enhanced photocatalytic decomposition of VOCs by visible-driven photocatalyst combined Cu-TiO2 and activated carbon fiber[J]. Process Safety and Environmental Protection, 2018, 119: 164-171.
[13] Zhang X L, Ye J H, Yuan J, et al. Excellent low-temperature catalytic performance of nanosheet Co-Mn oxides for total benzene oxidation[J]. Applied Catalysis A:General, 2018, 566: 104-112.
[14] Qiu Y N, Ye N, Situ D, et al. Study of catalytic combustion of chlorobenzene and temperature programmed reactions over CrCeOx/AlFe pillared clay catalysts[J]. Materials, 2019, 12(5): 728.
[15] Zhang C, Wang J G, Yang S F, et al. Boosting total oxidation of acetone over spinel MCo2O4 (M=Co, Ni, Cu) hollow mesoporous spheres by cation-substituting effect[J]. Journal of Colloid and Interface Science, 2019, 539: 65-75.
[16] Yang P, Li J R, Cheng Z, et al. Promoting effects of Ce and Pt addition on the destructive performances of V2O5/γ-Al2O3 for catalytic combustion of benzene[J]. Applied Catalysis A: General, 2017, 542: 38-46.
[17] Shu Y J, He M, Ji J, et al. Synergetic degradation of VOCs by vacuum ultraviolet photolysis and catalytic ozonation over Mn-xCe/ZSM-5[J]. Journal of Hazardous Materials, 2019, 364: 770-779.
[18] Santos V P, Pereira M F R,  rfão J J M, et al. The role of lattice oxygen on the activity of manganese oxides towards the oxidation of volatile organic compounds[J]. Applied Catalysis B Environmental, 2010, 99(1): 353-363.
rfão J J M, et al. The role of lattice oxygen on the activity of manganese oxides towards the oxidation of volatile organic compounds[J]. Applied Catalysis B Environmental, 2010, 99(1): 353-363.
[19] Kim S C, Shim W G. Catalytic combustion of VOCs over a series of manganese oxide catalysts[J]. Applied Catalysis B Environmental, 2010, 98(3): 180-185.
[20] Hou J T, Li Y Z, Liu L L, et al. Effect of giant oxygen vacancy defects on the catalytic oxidation of OMS-2 nanorods[J]. Journal of Materials Chemistry A, 2013, 1(23): 6736-6741.
[21] Wang Y, Deng W, Wang Y F, et al. A comparative study of the catalytic oxidation of chlorobenzene and toluene over Ce-Mn oxides[J]. Molecular Catalysis, 2018, 459: 61-70.
[22] Piumetti M, Fino D, Russo N. Mesoporous manganese oxides prepared by solution combustion synthesis as catalysts for the total oxidation of VOCs[J]. Applied Catalysis B: Environmental, 2015, 163(163): 277-287.
[23] Wang J L, Li J E, Jiang C J, et al. The effect of manganese vacancy in birnessite-type MnO2 on room-temperature oxidation of formaldehyde in air[J]. Applied Catalysis B:Environmental, 2017, 204: 147-155.
[24] Liu G, Li J Q, Yang K, et al. Effects of cerium incorporation on the catalytic oxidation of benzene over flame-made perovskite La1-xCexMnO3 catalysts[J]. Particuology, 2015, 19: 60-68.
[25] Trovarelli A. Catalytic properties of ceria and CeO2-containing materials[J]. Catalysis Reviews-Science and Engineering, 1996, 38(4): 439-520.
[26] Liotta L F, Ousmane M, Di Carlo G, et al. Total oxidation of propene at low temperature over Co3O4-CeO2 mixed oxides: Role of surface oxygen vacancies and bulk oxygen mobility in the catalytic activity[J]. Applied Catalysis A:General, 2008, 347(1): 81-88.
[27] He F, Qin K, Luo J Q, et al. Effect of preparation method and vanadium loading amount on the catalytic activity of V/TiO2 nanoparticles[J]. Journal of Nanoscience and Nanotechnology, 2017, 17(12): 9050-9055.
[28] Pitkaaho S, Matejova L, Jiratova K, et al. Oxidation of perchloroethylene-Activity and selectivity of Pt, Pd, Rh, and V2O5 catalysts supported on Al2O3, Al2O3-TiO2 and Al2O3-CeO2. Part 2[J]. Applied Catalysis B: Environmental, 2012, 126: 215-224.
[29] Wang X Y, Kang Q, Li D. Catalytic combustion of chlorobenzene over MnOx-CeO2 mixed oxide catalysts[J]. Applied Catalysis B:Environmental, 2009, 86(3/4): 166-175.
[30] Bertinchamps F, Poleunis C, Gregoire C, et al. Elucidation of deactivation or resistance mechanisms of CrOx, VOx, and MnOx supported phases in the total oxidation of chlorobenzene via ToF-SIMS and XPS analyses[J]. Surface and Interface Analysis, 2008, 40(3/4): 231-236.
[31] 唐文翔. 锰基多孔氧化物催化氧化VOCs性能及其强化机制[D]. 北京:中国科学院大学, 2014.
[32] Xie Y J, Yu Y Y, Gong X Q, et al. Effect of the crystal plane figure on the catalytic performance of MnO2 for the total oxidation of propane[J]. Crystengcomm, 2015, 17(15): 3005-3014.
[33] Wang F, Dai H, Deng J, et al. Manganese oxides with rod-, wire-, tube-, and flower-like morphologies: highly effective catalysts for the removal of toluene[J]. Environmental Science & Technology, 2012, 46(7): 4034-4041.
[34] Hou J T, Liu L L, Li Y Z, et al. Tuning the K+ concentration in the tunnel of OMS-2 nanorods leads to a significant enhancement of the catalytic activity for benzene oxidation[J]. Environmental Science & Technology, 2013, 47(23): 13730-13736.
[35] Li J H, Wang R H, Hao J M. Role of lattice oxygen and lewis acid on ethanol oxidation over OMS-2 catalyst[J]. The Journal of Physical Chemistry C, 2012, 114(23): 10544-10550.
[36] Cellier C, Ruaux V, Lahousse C, et al. Extent of the participation of lattice oxygen from γ-MnO2 in VOCs total oxidation: influence of the VOCs nature[J]. Catalysis Today, 2006, 117(1): 350-355.
[37] Wu Y S, Lu Y, Song C J, et al. A novel redox-precipitation method for the preparation of α-MnO2 with a high surface Mn4+ concentration and its activity toward complete catalytic oxidation of o-xylene[J]. Catalysis Today, 2013, 201(1): 32-39.
[38] Deng J G, Zhang L, Dai H X, et al. Ultrasound-assisted nanocasting fabrication of ordered mesoporous MnO2 and Co3O4 with high surface areas and polycrystalline walls[J]. The Journal of Physical Chemistry C, 2010, 114(6): 2694-2700.
[39] Pérez H, Navarro P, Delgado J J, et al. Mn-SBA15 catalysts prepared by impregnation: influence of the manganese precursor[J]. Applied Catalysis A: General, 2011, 400(1/2): 238-248.
[40] Delimaris D, Ioannides T. VOC oxidation over MnOx-CeO2 catalysts prepared by a combustion method[J]. Applied Catalysis B: Environmental, 2009, 84(1): 303-312.
[41] Chen J, Chen X, Chen X, et al. Homogeneous introduction of CeOy into MnOx-based catalyst for oxidation of aromatic VOCs[J]. Applied Catalysis B: Environmental, 2018, 224: 825-835.
[42] Hu F, Chen J, Shen Z, et al. Toluene catalytic combustion over copper modified Mn0.5Ce0.5Ox solid solution sponge-like structures[J]. Applied Catalysis A: General, 2017,540(25):57-67.
[43] Li B, Yang Q L, Peng Y, et al. Enhanced low-temperature activity of LaMnO3 for toluene oxidation: the effect of treatment with an acidic KMnO4[J]. Chemical Engineering Journal, 2019, 366: 92-99.
[44] Li J J, Yu E Q, Cai S C, et al. Noble metal free, CeO2/LaMnO3 hybrid achieving efficient photo-thermal catalytic decomposition of volatile organic compounds under IR light[J]. Applied Catalysis B: Environmental, 2019, 240: 141-152.
[45] Spinicci R, Fanticanti M, Marini P, et al. Catalytic activity of LaMnO3 and LaCoO3 perovskites towards VOCs combustion[J]. Journal of Molecular Catalysis A: Chemical, 2003, 197(1): 147-155.
[46] Pan K L, Pan G T, Chong S H, et al. Removal of VOCs from gas streams with double perovskite-type catalysts[J]. Journal of Environmental Sciences-China, 2018, 69: 205-216.
[47] Deng J G, Zhang L, Dai H X, et al. Strontium-doped lanthanum cobaltite and manganite: highly active catalysts for toluene complete oxidation[J]. Industrial & Engineering Chemistry Research, 2008, 47(21): 8175-8183.
[48] Bin H C, Pan K L, Chang M B. Catalytic oxidation of trichloroethylene from gas streams by perovskite-type catalysts[J]. Environmental Science and Pollution Research, 2018, 25(12): 11584-11594.
[49] Zhang C H, Guo Y L, Guo L, et al. LaMnO3 perovskite oxides prepared by different methods for catalytic oxidation of toluene[J]. Applied Catalysis B: Environmental, 2014, 148/149(15): 490-498.
[50] Wang Y Z, Xie S H, Deng J G, et al. Morphologically controlled synthesis of porous spherical and cubic LaMnO3 with high activity for the catalytic removal of toluene[J]. Acs Applied Materials & Interfaces, 2014, 6(20): 17394-17401.
[51] Miniajluk N, Trawczyński J, Zawadzki M. Properties and catalytic performance for propane combustion of LaMnO3 prepared under microwave-assisted glycothermal conditions: effect of solvent diols[J]. Applied Catalysis A: General, 2016, 531:119-128.
[52] Zhang C, Chao W, Gil S, et al. Catalytic oxidation of 1,2-dichloropropane over supported LaMnOx oxides catalysts[J]. Applied Catalysis B: Environmental, 2017, 201: 552-560.
[53] Marchetti L, Forni L. Catalytic combustion of methane over perovskites[J]. Applied Catalysis B: Environmental, 1998, 15(3/4): 179-187.
[54] Blasin-Aubé V, Belkouch J, Monceaux L. General study of catalytic oxidation of various VOCs over La0.8Sr0.2MnO3+x perovskite catalyst: influence of mixture[J]. Applied Catalysis B: Environmental, 2003, 43(2): 175-186.
[55] Benjamin F, Alphonse P. Co-Mn-oxide spinel catalysts for CO and propane oxidation at mild temperature[J]. Applied Catalysis B: Environmental, 2016, 180: 715-725.
[56] Liu P, He H P, Wei G L, et al. Effect of Mn substitution on the promoted formaldehyde oxidation over spinel ferrite: catalyst characterization, performance and reaction mechanism[J]. Applied Catalysis B: Environmental, 2016, 182(31): 476-484.
[57] Todorova S, Kolev H, Holgado J P, et al. Complete n-hexane oxidation over supported Mn-Co catalysts[J]. Applied Catalysis B: Environmental, 2010, 94(1): 46-54.
[58] Zhang Y G, Qin Z F, Wang G F, et al. Catalytic performance of MnOx-NiO composite oxide in lean methane combustion at low temperature[J]. Applied Catalysis B: Environmental, 2013, 129(2): 172-181.
[59] Li H J, Qi G S, Tana, et al. Low-temperature oxidation of ethanol over a Mn0.6Ce0.4O2 mixed oxide[J]. Applied Catalysis B: Environmental, 2011, 103(1/2): 54-61.
[60] Wang Z, Shen G L, Li J Q, et al. Catalytic removal of benzene over CeO2-MnOx composite oxides prepared by hydrothermal method[J]. Applied Catalysis B: Environmental, 2013, 138/139(17): 253-259.
[61] Tang W X, Wu X F, Li S P, et al. Porous Mn-Co mixed oxide nanorod as a novel catalyst with enhanced catalytic activity for removal of VOCs[J]. Catalysis Communications, 2014, 56(5): 134-138.
[62] Qu Z P, Gao K, Fu Q, et al. Low-temperature catalytic oxidation of toluene over nanocrystal-like Mn-Co oxides prepared by two-step hydrothermal method[J]. Catalysis Communications, 2014, 52(5): 31-35.
[63] Xia P, Zuo S F, Liu F J, et al. Ceria modified crystalline mesoporous Cr2O3 based nanocomposites supported metal oxide for benzene complete oxidation[J]. Catalysis Communications, 2013, 41(5): 91-95.
[64] Tang X F, Xu Y D, Shen W J. Promoting effect of copper on the catalytic activity of MnOx-CeO2 mixed oxide for complete oxidation of benzene[J]. Chemical Engineering Journal, 2008, 144(2): 175-180.
[65] Huang Q, Zhang Z Y, Ma W J, et al. A novel catalyst of Ni-Mn complex oxides supported on cordierite for catalytic oxidation of toluene at low temperature[J]. Journal of Industrial and Engineering Chemistry, 2012, 18(2): 757-762.
[66] Liu Y X, Dai H X, Du Y C, et al. Controlled preparation and high catalytic performance of three-dimensionally ordered macroporous LaMnO3 with nanovoid skeletons for the combustion of toluene[J]. Journal of Catalysis, 2012, 287(3): 149-160.
[67] Dai Q G, Wang X Y, Lu G Z. Low-temperature catalytic combustion of trichloroethylene over cerium oxide and catalyst deactivation[J]. Applied Catalysis B: Environmental, 2008, 81(3/4): 192-202.
[68] Vu V H, Belkouch J, Ould-Dris A, et al. Removal of hazardous chlorinated VOCs over Mn-Cu mixed oxide based catalyst[J]. Journal of Hazardous Materials, 2009, 169(1): 758-765.
[69] Wu M, Wang X Y, Dai Q G, et al. Catalytic combustion of chlorobenzene over Mn-Ce/Al2O3 catalyst promoted by Mg[J]. Catalysis Communications, 2010, 11(12): 1022-1025.
[70] Wu M, Wang X Y, Dai Q G, et al. Low temperature catalytic combustion of chlorobenzene over Mn-Ce-O/γ-Al2O3 mixed oxides catalyst[J]. Catalysis Today, 2010, 158(3/4): 336-342.
[71] Dai Y, Wang X Y, Li D, et al. Catalytic combustion of chlorobenzene over Mn-Ce-La-O mixed oxide catalysts[J]. Journal of Hazardous Materials, 2011, 188(1/2/3): 132-139.
[72] Li H F, Lu G Z, Dai Q G, et al. Efficient low-temperature catalytic combustion of trichloroethylene over flower-like mesoporous Mn-doped CeO2 microspheres[J]. Applied Catalysis B: Environmental, 2011, 102(3/4): 475-483.
[73] Dai Y, Wang X Y, Dai Q G, et al. Effect of Ce and La on the structure and activity of MnOx catalyst in catalytic combustion of chlorobenzene[J]. Applied Catalysis B: Environmental, 2012, 111/112(6): 141-149.
[74] Li J W, Zhao P, Liu S T. SnOx-MnOx-TiO2 catalysts with high resistance to chlorine poisoning for low-temperature chlorobenzene oxidation[J]. Applied Catalysis A: General, 2014, 482(22): 363-369.
[75] Wang X, Ran L, Dai Y, et al. Removal of Cl adsorbed on Mn-Ce-La solid solution catalysts during CVOC combustion[J]. Journal and Colloid Interface Science, 2014, 426(15): 324-332.
[76] He C, Yu Y K, Shi J W, et al. Mesostructured Cu-Mn-Ce-O composites with homogeneous bulk composition for chlorobenzene removal: catalytic performance and microactivation course[J]. Materials Chemistry and Physics, 2015, 157: 87-100.
[77] Kan J W, Deng L, Li B, et al. Performance of Co-doped Mn-Ce catalysts supported on cordierite for low concentration chlorobenzene oxidation[J]. Applied Catalysis A: General, 2016, 530: 21-29.
[78] Sun P F, Wang W L, Dai X X, et al. Mechanism study on catalytic oxidation of chlorobenzene over MnxCe1-xO2/H-ZSM5 catalysts under dry and humid conditions[J]. Applied Catalysis B: Environmental, 2016, 198: 389-397.
[79] Wu L Y, He F, Luo J Q, et al. Synthesis of three-dimensional ordered mesoporous MnO: X/CeO2 bimetal oxides for the catalytic combustion of chlorobenzene[J]. Rsc Advances, 2017, 7(43): 26952-26959.
[80] Yan L, Luo M F, Wei Z B, et al. Catalytic oxidation of chlorobenzene on supported manganese oxide catalysts[J]. Applied Catalysis B: Environmental, 2001, 29(1): 61-67.
[81] Döbber D, Kieβling D, Schmitz W, et al. MnOx/ZrO catalysts for the total oxidation of methane and chloromethane[J]. Applied Catalysis B: Environmental, 2004, 52(2): 135-143.