0 引 言
厌氧消化是一种复杂的生化过程,主要包括分解、水解、产酸、产乙酸和产甲烷阶段,具有产泥量低、容纳有机负荷率高、能耗低及可回收废物能量等[1],广泛用于高浓度有机废水和固体废物的处理。
垃圾中有机质组分(碳数>10)经过水解和产酸阶段可以转化为小分子有机物(碳数<6),其主要产物为挥发性有机酸醇(VFAs),同时还伴随性产生一些小分子挥发性有机物(VOCs)排放至气体中。因此,水解和产酸阶段一直是关注的话题。发酵产物VFAs具有经济价值,可以作为发酵工业的原料生产高附加值产品,但其在反应器中过度累积会导致pH降低,从而抑制产甲烷菌活性和甲烷产量[2];发酵副产物VOCs具有恶臭效应,影响厌氧消化场所周边居民的日常生活,在恶臭污染严重时可能会引发群体性事件,因此需要对其排放进行控制。
现有厌氧消化产VFAs和VOCs的文献普遍是基于蛋白类、糖类以及油脂类等混合组分底物进行的实验研究,如餐厨垃圾[3]、剩余污泥[4]等,而针对蛋白质类底物厌氧降解产VFAs和VOCs的报道相对较少[5]。与糖类降解产VFAs相比,蛋白质产VFAs具有途径复杂和产物种类丰富的特点。蛋白质中含20种氨基酸,每种氨基酸产VFAs的途径不同,这是蛋白质降解产VFAs途径复杂性的原因,如半胱氨酸通过先产生丙酮酸,然后通过丙酮酸降解途径产生乙酸,而亮氨酸先转化为3-甲基丁酰辅酶A,然后再转化为异戊酸[6]。与糖类降解产VOCs相比,蛋白质元素多,组成结构更复杂,降解产生的VOCs种类多样,且致臭性可能更加强烈。鉴于蛋白质元素种类多样且厌氧降解途径复杂,因此针对蛋白质的单一垃圾组分的降解研究是有意义的。
为了解蛋白类底物在厌氧水解和产酸阶段VFAs和VOCs的产生与排放规律,本文以不含糖的纯蛋白为底物,使用从填埋场中分离纯化出的厌氧菌株进行降解实验,连续监测挥发物VFAs和VOCs的浓度,分析其动态变化规律。
1 厌氧水解菌的筛选与发酵实验方法
1.1 菌株筛选与鉴定
以生活垃圾填埋场的陈腐垃圾为菌源,酪蛋白为碳源,采用Hungate厌氧滚管技术,经过富集、分离和纯化等步骤得到纯种厌氧蛋白质水解菌株906C,具体过程[7]如下。
接种液制备:取20 g垃圾样品和80 mL无菌无氧磷酸缓冲液于锥形瓶中,通N2,密封,混匀。转移部分液体到有培养基的Hungate厌氧管中,通N2,密封,于37 ℃厌氧培养箱中培养。
菌株富集:吸取0.1 mL接种液至装有培养基的厌氧管中,于37 ℃生化培养箱中培养3~7 d,再次将菌液转接到新鲜培养基中培养,整个过程重复至少5次。
菌株分离:取1 mL富集后的菌液到9 mL无菌无氧生理盐水的厌氧管中,制成10-1稀释液,按照此方法,进行10倍梯度稀释至10-6,制成不同稀释度的稀释液。取10-4、10-5、10-6 3个稀释液样品各0.1 mL,分别接种到50 ℃含有固体培养基的厌氧管中,平放在滚管装置上迅速滚动,厌氧管内壁形成凝固层后,置于37 ℃生化培养箱中培养7~14 d。
菌株纯化:形成菌落后,挑选水解圈大、形态多样的单菌至装有无菌无氧液体培养基的厌氧管中,置于37 ℃生化培养箱中培养3~7 d。分离纯化过程至少重复5次。
菌株鉴定:分离纯化后的菌株,通过比对16S rDNA序列进行菌种鉴定,选用正向引物包括27f-YM、27f-Bif、27f-Bor、27f-Chl,浓度比为4∶1∶1∶1,反向引物为通用引物1492r,进行PCR扩增。
1.2 发酵实验条件
发酵实验在500 mL螺口厌氧瓶中进行,0.6 g酪蛋白为碳源,加入300 mL培养基,培养基成分如下:0.06 g MgCl2·6H2O,0.12 g NH4Cl,0.015 g CaCl2·2H2O,1 mL微量元素,4 mL维生素,0.75 mL厌氧指示剂(刃天青溶液0.12 g/L)和0.36 g还原剂(半胱氨酸盐酸盐)。利用高纯N2(99.99%)对瓶内进行充气15 min,而后置于高压蒸汽灭菌锅中以121 ℃高温灭菌30 min,冷却至室温。当培养基为无色时,说明瓶内达到厌氧状态。为避免酸败,调节pH为7左右,pH调节剂组成为20 mL磷酸缓冲液(15.6 g/L KH2PO4+21.82 g/L K2HPO4)和7 mL 56.25 g/L NaHCO3溶液。按照体积比为5%的接种率,将处于对数生长期的菌液接种入培养基中,放入37 ℃生化培养箱中培养。OD600采用岛津双光束紫外可见分光光度计测定;pH采用雷磁数显台式酸度计测定;ORP采用笔式ORP计;氨基酸总浓度采用茚三酮比色法[8]。
1.3 VFA和VOCs分析方法
发酵产物取样处理方法:取5 mL液样于10 mL离心管中,用高速冷冻离心机在4 ℃下经12000 r/min离心7 min,上清液用0.22 μm的水系滤膜进行过滤,取0.9 mL滤液于2 mL棕色色谱进样瓶中,加入0.1mL 10%的磷酸溶液(体积比),保存于-20 ℃冰箱中,待测。
VAF用GC-FID[9]测定,色谱条件为DB-FFAP毛细管柱(30 m×0.25 mm×0.25 μm),进样口温度为230 ℃,采用不分流模式进样,进样量为0.2 μL;采用程序升温,初始温度为60 ℃,保留2 min,然后以15 ℃/min的速率升温到230 ℃,保留4 min,全程17.33 min;检测器温度为250 ℃,载气流量为45 mL/min,H2流量为20 mL/min,空气流量为450 mL/min。采用外标法进行定性和定量。
样品中的VOCs定性定量分析采用固相微萃取SPME预处理技术结合GC-MS测试手段[10]。通过NIST2005数据库与样品中出峰物质的MS图谱对比进行定性;由于被测样品中成分未知以及物质较多(44种),在被测样品中加入氘代对二甲苯-d10溶液作为标准物进行相对定量,然后根据样品物质的峰面积和标准曲线对比确定VOCs浓度。
2 结果与讨论
2.1 厌氧水解菌鉴定结果
PCR产物经测序分析,发现该菌株为Sporanaerobacter acetigenes,相似度达到99.85%;经革兰氏染色,发现该菌株为革兰氏阴性菌;透射电镜表明菌株的细胞呈短杆状((1.5~3.0) μm×(0.5~1.0) μm),存在鞭毛,具有一定运动性。系统发育树见图1,图中编号为906C的菌株即分离纯化后的菌株,其透射电镜照片见图2。
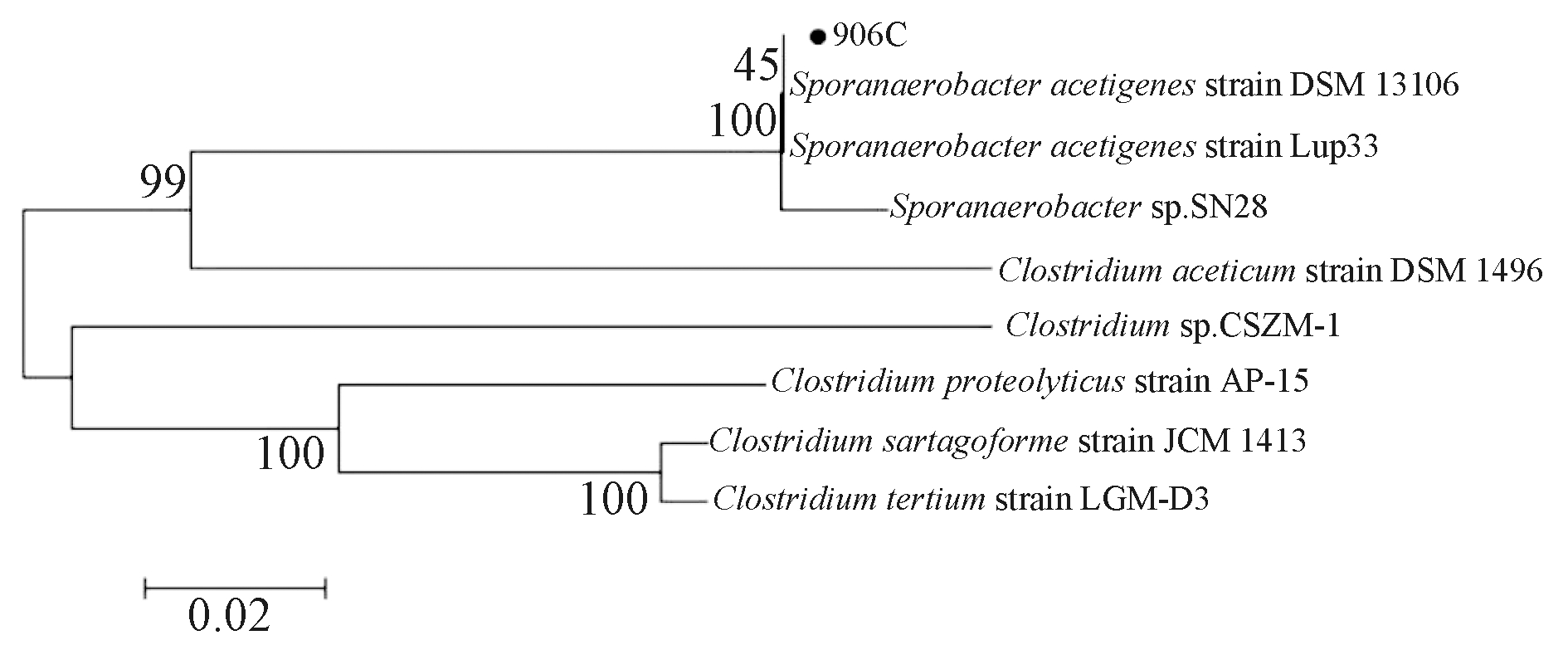
图1 系统发育树
Fig.1 Phylogenetic tree based on the 16S rDNA gene sequence
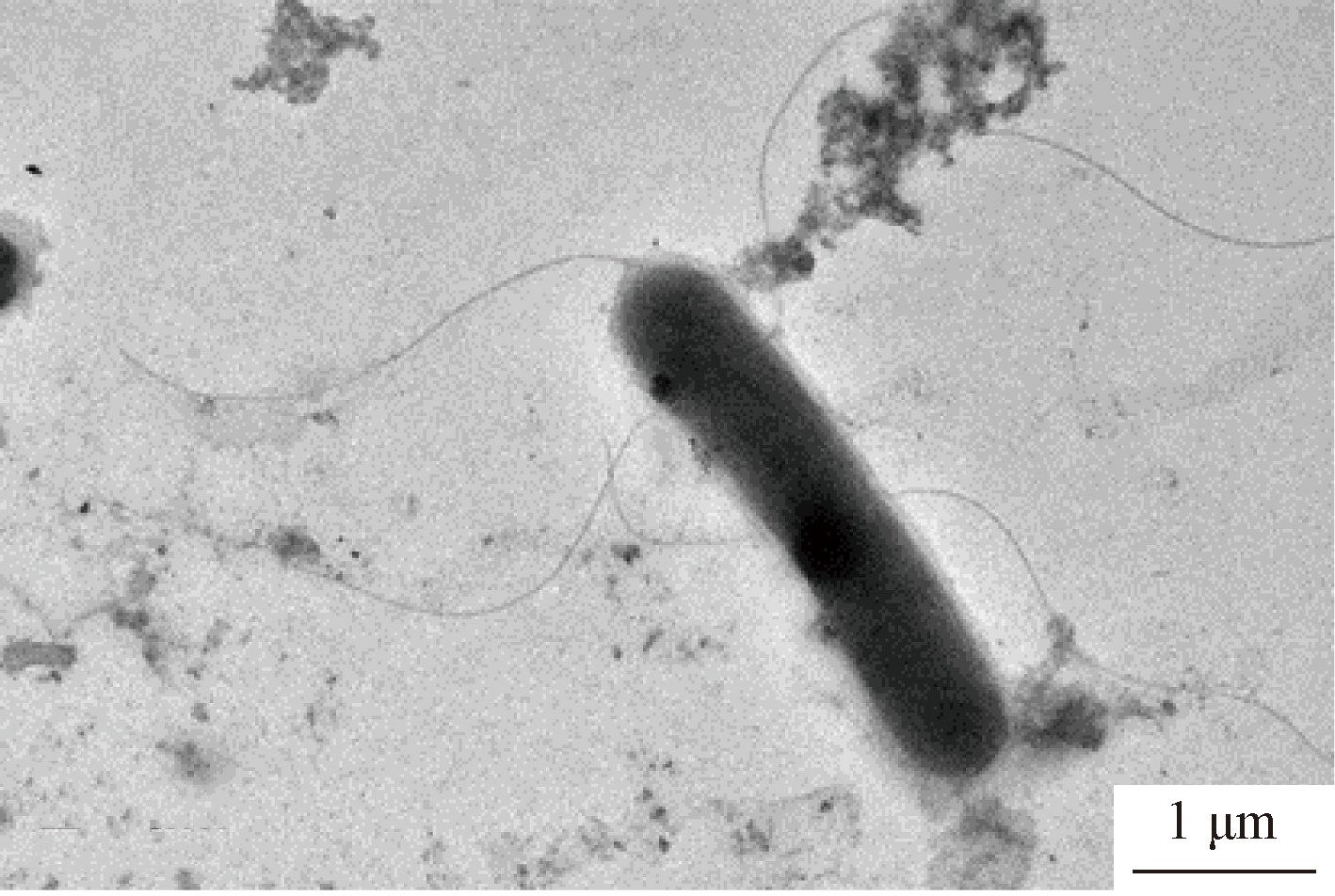
图2 厌氧菌的透射电镜照片
Fig.2 The transmission electron microscopy image of the bacterium isolated
测定菌株在10~55 ℃和pH 5.0~9.0条件下的生长曲线(图3),分析温度和pH对厌氧蛋白质水解菌生长的影响。菌株在10 ℃和55 ℃几乎不生长,在20~45 ℃内均生长良好,分别在110,110,60,30,50 h左右达到最大生长量,进入稳定期,30 ℃和37 ℃的最大生长量相对较大。菌株在pH为7.0~8.5的最大生长量较pH为5.0~6.5以及pH=9.0条件下更高,同时调整期时间也相对较短,说明该菌更适宜在中性以及偏碱性条件下生存。采用Logistic模型对不同温度和pH条件下的生长曲线进行拟合,发现菌株的最适温度为37 ℃,最适pH为8.0,对应的最大比生长速率μm分别为0.046,0.086 h-1。
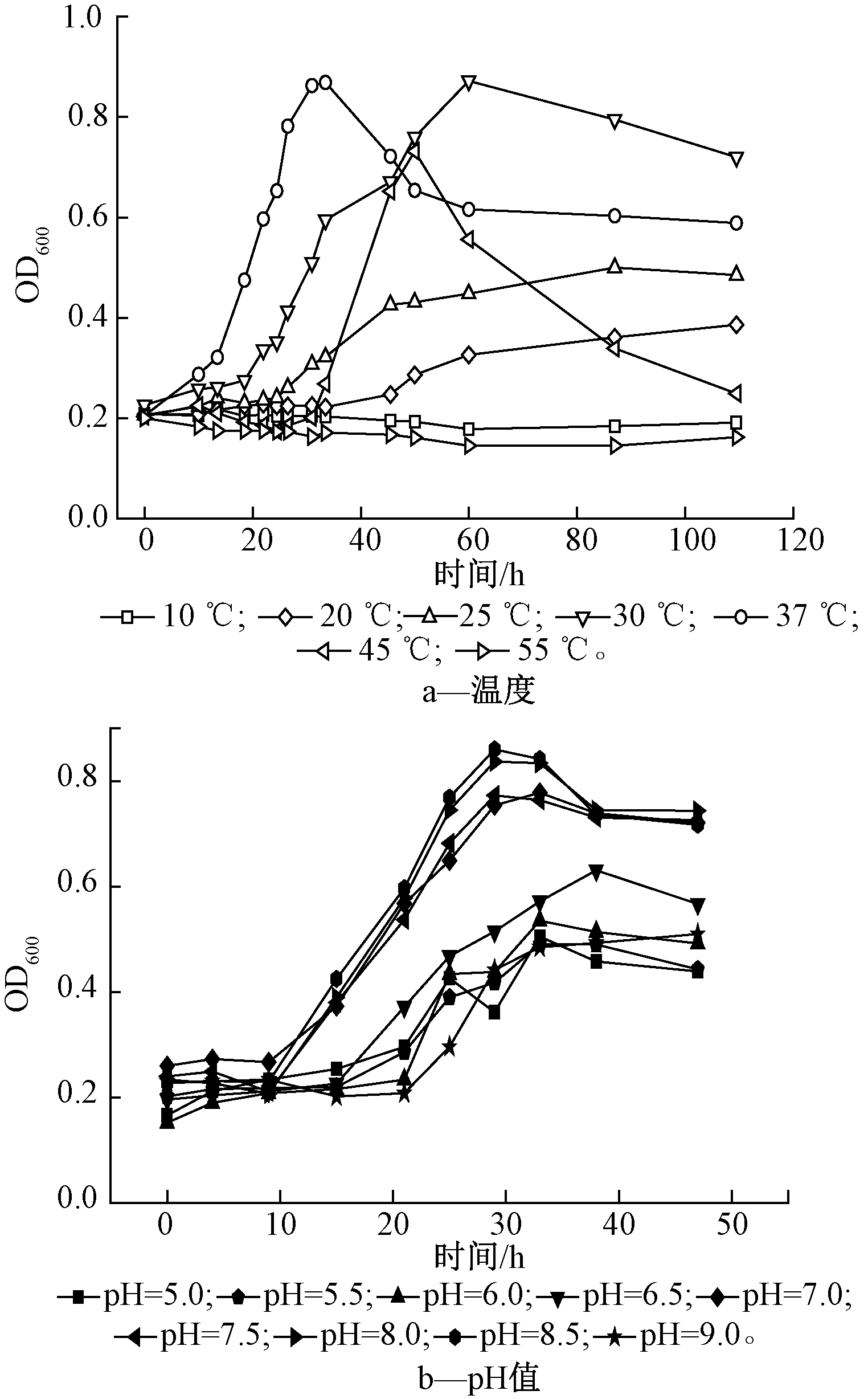
图3 不同温度和pH值条件下的生长曲线
Fig.3 Growth curves of strain at different temperature and pH
2.2 理化指标变化特征
pH和ORP反应实验体系内的环境条件,其影响菌株生长。pH、ORP随时间的变化见图4a。pH的变化范围在6.75~7.10,波动不大,原因是体系中加入了pH缓冲液,使得系统pH维持在菌株可生长的范围内,保证了菌株的生存环境;ORP初始值为-153 mV,菌株降解蛋白质,生成还原性物质,如丙酸、丁酸等在体系中累积,使ORP持续下降,最后维持在-245 mV,体系处于绝对厌氧环境,适合菌株生长繁殖。

图4 pH、ORP和氨基酸总浓度变化
Fig.4 Variation of pH, ORP and amino acid concentration
氨基酸是蛋白质水解的产物。氨基酸通过Stickland反应[11]发酵产生VFAs和有机醇,氨基酸的浓度和种类影响发酵产物的浓度和种类。图4b为氨基酸总浓度变化,分为4个阶段:慢速增加、快速增加、下降和稳定阶段。初始氨基酸浓度为800 mg/L,原因是体系中加入了还原剂半胱氨酸盐,以及在灭菌过程有部分的蛋白质水解。慢速增加阶段(0~25 h),菌株接种进实验体系会有一段适应期,分泌出的水解酶数量较少,致使蛋白质水解为氨基酸速率慢;快速增加阶段(25~80 h),菌株的活性增强,蛋白质水解速率远高于氨基酸发酵速率,氨基酸浓度迅速累积到最大值;下降阶段(80 h之后),蛋白质水解的完成,氨基酸被菌株利用,浓度下降;稳定阶段,随菌株的衰亡,氨基酸浓度趋近稳定。
2.3 发酵产物变化特征
实验体系中检测出的发酵产物包括甲醇、乙醇、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸8种。图5为发酵产物的浓度变化。可知:6种有机酸的累积总浓度远远大于2种有机醇的累积总浓度,占比达到93.4%;乙酸是蛋白质发酵的主要产物,累积浓度为507.2 mg/L,占发酵产物总浓度的39.0%;丁酸和丙酸浓度大致相当,接近200 mg/L;异丁酸和异戊酸的浓度大致相同;戊酸、甲醇和乙醇的浓度均<100 mg/L,乙醇浓度最低,为23.6 mg/L。
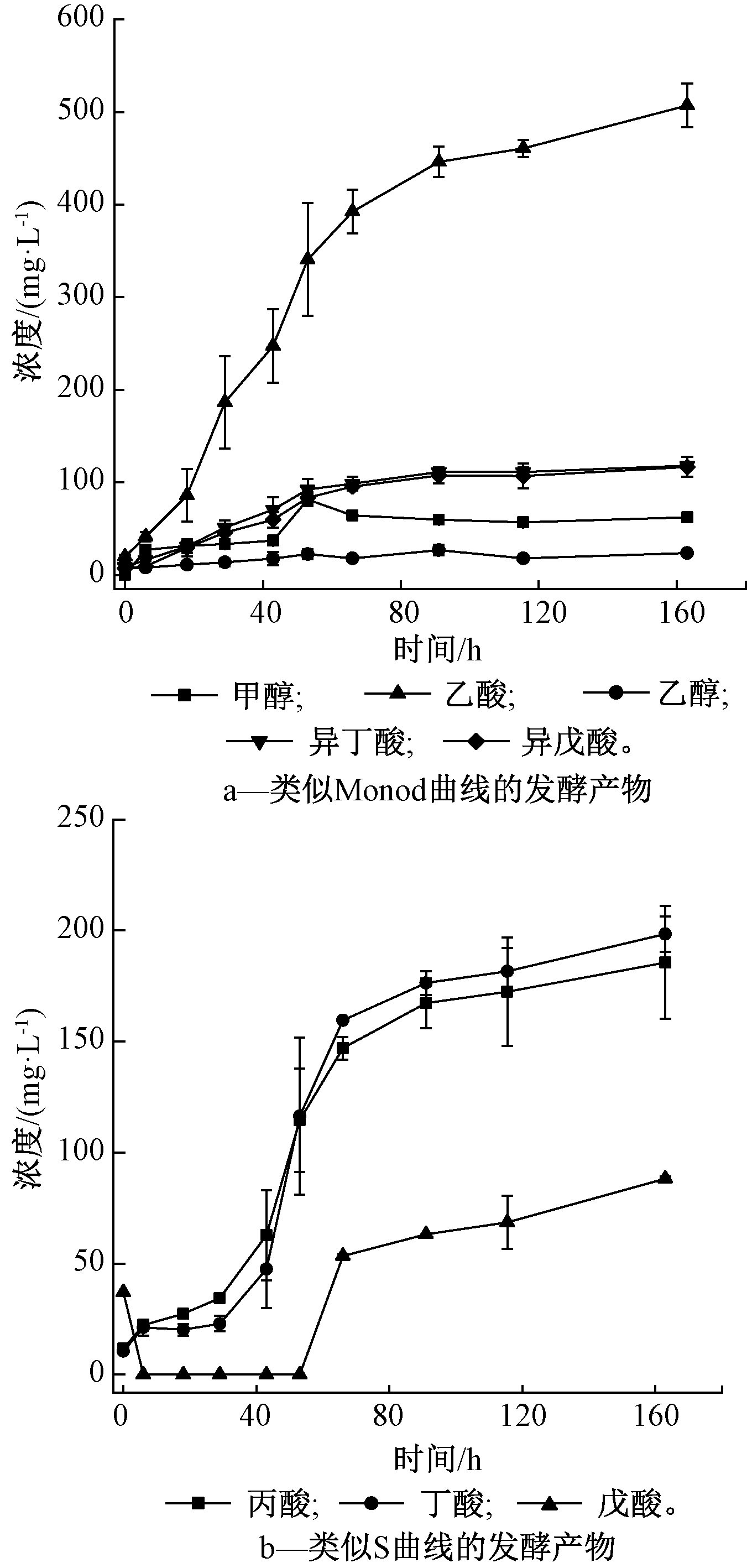
图5 发酵产物浓度的变化
Fig.5 Change in concentration of the fermentation products
发酵产物浓度随时间变化规律呈现出2种形式:Monod型和S型曲线。甲醇、乙醇、乙酸、异丁酸和异戊酸浓度随时间变化规律与Monod曲线形式类似,表现为先较快升高,后趋于平稳(图5a);丙酸、丁酸和戊酸浓度随时间变化具有S型曲线特征,表现为先缓慢升高,后较快升高,再基本保持稳定(图5b)。需要指出的是,由于接种液中存在少量发酵产物,图5中初始时刻发酵产物的浓度多数不为0。
发酵产物浓度变化出现2种规律,表面上的原因可能是氨基酸代谢途径复杂,更具体的原因可能是菌株对氨基酸的选择性利用[12]。表1为实验检测到的8种发酵产物所对应的氨基酸类型。初始时刻甲醇、乙醇、异丁酸、异戊酸的发酵产物较快积累,说明了菌株优先利用能产这些物质的氨基酸,表现出的规律符合Monod曲线形式;丙酸、丁酸和戊酸来源于多种氨基酸的发酵,前期增加缓慢,说明菌株对这些氨基酸的利用有滞后性,加之菌株接种进实验体系有适应期,使S型曲线规律更加显著。
表1 发酵产物对应的氨基酸类型
Table 1 Amino acids corresponding to the fermentation products

曲线类型发酵产物对应的氨基酸Monod甲醇文献中未报道Monod乙醇发酵产生丙酮酸的氨基酸Monod乙酸精氨酸、组氨酸、赖氨酸、酪氨酸、半胱氨酸、苏氨酸、丝氨酸、谷氨酸、天冬氨酸、甘氨酸、丙氨酸、脯氨酸Monod异丁酸缬氨酸Monod异戊酸亮氨酸、异亮氨酸S丙酸精氨酸、蛋氨酸、脯氨酸S丁酸组氨酸、赖氨酸、苏氨酸、谷氨酸S戊酸精氨酸、脯氨酸
注:乙醇对应的氨基酸关系来源于文献[13],其余的氨基酸关系来源于文献[14]。
S型曲线是经典的种群增长模型,目前已应用于厌氧消化产沼气过程[15],但在厌氧发酵产酸方面还应用较少。常见的厌氧发酵产酸模型是Monod形式[16-17],广泛应用于剩余污泥、餐厨垃圾等底物的厌氧消化过程,但基于发酵产酸过程的复杂性,应当结合产酸过程的实际情况选择合适的方程,最大程度上提高模型的适用性。很显然,在描述丙酸、丁酸和戊酸的累积浓度变化采用S型曲线更合适,根据S型曲线的特点,将其过程分为3个阶段[18]:慢速增加的初始阶段,生化过程开始减速的饱和阶段,维持最大产量的成熟阶段。S型曲线的应用价值在于可以对现有的厌氧消化模型进行适当的修正,以符合发酵产酸的实际情况。
实验发现了蛋白质发酵产物浓度变化的2种规律,而人们普遍认为仅有Monod一种形式,原因可能是文献中大多采用菌群降解复杂底物[19],蛋白质降解产生的发酵产物的规律,会受到糖类和脂质降解的产物和体系中广泛存在的抑制剂影响,加之部分发酵产物产生后,很快被其他微生物利用,很难发现其他变化规律。本实验由于采用单一菌株降解单一底物,从而能够排除不同微生物降解相互之间的影响,也能消除不同底物发酵产物之间的抑制和替代。
2.4 主要VOCs变化特征
蛋白质降解过程中,共检测出匹配度>70%的VOCs化合物44种(表2)。这44种化合物中酯类的数目最多,达到14种,碳数集中在C7—C18,其次是含硫化合物,碳数在C2—C7,相关研究也表明,有机物水解酸化阶段主要产生酯类等含氧化合物[20-21]。其他类别化合物还包括烷烃、醇类、烯烃、酸类、萜类、脂环烃、含氮化合物、酮类和芳香烃,但这9类物质化合物数目相对均较少,这些物质的碳数集中在C6—C15。除含硫化合物外,未检测到低级酸类、醇类等C1—C5的化合物,可能与检测条件有关。
表2 VOCs定性物质组成
Table 2 The qualitative analysis result of VOCs

类别物质名称酯类(14种)2-甲基丁酸乙酯、4-甲基戊酸乙酯、3-甲基丁酸异戊酯、己酸丁酯、己酸异戊酯、癸酸乙酯、十四酸乙酯、3-甲基丁酸乙酯、己酸乙酯、己酸异丁酯、苯甲酸乙酯、己酸己酯、月桂酸乙酯、十六酸乙酯含硫化合物(8种)环己硫醇、二甲基三硫、四甲基硫脲、六硫环庚烷、甲基糠基硫醚、甲苯硫醇、苯并噻唑、2-巯基苯并噻唑烷烃(5种)2,2,4,6,6-五甲基庚烷、5-甲基-十一烷、十四烷、癸烷、十二烷醇类(4种)4-甲基戊醇、2-乙基-1-己醇、3-甲基-1-己醇、十一醇烯烃(3种)2,2,4,6,6-五甲基-3-庚烯、1-十二烯、1-甲基-5-(1-甲乙基)环己烯酸类(2种)4-甲基戊酸、苯丙酸萜类(2种)α-蒎烯、柠檬烯脂环烃(2种)环十二烷、1,1,3-三甲基-3-(2-甲基-2-丙烯基)环戊烷含氮化合物(2种)2-哌啶酮、甲氧基苯基肟酮类(1种)2-十五烷酮芳香烃(1种)萘
对菌株降解蛋白质产生的脂类、含硫化合物、烷烃、醇类和烯烃5类主要的VOCs动态变化特征进行研究。脂类和烷烃的浓度呈现的动态变化趋于一致(图6a),显著升高之后迅速下降,最后基本保持稳定,最高浓度达到4.3 mg/m3;烯烃浓度波动不明显(图6a),基本保持不变,平均浓度约为0.079 mg/m3;醇类和含硫化合物浓度动态化也趋于一致(图6b),呈现出慢速升高的趋势。根据主要类别的VOCs浓度,可以看到在酪蛋白降解前期(0~60 h),恶臭污染物类别是脂类和烷烃;在酪蛋白降解中后期(60 h之后),主要恶臭污染物类别为脂类、醇类和含硫化合物。
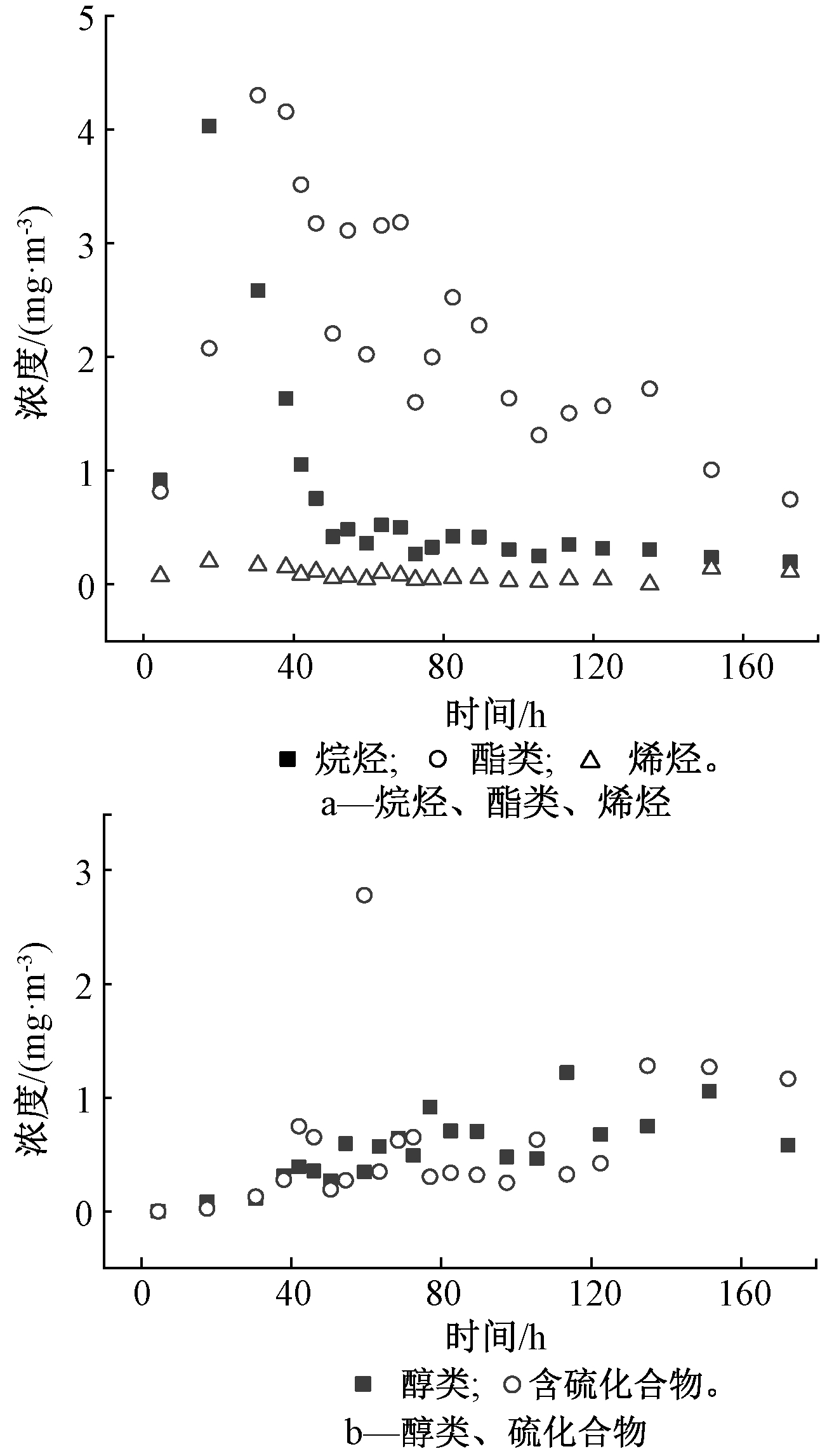
图6 主要类别VOCs的动态变化
Fig.6 Dynamic changes in concentration of major categories of VOCs
本实验条件虽然相对单一,但排除其他有机质的干扰,检测到的恶臭物质可以作为判断是否来源于蛋白质降解的参考,从而确定填埋场等厌氧消化场所中恶臭物质可能的底物来源。邓强等[10]测定了北京市安定生活垃圾填埋场排放的VOCs,共检测到48种恶臭化合物,其中己酸异戊酯、己酸己脂、2,2,4,6,6-五甲基庚烷、5-甲基-十一烷、十四烷、癸烷、十二烷、α-蒎烯、柠檬烯和甲氧基苯基肟10种恶臭物质VOCs在本实验中也检测到,说明填埋场中这些物质可能来源于酪蛋白降解。
3 结 论
1)从垃圾填埋场筛选出的厌氧水解菌,属于革兰氏阴性菌,经鉴定为Sporanaerobacter acetigenes,可生长温度为20~45 ℃,可生长pH为5.0~9.0。
2)单一菌株厌氧降解酪蛋白底物过程中,共检出8种发酵产物,包括甲醇、乙醇、乙酸、异丁酸、异戊酸、丙酸、丁酸和戊酸;共检出44种VOCs,包括脂类、含硫化合物、烷烃、醇类、烯烃、酸类、萜类、脂环烃、含氮化合物、酮类和芳香烃11类。
3)发酵产物浓度随降解的动态变化呈现出Monod型和S型曲线两种形式,可能与氨基酸的选择性利用有关;各类VOCs的动态变化规律不一,烷烃和酯类集中于降解前期排放,而醇类和含硫化合物排放量于降解后期达到最大值。
[1] 胡纪萃. 废水厌氧生物处理理论与技术[M]. 北京:中国建筑工业出版社, 2002.
[2] 杨紫怡, 王雯, 马宗虎, 等. 长链脂肪酸对餐厨垃圾厌氧消化产甲烷的影响[J]. 环境工程学报, 2017, 11(10): 5651-5657.
[3] 何琴, 李蕾, 彭爽, 等. 餐厨垃圾厌氧消化起泡现象研究[J]. 中国环境科学, 2017, 37(3): 1040-1050.
[4] 孙弘, 李清彪, 王远鹏, 等. 预处理法促进剩余活性污泥生产挥发性脂肪酸[J]. 化学工程与装备, 2009(7): 165-168.
[5] Liu H, Wang J, Liu X, et al. Acidogenic fermentation of proteinaceous sewage sludge: effect of pH[J]. Water Research, 2012, 46(3):799-807.
[6] KEGG: Kyoto Encyclopedia of Genes and Genomes数据库[EB/OL]. https://www.kegg.jp/kegg/pathway.html.
[7] 夏孟婧. 生活垃圾填埋场微生物群落结构的宏基因组学研究及厌氧水解菌的筛选[D]. 北京:北京大学, 2015.
[8] Minale M, Caserta S, Guido S. Quantitative determination of total free-amino acid in Nervilia fordii(Hance) Schltr. by Ninhydrin colorimetric method[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2010, 53(7):1849-1859.
[9] Prakasham R S, Sathish T, Brahmaiah P, et al. Biohydrogen production from renewable agri-waste blend: optimization using mixer design[J]. International Journal of Hydrogen Energy, 2009, 34(15):6143-6148.
[10] 邓强, 李振山, 刘添添, 等. 北京市安定生活垃圾填埋场VOCs恶臭物质及其臭气强度[J]. 环境科学学报, 2016, 36(1):201-209.
[11] Shen D, Yin J, Yu X, et al. Acidogenic fermentation characteristics of different types of protein-rich substrates in food waste to produce volatile fatty acids[J]. Bioresource Technology, 2017, 227:125-132.
[12] Sarmento H, Romera-Castillo C, Lindh M, et al. Phytoplankton species-specific release of dissolved free amino acids and their selective consumption by bacteria[J]. Limnology and Oceanography, 2013, 58(3):1123-1135.
[13] Bai F W, Anderson W A, Moo-Young M. Ethanol fermentation technologies from sugar and starch feedstocks[J]. Biotechnology Advances, 2008, 26(1):89-105.
[14] Ramsay I R, Pullammanappallil P C. Protein degradation during anaerobic wastewater treatment: derivation of stoichiometry[J]. Biodegradation, 2001, 12(4): 247-256.
[15] 高树梅, 赵明星, 许之扬, 等. 餐厨垃圾固渣厌氧发酵产甲烷潜力及Logistic动力学研究[J]. 安全与环境学报, 2015, 15(1): 263-268.
[16] Van Hulle S W H, Vesvikar M, Poutiainen H, et al. Importance of scale and hydrodynamics for modeling anaerobic digester performance[J]. Chemical Engineering Journal, 2014, 255:71-77.
[17] Batstone D J, Keller J, Angelidaki I, et al. The IWA anaerobic digestion model No 1 (ADM1)[J]. Water Science and Technology, 2002, 45(10):65-73.
[18] 杨雪. 强化污泥厌氧发酵产酸的效能及发酵液碳源的利用研究[D]. 哈尔滨:哈尔滨工业大学, 2012.
[19] 卢艳阳, 张又弛, 唐晓达, 等. 竹叶与餐厨垃圾厌氧共消化工艺[J]. 环境工程学报, 2015, 9(1): 407-412.
[20] Chiriac R, Morais J D A, Carre J, et al. Study of the VOC emissions from a municipal solid waste storage pilot-scale cell: comparison with biogases from municipal waste landfill site[J]. Waste Manag, 2011, 31(11):2294-2301.
[21] 段振菡. 典型生活垃圾填埋场作业面恶臭物质释放特征及源解析[D]. 北京: 清华大学, 2015.