0 引 言
重金属由于其持久性、生物毒性、不可降解性和能进入食物链的特点,甚至在一定条件下还能与某些有机物发生反应从而转化成毒性更大的金属-有机复合污染物[1],正成为最严重的环境问题之一[2-3]。水生生物如动物、植物和微生物等对重金属有一定的积累和浓缩作用[4],但当重金属的浓度和毒性超过水生生物所能承受的能力时,就会对它们的相关指标甚至生命活动等方面产生严重的毒性效应,同时会造成遗传突变或变异,进而产生物种多样性及生存方面的改变;由于重金属可以通过食物链最终传递给人等高级生物,对人体健康也产生严重威胁,如重金属进入人体后不易被排出,并不断积累,一旦超过人体的生理负荷时,就会引起生理结构病变,并导致急、慢性或长期的危害,如Zn、Cd、CH3Hg、Se、Ni等具有致畸性。在高浓度重金属环境下,摄入过量的重金属将会引起中毒,甚至可能产生严重后果[5]。
水体重金属污染是指含有重金属离子的污染物进入水体造成的污染[6],主要包括Pb、Cd、Cr、Hg、As、Mn等毒性较强的重金属,同时还包括Cu、Co、Zn、Se、Ni等一般毒性的重金属[7]。水体重金属的来源包括工业来源、农业来源和城市化来源,如来自化工、电镀、采矿及金属冶炼等行业,煤炭、石油等化石燃料的燃烧,其废气中的大量重金属进入大气后再通过降雨的形式进入水体;含重金属Cu、As、Hg、Pb等元素的化肥、农药通过农业的使用进入土壤,进而经过雨水的淋溶等方式进入水体;城市化进程的加快,使得垃圾焚烧、汽车尾气排放产生的重金属也能通过干湿沉降等途径进入水体[8]。
由于水体重金属对水生生物及人类的危害极大,众多专家学者已经开展了重金属对水生生物的生态毒性方面的研究,尤其是Hg、Cd、Pb、Cr、As等非必需元素对生物造成的急性、亚急性以及慢性中毒等毒性效应研究[9,10]。此外,也有研究人员做了重金属对人体和动物毒性或致癌方面的研究。结果表明:通过重金属Fe、Cu、Cd、Cr、Hg、Ni、Pb等的刺激作用产生的活性氧,会对机体产生一系列毒性效应,如脂质过氧化、巯基蛋白消耗,与核蛋白、DNA反应,对生物大分子物质造成损伤[11]。基于此,本文综述了水体重金属的污染现状,以及水体重金属对水生生物的生态毒性效应及其机制,并展望了重金属对水生生物生态毒性效应的未来研究重点和方向,可为重金属的水质基准和风险评估研究提供重要理论依据。
1 水体重金属污染现状
在过去的几十年里,由于工业化的迅速推进,含有重金属的工业废水、生活污水、农业杀虫剂等被排放到世界河流和湖泊中,进而在水生生物和沉积物中积累[12,13]。国内外对水体中的重金属污染状况均有很多报道,我国部分地区水体受重金属污染的情况比较严重,水体底泥中重金属污染率达到80.1%以上,而水体中99%的重金属以各种形态存储在底质沉积物中,且近年来多种重金属污染呈上升趋势[14]。谢文平等[15]在研究我国南部水体重金属污染情况时,发现贵州省地表水存在严重的重金属Cd、Pb污染现象;珠三角区域水体重金属Cr、Pb和Hg分别超标22.2%、11.1%和5.6%。张莉等[16]研究了华东地区如福建九龙江流域出现As超标情况,超标率达到14.81%。
国外对河流水体重金属污染研究较早,多瑙河、莱茵河等已成为水体重金属污染的重点研究对象[17,18];塔斯克基湖[19]、埃布罗河三角洲[20]和黑海[21]都检测出多种重金属存在;Rahman等[22]研究表明,孟加拉国Dhaka加工区内及Bangshi河的水体中重金属Pb、Cd、Cu、Zn、Mn、As、Ni和Cr的含量很高,远超过WHO及USEPA的标准。可见,目前水体重金属污染问题已成为一个全球性的环境问题。
2 水体重金属的来源及危害
2.1 水体重金属的来源
自然活动来源和人为活动来源是水体重金属的两大主要来源。其中,自然活动来源包括海洋火山喷发造成的重金属泄漏,地壳运动、岩石风化、土壤侵蚀、干湿沉降等方式也是水体重金属的重要来源途径;人为活动来源主要包括矿山采矿、油田开采、电镀冶金、废旧电器以及化工厂废水的排放,农业上农药化肥等的使用,并通过雨水冲刷等方式使得土壤里的重金属流失,进而直接或间接排放到水体中,都会对水体环境造成非常严重的重金属污染[23]。水体重金属具有污染来源广泛、停留时间漫长,且具有累积和富集浓缩特性,容易沿食物链传递,污染后不易被察觉及难以恢复等特点。
2.2 水体重金属的危害
重金属是一种原子密度>5 g/cm3的金属和类金属。一些有毒重金属如Ni、As、Cr、Zn、Cu、Cd、Co、Pb等,会对环境产生严重危害,Cd2+、Pb2+、Hg2+、Ag+和As3+等离子形式和生物组织器官发生作用,形成相应的有毒化合物,伴随着重金属生物富集和浓度的升高,所表现出来的毒性特征也不同,配体和氧化态对重金属的生物利用性起着至关重要的作用。如果重金属的累积浓度或效应达到一定限值时,以至于引起细胞新陈代谢的破坏,此时就成为有毒重金属[24]。金属的毒性效应主要引起大脑和神经系统功能损失,损害血液含量以及肝、脾、肾脏等器官,从而造成身体衰弱、记忆力减退、皮肤过敏、高血压等症状[25]。基于此,世界各地的卫生组织正在抓紧研究重金属的毒性机理,若干管理机构也已通过了含重金属废水排放的标准限值。研究人员也大力开展重金属废水处理新技术的研发,以期达到尽快减少重金属对环境危害的目的[26]。
表1列举了一些重金属污染物的来源、危害、最大有害浓度(maximum contaminant level, MCL)[27]以及GB 3838—2002《地表水环境质量标准》(Ⅲ类)限值。
表1 水体重金属来源和危害
Table 1 Sources and potential toxic effects of some heavy metals in aquatic
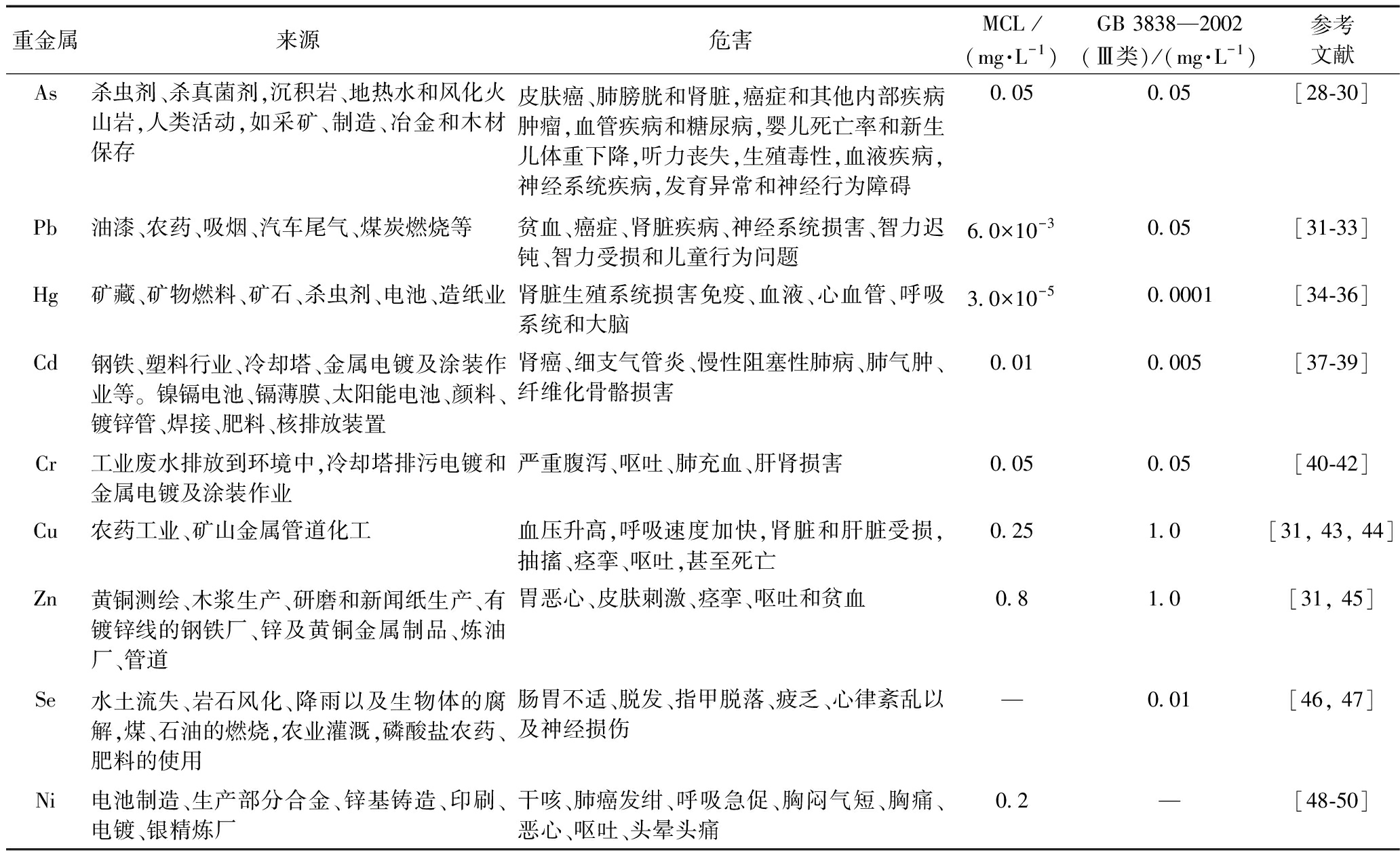
重金属来源危害MCL /(mg·L-1)GB 3838—2002(Ⅲ类)/(mg·L-1)参考文献As杀虫剂、杀真菌剂,沉积岩、地热水和风化火山岩,人类活动,如采矿、制造、冶金和木材保存皮肤癌、肺膀胱和肾脏,癌症和其他内部疾病肿瘤,血管疾病和糖尿病,婴儿死亡率和新生儿体重下降,听力丧失,生殖毒性,血液疾病,神经系统疾病,发育异常和神经行为障碍0.050.05[28-30]Pb油漆、农药、吸烟、汽车尾气、煤炭燃烧等贫血、癌症、肾脏疾病、神经系统损害、智力迟钝、智力受损和儿童行为问题6.0×10-30.05[31-33]Hg矿藏、矿物燃料、矿石、杀虫剂、电池、造纸业肾脏生殖系统损害免疫、血液、心血管、呼吸系统和大脑3.0×10-50.0001[34-36]Cd钢铁、塑料行业、冷却塔、金属电镀及涂装作业等。镍镉电池、镉薄膜、太阳能电池、颜料、镀锌管、焊接、肥料、核排放装置肾癌、细支气管炎、慢性阻塞性肺病、肺气肿、纤维化骨骼损害0.010.005[37-39]Cr工业废水排放到环境中,冷却塔排污电镀和金属电镀及涂装作业严重腹泻、呕吐、肺充血、肝肾损害0.050.05[40-42]Cu农药工业、矿山金属管道化工血压升高,呼吸速度加快,肾脏和肝脏受损,抽搐、痉挛、呕吐,甚至死亡0.251.0[31, 43, 44]Zn黄铜测绘、木浆生产、研磨和新闻纸生产、有镀锌线的钢铁厂、锌及黄铜金属制品、炼油厂、管道胃恶心、皮肤刺激、痉挛、呕吐和贫血0.81.0[31, 45]Se水土流失、岩石风化、降雨以及生物体的腐解,煤、石油的燃烧,农业灌溉,磷酸盐农药、肥料的使用肠胃不适、脱发、指甲脱落、疲乏、心律紊乱以及神经损伤—0.01[46, 47]Ni电池制造、生产部分合金、锌基铸造、印刷、电镀、银精炼厂干咳、肺癌发绀、呼吸急促、胸闷气短、胸痛、恶心、呕吐、头晕头痛0.2—[48-50]
3 重金属对水生生物的毒性效应及机制
3.1 重金属对水生生物的毒性效应
重金属主要通过以下3种途径进入水生动物体内:1)水生动物利用鳃等器官将溶解在水中的重金属离子吸收至体内,然后将重金属蓄积在皮肤表面细胞或经过血液输送至体内的各个器官或组织;2)水生动物通过摄取食物等方式,将重金属通过消化道吸收,进而进入体内;3)通过皮下层将重金属吸收,再通过重金属与体表的渗透交换作用进入体内[51]。
3.1.1 重金属的生物累积作用
水体中的重金属一旦进入生物体内,不易被代谢、分解、排除体外,非常容易在动物肝肾等器官内富集。Olivares等[52]证实,通过与机体内金属结合蛋白如金属硫蛋白相结合,是重金属在生物体内富集的主要机制。Rainbow等[53]研究发现,生物体摄入重金属的过程无需消耗能量,且不易被排出体外,进而呈现出毒性的累积效应。秦华伟等[54]研究了6种重金属对3种海水养殖生物的急性毒性效应时发现,在经过96 h的处理后,3种生物体内重金属含量明显增加。孙妮等[55]在研究湛江港海区沉积物和海洋生物中重金属的富集特征时发现,在沉积物中的重金属除Cd外,其他含量均高于其在海洋生物体中的含量;在湛江港流域的生物体内重金属Cu、Zn、Cd存在严重的富集累积情况;软体类和甲壳类对重金属Hg和Pb的富集能力相当,而软体类从沉积物中富集重金属Sn和Cd的能力强于甲壳类,富集重金属Cu的能力弱于甲壳类。Rzymski等[56]研究双壳类对不同重金属富集情况表明,双壳类对重金属Cu和Cd的富集能力非常高。Topcuo lu等[21]研究了重金属在土耳其黑海水生生物体内的含量,结果表明,Pb、Cd和Cr等在软体动物和贝类体内富集量最高,Fe和Zn富集量最少。
lu等[21]研究了重金属在土耳其黑海水生生物体内的含量,结果表明,Pb、Cd和Cr等在软体动物和贝类体内富集量最高,Fe和Zn富集量最少。
3.1.2 生物早期发育毒性
在鱼类的胚胎期和仔鱼期早期发育阶段,很容易被重金属伤害,重金属一旦进入幼体,可与生物体内的核酸、酶、维生素、激素等物质发生反应,改变其化学结构和生物活性,进而对遗传发育、内分泌以及中枢神经等多个系统的功能产生损害、引起病变甚至死亡等[57-59]。郭勇勇等[60]研究了三峡库区水样中重金属对斑马鱼(Brachydanio rerio)胚胎发育的毒性,结果表明,经7 d暴露后,虽然所有斑马鱼胚胎的孵化率、相对成活率和畸形率并无明显差异,但幼鱼体内生殖相关基因、神经发育相关基因均显著下降。张亚辉等[61]在采用斑马鱼胚胎早期发育技术测定Cu和Cd 2种重金属对胚胎发育的毒性效应,分别以24 h和72 h时达到致死和胚胎孵化抑制为终点时发现,重金属Cu和Cd对斑马鱼胚胎具有明显的毒性作用。García等[62]研究发现,海洋多毛纲动物沙蚕(Nereis succinea)的胚胎和幼虫对Ag更敏感,暴露于AgNO3中显著增加了胚胎的致死率和畸变率。Munley等[63]研究发现,水生蜗牛(Fruticicolidae)暴露于重金属Co、Cu、Pb、Ni中28 d后,抑制了其早期胚胎生长,56 d 后抑制了其产卵量。除此之外,Cu、Pb和Zn等重金属都能够显著影响生物早期胚胎的发育和孵化,进而导致胚胎发育延迟的后果[64]。
3.1.3 生物免疫毒性
通常认为,低剂量浓度的重金属或短期的暴露具有免疫刺激作用,促使生物体血细胞的吞噬活性增强[65, 66],但是高剂量浓度重金属或长期暴露能够显著干扰生物细胞的吞噬能力,主要是因为在此过程中重金属能够与细胞膜结合,从而改变细胞膜的流动性和细胞膜上离子泵的通透性,细胞膜稳定性下降,造成吞噬活性降低[67, 68]。Paul等[69]在研究Pb对淡水鱼的免疫毒性作用时发现,Pb干扰了肠巨噬细胞的噬菌作用和细胞粘着力,同时血清中的肿瘤坏死因子含量也明显下降。Qin等[70]报道称重金属Cd暴露影响了溪蟹(Potamidae)体内的酶活性。Vijayavel等[71]表明,Ni暴露促使青蟹血淋巴内超氧阴离子的生成及吞噬作用的增强,但是又显著抑制酚氧化酶的活性。Chandurvelan等[72]研究表明,重金属Cd暴露能增加河蚌体内起吞噬作用的嗜碱粒细胞和嗜酸粒细胞含量,并使细胞内DNA发生显著的损伤。
3.1.4 基因突变和变异
重金属一旦进入生物体内后会发生富集浓缩,当重金属剂量浓度超过一定量或长期暴露后会对生物体组织器官造成损伤,并诱导大量的活性氧(ROS)及亲电子代谢产物产生,进而与DNA分子结合,使得生物体内的细胞受到外界环境的氧化攻击,导致生物体内脂质发生一系列的反应,如过氧化反应、遗传物质改变、碱基核糖基氧化,进而造成某些细胞死亡或癌变[73-75]。Hix等[76]研究结果表明,DNA在被铁离子诱导以后产生的大量甲基自由基攻击时,会引起DNA高度甲基化。Pfohl-Leszkowicz等[77]的研究也表明,重金属离子能够显著抑制甲基转移酶的活性,重金属铅、铜以及锌离子等均能抑制5-甲基转移酶的活性。Rossiello等[78]的研究也表明了Pb能引起DNA低度甲基化。唐建勋等[79]在研究重金属Cu、Pb单因子及联合毒性对泥鳅(Misgurnus anguillicaudatus)卵细胞DNA的损伤效应时发现,均造成泥鳅卵细胞DNA损伤,具有基因毒性。同时,行文珍[80]研究表明,Pb和Cr对泥鳅具有不同程度的遗传毒性效应,且毒性效应在一定条件下随着处理浓度的增大和处理时间的延长而增强,达到一定浓度和时间后毒性效应则会被抑制。
3.1.5 内分泌干扰毒性
重金属暴露导致高血压和糖尿病等代谢疾病的机制之一可能是重金属、有机氯农药和多氯联苯都是典型的内分泌干扰物,进入生物体内就可以对激素合成和分泌产生干扰,并形成内分泌干扰毒性,如重金属Cd、Mn、Cr等元素会增加代谢紊乱的发病率,金属类内分泌干扰物暴露后可增加氧化应激并诱导线粒体功能紊乱的风险[81]。成年的大西洋石首鱼(Micropogonias undulatus)暴露于亚致死浓度的Pb、Cd等重金属后造成血液类固醇浓度、卵巢类固醇分泌活动和卵巢发育显著上升或下降[82]。木伟娜[83]研究表明,Cd暴露对鲤鱼(Cyprinus carpio)血浆中甲状腺激素产生较大的干扰效应。罗永巨[84]在研究Cd对吉富罗非鱼(Oreochroms mossambcus)毒性效应及繁殖力影响过程中发现,Cd能够提升血清中雌二醇的含量,但对睾丸酮含量影响不明显。在基因水平,Cd能够提高卵巢中雌激素受体(estrogen receptor, ER)的表达,但Cd暴露可以抑制卵黄蛋白原(vitellogenin, VTG)的生成。在精巢中,Cd通过提高糖皮质激素受体(glucocorticoid receptor, GR)的表达抑制精细胞和精子的发育。另外,采用经过60 d不同Cd暴露组的罗非鱼配组繁殖后代,研究Cd对罗非鱼相对产卵量、出苗数、孵化率以及崎形率的影响。Li等[85]研究发现,鲦鱼(minnow)幼体暴露于重金属Hg 4 d后,体内促肾上腺皮质激素释放激素,甲状腺球蛋白、甲状腺受体α和β基因表达被显著诱导,甲状腺素T3和T4含量增加。
3.2 重金属对水生生物的毒性效应机制
3.2.1 重金属对水生动物的毒性效应机制
一些水生动物长期生活在有重金属存在的环境中,可调整自身的生理生化指标,以提高对重金属的应激性和耐受性。例如,鱼类长期生活在有重金属污染的水体中,其体内会产生相应的蛋白质和酶来抵抗体内的重金属离子,如热激蛋白(heat shock protein, HSP)、金属硫蛋白(metallothionein, MT)、转铁蛋白(transferrins,TF)、谷胱甘肽转移酶(glutathione transferase, GT)、过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)等,从而减轻重金属对细胞的损伤[86]。重金属如Cd、Hg等进入生物体内,会与体内其他物质发生竞争作用,此时,MT的巯基能与有害重金属发生结合反应,从而发挥解毒作用,进而将重金属等有害物质排出体外[87]。SOD能够歧化超氧阴离子自由基产生H2O2,从而把对有机体有害的自由基清除,CAT可将H2O2催化生成无害的H2O和O2,同时还与SOD、POD产生协同作用,清除体内多余的自由基和过氧化物。Xu等[88]发现,MT表达量在被重金属Cd胁迫诱导后会升高,使得羟基和过氧化物得以被清除,促使机体产生抵御氧化的应激反应。Chen等[89]研究了大黄鱼肝脏中转铁蛋白在重金属Cd离子暴露下的含量变化情况时,发现其血清中的铁离子经重金属Cd离子处理后迅速升高,在24 h达到最大值,后缓慢下降并达到初始正常值。Hansen等[90]将鳟(Salmo playtcephalus)暴露于含Cd和Zn的水体15 d期间,发现鳃中Cd和Zn有显著吸收,且Cd的水平与SOD转录的水平存在显著的相关性。此外,水生动物在受到重金属污染时会分泌丰富的黏液,在一定程度上可以提高对重金属的耐受性[91]。
3.2.2 重金属对水生植物的毒性效应机制
水生植物的重金属毒性效应主要表现在破坏细胞膜结构、抑制呼吸作用、光合作用、生长发育过程,以及对遗传物质的毒害等生理生化过程。重金属进入植物体内会改变抗氧化酶活性、诱发ROS产生、引起氧化损伤效应,同时还会通过干扰一些细胞内的转录因子活性、诱发细胞凋亡等,干扰植物体内正常的生理、生化反应[11, 92]。付贵权等[93]在研究Cu胁迫对半叶马尾藻(Sargassum hemiphyllum)生长及生理生化特性的影响时发现,适当质量浓度的Cu胁迫(≤0.05 mg/L)对半叶马尾藻生长和生理生化指标有正面效应,而过高质量浓度Cu胁迫(0.05 mg/L)对藻体生长和抗逆能力有一定的负面影响。简敏菲等[94]研究Cd、Pb胁迫下湿地植物丁香蓼(Ludwigia prostrata)的生理生化特征时发现,丁香蓼生长受到显著抑制,叶绿素a、b及叶绿素a+b的含量随重金属浓度升高呈下降趋势,对丁香蓼体内的超氧化物歧化酶活性的影响表现出不同的趋势。也有研究表明,在高浓度Cu处理下,水芹(Oenanthe javanica)株高和根数都显著减少,鲜重生物量也明显降低,同时叶绿素总量、叶绿素a和可溶性蛋白总体均呈下降趋势[95]。另外,植物细胞的超微结构及细胞膜的通透性,生长发育、水分及营养元素的吸收代谢、光合作用、呼吸作用、体内的抗氧化酶活性、体内的遗传物质等方面也受到重金属的严重影响[96]。
3.2.3 重金属对水生微生物的毒性效应机制
细菌和真菌是水生态系统中常见的微生物,是生物的分解者和微型消费者,同时也是初级生产者,例如自养菌类光合细菌等。微生物通过细胞次生代谢产物如有机酸、糖蛋白、多糖等的分泌来增强细胞对重金属胁迫等环境的适宜性,这些胞外代谢物靠和重金属离子结合来提高细胞的抗逆性,但是,重金属离子常常会对生物体产生氧化损伤作用,进而诱导产生过量的氧自由基,造成生物体的细胞膜被破坏,同时破坏生物体正常的呼吸代谢途径[97]。张博文等[97]研究了滏阳河河流水体中重金属对青海弧菌Q67毒性,重金属离子抑制了还原型黄素单核苷酸与氧化型黄素单核苷酸活性,使得它们之间的转化不能正常进行。许飘[98]用白腐真菌吸附重金属结果发现,高浓度Cd胁迫可显著抑制黄孢原毛平革菌的生长,并导致菌丝体形态变化以及木质素降解酶系(LiP和MnP)活性降低。周上洋等[99]应用基因重组发光菌E.coli HB101 pUCD607研究了Zn2+、Cu2+、Hg+的单一毒性和二元混合体系的联合毒性,实验结果表明,单一重金属离子对基因重组发光菌的毒性顺序为Hg+>Zn2+>Cu2+。
4 结论与展望
水体重金属污染已经成为一个全球性的问题,重金属一旦进入水体将不能被去除,只能通过一系列的物理化学反应使重金属发生形态上的迁移、转化,最终在水体各组分之间形成一个复杂的体系。目前,世界各国的专家学者对重金属的毒性效应、机制等方面已经做了很多研究,在后续的研究工作中,提出以下几点建议:
1)由于一些新兴污染物如抗生素、微塑料等进入水体,联合水体颗粒物、溶解性有机物 (dissolved organic material, DOM)等与重金属形成一个更为复杂的体系,水环境因子对金属生物有效性的影响和机制研究应成为研究重点。
2)一些重金属可能是微量级的,但重金属在迁移、转化过程中是否发生毒性效应的改变应该被持续追踪,并建立相应的模型,以监督、预测、评估重金属的毒性变化情况。
[1] 傅海霞, 刘怡, 董志英, 等. 抗生素与重金属复合污染的生态毒理效应研究进展[J]. 环境工程, 2016, 34 (4): 60-63.
[2] Maceda-Veiga A, Monroy M, Navarro E, et al. Metal concentrations and pathological responses of wild native fish exposed to sewage discharge in a mediterranean river[J]. Science of the Total Environment, 2013, 449 (2): 9-19.
[3] Yohannes Y B, Ikenaka Y, Nakayama S M M, et al. Organochlorine pesticides and heavy metals in fish from Lake Awassa, Ethiopia: insights from stable isotope analysis[J]. Chemosphere, 2013, 91 (6): 857-863.
[4] Rose M, Fernandes A, Mortimer D, et al. Contamination of fish in UK fresh water systems: risk assessment for human consumption[J]. Chemosphere, 2015, 122 (2): 183-189.
[5] 赵岩. 几种重金属对孔雀鱼的毒性效应研究[D]. 济南:山东师范大学, 2010.
[6] 杨瑞香. 水体重金属污染来源及治理技术研究进展[J]. 资源节约与环保, 2016(4):66-66.
[7] 张坤, 罗书. 水体重金属污染治理技术研究进展[J]. 中国环境管理干部学院学报, 2010, 20(3):62-64.
[8] 张聪, 宋超, 胡庚东, 等. 中国渔业水体重金属的污染现状及消除技术研究进展[J]. 中国农学通报, 2018, 34(2): 141-145.
[9] Mann R M, Hyne R V, Choung C B, et al. Amphibians and agricultural chemicals: review of the risks in a complex environment[J]. Environmental Pollution, 2009, 157 (11): 2903-2927.
[10] Strong R J, Halsall C J, Feren ík M, et al. Biospectroscopy reveals the effect of varying water quality on tadpole tissues of the common frog (Rana temporaria)[J]. Environmental Pollution, 2016, 213: 322-337.
ík M, et al. Biospectroscopy reveals the effect of varying water quality on tadpole tissues of the common frog (Rana temporaria)[J]. Environmental Pollution, 2016, 213: 322-337.
[11] Morcillo P, Esteban M  , Cuesta A. Heavy metals produce toxicity, oxidative stress and apoptosis in the marine teleost fish SAF-1 cell line[J]. Chemosphere, 2016, 144: 225-233.
, Cuesta A. Heavy metals produce toxicity, oxidative stress and apoptosis in the marine teleost fish SAF-1 cell line[J]. Chemosphere, 2016, 144: 225-233.
[12] Rahmana M S, Saha N, Rahman A. Study on heavy metals levels and its risk assessment in some edible fishes from Bangshi River, Savar, Dhaka, Bangladesh[J]. Food Chemistry, 2012, 134 (4): 1847-1854.
[13] Saha N, Zaman M R. Evaluation of possible health risks of heavy metals by consumption of foodstuffs available in the central market of Rajshahi City, Bangladesh[J]. Environmental Monitoring & Assessment, 2013, 185 (5): 3867-3878.
[14] 牛勇, 余辉, 张敏, 等. 太湖流域典型河流沉积物重金属污染特征及生态风险评价[J]. 环境工程, 2013, 31 (5): 151-155.
[15] 谢文平, 陈昆慈, 朱新平, 等. 珠江三角洲河网区水体及鱼体内重金属含量分析与评价[J]. 农业环境科学学报, 2010, 29 (10): 1917-1923.
[16] 张莉, 祁士华, 瞿程凯, 等. 福建九龙江流域重金属分布来源及健康风险评价[J]. 中国环境科学, 2014, 34 (8): 2133-2139.
[17] Gioda A, Ventura L M B, Ramos M B, et al. Half century monitoring air pollution in a megacity: a case study of Rio de Janeiro[J]. Water Air & Soil Pollution, 2016, 227 (3): 1-17.
[18] Izzo L, Griffiths P C, Nilmini R, et al. Application of geoaccumulation index and enrichment factor for assessing metal contamination in the sediments of Kafrain Dam, Jordan[J]. Environmental Monitoring & Assessment, 2011, 178 (1/2/3/4): 95-109.
[19] Ikem, Egiebor N O, et al. Trace elements in water, fish and sediment from Ttuskegee Lake, southeastern USA[J]. Water Air & Soil Pollution, 2003, 149 (1/2/3/4): 51-75.
[20] Ramos L, Fernández M A, González M J, et al. Heavy metal pollution in water, sediments, and earthworms from the Ebro River, Spain[J]. Bulletin of Environmental Contamination & Toxicology, 1999, 63 (3): 305-311.
[21] Topcuo lu S, Kirba
lu S, Kirba o
o lu C, Güngör N. Heavy metals in organisms and sediments from turkish coast of the black sea, 1997—1998[J]. Environment International, 2002, 27 (7): 521-526.
lu C, Güngör N. Heavy metals in organisms and sediments from turkish coast of the black sea, 1997—1998[J]. Environment International, 2002, 27 (7): 521-526.
[22] Rahman M S, Saha N, Molla A H, et al. Assessment of anthropogenic influence on heavy metals contamination in the aquatic ecosystem components: water, sediment, and fish[J]. Journal of Soil Contamination, 2014, 23 (4): 353-373.
[23] Joseph L, Jun B-M, Flora J R V, et al. Removal of heavy metals from water sources in the developing world using low-cost materials: a review[J]. Chemosphere, 2019, 229: 142-159.
[24] Salman M, Athar M, Farooq U. Biosorption of heavy metals from aqueous solutions using indigenous and modified lignocellulosic materials[J]. Reviews in Environmental Science & Bio/technology, 2015, 14 (2): 211-228.
[25] Olga K, Violetta S, Michaela G, et al. Sunflower plants as bioindicators of environmental pollution with lead (Ⅱ) ions[J]. Sensors, 2009, 9 (7): 5040-5058.
[26] Dhir B, Sharmila P, Saradhi P P. Potential of aquatic macrophytes for removing contaminants from the environment[J]. Critical Reviews in Environmental Science & Technology, 2009, 39 (9): 754-781.
[27] Babel S, Kurniawan T A. A research study on (Cr(Ⅵ) removal from contaminated wastewater using natural zeolite[J]. Journal of Ion Exchange, 2003, 14 (Supplement): 289-292.
[28] Chen R Z, Zhi C Y, Yang H, et al. Arsenic (Ⅴ) adsorption on Fe3O4 nanoparticle-coated boron nitride nanotubes[J]. Journal of Colloid and Interface Science, 2011, 359(1):261-268.
[29] Ntim S A, Mitra S. Adsorption of arsenic on multiwall carbon nanotube-zirconia nanohybrid for potential drinking water purification[J]. Journal of Colloid and Interface Science, 2012, 375(1):154-159.
[30] Baskan M B, Pala A. Removal of arsenic from drinking water using modified natural zeolite[J]. Desalination, 2011, 281:396-403.
[31] Fu F L, Wang Q. Removal of heavy metal ions from wastewaters: a review[J]. Journal of Environmental Management, 2011, 92(3):407-418.
[32] Qu X, Alvarez P J J, Li Q. Applications of nanotechnology in water and wastewater treatment[J]. Water Research, 2013, 47(12):3931-3946.
[33] Salem A, Sene R A. Removal of lead from solution by combination of natural zeolite-kaolin-bentonite as a new low-cost adsorbent[J]. Chemical Engineering Journal, 2011, 174(2/3):619-628.
[34] Wajima T, Sugawara K. Adsorption behaviors of mercury from aqueous solution using sulfur-impregnated adsorbent developed from coal[J]. Fuel Processing Technology, 2011, 92(7):1322-1327.
[35] Natale F D, Erto A, Lancia A, et al. Mercury adsorption on granular activated carbon in aqueous solutions containing nitrates and chlorides[J]. Journal of Hazardous Materials, 2011, 192(3):1842-1850.
[36] Shamsijazeyi H, Kaghazchi T. Investigation of nitric acid treatment of activated carbon for enhanced aqueous mercury removal[J]. Journal of Industrial and Engineering Chemistry, 2010, 16(5):852-858.
[37] Ihsanullah, Al-Khaldi F A, Abusharkh B, et al. Adsorptive removal of cadmium(Ⅱ) ions from liquid phase using acid modified carbon-based adsorbents[J]. Journal of Molecular Liquids, 2015, 204:255-263.
[38] Arias M, Barral M T, Mejuto J C. Enhancement of copper and cadmium adsorption on kaolin by the presence of humic acids.[J]. Chemosphere, 2002, 48(10):1081-1088.
[39] Vukovic G D, Marinkovic A D, Colic M, et al. Removal of cadmium from aqueous solutions by oxidized and ethylenediamine-functionalized multi-walled carbon nanotubes[J]. Chemical Engineering Journal, 2010, 157(1):238-248.
[40] Ihsanullah, Al-Khaldi F A, Abu-Sharkh B, et al. Effect of acid modification on adsorption of hexavalent chromium (Cr(Ⅵ)) from aqueous solution by activated carbon and carbon nanotubes[J]. Desalination & Water Treatment, 2016, 57(16):7232-7244.
[41] Liu S S, Chen Y Z, Zhang L D, et al. Enhanced removal of trace (Cr(Ⅵ)) ions from aqueous solution by titanium oxide-Ag composite adsorbents[J]. Journal of Hazardous Materials, 2011, 190(1/2/3):723-728.
[42] Li Y C, Jin Z H, Li T. A novel and simple method to synthesize SiO2-coated Fe nanocomposites with enhanced Cr (Ⅵ) removal under various experimental conditions[J]. Desalination, 2012, 288:118-125.
[43] Awual M R, Ismael M, Yaita T, et al. Trace copper(Ⅱ) ions detection and removal from water using novel ligand modified composite adsorbent[J]. Chemical Engineering Journal, 2013, 222:67-76.
[44] Al-Rashdi M, Johnson D J, Hilal N. Removal of heavy metal ions by nanofiltration[J]. Desalination, 2013, 315:2-17.
[45] Deliyanni E A, Peleka E N, Matis K A. Removal of zinc ion from water by sorption onto iron-based nanoadsorbent[J]. Journal of Hazardous Materials, 2007, 141(1):176-184.
[46] 李润, 杨军强, 孙雪杰, 等. 环境水样中Se(Ⅳ)/Se(Ⅵ)的分析方法研究进展[J]. 环境化学, 2017, 36(5):939-950.
[47] 雒昆利, 李会杰, 陈同斌, 等. 云南昭通氟中毒区煤、烘烤粮食、黏土和饮用水中砷、硒、汞的含量[J]. 煤炭学报, 2008, 33(3):289-294.
[48] Mobasherpour I, Salahi E, Ebrahimi M. Removal of divalent nickel cations from aqueous solution by multi-walled carbon nano tubes: equilibrium and kinetic processes[J]. Research on Chemical Intermediates, 2012, 38(9):2205-2222.
[49] Reddad Z, Gerente C, Andres Y, et al. Adsorption of several metal ions onto a low-cost biosorbent: kinetic and equilibrium studies[J]. Environmental Science and Technology, 2002, 36(9):2067-2073.
[50] Omer Y, Altunkaynak Y, Fuat Güzel. Removal of copper, nickel, cobalt and manganese from aqueous solution by kaolinite[J]. Water Research, 2003, 37(4):948-952.
[51] 龙昱, 罗永巨, 肖俊, 等. 重金属胁迫对鱼类影响的研究进展[J]. 南方农业学报, 2016, 47 (9): 1608-1614.
[52] Olivares H G, Lagos N M, Gutierrez C J, et al. Assessment oxidative stress biomarkers and metal bioaccumulation in macroalgae from coastal areas with mining activities in Chile[J]. Environmental Monitoring & Assessment, 2016, 188 (1): 1-11.
[53] Rainbow P S, 唐森铭. 海洋生物对重金属的积累及意义[J]. 海洋环境科学, 1992(1): 44-52.
[54] 秦华伟,刘爱英,谷伟丽,等. 6种重金属对3种海水养殖生物的急性毒性效应[J]. 生态毒理学报, 2015, 10 (6): 287-296.
[55] 孙妮, 黄蔚霞, 于红兵. 湛江港海区沉积物和海洋生物中重金属的富集特征分析与评价[J]. 海洋环境科学, 2015, 34 (5): 669-672.
[56] Rzymski P, Niedzielski P, Klimaszyk P, et al. Bioaccumulation of selected metals in bivalves (Unionidae) and Phragmites australis inhabiting a municipal water reservoir[J]. Environmental Monitoring & Assessment, 2014, 186 (5): 3199-212.
[57] 孟娣, 王潇, 王赛赛, 等. 水体中典型重金属和全氟化合物对水生生物的联合毒性[J]. 生态毒理学报, 2018, 13 (2): 16-25.
[58] Jakubowski, Marek. Handbook on the Toxicology of Metals[M]. 4 Edition, 2015.
[59] Tolins M, Ruchirawat M, Landrigan P. The developmental neurotoxicity of arsenic: cognitive and behavioral consequences of early life exposure[J]. Annals Global Health, 2014, 80 (4): 303-314.
[60] 郭勇勇, 华江环, 杨丽华, 等. 三峡库区水样中重金属含量及其对斑马鱼胚胎发育的毒性评价[J]. 水生生物学报, 2015,39(5):885-892.
[61] 张亚辉, 刘征涛, 王一喆, 等. Cu2+和Cd2+对斑马鱼胚胎早期发育的联合毒性[J]. 环境科学研究, 2010, 23 (11): 1415-1420.
[62] García-Alonso J, Rodriguez-Sanchez N, Misra S K, et al. Toxicity and accumulation of silver nanoparticles during development of the marine polychaete Platynereis dumerilii[J]. Science of the Total Environment, 2014, 476/477 (1): 688-695.
[63] Munley, Kathleen M, Kevin V, et al. Growth inhibition in early life-stage tests predicts full life-cycle toxicity effects of lead in the freshwater pulmonate snail, Lymnaea stagnalis[J]. Aquatic Toxicology, 2013, 128/129: 60-66.
[64] Salvaggio A, Marino F, Albano M, et al. Toxic Effects of Zinc Chloride on the Bone Development in Danio rerio (Hamilton, 1822)[J]. Frontiers in Physiology, 2016, 7 (56).
[65] Hannam M L, Bamber S D, Sundt R C, et al. Immune modulation in the blue mussel Mytilus edulis exposed to North Sea produced water[J]. Environmental Pollution, 2009, 157 (6): 1939-1944.
[66] Rickwood C J, Galloway T S. Acetylcholinesterase inhibition as a biomarker of adverse effect: a study of Mytilus edulis exposed to the priority pollutant chlorfenvinphos[J]. Aquatic Toxicology, 2004, 67 (1): 45-56.
[67] Camus L, Jones M B, Børseth J F, et al. Total oxyradical scavenging capacity and cell membrane stability of haemocytes of the Arctic scallop, Chlamys islandicus, following benzo(a)pyrene exposure[J]. Marine Environmental Research, 2002, 54 (3/4/5): 425-430.
[68] Grundy M M, Moore M N, Howell S M, et al. Phagocytic reduction and effects on lysosomal membranes by polycyclic aromatic hydrocarbons, in haemocytes of Mytilus edulis[J]. Aquatic Toxicology, 1996, 34 (4): 273-290.
[69] Paul N, Chakraborty S, Sengupta M. Lead toxicity on non-specific immune mechanisms of freshwater fish Channa punctatus[J]. Aquatic Toxicology, 2014, 152 (5): 105-112.
[70] Qin Q, Sheng J Q, Lan W, et al. Immune responses and ultrastructural changes of hemocytes in freshwater crab Sinopotamon henanense exposed to elevated cadmium[J]. Aquatic Toxicology, 2012, 106 (1): 140-146.
[71] Vijayavel K, Gopalakrishnan S, Thiagarajan R, et al. Immunotoxic effects of nickel in the mud crab Scylla serrata[J]. Fish & Shellfish Immunology, 2009, 26 (1): 133-139.
[72] Chandurvelan R, Marsden I D, Gaw S, et al. Waterborne cadmium impacts immunocytotoxic and cytogenotoxic endpoints in green-lipped mussel, Perna canaliculus[J]. Aquatic Toxicology, 2013, s142/143 (66): 283-293.
[73] Waisberg M, Joseph P B, Beyersmann D. Molecular and cellular mechanisms of cadmium carcinogenesis[J]. Toxicology, 2003, 192 (2): 95-117.
[74] Thomas R E, Mandy L, Harris P M, et al. Induction of DNA strand breaks in the mussel (Mytilus trossulus) and clam (Protothaca staminea) following chronic field exposure to polycyclic aromatic hydrocarbons from the Exxon Valdez spill[J]. Marine Pollution Bulletin, 2007, 54 (6): 726-732.
[75] Pan L, Ren J, Jing L. Effects of benzo(k)fluoranthene exposure on the biomarkers of scallop Chlamys farreri[J]. Comparative Biochemistry and Physiology Part C Toxicology & Pharmacology, 2005, 141 (3): 248-256.
[76] Hix S, Augusto O. DNA methylation by tert-butyl hydroperoxide-iron (Ⅱ): a role for the transition metal ion in the production of DNA base adducts[J]. Chemico-Biological Interactions, 1999, 118 (2): 141-149.
[77] Pfohl-Leszkowicz A, Baldacini O, Keith G, et al. Stimulation of rat kidney, spleen and brain DNA-(cytosine-5)-methyltransferases by divalent cobalt ions [J]. Biochimie, 1987, 69 (11): 1235-1242.
[78] Rossiello M R, Aresta A M, Prisco M, et al. DNA hypomethylation during liver cell proliferation induced by a single dose of lead nitrate[J]. Bollettino Della Societa Italiana Di Biologia Sperimentale, 1991, 67 (12): 993-997.
[79] 唐建勋, 唐奕扬, 孙红祥, 等. 重金属Cu2+、Pb2+单因子及联合毒性对泥鳅卵细胞DNA的损伤效应[J]. 水生生物学报, 2013, 37 (3): 501-506.
[80] 行文珍. 重金属铅、铬对泥鳅的组织学损伤与遗传毒性效应[D]. 延安:延安大学, 2016.
[81] Rafa P, Pawe G, Malgorzata P, et al. Relationship between chronic exposure to lead, cadmium and manganese, blood pressure values and incidence of arterial hypertension[J]. Medycyna Pracy, 2010, 61 (1): 5-14.
[82] Nunez B S, Applebaum S L. Tissue-and sex-specific regulation of CYP19A1 expression in the Atlantic croaker (Micropogonias undulatus)[J]. General and Comparative Endocrinology, 2006, 149 (2): 205-216.
[83] 木伟娜. 低剂量三丁基锡和镉联合暴露对鲤鱼甲状腺轴及抗氧化指标的影响[D]. 武汉:华中农业大学, 2017.
[84] 罗永巨. 镉对吉富罗非鱼毒性效应及繁殖力影响的研究[D]. 南京:南京农业大学, 2015.
[85] Li Z H, Chen L, Wu Y H, et al. Alteration of thyroid hormone levels and related gene expression in Chinese rare minnow larvae exposed to mercury chloride[J]. Environ Toxicol Pharmacol, 2014, 38 (1): 325-331.
[86] 丁为群, 刘迪秋, 葛锋, 等. 鱼类对重金属胁迫的分子反应机理[J]. 生物学杂志, 2012, 29 (2): 84-87.
[87] 盛樟, 竺俊全. 水生动物金属硫蛋白分子毒理学研究进展[J]. 生物学杂志, 2014, 31 (2): 77-81.
[88] Xu D, Bo Y, Yan Z, et al. Metallothionein protein expression of Crassostrea hongkongensis in response to cadmium stress[J]. Journal of Shellfish Research, 2015, 34 (2): 311-318.
[89] Chen J, Shi Y H, Li M Y, et al. Changes in transferrin and hepcidin genes expression in the liver of the fish Pseudosciaena crocea following exposure to cadmium[J]. Archives of Toxicology, 2008, 82 (8): 525-530.
[90] Hansen B H, Rømma S, Søfteland L I R, et al. Induction and activity of oxidative stress-related proteins during waterborne Cu-exposure in brown trout (Salmo trutta)[J]. Chemosphere, 2006, 65 (10): 1707-1714.
[91] Rhee J S, Kim B M, Jeong C B, et al. Development of enzyme-linked immunosorbent assay (ELISA) for glutathione S-transferase (GST-S) protein in the intertidal copepod Tigriopus japonicus and its application for environmental monitoring[J]. Chemosphere, 2013, 93 (10): 2458-2466.
[92] Sevcikova M, Modra H, Slaninova A, et al. Metals as a cause of oxidative stress in fish: a review[J]. Veterinární Medicína, 2011, 56 (11): 537-546.
[93] 付贵权, 韩婷婷, 巩秀玉, 等. 重金属Cu2+胁迫对半叶马尾藻生长及生理生化特性的影响[J]. 南方水产科学, 2015, 11 (4): 34-39.
[94] 简敏菲, 史雅甜, 陈涛, 等. 重金属镉、铅胁迫下湿地植物丁香蓼的生理生化特征研究[J]. 江西师范大学学报(自然版), 2017, 41 (1): 93-98.
[95] 张静, 赵秀侠, 汪翔, 等. 重金属镉(Cd)胁迫对水芹生长及生理特性的影响[J]. 植物生理学报, 2015,51(11): 1969-1974.
[96] 李菲菲. 重金属元素铅(Pb)和镉(Cd)对浮水植物紫背浮萍(Spirodela polyrrhiza)的毒理学效应研究[D]. 南京:南京师范大学, 2016.
[97] 张博文, 赵甲亭, 吴二威, 等. 滏阳河河流水体中重金属污染特征及其对青海弧菌和斜生栅藻的毒性效应[J]. 生态毒理学报, 2018, 13 (1): 179-189.
[98] 许飘. 白腐真菌对重金属的吸附富集特性及其重金属耐受性和抗性机制研究[D]. 长沙:湖南大学, 2016.
[99] 周上洋, 赵建亮, 黄国勇, 等. 重金属Zn、Cu和Hg对基因重组发光菌的综合毒性及其联合效应[J]. 华南师范大学学报(自然科学版), 2018, 50(1): 33-37.