0 引 言
锌作为一种生命体必需的微量元素[1],存在于人体各种器官和酶类中。人体每天所摄入锌的量为10~15 mg,而成人体内含锌2~3 g[2]。由于锌是微量元素,若超过生物体需求量限度,则转变成1种有毒物质,对生命体产生一定的毒性效应[3-5]。根据美国颁布的锌的基准[6],保护淡水水生生物的基准值为120 μg/L,保护人体健康的基准值则为7400 μg/L(食用水+水生生物),明显看出水生生物对锌的敏感性远高于人体,因此多数国家制定锌的水产用水水质基准要严于饮用水水质基准。
水环境因子会对重金属的毒性产生影响,尤其是硬度对重金属毒性的影响较大[7-9]。由于我国地域广阔,河流湖泊的硬度范围广且硬度差异明显。据报道,地表水总硬度为4.5~15600 mg/L(以CaCO3计)[10]。目前欧美等国关于锌在不同水体硬度下对鲑科鱼类和大型蚤的毒性进行了一系列研究[11-16],可以看出水体硬度对锌毒性的影响要高于其他水质参数[16]。目前国内对于不同硬度下锌对本土物种的毒性还鲜有研究。鉴于此,本研究选取我国本土物种,在水体硬度为0~500 mg/L(以CaCO3计)下,探究锌毒性效应的变化,并推导锌的短期危害浓度值(HC5),这为锌的水质基准/标准的制定及管理提供科学依据。
1 研究方法
1.1 实验材料和物种
ZnSO4·7H2O(纯度>99.0%)分析纯,购自于美国Sigma-Aldrich化学品公司;分析纯CaCl2·2H2O(纯度为99.0%~103.0%)和优级纯HCl(纯度>99.0%)购自于中国国药集团化学试剂有限公司;优级纯MgSO4·7H2O(纯度>99.5%)、优级纯KCl(纯度>99.8%)、分析纯NaHCO3(纯度>99.5%)和优级纯NaOH(纯度>98.0%)购自于中国天津京科精细化工研究所;YD300型水质硬度计购自于上海三信科学仪器公司; 7800-ICP-MS购自于美国安捷伦公司。
依据OECD标准配制的标准稀释水在使用前需要连续曝气至少24 h,ρ(DO)>8 mg/L(或者空气饱和值的80%以上),同时也要满足pH=7.8±0.2,c(Ca)∶c(Mg)=4∶1,c(Na)∶c(K)=10∶1,Ca2+和Mg2+的浓度之和为2.5 mmol/L, 总硬度为(250±25) mg/L(以CaCO3计)[17-20]。
本次研究中,依据我国发布的HJ 831—2017《淡水水生生物水质基准制定指南》[21],受试物种选取我国水环境中普遍存在的8种水生动物,依次为泥鳅、麦穗鱼、青虾、中华圆田螺、大型蚤、中华大蟾蜍幼体(蝌蚪)、霍甫水丝蚓和摇蚊幼虫,来进行不同水体硬度下锌的短期急性毒性实验。在进行实验前对受试物种至少驯养1周,而其他步骤则遵循OECD、ASTM[22]。
1.2 毒性测试条件
对泥鳅、麦穗鱼、青虾、中华圆田螺和中华大蟾蜍幼体(蝌蚪)物种采取流水实验,并且前4种动物实验所需的缸体水量≥1 g/L,但换水频率<5倍[17]。实验所需的霍甫水丝蚓、摇蚊幼虫和大型蚤则选用半静态实验,同时每天更换1次相应锌浓度和硬度的水样。实验中添加适量一定浓度的MgSO4和CaCl2溶液调节每组溶液的硬度,再用NaOH和HCl调节溶液pH=7.0±0.2,高于此值时锌溶解度大幅下降。实验过程中昼夜时间比为12 h∶12 h,控制水浴温度为(20.0±1.0) ℃,每个浓度做3组平行样,每组样品投入10个受试动物进行实验。在开始实验前24 h禁止喂食受试动物,实验过程中保证每天对每个实验缸体中溶液温度、溶解氧、pH、硬度以及Zn浓度测定1次,以防上述参数改变而影响实验的准确性。其中暴露前后用ICP-MS测定Zn的实际浓度。同时每天观察记录受试动物的生长状况,每天记录死亡数目并计算96 h半数致死浓度(LC50)。
1.3 数据统计
1.3.1 毒性计算方法
选取符合统计分析的死亡率数据,实验物质浓度作为横坐标,死亡率作为纵坐标,采取概率单位分析法(probit analysis),从而计算出各受试生物的96 h LC50/EC50值(大型蚤则为48 h LC50/EC50值)。
1.3.2 物种敏感度分布法推导水质基准
物种敏感度分布法是目前我国用于水质基准推导的标准方法[21],是用污染物的效应浓度与物种受危害的累积概率拟合形成的分布曲线[21,23]。大致步骤如下:1)确定毒性数据累积概率,并进行排序;2)模型拟合,构建物种敏感度分布曲线(SSD);3)根据SSD外推获得保护95%物种对应的危害浓度(HC5)[24],再除以评价因子,可得污染物的淡水水生生物水质基准[21, 25-27]。
2 结果与讨论
2.1 不同水体硬度下锌的急性毒性
通过实验发现,水体硬度为0~500 mg/L,受试动物均能短期生存,其死亡率接近于0。根据投入的溶液中硬度和锌浓度差异,可将受试动物的死亡情况分为2个阶段(图1):当硬度从500 mg/L降到100 mg/L时,锌毒性对生物的影响缓慢增加,表明当水体硬度为中硬度或者高硬度时,锌毒性的变化不是很明显,而且毒性存在2~4倍的差距。当硬度从100 mg/L降到0时,此时锌毒性对生物的危害程度增加明显,表明在软水条件下,锌毒性的变化差距高达6~10倍。本研究表明,与前人对重金属的研究结果比较,Zn的毒性也会随着水体硬度的增加而降低[16,28-29]。同时也说明此规律不仅对国外鲑科鱼类适用[30-32],而且对我国本土物种也适用。
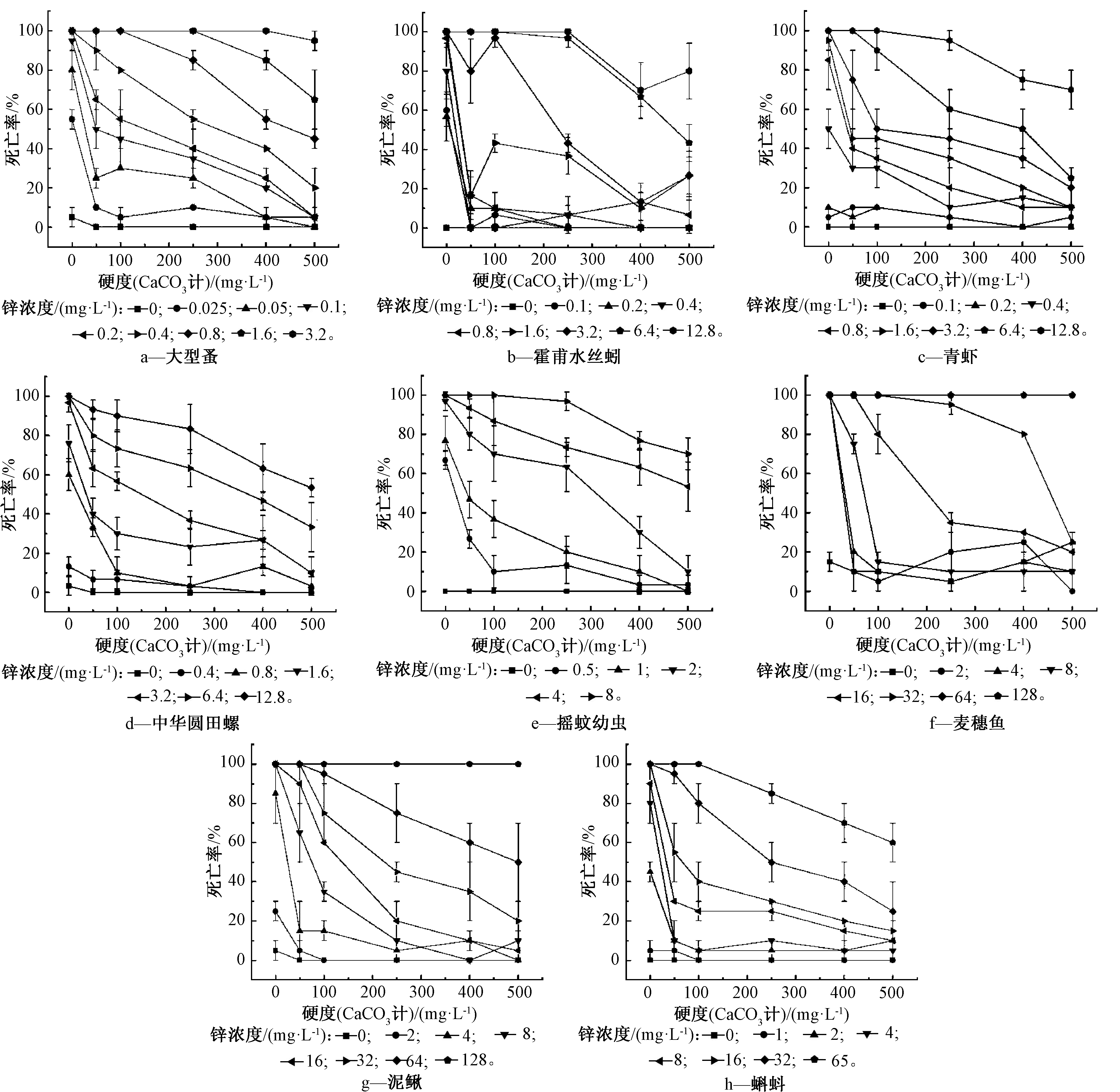
图1 不同水体硬度下受试物种的死亡率
Fig.1 Mortality rate of test species under different water hardness
目前关于水体硬度对重金属毒性影响的机理解释有以下2种[33,34]:1)当水体硬度较高时,![]() 可与水中重金属离子形成络合态离子或形成沉淀,并与水中Ca2+、Mg2+共同作用而形成众多不溶于水的碳酸盐,进而吸附在鱼鳃上,抑制生物对重金属的吸收作用[33];2)在高硬度水体中,Ca2+和Mg2+浓度较高,而且在细胞膜上与重金属离子存在竞争吸附关系,因此减少了生物膜对重金属离子的吸收,由此导致生物对重金属的吸收受抑制[34]。本研究发现,当硬度为0~500 mg/L时,所有实验组均未产生沉淀,又通过ICP-MS测定各实验组Zn浓度,发现Zn2+实际浓度与表观浓度的差距<10%,因此与Ca2+、Mg2+共同作用形成不溶性碳酸盐吸附在鳃上的现象并不明显。同时在实验过程中,为了满足水体中不同硬度的要求,n(Ca2+)∶n(Mg2+)始终维持在2∶1,只改变Ca2+和Mg2+总量,此时会对锌毒性产生一定影响。鉴于此,机理1)不太合理,而机理2)对于重金属离子的竞争吸附解释更加合理。
可与水中重金属离子形成络合态离子或形成沉淀,并与水中Ca2+、Mg2+共同作用而形成众多不溶于水的碳酸盐,进而吸附在鱼鳃上,抑制生物对重金属的吸收作用[33];2)在高硬度水体中,Ca2+和Mg2+浓度较高,而且在细胞膜上与重金属离子存在竞争吸附关系,因此减少了生物膜对重金属离子的吸收,由此导致生物对重金属的吸收受抑制[34]。本研究发现,当硬度为0~500 mg/L时,所有实验组均未产生沉淀,又通过ICP-MS测定各实验组Zn浓度,发现Zn2+实际浓度与表观浓度的差距<10%,因此与Ca2+、Mg2+共同作用形成不溶性碳酸盐吸附在鳃上的现象并不明显。同时在实验过程中,为了满足水体中不同硬度的要求,n(Ca2+)∶n(Mg2+)始终维持在2∶1,只改变Ca2+和Mg2+总量,此时会对锌毒性产生一定影响。鉴于此,机理1)不太合理,而机理2)对于重金属离子的竞争吸附解释更加合理。
2.2 不同物种在不同水体硬度下对锌毒性敏感度的响应
不同硬度条件下,锌对水生生物的急性毒性如表1所示。可知:以水体硬度为250 mg/L时的毒性来看[18],锌毒性效应排序为:大型蚤>摇蚊幼虫>霍甫水丝蚓>青虾>中华圆田螺>麦穗鱼>蝌蚪>泥鳅。由以上排序看出,在不同硬度下,锌毒性与营养级有一定关系,大型蚤处于低营养级,对锌的毒性效应最明显;而泥鳅的营养级较高,对锌的毒性效应不明显。低营养级更容易吸收Zn2+,并进行生物富集;而高营养级的组织器官更为发达,对毒性有一定的抵抗力,并且降解和排泄能力也高于低营养级动物,从而对毒性的敏感性较差。
表1 不同硬度下锌的急性值(LC50/EC50)
Table 1 Acute toxicity (LC50/EC50) of zinc at different water hardness mg/L
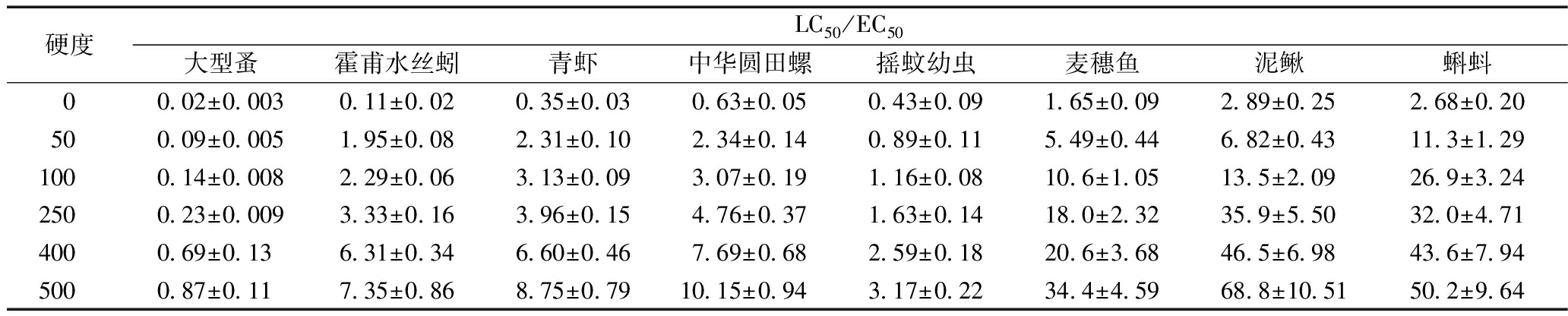
硬度LC50/EC50大型蚤霍甫水丝蚓青虾中华圆田螺摇蚊幼虫麦穗鱼泥鳅蝌蚪00.02±0.0030.11±0.020.35±0.030.63±0.050.43±0.091.65±0.092.89±0.252.68±0.20500.09±0.0051.95±0.082.31±0.102.34±0.140.89±0.115.49±0.446.82±0.4311.3±1.291000.14±0.0082.29±0.063.13±0.093.07±0.191.16±0.0810.6±1.0513.5±2.0926.9±3.242500.23±0.0093.33±0.163.96±0.154.76±0.371.63±0.1418.0±2.3235.9±5.5032.0±4.714000.69±0.136.31±0.346.60±0.467.69±0.682.59±0.1820.6±3.6846.5±6.9843.6±7.945000.87±0.117.35±0.868.75±0.7910.15±0.943.17±0.2234.4±4.5968.8±10.5150.2±9.64
由表1的数据分析可知:水体硬度为0~500 mg/L时,各受试动物随着水体硬度的增加,锌的急性毒性值递增。当硬度为0时,受试动物的毒性最大,而硬度为500 mg/L时,毒性最小。为便于对各受试动物在不同水体硬度下锌毒性的敏感性量化,研究中以硬度为500 mg/L时各生物的急性毒性值作为标准值,并除以其他硬度条件下的毒性值得到比值倍数。结果发现,随着水体硬度不断降低,各受试动物对锌毒性的相对敏感性变化程度顺序为:霍甫水丝蚓>大型蚤>青虾>泥鳅>麦穗鱼>蝌蚪>中华圆田螺>摇蚊幼虫。根据该排序可以看出,低营养级生物对锌毒性的敏感性变化程度较大,最小和最大毒性值相差43.5~66.81倍;而相对较高的营养级对锌毒性的敏感性变化程度则较小,相差16.11~23.83倍,远远低于低营养级的比值倍数。已有研究指出,水生生物细胞膜的通透性会因水体硬度改变而受到影响[35],而低营养级生物的组织器官和生命机能相对简单,对离子的通透性变化更为明显,故水体硬度降低可能导致锌毒性效应剧增。但是摇蚊幼虫对锌毒性的相对敏感性变化程度最小,最大和最小毒性差距只有7.37,这有可能和它生活的环境背景有关。摇蚊幼虫主要生活在水体污染较严重,而且腐殖质含量较高的水域,具有较强的耐毒性,对毒性变化并不是很敏感。
2.3 不同硬度下锌的短期危害浓度(HC5)
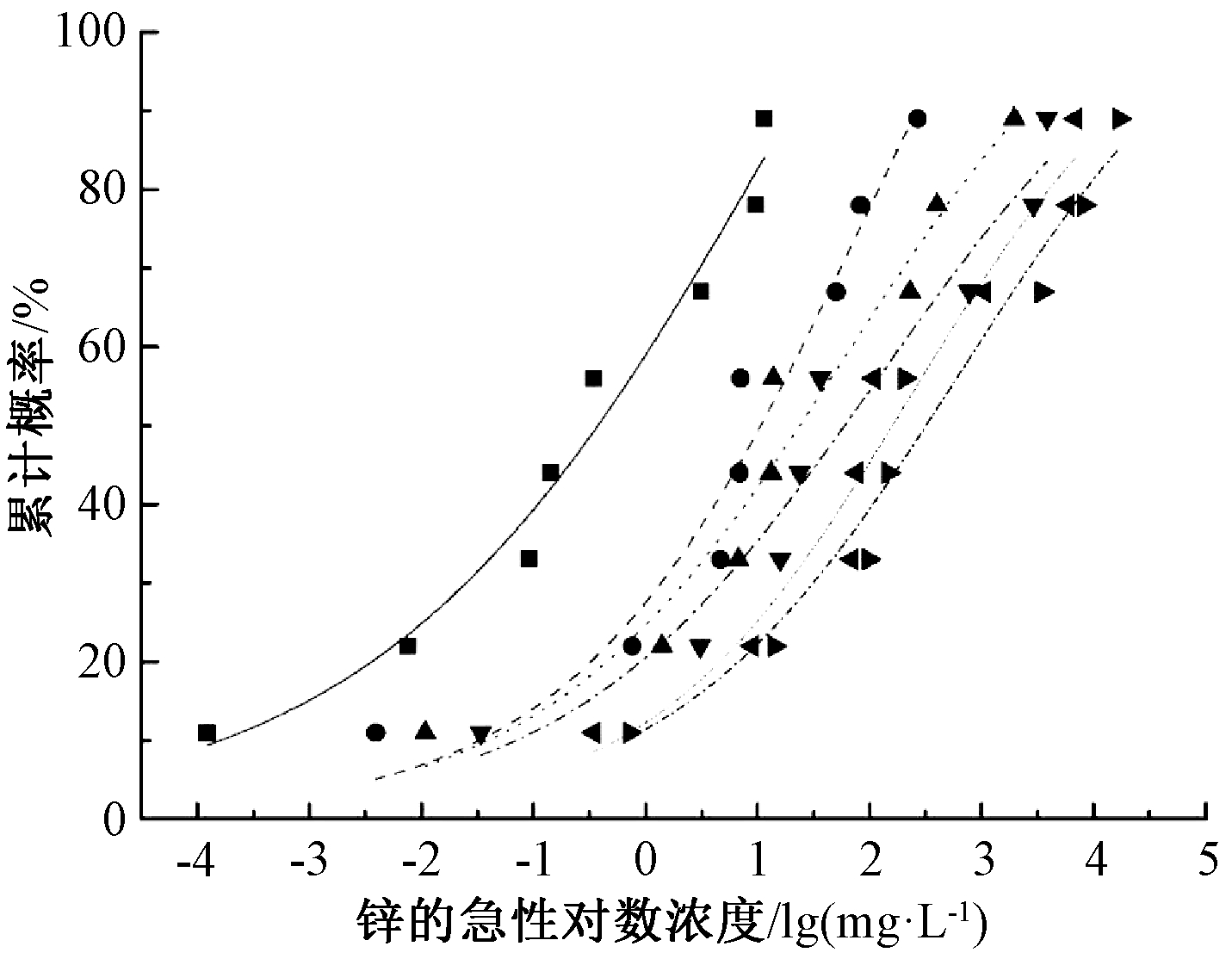
物种敏感度分布法早期用于污染物的生态风险评估,后来各国学者对其进行深入研究,扩展了应用[36-38]。目前在我国主要用于推导淡水水生生物水质基准[4,39]。通过模型拟合构建最佳SSD拟合曲线(图2),推导不同水体硬度下锌的HC5分别为:7.1 μg/L(硬度为0)、63 μg/L(硬度为50 mg/L)、67 μg/L(硬度为100 mg/L)、230 μg/L(硬度为250 mg/L)、367 μg/L(硬度为400 mg/L)和476 μg/L(硬度为500 mg/L)。再除以评估因子2,得出不同硬度下锌的短期基准值,依次为3.55,31.5,33.5,115,183.5,238 μg/L。本课题组之前研究[2,40]获得的锌的短期基准值为102.33 μg/L,本实验在硬度为250 mg/L时获得的基准值与之误差在10%以内,而其他硬度下基准值差异明显。
![]() —0; --
—0; --![]() ---50; ··
---50; ··![]() ···100; -·
···100; -·![]() -·-250;
-·-250; ![]() …400; -·
…400; -·![]() -··500。
-··500。
图2 不同水体硬度下锌的物种敏感度分布曲线
Fig.2 Species sensitivity distribution curves of zinc under different water body hardness
根据GB 3838—2002《地表水环境质量标准》[5],锌标准可分为5级,Ⅰ类水质标准为50 μg/L,Ⅱ类和Ⅲ类标准均为1000 μg/L,Ⅳ类和Ⅴ类均为2000 μg/L。与我国锌的水质标准相比,硬度为50~100 mg/L时,此时的基准值与Ⅰ类水质标准较为相近。但是硬度较高时,Ⅰ类水存在“过保护”,硬度较低时则存在“欠保护”现象。然而对于其余4类水,在硬度为0~500 mg/L时,均会出现“欠保护”问题。与GB 11607—1989《渔业水质标准》中锌标准相比发现[41],硬度为250 mg/L时的基准值较为合适,两者相差不大,硬度>250 mg/L则出现“过保护”,硬度<250 mg/L则“欠保护”。由于目前我国地表水标准中并没有考虑硬度的影响,因此建议今后在修订我国地表水标准中重金属标准时,要考虑硬度对标准的影响,从而更加有效地保护水生态系统。
3 结 论
1)水体硬度变化可导致水生生物急性毒性的变化。当硬度从500 mg/L降到100 mg/L的阶段,锌毒性缓慢增加;而从100 mg/L降到0的阶段,毒性急剧增加。可能因为Ca2+和Mg2+在细胞膜上与重金属离子存在竞争吸附关系,高硬度抑制Zn2+吸附,低硬度促进Zn2+吸附。
2)水体硬度降低过程中,各受试动物对锌毒性的相对敏感性变化有显著差异。低营养级对锌毒性敏感性变化较大,且随着水体硬度的降低,锌对低营养级的水生生物影响更明显。
[1] Smirnova On. Study of zinc and cadmium chloride toxicity usinghuman embryo fibroblast cultures [J]. Gigiena Truda I Professionalnye Zabolevaniia, 1990(7):49-50.
[2] 吴丰昌,冯承莲,曹宇静,等. 锌对淡水生物的毒性特征与水质基准的研究[J]. 生态毒理学报, 2011, 6(4):367-382.
[3] Lindholmer C. Toxicity of zinc ions to human spermatozoa and theinfluence of albumin [J]. Andrologia, 1974, 6(1):7-16.
[4] 吴丰昌, 冯承莲, 张瑞卿,等. 我国典型污染物水质基准研究[J]. 中国科学, 2012, 42(5):665-672.
[5] 国家环境保护总局. 地表水环境质量标准:GB 3838—2002[S]. 北京: 中国标准出版社, 2002.
[6] United states environmental protection agency (US EPA). National recommended water quality criteria [R]. Washington DC: Office of Water, Office of Science and Technology, 2009.
[7] CCME A. Protocol for the derivation of water quality guidelines for the protection of aquatic life [J]. Winnipeg, Manitoba: Canadian Council of Ministers of the Environment, 2007.
[8] Conradi M, Depledge M H. Effects of zinc on the life-cycle, growth and reproduction of the marine amphipod Corophium volutator [J]. Marine Ecology Progress Series, 1999, 176:131-138.
[9] Bradley R W, Sprague J B. The influence of pH, water hardness, and alkalinity on the acute lethality of zinc to rainbow trout (Salmo gairdneri) [J]. Canadion Journal of Fisheries and Aquatil, 1985, 42(4): 731-735.
[10] Cusimano R F, Brakke D F, Chapman G A. Effects of pH on the toxicities of cadmium, copper, and zinc to steelhead trout (Salmo gairdneri) [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1986, 43(8):1497-1503.
[11] Dhanapakiam P, Ramasamy V K. Toxic effects of copper and zinc mixtures on some haematological and biochemical parameters in common carp, Cyprinus carpio (Linn) [J]. Journal of environmental biology, 2001, 22(2):105-111.
[12] Diamantino T C, Almeida E, Soares A M V M, et al. Lactate dehydrogenase activity as an effect criterion in toxicity tests with Daphnia magna straus [J]. Chemosphere, 2001, 45(4/5):553-560.
[13] Diamantino T C, Almeida E, Soares A, et al. Characterization of cholinesterases from Daphnia magna Straus and their inhibition by zinc [J]. Bulletin of environmental contamination and toxicology, 2003, 71(2):0219-0225.
[14] Donat J R, Bruland K W. A comparison of two voltammetric techniques for determining zinc speciation in northeast pacific ocean waters [J]. Marine Chemistry, 1990, 28(4):301-323.
[15] Dung L Q, Cuong N M, Huyen N T, et al. Acute toxicity test to determine the effects of copper, zinc and cyanide on cobia (Rachycentron canadum) resources in North Vietnam [J]. Australasian Journal of Ecotoxicology, 2005, 11(3):163-166.
[16] European Commission. Technical guidance document on risk assessment in support of commission directive 93/67/EEC on risk assessment for new notified substances and the commission regulation[R]. Environmental Risk Assessment Part II. EUR 20418 EN/3, 2003.
[17] 曹锡章, 宋天佑, 王杏乔. 无机化学(下册)[M]. 3版. 北京:高等教育出版社, 1994.
[18] 殷浩文, 蔡磊明. 化学品测试方法:生物系统效应卷[M]. 北京:中国环境出版社, 2013: 22-29.
[19] Wang Y, Wu F C, Mu Y S, et al. Directly predicting water quality criteria from physicochemical properties of transition metals [J]. Scientific Reports, 2016, 6:22515.
[20] Karntanut W, Pascoe D. The toxicity of copper,cadmium and zinc to four different hydra (Cnidaria: Hydrozoa) [J]. Chemosphere, 2002, 47(10):1059-1064.
[21] 中华人民共和国环境保护部. 淡水水生生物水质基准制定技术指南:HJ 831—2017[S].北京:中国环境出版社,2017.
[22] Lussier S M, Gentile J H, Walker J. Acute and chronic effects of heavy metals and cyanide on Mysidopsis bahia (crustacea: mysidacea)[J]. Aquatic Toxicology (Amsterdam), 1985, 7(1/2): 25-35.
[23] 侯俊, 赵芊渊, 王超,等. 应用概率物种敏感度分布法研究太湖铜水生生物水质基准[J]. 生态毒理学报, 2015, 10(6):121-128.
[24] Wheeler J R, Grist E P M, Leung K M Y, et al. Species sensitivity distributions: data and model choice [J]. Marine Pollution Bulletin, 2002, 45(1/2):192-202.
[25] Diamantino T. Almeida E. Soares A, et al. Characterization of cholinesterases from Daphnia magna straus and their inhibition by zinc [J]. Bulletin of Environmental Contamination and Toxicology, 2003, 71(2):219-225.
[26] Nor Y. Effects of organic ligands on toxicity of copper and zinc to Carassius auratus [J]. Chemical Speciation and Bioavailability, 1990,2(3):111-115.
[27] 唐文清, 曾荣英, 冯泳兰,等. 2014年湘江衡阳段水体重金属污染特征[J]. 环境与健康杂志, 2016, 33(6):553-556.
[28] Ellwood M J, van den Berg C M G. Zinc speciation in the northeastern Atlantic Ocean [J]. Marine Chemistry, 2000, 68(4):295-306.
[29] Enserink E L, Maas-Diepeveen J L, Leeuwen C J V. Combined effects of metals; an ecotoxicological evaluation [J]. Water Research, 1991, 25(6):679-687.
[30] Erten-Unal M, Wixson B G. Biotreatment and chemical speciation of lead and zinc mine/mill wastewater discharges in Missouri, USA [J]. Water, Air, and Soil Pollution, 1999, 116(3/4):501-522.
[31] Hou X D, Liu Q P, Smith T J, et al. Evaluation of toxicity and biodegradability of cholinium amino acids ionic liquids [J]. Plos One, 2013, 8(3):e59145.
[32] Gillespie Jr W B, Hawkins W B, Rodgers Jr J H, et al. Transfers and transformations of zinc in constructed wetlands: mitigation of a refinery effluent [J]. Ecological Engineering, 2000, 14(3):279-292.
[33] Greenwood J G, Fielder D R. Acute toxicity of zinc and cadmium to zoeae of three species of portunid crabs (crustacea: brachyura) [J]. Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 1983, 75(1):141-144.
[34] Hernando M D, Mezcua M, Fernández-Alba A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments [J]. Talanta, 2006, 69(2):334-342.
[35] 郑乃彤, 陆昌淼. 中国大百科全书·环境科学卷[M]. 北京: 大百科全书出版社, 1983:249-251.
[36] Kooijman S A L M. A safety factor for LC50 values allowing for differences in sensitivity among species [J]. Water Research, 1987, 21(3):269-276.
[37] van Straalen N M, Denneman C A J. Ecotoxicological evaluation of soil quality criteria [J]. Ecotoxicology and Environmental Safety, 1989, 18(3):241-251.
[38] Aldenberg T, Slob W. Confidence limits for hazardous concentrations based on logistically distributed NOEC toxicity data [J]. Ecotoxicology and Environmental Safety, 1993, 25(1):48-63.
[39] 冯承莲, 吴丰昌, 赵晓丽,等. 水质基准研究与进展[J]. 中国科学: 地球科学, 2012, 42(5):657-664.
[40] 刘大庆, 李小峰, 付卫强,等. 我国淡水中锌的水生生物水质基准和生态风险[J]. 环境工程, 2017, 35(9):18-23.
[41] 农牧渔业部. 渔业水质标准:GB 11607—1989[S]. 北京:中国标准出版社, 1989.