0 引 言
活性污泥法因其具有处理效果好、处理程度高、处理负荷大等优点而得到广泛应用[1],但该过程会产生大量的剩余污泥[2],污泥中含有较多难降解有机物、有毒重金属及病原微生物等,其中有毒重金属是阻碍污泥资源化利用的最重要因素[3, 4]。目前污泥重金属的去除方法主要有吸附法[5]、电动修复法[6]、化学浸出法[7-9]、生物沥滤法[10]、植物提取法[11]、联合修复法[5]等,然而这些方法存在处理成本高、二次污染、修复速度慢及修复时间长等弊端。利用人工湿地技术处理污泥重金属的相关报道较少,更多的是考察人工湿地对水体中重金属的处理效果及其影响因素。Buddhawong等[12]研究表明,砾石床湿地对As和Zn可完全去除,且潜流型湿地比表面流湿地去除效果更快。窦磊等[13]研究证明,浮萍能富集锌、铁和锰,芦苇能有效富集铅、锰和铬,而香蒲和黑三棱可有效富集铅和锌。Weiss等[14]使用甜柚、水葱和大米草蒿处理Pb、Zn、Cu和Cr,结果表明,3种植物的地下部分比地上部分对4种重金属的积累更高。
化学预处理能显著改变污泥的性状,从而对人工湿地处理污泥重金属产生影响。吴青[15]用谷氨酸N,N-二乙酸(L-glutamic acid N,N-diacetic acid,GLDA)去除风干污泥重金属,发现GLDA能够去除风干污泥中80%以上的Cd、Ni、Cu,而把GLDA直接用于脱水前污泥重金属的去除尚未见报道。卫泽斌等[16]使用GLDA诱导东南景天修复重金属污染的土壤研究发现,施用GLDA提高了东南景天对土壤Cd和Zn的提取效率。罗冰等[17]发现,柠檬酸对Cu和Zn的浸出效率可分别达到74.8%和65.3%,Sun等[18]通过使用柠檬酸(critic acid, CA)淋洗受重金属污染的土壤后发现,CA对Pb、Cu和Cd的去除可分别达到36%、47.74%和61.88%。另外,Moon等[19]的实验结果也表明,用柠檬酸修复重金属污染土壤具有一定的效果。
基于此,本研究重点考察的化学预处理对人工湿地处理污泥重金属的影响。以污水处理厂二沉池污泥(含水率95%~98%)为对象,采用CA和GLDA预处理污泥,在此基础上构建人工湿地系统,利用人工湿地对预处理后的污泥进行处理,分析化学预处理对人工湿地处理污泥重金属去除效果的影响。
1 实验部分
1.1 试剂、污泥及植物来源
实验试剂包括柠檬酸、H2SO4、HClO4、HCl、HNO3、NaOH,均为分析纯。谷氨酸N,N-二乙酸,为40%水溶液,购自昊睿化学(上海)有限公司。
实验污泥取自芜湖某企业污水处理厂未经脱水的污泥,污泥的初始特征如表1所示。所用黄菖蒲取自校内景观湿地,置于室内采用自来水培养,待生长状况正常后开始实验。
1.2 实验方法
1.2.1 CA和GLDA预处理污泥
根据前期的实验研究,在最佳优化条件下预处理污泥[20],即配制浓度分别为0.3,0.05 mol/L的CA和GLDA污泥溶液,并用HNO3和NaOH调节污泥溶液pH为6.0,CA处理系统反应时间为2 h,GLDA处理系统反应时间为3 h,预处理完成后将污泥溶液投加到湿地系统。
表1 实验污泥基本特征
Table 1 Characteristics of the raw sludge
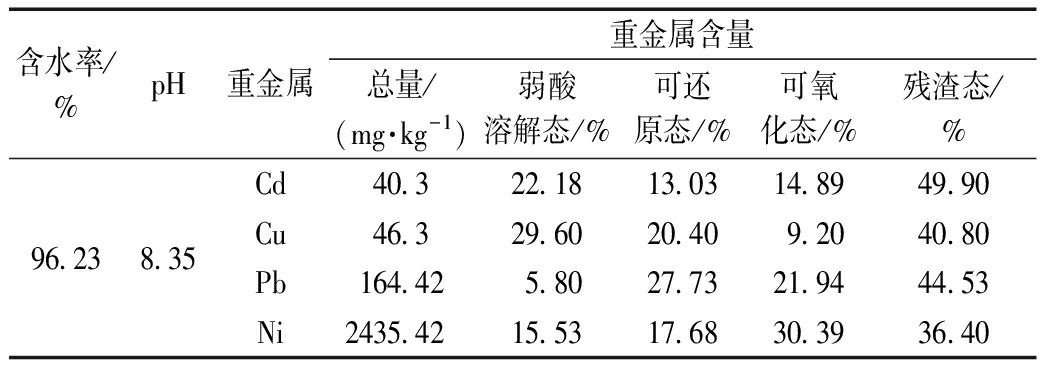
含水率/%pH重金属重金属含量总量/(mg·kg-1)弱酸溶解态/%可还原态/%可氧化态/%残渣态/%96.238.35Cd40.322.1813.0314.8949.90Cu46.329.6020.409.2040.80Pb164.425.8027.7321.9444.53Ni2435.4215.5317.6830.3936.40
1.2.2 人工湿地的构建与运行
于2016年12月,以塑料铁柄水桶(外径400 mm×400 mm,容积50 L)构建人工湿地系统,如图1所示。湿地填料共厚300 mm,从底部往上依次为鹅卵石层(50 mm,粒径5~10 mm)、陶粒层(150 mm,粒径1~2 mm)和细沙层(100 mm,<0.1 mm)。湿地留有100 mm超高,人工湿地出水取样口设置在距桶底50 mm处,桶内壁用防腐尼龙纱布包裹出水口处,防止砂砾堵塞。以黄菖蒲为湿地植物,栽植后稳定3个月,待黄菖蒲生长正常后,开始进泥。如图1所示,第1—3个湿地系统各投加9 L污泥,之后等到液面下降后继续投加污泥,待污泥厚度积累到80 mm后停止进泥。最后1次进泥后的5个月内(2017年3—7月),每隔半个月取1次水样和泥样,分别测定水样和污泥中重金属(Cd、Cu、Pb、Ni)浓度;从2017年8—12月,每隔1个月取1次水样和泥样,每次取完水样和泥样后,向各系统添加等量的自来水,以浸没污泥为准。

1—原污泥(未处理); 2—CA处理; 3—GLDA处理; 4—对照。
图1 人工湿地系统
Fig.1 The constructed wetland systems
1.3 测试分析
1)人工湿地出水重金属指标:Cd、Cu、Pb和Ni采用火焰原子吸收法测定[20](TAS-990,北京普析通用仪器有限公司)。
2)污泥指标:Cd、Cu、Pb和Ni,称取0.2000 g干污泥样品,加入王水(HNO3∶HCl=1∶3)+高氯酸+浓硫酸(10 mL+5 mL+2 mL)静置24 h后,采用COD消解仪(青岛尚德环保科技有限公司,SN-102A)分别在185,205 ℃下消解3,7 h,冷却后用0.45 μm滤膜抽滤,滤液定容至50 mL,然后采用火焰原子吸收法测定污泥消解液重金属总量。
3)植物指标:植物生物量测定,植物样品取样后,用清水洗掉泥沙,自然晾干水分后称重;植物中重金属浓度测定,称取0.1500 g在105 ℃下干燥24 h并研磨成细小粉末的植物样品,先用少量蒸馏水润湿,测试步骤同污泥重金属。
2 结果与分析
2.1 人工湿地出水重金属的变化
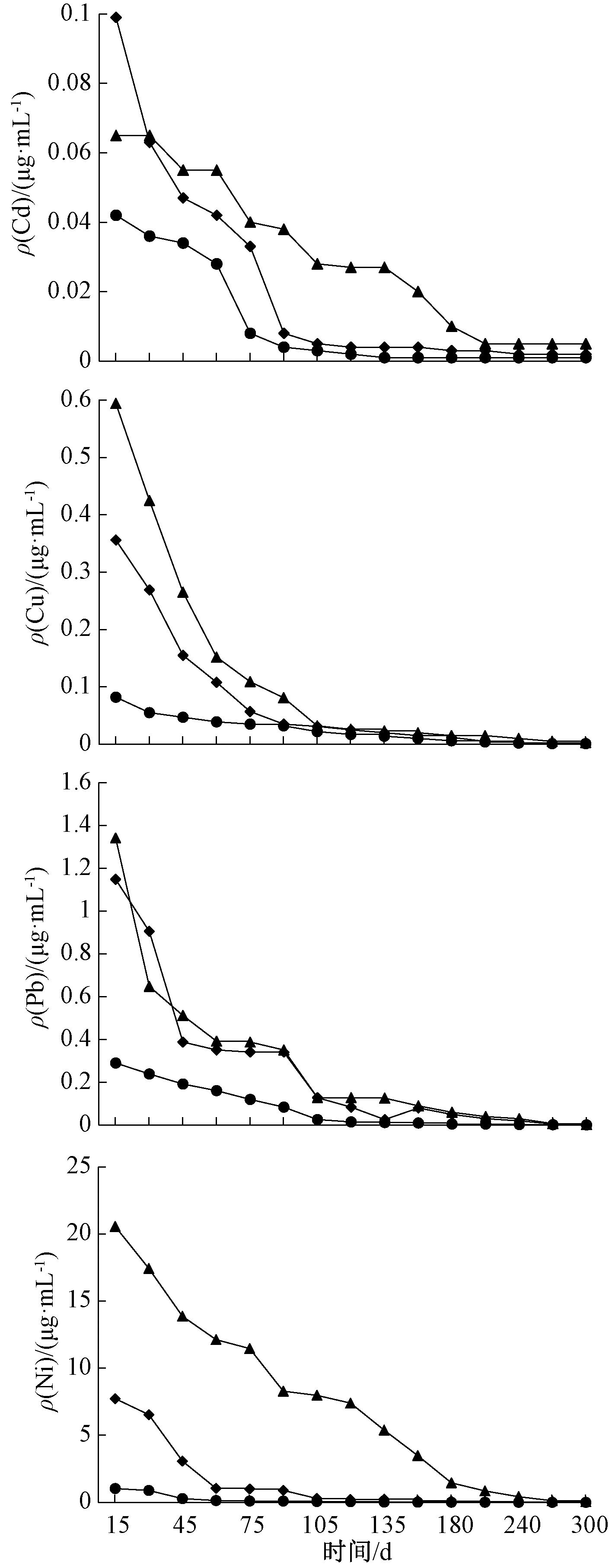
污泥在湿地填料表层进行泥水分离,经过填料表面微生物的作用,水质成分有相应变化。通过测定水样重金属(Cd、Cu、Pb和Ni)浓度的变化情况,用以表征人工湿地对污泥渗滤液的净化效果。出水重金属浓度变化如图2所示。
![]() —未处理;
—未处理; ![]() —CA处理;
—CA处理; ![]() —GLDA处理。
—GLDA处理。
图2 出水重金属Cd、Cu、Pb、Ni浓度变化
Fig.2 The concentration of Cd, Cu, Pb,Ni in effluent of the artficial wetland
由图2可知:经过人工湿地处理15 d后,CA、GLDA和未预处理的出水ρ(Cd)分别为0.099,0.065,0.042 μg/mL,说明经过预处理后污泥固相里的重金属更容易转移到液相,从而从污泥里去除,而CA预处理酸性条件下破坏污泥的菌胶团结构,使得污泥固相里的重金属释放出来[21],因此,CA处理的Cd浓度高于GLDA处理。而经过30 d处理后,GLDA预处理出水中Cd的浓度高于CA预处理,说明后期GLDA的螯合反应强于CA的作用。当处理210 d后,3种处理的出水Cd浓度逐渐趋于稳定。
经过15 d的处理后,未处理、CA处理和GLDA处理出水ρ(Cu)分别为0.082,0.356,0.594 μg/mL,GLDA处理和CA处理Cu浓度分别是未处理的7.24倍和4.34倍。经过15 d的处理后,未处理、CA处理和GLDA处理后出水中ρ(Pb)分别为0.29,1.148,1.341 μg/mL,且GLDA处理分别是前两者的4.62和1.17倍,当处理时间为30~180 d时,未处理的出水Pb浓度按一定速率下降,而CA处理和GLDA处理Pb浓度先快速下降,后缓慢下降,最后又快速下降,但最终在210 d后都逐渐达到稳定状态。
未处理出水Ni的浓度变化不明显,由处理15 d的1.033 μg/mL降到最后的0.002 μg/mL,而CA处理和GLDA处理分别由15 d的7.730,20.555 μg/mL降为最终的0.005和0.0512 μg/mL,可以看出,GLDA处理能使Ni更容易从固相转移至液相,从而降低污泥中Ni浓度。人工湿地已被用于各种废水的处理,如工业废水、生活污水和雨水[22, 23],同样也被应用于治理酸矿废水,处理效果显著[24]。Cheng等[25]用人工湿地处理含Cd、Cu、Pb等的重金属废水,发现具有很好的处理效果,出水重金属可达到WHO饮用水标准。阳承胜等[26]利用人工湿地处理铅锌矿废水中Pb、Zn、Cu和Cd,其去除率分别达到93.98%、97.02%、96.87%和96.39%,接近GB 5084—2005《农田灌溉水的水质标准》。
2.2 人工湿地积存污泥指标变化
人工湿地在处理过程中,积存污泥的成分也会发生相应变化,为研究相关指标的变化情况,取样频率同水样,分别测定积存污泥重金属Cd、Cu、Pb和Ni浓度的变化情况,实验结果如图3所示。
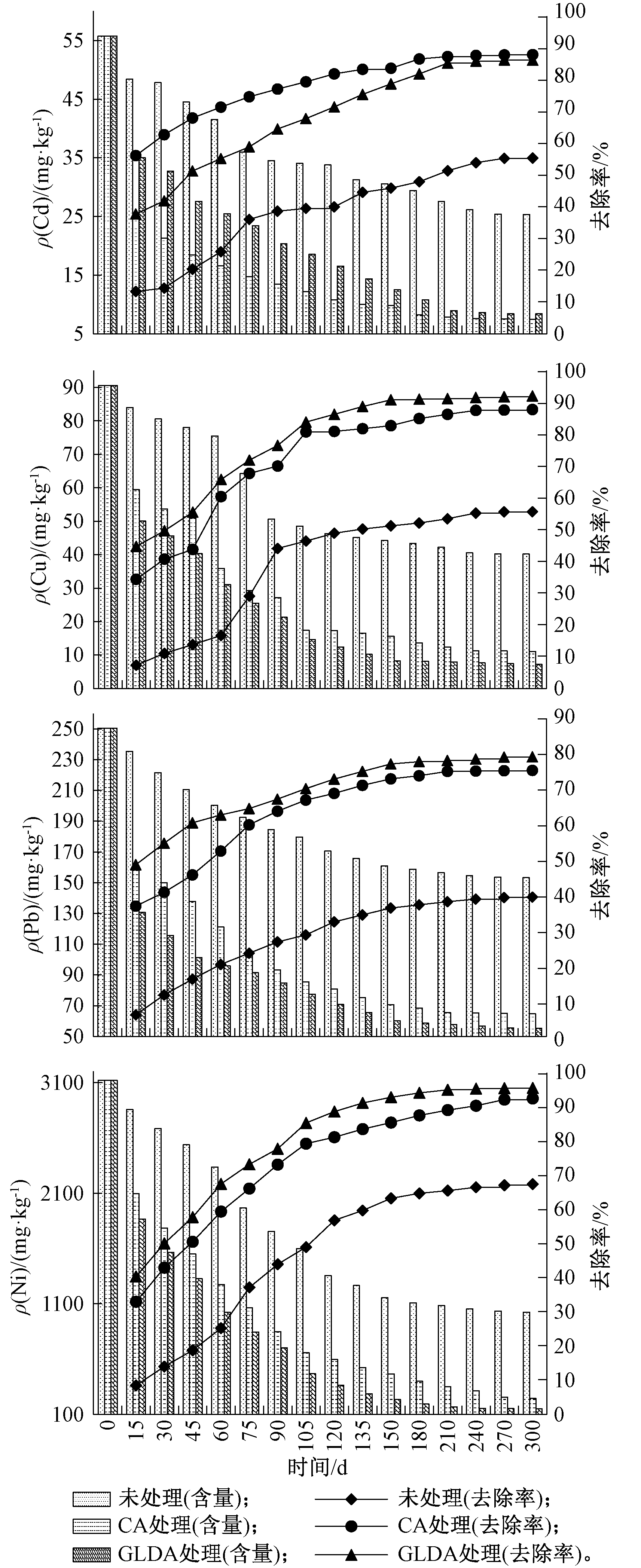
图3 积存污泥重金属Cd、Cu、Pb、Ni浓度变化
Fig.3 The concentration of Cd, Cu, Pb, Ni in sludge in different treatments
由图3可知:原污泥中重金属Cd、Cu、Pb、Ni的含量分别为55.73,90.58,250.56,250.56 mg/kg。经过人工湿地处理15 d后,未处理、CA和GLDA处理中Cd的去除效果最明显,去除率分别达到13.16%、55.25%和37.16%,随后去除率缓慢上升,这是因为经过预处理后使得污泥固相中的弱酸溶解态的Cd转移到液相中,然后通过植物、微生物和出水等作用排出体系[27]。当系统运行240 d后基本达到稳定状态,实验结束后未处理、CA处理和GLDA处理的Cd含量分别降为25.36,7.51,8.45 mg/kg,去除率分别达到54.49%、86.52%和84.84%,并且CA的处理效果优于GLDA的处理效果。
CA、GLDA预处理系统对重金属Cu的去除率大于未处理系统。当系统运行300 d后,Cu含量在未处理、CA和GLDA处理中分别达到40.19,11.08,7.23 mg/kg,去除率分别达到55.63%、87.77%和92.02%,未处理系统中污泥重金属Cu含量分别是CA处理和GLDA处理的3.63和5.56倍,GLDA处理效果优于CA处理。
CA处理和GLDA处理对重金属Pb的去除率明显高于未预处理的,当系统运行210 d后污泥中Pb的含量逐渐趋于稳定,当处理时间达到300 d时,在未处理、CA处理和GLDA处理系统中污泥重金属Pb含量分别达到153.25,64.75,55.26 mg/kg,去除率分别达到38.84%、74.16%和77.95%,未处理中Pb含量分别是CA处理和GLDA处理的2.37和2.77倍,可以得到GLDA预处理效果优于CA预处理。但是去除率均低于80%,这是因为原始污泥中弱酸溶解态的Pb含量只有5.80%,而残渣态的Pb含量达到44.53%[20],使得Pb不易被去除。
未处理污泥中Ni含量明显高于CA处理和GLDA处理,当系统运行240 d后污泥中Ni含量逐渐趋于稳定。当处理时间达到300 d时,Ni含量在未处理、CA处理和GLDA处理中分别达到1025.13,245.98,150.09 mg/kg,去除率分别达到67.15%、92.12%和95.19%,GLDA处理效果优于CA处理,而且3种处理对重金属Ni的去除效果都是最好的,这是因为原始污泥中弱酸溶解态Ni的含量达到15.53%,可还原态Ni含量达到30.39%,可氧化态Ni含量达到36.40%,而残渣态Ni含量仅为17.68%,使得Ni易被去除[20]。
污泥中重金属的去除途径主要包括:1)金属离子与沉淀物、有机物结合,被基质吸附、沉淀;2)湿地植物对重金属的吸收富集;3)污泥在下渗过程中,部分重金属会通过渗滤液排除;4)残留在积存污泥中[28]。污泥经过预处理后,改变了污泥重金属的形态,使得有效态重金属含量增加,通过人工湿地植物、基质和微生物的共同作用得以去除[29]。通过比较不同的预处理对污泥重金属的去除效果可以发现,CA处理对重金属Cd的去除效果(86.52%)优于GLDA处理(84.84%),GLDA处理对于重金属Cu、Pb和Ni的去除效果(分别为92.02%、77.95%和95.19%)优于CA处理(分别为87.77%、74.16%和92.12%)。与对照相比,人工湿地对化学预处理污泥重金属Cd、Cu、Pb和Ni的去除率分别增加了60.19%,34.29%,37.22%,25.51%。石一民等[30]研究了人工湿地处理海水淡化厂污泥时发现,人工湿地对污泥中重金属Pb、Cd、Hg、As的去除率为49%~65%,这也证明了本实验采用预处理污泥后对重金属的去除效率高于未预处理。
2.3 化学预处理对污泥重金属去除效果差异性分析
为了确定未处理、CA处理和GLDA处理在污泥重金属去除中的影响程度及对重金属Cd、Cu、Pb和Ni去除效果的差异,进行了相关方差分析和显著性检验。不同处理方式对重金属去除率如表2所示。
表2 化学预处理对重金属的去除率
Table 2 The removal rate of heavy metals by chemical pretreatments

预处理重金属去除率/%CdCuPbNi未处理54.49 55.63 38.84 67.15 CA处理86.52 87.77 74.16 92.12 GLDA处理84.84 92.02 77.95 95.19
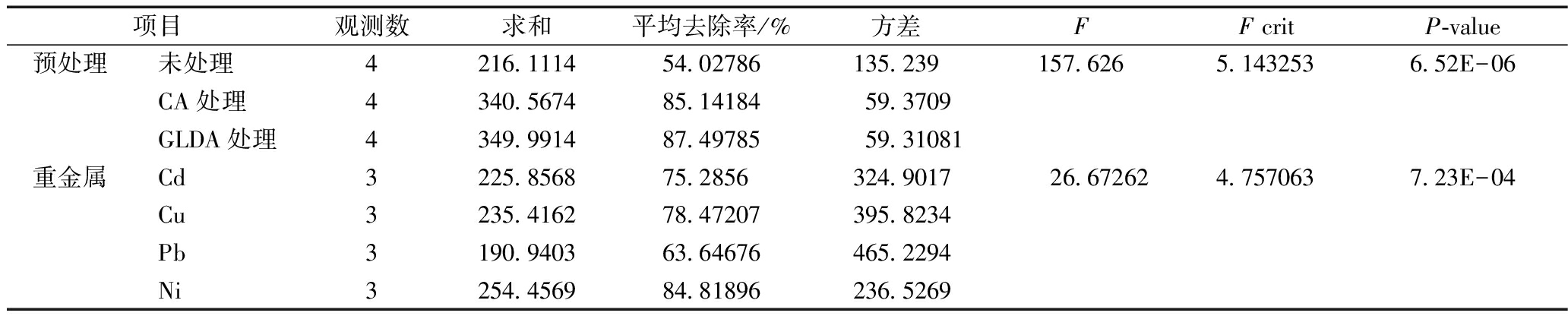
同时,使用方差和显著性检验分析对表2数据进行分析,结果如表3所示。
表3 各预处理方差分析
Table 3 Variance analysis results of different pretreat
项目观测数求和平均去除率/%方差FF critP-value预处理未处理4216.111454.02786135.239157.6265.1432536.52E-06CA处理4340.567485.1418459.3709GLDA处理4349.991487.4978559.31081重金属Cd3225.856875.2856324.901726.672624.7570637.23E-04Cu3235.416278.47207395.8234Pb3190.940363.64676465.2294Ni3254.456984.81896236.5269
由表3可知:未处理、CA处理和GLDA处理对重金属Cd、Cu、Pb和Ni的平均去除率分别为54.03%、85.14%、87.50%。结合方差分析可得,预处理的F(157.63)>F crit(5.14),表明不同预处理之间对污泥重金属去除影响存在差异,且此处P-value(6.52×10-6)<0.01,表明差异极显著[31],因此,GLDA处理对污泥重金属的去除影响最大,CA处理次之,而未处理对污泥重金属的去除影响最小。
此外,预处理方式对重金属Cd、Cu、Pb、Ni的平均去除率分别为75.29%、78.47%、63.65%、84.82%,结合方差分析可得,各重金属去除率的F(26.67)>F crit(4.76),表明各重金属的去除效果之间存在差异,且此处P-value(7.2×10-4)<0.01,差异极显著,因此人工湿地对污泥重金属Ni去除效果最好,对重金属Pb去除效果最差,去除效果顺序为Ni>Cu>Cd>Pb,与石一民等[30]和刘佳[32]的研究结果类似,但这与张斌[33]和叶涛等[34]的研究结果略有不同,这可能与污泥来源有关。
2.4 植物生长状况及对重金属的富集情况
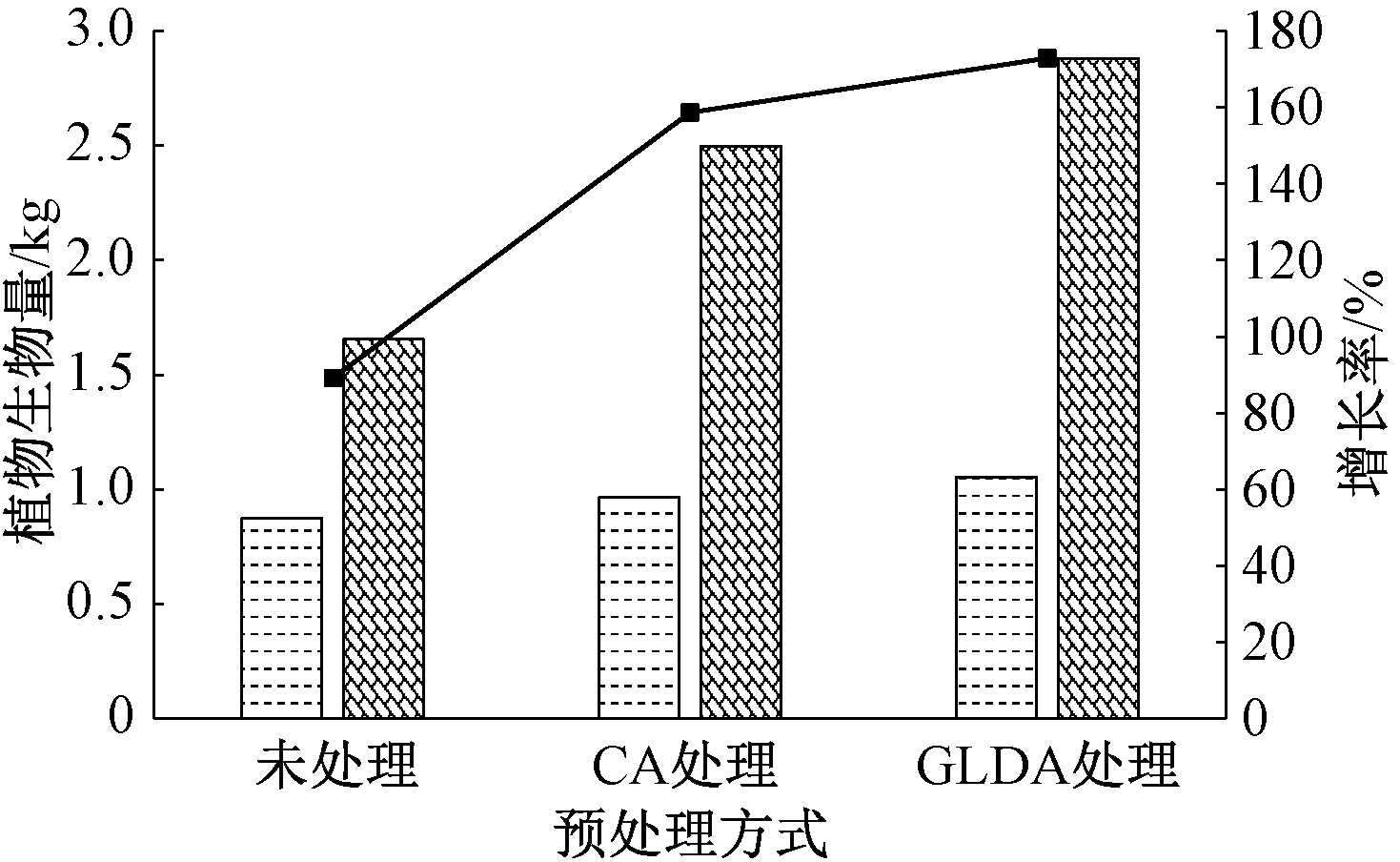
植物修复不仅成本低,且无二次污染。目前植物修复主要是指植物的提取作用[35, 36]。湿地植物不仅可以过滤、截流污水中悬浮物质,还可以吸收污水中有机物、N、P等营养物质。此外,部分植物会通过释放化学物质,影响周围植物的正常生长,从而进一步影响对污水的净化效果[37]。实验前后黄菖蒲生物量的变化情况如图4所示。
![]() 实验前;
实验前; ![]() 实验后;
实验后; ![]() —增长率。
—增长率。
图4 不同预处理黄菖蒲生物量变化
Fig.4 The plant biomass variation by different pre-treatments
由图4可知:3个系统中黄菖蒲生物量分别由实验前的0.875,0.965,1.055 kg增长到实验后的1.655,2.496,2.879 g,增长率分别达到89.14%、158.65%和172.89%,说明各个系统都有利于植物的生长,不会对植物生长造成抑制作用,GLDA处理后的植物增长率最大,这是因为GLDA主要是由天然的碳水化合物(如生产蔗糖的副产品-糖蜜与各种淀粉)为原料发酵而成[38],可促进植物的生长。
植物对重金属的富集情况如表4所示。可知:植物根部的重金属含量高于茎叶部,这是因为根部处于污泥之中,更容易吸收重金属,而吸收的重金属需要通过运输作用才能转移到茎叶部[39]。未处理、CA处理和GLDA处理对Cd的富集率为19.17%、29.80%和37.70%,对Cu的富集率分别为22.30%、38.38%和40.49%,对Pb的富集率分别为15.43%、33.09%和34.98%,对Ni的富集率分别为30.21%、41.25%和42.79%。CA和GLDA处理系统植物对重金属的贡献分别比对照组增加了13.85%和17.21%,GLDA处理的植物对重金属的贡献最大。
表4 不同预处理植物对重金属的富集情况
Table 4 The enrichment situation of heavy metals in plants by different pre-treatments
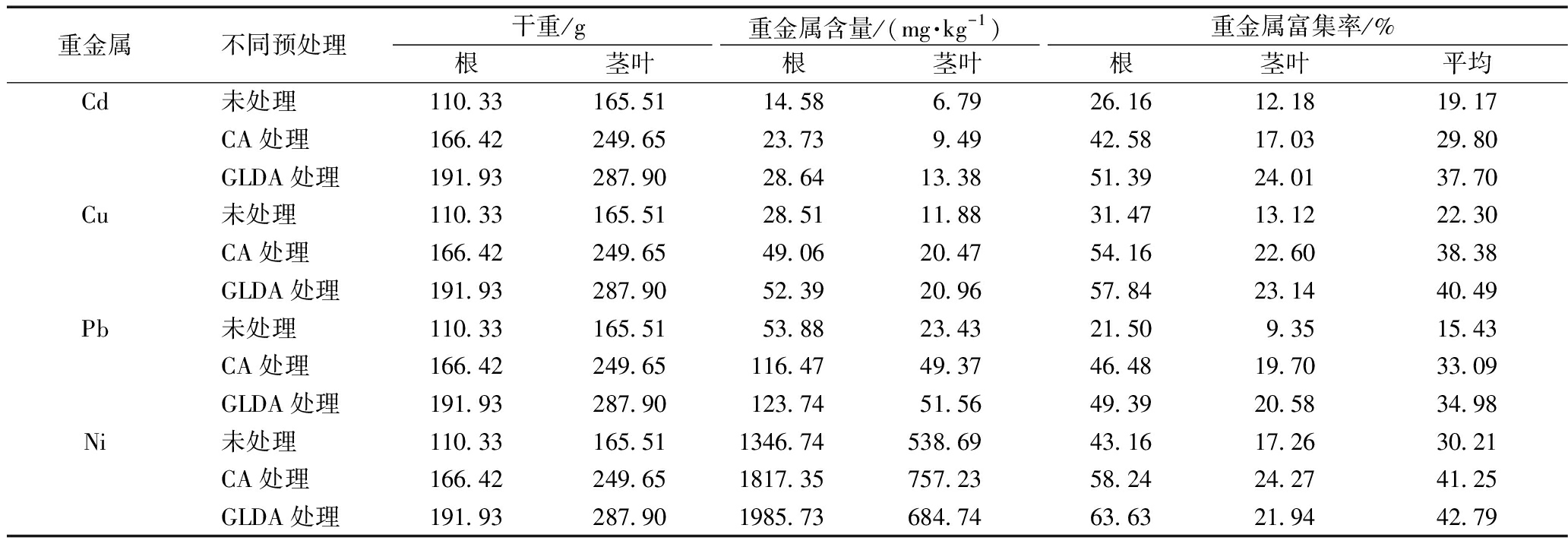
重金属不同预处理干重/g重金属含量/(mg·kg-1)重金属富集率/%根茎叶根茎叶根茎叶平均Cd未处理110.33 165.51 14.58 6.79 26.16 12.18 19.17 CA处理166.42 249.65 23.73 9.49 42.58 17.03 29.80 GLDA处理191.93 287.90 28.64 13.38 51.39 24.01 37.70 Cu未处理110.33 165.51 28.51 11.88 31.47 13.12 22.30 CA处理166.42 249.65 49.06 20.47 54.16 22.60 38.38 GLDA处理191.93 287.90 52.39 20.96 57.84 23.14 40.49 Pb未处理110.33 165.51 53.88 23.43 21.50 9.35 15.43 CA处理166.42 249.65 116.47 49.37 46.48 19.70 33.09 GLDA处理191.93 287.90 123.74 51.56 49.39 20.58 34.98 Ni未处理110.33 165.51 1346.74 538.69 43.16 17.26 30.21 CA处理166.42 249.65 1817.35 757.23 58.24 24.27 41.25 GLDA处理191.93 287.90 1985.73 684.74 63.63 21.94 42.79
3 结 论
1)与对照相比,人工湿地对化学预处理污泥重金属Cd、Cu、Pb和Ni的去除率分别增加了60.19%,34.29%,37.22%,25.51%。
2)GLDA处理对污泥重金属的去除影响最大,CA处理次之,而未处理最小。
3)人工湿地对污泥重金属Ni去除效果最好,对重金属Pb去除效果最差,去除效果顺序为Ni>Cu>Cd>Pb。
4)CA和GLDA预处理系统中的湿地植物生物量分别增加了158.65%和172.89%,大于对照组的89.14%;CA和GLDA预处理系统植物对重金属的贡献分别比对照组增加了13.85%和17.21%,GLDA预处理的植物对重金属的贡献最大。
[1] 王杰, 彭永臻, 杨雄, 等. 温度对活性污泥沉降性能与微生物种群结构的影响[J]. 中国环境科学, 2016, 36(1):109-116.
[2] 端正花, 潘留明, 陈晓欧,等. 低温下活性污泥膨胀的微生物群落结构研究[J]. 环境科学, 2016, 37(3):1070-1074.
[3] Domínguez M T, Alegre J M, Madejón P, et al. River banks and channels as hotspots of soil pollution after large-scale remediation of a river basin[J]. Geoderma, 2016, 261: 133-140.
[4] Huber M, Welker A, Helmreich B. Critical review of heavy metal pollution of traffic area runoff: Occurrence, influencing factors, and partitioning[J]. Science of the Total Environment, 2016, 541: 895-919.
[5] 孙韶玲, 盛彦清, 孙启耀,等. 活性炭吸附法处理污泥热干化蒸汽的研究[J]. 环境科学与技术, 2017, 40(1):118-122.
[6] Marques A P G C, Rangel A N O S S, Castro P M L. Remediation of heavy metal contaminated soils: an overview of site remediation techniques[J]. C R C Critical Reviews in Environmental Control, 2011, 41 (10): 879-914.
[7] 车轩, 程刚, 周乃然. 化学淋滤剂浸出污泥中重金属研究进展[J]. 应用化工, 2013, 42 (10): 1913-1915.
[8] 陈曦. 化学法去除污泥中重金属的后续研究[J]. 环境科学与管理, 2012, 37 (1): 44-47.
[9] 廖世国, 黄启飞, 周在江, 等. 废水污泥中重金属的浸出特性研究[J]. 环境影响评价, 2010, 3 (1): 24-25.
[10] Kumar R N, Nagendran R. Influence of initial pH on bioleaching of heavy metals from contaminated soil employing indigenous Acidithiobacillus thiooxidans[J]. Chemosphere, 2007, 66 (9): 1775-1781.
[11] 贺菊花, 张莹琦, 程刚. 城镇污泥重金属去除技术研究进展[J]. 应用化工, 2015, 44(8):1541-1545.
[12] Buddhawong S, Kuschk P, Mattusch J, et al. Removal of arsenic and zinc using different laboratory model wetland systems[J]. Engineering in Life Sciences, 2005, 5 (3): 247-252.
[13] 窦磊, 周永章, 蔡立梅, 等. 酸矿水中重金属人工湿地处理机理研究[J]. 环境科学与技术, 2006, 29 (11): 109-111.
[14] Weiss J, Hondzo M, Biesboer D, et al. Laboratory study of heavy metal phytoremediation by three wetland macrophytes[J]. International Journal of Phytoremediation, 2006, 8 (3): 245-259.
[15] 吴青. 生物可降解螯合剂IDS与GLDA去除工业污泥中重金属的研究[D]. 新乡:河南师范大学, 2015.
[16] 卫泽斌, 陈晓红, 吴启堂, 等. 可生物降解螯合剂GLDA诱导东南景天修复重金属污染土壤的研究[J]. 环境科学, 2015, (5): 1864-1869.
[17] 罗冰, 张清东. 柠檬酸浸出土壤中铜、锌的优化设计[J]. 环境工程学报, 2013, 7 (9): 3629-3634.
[18] Sun L, Liu H Q, Wei G X, et al. Removal of heavy metals from contaminated soils by washing with citric acid and subsequent treatment of soil-washing solutions[J]. Advanced Materials Research, 2014, 937: 646-651.
[19] Moon D H, Lee J R, Wazne M, et al. Assessment of soil washing for Zn contaminated soils using various washing solutions[J]. Journal of Industrial & Engineering Chemistry, 2012, 18 (2): 822-825.
[20] 徐大勇, 洪亚军, 唐海, 等. 柠檬酸和谷氨酸N,N-二乙酸优化处理污泥重金属[J]. 化工学报, 2017, 68 (6): 2535-2545.
[21] 孙洪伟, 陈翠忠, 吴长峰, 等. 交替好氧/缺氧运行模式对生物脱氮效能及活性污泥胞外聚合物的影响[J]. 环境科学, 2018(1):256-262.
[22] Lloyd J R, Klessa D A, Parry D L, et al. Stimulation of microbial sulphate reduction in a constructed wetland: microbiological and geochemical analysis[J]. Water Research, 2004, 38 (7): 1822-1830.
[23] Ran N, Agami M, Oron G. A pilot study of constructed wetlands using duckweed (Lemna gibba L.) for treatment of domestic primary effluent in Israel[J]. Water Research, 2004, 38 (9): 2241-2248.
[24] 徐秀月, 吴永贵, 饶益龄,等. 模拟湿地植物根系分泌物对酸性矿山废水沉淀物中Fe、 Mn释放及形态的影响[J]. 环境工程, 2017, 35(6):39-43.
[25] Cheng S, Grosse W, Karrenbrock F, et al. Efficiency of constructed wetlands in decontamination of water polluted by heavy metals[J]. Ecological Engineering, 2002, 18 (3): 317-325.
[26] 阳承胜, 蓝崇钰. 宽叶香蒲人工湿地对铅/锌矿废水净化效能的研究[J]. 深圳大学学报(理工版), 2000, 17 (增刊1): 51-57.
[27] Song X S, Yan D H, Liu Z H, et al. Performance of laboratory-scale constructed wetlands coupled with micro-electric field for heavy metal-contaminating wastewater treatment[J]. Ecological Engineering, 2011, 37 (12): 2061-2065.
[28] Peruzzi E, Masciandaro G, Macci C, et al. Heavy metal fractionation and organic matter stabilization in sewage sludge treatment wetlands[J]. Ecological Engineering, 2011, 37 (5): 771-778.
[29] B ezinová T, Vymazal J. Evaluation of heavy metals seasonal accumulation in Phalaris arundinacea in a constructed treatment wetland[J]. Ecological Engineering, 2015, 79 (3): 94-99.
ezinová T, Vymazal J. Evaluation of heavy metals seasonal accumulation in Phalaris arundinacea in a constructed treatment wetland[J]. Ecological Engineering, 2015, 79 (3): 94-99.
[30] 石一民, 叶继红, 王波, 等. 人工湿地对海水淡化厂污泥中重金属和COD去除效果的初步研究[J]. 浙江海洋学院学报(自然科学版), 2014,33(2): 190-193.
[31] 侯韦竹, 丁晶, 赵庆良, 等. 响应面法优化电氧化-絮凝耦合工艺深度处理垃圾渗滤液[J]. 中国环境科学, 2017, 37 (3): 948-955.
[32] 刘佳. 绿色有机酸和螯合剂萃取水厂污泥中典型重金属的研究[D]. 长沙:湖南大学, 2012.
[33] 张斌. 皂角苷和柠檬酸去除污泥和高岭石中重金属的研究[D]. 武汉:华中农业大学,2016.
[34] 叶涛, 黄丽, 张克强, 等. 皂角苷和柠檬酸联合对污泥中Cu、Pb和Zn的去除及其稳定性特征[J]. 环境科学, 2017(11):406-415.
[35] 许田芬, 谢方文, 丘锦荣, 等. 污泥植物处理后对玉米生长及土壤重金属含量的影响[J]. 中国环境科学, 2012, 32 (9): 1640-1646.
[36] Lasat M M, Pence N S, Deborah L D, et al. Zinc phytoextraction in Thlaspi caerulescens[J]. International Journal of Phytoremediation, 2001, 3 (1): 129-144.
[37] 张洪刚, 洪剑明. 人工湿地中植物的作用[J]. 湿地科学, 2006, 4 (2): 146-154.
[38] 陈叶享. 更绿色和持续性螯合剂GLDA及其应用之道[J]. 中国洗涤用品工业, 2011(3): 65-67.
[39] 刘秀梅, 聂俊华, 王庆仁. 植物对污泥的响应及根系对重金属的活化作用[J]. 生态环境学报, 2002, 11 (2): 121-124.