0 引 言
生物膜法是一类高效的污水生物处理技术。生物膜法与传统活性污泥法相比,具有去除负荷高、抗冲击能力强等优点,在厌氧氨氧化脱氮工艺、去除水源微污染等领域均有广泛应用。污水处理系统中的生物膜由微生物细胞和胞外聚合物(EPS)组成,其表面分布有大量孔道[1-3]。水中溶解氧和污染物可通过生物膜表面的孔道由液相向生物膜内部扩散[4],在生物膜内形成不同的微环境和微生物群落[5]。各种微生物在生物膜中的协同作用可实现污染物的去除。
生物膜法污水处理工艺的处理效果受多种因素的影响,而进水碳氮比(C/N)是其中重要的影响因素之一,其对系统去除有机物和氮污染物均有显著影响,且影响机制较为复杂。一方面,进水C/N可影响生物膜EPS的产生,从而改变整个生物膜结构与形态,最终影响污染物的去除[6-7];另一方面,进水C/N的变化对生物膜的微生物群落结构也有显著影响[8]。Gonenc和Okabe 等[9-10]报道在高有机物负荷下,异养菌大量生长在生物膜表面,影响溶解氧和污染物的传质效率,甚至导致系统处理效果恶化。
目前,进水C/N波动对生物膜反应器的影响日益受到重视。城市污水和工业废水的进水C/N受生产、季节以及前处理工艺环境的影响,可能出现较大范围的波动,从而对系统运行性能产生显著影响。基于生物膜的新型工艺如厌氧氨氧化工艺在城市污水处理领域日益受到重视,新工艺的应用受进水C/N等因素影响显著。但是目前C/N的波动对生物膜系统的影响研究多集中在生物强化去除污染物性能的角度[11-12],针对生物膜自身特性和微生物群落的迁移变化研究较少。针对进水C/N对生物膜系统中生物膜形态、生物膜微生物群落和EPS的综合影响进行研究,有利于进一步解析进水C/N对生物膜系统的影响机制。
本试验启动复合式生物膜反应器并模拟进水C/N波动条件,在进水C/N逐渐降低的运行条件下,考察了生物膜形态、生物膜微生物群落和EPS组分的变化,讨论了生物膜形态特征与微生物群落之间的相互作用及其对反应器性能的影响,有利于生物膜反应器在进水C/N波动条件下的优化运行。
1 试验部分
1.1 反应器与填料
本试验采用有机玻璃制成的固定生物膜-活性污泥(IFAS)反应器,有效容积为46 L(图1)。反应器分为4个隔室,每个隔室底部设直径15 cm的曝气盘进行曝气,曝气量由流量计控制。反应器的混合液进入有效容积为30 L的沉淀池进行泥水分离,污泥回流比为100%。通过蠕动泵控制反应器进水水量与污泥回流量。反应器所用填料为立方体聚氨酯填料(边长1.5 cm),孔径为0.5 mm,比表面积为400 m2/m3,密度为40 kg/m3。反应器中的悬浮污泥接种自北京工业大学中试SBR和高碑店污水处理厂连续流中试的剩余污泥[13]。
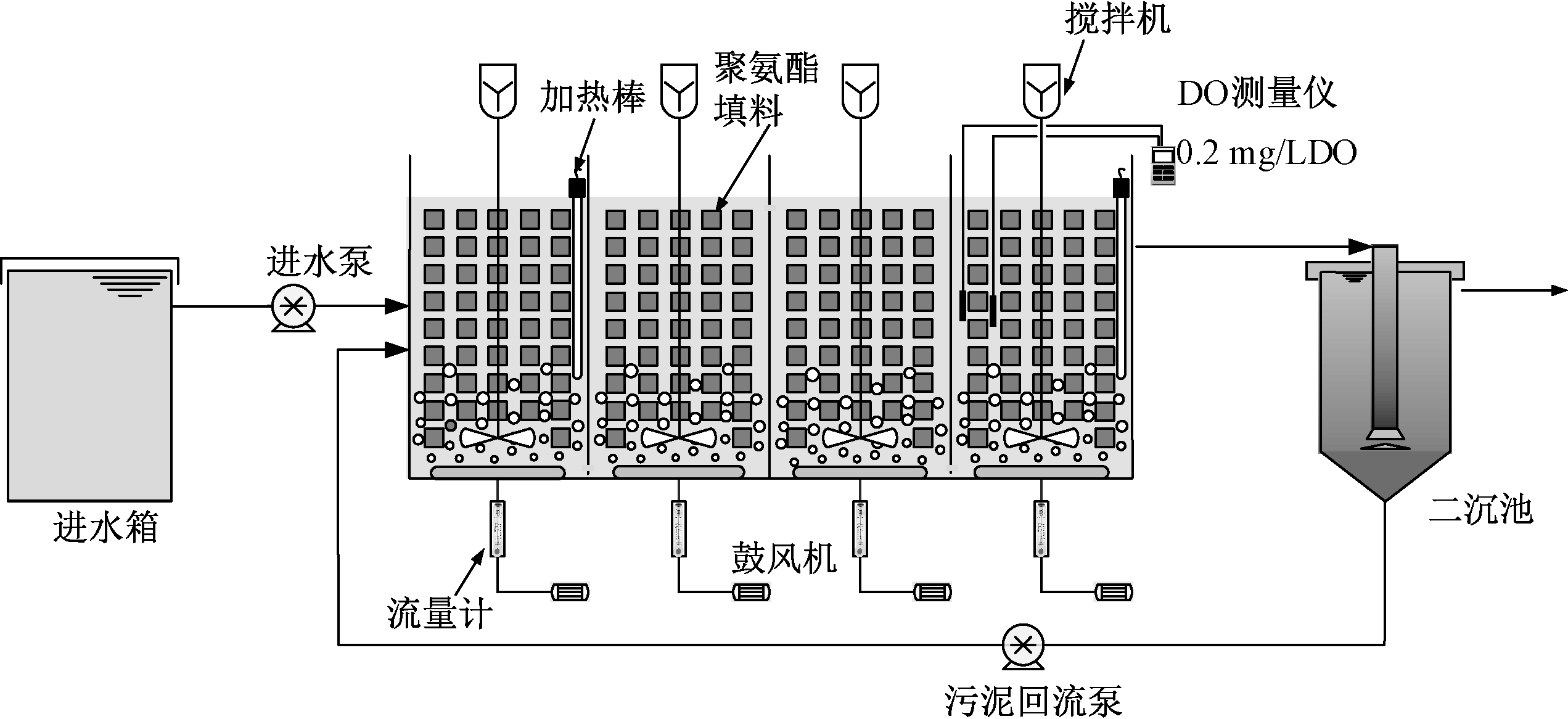
图1 IFAS工艺装置示意
Fig.1 Schematic diagram of the IFAS reactor
1.2 进水水质和运行参数
试验进水为生活污水中添加NH4HCO3、NaHCO3混合而成的配水。根据进水水质条件主要分为2个阶段:第1阶段进水C/N为2.5,平均进水有机负荷、总无机氮负荷分别为0.75,0.3 kg/(m3·d);第2阶段进水C/N为0.14,平均进水有机负荷、总无机氮负荷分别为0.14,1.0 kg/(m3·d)。整个试验过程不控制pH,pH=7.3~8.0,ρ(DO)为0.15~0.5 mg/L,温度为(29±2)℃。
1.3 分析项目与方法
氨氮采用纳氏试剂分光光度法;亚硝酸盐采用 N-(1萘基)-乙二胺分光光度法;硝酸盐氮采用麝香草酚法;COD采用COD快速测定仪测定(兰州连华 5B-1型); pH、DO、温度采用便携式检测仪(3420)检测(德国WTW);生物膜经超声洗脱后,采用标准重量法测定污泥浓度;EPS的提取采用热消解法[14],EPS中多糖和蛋白质分别采用蒽酮法[15]、福林酚法[16]测定;生物膜形态通过扫描电镜观察,生物填料样品从反应器取出后,立即用蒸馏水清洗3遍,然后将其切成0.5 cm×0.5 cm×0.2 cm的块样。随后根据Jia 等[17]提供的方法对块样预处理,最后使用扫描电子显微镜(Hitachi S-4300,Japan)对样品进行观察。
1.4 DNA的提取与高通量测序
称取0.1~0.2 g经-50 ℃真空冻干的活性污泥(LABCONCO Co.,Free Zone,USA),采用土壤DNA快速提取试剂盒(MP Biomedicals,OH,USA)提取污泥样品DNA,具体方法参照试剂盒使用说明。DNA样品送至诺禾生物科技有限公司(中国,北京)进行高通量测序分析,样品16SrRNA中的V3—V4区被扩增,所用引物为341F (5′-CCTAYGGGRBGCASCAG-3′)与806R (5′-GGACTACCAGGGTATCTAAT-3′)。高通量原始序列已上传至NCBI数据库,读取序列号为SRR8474830-SRR8474834。
2 结果与讨论
2.1 C/N波动条件下生物膜的生物量与形态变化
整个试验过程分为2个阶段,生物膜污泥浓度和形态的动态变化如图2所示。反应器启动运行时进水C/N为2.5(1~54 d)。生物膜污泥浓度在第14天快速达到9.5 mg/cm3,系统COD去除率达到70%,氨氮去除率达到88%,平均总无机氮去除负荷为0.2 kg/(m3·d),COD去除和脱氮的性能良好。随着生物膜的不断生长,本阶段末生物膜污泥浓度增长至最大值19.6 mg/cm3。该过程中,生物膜表面先后呈现棕色和黑色,并在生物膜表面观察到黏性物质存在(图2b,阶段Ⅰ 49 d)。扫描电镜结果显示生物膜表面存在大量丝状菌(图2b,阶段Ⅱ 49 d)。此外,虽然生物膜污泥浓度增加,但是反应器平均COD去除率并未提高,平均氨氮去除率反而下降至20%,总无机氮去除负荷降低至0.07 kg/(m3·d)。

图2 反应器各阶段的运行性能、生物膜污泥浓度和形态的变化
Fig.2 Performance of operation, variation of sludge concentration and morphology on biofilm in different phases
试验第2阶段进水C/N降至0.14(55~160 d)。该阶段初期(55~79 d),进水波动导致生物膜污泥浓度降至10.1 mg/cm3。扫描电镜观察结果显示:在第79天时,生物膜表面的丝状菌大量脱落,105 d时已无明显丝状菌存在(图2b,阶段Ⅱ 105 d)。与此同时,随着进水C/N的降低,系统氨氮去除率恢复至85%,总氮去除负荷恢复至0.25 kg/(m3·d)。在进水低C/N条件下生物膜逐渐开始恢复生长,在第160天时生物膜污泥浓度增至16.8 mg/cm3。伴随着生物膜污泥浓度的变化,生物膜表面由黑色变为棕色,黏性物质减少(图2b,阶段 Ⅰ 105 d),填料表面逐渐变得粗糙,开始呈现砖红色(图2b,阶段 Ⅰ 160 d),并在试验末期的填料和生物膜表面观察到密实的颗粒聚集体(图2b,阶段 Ⅱ 160 d)。随着生物膜的增加系统脱氮负荷不断增加,并最终维持在(1.2±0.14) kg/(m3·d),总氮去除率恢复至88%。
试验结果表明:高进水C/N虽利于生物膜的形成和生长,但形成的生物膜表观形态疏松,黏性物质和丝状菌起主导作用。当进水C/N由2.5降为0.14时,系统的生物膜结构发生了剧烈的变化,生物膜从载体表面脱落,系统的处理性能受到影响。但是生物膜系统表现出良好的适应性,在低C/N条件下生物膜脱落未持续破坏生物膜结构,反而使生物膜更加密实,提高了系统的脱氮性能。
2.2 C/N波动条件下生物膜微生物群落的迁移变化
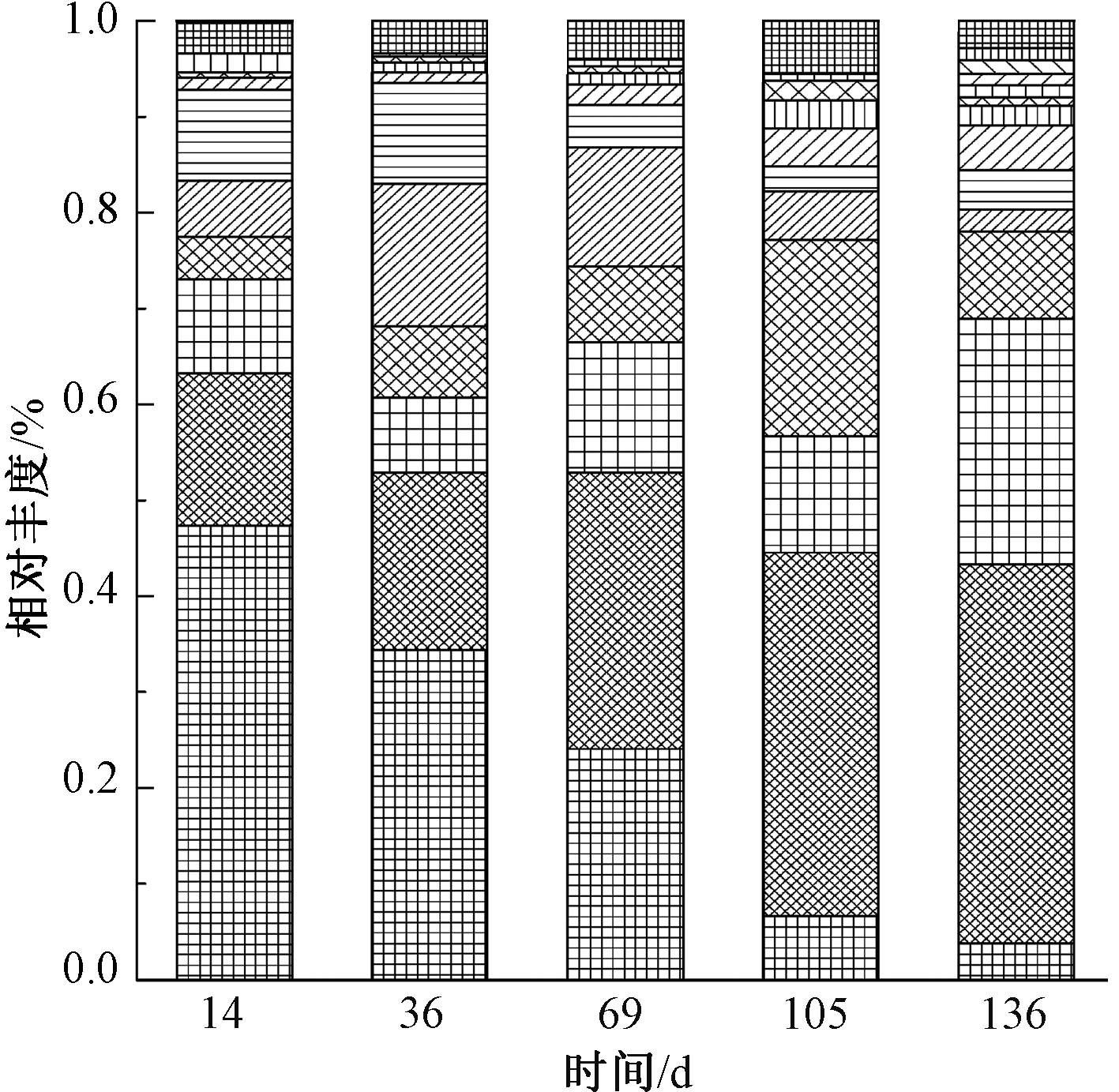
进水C/N波动对生物膜的微生物群落结构产生的影响,通过高通量测序技术进一步考察。不同C/N条件下生物膜中微生物多样性有显著不同。如表1所示,进水C/N由2.5降为0.14时,微生物多样性指数、Chao1和Shannon指数均减小。该结果表明:进水有机负荷高时,微生物多样性低,少数具有竞争优势的异养微生物占据主导。而随着进水C/N的降低,生物膜中微生物多样性增加。这可能是因为生长世代时间长的微生物被逐渐富集[18]。
表1 生物膜样品中物种多样性指数
Table 1 The index of microbial diversity on biofilm
C/NChao1Shannon2.51361.176.9280.141530.927.493
生物膜微生物在门水平上随时间的变化如图3所示。进水C/N由2.5降为0.14时,生物膜微生物中的放线菌门(Actinobacteria)显著下降,相对比例从47.4%下降至3.8%。而变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)的相对比例有显著增加,其中变形菌门相对比例从15.7%增加到39.5%,而绿弯菌门从9.8%增加到25.7%。此外,拟杆菌门(Bacteroidetes)也从4.4%逐渐增加到9.1%。值得关注的是,在属水平上,当进水C/N逐渐降低时,与氮循环有关的微生物,包括Denitratisoma、Nitrosomonas、Candidatus Jettenia、 Candidatus kuenenia等的相对丰度增加。以上试验结果表明:进水C/N的变化对生物膜的群落结构有显著影响,进水C/N降低有利于生物膜中微生物多样性的增加和氮循环相关微生物的富集。
![]() Others;
Others; ![]() Planctomycetes;
Planctomycetes; ![]() Parcubacteria;
Parcubacteria; ![]() Armatimonadetes;
Armatimonadetes; ![]() Ignavibacteriae;
Ignavibacteriae; ![]() Verrucomicrobia;
Verrucomicrobia; ![]() Chlorobi;
Chlorobi; ![]() Acidobacteria;
Acidobacteria; ![]() Firmicutes;
Firmicutes; ![]() Thermomicrobia;
Thermomicrobia; ![]() Bacteroidetes;
Bacteroidetes; ![]() Chloroflexi;
Chloroflexi; ![]() Proteobacteria;
Proteobacteria; ![]() Actinobacteria。
Actinobacteria。
图3 不同阶段微生物群落在门水平的变化
Fig.3 Variation of microbial community on phylum level in difference phases
2.3 进水C/N波动对生物膜中多糖和蛋白质含量的影响
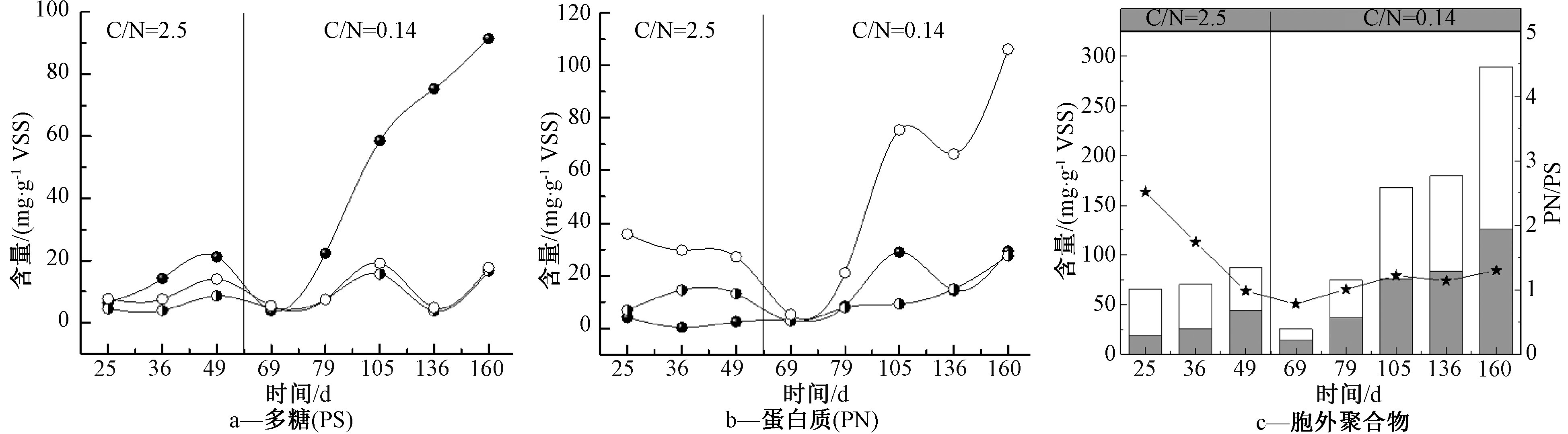
生物膜的微生物群落与胞外聚合物(EPS)存在相互影响[3],因此对C/N波动条件下生物膜EPS的变化进行了进一步考察。如图4所示:进水C/N为2.5阶段(1~54 d),生物膜中的多糖和蛋白质总含量为65.9~86.8 mg/g VSS,多糖在总含量中的占比由28.4%逐渐增加至50.5%,使得蛋白质与多糖比(PN/PS)由初始的2.52降至0.98。而且溶解层EPS(S-EPS)的多糖含量显著增加。据Miqueleto等[19] 报道,在高有机负荷条件下,有机物除了用于微生物自身的生长,还会加速三磷酸腺苷(ATP)的产生,促进多糖的合成有利于微生物的附着生长,促使生物膜快速形成。
进水C/N为0.14阶段的初期,生物膜中的EPS出现显著下降。EPS总含量减少至25.2 mg/g VSS,其中,S-EPS层的多糖和TB-EPS层的蛋白质含量下降显著。随着反应的进行,低C/N阶段后期(105~160 d),生物膜中多糖和蛋白质均有显著增加,含量分别为75.6~125.7,92.1~163.3 mg/g VSS。其中,S-EPS层中的多糖和TB-EPS中的蛋白质含量增加显著,PN/PS稳定在1.1~1.3,蛋白质在总含量中的占比为(55±1)%。该结果表明:生物膜中EPS含量的变化可能是导致生物膜污泥浓度和形态变化的原因。当进水C/N降低时,生物膜中的微生物分泌的蛋白质和多糖均大量减少,削弱了微生物与载体之间的黏滞力,从而导致生物膜脱落。而随着生物膜中微生物逐渐适应低C/N环境,EPS含量增加,尤其是S-EPS层中的多糖和TB-EPS中的蛋白质含量的增加,增强了生物膜表面的疏水性和微生物之间的吸附架桥作用[20],有利于生物膜的稳固生长。
2.4 进水C/N波动对生物膜系统的影响机制
本试验初期由于填料孔隙可快速吸附、截留大量悬浮污泥,有效地持留微生物,因此,在进水C/N和有机负荷较高的条件下依然可到达良好的去除效果。但随着反应器的运行时间延长,生物膜中的微生物群落结构和EPS逐渐变化。一方面,生物膜在EPS中多糖增加,生物膜污泥浓度迅速增加;另一方面,微生物中放线菌比例逐渐增加。此时水中的溶解氧被大量生长的放线菌Candidatus Microthrix、绿弯菌Unidentified Anaerolineaceae等异养菌消耗,同时生物膜表面的EPS和异养菌形成的黏液层,阻碍剩余污染物由液相向生物膜相的扩散[4],导致Nitrosomonas、 Denitratisoma的丰度减少,硝化性能变差,脱氮效果恶化。在第1阶段后期,反应器平均COD去除率仍可维持在70%,但总无机氮去除负荷仅为0.07 kg/(m3·d)。以上结果表明:在高有机负荷下生物膜中的微生物多样性低,虽然可实现良好的有机物去除,但是对脱氮效果有不利影响。
![]() —S-EPS;
—S-EPS; ![]() —LB-EPS;
—LB-EPS; ![]() —TB-EPS;
—TB-EPS; ![]() 多糖;
多糖; ![]() 蛋白质;
蛋白质; ![]() —PN/PS。
—PN/PS。
图4 不同阶段生物膜胞外聚合物含量的变化
Fig.4 Variation of EPS component on biofilm in different phases
当进水C/N降低至0.14时,生物膜中以放线菌门为主的异养菌相对丰度减少, 生物膜表面黏性物质逐渐脱落。水中的溶解氧和污染物在生物膜中的传质效率提高, 生物膜中的Nitrosomonas、Denitratisoma、 Candidatus Jettenia、 Candidatus kuenenia等脱氮功能菌被逐渐富集,因而生物膜中存在多种可能的氮素循环途径。在生物膜中,Nitrosomonas首先将部分氨氮氧化为亚硝酸盐,Candidatus Jettenia、 Candidatus kuenenia为主的厌氧氨氧化菌在生物膜厌氧区进一步利用生物膜中剩余的氨氮和生成的亚硝酸盐进行自养脱氮,生成N2和少量硝态氮。同时,Denitratisoma在生物膜中的缺氧区以污水中或降解EPS产生的有机物为碳源,还原亚硝酸盐和硝酸盐为N2。伴随着反应器脱氮性能的提高,生物膜污泥浓度逐渐增至16.8 mg/cm3,系统脱氮负荷不断增加,并最终维持在(1.2±0.14) kg/(m3·d),总氮去除率恢复至88%。
进水C/N对生物膜结构和微生物群落均具有显著影响,并最终导致污染物去除效果的变化。因此,实际污水处理中出现进水C/N波动时,应强化监测与运行调整,避免因生物膜脱落导致的运行不稳定现象。另外本研究发现,在低C/N条件下生物膜中存在多种与氮循环相关的微生物,尤其是实现厌氧氨氧化的富集并表现出良好的脱氮效果,这为低C/N废水高效脱氮提供了新的思路。一般认为城市污水的C/N较高(2~4),不利于厌氧氨氧化菌等世代时间较长的脱氮功能微生物的生长与富集[21],本研究表明实际污水处理系统中,构建低C/N的缺氧区或好氧区并投加填料,有可能实现脱氮功能微生物的富集并强化低C/N废水的总无机氮去除。
3 结 论
1)进水C/N对生物膜的生长和生物膜形态有显著影响。进水C/N为2.5时,生物膜形成周期短,表面被黑色黏性物质包裹,形态较为松散;进水C/N降低为0.14,可导致生物膜发生脱落,但脱落后生物膜污泥浓度会逐渐恢复生长。
2)进水C/N下降会导致生物膜微生物群落多样性的增加。伴随着绿弯菌门和变形菌门的增加,Nitrosomonas、Denitratisoma和厌氧氨氧化菌也被富集共生,多种氮循环途径有利于低C/N废水的脱氮。
3)进水C/N的变化,将首先导致生物膜形态和生物膜微生物群落组成的改变,从而影响生物膜系统的脱氮性能。
[1] Chen Y P, Zhang P, Guo J S, et al. Functional groups characteristics of EPS in biofilm growing on different carriers [J]. Chemosphere, 2013,92(6):633-638.
[2] Lee L Y, Ong S L, Ng W J. Biofilm morphology and nitrification activities: recovery of nitrifying biofilm particles covered with heterotrophic outgrowth [J]. Bioresource Technology, 2004,95(2):209-214.
[3] Zhang Y P, Wang F, Zhu X Z, et al. Extracellular polymeric substances govern the development of biofilm and mass transfer of polycyclic aromatic hydrocarbons for improved biodegradation [J]. Bioresource Technology, 2015,193:274-280.
[4] 周律,李哿,Shin H,等.污水生物处理中生物膜传质特性的研究进展 [J].环境科学学报, 2011,31(8):1580-1586.
[5] Ahmad M, Liu S, Mahmood N, et al. Effects of porous carrier size on biofilm development, microbial distribution and nitrogen removal in microaerobic bioreactors [J]. Bioresource Technology, 2017, 234:360-369.
[6] Fu Z M, Yang F L, Zhou F F, et al. Control of COD/N ratio for nutrient removal in a modified membrane bioreactor (MBR) treating high strength wastewater [J]. Bioresource Technology, 2009,100(1):136-141.
[7] Hao L, Liss S N, Liao B Q. Influence of COD:N ratio on sludge properties and their role in membrane fouling of a submerged membrane bioreactor [J]. Water Research, 2016,89(1):132-141.
[8] Chen C J, Sun F Q, Zhang H Q, et al. Evaluation of COD effect on anammox process and microbial communities in the anaerobic baffled reactor (ABR) [J]. Bioresource Technology, 2016, 216:571-578.
[9] Gönenc E, Harremo⊇s P. Nitrification in rotating-disk systems-Ⅱ. Criteria for simultaneous mineralization and nitrification [J]. Water Research, 1990,24(4):499-505.
[10] Okabe S, Kindaichi T, Ito T, et al. Analysis of size distribution and a real cell density of ammonia-oxidizing bacterial microcolonies in relation to substrate microprofiles in biofilms [J]. Biotechnology and Bioengineering, 2004,85:86-95.
[11] Chen C, Guo W S, Ngo H H, et al. Effects of C/N ratio on the performance of a hybrid sponge-assisted aerobic moving bed-anaerobic granular membrane bioreactor for municipal wastewater treatment [J]. Bioresource Technology, 2018,247:340-346.
[12] Di Trapani D, Di Bella G, Mannina G, et al. Effect of C/N shock variation on the performances of a moving bed membrane bioreactor [J]. Bioresource Technology, 2015,189:250-257.
[13] Zhang L, Zhang S J, Peng Y Z, et al. Nitrogen removal performance and microbial distribution in pilot-and full-scale integrated fixed-biofilm activated sludge reactors based on nitritation-anammox process [J]. Bioresource Technology, 2015, 196:448-453.
[14] Li X Y, Yang S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewaterability of activated sludge [J]. Water Research, 2007,41(5):1022-1030.
[15] Dubois M, Gilles H A, Hamilton J K. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry, 1956,28(3):350-356.
[16] Frrølund B, Griebe T, Nielseni P H. Enzymatic activity in the activated-sludge floc matrix [J]. Applied Microbiology Biotechnology, 1995,43(4):755-761.
[17] Jia F, Yang Q, Liu X, et al. Stratification of extracellular polymeric substances (EPS) for aggregated anammox microorganisms [J]. Environmental Science & Technology, 2017,51(6): 3260-3268.
[18] Wang C, Liu S T, Xu X C, et al. Achieving mainstream nitrogen removal through simultaneous partial nitrification, anammox and denitrification process in an integrated fixed film activated sludge reactor [J]. Chemosphere, 2018, 203:457-466.
[19] Miqueleto A P, Dolosic C C, Pozzi E, et al. Influence of carbon sources and C/N ratio on EPS production in anaerobic sequencing batch biofilm reactors for wastewater treatment [J]. Bioresource Technology, 2010,101(4):1324-1330.
[20] Salam Y, Chennaoui M, Sylla A, et al. Characterization, structure, and function of extracellular polymeric substances (EPS) of microbial biofilm in biological wastewater treatment systems: a review [J]. Desalination and Water Treatment, 2015, 57(35):16220-16237.
[21] Ma B, Wang S Y, Cao S B, et al. Biological nitrogen removal from sewage via anammox: recent advances [J]. Bioresource Technology, 2016, 200: 981-990.