0 引 言
多种水生植物的分泌物被发现具有明显抑制藻类生长的作用[1-7],目前从具有克藻作用的各种水生植物中提取、分离和鉴定抑藻化感物质等方面的研究越来越引起关注。
孙文浩等[1,2]研究发现,凤眼莲根系分泌物可抑制藻类生长,采用吸附柱过滤凤眼莲培养液,GC/MS测定洗脱液,分离鉴定出具有强烈抑藻活性的胺化合物——N-苯基-2-萘胺和N-苯基-1-萘胺。Tiziana等[3]从眼子菜科的6种植物中分离到各种构型的半日花烷二萜类物质,其中某些物质对绿藻门Selenastrum capricormutum抑制明显。Gross[4]对植株的丙酮和水溶液提取物分离鉴定出具有克藻活性的水溶性多酚类物质,主要为Tellimagrandin Ⅱ,其对多种球形藻和丝状蓝藻表现出强烈的抑制作用,对绿藻和硅藻也表现出轻度抑制。Wang等[5]发现眼子菜科、苦草等6种水生植物中提取出的精油对铜绿微囊藻Microcystis aeruginosa具有生长抑制作用,通过GC/MS从精油中鉴定出30多种成分; 并从眼子菜科Potamogeton malainus和Potamogeton maackianus的乙酸乙酯馏分中分析出具有克藻作用的脂肪酸、酚酸和羟基脂肪酸成分[5,6]。Zhang等[7]研究表明:眼子菜科分泌物对羊角月牙藻Selenastrum capricornutum和铜绿微囊藻具有生长抑制作用,并从提取物中分离出1-甲氧基-2-甲基-2-丙醇、2-甲基-2-己醇和4-乙基-2,6-二甲基-4-庚醇3种醇类抑藻物质。这些化感物质都是植物次生代谢产物,一般分子量较小,结构较简单[8]。
笔者前期的研究成果[9]表明,绿狐尾藻对2种典型蓝藻(水华鱼腥藻和铜绿微囊藻)生长有抑制作用,绿狐尾藻组织内可能存在化感物质,当绿狐尾藻与藻类共同存在时,该活性物质会被分泌至周围水体,使藻类的生长受到一定程度的抑制。笔者以绿狐尾藻的抑藻功能为基础,采用化学方法对绿狐尾藻-蓝藻共培养液进行提纯、分离,以及利用水溶性溶剂从绿狐尾藻植株体中提取具有抑藻效应的物质;并结合藻类测试实验,对非极性提取物进行鉴定,探寻绿狐尾藻化感活性的物质基础。
1 实验部分
1.1 实验材料
绿狐尾藻采自长沙县金井镇实验基地,在室外培养水箱中扩大培养;水华鱼腥藻和铜绿微囊藻购自中国科学院水生生物研究所藻种库。水华鱼腥藻和铜绿微囊藻采用BG-11培养液[10],光暗比为12∶12培养,光照强度4500 lux,温度25 ℃。每7~10 d转接1次。所有转接均在无菌条件下进行。
1.2 实验设置
1)绿狐尾藻与蓝藻共培养实验设置。
实验开始前3 d植物转入室内适应培养。选取室外水池中生长良好、长势基本一致的绿狐尾藻,在不影响植株生长状态的前提下,去除枯烂部分,用自来水和蒸馏水清洗干净,称取全株绿狐尾藻(每株(10±0.5) g鲜重)分别与水华鱼腥藻和铜绿微囊藻进行共培养实验。每组实验在盛有500 mL BG-11培养藻液的1 L锥形瓶内进行,光照强度为4500 lux,温度为25 ℃,光暗12 h∶12 h培养。
2)绿狐尾藻滤液培养蓝藻实验设置。
选取室外水池中生长良好、长势基本一致的绿狐尾藻,在不影响植株生长状态的前提条件下,去除枯烂部分,用自来水和蒸馏水清洗干净,称取全株绿狐尾藻(每株(10±0.5) g鲜重)在盛有500 mL BG-11培养液的1 L锥形瓶内,提供光照强度4500 lux,温度25 ℃,光暗12∶12培养。4 d后取250 mL的滤液,接种试验藻种250 mL,在相同条件下培养,如表1所示。
表1 共培养和滤液培养藻设定
Table 1 Algae setting in co-cultivating and filtrate cultivating experiments
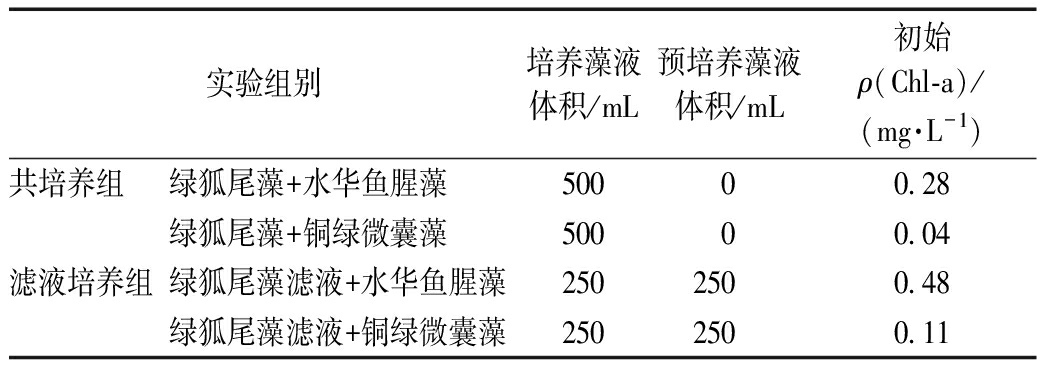
实验组别培养藻液体积/mL预培养藻液体积/mL初始ρ(Chl-a)/(mg·L-1)共培养组绿狐尾藻+水华鱼腥藻50000.28绿狐尾藻+铜绿微囊藻50000.04滤液培养组绿狐尾藻滤液+水华鱼腥藻2502500.48绿狐尾藻滤液+铜绿微囊藻2502500.11
1.3 实验方法
1.3.1 共培养液物质分离
用定性滤纸过滤收集绿狐尾藻-蓝藻共培养组实验9 d后的培养液,滤液先由石油醚萃取3次,收集石油醚相,水相继续用乙酸乙酯萃取3次,分别收集乙酸乙酯相和水相,各相组分旋转浓缩至近干,自然风干后分别由2 mL二甲基亚砜(DMSO)溶解,过Millipore超滤离心管待用。共培养液物质分离过程步骤见图1。
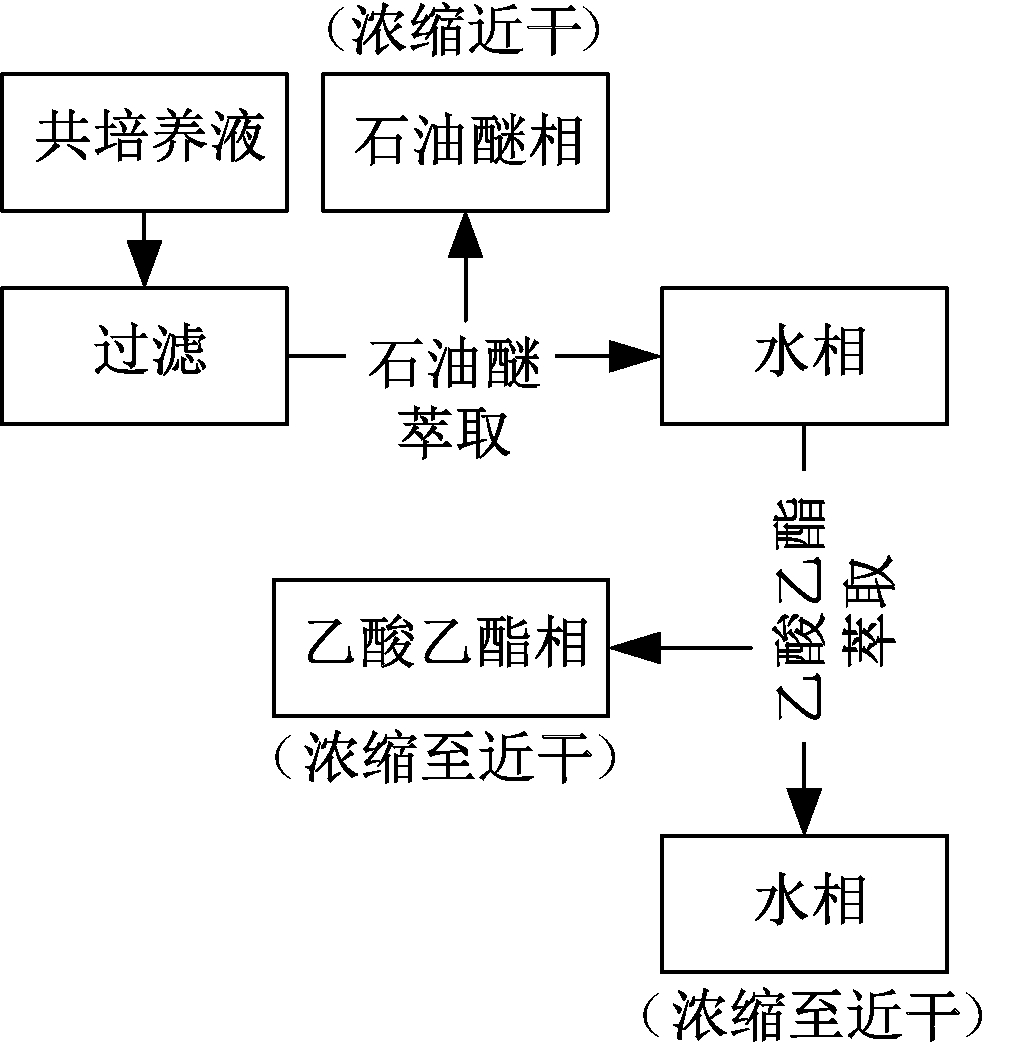
图1 共培养液物质分离过程步骤
Fig.1 Separation process of co-culture filtrate
1.3.2 绿狐尾藻浸膏的制备和提纯
1)制备。选取生长良好、长势基本一致的绿狐尾藻约5 kg,在不影响植株生长状态的前提条件下,去除枯烂部分,用自来水和蒸馏水清洗干净备用。将全部洗净的新鲜绿狐尾藻晾干表面水分后置于40 ℃烘箱内烘至恒重;烘干的绿狐尾藻植物用粉碎机粉碎过100目筛,得到干粉约2 kg;粉碎后的干粉以四分法取样100 g,加入70%乙醇(色谱纯)浸渍提取(30 d,室温)。将浸提液定性滤纸过滤,滤液经旋转蒸发仪减压浓缩(35 ℃)至15 mL,制得绿狐尾藻浸膏。
2)提纯。绿狐尾藻浸膏用定性滤纸进行过滤,除去浸提液中的沉淀,收集滤液。将滤液置于250 mL分液漏斗内,分3次加入10 mL石油醚分层萃取,收集下层水相;分3次加入10 mL乙酸乙酯继续萃取,收集下层水相后蒸发浓缩至近干待用。
1.3.3 96孔板剂量-效应试验
1)共培养液萃取液抑藻的剂量-效应试验。选用96微孔板进行剂量-效应试验[9],微板设计如图2所示。在微板四周36个孔中加入200 μL水防止产生边缘效应,微板中间6×10阵列共60个孔为试验孔,进行剂量-效应测定时,取稀释系数为0.4,待测物的体积分数分别为100%、40%、16%、6.4%、2.56%、1.02%、0.4%、0.16%、0.06%、0%。前3行30个孔为设置3次平行的10个按等比级数设计的不同浓度污染物的毒性试验,试液总体积为100 μL;后3行30个孔为设置3次平行的加入对应二甲基亚砜(DMSO)浓度的试剂空白对照。相应的空白对照中DMSO浓度与待测物稀释度相同。最后在60个试验孔中分别加入100 μL处于对数生长期的藻液,使各孔总体积达到200 μL。盖上盖子,放入光照培养箱内光照培养,培养条件同藻种预培养。暴露时间为72 h,以酶标仪在430 nm处检测光密度。根据处理组与空白对照的差值,计算剂量-效应抑制率[10]。

图2 藻毒性试验的96孔板设计
Fig.2 The ninety-six-well-amicroplate for algae toxicity test
2)绿狐尾藻浸液抑藻的剂量-效应试验。将分离浓缩后的绿狐尾藻浸膏溶解于5 mL DMSO中,使用前以0.45 μm滤膜过滤,除去微生物和杂质后待用。进行剂量-效应测定时,取稀释系数为0.4,待测物的体积分数分别为100%、40%、16%、6.4%、2.56%、1.02%、0.4%、0.16%、0.06%、0%。相应的试剂空白对照中二甲基亚砜浓度与待测物稀释度相同。进行藻类测试(96孔板法)测定该浸膏的抑藻效果。96孔板上处理组和对照组的布置、培养、检测、计算与1.3.3节中1)相同。
1.4 测定与分析方法
水相组分的GC-MS分析:取水相组分采用GC-MS测定分析。仪器型号为安捷伦7890A-5975C,毛细管柱HP-5MS,30 m×0.25 mm×0.25 μm。GC-MS载气为He,采用不分流进样,流速为1.0 mL/min;进样量为1 μL;进样温度和接口温度均为250 ℃。整个过程设置为:从50 ℃开始,以10 ℃/min上升至120 ℃,持续1 min后,以3 ℃/min上升至240 ℃。样品中各组分的鉴定参照NIST11标准谱库,使用面积归一化法计算提取液中各种物质的相对含量。
藻类叶绿素a的测定采用热乙醇方法[10]。
2 结果与讨论
2.1 共培养萃取液抑藻的剂量-效应
不同极性萃取液抑藻的剂量-效应曲线如图3所示。小极性石油醚萃取液和中等极性乙酸乙酯萃取液随着添加的体积分数增加,水华鱼腥藻的生长并没有表现出明显的抑制现象;大极性水相萃取液在低体积浓度也没有出现抑制水华鱼腥藻生长的现象,直到水相萃取液体积分数达到16%以上,水华鱼腥藻的生长抑制率明显上升,达到30%,并随添加的体积分数增加,抑制率也不断增加。不同极性萃取液对铜绿微囊藻的生长抑制作用在低浓度也没有发现明显区别,同样在高体积分数的水相萃取液添加组,铜绿微囊藻生长抑制率比其他2组小极性和中极性萃取液显著。结果表明,绿狐尾藻分泌的化感物质主要分布于水相中,并且仅在高浓度的水相组分对蓝藻有明显的抑制作用,这与其他研究者发现化感物质抑藻作用主要存在于高浓度添加组的现象一致[6]。
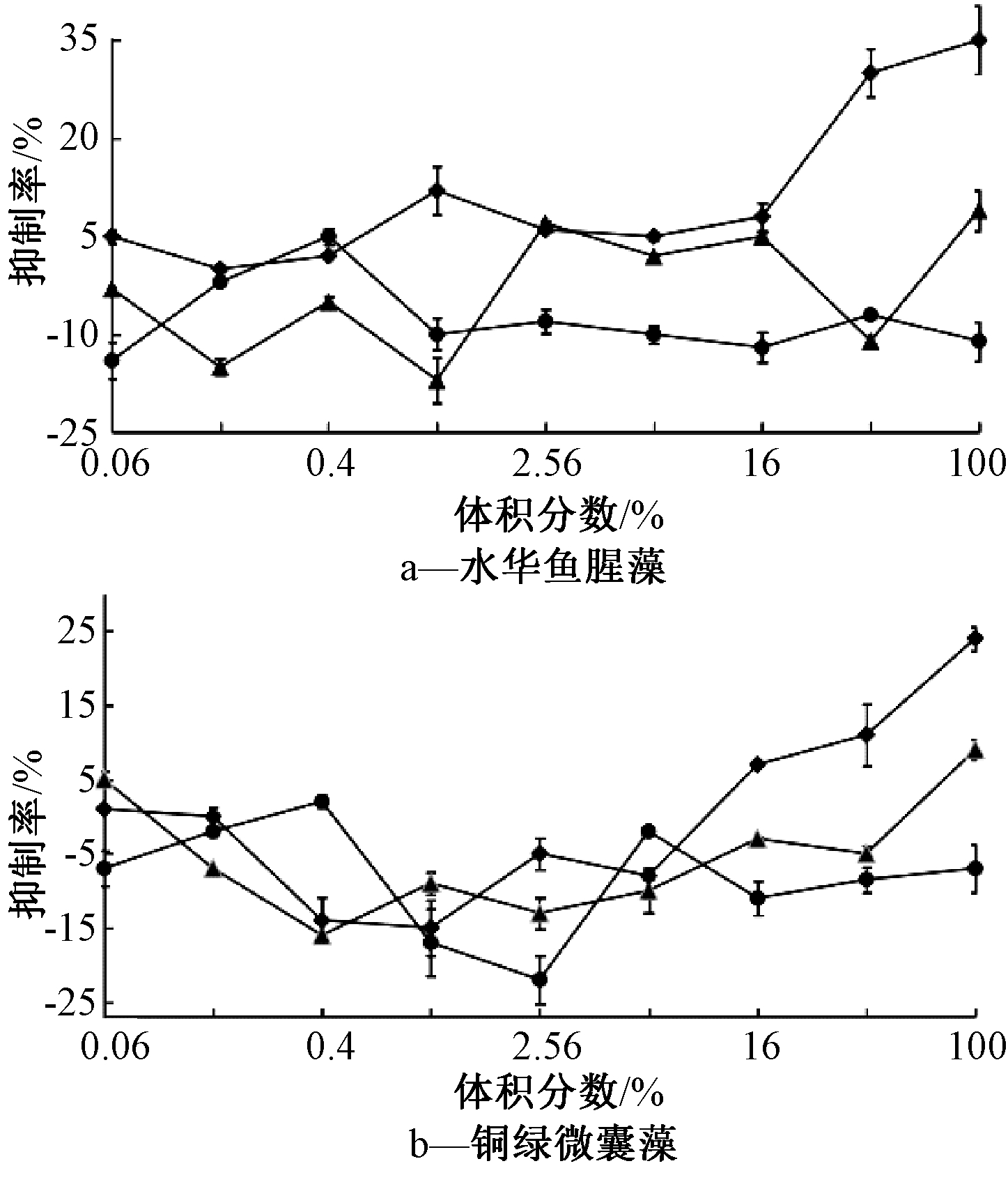
![]() —石油醚相;
—石油醚相; ![]() —乙酸乙酯相;
—乙酸乙酯相; ![]() —水相。
—水相。
图3 不同萃取液对水华鱼腥藻和铜绿微囊藻的剂量-效应曲线
Fig.3 Dosage-effects curves of extract liquors to A. flos-aquae and M. aeruginosa
2.2 绿狐尾藻浸液抑藻的剂量-效应
经大极性乙醇对绿狐尾藻干粉30 d的充分浸提后,获得的水相可溶组分再经提纯处理后用于剂量-效应实验,绿狐尾藻浸液对水华鱼腥藻和铜绿微囊藻的剂量-效应曲线如图4所示。可知:除绿狐尾藻干粉浸液投加量为0.06%时对铜绿微囊藻添加组有负向抑制外,体积分数0.16%~100%下对2种蓝藻均为正向抑制,并随添加的体积分数增加,抑制率总体呈不断上升的趋势。对比共培养液的水相萃取液对2种蓝藻抑制效果,干粉浸液对藻类的抑制效果更加显著。尤其是对铜绿微囊藻在高浓度添加组,干粉浸液的抑制率高达65%。这可能与化感物质提取的方式有关,理论上通过干粉浸液比直接从植物体外收集的化感物质的浓度更高,种类更多。
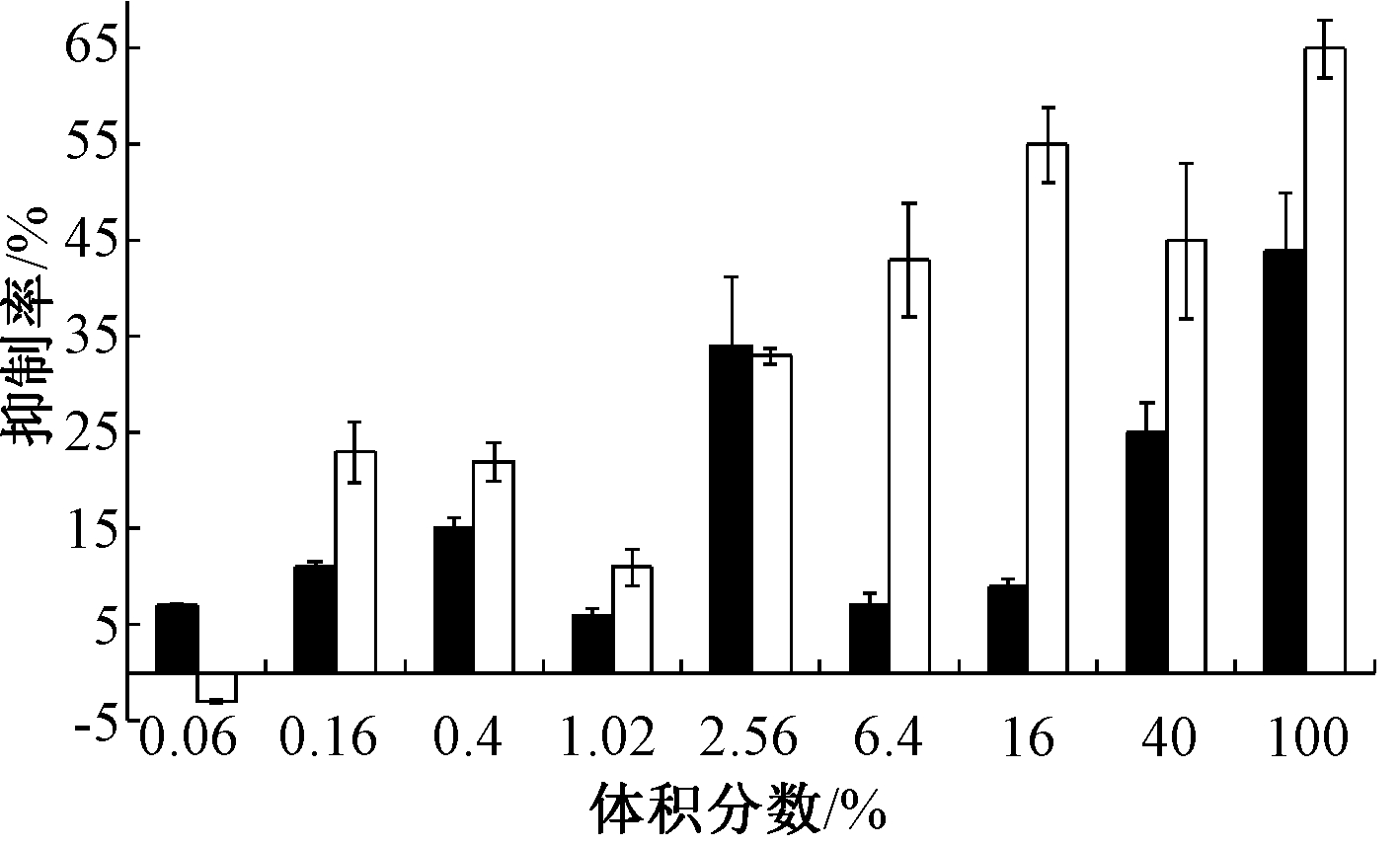
![]() 水华鱼腥藻;
水华鱼腥藻; ![]() 铜绿微囊藻。
铜绿微囊藻。
图4 绿狐尾藻浸液对水华鱼腥藻和铜绿微囊藻的剂量-效应曲线
Fig.4 Dosage-effects curves of eluant liquors to A. flos-aquae and M. aeruginosa
2.3 绿狐尾藻-蓝藻共培养液水相组分鉴定结果
采用GC-MS测定绿狐尾藻-蓝藻共培养液水相组分中化合物的结构信息,使用HP-5MS毛细管柱对样品进行分离,HP-5MS毛细管柱兼有非极性柱与极性柱的优点,对非极性的烃类组分及中等极性的酯、醚等成分均有较好的分离效果。
绿狐尾藻-水华鱼腥藻共培养液水相组分GC-MS测定的总离子流见图5,将质谱图经NIST11谱库检索和分析,确定水相组分中化学成分详见表2。可知:共鉴定出40多种有机化合物,主要包括烃类、酸类、醇类、酮类、醛类和胺类等化合物,其中酸类有10种,烃类有9种,胺类有7种,醇类5种,酮类有4种,且酸类相对含量最高,烃类,胺类和酮类化合物的相对含量较高。其他醛类、杂环等化合物种类和含量较少。酸类化感物质是第一大类化感物质,具有较强的化感作用,很多研究也发现酸类物质具有非常好的抑藻效果[8,13-14]。
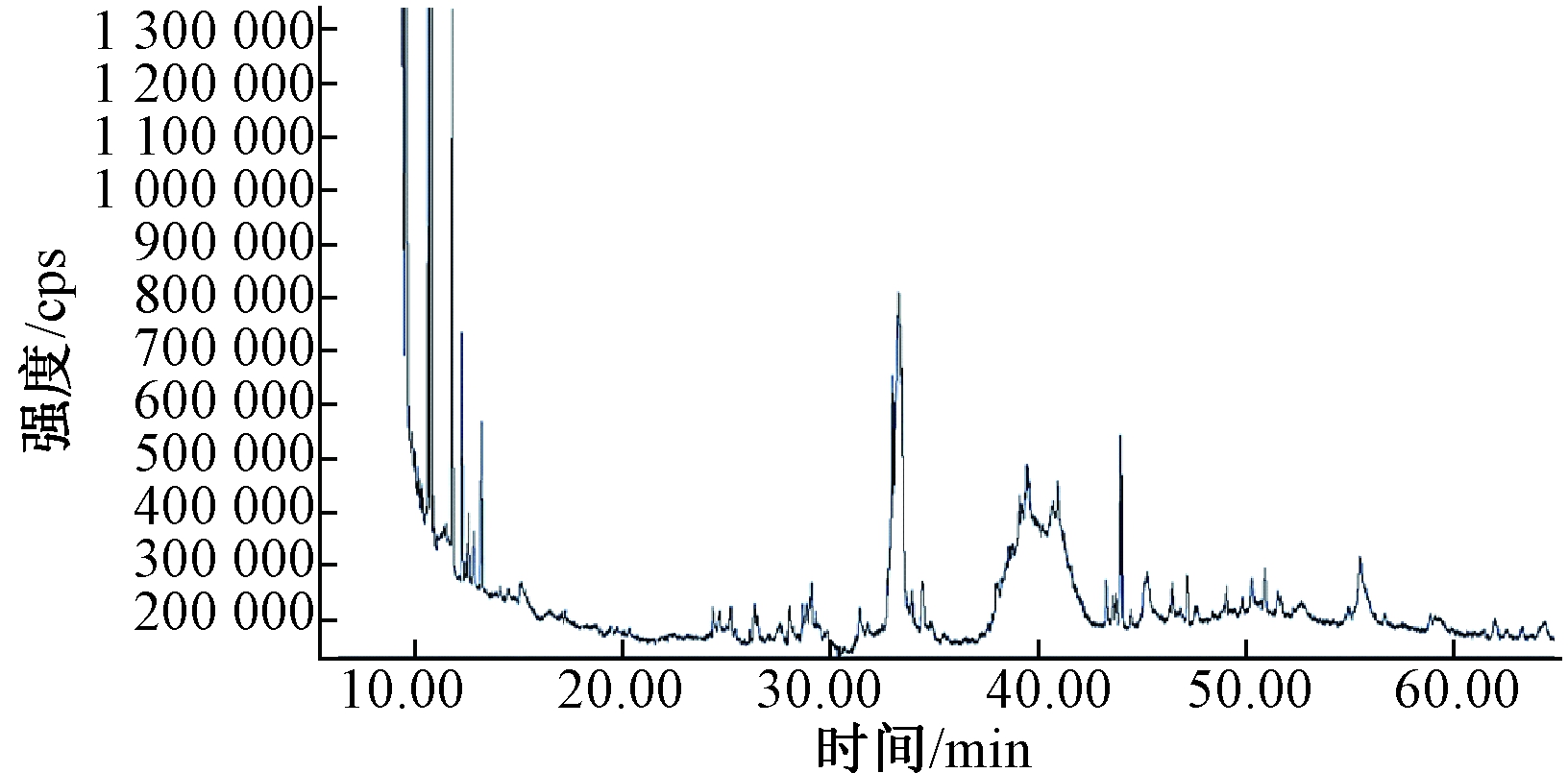
图5 绿狐尾藻-水华鱼腥藻共培养液水相组分GC-MS 的总离子流
Fig.5 TIC via GC/MS of the aqueous eluant components from co-culture filtrate of M. aquaticum and A. flos-aquae
表2 绿狐尾藻-水华鱼腥藻共培养液水相组分GC-MS鉴定结果
Table 2 Composition of the water phase from co-culture filtrate of Myriophyllum aquaticum and A. flos-aquae by GC-MS

分类名称烃类二十烷、1-乙烯氧基正十八烷、甲基二乙氧基硅烷、1氯-2-对十二氧乙烷、甲基二乙氧基硅烷、十四甲基六硅氧烷、3,8-二甲基-癸烷、十八甲基环壬硅氧烷、3-异丙氧基-1,1,1,7,7,7-六甲基-3,5,5-三甲硅氧基硅氧烷醇类豆甾醇、顺-13-十八碳二烯-1-醇、顺,顺-2-甲基-3,13-十八二烯醇、3-(4-甲氧基-苯亚胺基)-1-苯基-丙烯-1-醇、Z,E-3,13-十八碳二烯-1-醇酮类2-十五烷酮、22-豆甾烯-3-酮、八氢-4a-甲基-7-(1-甲基乙基)2-(1H)萘酮、N-(2-羟丙基)-4,6-二甲基-3-氰基吡啶酮酸类棕榈酸、花生酸、十四酸、十八烯酸、(Z,Z)-9,12-十八烷二烯酸、苯二羧酸(2-乙基)甲酯、碳酸三氯丙酯、碳酸丙酯2,2,2-三氯乙基酯、缩水甘油酸,2-氨基甲酰基,3-甲基-3-(1-甲基乙基)乙酯、三甲基硅醇甲酸胺类N-苯甲基-N-乙基-丙基异苯甲胺、苯丙胺、N-(4-异丙基苯甲醇)-3-苯基丙酰胺、三(三甲基硅基)羟胺、己内酰胺、二甲基苯甲酰胺、2-(1-金刚烷基)-N-(1-金刚烷基-1-基乙基)-乙酰胺醛类7,11-十六碳二烯醛酚类1-甲基-2-苯基吲哚其他2,3-二甲基吡啶、甲氧基苯基肟、 2,3-二氢-1-甲基-1-丙基-1H-1-硅茚、3-(二异丙基-甲基磷酰)-苯甲精
绿狐尾藻-铜绿微囊藻共培养液水相组分GC-MS测定的总离子流见图6,将质谱图经NIST11谱库检索和分析,水相组分见表3。可知:共鉴定出17种有机化合物,包括烃类、酸类、醇类、酚类和胺类等,其中酸类有3种,烃类有2种,胺类有3种,醇类1种及苯类、其他杂环等种类。与绿狐尾藻-水华鱼腥藻共培养水相组分GC-MS鉴定结果相比,化学成分的种类和含量较少。但是鉴定结果显示己内酰胺、甲氧基苯基肟2种化合物均在2组水相组分中检出。
2.4 绿狐尾藻浸膏水相组分GC-MS鉴定结果
采用GC-MS测定绿狐尾藻浸膏水相组分中化合物的结构信息,其总离子流图见图7。
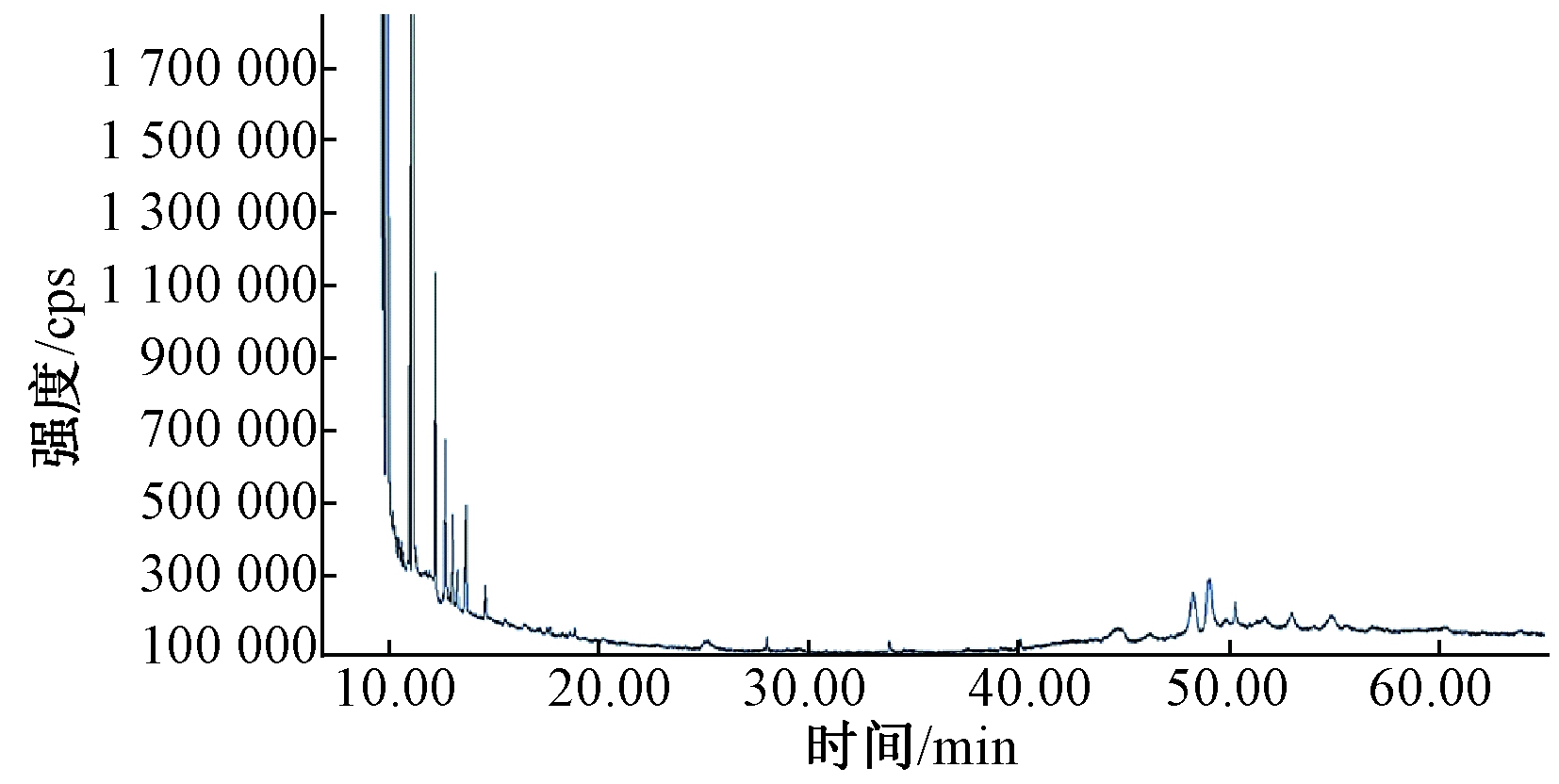
图6 绿狐尾藻-铜绿微囊藻共培养液水相组分 GC-MS 的总离子流
Fig.6 TIC va GC/MS of the aqueous eluant components from co-culture filtrate of Myriophyllum aquaticum and M. aeruginosa
表3 绿狐尾藻-铜绿微囊藻共培养液水相组分
GC-MS鉴定结果
Table 3 Composition of the water phase from co-culture filtrate of Myriophyllum aquaticum and M. aeruginosa by GC-MS

分类名称烃类17-三十五碳烯、2-二甲基硅氧基戊烷醇类二聚丙三醇酚类3,4-二硝基苯酚、1-甲基-5-苯基吲哚醚类正辛基丙基硫醚酸类4-氨基甲酰-2-硝基苯基-乙酸、邻苯二甲酸二(2-乙基己基)酯、邻苯二甲酸二戊酯胺类4-乙基苯甲酰胺、己内酰胺、邻甲苯胺其他甲基福林、甲氧基苯基肟、二十三烷基 三氟醋酸盐、吡啶并[2,3-d]嘧啶苯、(1,2-二溴-2-硝基乙基)-苯

图7 绿狐尾藻浸膏水相组分GC-MS的总离子流
Fig.7 TIC via GC/MS of the aqueous eluant components from Myriophyllum aquaticum extract
将质谱图经NIST11谱库检索和分析,确定了水相组分中的化学成分,结果见表4。可知:共鉴定出63种有机化合物,主要包括酸类、酮类、酚类和胺类等,其中酸类有16种,胺类有11种,酚类有7种,酮类有5种,且酸类相对含量最高,胺类和酚类的相对含量较高,醇类和醛类等化合物种类和含量较少。
与共培养水相组分GC-MS鉴定结果相比,绿狐尾藻植株浸提液中化学成分的种类和含量最多,其中在狐尾藻植株浸提液和狐尾藻-水华鱼腥藻水相组分中均检出n-十六烷酸,但在狐尾藻-铜绿微囊藻水相组分中未检出n-十六烷酸;己内酰胺和甲氧基苯基肟2种化合物在藻植株浸提液、狐尾藻-水华鱼腥藻水相组分和狐尾藻-铜绿微囊藻水相组分中均有检出。己内酰胺(CPL)主要用于生产聚己内酰胺纤维树脂,广泛应用于纺织、汽车、电子、机械等领域,主要来源于化学制剂合成[15,16],未见从植物中提取的报道。因此,检出的己内酰胺很有可能来源于浸提液或滤液在提纯分离过程中所直接或间接接触塑料制品时引入的已内酰胺,而不是绿狐尾藻分泌的物质。甲氧基苯基肟从其他植物或菌种的分泌物中也被检出,Chipps等[18]从苦瓜种浸液中提取的活性成分中检出甲氧基苯基肟,Zheng等[19]通过GC-MS从竹笋中检出甲氧基苯基肟[17,18],Hu等[19]研究表明,甲氧基苯基肟具有抑菌作用。结合本实验鉴定结果表明,甲氧基苯基肟从绿狐尾藻体内和体外浸液中均可检出,甲氧基苯基肟可能为绿狐尾藻抑制蓝藻生长的化感物质成分。
表4 绿狐尾藻浸膏水相组分GC-MS鉴定结果
Table 4 Chemical composition in aqueous extracts of dry Myriophyllum aquaticum powder

分类名称烃类三甲基氟硅烷、(3-甲基-1-丁炔基)三甲基硅烷、2-氯-丙烷醇类L-苏丁醇、2-呋喃基甲醇、顺,顺-2-甲基-3,13-十八二烯醇酚类1,2,3-苯三酚、对苯二酚、儿茶酚、4-甲氧基-2-硝基苯酚、4-硝基愈创木酚、4-乙烯基-2-甲氧基苯酚、2-甲氧基-5-硝基苯酚醚类正辛基丙基硫醚、2-氯乙基甲基醚酮类2,3-二氢-3,5二羟基-6-甲基-4(H)-吡喃-4-酮、6-羟基-5-甲基苯甲胺-嘧啶-2,4(1H,3H)-二酮、2,3-二氢-香豆酮、四氢-7a-乙酰基-3-叔丁基-吡咯[1,2-c]恶唑-1(3H)-酮、3,3-二甲基-4-甲氨基丁酮酸类4-氨基甲酰-2-硝基苯基-乙酸、反式-1,2-环丁二酸、苯甲酸、2,4-己二烯酸、3-呋喃甲酸、苯甲酸、n-十六烷酸、5,6,7,7a-四氢-7a甲基-5-氧-4-茚羧酸、乙基异丙基二甲基氨基磷酸酯、3-氯-4-甲氧基苯甲酸甲酯、2-氯丙酸乙酯、2,2-二甲基丙酸2,4-二硝基苯基酯、邻甲苯基异硫代异氰酸酯、2,6-二甲基-3,4-吡啶二羧酸、二脲基乙酸、甘氨酰甘氨酸胺类1-甲基-N-香草基-(+)-2-苯胺、己内酰胺、双(β-氨乙基)胺、(4-甲氧基苯基)丙-2-胺、N,N′,N″-三肼基羰基磷酰胺、N-甲基-1,3-丙二胺、3-氯-N-甲基丙胺、氟苯氧丙胺、间羟胺、O,O-二甲基 N,N-硫代磷酰胺、2,4,5-三甲氧基苯丙胺醛类5-乙酰氧基甲基-2-呋喃醛、5-羟甲基糠醛、5-(4-硝基苯氧基甲基)-呋喃-2-甲醛、其他甲氧基苯基肟、甲基内吸磷砜、4-甲硫基丁腈、1-甲基-3-巯基-丙磺酸盐、苯福林、2,3-二氢-2-(1-苄氨基)乙烷基-苯并[b]1,4-二氧芑、2-氨基-5-(2-丙烯酸基)咪唑、乙二醛二甲肼、1,6-脱水-:β.-D-葡萄吡喃糖、3-羟基-6-甲基吡啶、2,2-二氯乙基 丙基碳酸盐、2-(二甲基胺基甲基)-3-羟基吡啶、2-甲胺基甲基-1,3-二氧戊环、2,5-二甲氧基-4-乙基安非他命、2,5-二甲酰基呋喃
3 结 论
绿狐尾藻萃取液抑藻试验和化感物质分离鉴定研究表明,绿狐尾藻分泌物的水相提取物在高体积分数时有明显的抑藻作用;绿狐尾藻干粉浸液比植物体分泌物对蓝藻的抑制效果更加显著;在绿狐尾藻干粉浸液和绿狐尾藻-蓝藻共培养水相中均有检出的甲氧基苯基肟可能为抑制蓝藻生长的化感物质。
本文探索了绿狐尾藻抑制蓝藻的机理,丰富了水生植物化感物质的种类和分离鉴定方法,为绿狐尾藻应用于抑制蓝藻生长和富营养化水体的修复提供了新的理论依据。而绿狐尾藻化感物质对其他藻类的生长影响还有待进一步研究。
[1] 孙文浩, 俞子文, 郭克勤, 等.凤眼莲克藻化合物的生物检测[J].植物生理学报, 1991,27 (6):433-436.
[2] 孙文浩, 余叔文, 杨善元,等.凤眼莲根系分泌物中的克藻化合物[J].植物生理学报, 1993,19(1): 92-96.
[3] Tiziana C, Marina D, Antonio F, et al. Lactone diterpenes from the aquatic plant Potamogeton natans[J]. Phytochemistry, 2001,56(5): 469-473.
[4] Gross E M. Differential response of tellimagrandin Ⅱ and total bioactive hydrolysable tannins in an aquatic angiosperm to changes in light and nitrogen[J]. Oikos, 2003, 103 (3):497-504.
[5] Wang H Q, Cheng S P, Zhang S H, et al. Chemical composition in aqueous extracts of Potamogeton malaianus and Potamogeton maackianus and their allelopathic effects on Microcystis aeruginosa[J]. Polish Journal of Environmental Studies, 2010,19(1):213-218.
[6] Wang H Q, Liang F, Zhang L Y. Composition and anti-cyanobacterial activity of essential oils from six different submerged Macrophytes[J]. Polish Journal of Environmental Studies, 2015,24(1):333-338.
[7] Zhang S H, Sun P S, Ge F J, et al. Different sensitivities of Selenastrum capricornutum and toxic strain Microcystis aeruginosa to exudates from two Potamogeton species[J]. Polish Journal of Environmental Studies, 2011,20(5): 1359-1366.
[8] Liu B Y, Zhou P J, Tian J R, et al. Effect of Pyrogallol on the growth and pigment content of cyanobacteria-blooming toxic and nontoxic Microcystis aeruginosa[J]. Bulletin of Environmental Contamination & Toxicology, 2007, 78(6):499-502.
[9] Wang H P, Liu F, Luo P, et al. Allelopathic Effects of Myriophyllum aquaticum on Two Cyanobacteria of Anabaena flos-aquae and Microcystis aeruginosa[J].Bull Environ Contam Toxicol, 2017, 98(4):556-561.
[10] 国家环境保护局《水和废水分析监测方法》编委会. 水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[11] 张兵之. 伊乐藻对铜绿微囊藻的化感作用研究[D]. 武汉:中国科学院水生生物研究所, 2007.
[12] 葛会林, 刘树深, 朱祥伟,等.微板吸光法测定9种农药对斜生栅藻的抑制毒性[J].生态毒理学报, 2008,3(6):606-612.
[13] Williamson G B, Obee E M, Weidenhamer J D. Inhibition of Schizachyrium scoparium (poaceae) by the allelochemical hydrocinnamic acid[J]. Journal of Chemical Ecology, 1992, 18(11):2095-2105.
[14] 刘晓宇, 傅海燕, 黄国和,等. 美人蕉有机酸组分对铜绿微囊藻的化感作用[J]. 环境工程学报, 2015, 9(12):5769-5774.
[15] 程立泉.己内酰胺生产技术概述[J].化工进展, 2005, 24 (5):114-116.
[16] Premkumar S, Karikal Chozhan C, Alagar M. Studies on thermal, mechanical and morphological behaviour of caprolactam blocked methylenediphenyl diisocyanate toughened bismaleimide modified epoxy matrices[J]. European Polymer Journal, 2008,44(8):2599-2607.
[17] Chipps E S, Jayini R, Ando S, et al. Cytotoxicity analysis of active components in bitter melon (Momordica charantia) seed extracts using human embryonic kidney and colon tumor cells[J]. Natural Product Communications, 2012,7(9):1203-1208.
[18] Zheng J, Zhang F S, Zhou C H, et al. Comparison of flavor compounds in fresh and pickled bamboo shoots by GC-MS and GC-olfactometry[J]. Food Science and Technology Research, 2014, 20 (1):129-138.
[19] Hu G Q, Yao S M, Li S, et al. Synthesis and antibacterial activity of s-triazole salicylidene-amino schiff-bases containing oxadiazole-substituted oxime-ether[J]. Chinese Journal of Organic Chemistry, 2007, 27(5):636-639.