0 引 言
近年来,随着养殖规模扩大,畜禽养殖沼液也随之增加[1-2]。畜禽养殖沼液污染物成分复杂、浓度高[3]、潜在风险不明,极易引起水体富营养化、地表及地下水源污染[4-5]。目前,对沼液的处理技术包括生物处理工艺、自然生态处理等[3-5]。
沼液中含有微藻生长所需的营养成分[6-8],适合微藻大规模增殖[6],同时微藻又可减少沼液中氮、磷含量[7-8],富集和吸附污水中的重金属离子[9-11],对沼液污染物具有去除作用。
微藻作为水生生物,其脂肪含量一般为1%~70%,大部分微藻的脂肪含量都高于10%[12]。在特殊条件下,有的微藻脂肪含量可达到干重的90%[13-14]。微藻中脂肪酸多为C14~C18,通过甲基转移法可将其转化为脂肪酸甲酯或者脂肪酸乙酯混合物,即生物柴油,其含有较高的十六烷值,符合欧盟EU14214标准[15]。微藻对环境适应力强,可在多种污水中生长,适合大规模培养,是理想的能源微藻[12-16]。
本试验以小球藻为藻种,以陕西杨凌示范区猪粪沼气发酵沼液为培养基,将微藻培养、油脂积累、沼液净化结合起来,分析不同浓度沼液对小球藻生长、油脂产率及油脂成分的影响,以及小球藻对沼液中氮、磷和重金属的净化作用,为沼液处理及小球藻规模化培养提供基础。
1 试验部分
1.1 藻 种
所用藻种为小球藻(Chlorella vulgaris),由本实验室分离自西北农林科技大学北校区池塘内。
1.2 沼液培养基及预处理
沼液采集于陕西省杨凌示范区猪沼气发酵池。将沼液自然沉降24 h后用纱布过滤取上清液备用。经测定,沼液中ρ(TN)为1111.47 mg/L、ρ(TP)为35.65 mg/L。使用BG11培养基(中科院淡水藻藻种库)[17]对沼液进行稀释,配制浓度分别为0%(CK)、10%、20%、30%、40%、50%、60%的沼液培养基,调节pH=7.0后,高压蒸汽灭菌备用。
1.3 培养条件
在超净工作台内将小球藻接种至不同浓度的沼液培养基,接种密度为1×106 cell/mL。置于人工气候培养箱中,于(20±1)℃、光照强度100 μmol/(m2·s)、光暗比14 h∶10 h的条件下每天定时充分摇动[17]。
1.4 成分指标测定
1.4.1 小球藻的相对生长密度
取对数生长期的藻液,稀释至不同的倍数,用分光光度计测定藻液的吸光值(OD),并在显微镜下对藻细胞进行计数,制作藻细胞密度与藻液吸光值(OD)之间的标准曲线[18]。每天定时取样,在680 nm吸收波长下测定其吸光值OD680,同时在显微镜下对藻细胞进行计数,计算藻细胞的相对生长密度。
1.4.2 小球藻油脂提取及分析
待小球藻生长至稳定期时,6000 r/min高速离心,收集小球藻沉淀。60 ℃烘干至恒重后研磨成藻粉备用,称重记为m1。取适量提取液加入研磨好的藻粉中,充分振荡24 h后离心,收集上清液。重复该步骤,直至油脂完全提取。将藻泥烘干至恒重,称重记为m2[19]。合并上述步骤中所有上清液,挥发提取液,剩余物质即为油脂。其含量计算如式(1)所示:
油脂含量=(m1-m2)/m1×100%
(1)
使用气相色谱定量[20]法分析油脂组成成分,并按峰面积归一化法[21]计算各油脂脂肪酸组成。
1.4.3 总氮、总磷及其重金属含量测定
TN使用GB 7481—87《水杨酸分光光度法》进行测定[22-23];TP测定采用GB/T 11893—1983《钼酸铵分光光度法》[20];Cu2+、Zn2+、Cd2+的含量使用火焰原子吸收法[17]测定。
1.5 数据分析
所有处理设置3个重复,采用Excel、Origin进行数据处理,并用统计软件SPSS 17对试验结果进行单因素方差分析(ANOVA),用LSD法对组间差异进行比较,以P≤0.05作为差异显著水平标准。
2 结果与讨论
2.1 沼液对小球藻的影响
小球藻在不同沼液浓度培养基中培养21 d(表1),沼液浓度为0、10%时,小球藻的细胞密度不断增加,且在沼液浓度为0中,小球藻细胞密度最大,为113.09×105个/mL。沼液浓度为20%、30%、40%时,培养初期,小球藻生长均有一段适应期,故小球藻的细胞密度先减小再增加。沼液浓度为50%时,小球藻的生长受到抑制,呈负增长。沼液浓度为60%时,小球藻细胞密度先降低后增加,小球藻在适应期内生长缓慢,当达到一定程度时,小球藻适应其环境并加速生长。
表1 不同浓度沼液中小球藻的相对密度
Table 1 The cell density of C. vulgaris in biogas slurry with different concentration ×105个/mL
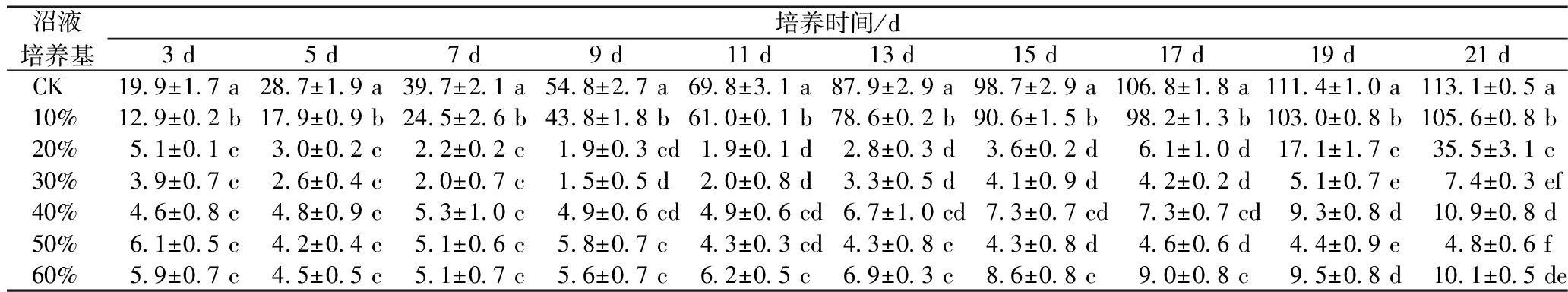
沼液培养基培养时间/d3 d5 d7 d9 d11 d13 d15 d17 d19 d21 dCK19.9±1.7 a28.7±1.9 a39.7±2.1 a54.8±2.7 a69.8±3.1 a87.9±2.9 a98.7±2.9 a106.8±1.8 a111.4±1.0 a113.1±0.5 a10%12.9±0.2 b17.9±0.9 b24.5±2.6 b43.8±1.8 b61.0±0.1 b78.6±0.2 b90.6±1.5 b98.2±1.3 b103.0±0.8 b105.6±0.8 b20%5.1±0.1 c3.0±0.2 c2.2±0.2 c1.9±0.3 cd1.9±0.1 d2.8±0.3 d3.6±0.2 d6.1±1.0 d17.1±1.7 c35.5±3.1 c30%3.9±0.7 c2.6±0.4 c2.0±0.7 c1.5±0.5 d2.0±0.8 d3.3±0.5 d4.1±0.9 d4.2±0.2 d5.1±0.7 e7.4±0.3 ef40%4.6±0.8 c4.8±0.9 c5.3±1.0 c4.9±0.6 cd4.9±0.6 cd6.7±1.0 cd7.3±0.7 cd7.3±0.7 cd9.3±0.8 d10.9±0.8 d50%6.1±0.5 c4.2±0.4 c5.1±0.6 c5.8±0.7 c4.3±0.3 cd4.3±0.8 c4.3±0.8 d4.6±0.6 d4.4±0.9 e4.8±0.6 f60%5.9±0.7 c4.5±0.5 c5.1±0.7 c5.6±0.7 c6.2±0.5 c6.9±0.3 c8.6±0.8 c9.0±0.8 c9.5±0.8 d10.1±0.5 de
注:不同小写字母表示在不同沼液浓度处理间差异显著性(P≤0.05)。
在一定范围内,随着沼液浓度增加,小球藻的细胞密度减小,生长趋向缓慢,不同沼液浓度对小球藻生长有不同程度的抑制作用。随着沼液浓度的提高,水体污染物浓度和N/P增大,营养成分不同[24]逐渐超过了小球藻的承载能力。
2.2 小球藻的油脂含量
小球藻在生长过程中具有积累油脂作用(图1)。沼液浓度为30%时,小球藻油脂产量最高,为110.32 mg/L,油脂产率也最高,达到32.89%;沼液浓度为60%时,油脂产量最低,为19.88 mg/L,油脂产率为17.95%;但在沼液浓度为10%时,产率最低,为17.28%。由图1可看出:开始时随沼液浓度的增加,小球藻油脂产率增加,但当沼液浓度超过30%时,油脂产率反而降低。分析原因认为是沼液浓度过低,沼液中营养成分不适宜小球藻积累油脂,沼液浓度过高,抑制小球藻的生长,从而抑制小球藻积累油脂。
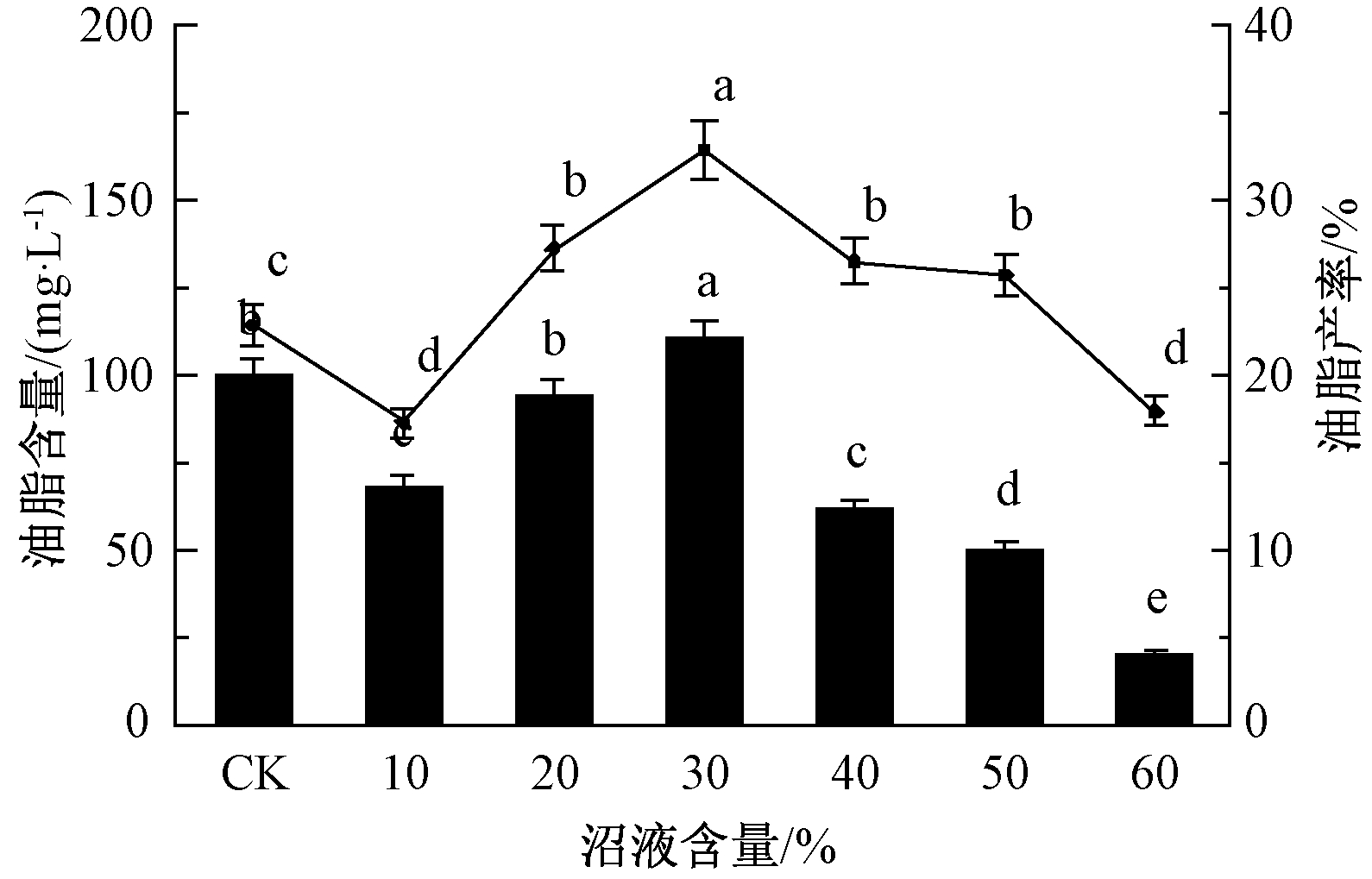
![]() 油脂含量;
油脂含量; ![]() —油脂产率。
—油脂产率。
注:不同小写字母表示各处理间差异显著(P=0.05)。下同。
图1 不同沼液浓度下小球藻油脂含量及油脂产率
Fig.1 Lipid content and productivity of C.vulgaris in biogas slurry of different concentration
不同浓度沼液培养得到的小球藻油脂中检测到的脂肪酸包括:软脂酸(C16∶0)、十六碳二烯酸(C16∶2)、硬脂酸(C18∶0)、花生酸(C20∶0),并且脂肪酸主要集中在C16~C18(C16∶0、C16∶2、C18∶0、C18∶1、C18∶2);不同浓度沼液下C16~C18脂肪酸的相对含量分别达到91.11%、91.09%、78.6%、95.07%、83.51%、81.05%、96.05%(表2),说明小球藻产生的油脂可以作为生物柴油。另外,不同沼液浓度下,各种脂肪酸含量均不同,如C16∶0在沼液浓度30%时相对含量最高,为17.44%;C16∶2在50%时相对含量最高,为34.65%;C18∶0在20%时相对含量最高,为30.77%;C18∶1在30%时相对含量最高,为12.36%;C18∶2在30%时相对含量最高,为2.39%;C20∶0在20%时相对含量最高,为21.42%。因此,可根据这些脂肪酸相对含量最高时对应的沼液浓度,来提取某种特定的脂肪酸。
表2 小球藻油脂中各脂肪酸的相对含量
Table 2 The relative contents of fatty acids in lipid by C. vulgaris %

沼液培养基脂肪酸相对含量C16∶0C16∶2C18∶0C18∶1C18∶2C20∶0CK15.8119.1223.438.902.858.891014.2628.3022.836.632.398.912015.4327.4830.770.450.1521.423017.4413.8321.4512.366.144.934014.6830.4728.53——16.495014.8634.6529.300.34—18.956016.3423.2425.229.50—3.30
注:Cn:m, n表示脂肪酸的碳链数;m表示不饱和度。
本试验中小球藻产油率为17.28%~32.89%,沼液会影响小球藻体内新陈代谢,改变小球藻油脂含量及其组成成分。在一定范围内,沼液浓度越高,小球藻油脂产率越高,但沼液浓度过高后,小球藻生长受到抑制,导致油脂含量降低。在沼液浓度为30%时,小球藻产生的油脂符合生物柴油对碳链长度的要求[25-27],与蒋霞敏等[13]和Sung等[25]的研究结果基本一致。
2.3 小球藻对总氮的去除作用
试验所用的沼液含量为10%~60%沼液培养基中ρ(TN)依次为98.16,215.62,344.44,394.06,503.90,572.28 mg/L,依据GB 18596—2001《畜禽养殖业污染物排放标准》[28],均超出集约化畜禽养殖业水污染最高允许日均排放浓度80.00 mg/L [28]。图2为小球藻在沼液培养基中培养21 d后,小球藻对TN去除率随沼液浓度的增加而降低,随着小球藻生长密度的减小而减小。浓度为10%、20%的沼液经处理后TN含量达到排放标准,其余浓度沼液因初始TN含量过高,仍未达到排放标准,可以进行小球藻的二次处理。小球藻对沼液中氮去除的原因可能是:一方面,由于藻类利用氮作为其生长所需氮源,TN中部分NH3-N被小球藻吸收转化[29];另一方面,小球藻表面的吸附作用也可吸附去除部分氮[30]。
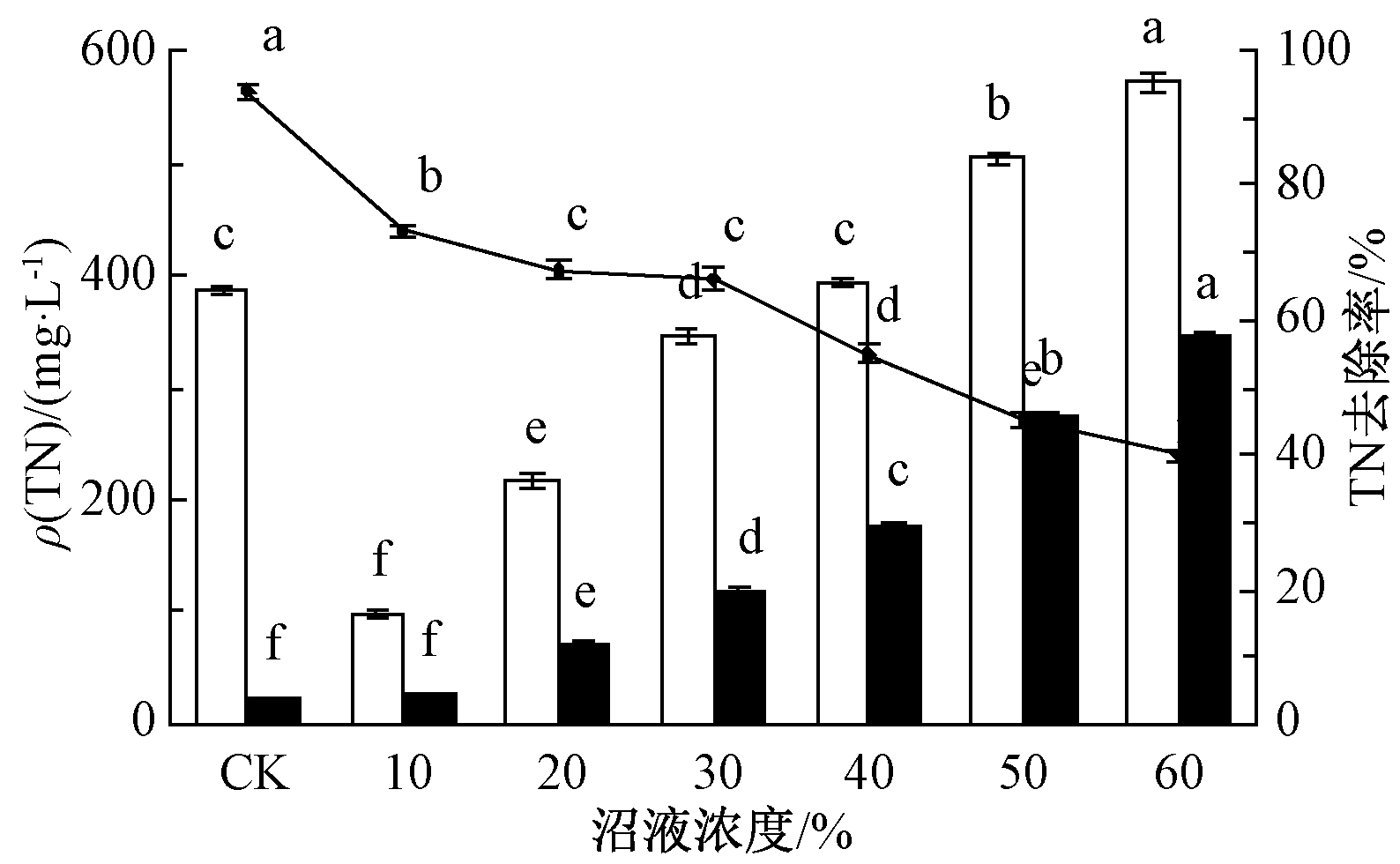
![]() 培养前;
培养前; ![]() 培养后;
培养后; ![]() —氮去除率。
—氮去除率。
图2 不同沼液浓度中小球藻对TN的去除率
Fig.2 The removal efficiency of total nitrogen by C. vulgaris in biogas slurry of different concentration
2.4 小球藻对TP的去除作用
试验使用的沼液含量为10%~60%沼液培养基中ρ(TP)依次为3.54,8.76,9.70,11.05,12.87,14.05 mg/L。一些沼液培养基超出集约化畜禽养殖业水污染最高允许日均排放浓度8.00 mg/L[28]。图3表明:沼液浓度为30%时,TP去除率最高,为93.93%;其次为20%时,TP去除率为93.02%;沼液浓度为10%时,TP去除率最低,仅为86.07%;其余沼液培养基TP去除率均在88.75%以上。利用小球藻去除TP后,各沼液中ρ(TP)依次为0.51,0.61,0.59,0.95,1.25,1.58 mg/L,均达到GB 18596—2001标准。TP去除率随沼液浓度的增大先上升后下降,沼液浓度达到30%(ρ(TP)为9.70 mg/L)后开始下降。随着沼液浓度的增加,小球藻对TN的去除能力减小,但对总磷的去除率均在86.07%以上,然而仍有少量氮、磷未去除,这可能与藻体表面的吸附作用有关,也可能是小球藻受沼液中其他微生物生长代谢的影响[29-31]。
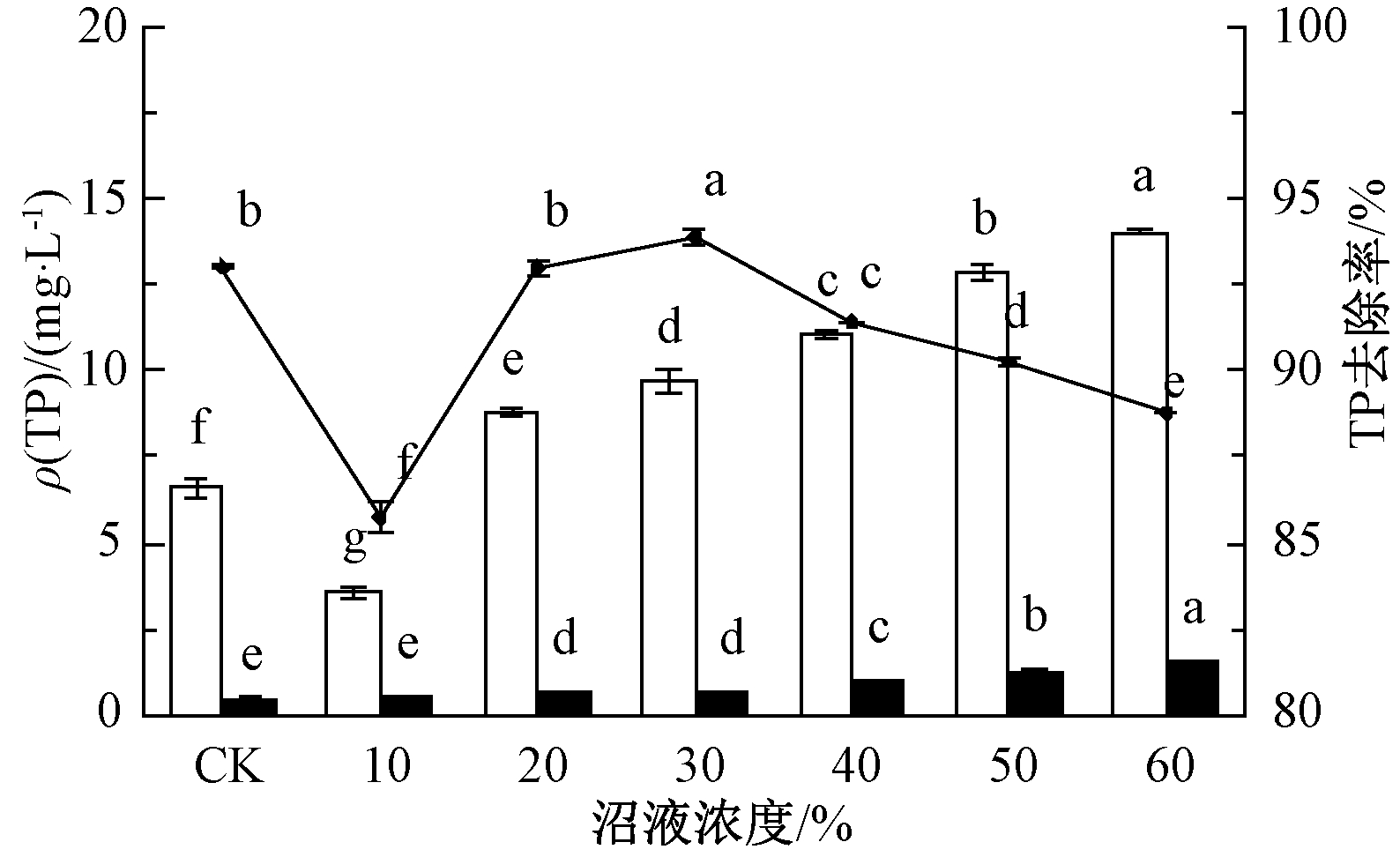
![]() 培养前;
培养前; ![]() 培养后;
培养后; ![]() —TP去除率。
—TP去除率。
图3 不同沼液浓度中小球藻对TP去除率
Fig.3 The removal efficiency of total phosphorus by C. vulgaris in biogas slurry of different concentration
2.5 小球藻对重金属Cu2+、Zn2+、Cd2+的去除作用
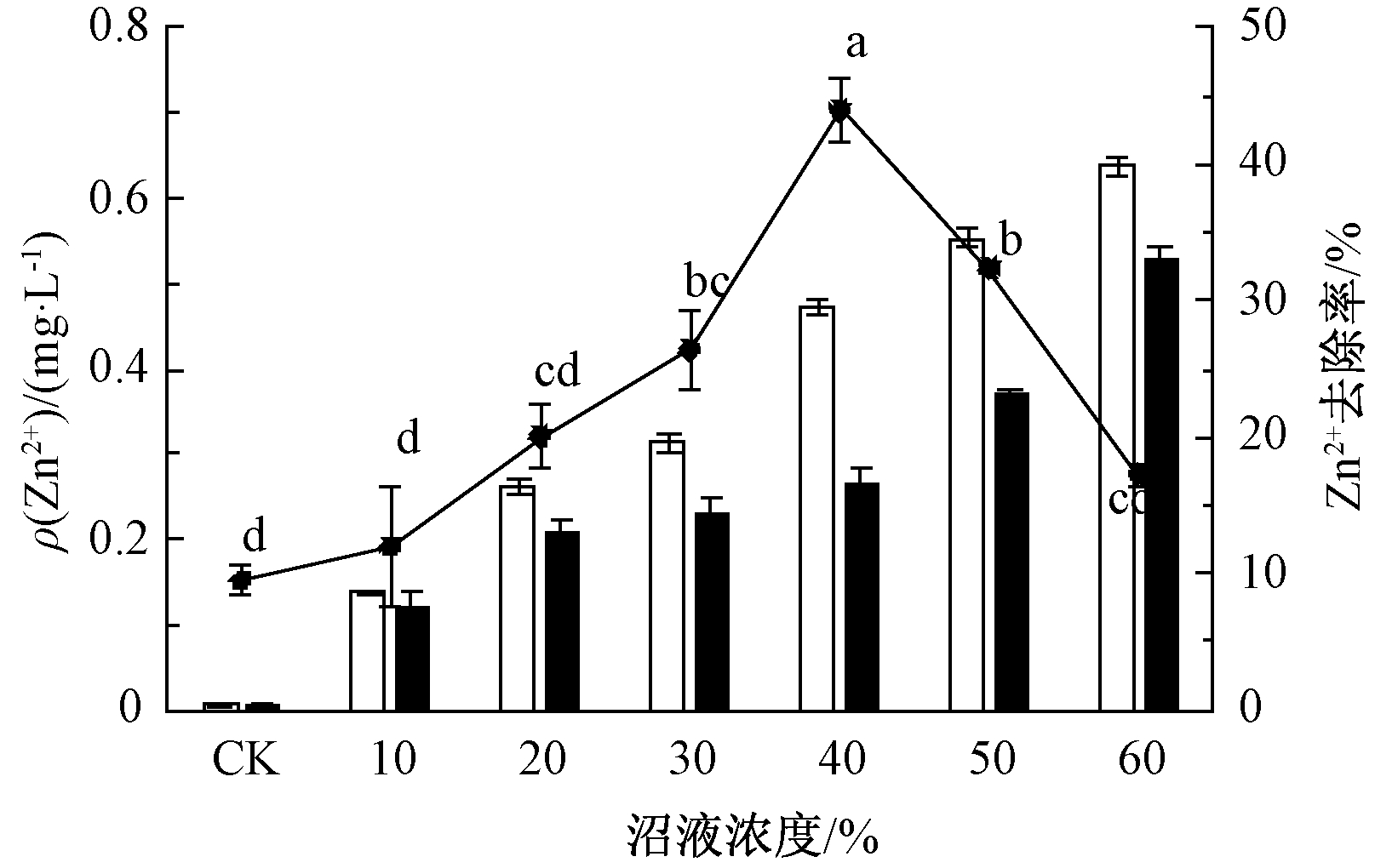
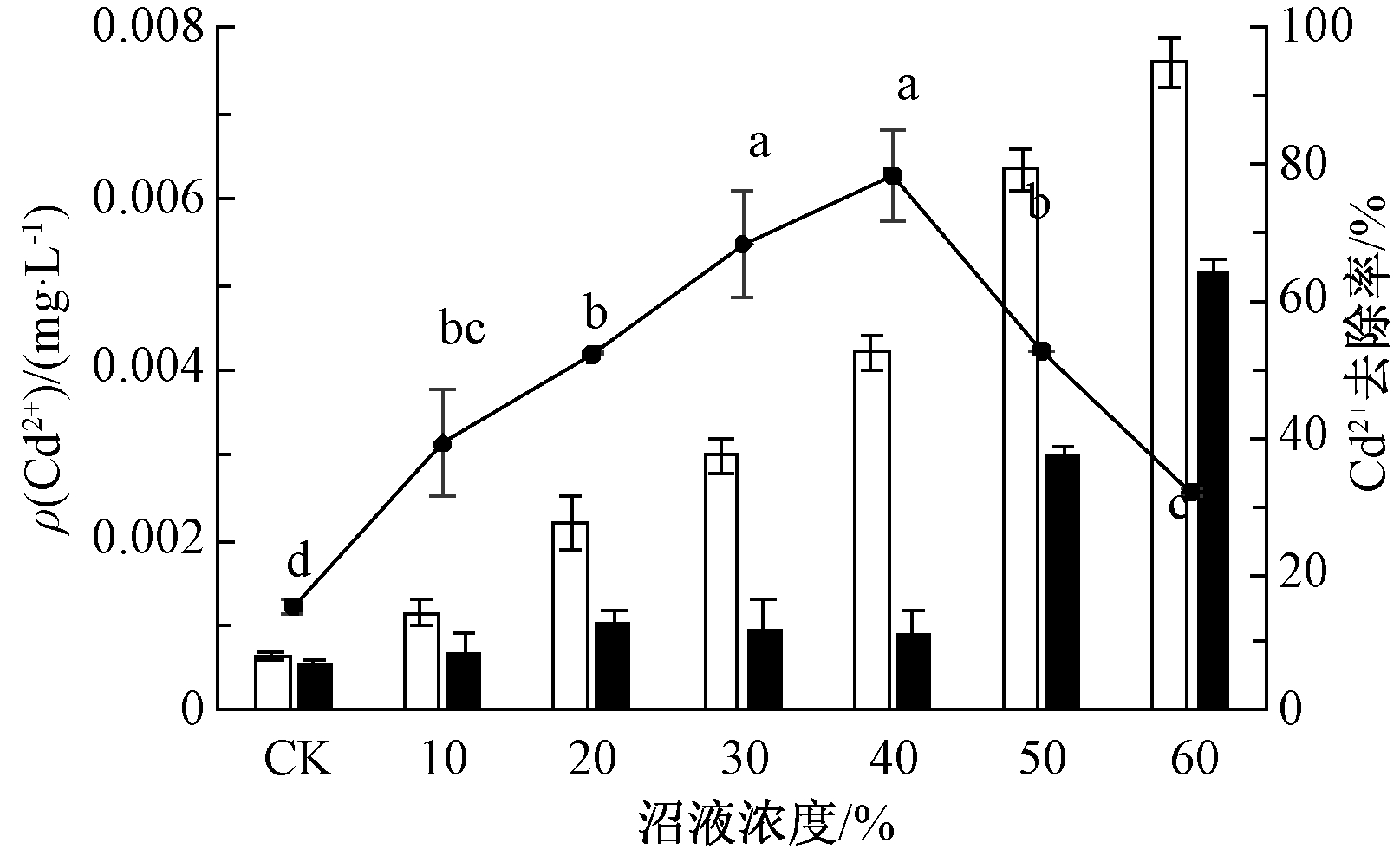
沼液中初始重金属ρ(Cu2+)、ρ(Zn2+)、ρ(Cd2+)分别为0.31,1.07,0.01 mg/L,依据GB 5084—2005《农田灌溉水质标准》[32],利用小球藻去除沼液中重金属,降低沼液中重金属的潜在风险。其试验结果如图4—6所示。

![]() 培养前;
培养前; ![]() 培养后;
培养后; ![]() —Cu2+去除率。
—Cu2+去除率。
图4 不同沼液浓度中小球藻对重金属Cu2+的去除率
Fig.4 The removal efficiency of Cu2+ by C. vulgaris in biogas slurry of different concentration
![]() 培养前;
培养前; ![]() 培养后;
培养后; ![]() —Zn2+去除率。
—Zn2+去除率。
图5 不同沼液浓度中小球藻对重金属Zn2+的去除率
Fig.5 The removal efficiency of Zn2+ by C. vulgaris in biogas slurry of different concentration
![]() 培养前;
培养前; ![]() 培养后;
培养后; ![]() —Cd2+去除率。
—Cd2+去除率。
图6 不同沼液浓度中小球藻对重金属Cd2+的去除率
Fig.6 The removal efficiency of Cd2+ by C. vulgaris in biogas slurry of different concentration
如图4所示:小球藻对Cu2+去除率的趋势随着沼液浓度的增加先升后降,沼液浓度为20%时,Cu2+去除率最高为36.98%;60%时,去除率最低为17.94%。沼液浓度为10%、20%和30%时小球藻对Cu2+去除率差异显著。如图5所示:小球藻对Zn2+去除率随沼液浓度增加先上升后降低,沼液浓度为0时,小球藻对Zn2+去除率最低为12%,而沼液浓度为40%时,其去除率最高为44.01%。如图6所示,小球藻对Cd2+去除率随沼液浓度增加先上升后下降,沼液浓度为40%时,去除率最高为78.57%。
比较上述结果可知:小球藻对重金属离子去除能力排序为Zn2+>Cu2+>Cd2+。吴海锁等[33]表明:联合吸附时, 小球藻对重金属离子去除能力为Cu2+>Cd2+>Zn2+, 与本试验中结果不相符, 可能是由于小球藻的品种不同,或者是在多种金属离子共存时,小球藻的吸附具有一定的选择性,与藻类种类及重金属离子在水溶液中的状态、含量、键能等因素有关[33]。
3 结 论
1)沼液对小球藻的影响主要表现在相对生长和油脂含量,小球藻油脂含量为17.28%~32.89%,其主要脂肪酸为C16和C18脂肪酸。沼液浓度为30%(ρ(TN)为344.44 mg/L、ρ(TP)为9.70 mg/L)时,油脂含量最高为32.89%,油脂积累效果最好。
2)小球藻对沼液的净化作用:TN去除率为39.85%~94.07%,TP去除率为86.07%~93.93%。沼液浓度为20%~40%(ρ(TN)为215.62~394.06 mg/L,ρ(TP)为8.76~11.05 mg/L),小球藻去除氮、磷效果最佳。小球藻对重金属Cu2+、Zn2+、Cd2+最高去除率分别为36.98%、44.01%、78.57%。为了降低沼液对周围环境的潜在危险,可利用小球藻对沼液进行预处理。
3)小球藻的培养可以选用浓度为30%的沼液,该条件下小球藻油脂含量及对沼液的净化效果均最好。
[1] 巫小丹, 张珊珊, 黎紫含, 等. 沼液养殖小球藻最适通气量的研究[J]. 水污染防治,2014,10(13):45-48.
[2] 马艳茹, 丁京涛, 赵立欣, 等. 沼液中氮的回收利用技术研究进展[J]. 环境污染与防治,2018,40(3):339-344.
[3] 盛婧, 孙国峰, 郑建初. 典型粪污处理模式下规模养猪场农牧结合规模配置研究Ⅰ.固液分离-液体厌氧发酵模式[J]. 中国生态农业学报,2015,23(2):199-206.
[4] 谢涛. 农村沼气发酵及其残余物的主要化学成分评价[D]. 重庆: 西南大学,2007.
[5] 刘思辰, 王莉玮, 李希希, 等. 沼液灌溉中的重金属潜在风险评估[J]. 植物营养与肥料学报,2014,20(6):1517-1524.
[6] Sialve B, Bernet N, Bernard O. Anaerobic digestion of microalgae as a necessary step to make microalgal biodiesel sustainable[J]. Biotechnology Advances, 2009, 27(4): 409-416.
[7] Wilkie A C, Mulbry W W. Recovery of dairy manure nutrients by benthic freshwater algae[J]. Bioresource Technology, 2002, 84(1): 81-91.
[8] 李博, 颜城, 王东, 等. 小球藻(Chlorella vulgaris)净化沼液和提纯沼气[J]. 环境工程学报,2013,7(6):2395-2400.
[9] 王增焕, 林钦, 李刘冬, 等. 大型海藻对重金属镉、铜的富集动力学研究[J]. 中国环境科学,2013,33(1):154-160.
[10] 朱婧文, 刁硕, 张阳. 海藻在处理含重金属废水中的应用研究[J]. 北方环境,2013,29(1): 118-119.
[11] 林海, 陈思, 董颖博, 等. 黑藻、狐尾藻对重金属铅、镉、铬、钒污染水体的修复[J]. 中国有色金属学报,2017,27(10):178-186.
[12] 梅帅, 赵凤敏, 曹有福, 等. 三种小球藻生物柴油品质指标评价[J]. 农业工程学报,2013,29(15):229-235.
[13] 蒋霞敏, 郑亦周. 14种微藻总脂含量和脂肪酸组成研究[J]. 水生生物学报,2013,29(15):229-235.
[14] 杨慧敏, 秦焰祯, 杨青峰, 等. 蛋白核小球藻不同生长阶段油脂和脂肪酸组成的分析[J]. 食品工业科技,2017,38(6):185-188.
[15] Mata T M, Martins A A, Caetano N S. Microalgae for biodiesel production and other applications: a review[J]. Renewable and Sustainable Energy Reviews, 2010, 14(1): 217-232.
[16] 黄英明, 王伟良, 李元广, 等. 微藻能源技术开发和产业化的发展思路与策略[J]. 生物工程学报,2010,26(7):907-913.
[17] 尹文珂, 程金凤, 肖婉露, 等. 四尾栅藻对重金属镉胁迫的响应[J]. 农业环境科学学报,2015,34(4):633-638.
[18] Cai Z P, Huang W W, Duan S S. Iron concentration-induced changes in growth and biochemical compositions of marine diatom Phaeodactylum-tricornutum (Bacillariophyceae) [J]. Ecology and Environment, 2008, 17(4): 1327-1333.
[19] 刘宪夫, 孙利芹, 王长海. 小球藻油脂不同提取方法的比较[J]. 食品研究与开发,2014,10(3):18-22.
[20] 高俊风. 植物生理学实验指导[M]. 北京: 高等教育出版社,2006: 231-233.
[21] 陈炜, 梁明明, 白永安, 等. 小球藻不同生长时期总脂含量和脂肪酸组成的变化[J]. 水产科学,2013,32(9):545-548.
[22] 国家环境保护总局《水和废水分析监测方法委员会》. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社,2002:701-705.
[23] 贺莉, 张冀川, 袁丁, 等. 凯氏定氮法测定沼液中有机氮含量的不确定度计算[J]. 中国沼气,2014,32(6):51-52.
[24] 蔡小波, 郁强强, 刘锐, 等. 沼液SBR处理出水养殖螺旋藻[J]. 环境科学,2017,38(7):2910-2916.
[25] Sung G W, Keunje Y, Juyoun L, et al. Comparison of fatty acid analysis methods for assessing biorefinery applicability of wastewater cultivated microalgae[J]. Talanta, 2012, 97(15): 103-110.
[26] Huang G H, Chen F, Wei D, et al. Biodesel production by microalgal biotechnology[J]. Applied Energy, 2010, 87(1): 38-46.
[27] Markou G, Georgakakis D. Cultivation of filamentous cyanobacteria (blue-green algae) in agro-industrial wastes and wastewaters: a review[J]. Applied Energy, 2011, 88(10): 3389-3401.
[28] 国家环境保护总局. 畜禽养殖业污染物排放标准:GB 18596—2001[M]. 北京: 中国环境科学出版社,2003.
[29] 冯道伦, 程远杰. 用螺旋藻吸收去除尿液中氮、磷和有机物[J]. 上海海事大学学报,2008,29(4):76-79.
[30] 张向阳, 邢丽贞, 张彦浩, 等. 固定化小球藻去除污水中氮、磷的试验研究[J]. 中国给水排水,2008,24(41):95-101.
[31] Mezzomo N, Saggiorato A G, Siebert R, et al. Cultivation of microalgae Spirulina platensis (Arthrospira platensis) from biological treatment of swine wastewater[J]. Food Science and Technology (Campinas), 2010, 30(1): 173-178.
[32] 杨涛, 李建国, 陈院华, 等. 畜禽养殖场沼液重金属含量现状及安全性分析[J]. 江西农业学报,2017,29(2):63-66.
[33] 吴海锁, 张洪玲, 张爱茜, 等. 小球藻吸附重金属离子的试验研究[J]. 环境化学,2004,23(2):173-177.