水体中重金属主要来自工业废水,包括有色金属加工冶炼行业[1]、电池制造行业[2]、矿石开采行业等。常见重金属主要有Cd、Pb、Cr6+、Cu、Zn等[3-6]。由于生物体对重金属无分解能力,会在生物体内富集并最终通过食物链进入人体,对健康造成威胁[7-8]。目前常用的去除重金属方法有化学钝化处理法、电化学法、离子交换法及吸附法等,吸附法是较为经济有效的处理方法之一。
生物炭是指生物质在完全或部分缺氧条件下,通过高温裂解而生成的稳定难熔、含碳量丰富、高度芳香化的固体物质[9-12],具有比表面积大、孔隙度高、吸附能力强等特点[13]。梁成凤、王红等[14-15]研究发现生物炭对Pb和Cd都有强的吸附能力,且投加量为10%左右时,其对土壤Pb的吸附率高达93.93%,吸附机制主要为离子交换反应和表面络合反应。我国作为膨润土的主要产地之一,其由于取材便利、价格低廉,广泛应用于污水处理。Andelka等[16]研究了膨润土对Zn2+和Cd2+的吸附效率,结果表明,在pH为4~6.4时Zn2+和Cd2+的去除率接近95%。成捷凤等[17]在研究中发现,膨润土对铀(Ⅵ) 为瞬时吸附,且在pH为7、膨润土颗粒均匀时对铀(Ⅵ) 的吸附性能最佳,达到90%以上。
大量实验表明,各种生物炭和膨润土都对重金属有较高的吸附能力,本研究主要针对不同吸附剂对重金属镉的吸附进行比较,分析其吸附等温线及吸附动力学,并探讨了pH、吸附材料的投加量及镉初始浓度对吸附效果的影响,为其未来工业化应用提供参考。
1.1.1 实验材料
松木生物炭(PN-B)、花生壳生物炭(PT-B)及膨润土(Bent)。以上材料均经研磨过60目筛,分装备用。
1.1.2 实验试剂
Cd(NO3)2·4H2O、CHCl3、H2SO4、HCl、HNO3、HClO4、NH4OH等化学试剂均为分析纯。实验用水均为去离子水。
1.2.1 3种吸附材料对Cd2+的等温吸附实验
准确称量0.1 g PN-B、PT-B及Bent于100 mL三角瓶中,分别加入40 mL 质量浓度为20~100 mg/L的Cd2+溶液,调节溶液pH为6;在25 ℃恒温振荡器中以180 r/min匀速振荡4 h;振荡结束后将样品以8000 r/min高速离心10 min,最后过0.45 μm水相滤膜,滤液中的Cd2+用土壤养分速测仪进行测定。
1.2.2 3种吸附材料对Cd2+的吸附动力学实验
准确称量0.1 g PN-B、PT-B及Bent于100 mL三角瓶中,分别加入40 mL质量浓度为 40 mg/L的Cd2+溶液,调节溶液pH为6;在25 ℃恒温振荡器中以180 r/min匀速振荡0~5 h;振荡结束后将样品以8000 r/min高速离心10 min,最后过0.45 μm水相滤膜,滤液中的Cd2+用土壤养分速测仪进行测定。
1.2.3 影响因素实验
用HNO3和NaOH调节溶液pH为4~8;生物炭投加量为0.05~0.25 g;在25 ℃恒温振荡器中以180 r/min匀速振荡4 h,振荡结束后将样品以8000 r/min高速离心10 min,最后过0.45 μm水相滤膜,滤液中的Cd2+用土壤养分速测仪进行测定。
1.2.4 3种吸附材料的吸附机理研究
吸附材料表面形貌通过电镜扫描表征;采用X射线衍射仪(XRD)测定吸附材料中所含晶体性物质;用傅里叶红外光谱仪测定吸附材料表面官能团(KBr压片法)[18]。
利用土壤养分速测仪测定重金属离子Cd2+的浓度(mg/kg)。吸附材料对Cd2+的吸附量qe及吸附率η的计算公式见式(1)—(2):
Q=(C0-Ce)V/m
(1)
η=(C0-Ce)/C0×100%
(2)
式中:V为Cd2+溶液体积,mL;C0和Ce分别为Cd2+的初始浓度和平衡浓度,mg/L;m为吸附材料的质量,g。
图1为pH=6时3种吸附材料对Cd2+吸附量随溶液中Cd2+浓度的变化。采用Langmuir、Freundlich方程[19]2种模型对实验数据拟合,相关参数见表1。
Langmuir 方程:
qe=qmKLCe/(1+KLCe)
(3)
Freundlich方程:
![]()
(4)
式中:qe为吸附平衡时Cd2+的单位吸附量,mg/g;qm为饱和吸附时Cd2+的最大吸附量,mg/g;KL为Langmuir模型吸附特征常数;Ce为吸附平衡时Cd2+浓度,mg/L;KF为 Freundlich吸附特征常数。
由图1和表1可知:2种生物炭的Freundlich模型拟合的相关系数R2均高于Langmuir模型拟合,即生物炭和膨润土对Cd2+的吸附被Freundlich等温吸附模型拟合更好;Bent被Langmuir模型和Freundlich模型均能拟合。这表明3种吸附材料对Cd2+的吸附均为多层吸附,Cd2+浓度与吸附量呈正相关。Freundlich模型拟合参数1/n<1,因此该吸附是非线性等温吸附,1/n值越小,吸附能力越强[20]。由表1可知:吸附能力PN-B>Bent>PT-B。吸附剂的吸附能力可以用分离因子RL判断[21],见式(5):
RL=1/(1+KLC0)
(5)
初始浓度是RL的主要影响因素;RL>1,不利于吸附;0<RL<1,有利吸附;RL=1,吸附过程为线性吸附;RL=0吸附过程则为不可逆吸附。在本实验研究的C0范围内,3种吸附材料的RL值分别为0.3448~0.7246、0.4329~0.6173、0.2857~0.6667,3种吸附材料对Cd2+均能实现很好地吸附。
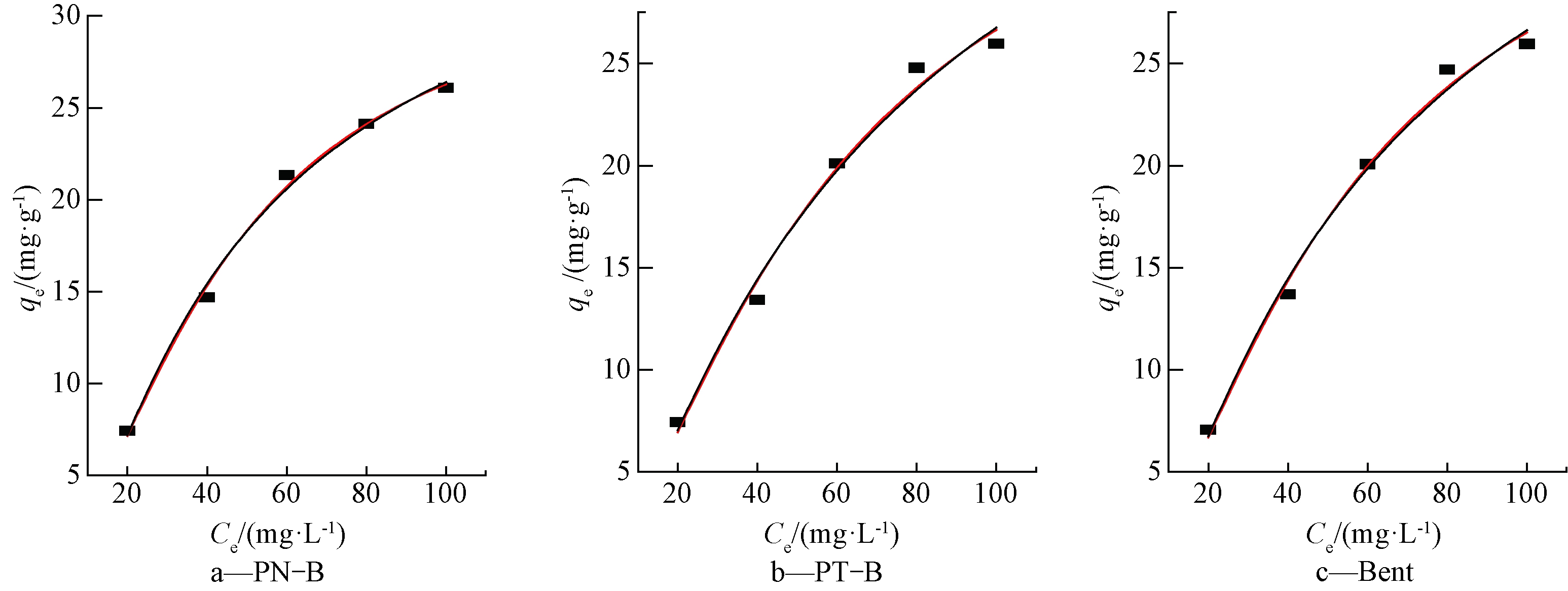
![]() qe; ……Langmuir; ——Freundlich。
qe; ……Langmuir; ——Freundlich。
图1 pH为6时3种吸附材料对Cd2+的吸附等温线
Fig.1 Adsorption isotherms of Cd2+ on three adsorbents with pH=6
表1 吸附材料对Cd2+的吸附等温线参数拟合
Table 1 Fitting parameters of adsorption isotherm for Cd2+

吸附材料Langmuir等温线拟合Freundlich等温线拟合R2KLQm/(mg·g-1)R2KF1/n PN-B0.87310.01920.40.99811.610.67 PT-B0.85650.03112.80.99371.630.7 Bent0.94230.02514.70.99951.580.69
分别采用标准一级动力学和标准二级动力学方程对实验结果进行拟合,见式(6)—(7):
标准一级动力学方程:
qt=qm(1-e-k1t)
(6)
标准二级动力学方程:
qt=qmk2t(1+qmk2t)
(7)
式中:qt为t时刻的吸附量,mg/g;qm为平衡时的吸附量,mg/g;t为吸附时间,min;k1为一级动力学方程常数,h-1;k2为二级动力学方程常数,g/(mg·h)。拟合结果如图2所示,相关参数见表2。
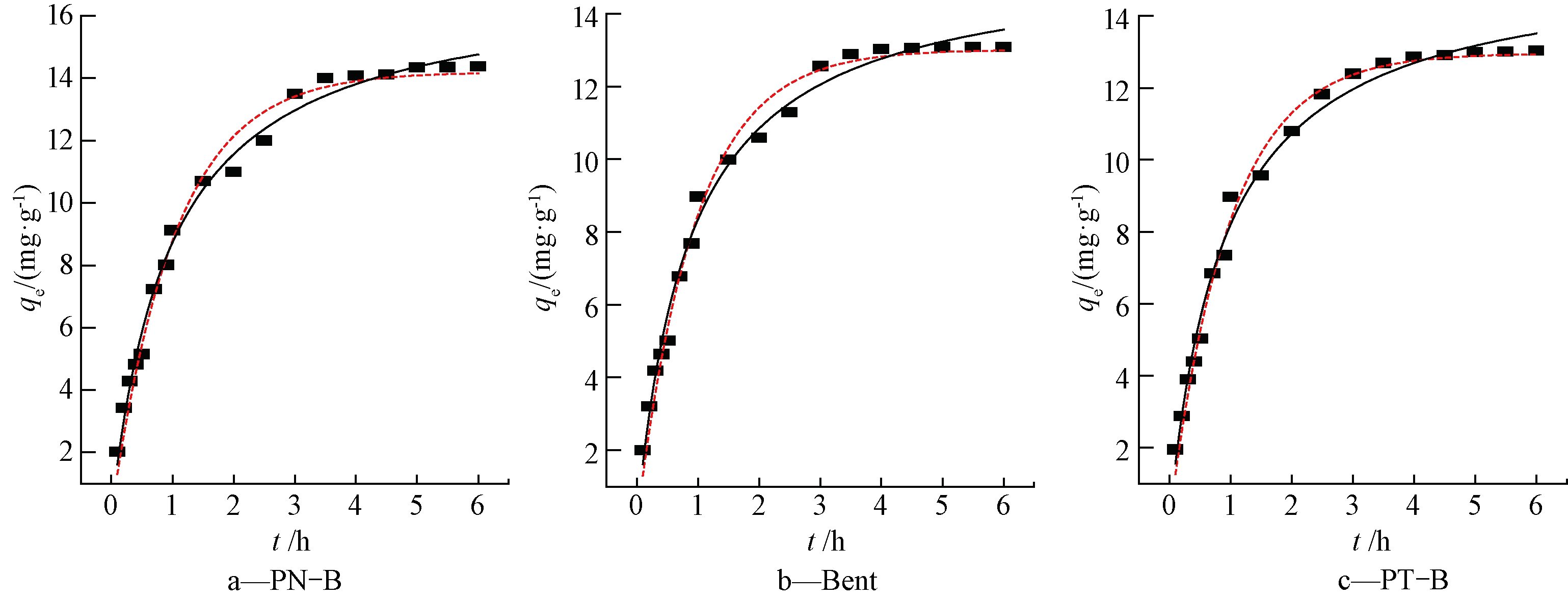
![]() qe; -----一级动力学; ——二级动力学。
qe; -----一级动力学; ——二级动力学。
图2 pH为6时3种吸附材料对Cd2+的吸附动力学
Fig.2 Adsorption kinetics of three adsorbents on Cd2+ with pH=6
由图2和表2可知:0~2 h 时,3种吸附材料吸附均处快反应阶段,吸附量达到70%以上,在3 h时吸附达到平衡。3种吸附材料二级反应动力学模型R2相对较高,均在99%以上,平衡时吸附量与实际吸附量接近,3种吸附材料更适合被二级反应动力学拟合。吸附反应的过程主要为化学吸附,这可能与其表面官能团有关[22]。
图3显示随着pH的升高,3种吸附材料的平衡吸附量均表现为先增加后减小的趋势,其中pH为
表2 3种吸附材料对Cd2+的吸附动力学参数拟合
Table 2 Fitting parameters of adsorption kinetics of three adsorption materials for Cd2+
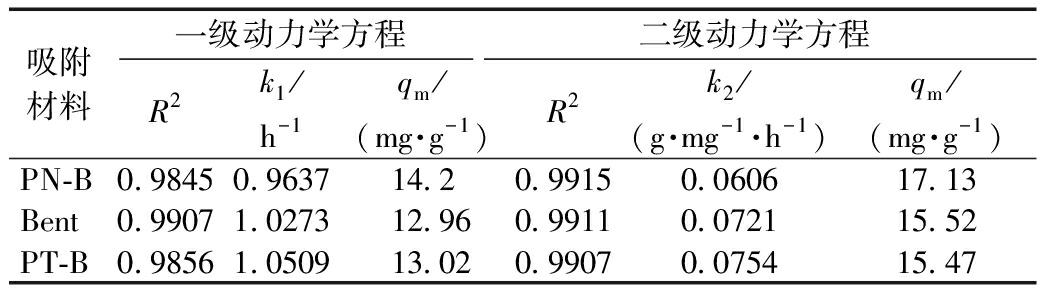
吸附材料一级动力学方程二级动力学方程R2k1/h-1qm/(mg·g-1)R2k2/(g·mg-1·h-1)qm/(mg·g-1)PN-B0.98450.963714.20.99150.060617.13Bent0.99071.027312.960.99110.072115.52PT-B0.98561.050913.020.99070.075415.47
6.0时,PN-B和PT-B对Cd2+的吸附量达到最高值,分别为16.56,15.07 mg/g,且和吸附率也达到最高值,分别为95%和91.06%。Bent在pH为5.0时吸附量和吸附率达到最高值15.52 mg/g和89.4%。当溶液中OH-增加时,OH-与吸附剂表面H+结合,H+和Cd2+与OH-结合竞争减小,使得Cd2+与负电荷结合位点容易结合,吸附量快速增加,达到最大吸附量。而当溶液pH继续升高时,大量OH-与Cd2+发生沉淀反应,该反应为吸附剂去除Cd2+的主要形式,吸附量发生降低[24]。
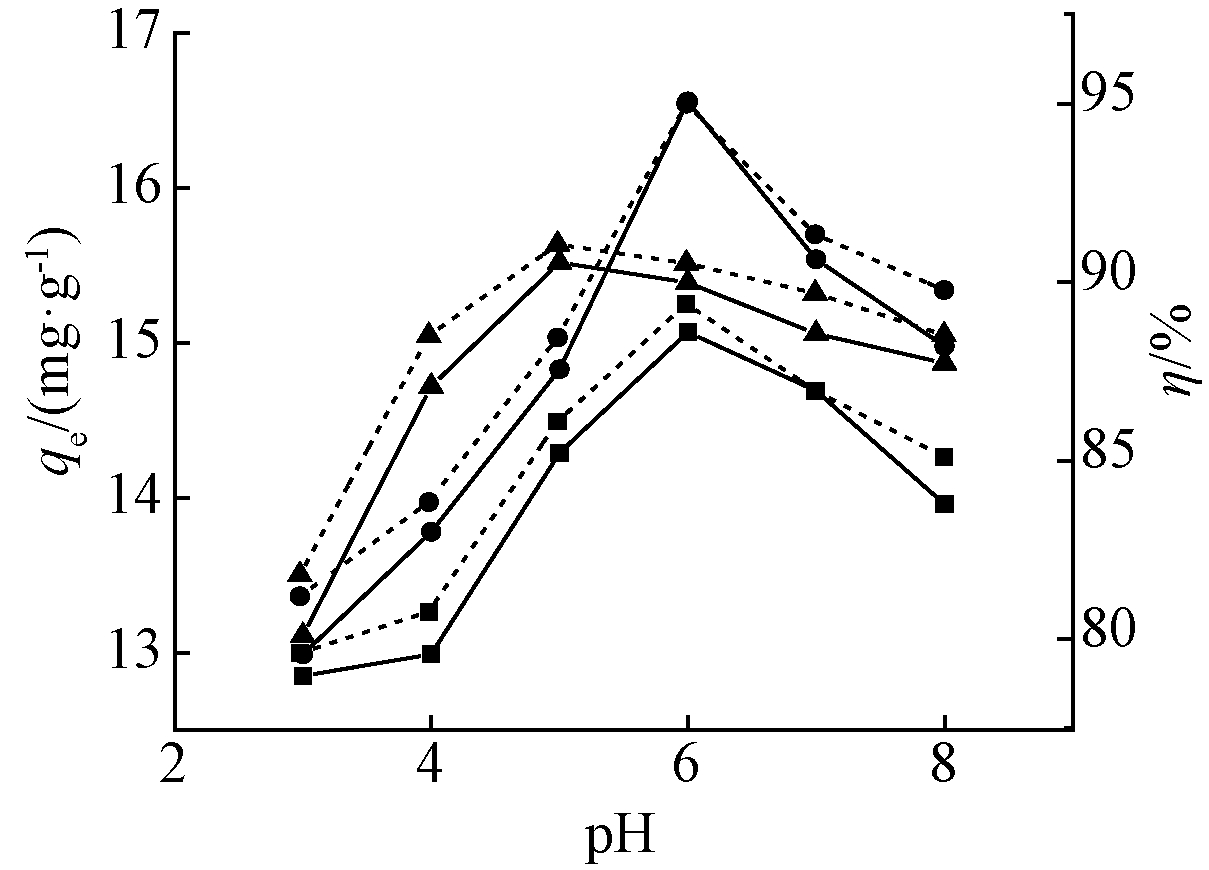
![]() —PT-B(qe);
—PT-B(qe); ![]() —PN-B(qe);
—PN-B(qe); ![]() —Bent(qe);
—Bent(qe);![]() …PT-B(η);
…PT-B(η); ![]() …PN-B(η);
…PN-B(η); ![]() …Bent(η)。
…Bent(η)。
图3 溶液pH对3种吸附材料吸附Cd2+的影响
Fig.3 Effect of solution pH on Cd2+ adsorption by three adsorbents
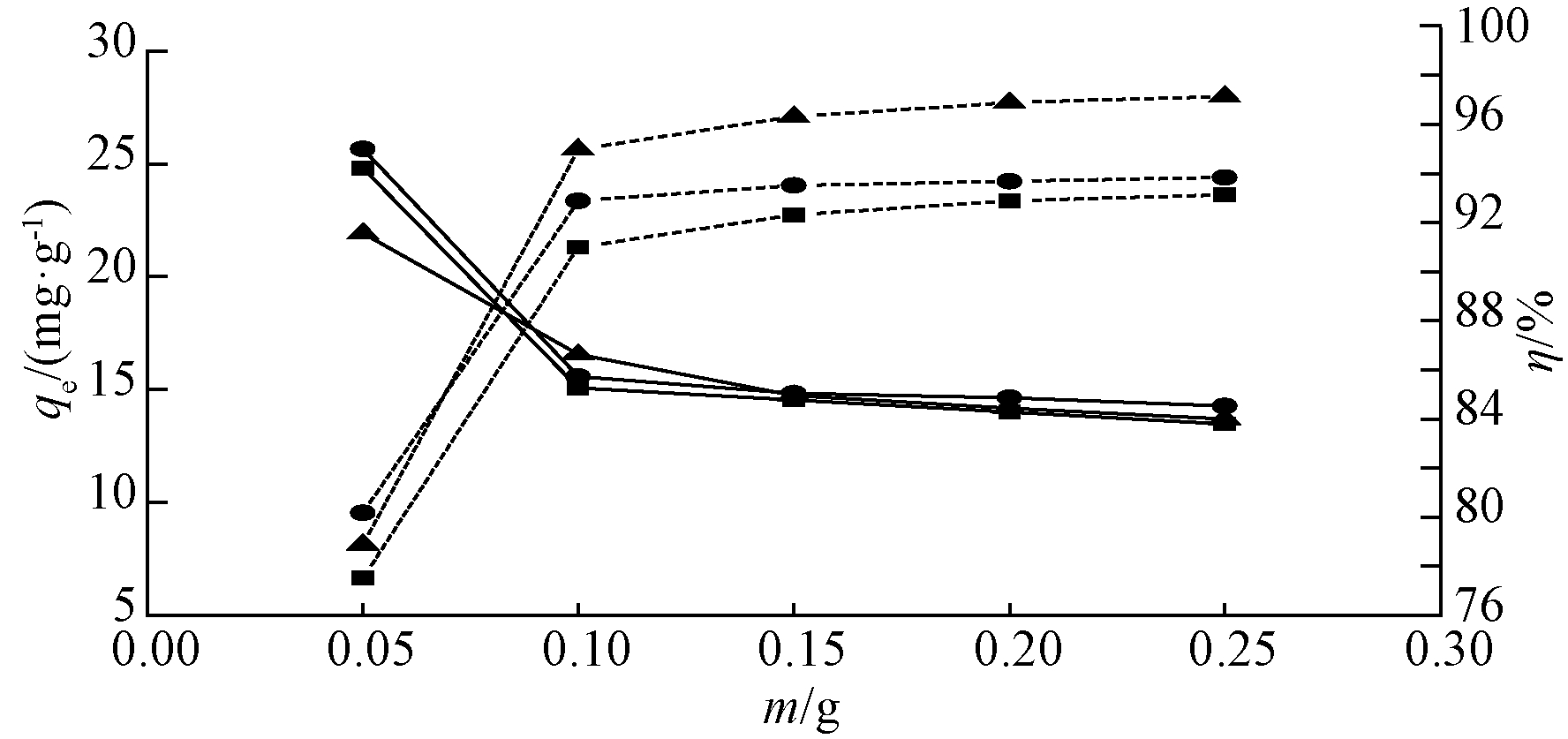
图4为吸附材料投加量的影响。3种吸附材料
变化趋势基本一致,随投加量的增加,吸附效率η呈上升趋势,但单位吸附量逐渐降低。在投加量为0.05 g时,单位吸附量均很高,但是吸附率η太低,当投加量>0.1 g时,吸附率η上升缓慢,而单位吸附量处于相对稳定状态,故选择0.1 g为最佳投加量。因此,在投加量相同的状态,吸附效率PN-B>Bent>PT-B,PN-B最大吸附量为16.56 mg/g,最大吸附率为95%。
![]() —Bent(qe);
—Bent(qe);![]() —PN-B(qe);
—PN-B(qe); ![]() —PT-B(qe);
—PT-B(qe); ![]() …Bent(η);
…Bent(η); ![]() …PN-B(η);
…PN-B(η); ![]() …PT-B(η)。
…PT-B(η)。
图4 吸附材料投加量对Cd2+吸附的影响
Fig.4 Effect of adsorbent dosage on Cd2+ adsorption
2.5.1 表面形态分析
PN-B、PT-B及Bent电镜扫描图如图5所示。PN-B表面凹凸不平,存在较多的孔道结构,且孔道上有少许微孔,比表面积相对较大(图5a);PT-B孔道规则,孔道表面不规则,少见微孔结构,比表面积相对较小(图5b);而Bent电镜扫描只能看出碎屑状,表面有多孔和疏松结构,由于范德华力和氢键作用使得一些分子聚集在表面,导致表面粗糙(图5c)。3种不同吸附材料表面结构的差异也是其吸附能力不同的重要原因。

图5 不同吸附材料样品电镜扫描
Fig.5 Scanning electron microscopy of different adsorbents samples
2.5.2 红外光谱(FTIR)分析
图6为3种吸附材料吸附Cd2+前后的红外光谱图。由图谱和表3可见,PN-B吸附Cd2+前后3421.58 cm-1、2931.79 cm-1和1595 cm-1均产生了位移,由于Cd2+与—OH和CH2中的H+发生了离子交换反应,且C![]() O或COOH与Cd2+发生络合反应;PT-B吸附Cd2+前后3340.7 cm-1、2900.93 cm-1及1078.20 cm-1处产生位移,由于Cd2+与CH2和C—OH发生离子交换反应;而Bent吸附Cd2+前后主要是3431.35 cm-1和1651.01 cm-1产生位移,这是诱导效应所致,即OH或COOH与Cd2+发生离子交换反应。且其透过率有明显差异,红外光谱透过率越低,杂质含量越高,图中Bent吸附后的透过率均低于吸附前透过率,说明有新的杂质生成,而PN-B与PT-B吸附前后透过率时高时低,说明吸附机理更为复杂,可能是因为离子交换和络合反应共同存在。
O或COOH与Cd2+发生络合反应;PT-B吸附Cd2+前后3340.7 cm-1、2900.93 cm-1及1078.20 cm-1处产生位移,由于Cd2+与CH2和C—OH发生离子交换反应;而Bent吸附Cd2+前后主要是3431.35 cm-1和1651.01 cm-1产生位移,这是诱导效应所致,即OH或COOH与Cd2+发生离子交换反应。且其透过率有明显差异,红外光谱透过率越低,杂质含量越高,图中Bent吸附后的透过率均低于吸附前透过率,说明有新的杂质生成,而PN-B与PT-B吸附前后透过率时高时低,说明吸附机理更为复杂,可能是因为离子交换和络合反应共同存在。
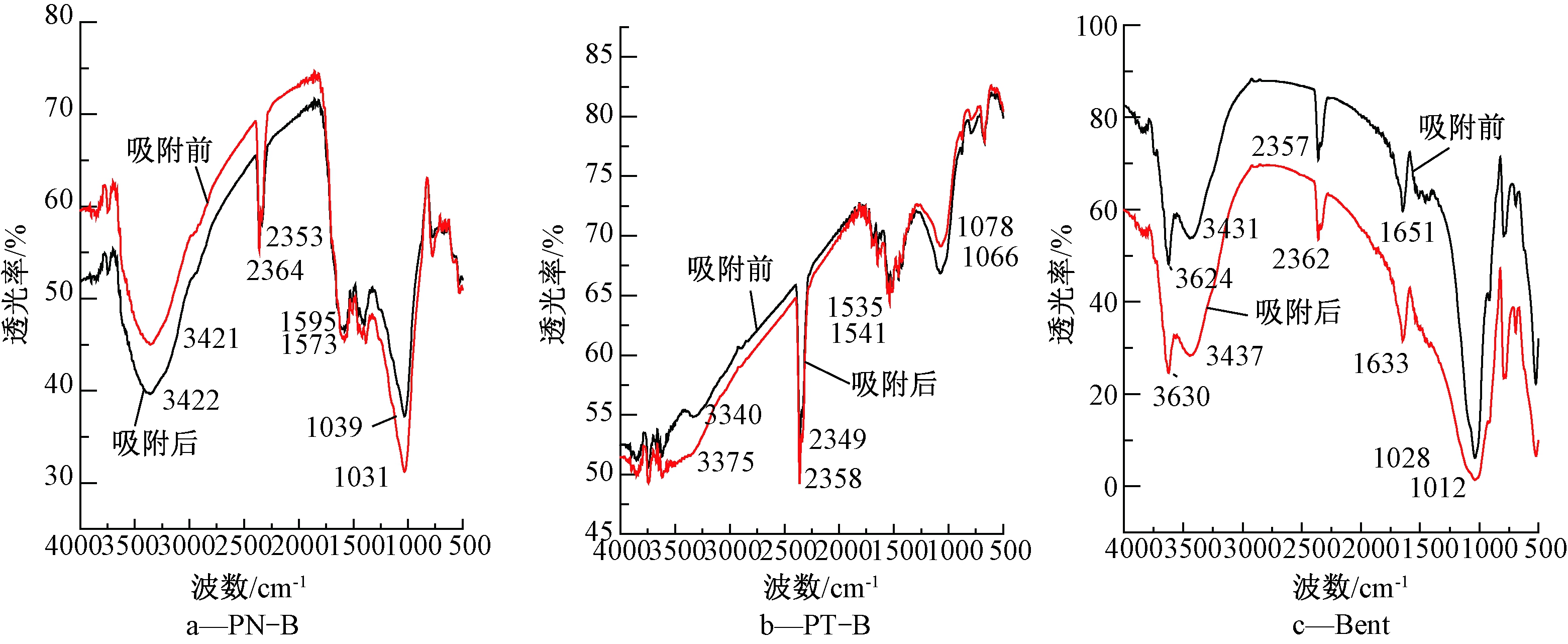
图6 三种吸附材料吸附Cd2+前后红外光谱图
Fig.6 IR spectra of three adsorbents before and after Cd2+ adsorption
表3 3种吸附材料主要出峰位置及官能团
Table 3 Main peak positions and functional groups of three kinds of adsorbent materials
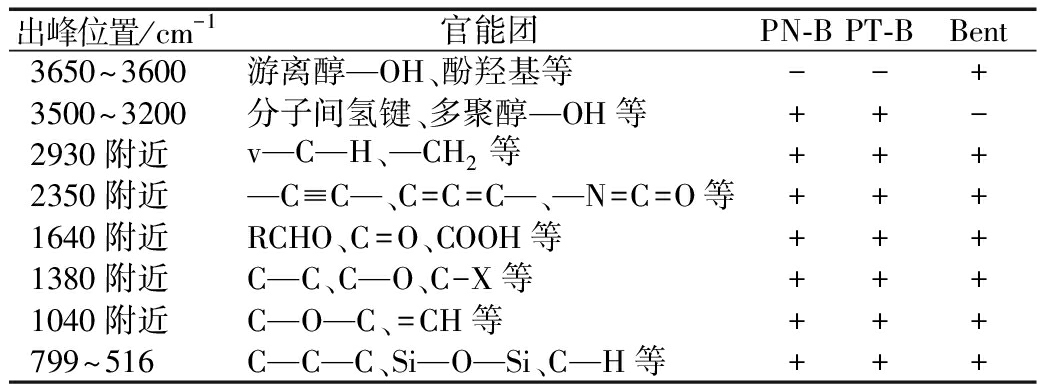
出峰位置/cm-1官能团PN-BPT-BBent3650~3600游离醇—OH、酚羟基等--+3500~3200分子间氢键、多聚醇—OH等++-2930附近v—C—H、—CH2等+++2350附近—C≡C—、C=C=C—、—N=C=O等+++1640附近RCHO、C=O、COOH等+++1380附近C—C、C—O、C-X等+++1040附近C—O—C、=CH等+++799~516C—C—C、Si—O—Si、C—H等+++
注:+存在,-不存在。
2.5.3 X射线衍射(XRD)分析
图7分别为3种吸附材料吸附Cd2+前后的XRD图。可知:3种物质在2θ=25°~30°的强峰表明有较多SiO2的存在。3种吸附材料在吸附前均有6~7个较尖锐的峰,在2θ=50°出现镉的盐类衍射峰,这可能是Cd2+和其他离子发生离子交换反应[25-26];3种吸附材料吸附Cd2+后XRD图谱未发生明显差异,说明无新沉淀生成,故表面沉淀作用不是主要吸附机制,而离子交换反应可能是其主要吸附机制。
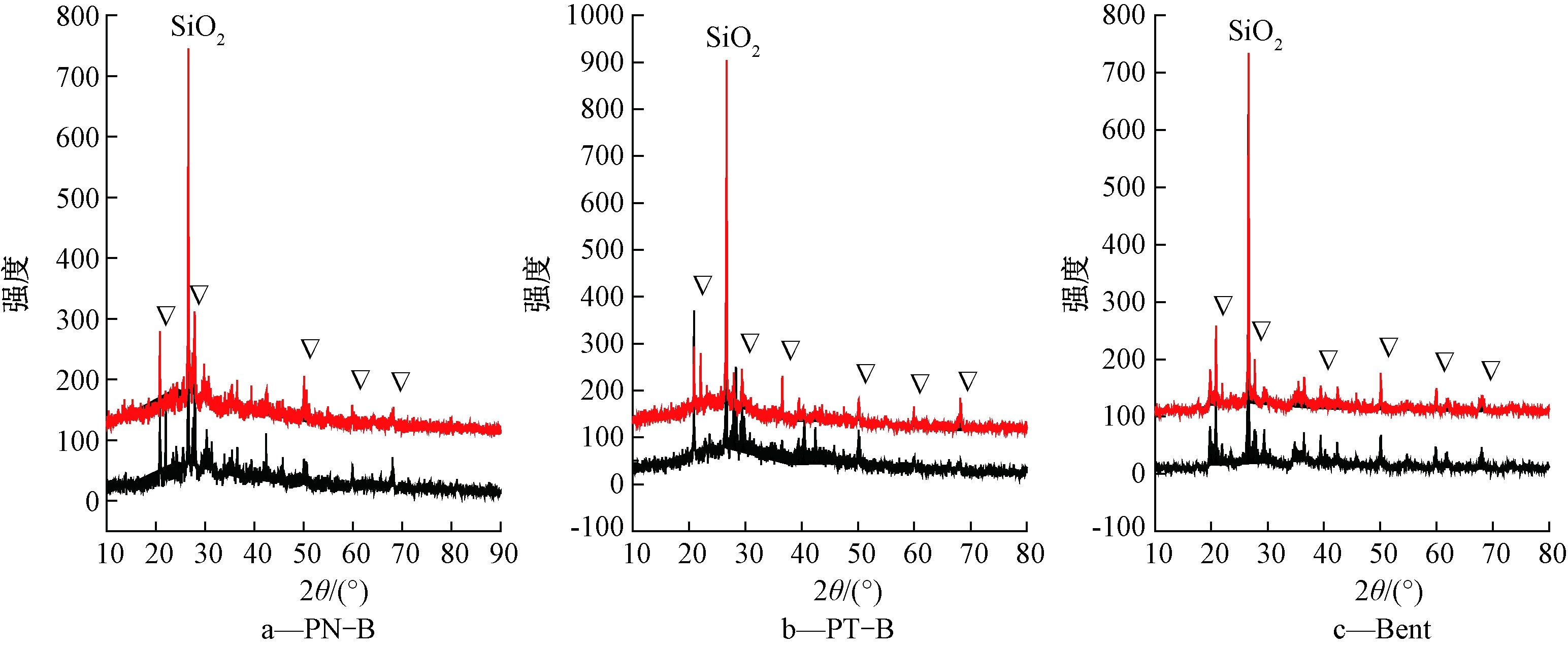
图7 三种吸附材料吸附Cd2+前后X-射线衍射图
Fig.7 X-ray diffraction patterns of three adsorbents before and after Cd2+ adsorption
本研究以松木生物炭,花生壳生物炭及膨润土为吸附剂,研究比较其对重金属镉的吸附性能,发现3种吸附材料对Cd2+的吸附都被Freundlich等温吸附模型和标准二级反应动力学拟合。三者对Cd2+的吸附机理主要为表面—OH、—C![]() O及—CH2与Cd2+发生离子交换反应和络合反应作用。王风[25]的研究结果中,稻壳生物炭对重金属镉的吸附可被Freundlich等温吸附模型和标准二级反应动力学较好拟合,其活性基团及含氧官能团与重金属发生离子交换反应、络合反应等降低镉的活性,与本实验结果中生物炭的吸附一致。Mohammed-Azizi[27]和Anirudhan[28]等在膨润土吸附重金属的研究中,实验结果均与本实验相似,即吸附等温线被Freundlich模型和 Langmuir 模型拟合,吸附动力学被二级反应动力学方程拟合,其吸附机理主要表现为表面官能团与重金属离子的离子交换反应和络合反应;但张洁等[29]研究了膨润土对溶液中铅的吸附,发现60 min时反应达到平衡,且吸附动力学方程符合一级动力学方程。该实验结果与本研究中的膨润土吸附研究结论有所差异,这可能是由于实验选材及研究条件不同所致。本研究从三种不同的吸附材料中选择出最经济高效的吸附剂PN-B,其最大吸附量为16.56 mg/g,最大吸附率为95%,并探讨了其吸附机理主要为表面络合反应和离子交换反应及表面吸附共同作用,为吸附剂的选择提供了理论基础。
O及—CH2与Cd2+发生离子交换反应和络合反应作用。王风[25]的研究结果中,稻壳生物炭对重金属镉的吸附可被Freundlich等温吸附模型和标准二级反应动力学较好拟合,其活性基团及含氧官能团与重金属发生离子交换反应、络合反应等降低镉的活性,与本实验结果中生物炭的吸附一致。Mohammed-Azizi[27]和Anirudhan[28]等在膨润土吸附重金属的研究中,实验结果均与本实验相似,即吸附等温线被Freundlich模型和 Langmuir 模型拟合,吸附动力学被二级反应动力学方程拟合,其吸附机理主要表现为表面官能团与重金属离子的离子交换反应和络合反应;但张洁等[29]研究了膨润土对溶液中铅的吸附,发现60 min时反应达到平衡,且吸附动力学方程符合一级动力学方程。该实验结果与本研究中的膨润土吸附研究结论有所差异,这可能是由于实验选材及研究条件不同所致。本研究从三种不同的吸附材料中选择出最经济高效的吸附剂PN-B,其最大吸附量为16.56 mg/g,最大吸附率为95%,并探讨了其吸附机理主要为表面络合反应和离子交换反应及表面吸附共同作用,为吸附剂的选择提供了理论基础。
1)3种吸附材料中,松木生物炭对重金属镉吸附效果最优,吸附等温线被Freundlich等温吸附模型拟合,吸附动力学被标准二级动力学方程拟合。
2)松木生物炭吸附机理主要为表面的—OH及CH2与Cd2+发生离子交换反应,以及—C![]() O、—COOH等和Cd2+发生络合反应作用。
O、—COOH等和Cd2+发生络合反应作用。
3)花生壳生物炭吸附机理与松木生物炭基本一致,但吸附性能较差,这与其表面官能团有关;膨润土也具有较高吸附能力,但吸附机制主要为表面官能团与Cd2+发生离子交换反应。生物炭不仅具有很强的吸附能力,还有固碳减排等环保作用,在环境治理、土壤修复等方面具有较高的应用价值。
[1] Akpomie K G,Dawodu F A. Potential of a low-cost bentonite for heavy metal abstraction from binary component system [J]. Beni-Suef University Journal of Basic and Applied Sciences,2015,4(1):1-13.
[2] Sis H, Uysal T. Removal of heavy metal ions from aqueous medium using Kuluncak (Malatya) vermiculites and effect of percipitation on removal [J]. Applied Clay Science,2014,95(3):1-8.
[3] Alir M,Hamad H A,Hussein M M,et al.Potential of using green adsorbent of heavy metal removal from aqueous solutions:Adsorption kinetics,istherm,thermodynamic, mechanism and economic analysis[J]. Ecological Engineering, 2016, 91(3): 317-332.
[4] Andrejkovi Ov S, Sudagar A, Rocha J, et al. The effect of natural zeolite on microstructure, mechanical and heavy metals adsorption properties of metakaolin based geopolymers [J].Applied Clay Science, 2016, 126(1): 141-152.
Ov S, Sudagar A, Rocha J, et al. The effect of natural zeolite on microstructure, mechanical and heavy metals adsorption properties of metakaolin based geopolymers [J].Applied Clay Science, 2016, 126(1): 141-152.
[5] Fan H L, Li L, Zhou S F, et al. Continuous preparation of Fe3O4 nanoparticles combined with surface modification by L-cysteine and their application in heavy metal adsorption [J]. Ceramics International, 2016, 42(3): 4228-4237.
[6] Ghiloufi I, Ghoul J E, Modwi A, et al. Ga-doped ZnO for adsorption of heavy metals from aqueous solution [J]. Materials Science in Semiconductor Processing, 2016, 42, Part 1:102-106.
[7] Sun B, Li X, Zhao R, et al. Hierarchical aminated PAN/γ-AlOOH electrospun composite nanofibers and their heavy metal ion adsorption performance [J]. Journal of the Taiwan Institute of Chemical Engineers, 2016, 62(2): 219-227.
[8] Xiang B, Fan W, Yi X W, et al. Dithiocarbamate-modified starch derivatives with high heavy metal adsorption performance [J]. Carbohydrate Polymers, 2016, 136(8): 30-37.
[9] Guyo U, Makawa T, Moyo M, et al. Application of response surface methodology for Cd(Ⅱ) adsorption on maize tassel-magnetite nanohybrid adsorbent [J]. Journal of Environmental Chemical Engineering, 2015, 3(4, PartA): 2472-2483.
[10] Ma L Y, Zhu J X, Xi Y F, et al. Adsorption of phenol, phosphate and Cd(Ⅱ) by inorganic-organic montmorillonites: A comparative study of single and multiple solute [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016, 497(2): 63-71.
[11] Lehmann J, Joseph S. Biochar for environmental management: science and technology [M]. London: Earth scan, 2009:1-29,107-157.
[12] Gaunt J L, Lehmann J. Energy balance and emissions associated with biochar sequestration and pyrolysis bioenergy production [J]. Environ Sci Technol, 2008,42(11): 4152-4158.
[13] 何绪生, 张树清, 佘雕,等. 生物炭对土壤肥料的作用及未来研究[J].中国农学通报, 2011,27(15):16-25.
[14] 梁成凤. 生物炭对底泥吸附固定重金属的影响[D]. 杭州:浙江大学, 2017.
[15] 王红, 夏雯, 卢平,等. 生物炭对土壤中重金属铅和锌的吸附特性[J]. 环境科学, 2017, 38(9):3944-3952.
[16] Andelka B,et al. Simultaneous removal of Pb2+,Cu2+,Zn2+ and Cd2+ from highly acidic solutions using mechanochemically synthe-sized montmorillonite-kaolinite/TiO2 composite[J].Applied Clay Science,2015,103(10): 20-27.
[17] 成捷凤,蔡永涛,常凯凯,等.膨润土对重金属铀(Ⅵ) 的吸附研究[J]. 广州化工.2016,44(21):94-96.
[18] Ding W C, Dong X, Ime I M, et al. Pyrolytic temperatures impact lead sorption mechanisms by bagasse biochars [J]. Chemosphere, 2014,105(4):68-74.
[19] 郑刘春. 玉米秸秆及其纤维素的改性和吸附水体镉离子的机理研究[D]. 广州:华南理工大学, 2011.
[20] Dong X, Ma L Q, Li Y. Characteristics and mechanisms of hexavalent chromium removal by biochar from sugar beet tailing[J]. Journal of Hazardous Materials, 2011, 190(1/2/3):909-915.
[21] Zhao Y F, Zhang B, Zhang X, et al. Preparation of highly ordered cubic naa zeolite from halloysite mineral for adsorption of ammonium ions [J]. Journal of Hazardous Materials, 2010,178(1/3):658-664.
[22] 王慧.氧化石墨烯及其功能化改性材料富集水中重金属离子机理研究[D].长沙:湖南大学,2016.
[23] Kadirvelu K, Kavipriya M, Karthika C, et al. Mercury(Ⅱ) adsorption by activated carbon made from sago waste[J]. Carbon, 2004, 42(4):745-752.
[24] Chen X C, Chen G C, Chen L G, et al. Adsorption of copper and zinc by biochars produced from pyrolysis of hardwood and corn straw in aqueous solution[J]. Bioresource Technology,2011,102(19):8877-8884.
[25] 王风.稻壳生物炭对重金属镉的吸附特性及对镉污染土壤的修复效应[D].沈阳:沈阳农业大学,2017.
[26] 王菁姣.生物炭对重金属的吸附作用及腐殖酸的影响[D].北京:中国地质大学,2015.
[27] Mohammed-Azizi F, Dib S, Boufatit M. Removal of heavy metals from aqueous solutions by Algerian bentonite[J]. Desalination and Water Treatment, 2013,51(22/23/24): 4447-4458.
[28] Anirudhan T S, Suchithra P S. Heavy metals uptake from aqueous solutions and industrial wastewaters by humic acid-immobilized polymer/bentonite composite: kinetics and equilibrium modeling[J]. Chemical Engineering Journal, 2010,156(1): 146-156.
[29] 张洁,王强,张洁婷,等. 膨润土对Pb2+的吸附及铝的影响实验[J]. 当代化工, 2014,43(12):2486-2489.