0 引 言
近年来,富氢水作为一种新型的抗氧化剂引起了中外学者的广泛关注。氢气独特的抗氧化作用主要表现在2个方面:一是具有良好的扩散性,可以穿过细胞膜到达线粒体甚至细胞核;二是可以选择性去除具有细胞毒性的活性氧(ROS),而不会影响在正常生理代谢中起重要作用的ROS [1]。在医学领域中,富氢水在2型糖尿病[2]、大鼠缺血再灌注损伤[3]、大鼠脑损伤[4]等疾病模型中均被证明有良好的治疗效果。另外,研究人员还对其进行了广泛的临床应用研究,发现富氢水在抑制肿瘤细胞增殖、改善与代谢相关的疾病(代谢综合征、肥胖等)和神经系统疾病(认知功能障碍、脊髓损伤等)中发挥了重要作用[5-6]。在植物学领域中,富氢水可以提高植物对重金属胁迫[7-8]、干旱胁迫、盐胁迫[9-10]等的抗性,而且作为一种信号分子还可以提高种子萌发、调控植物的生长发育[11]和延缓水果蔬菜的衰老[12]。虽然富氢水在医学和植物学领域的研究日渐成熟,但在环境领域还未有广泛关注和重大突破,现有的报道重点在于富氢水的短期效应,而很少人关注长期使用富氢水所产生的效应。
氢气在水中的低溶解度和短暂的停留时间成为富氢水应用的主要限制因素,而纳米气泡因具有粒径小、相对比表面积高、带有表面电荷等特点,增加了气体的溶解度和稳定性[13-15]。另外,有研究表明纳米气泡可以强化氢分子本身的还原能力,通过电子自旋共振(ESR)[16]和荧光检测[17]均证明了在相同溶解氢(DH)浓度时,氢气纳米气泡水比不含纳米气泡的氢气水具有更强的抗氧化活性,对羟基自由基(·OH)的去除能力更强。氢气纳米气泡水因具有独特的纳米特性和抗氧化特性,使其在更多领域的应用令人期待。
重金属铜(Cu)是1种生物体必需的微量元素,然而过量的铜必然会产生毒害作用[18-19]。随着工业的发展,水环境遭受了严重的重金属污染,对水生生物造成的威胁成为人们关注的焦点。大型溞具有生活周期短、对各种环境胁迫敏感、拥有庞大的基因组及孤雌繁殖等优点,是理想的毒性试验模型生物[20]。铜对大型溞产生毒性的1个重要因素是在生物体中的积累,它可能导致严重的生长抑制、代谢紊乱和死亡[21]。大型溞在水生态食物链中作为初级消费者起着连接浮游植物和食肉动物的作用,铜在食物链中的生物富集效应最终会对人类健康构成严重威胁,因此利用外源物质减轻铜对生物体的胁迫,减少铜在体内的残留是十分必要的。
本研究以大型溞为研究对象,以Cu为实验毒物,以死亡率和铜的生物积累量为指标,探讨了在铜污染胁迫下氢气纳米气泡水对大型溞毒性的缓解效应;以21 d内大型溞的体长和产溞量为指标,探讨了氢气纳米气泡水对大型溞生长繁殖的影响。该研究提供了氢气纳米气泡水在环境毒理领域的基础数据,可对氢气纳米气泡水在环境领域的应用提供参考。
1 材料与方法
1.1 大型溞的培养
来自同一母溞且在实验室培养了十余年的受试生物大型溞(Daphnia magna),在光照∶黑暗=16 h∶8 h的循环光照,温度为23.5 ℃,光照强为3500~4000 Lux的恒温培养箱中培养。符合培养要求的天然水取自北京航空航天大学南湖(40°09′7.88″N, 116°15′51.84″E),在使用前用1.2 μm膜(GF/C Whatman, Maidstone,英国)过滤,且每2天更换1次水。大型溞每天以浓度为1×105~2×105 cells/mL的小球藻为食,小球藻于人工配制的WC[22]培养基中培养,在对数生长期时取出作为大型溞的食物。正式实验之前用重铬酸钾法对大型溞进行敏感性测试[23],测得24 h-EC50=0.54 mg/L,在GB/T 13266—91《水质 物质对蚤类(大型蚤)急性毒性测定方法》[23]规定的限值范围内(24 h-LC50=0.5~1.2 mg/L),认为大型溞的灵敏度符合实验要求。
1.2 氢气纳米气泡水和氮气水
氢气纳米气泡发生器(NB-T71 A,中国)通过电解水的原理产生氢气,然后用催化剂涂覆的膜来分离纯化氢气纳米气泡来制得氢气纳米气泡水。本研究中将从超纯水发生器(Research UV,中国)中接取的超纯水倒入氢气纳米气泡发生器中,待仪器稳定后制得氢气纳米气泡水。用于去除外源性ROS的氢气纳米气泡水,是将超纯水制备的Krebs-Ringer磷酸盐缓冲液(114 mmol/L NaCl, 4.6 mmol/L KCl, 2.4 mmol/L MgSO4, 1.0 mmol/L CaCl2, 15 mmol/L NaH2PO4/Na2HPO4, pH=7.4)倒入氢气纳米气泡发生器中,待仪器稳定后制得带有氢气纳米气泡的缓冲溶液。用溶存水素浓度判定试剂[24](Miz Co. Ltd,日本)测得氢气纳米气泡水的溶解氢(DH)浓度为1.6 mg/L。溶解氧浓度(DO)、氧化还原电位(ORP)和pH分别用DO电极(QC7687,Qcontums,美国)、ORP电极(QC3580,Qcontums,美国)和pH电极(QC3580,Qcontums,美国)测定。另外,用激光粒度仪(NANO-ZS,Malvern,英国)测定氢气纳米气泡水的Zeta电位,用纳米颗粒跟踪分析仪(LM14C,Malvern,英国)观察氢气纳米气泡水中的气泡数量和分布随储存时间的变化。
由于氢气纳米气泡水的ρ(DO)为3.5 mg/L左右,而超纯水中ρ(DO)为8.5 mg/L左右,为了与氢气纳米气泡水的DO相同,将氮气通入超纯水中,在本研究中称为氮气水。对于大型溞的暴露实验,为了模拟天然水中各种离子的状态,减少实验室之间的误差,需要在制得的氢气纳米气泡水、氮气水和超纯水中加一些营养物质。根据OECD标准[25],各营养物质的最终浓度分别为293.8 mg/L CaCl2,123.3 mg/L MgSO4,0.184 mg/L K2HPO4,0.274 mg/L NaNO3,64.8 mg/L NaHCO3,10 mg/L Na2SiO3,0.175 mg/L H3BO3,5.8 mg/L KCl和0.143 mg/L KH2PO4。在大型溞的暴露实验中,将加入营养物质后的3种暴露溶液称为氢气纳米气泡水、氮气水和超纯水。
1.3 氢气纳米气泡水与外源性H2O2和·OH的反应
自由基在水溶液中极不稳定且存在时间短,因此需要及时测定其浓度。过氧化氢(H2O2)在240 nm波长处有强吸收,在本研究中,用双氧水(30%)配制成1 mmol/L的H2O2母液,在有氢气纳米气泡的缓冲溶液和无氢气纳米气泡的缓冲溶液(对照)中分别加入1 mmol/L的H2O2母液,使H2O2最终浓度为300,750 μmol/L,反应5 min后,分别在240 nm处测定吸光值。
氨基苯基荧光素(APF)是1种对·OH、ClO-和ONOO-具有较高选择性和更强抗自氧化性的荧光探针,其本身无荧光,与·OH、ClO-和ONOO-反应,会产生强绿色荧光。在本研究中,将APF粉末溶于DMF配制成5 mmol/L的母液,·OH由芬顿反应(1)产生[26]:
H2O2+Fe2+→Fe3++OH+OH-
(1)
从式(1)可看出:当H2O2足量时,1 mol的Fe2+生成1 mol的·OH,因此本实验中通过控制加入Fe2+的量来控制产生·OH的量,首先在10 mL的含氢气纳米气泡的缓冲溶液和对照中加入10 μL 150 mmol/L的H2O2(终浓度:150 μmol/L),然后加入2 μL 5 mmol/L的APF母液(终浓度:1 μmol/L),最后加入1,3,5 μL 10 mmol/L的Fe2+,使·OH的最终浓度分别为1,3,5 μmol/L,混匀后用荧光分光光度计(F-7000,HITACHI,日本)分别在490 nm激发波长和515 nm发射波长下测量荧光强度,光电倍增管电压设置为700 V,狭缝宽度为5 nm。
1.4 大型溞的急性毒性暴露实验
根据(OECD,2004)[27]进行大型溞的急性毒性实验,在2 L溶液(氢气纳米气泡水和氮气水,标准人工配水)中添加一定量的Cu(NO3)2 标液(购自国家标准物质研究中心),使其最终浓度为100 μg/L,然后将200只14 d左右的大型溞放入盛有暴露液的烧杯中,每组处理设置1000只大型溞(5个烧杯)。暴露期间每12 h换1次暴露溶液,不喂食,在暴露3,6,12,24,36,48 h时,记录每个烧杯中大型溞的生存情况,以死亡数为标准对各个暴露条件的大型溞进行生存分析[28]。
1.5 大型溞体内铜积累量的测定
在暴露的3,6,12,24,36,48 h时,从每个处理中取出10只活体大型溞并用超纯水清洗3遍[29-30],每个处理设置3个平行,随后将大型溞转移到定性滤纸(Whatman 3 M,Fisher Scientific)吸干大型溞体表的水分。将收集到的大型溞在冷冻干燥机(Alpha 1-2 LDplus,CHRIST,德国)中-80 ℃干燥24 h,直至重量保持不变,测量干重进行记录,然后把大型溞转移至消解管内,加入2 mL浓硝酸(优级纯,68%),在120 ℃条件下消解至澄清,再转移至离心管中用2%的硝酸稀释至10 mL,用ICP-MS (NexLON350X,PerkinElmer,美国) (检出限:0.5 μg/L)测定大型溞体内金属铜积累量,μg/g(以干重计),具体计算见式(2)。
Cu积累量![]() (干重)
(干重)
(2)
式中:CCu为ICP-MS测定的Cu浓度,μg/L;V为消解定容后的体积,L;md为大型溞的干重,g。
1.6 氢气纳米气泡水对大型溞生长繁殖的影响
慢性实验依据大型溞的繁殖实验标准(OECD,2012)[25]进行设计,将加入营养物质后的氢气纳米气泡水、氮气水和超纯水(对照)(标准人工稀释水)作为暴露溶液,每个处理设置15个平行,大型溞暴露在25 mL的小烧杯中,每个烧杯中加入25 mL暴露溶液和1只6~24 h的幼溞,连续暴露21 d。暴露的光照周期、温度和湿度均与培养条件一致。在暴露过程中,每12 h更换1次暴露溶液,更换暴露溶液后向每个烧杯中加入藻液1滴且根据大型溞的年龄适当调节藻液量,同时,每次更换暴露液时观察并记录母溞死亡数、第1次产溞时间和产溞数,并及时移出幼溞和死亡的母溞。在暴露的第7天、第14天和第21天时使用体视镜对母溞进行拍照,测量从头盔至壳刺部的长度,作为大型溞的体长。在暴露结束后计算净生殖率(R0)、内禀增长率(r)[31,32],其相关计算如下式所示:
存活率lx:
![]()
(3)
每1龄的产溞数mx:
![]()
(4)
净生殖率R0:
R0=∑lxmx
(5)
世代周期T:
T=(∑Xlxmx)/(lxmx)
(6)
内禀增长率r:
![]()
(7)
式中:N0为种群起始数量;Nt为各天的存活数;F为各天的产仔数;X为大型溞存活的天数。
1.7 统计分析方法
分析结果均以平均值±标准差的形式表示,采用Origin 2019b及SPSS 22软件对实验数据进行图表绘制与统计分析。采用单因素方差分析(one-way ANOVA)2个处理组的显著性差异,采用Tukey HSD分析2个样本的显著性差异,当P<0.05时,2组比较差异有统计学意义。使用Kaplan-Meier生存分析统计比较在急性毒性暴露中不同处理组随时间的死亡率,估计每组的平均和中位生存时间,并采用Log Rank检验进行显著性分析。
2 结果与分析
2.1 氢气纳米气泡水、氮气水和超纯水的物理化学指标
在大型溞暴露过程中,氢气纳米气泡水、氮气水和超纯水在0 h 和12 h时的各物理化学指标如表1所示。结果表明:氢气纳米气泡水的DH浓度为1.6 mg/L,且随着时间不断下降直至12 h后<0.1 mg/L,而氮气水和超纯水中没有检测到DH。氢气纳米气泡水和氮气水在0 h时的ρ(DO)为3.7 mg/L,随着时间不断升高,12 h后升高到5.9 mg/L左右,而超纯水中的ρ(DO)随时间变化不大,维持在7.8 mg/L左右,均满足大型溞对DO浓度的要求(>3 mg/L)。与之前的研究结果类似[17],测得氢气纳米气泡水的ORP为(-423.17±29.89) mV,而氮气水和超纯水的ORP分别为(117.93±15.09) mV和(206.57±21.80) mV,在12 h内维持正值。另外,3种水的酸碱度均为6.65~7.84,温度为22.43~23.90 ℃。
表1 大型溞暴露过程中,氢气纳米气泡水、氮气水和超纯水在0 h和12 h的物理化学指标
Table 1 Physicochemical properties of hydrogen nanobubble water, nitrogen water and ultrapure water at 0 h and 12 h during Daphnia magna exposure
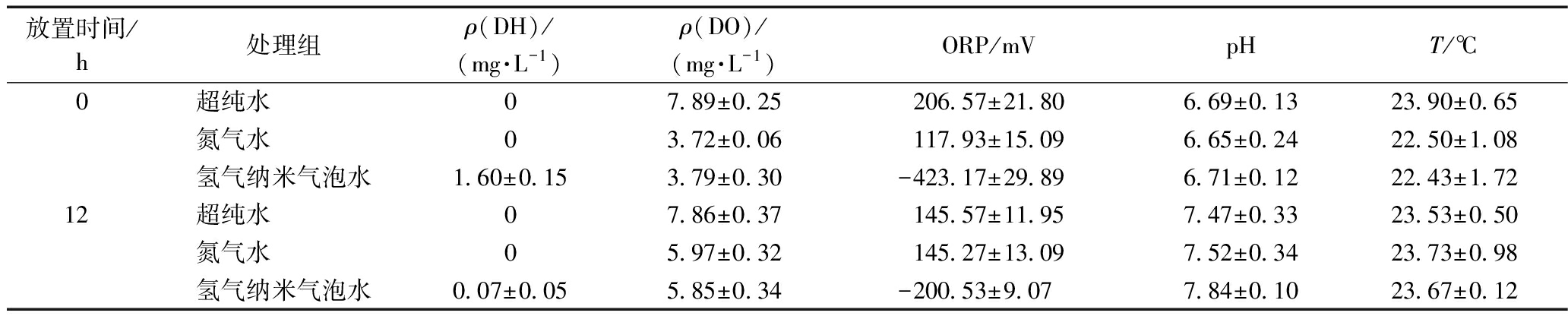
放置时间/h处理组ρ(DH)/(mg·L-1)ρ(DO)/(mg·L-1)ORP/mVpHT/℃0超纯水07.89±0.25206.57±21.806.69±0.1323.90±0.65氮气水03.72±0.06117.93±15.096.65±0.2422.50±1.08氢气纳米气泡水1.60±0.153.79±0.30-423.17±29.896.71±0.1222.43±1.7212超纯水07.86±0.37145.57±11.957.47±0.3323.53±0.50氮气水05.97±0.32145.27±13.097.52±0.3423.73±0.98氢气纳米气泡水0.07±0.055.85±0.34-200.53±9.077.84±0.1023.67±0.12
注:每个处理每个指标均测量3次,结果以平均值±标准差的形式表示。
图1a为氢气纳米气泡水的Zeta电位值。可知:氢气纳米气泡水的Zeta电位集中在-17~-23 mV,纳米气泡Zeta电位为负值,其原因为,在气-水界面处羟基离子多于氢离子[33],造成这种结果有2种解释:一类学者[34]认为是由于羟基离子的水合能低于氢离子,因此氢离子比羟基离子更容易留在水相中;另一类学者[35]认为是由于界面处水偶极子的取向,氢原子指向水相,氧原子指向气相,形成双电层,这种排列使阴离子吸引到气-水界面。氢气纳米气泡水中纳米气泡数量和分布随时间的变化如图1b所示。结果表明:氢气纳米气泡水中的气泡尺寸集中在0~200 nm,放置24 h后的气泡数量(2.20×106~3.46×106个/mL)明显低于新配制的氢气纳米气泡水中的气泡数量(3.17×106~1.64×107个/mL), 这一结果与之前的研究类似[14, 33],导致气泡数量降低的可能原因为:1)纳米气泡的表面电荷被中和,导致消失;2)纳米气泡接触到储存容器的亲水表面,导致其破裂;3)纳米气泡与悬浮液的表面相互作用,处于悬浮液上部的纳米气泡最终扩散到气水界面而消失。随着时间的推移,观察到纳米尺寸逐渐减小,说明测定的是纳米气泡,而不是纳米级的杂质。

![]() 均值±标准误差;
均值±标准误差; ![]() 范围; —中位线; ● 均值;
范围; —中位线; ● 均值;![]() —放置24 h的氢气纳米气泡水;
—放置24 h的氢气纳米气泡水; ![]() —新配置的氢气纳米气泡水。
—新配置的氢气纳米气泡水。
图1 氢气纳米气泡水的Zeta电位及纳米气泡数量和分布随储存时间的变化
Fig.1 Change of Zeta potential of hydrogen nanobubble water and hydrogen nanobubbles number with storage time
因此,氢气纳米气泡是相对不稳定的,在急性暴露和慢性暴露过程中,为了保证暴露溶液中有足够的DH,选择每12 h更换1次暴露溶液。
2.2 氢气纳米气泡水对外源性H2O2和·OH去除作用
氢气纳米气泡水对外源性H2O2的去除作用见图2a。结果表明:当H2O2浓度为300,750 μmol/L时,氢气纳米气泡和对照组的吸光度没有显著性差异(P>0.05,one-way ANOVA),说明氢气纳米气泡不能有效去除H2O2。氢气纳米气泡水对外源性·OH的去除作用见图2b。结果表明:当只有APF荧光指示剂时,测得的荧光强度为(35.88±1.31),且不随时间变化,当·OH浓度为3,5 μmol/L时,氢气纳米气泡中APF的荧光强度显著低于对照组(P<0.05,one-way ANOVA),说明氢气纳米气泡可以有效去除·OH。
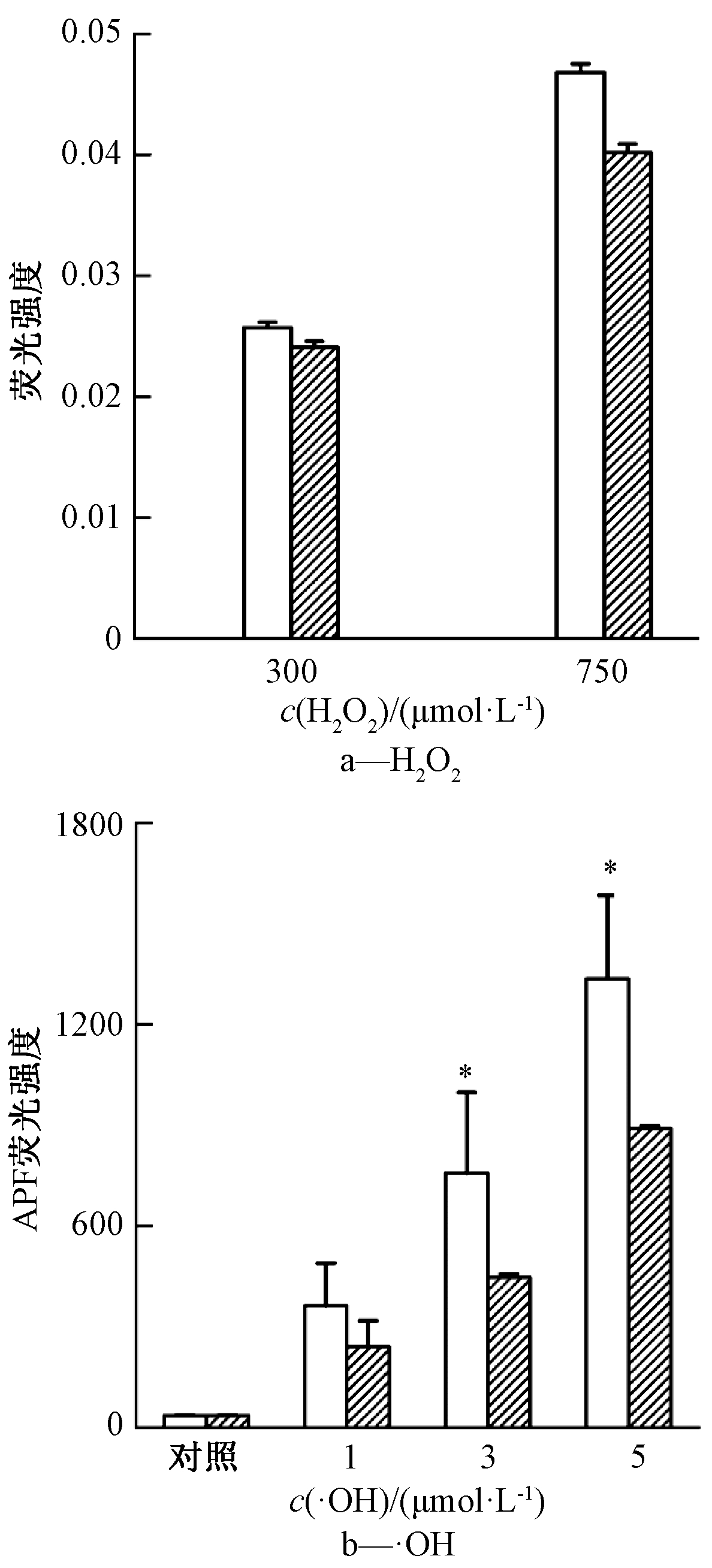
![]() 对照;
对照; ![]() 氢气纳米气泡水。
氢气纳米气泡水。
注:不含氢气情况下2种活性氧的荧光值设置为对照;误差线为3次平行数据的标准方差;*表示在0.05水平上有显著性差异。
图2 氢气纳米气泡水对不同浓度H2O2和·OH的去除效果
Fig.2 Removal efficiencies of different concentrations of H2O2 (a) and ·OH (b) by hydrogen nanobubble
近年来的研究表明,ROS不只是指对酯类、蛋白质和核酸造成氧化损伤的有毒物质,有些ROS可以作为在细胞信号通路中起重要作用的生理调节因子[26]。Ohsawa等[36]在2007年Nature Medicine上首次报道了氢气可以选择性去除具有细胞毒性的ROS,从而可以作为一种新型有效的抗氧化剂。Liu等[17]也证明了氢气纳米气泡水可以有效去除对细胞有毒性的·OH、ClO-和ONOO-,而不会影响其他在生理上重要的ROS,如H2O2和NO。本试验再一次验证了氢气纳米气泡水具有选择性去除ROS的特点,为后续大型溞受铜胁迫后,探究氢气纳米气泡水对大型溞体内ROS的去除及对解释毒性缓解作用机制提供了基础数据。
2.3 氢气纳米气泡水对大型溞急性死亡率的影响
在铜污染胁迫下(100 μg/L),氮气水和氢气纳米气泡水的大型溞的存活率如图3所示。经过48 h暴露后,大型溞在氮气水和氢气纳米气泡水中的最终存活率分别为25.6%和41.5%。氮气水和氢气纳米气泡水中大型溞的生存曲线具有显著性差异(Log-rank test, df=1, P<0.05)。
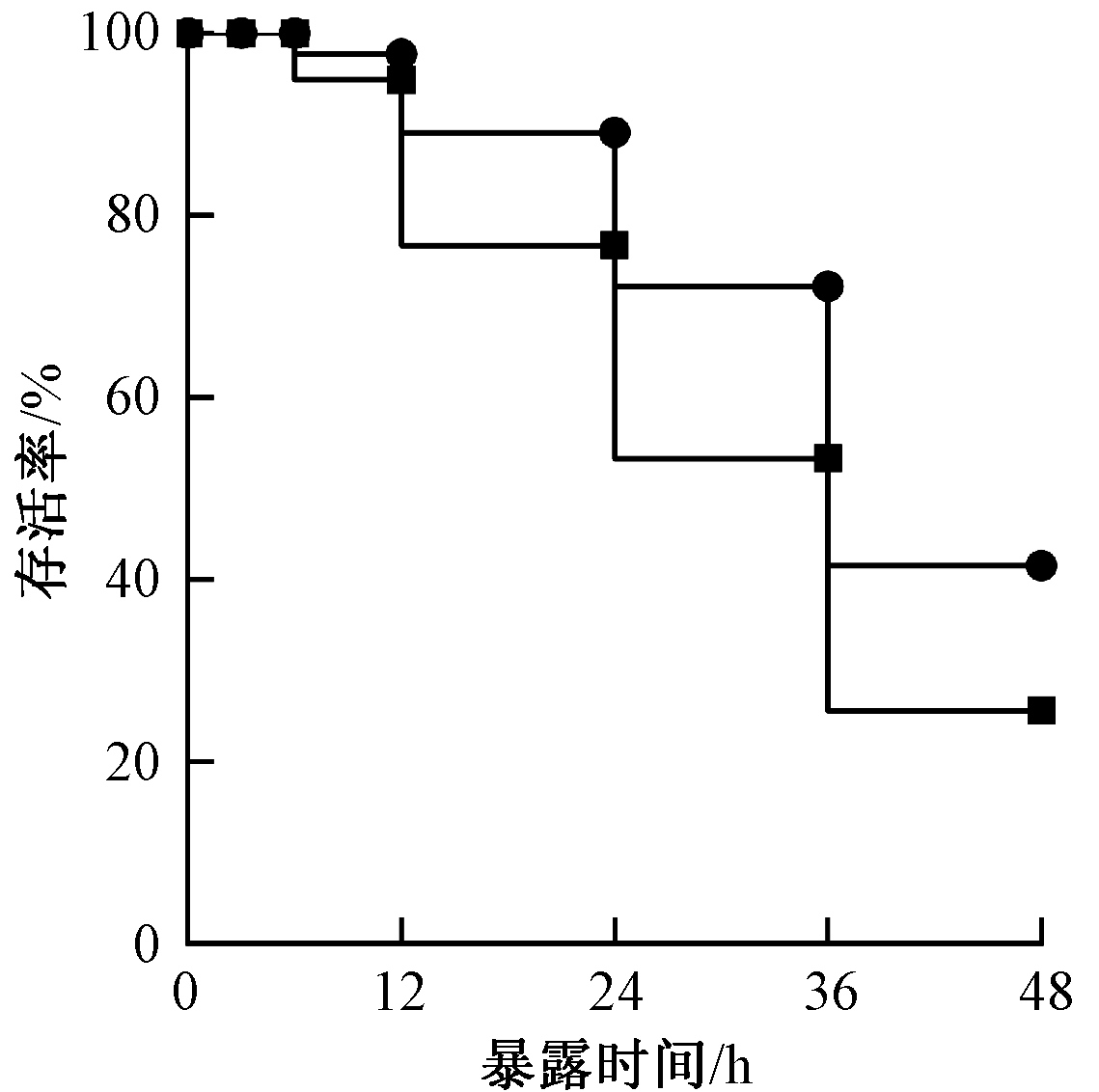
![]() —氮气水+100 μg/L Cu;
—氮气水+100 μg/L Cu; ![]() —氢气纳米气泡水+100 μg/L Cu。
—氢气纳米气泡水+100 μg/L Cu。
图3 暴露于氮气水和氢气纳米气泡水(100 μg/L Cu)48 h中,大型溞的生存曲线(每组处理1000只大型溞)
Fig.3 The survival curve of Daphnia magna exposed to nitrogen water and hydrogen nanobubble water containing 100 μg/L of Cu for 48 h(1000 Daphnia magna for each batch)
表2为暴露于含有100 μg/L铜的氮气水和氢气纳米气泡水48 h后,大型溞的平均生存时间和中位生存时间。可知:氮气水中大型溞的平均生存时间(38.994±0.256) h,低于氢气纳米气泡水(43.079±0.240) h。因此,氢气纳米气泡水使大型溞的死亡率降低、平均生存时间延长,初步表明氢气纳米气泡水起到了缓解Cu对大型溞毒性的作用。在植物学领域中,类似的研究表明添加氢气水降低了镉对紫花苜蓿的毒性,促进了根系的伸长和幼苗的生长[7];还有研究表明外源的氢气水缓解了水稻萌发过程中的盐胁迫[9]。
表2 在氮气水和氢气纳米气泡水中暴露48 h后大型溞存活时间的平均数和中位数
Table 2 Means and medians for survival time of Daphnia magna after exposure to nitrogen water and hydrogen nanobubble water for 48 h

处理组平均数估计标准误差95%信赖区间下限上限中位数估计标准误差95%信赖区间下限上限氮气水38.9940.25638.49139.496480.47347.07348.927氢气纳米气泡水43.0790.24042.60943.549480.51846.98549.015
2.4 氢气纳米气泡水对大型溞体内铜积累的影响
铜对大型溞产生毒性的一个重要因素是生物积累,它可能导致严重的生长抑制、代谢紊乱和死亡。如图4所示,当暴露48 h后,含有100 μg/L铜的氮气水和氢气纳米气泡水中大型溞体内铜的积累量分别从25.6,25.6 μg/g(干重)增加到338.5,208.4 μg/g(干重),且具有显著性差异(P<0.05,one-way ANOVA)。
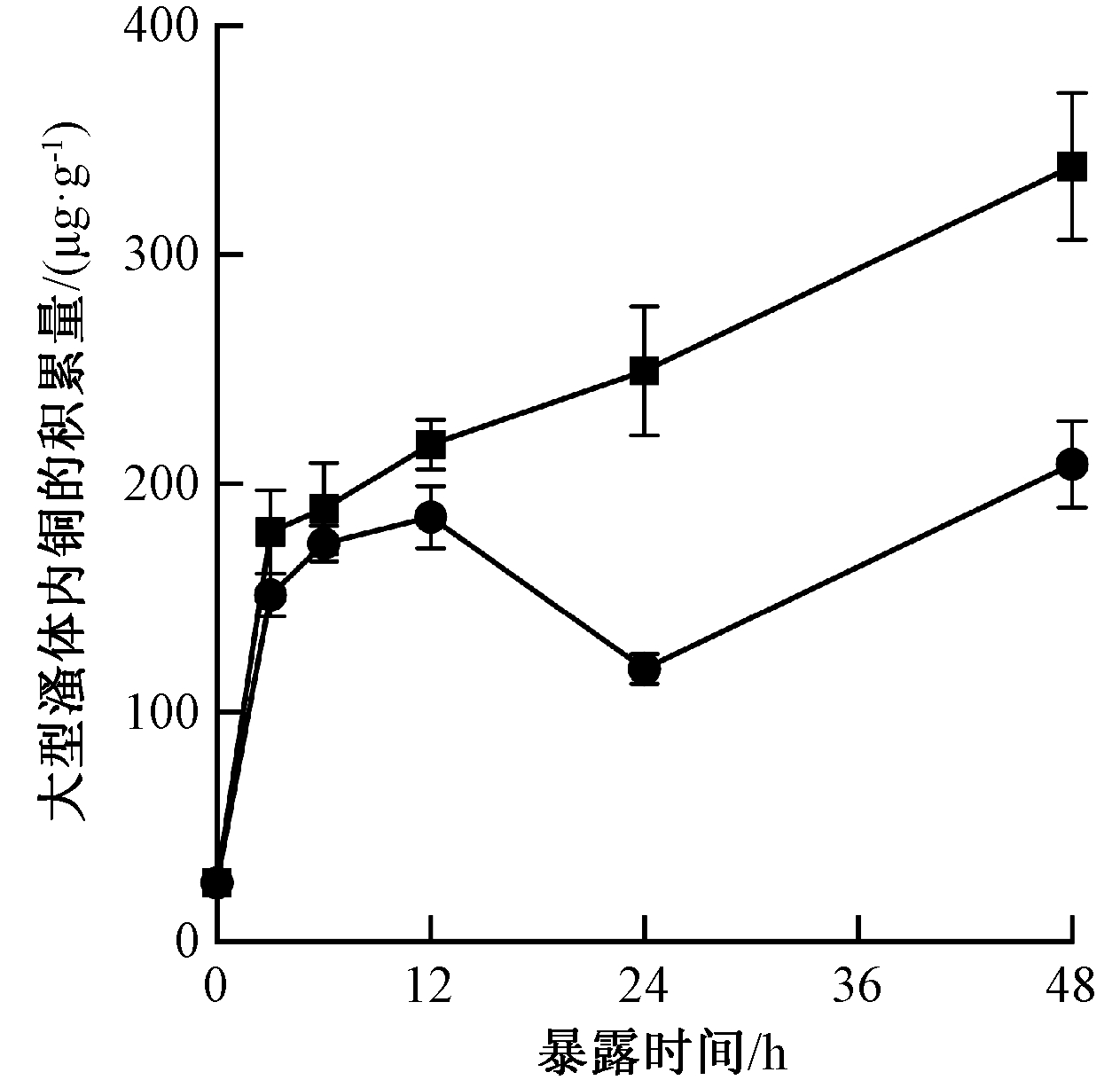
![]() —氮气水+100 μg/L Cu;
—氮气水+100 μg/L Cu; ![]() —氢气纳米气泡水+100 μg/L Cu。
—氢气纳米气泡水+100 μg/L Cu。
注:数据为平均值±标准方差(n=3)。
图4 暴露于氮气水和氢气纳米气泡水(100 μg/L Cu)48 h中,大型溞体内Cu的积累量随时间的变化
Fig.4 Cu bioaccumulation in Daphnia magna exposed to nitrogen water and hydrogen nanobubble water containing 100 μg/L Cu for 48 h (n=3)
Wu等[8]研究表明,氢气水通过调节与Cd摄取和转运相关的基因来减轻Cd的积累,增强了白菜对镉的耐受性。而在本研究中,氢气纳米气泡水降低了大型溞体内铜的积累量,起到缓解毒性的作用,其原因可能是:1)Cu在自然条件下有3种存在形式Cu2+、Cu+和Cu0,氢气纳米气泡水作为一种潜在的还原剂,可能会将Cu2+转化为Cu0,进而阻碍铜进入细胞,使大型溞体内铜积累量降低;2)氢气纳米气泡水可能调节大型溞体内与Cu摄取相关的基因来降低Cu的积累。氢气纳米气泡水的具体解毒机制有待进一步探究。
2.5 氢气纳米气泡水对大型溞繁殖的影响
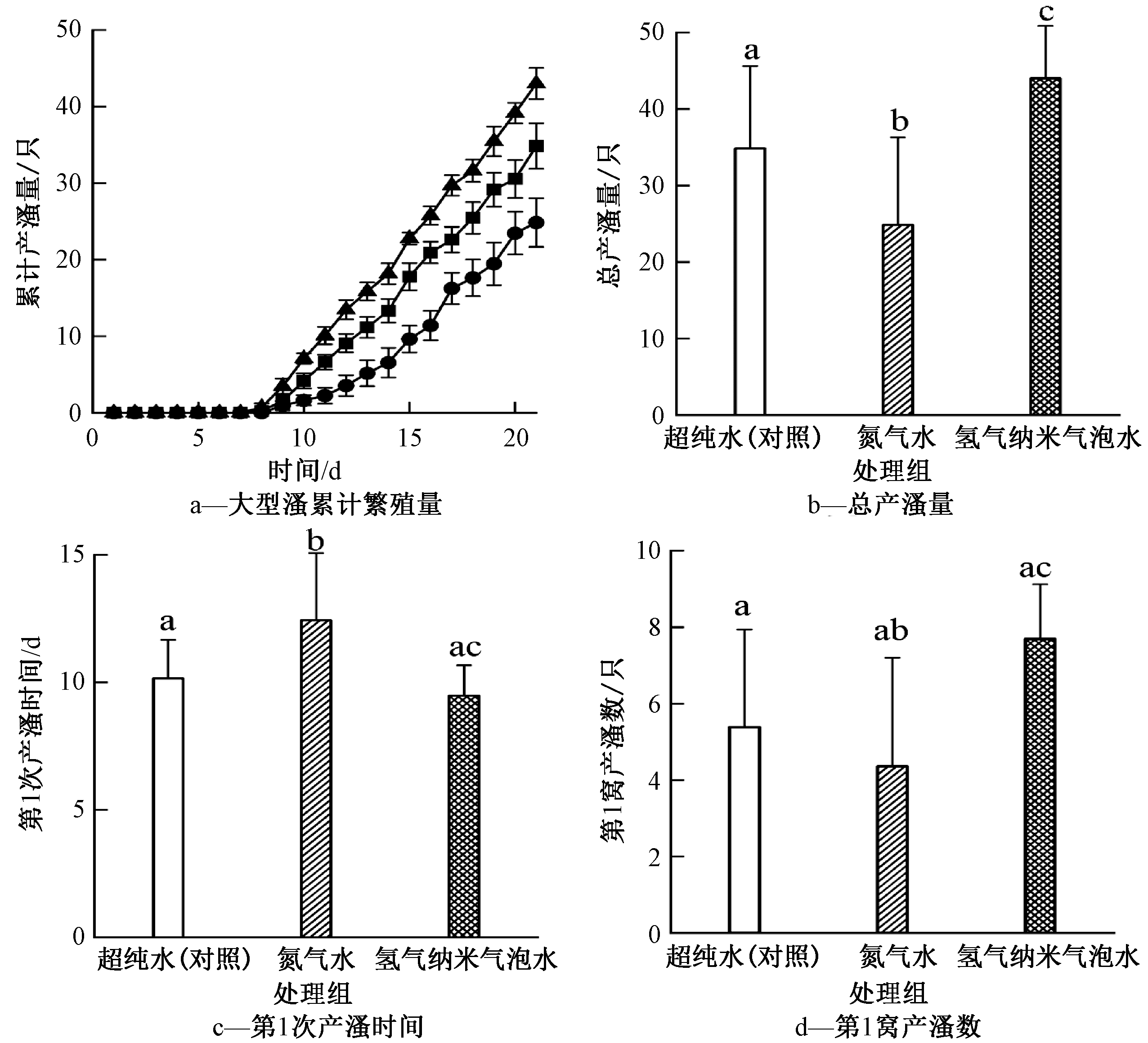
大型溞生活于氢气纳米气泡水、氮气水和超纯水21 d后的繁殖情况如图5所示。可知:与对照组(超纯水)相比,氮气水对大型溞的累计产溞量产生了明显抑制作用(P<0.05,one-way ANOVA),而暴露于氢气纳米气泡水的大型溞明显促进了累计产溞量(P<0.05,one-way ANOVA)。图5b的结果也表明:氮气水显著降低了总产溞量(P<0.05,one-way ANOVA),而氢气纳米气泡水显著增加了总产溞量(P<0.05,one-way ANOVA),而21 d的总产溞量均低于OECD规定方法的60只,可能原因是:1)暴露过程中每12 h更换1次暴露溶液,而标准方法中是每2 d更换1次暴露液,频繁的更换过程可能会对大型溞的生长造成一定影响;2)在暴露过程中可能没有掌握好喂养大型溞的绿藻量,导致繁殖量较低;3)氢气纳米气泡水和氮气水中溶解氧较低(3.7~5.8 mg/L),导致繁殖量较低。
氢气纳米气泡水、氮气水和超纯水对大型溞第1次产溞时间的影响如图5c所示。可知:与对照组相比,氮气水明显延迟了大型溞的第1次产溞时间(P<0.05,one-way ANOVA),而氢气纳米气泡水提前了第1次产溞时间,但没有显著差异(P>0.05,one-way ANOVA)。3种暴露液对第1窝小溞数的影响见图5d,对照组中第1窝小溞数为(5.38±2.56)只,氮气水中第1窝小溞数降低到(4.36±2.84)只,而氢气纳米气泡水提高了第1窝小溞数[(6.93±2.35)只],氮气水和氢气纳米气泡水2个处理组在统计学上具有显著性差异(P<0.05,one-way ANOVA)。
繁殖率描述了种群产生后代的能力,没有考虑其存活能力,不能全面刻画种群的增长能力,而内禀增长率(r)是种群的瞬时增长率,它不仅决定于出生率和死亡率,而且决定于种群世代发育时间,是一个理想的刻画种群增长能力的指标[31]。由表3结果表明:氢气纳米气泡水中大型溞的净生殖率(R0)和内禀增长率(r)均高于对照组,而氮气水中大型溞的R0和r均低于对照组。繁殖率和内禀增长率的结果都表明长期暴露于氢气纳米气泡水对大型溞的生长繁殖产生了积极影响。
![]() —超纯水(对照);
—超纯水(对照); ![]() —氮气水;
—氮气水; ![]() —氢气纳米气泡水。
—氢气纳米气泡水。
注:数据为平均值±标准方差(n=15);小写字母a、b和c表示与对照的显著差异。
图5 氢气纳米气泡水、氮气水和超纯水对大型溞累计繁殖量、总产溞量、第1次产溞时间和第1窝产溞数的影响
Fig.5 The effects of hydrogen nanobubble water, nitrogen water and ultrapure water on offspring, total neonates,time to first brood, and neonates of first brood
表3 氢气纳米气泡水、氮气水和超纯水对大型溞净生殖率(R0)和内禀增长率(r)的影响
Table 3 Influence of hydrogen nanobubble water, nitrogen water and ultrapure water on the net reproduction rate (R0) and intrinsic rate (r) of Daphnia magna

处理组净生殖率/R0内禀增长率/r超纯水(对照)30.170.22氮气水22.060.19氢气纳米气泡水39.330.24
有研究表明,长期使用氢气水在医学中产生了积极的影响,癌症患者饮用氢气水6周可以降低血液中的活性氧代谢产物,维持血液氧化电位,改善了放射治疗过程的生活质量,但不会影响抗肿瘤的效果[37]。2型糖尿病或糖耐量受损患者每天饮用900 mL氢气水,8周后,氢气水通过提供对氧化应激的保护来预防或延迟糖尿病[2]。本文中大型溞的慢性实验表明,氢气纳米气泡水增加了产溞量和内禀增长率,提前了第1次产溞时间,氢气纳米气泡水作为一种潜在的抗氧化剂可能去除了大型溞生长过程中有害的ROS,提高了大型溞的抗氧化机制,对大型溞的繁殖产生了促进作用,但是具体作用机制还有待进一步研究。
2.6 氢气纳米气泡水对大型溞体长的影响
图6为暴露于3种暴露溶液中7,14,21 d后大型溞的体长结果。可知:大型溞的体长随时间不断增长,但是无论是第7天、第14天还是第21天,在3种暴露溶液中,大型溞的体长均无显著性差别(P>0.05,one-way ANOVA)。

![]() 超纯水;
超纯水; ![]() 氮气水;
氮气水; ![]() 氢气纳米气泡水。
氢气纳米气泡水。
图6 氢气纳米气泡水、氮气水和超纯水对大型溞第7,14,21天体长的影响
Fig.6 The influence of hydrogen nanobubble water, nitrogen water, and ultrapure water on the body length of Daphnia magna on the 7th, 14th, and 21st day
3 结 论
1)氢气纳米气泡在pH中性水中的Zeta电位为-17~-23 mV,其表面电荷绝对量小于其他气源的纳米气泡。此外,溶解氢气浓度和纳米气泡数量随着储存时间显著降低,ORP随着储存时间显著升高,说明与其他气源的纳米气泡相比,氢气纳米气泡相对不稳定。因此,在急性暴露和慢性暴露过程中,为了保证暴露溶液中有足够的DH,选择每12 h更换1次暴露溶液。
2)外源性实验证明,氢气纳米气泡水具有选择性去除ROS的特点,它可以有效去除强氧化自由基·OH,但不能去除作为信号物质的H2O2。这为后续探究大型溞受铜胁迫后,氢气纳米气泡水对大型溞体内ROS的去除及对解释毒性缓解作用机制提供了基础数据。
3)在重金属Cu2+污染胁迫下,氢气纳米气泡水的存在降低了大型溞死亡率,在一定程度上阻止了Cu2+在大型溞体内的积累,从而缓解了Cu2+对其的毒性。
4)在没有重金属污染胁迫的环境下,氢气纳米气泡水显著提高了大型溞的生理活性,大型溞的产溞量显著增加,产溞时间显著缩短,说明氢气纳米气泡对大型溞的繁殖产生了促进作用。
[1] Ohta S. Molecular hydrogen is a novel antioxidant to efficiently reduce oxidative stress with potential for the improvement of mitochondrial diseases[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2012, 1820(5): 586-594.
[2] Kajiyama S, Hasegawa G, Asano M, et al. Supplementation of hydrogen-rich water improves lipid and glucose metabolism in patients with type 2 diabetes or impaired glucose tolerance[J]. Nutr Res, 2008, 28(3): 137-143.
[3] 李翔子,孙晓宇,王赞,等. 富氢水对大鼠离体心肌缺血再灌注损伤细胞凋亡的影响[J]. 实用医学杂志, 2018, 34(20): 3356-3361.
[4] Paulis M G, Hassan O A, Abbass M F, et al. Structural and lipid peroxidation effects of lead on rat hippocampus and its attenuation by hydrogen rich water[J]. J Chem Neuroanat, 2018, 91: 55-62.
[5] 卢宏涛,孙学军. 氢气医学研究的进展、争议和挑战[J]. 第二军医大学学报,2018, 39(11): 1181-1187.
[6] 寻治铭,赵清辉,琚芳迪,等. 氢分子在临床应用中的研究进展[J]. 生物技术进展,2019, 9(3): 217-222.
[7] Cui W T, Gao C Y, Fang P, et al. Alleviation of cadmium toxicity in Medicago sativa by hydrogen-rich water[J]. J Hazard Mater, 2013, 260: 715-724.
[8] Wu Q, Su N N, Cai J T, et al. Hydrogen-rich water enhances cadmium tolerance in Chinese cabbage by reducing cadmium uptake and increasing antioxidant capacities[J]. Journal of Plant Physiology, 2015, 175: 174-182.
[9] Xu S, Zhu S S, Jiang Y L, et al. Hydrogen-rich water alleviates salt stress in rice during seed germination[J]. Plant and Soil, 2013, 370(1/2): 47-57.
[10] 田婧芸,杨利艳,王创云,等. 外源氢气对玉米幼苗耐盐性的影响[J]. 湖南师范大学自然科学学报, 2018, 41(6): 23-30.
[11] Chen M, Cui W T, Zhu K K, et al. Hydrogen-rich water alleviates aluminum-induced inhibition of root elongation in alfalfa via decreasing nitric oxide production[J]. Journal of Hazardous Materials, 2014, 267: 40-47.
[12] Chen H, Hai H B, Wang H, et al. Hydrogen-rich water mediates redox regulation of the antioxidant system, mycelial regeneration and fruiting body development in Hypsizygus marmoreus[J]. Fungal Biol, 2018, 122(5): 310-321.
[13] Alheshibri M, Qian J, Jehannin M, et al. A history of nanobubbles[J]. Langmuir, 2016, 32(43): 11086-11100.
[14] Nirmalkar N, Pacek A W, Barigou M. On the existence and stability of bulk nanobubbles[J]. Langmuir, 2018, 34(37): 10964-10973.
[15] Ushikubo F Y, Furukawa T, Nakagawa R, et al. Evidence of the existence and the stability of nanobubbles in water[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2010, 361(1/2/3): 31-37.
[16] Kato S, Matsuoka D, Miwa N. Antioxidant activities of nano-bubble hydrogen-dissolved water assessed by ESR and 2,2′-bipyridyl methods[J]. Materials Sciences Engineering C Materials Biological Applications, 2015, 53: 7-10.
[17] Liu S, Oshita S, Thuyet D Q, et al. Antioxidant activity of hydrogen nanobubbles in water with different reactive oxygen species both in vivo and in vitro[J]. Langmuir, 2018, 34(39): 11878-11885.
[18] 吴丰昌,冯承莲,曹宇静,等. 我国铜的淡水生物水质基准研究[J]. 生态毒理学报, 2011, 6(6): 617-628.
[19] Gaetke L. Copper toxicity, oxidative stress, and antioxidant nutrients[J]. Toxicology, 2003, 189(1/2): 147-163.
[20] Poynton H C, Varshavsky J R, Chang B, et al. Daphnia magna ecotoxicogenomics provides mechanistic insights into metal toxicity[J]. Environmental Science & Technology, 2007, 41(3): 1044-1050.
[21] Zhao C M, Fan W H, Wang W X. Aqueous and dietary copper uptake and elimination in Daphnia magna determined by the 67Cu radiotracer[J]. Environmental Toxicology and Chemistry, 2009, 28(11): 2360-2366.
[22] Guillard R R L, Lorenzen C J. Yellow-green algae with chlorophyllide C[J]. Journal of Phycology, 1972, 8(1): 10-14.
[23] 国家环境保护局. 水质 物质对蚤类(大型蚤)急性毒性测定方法:GB/T 13266—91[S]. 1991.
[24] Seo T, Kurokawa R, Sato B. A convenient method for determining the concentration of hydrogen in water: use of methylene blue with colloidal platinum[J]. Medical Gas Research, 2012, 2(1): 1-6.
[25] Organization for Economic Co-operation and Development, Daphnia Magna Reproduction Test[M]. Paris, 2012.
[26] Liu S, Oshita S, Kawabata S, et al. Identification of ROS produced by nanobubbles and their positive and negative effects on vegetable seed germination[J]. Langmuir, 2016, 32(43): 11295-11302.
[27] Organization for Economic Co-operation and Development, Acute Immobilisation Test. In: OECD Guidelines for the Testing of Chemicals, Section 2: Effects on Biotic Systems[M]. Paris, 2004.
[28] Liu S, Cui M M, Li X M, et al. Effects of hydrophobicity of titanium dioxide nanoparticles and exposure scenarios on copper uptake and toxicity in Daphnia magna[J]. Water Research, 2019, 154: 162-170.
[29] Fan W H, Wang X L, Cui M M, et al. Differential oxidative stress of octahedral and cubic Cu2O micro/nanocrystals to Daphnia magna[J]. Environ Science & Technology, 2012, 46(18): 10255-10262.
[30] Fan W H, Cui M M, Liu H, et al. Nano-TiO2 enhances the toxicity of copper in natural water to Daphnia magna[J]. Environmental Pollution, 2011, 159(3): 729-734.
[31] 张榜军,刘坤. Cu2+对大型溞生长和繁殖的影响[J]. 水生态学杂志, 2009, 2(1): 128-130.
[32] 单访,况荣平. 苹果棉蚜种群内禀增长率的研究[J]. 动物学研究, 1988,9(3):285-290.
[33] Liu S, Kawagoe Y, Makino Y, et al. Effects of nanobubbles on the physicochemical properties of water: the basis for peculiar properties of water containing nanobubbles[J]. Chemical Engineering Science, 2013, 93: 250-256.
[34] Najafi A S, Drelich J, Yeung A, et al. A novel method of measuring electrophoretic mobility of gas bubbles[J]. Journal of Colloid and Interface Science, 2007, 308(2): 344-350.
[35] Takahashi M. Zeta potential of microbubbles in aqueous solutions: electrical properties of the gas-water interface[J]. The Journal of Physical Chemistry B, 2005, 109(46): 21858-21864.
[36] Ohsawa I, Ishikawa M, Takahashi K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nature Medicine, 2007, 13(6): 688-694.
[37] Kang K M, Kang Y N, Choi I. B, et al. Effects of drinking hydrogen-rich water on the quality of life of patients treated with radiotherapy for liver tumors[J]. Medical Gas Research, 2011, 1(11): 1-8.