目前,含有S2-和![]() 的工业废水产生、排放量越来越大,给自然生态环境造成了严重的危害。其中S2-可能会引起生物腐蚀,而且在酸性环境下还有可能会产生有毒有害的H2S,大量消耗水中的溶解氧,致使水生生物大量死亡,严重破坏水生生态系统[1,2]。
的工业废水产生、排放量越来越大,给自然生态环境造成了严重的危害。其中S2-可能会引起生物腐蚀,而且在酸性环境下还有可能会产生有毒有害的H2S,大量消耗水中的溶解氧,致使水生生物大量死亡,严重破坏水生生态系统[1,2]。
生物反硝化过程分为自养反硝化和异养反硝化,异养反硝化以有机碳源作为电子供体,以![]() 或
或![]() 作为电子受体;而在自养反硝化中,以无机物(如S2-、Fe2+等)作为电子供体,以
作为电子受体;而在自养反硝化中,以无机物(如S2-、Fe2+等)作为电子供体,以![]() 或
或![]() 作为电子受体。近年来,众多国内外学者在氮循环路径中发现了硝酸盐异化还原成铵(DNRA)的现象[3,4],有关DNRA作用的研究多集中在生态环境中,如河流、湖泊和海洋等地表水底泥和土壤及消化污泥,而针对活性污泥、生物膜脱氮系统研究较少。
作为电子受体。近年来,众多国内外学者在氮循环路径中发现了硝酸盐异化还原成铵(DNRA)的现象[3,4],有关DNRA作用的研究多集中在生态环境中,如河流、湖泊和海洋等地表水底泥和土壤及消化污泥,而针对活性污泥、生物膜脱氮系统研究较少。
本实验以乙酸盐和硫化钠同时作为电子供体,以![]() 作为电子受体,以序批式生物膜反应器(SBBR)中微生物群作为电子转移载体,通过不断降低C/S,影响异养和自养反硝化菌的微生物活性,提高自养反硝化路径在氮转移路径中的贡献占比,探讨电子供体对生物脱氮性能以及氮转化途径的影响。
作为电子受体,以序批式生物膜反应器(SBBR)中微生物群作为电子转移载体,通过不断降低C/S,影响异养和自养反硝化菌的微生物活性,提高自养反硝化路径在氮转移路径中的贡献占比,探讨电子供体对生物脱氮性能以及氮转化途径的影响。
本实验采用SBBR工艺,实验装置(图1)采用有机玻璃制作的圆柱形容器,内径为130 mm,高度为165 mm,有效容积2 L。实验用接种污泥取自西安市邓家村污水处理厂,采用醛化纤维及涤纶丝组合填料作为生物膜载体,悬挂于圆柱形容器内,内置磁力搅拌转子,容器置于恒温磁力搅拌器上从而控制水温和搅拌速度,转速为400 r/min,温度控制在25 ℃。通过蠕动泵和自动控制系统控制进出水,容器内分别放置DO、pH、ORP电极探头,实时监测系统运行情况。
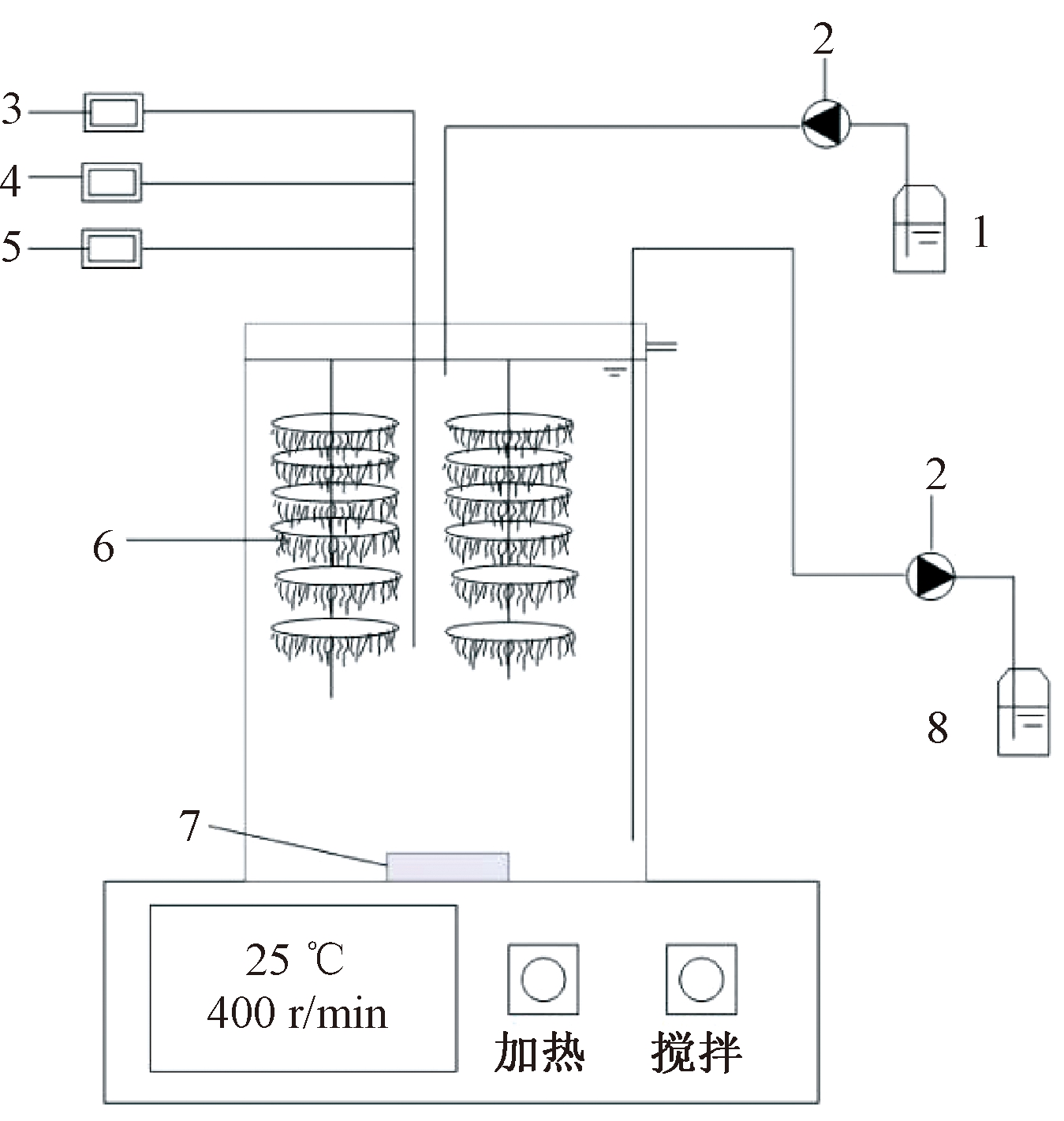
1—进水装置;2—蠕动泵;3—ORP电极控制系统;4—DO电极控制系统;5—pH电极控制系统;6—生物填料;7—磁力搅拌转子;8—出水箱装置。
图1 SBBR实验装置
Fig.1 The SBBR experimental device diagram
反应器周期运行,通过自动监控系统完成进出水,进出水比为1∶1,进水pH控制在(7.70±0.10),HRT=2 h。为了尽量减少其他因素对反应结果的干扰,在每次实验测定前,先将25 ℃清水放置于恒温装置上,用N2吹脱30 min,使其溶解氧(DO)<0.3 mg/L以待备用。同时,将生物膜用自来水清洗3次,以减小上一周期遗留物质对实验的干扰。准备工作结束后,将新鲜配制的进水注入反应器内,按照时间间隔采样收集以待测定。
在![]() 为2 mmol/L的条件下,通过改变有机碳源的浓度和S2-物质的浓度来探索不同C/S下的脱氮效率,运行条件见表1。
为2 mmol/L的条件下,通过改变有机碳源的浓度和S2-物质的浓度来探索不同C/S下的脱氮效率,运行条件见表1。
表1 不同C/S下运行条件
Table 1 Operating conditions under different C/S

编号n(C)/n(S)ρ(COD)/(mg·L-1)ρ(S2--S)/(mg·L-1)ρ(NO-3-N)/(mg·L-1)18∶1260323024∶1130323032∶165323042∶3659630
实验用水采用人工配水,初期进水各物质浓度为:NaHCO3 800 mg/L、KH2PO4 350 mg/L、CaCl2 50 mg/L、微量元素2 mL;微量元素组分:H3BO3 50 mg/L、CuCl2 30 mg/L、ZnCl2 50 ![]() 4H2O 50 mg/L、MgSO4·H2O 500 mg/L、CoCl2·6H2O 50 mg/L、AlCl3 50 mg/L、NiCl2 50 mg/L、浓HCl为1 mL/L。
4H2O 50 mg/L、MgSO4·H2O 500 mg/L、CoCl2·6H2O 50 mg/L、AlCl3 50 mg/L、NiCl2 50 mg/L、浓HCl为1 mL/L。
试样分析方法均采用国家环境保护总局发布的标准方![]() 测定采用纳式试剂分光光度法;
测定采用纳式试剂分光光度法;![]() 测定采用紫外分光光度法;
测定采用紫外分光光度法;![]() 测定采用N-(1-萘基)-乙二胺光度法;S2-测定采用亚甲基蓝分光光度法;
测定采用N-(1-萘基)-乙二胺光度法;S2-测定采用亚甲基蓝分光光度法;![]() 测定采用USEPA1 SulfaVer4试剂浊度法;COD测定采用连华科技多参数水质快速测定仪;DO、pH采用WTWmulti3630 IDS测定;氧化还原电位(ORP)采用雷磁PHSJ-3F测定。
测定采用USEPA1 SulfaVer4试剂浊度法;COD测定采用连华科技多参数水质快速测定仪;DO、pH采用WTWmulti3630 IDS测定;氧化还原电位(ORP)采用雷磁PHSJ-3F测定。
![]() 采用纳氏试剂分光光度法检测,由于
采用纳氏试剂分光光度法检测,由于![]() 的测定在一定程度上受到S2-的干扰[5],为消除该干扰,本实验利用35组单一状态不同浓度的S2-对
的测定在一定程度上受到S2-的干扰[5],为消除该干扰,本实验利用35组单一状态不同浓度的S2-对![]() 的影响数据,绘制拟合曲线(图2,Pearson’s r=0.969>0.8)。本文中均采用此法处理:溶液中
的影响数据,绘制拟合曲线(图2,Pearson’s r=0.969>0.8)。本文中均采用此法处理:溶液中![]()

注:y=a+bx,a为(0.8606±0.39711),b为(0.1823±0.00876)。
图2 ρ(S2-)对![]() 的影响拟合曲线
的影响拟合曲线
Fig.2 Fitting curve of influence of ρ(S2-)on ![]()
DNRA过程占比n按式(1)计算:
![]()
(1)
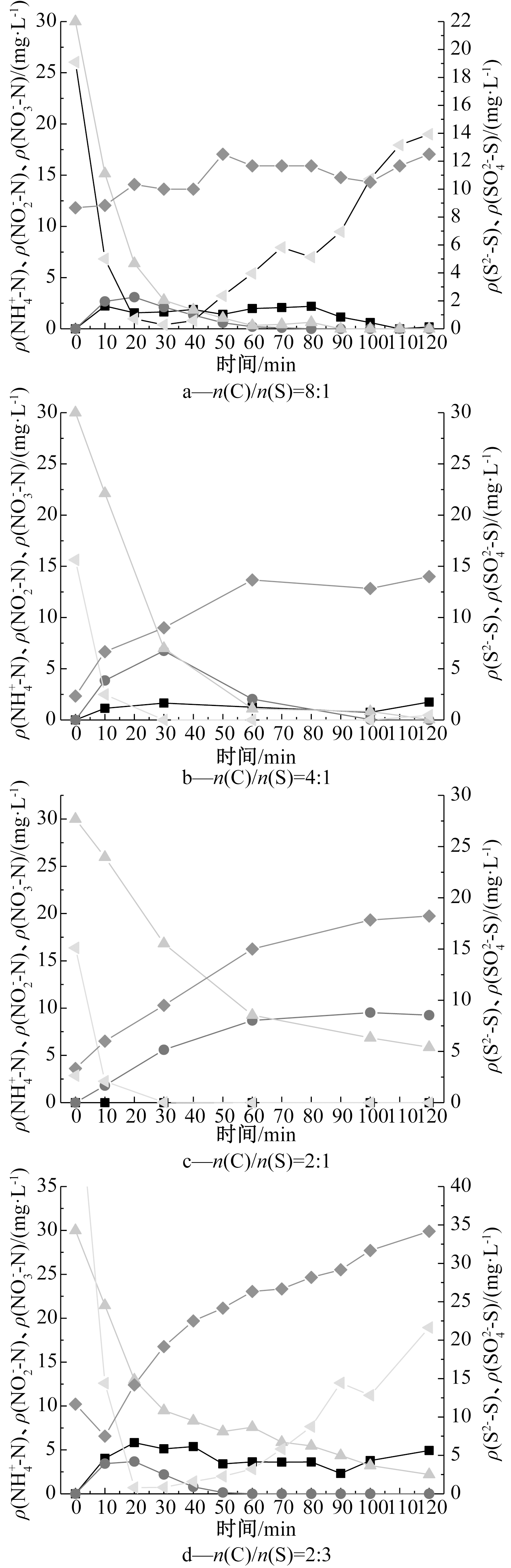
2.1.1 不同C/S下含氮、硫组分变化
在生物脱氮过程中,![]() 可转化为
可转化为![]() N2、NO、N2O,本实验除检测的
N2、NO、N2O,本实验除检测的![]() 外,假设其余转化为含氮气体逸出,各含N物质组分见表2。当电子供体当量越小C/S为2∶1时,反应结束时N以液态的形式存在较多,说明脱氮效率较低。
外,假设其余转化为含氮气体逸出,各含N物质组分见表2。当电子供体当量越小C/S为2∶1时,反应结束时N以液态的形式存在较多,说明脱氮效率较低。
不同C/S下含氮组分及含硫组分随时间的变化如图3所示。可知:当C/S为8∶1,4∶1,2∶1,2∶3时对应的![]() 反应速率分别为20.00,14.98,12.07,13.9
反应速率分别为20.00,14.98,12.07,13.9 ![]() 去除率为
去除率为![]() 作为中间产物,其最大积累量总体呈现先增加后减少,最大积累量分别为3.09,6.75,9.53,3.67 mg/L,其对微生物的副作用可忽略不计;在电子供体转移过程中,1 mol CH3COO-完全去除需要转移4 mol e-,1 mol S2-完全氧化可转移8 mol e-,在图3中,电子供体总量约为40,24,16,32 mmol/L,说明电子供体过量时,
作为中间产物,其最大积累量总体呈现先增加后减少,最大积累量分别为3.09,6.75,9.53,3.67 mg/L,其对微生物的副作用可忽略不计;在电子供体转移过程中,1 mol CH3COO-完全去除需要转移4 mol e-,1 mol S2-完全氧化可转移8 mol e-,在图3中,电子供体总量约为40,24,16,32 mmol/L,说明电子供体过量时,![]() 积累量相对较小;其中,有机物(CH3COO-)可提供电子供体与无机物(S2-)可提供电子供体之比分别为4∶1、2∶1、1∶1、1∶3,说明当以有机物作为主要电子供体时,脱氮效率较高;通过n(C)/n(S)=8∶1和n(C)/n(S)=4∶1对比可发现,电子供体量(有机物)越高,脱氮效率越高,所需时间也越短。
积累量相对较小;其中,有机物(CH3COO-)可提供电子供体与无机物(S2-)可提供电子供体之比分别为4∶1、2∶1、1∶1、1∶3,说明当以有机物作为主要电子供体时,脱氮效率较高;通过n(C)/n(S)=8∶1和n(C)/n(S)=4∶1对比可发现,电子供体量(有机物)越高,脱氮效率越高,所需时间也越短。
表2 各含N物质组分(氮平衡)
Table 2 Compositions of substances containing nitrogen mg/L

时间/minn(C)/n(S)=8∶1n(C)/n(S)=4∶1n(C)/n(S)=2∶1n(C)/n(S)=2∶3液态N气态N液态N气态N液态N气态N液态N气态N030.000.0030.000.0030.000.0030.000.001020.059.9527.112.8928.949.9528.941.06306.5623.4415.3914.6116.8023.4416.8013.20602.5227.484.3925.6111.2227.4811.2218.78901.1528.852.9727.036.6928.856.6923.311200.1729.831.8028.207.1329.837.1322.87
![]()
![]()
图3 不同C/S下含氮组分及含硫组分随时间的变化
Fig.3 Variation of nitrogen and sulfur containing components with time at different C/S
2.1.2 不同C/S条件下COD变化
有机碳源和S2-以COD的形式呈现(图4),COD的下降主要集中在0~60 min,即![]() 的还原过程主要发生在这一阶段,而后随着电子受体的大量减少,COD消耗缓慢。进水中COD不断增多的情况下,在C/S为8∶1,4∶1,2∶1,2∶3条件下COD消耗量分别为156.5,136.9,62.1,143.5 mg/L,随着COD消耗量的减少,脱氮效率降低,说明
的还原过程主要发生在这一阶段,而后随着电子受体的大量减少,COD消耗缓慢。进水中COD不断增多的情况下,在C/S为8∶1,4∶1,2∶1,2∶3条件下COD消耗量分别为156.5,136.9,62.1,143.5 mg/L,随着COD消耗量的减少,脱氮效率降低,说明![]() 作为有限的电子受体时,过量的电子供体不仅提高了反硝化菌、DNRA过程菌对
作为有限的电子受体时,过量的电子供体不仅提高了反硝化菌、DNRA过程菌对![]() 的获取能力,同时更有助于脱氮。而在n(C)/n(S)=2∶1情况下,有机物消耗量较少,电子供体明显不足,导致脱氮效果不佳。
的获取能力,同时更有助于脱氮。而在n(C)/n(S)=2∶1情况下,有机物消耗量较少,电子供体明显不足,导致脱氮效果不佳。
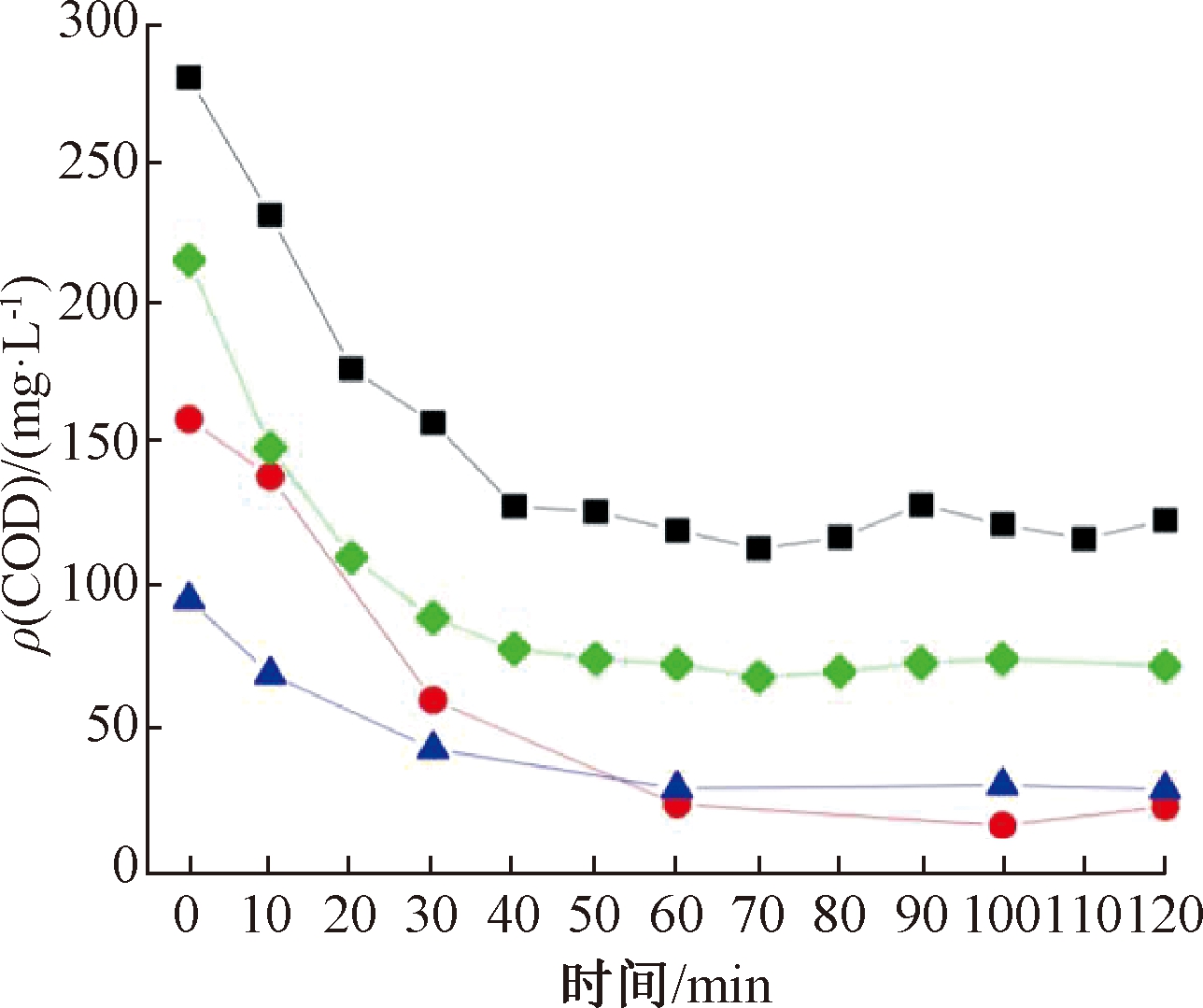
![]() —n(C)/n(S)=8∶1;
—n(C)/n(S)=8∶1;![]() —n(C)/n(S)=4∶1;
—n(C)/n(S)=4∶1;![]() —n(C)/n(S)=2∶1;
—n(C)/n(S)=2∶1;![]() —n(C)/n(S)=2∶3。
—n(C)/n(S)=2∶3。
图4 不同C/S下COD随时间变化
Fig.4 Variation of COD under different C/S
综上,在同时投加有机碳源和硫化物作为电子供体的混养系统内,通过改变C/S,发现较高的COD会促进![]() 的去除。
的去除。
由于初始溶液中![]() 受限,即电子受体有限,在有机碳源发生变化后,异养反硝化菌与自养反硝化菌会对
受限,即电子受体有限,在有机碳源发生变化后,异养反硝化菌与自养反硝化菌会对![]() 产生竞争,说明在单独改变C/S的同时,系统内的微生物竞争关系会发生明显的改变。不断降低C/S,会对系统内的硫自养反硝化过程产生间接的影响,硫自养反硝化速率加快,导致硫自养反硝化占比增大。
产生竞争,说明在单独改变C/S的同时,系统内的微生物竞争关系会发生明显的改变。不断降低C/S,会对系统内的硫自养反硝化过程产生间接的影响,硫自养反硝化速率加快,导致硫自养反硝化占比增大。
由图3及含硫各物质组分(表3)可知:在![]() 去除过程中,具有还原性较强的S2-参与硫自养反硝化过程,进一步转化为
去除过程中,具有还原性较强的S2-参与硫自养反硝化过程,进一步转化为![]() 等物质[6-8],且含S中间物质均呈现先升高后降低现象。此处以n(C)/n(S)=2∶3为例,在图3d中,前20 min,足量的电子供体导致脱氮反应速度缓慢,
等物质[6-8],且含S中间物质均呈现先升高后降低现象。此处以n(C)/n(S)=2∶3为例,在图3d中,前20 min,足量的电子供体导致脱氮反应速度缓慢,![]() 波动较小,表3中n(C)/n(S)=2∶3时含S中间物质在30 min达到峰值,说明此阶段主要转换为
波动较小,表3中n(C)/n(S)=2∶3时含S中间物质在30 min达到峰值,说明此阶段主要转换为![]() 等中间产物,其后
等中间产物,其后![]() 和S2-均呈现增长迅速,而其他含S物质减少,说明含S中间产物作为电子供体参与硝酸盐、硫酸盐的还原过程。而初期硫酸盐的存在是由于日常含S进水生成的过量硫酸盐在微生物膜表面有附着,导致生物膜上一直有硫酸盐的积累[9]。
和S2-均呈现增长迅速,而其他含S物质减少,说明含S中间产物作为电子供体参与硝酸盐、硫酸盐的还原过程。而初期硫酸盐的存在是由于日常含S进水生成的过量硫酸盐在微生物膜表面有附着,导致生物膜上一直有硫酸盐的积累[9]。
如表3、图3a、3d所示,在n(C)/n(S)=8∶1、n(C)/n(S)=2∶3条件下,由于电子供体的过量,S2-浓度整体均呈现先消耗后再次产生的现象,同时再次产生的时间分别为40,30 min,反应后期S2-浓度分别为13.9,21.6 mg/L,说明前期S2-消耗主要是由于硫自养反硝化,而后期S2-的生成是由于系统中存在的硫酸盐还原菌利用剩余的COD对硫酸盐、单质硫及不稳定的含硫化合物进行还原而产生[9]。在n(C)/n(S)=4∶1、n(C)/n(S)=2∶1中,S2-的去除率较高,可达到98.58%和100%;n(C)/n(S)=8∶1、n(C)/n(S)=2∶3时仅分别为56.56%和49.23%。
如图3所示,在n(C)/n(S)=8∶1、n(C)/n(S)=4∶1、n(C)/n(S)=2∶1、n(C)/n(S)=2∶3条件下,![]() 在各反应条件下达到的峰值分别为12.5,14,18.2,34.2 mg/L,净生成量分别为3.9,14.9,11.7,22.5 mg/L;通过图3c、3d在进水中电子供体明显增多后,电子受体有限,异养反硝化竞争能力减弱,导致自养反硝化菌对
在各反应条件下达到的峰值分别为12.5,14,18.2,34.2 mg/L,净生成量分别为3.9,14.9,11.7,22.5 mg/L;通过图3c、3d在进水中电子供体明显增多后,电子受体有限,异养反硝化竞争能力减弱,导致自养反硝化菌对![]() 的获取能力相对增强,S2-无法传递更多的电子转化为
的获取能力相对增强,S2-无法传递更多的电子转化为![]() 而是转化为含硫中间产物,导致
而是转化为含硫中间产物,导致![]() 的净生成量会明显下降;同时反应器水样表面有白色悬浮层,可能是单质硫,这在Dolejs等[10]和Moraes等[2]研究中均得到了验证。
的净生成量会明显下降;同时反应器水样表面有白色悬浮层,可能是单质硫,这在Dolejs等[10]和Moraes等[2]研究中均得到了验证。
表3 含S各物质组分
Table 3 Compositions of substances containing sulfur mg/L
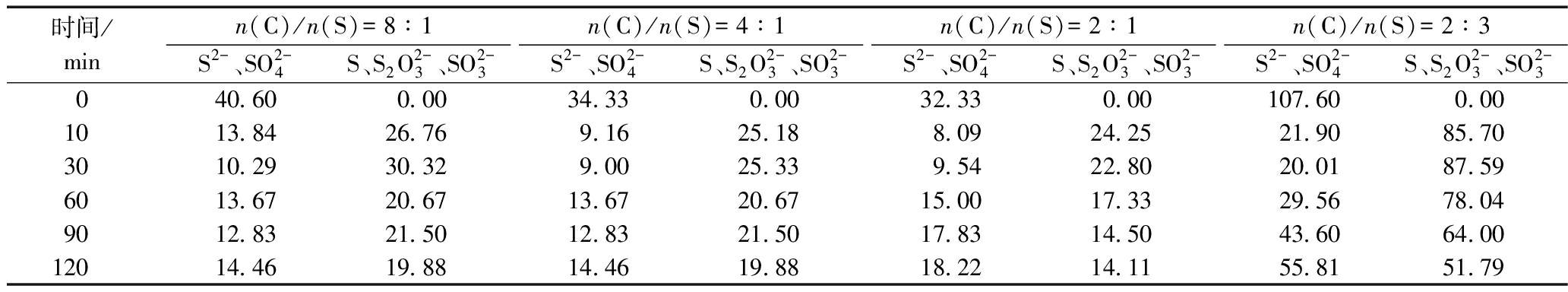
时间/minn(C)/n(S)=8∶1n(C)/n(S)=4∶1n(C)/n(S)=2∶1n(C)/n(S)=2∶3S2-、SO2-4S、S2O2-3、SO2-3S2-、SO2-4S、S2O2-3、SO2-3S2-、SO2-4S、S2O2-3、SO2-3S2-、SO2-4S、S2O2-3、SO2-3040.600.0034.330.0032.330.00107.600.001013.8426.769.1625.188.0924.2521.9085.703010.2930.329.0025.339.5422.8020.0187.596013.6720.6713.6720.6715.0017.3329.5678.049012.8321.5012.8321.5017.8314.5043.6064.0012014.4619.8814.4619.8818.2214.1155.8151.79
注:各组分质量按所含S元素计。
综上所述,在前期电子供体充足的情况下,硫自养反硝化生成硫酸盐及含硫中间产物;当电子受体消耗完时,硫酸盐还原菌利用剩余COD将不稳定含硫化合物还原为S2-,降低了S2-的去除效率。
如图![]() 在整个过程中均可以检测到,出水分别为1.7,4.9 mg/L;图3c n(C)/n(S)=2∶1条件下全过程未检测到
在整个过程中均可以检测到,出水分别为1.7,4.9 mg/L;图3c n(C)/n(S)=2∶1条件下全过程未检测到![]() 产生;如图3a所示,
产生;如图3a所示,![]() 在部分过程段可检测到,总体趋势呈先上升后降低至零。S2-在快速消耗的同时,
在部分过程段可检测到,总体趋势呈先上升后降低至零。S2-在快速消耗的同时,![]() 的产生是由于初期电子供体足够且少量的
的产生是由于初期电子供体足够且少量的![]() 存在条件下发生的DNRA现象,Eveline等[11]也认为电子供体充足且
存在条件下发生的DNRA现象,Eveline等[11]也认为电子供体充足且![]() 受限的环境下有利于DNRA过程的产生。分析不同条件下
受限的环境下有利于DNRA过程的产生。分析不同条件下![]() 转移路径占比(表4)可知,n(C)/n(S)=2∶3条件下,DNRA路径可达到16.3%。
转移路径占比(表4)可知,n(C)/n(S)=2∶3条件下,DNRA路径可达到16.3%。
表4 不同![]() 转移路径占比
转移路径占比
Table 4 Proportions of different ![]() transition paths %
transition paths %
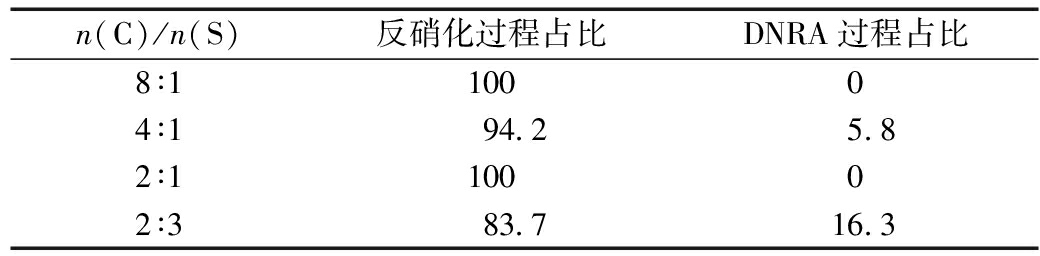
n(C)/n(S)反硝化过程占比DNRA过程占比8∶110004∶194.25.82∶110002∶383.716.3
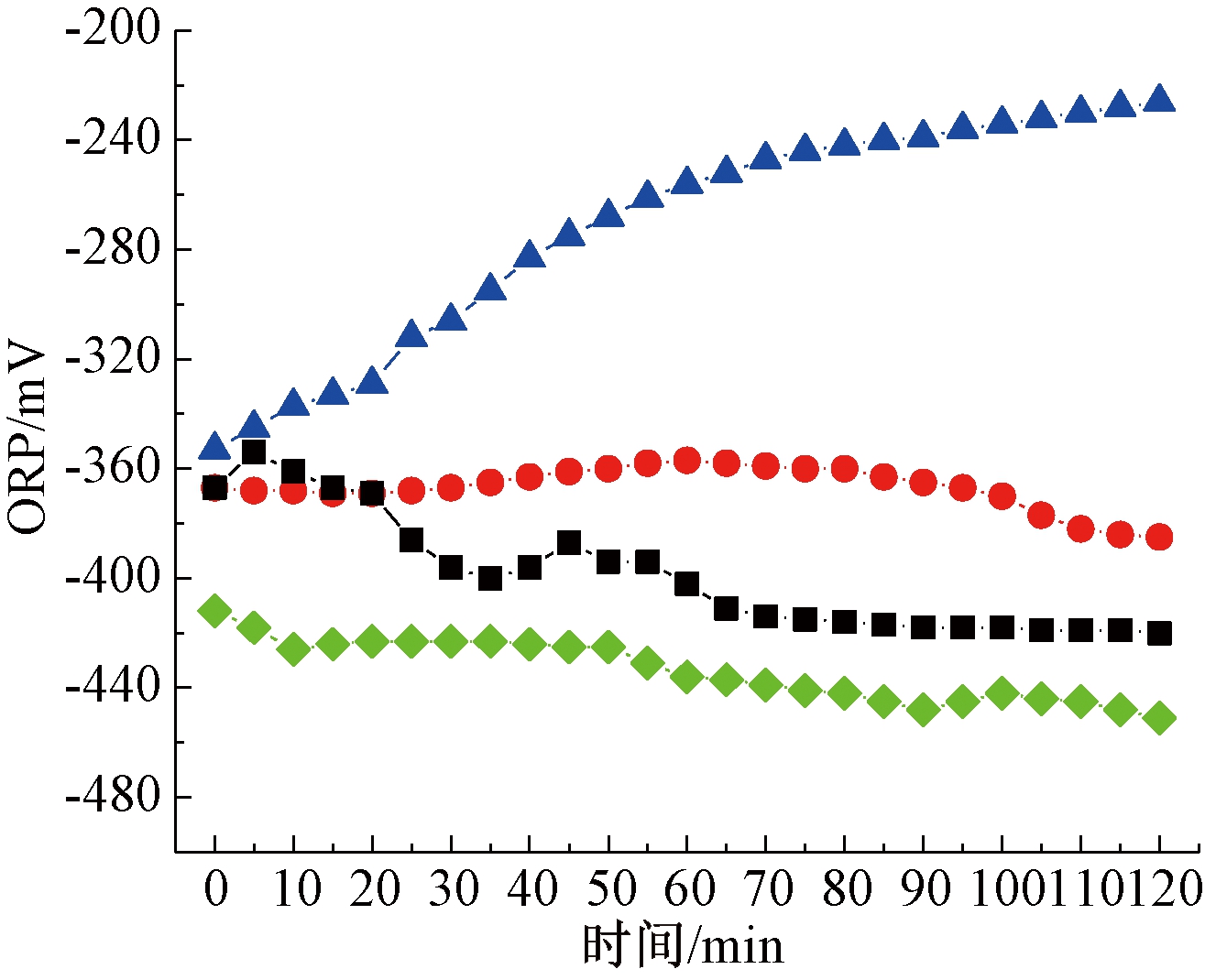
在不断改变C/S后,异养反硝化与自养反硝化占比在不同阶段会有明显差异,间接导致系统内ORP及pH发生不同的变化。
不同C/S下ORP随时间变化如图5所示,在n(C)/n(S)=8∶1条件下ORP整体呈现逐渐下降的状态;n(C)/n(S)=4∶1条件下ORP变化范围较小;n(C)/n(S)=2∶1条件下,ORP呈现上升现象,硝酸盐物质剩余较多,说明电子供体不足导致脱氮效率低;n(C)/n(S)=2∶3条件下,呈现逐渐降低的现象,同时全过程均保持在<-400 mV,说明此条件下电子供体完全过量,反硝化速率相对较快。n(C)/n(S)=2∶3条件中0~10 min ORP快速下降,此时电子供体优先选择![]() 作为电子受体并将其还原为
作为电子受体并将其还原为![]() 可将其作为
可将其作为![]() 还原的指示点;10~50 min有一个平台期,主要是
还原的指示点;10~50 min有一个平台期,主要是![]() 作为电子受体进行反硝化,而后ORP呈现持续降低,电子受体减少,电子供体相对过量,同时伴随S2-的还原。
作为电子受体进行反硝化,而后ORP呈现持续降低,电子受体减少,电子供体相对过量,同时伴随S2-的还原。
![]() —n(C)/n(S)=8∶1;
—n(C)/n(S)=8∶1;![]() —n(C)/n(S)=4∶1;
—n(C)/n(S)=4∶1;![]() —n(C)/n(S)=2∶1;
—n(C)/n(S)=2∶1;![]() —n(C)/n(S)=2∶3。
—n(C)/n(S)=2∶3。
图5 不同C/S下ORP随时间变化
Fig.5 Variation of ORP with time under different C/S
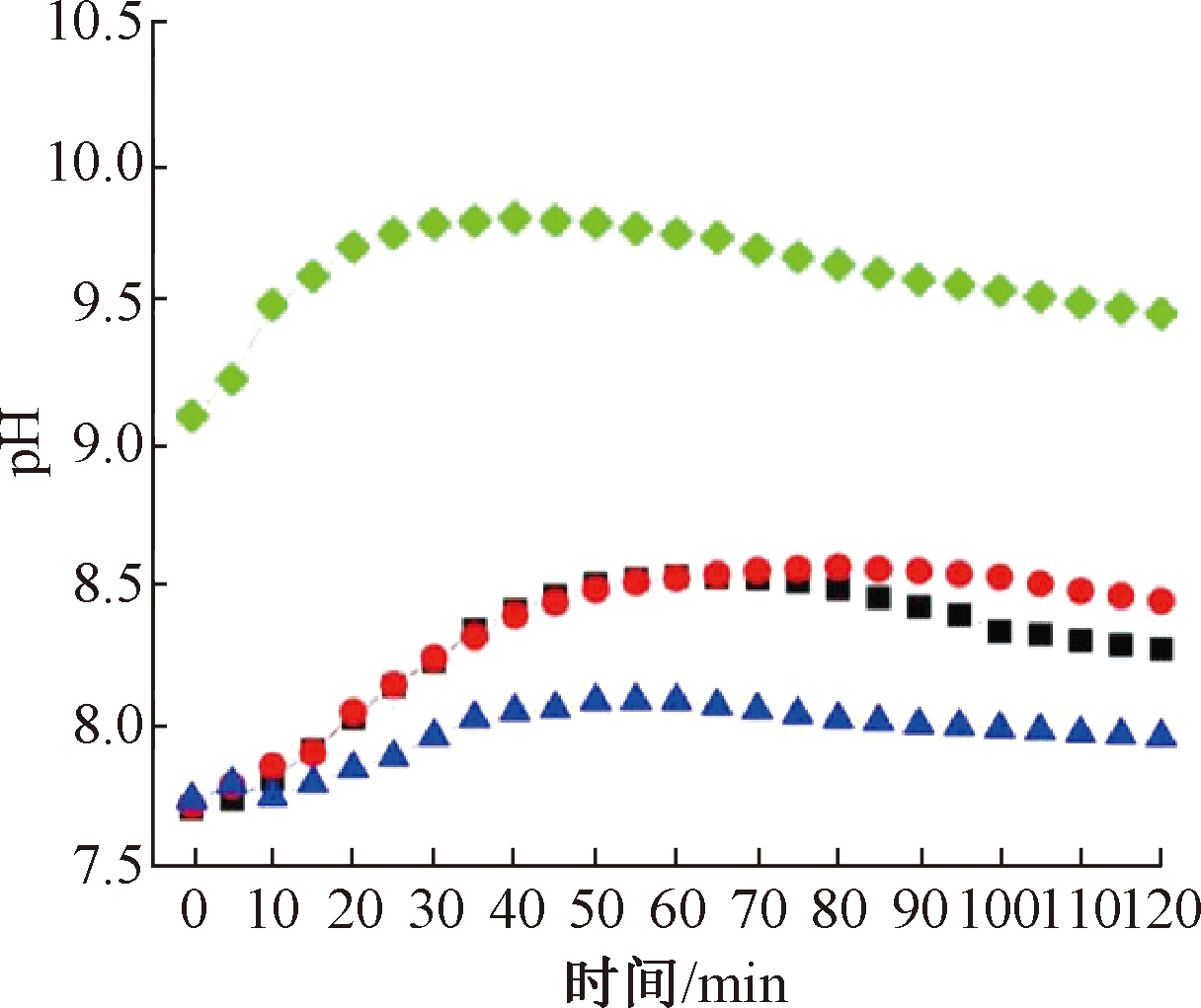
不同C/S下pH随时间变化如图6所示,pH变化趋势基本一致,前期由于反硝化阶段消耗氮源,释放OH-,导致pH上升,后期硫酸盐还原菌进行还原反应消耗OH-,产生S2-,所以导致pH下降并趋于稳定。实验中n(C)/n(S)=2∶1、n(C)/n(S)=2∶3条件下,pH上限依次升高,说明随着C/S下降,自养反硝化过程逐渐占优;同时反硝化过程中消耗同样的电子受体,S2-比有机碳源产生更多的OH-。n(C)/n(S)=8∶1、n(C)/n(S)=4∶1、n(C)/n(S)=2∶1、n(C)/n(S)=2∶3条件下,pH的峰值分别出现在10,50,50,30 min,基本与COD变化相吻合,而与S2-相比,有一定时间的延后性,说明pH可以为混养状态下反硝化过程提供指示作用。
![]() —n(C)/n(S)=8∶1;
—n(C)/n(S)=8∶1;![]() —n(C)/n(S)=4∶1;
—n(C)/n(S)=4∶1;![]() —n(C)/n(S)=2∶1;
—n(C)/n(S)=2∶1;![]() —n(C)/n(S)=2∶3。
—n(C)/n(S)=2∶3。
图6 不同C/S下pH随时间变化
Fig.6 Variation of pH with time under different C/S
1)随着C/S逐渐降低,在电子供体足够的情况下,反硝化脱氮途径中自养反硝化过程逐渐占优,自养反硝化过程中S2-的消耗速率增大,系统中![]() 去除率较高,可达到92%以上。
去除率较高,可达到92%以上。
2)在n(C)/n(S)=4∶1中,S2-的去除率较高,可达到98.58%。在前期电子供体充足的情况下,硫自养反硝化生成硫酸盐;当电子受体不足时,硫酸盐还原菌利用剩余COD将不稳定含硫化合物还原为S2-,降低了S2-的去除效率。
3)在n(C)/n(S)=4∶1、n(C)/n(S)=2∶3情况下,有机物作为电子供体过量,出水中出现![]() 说明有DNRA现象出现。同时,在n(C)/n(S)=2∶3条件下,
说明有DNRA现象出现。同时,在n(C)/n(S)=2∶3条件下,![]() 可达到4.9 mg/L,DNRA现象最显著。
可达到4.9 mg/L,DNRA现象最显著。
[1] 郭磊, 王爱杰, 刘春爽, 等.碳氮比对碳氮硫同步脱除的影响[J].给水排水, 2008, 34(增刊1):224-227.
[2] Moraes B S,Foresti E.Determination of the intrinsic kinetic parameters of sulfide-oxidizing autotrophic denitrification in differential reactors containing immobilized biomass[J].Bioresource Technology, 2012, 104:250-256.
[3] Vitousek P M, Tilman D G.Technical report: human alteration of the global nitrogen cycle: sources and consequences[J].Ecological Applications, 1997, 7(3): 737-750.
[4] Giblin A E, Tobias C R, Song B, et al.The importance of dissimilatory nitrate reduction to ammonium (DNRA)in the nitrogen cycle of coastal ecosystems [J].Oceanography, 2013, 26(3):124-131.
[5] 国家环境保护总局,水和废水监测分析方法编委会.水和废水监测分析方法[M].4版.北京: 中国环境科学出版社, 2002.
[6] 刘春爽, 李甲国, 闫来洪, 等.废水中硫化物、硝酸盐和氨氮生物同步去除及其机理[J].化工学报, 2014, 66(2):300-305.
[7] Xu X J, Chen C, Wang A J, et al.Simultaneous removal of sulfide, nitrate and acetate under denitrifying sulfide removal condition: Modeling and experimental validation[J].Journal of Hazardous Materials, 2014, 264:16-24.
[8] Xu X J, Chen C, Lee D J, et al.Sulfate-reduction, sulfide-oxidation and elemental sulfur bioreduction process: modeling and experimental validation[J].Bioresource Technology, 2013, 147(11):202-211.
[9] 刘双,赵剑强,王莎,等.硫自养与异养混合![]() 反硝化过程铵生成机制[J].环境工程学报,2019,13(6).
反硝化过程铵生成机制[J].环境工程学报,2019,13(6).
[10] Dolejs P, LadislavPaclík, Maca J, et al.Effect of S/N ratio on sulfide removal by autotrophic denitrification[J].Applied Microbiology and Biotechnology, 2015, 99(5):2383-2392.
[11] Eveline M,van den Berg.Enrichment of DNRA bacteria in a continuous culture[J].The ISME Journal,2015,9(10):2153-2161.
[12] 张新艳, 彭党聪, 万琼, 等.活性污泥中![]() 异化还原成铵(DNRA)过程及其影响因素[J].环境保护前沿, 2018, 8(2): 95-105.
异化还原成铵(DNRA)过程及其影响因素[J].环境保护前沿, 2018, 8(2): 95-105.