硝酸盐![]() 和铵
和铵![]() 会对水体环境产生重大影响[1]。水生生态系统中过量的无机氮会导致富营养化,使有害藻类大量繁殖[2,3]。硫化物是一种有毒、腐蚀性和高化学需氧量(COD)的化合物,浓度低至10 mg/L时仍对人体健康有害[4,5]。
会对水体环境产生重大影响[1]。水生生态系统中过量的无机氮会导致富营养化,使有害藻类大量繁殖[2,3]。硫化物是一种有毒、腐蚀性和高化学需氧量(COD)的化合物,浓度低至10 mg/L时仍对人体健康有害[4,5]。
硫自养反硝化使用还原性的硫化合物![]() 作为电子供体,来还原
作为电子供体,来还原![]() 或其他氧化态的氮化合物[6,7]。硫自养反硝化过程有3个主要优点:不需要外加碳源,污泥产量低,在一个过程中可同时去除硫化物和
或其他氧化态的氮化合物[6,7]。硫自养反硝化过程有3个主要优点:不需要外加碳源,污泥产量低,在一个过程中可同时去除硫化物和![]()
然而在![]() 浓度有限,硫化物浓度较高的条件下,会出现硝酸盐异化还原成铵(DNRA)的现象[9,10]。高浓度的硫化物会抑制反硝化,并作为额外的电子供体来刺激DNRA[11]。DNRA过程可分为2个步骤[12,13]:第1步是
浓度有限,硫化物浓度较高的条件下,会出现硝酸盐异化还原成铵(DNRA)的现象[9,10]。高浓度的硫化物会抑制反硝化,并作为额外的电子供体来刺激DNRA[11]。DNRA过程可分为2个步骤[12,13]:第1步是![]() 还原为
还原为![]() 第2步是
第2步是![]() 还原成
还原成![]() 在这个过程中,
在这个过程中,![]() 和
和![]() 绕过反硝化和N2固定直接转化为
绕过反硝化和N2固定直接转化为![]() 因此,DNRA也被称为“生物氮循环中的短路”[14,15]。而且,DNRA过程也普遍存在于活性污泥系统和其他生物脱氮系统中[16,17]。越来越多的研究表明,DNRA是一种不可忽视的氮循环途径。
因此,DNRA也被称为“生物氮循环中的短路”[14,15]。而且,DNRA过程也普遍存在于活性污泥系统和其他生物脱氮系统中[16,17]。越来越多的研究表明,DNRA是一种不可忽视的氮循环途径。
本研究采用SBBR反应器,以![]() 和硫化物为底物,研究不同硫化物浓度对
和硫化物为底物,研究不同硫化物浓度对![]() 自养反硝化产物的影响,初步探讨了
自养反硝化产物的影响,初步探讨了![]() 自养反硝化系统中DNRA的形成机制与环境条件,为硫自养反硝化的实际应用提供参考。
自养反硝化系统中DNRA的形成机制与环境条件,为硫自养反硝化的实际应用提供参考。
实验使用SBBR反应器,用2 L玻璃烧杯搭建而成,烧杯内悬挂生物膜载体。生物膜载体使用单元直径为150 mm的聚酯纤维组合填料。在实验期间,反应器用锡箔纸进行避光处理,以防止光合细菌和藻类的繁殖[7]。使用恒温磁力搅拌器进行搅拌和温度控制,转速控制在350~450 r/min,温度控制在(25±1)℃。
接种污泥取自西安市邓家村污水处理厂二沉池配水井。实验采用人工进水,排水比约为100%,水力停留时间为12 h。实验进水为人工模拟废水,进水主要成分为NaNO3 180 mg/L、KH2PO4 350 mg/L、NaHCO3 400 mg/L、微量元素1 mL/L。不同S/N实验方案如表1所示。
表1 不同S/N实验方案
Table 1 Experimental scheme with different S/N
n(S)/n(N)1∶11.3∶11.5∶11.7∶1ρ(Na2S·9H2O)/(mg·L-1)515671775877
反应器连续运行2个月后,![]() 去除率均可到达98%以上,在此稳定条件下,通过改变硫化物浓度进行自养反硝化产物研究。
去除率均可到达98%以上,在此稳定条件下,通过改变硫化物浓度进行自养反硝化产物研究。
过程曲线测定开始前先曝N2以吹脱清水中的溶解氧(DO),以得到低氧(ρ(DO)<0.3 mg/L)环境,同时将清水加热到25 ℃。为了减少生物膜自身储存物质以及上一周期反应剩余物质的影响,在每组实验开始前,先进行洗泥。向烧杯中加入2 L清水,完全浸没生物膜,搅拌5 min,然后静置10 min,最后将水全部排出烧杯,重复3次。然后向反应器中加入1.95 L、25 ℃的低氧温水。把药剂用低氧温水溶解于50 mL的烧杯中,快速加入反应器,轻轻搅拌均匀,然后放入生物膜。每隔一段时间进行取样待测。所有样品均使用0.45 μm滤膜进行预处理。
![]() 和S2--S的测定均采用国家标准方法[18]测定,
和S2--S的测定均采用国家标准方法[18]测定,![]() 测定使用SulfaVer 4试剂粉枕包法[19](HACH,美国),pH和DO使用德国Multi 3630 IDS数字化便携多参数水质分析仪监测,氧化还原电位(ORP)使用雷磁PHSJ-3F实验室ORP计监测。
测定使用SulfaVer 4试剂粉枕包法[19](HACH,美国),pH和DO使用德国Multi 3630 IDS数字化便携多参数水质分析仪监测,氧化还原电位(ORP)使用雷磁PHSJ-3F实验室ORP计监测。
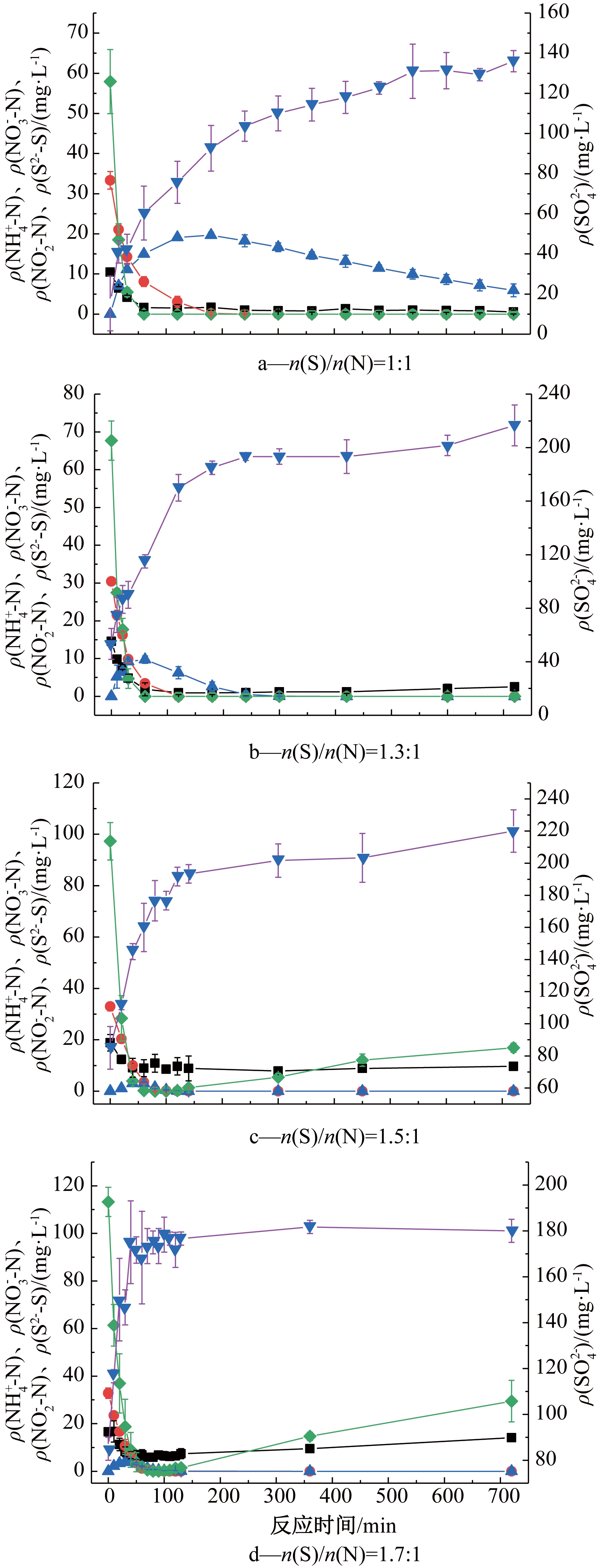
不同S/N下各组分浓度随时间的变化情况如图1所示。n(S)/n(N)=1∶1时(图1a),12 h内![]() 可以完全反应,但是
可以完全反应,但是![]() 有积累,说明此时电子供体(硫化物)不足。增大n(S)/n(N),如图1b、1c、1d所示,系统反应周期缩短,无
有积累,说明此时电子供体(硫化物)不足。增大n(S)/n(N),如图1b、1c、1d所示,系统反应周期缩短,无![]() 的积累。随着n(S)/n(N)的增加,
的积累。随着n(S)/n(N)的增加,![]() 的去除速率越来越快,
的去除速率越来越快,![]() 的还原速率分别为
的还原速率分别为![]() 还原所需的时间也越来越短。
还原所需的时间也越来越短。
![]()
![]()
图1 不同S/N下各组分浓度随时间的变化情况
Fig.1 The variation of concentration of each component under different S/N with time
在n(S)/n(N)=1∶1、n(S)/n(N)=1.3∶1和n(S)/n(N)=1.5∶1的条件下,S2--S在1 h内耗尽,但![]() 的产生和
的产生和![]() 以及
以及![]() 的消耗持续进行,超过1 h。表明这个过程有2个步骤[20]:1)硫化物先氧化成元素硫或者硫的其他形态;2)再将其氧化成硫酸盐。4个条件下消耗的S2--S浓度均高于整个反应期间产生的
的消耗持续进行,超过1 h。表明这个过程有2个步骤[20]:1)硫化物先氧化成元素硫或者硫的其他形态;2)再将其氧化成硫酸盐。4个条件下消耗的S2--S浓度均高于整个反应期间产生的![]() 的浓度,这可能是由于硫的其他中间化合物的形成[21,22]。实验开始时就可以检测到
的浓度,这可能是由于硫的其他中间化合物的形成[21,22]。实验开始时就可以检测到![]() 这是因为实验前的洗泥,也很难将积累
这是因为实验前的洗泥,也很难将积累![]() 完全清洗干净。在n(S)/n(N)=1.5∶1时,观察到反应器表面有一层白色胶状薄膜。在n(S)/n(N)=1.7∶1时,
完全清洗干净。在n(S)/n(N)=1.5∶1时,观察到反应器表面有一层白色胶状薄膜。在n(S)/n(N)=1.7∶1时,![]() 的产生在
的产生在![]() 以及
以及![]() 反应完时也几乎停止,生物膜菌丝上出现了白色颗粒物质附着的现象,导致部分菌丝变白。很有可能是单质硫的产生,有研究也发现了类似的现象[21,22]。
反应完时也几乎停止,生物膜菌丝上出现了白色颗粒物质附着的现象,导致部分菌丝变白。很有可能是单质硫的产生,有研究也发现了类似的现象[21,22]。
n(S)/n(N)=1.5∶1和n(S)/n(N)=1.7∶1时,反应后期系统内又出现了S2--S。很可能是因为S/N过高,而电子受体不足,加上系统的ORP很低,使部分硫的其他形态又还原为S2--S。
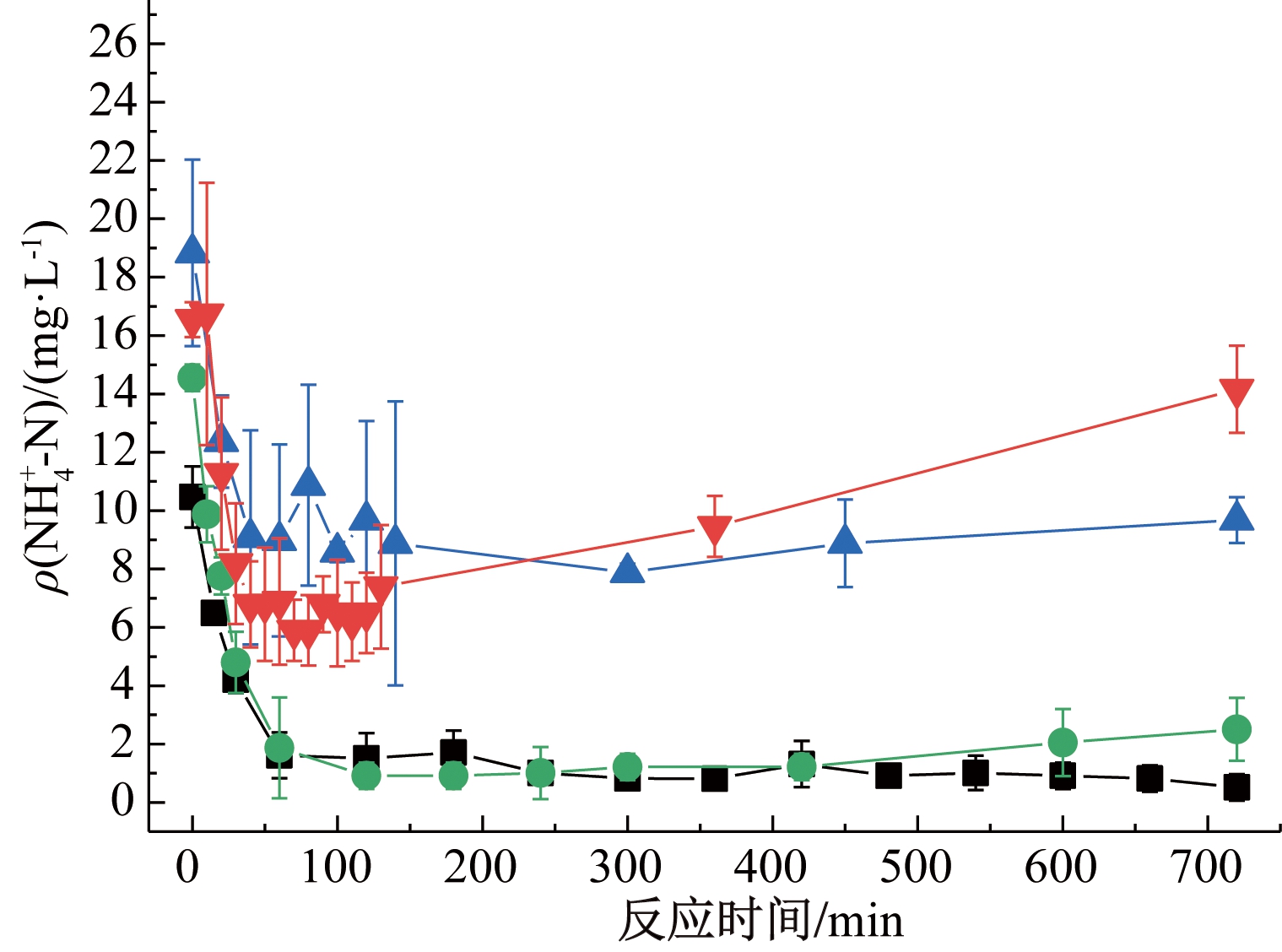
不同S/N下系统![]() 随时间变化的情况如图2所示。实验开始时就可以测到高浓度的
随时间变化的情况如图2所示。实验开始时就可以测到高浓度的![]() 这是因为高浓度的S2--S会影响
这是因为高浓度的S2--S会影响![]() 的测定。S2--S与纳氏试剂反应产生黄色产物,在420 nm波长下也有较强的吸收。当ρ(S2--S)<0.80 mg/L对
的测定。S2--S与纳氏试剂反应产生黄色产物,在420 nm波长下也有较强的吸收。当ρ(S2--S)<0.80 mg/L对![]() 测定结果影响不大[23]。
测定结果影响不大[23]。
![]() —n(S)/n(N)=1∶1;
—n(S)/n(N)=1∶1;![]() —n(S)/n(N)=1.3∶1;
—n(S)/n(N)=1.3∶1;![]() —n(S)/n(N)=1.5∶1;
—n(S)/n(N)=1.5∶1;![]() —n(S)/n(N)=1.7∶1。
—n(S)/n(N)=1.7∶1。
图2 不同S/N下系统![]() 随时间变化的情况
随时间变化的情况
Fig.2 The variation of ![]() with time under different S/N
with time under different S/N
在n(S)/n(N)=1∶1和n(S)/n(N)=1.3∶1时,出水可以监测到![]() 的产生但浓度均较小,分别为(0.51±0.45),(2.51±1.08)mg/L。产生
的产生但浓度均较小,分别为(0.51±0.45),(2.51±1.08)mg/L。产生![]() 可能有2个原因:1)部分去除的
可能有2个原因:1)部分去除的![]() 通过DNRA转化为
通过DNRA转化为![]() 自养环境引起的内源性衰变,污泥(主要是异养污泥)正在适应[21]。
自养环境引起的内源性衰变,污泥(主要是异养污泥)正在适应[21]。
n(S)/n(N)=1.5∶1时,系统不仅进行了自养反硝化,还出现了DNRA现象。![]() 的浓度明显增多,系统内
的浓度明显增多,系统内![]() 最高可达(10.87±3.44)mg/L。硫化物浓度的增加,会抑制反硝化作用,从而驱动部分电子从S2-转移到NH4+[11],通过DNRA过程产生铵。n(S)/n(N)=1.7∶1时,130 min的
最高可达(10.87±3.44)mg/L。硫化物浓度的增加,会抑制反硝化作用,从而驱动部分电子从S2-转移到NH4+[11],通过DNRA过程产生铵。n(S)/n(N)=1.7∶1时,130 min的![]() 为(7.39±2.12)mg/L,并没有随S/N的增加而进一步上升。在n(S)/n(N)=1.5∶1和n(S)/n(N)=1.7∶1时,反应后期又检测到
为(7.39±2.12)mg/L,并没有随S/N的增加而进一步上升。在n(S)/n(N)=1.5∶1和n(S)/n(N)=1.7∶1时,反应后期又检测到![]() 的上升,这是由于系统中又出现了S2--S,对
的上升,这是由于系统中又出现了S2--S,对![]() 浓度的测定产生影响。
浓度的测定产生影响。
DNRA过程的出现不利于系统脱氮效率的提升。n(S)/n(N)=1∶1时,![]() 积累,TN去除率仅为83%。n(S)/n(N)=1.3∶1时,发生完整的硫自养反硝化过程,TN去除率为94.8%。n(S)/n(N)=1.5∶1时,出现DNRA现象,产生了
积累,TN去除率仅为83%。n(S)/n(N)=1.3∶1时,发生完整的硫自养反硝化过程,TN去除率为94.8%。n(S)/n(N)=1.5∶1时,出现DNRA现象,产生了![]() 去除率下降为79.7%。n(S)/n(N)=1.7∶1时,DNRA现象相对减弱,此时TN去除率又上升为85%。
去除率下降为79.7%。n(S)/n(N)=1.7∶1时,DNRA现象相对减弱,此时TN去除率又上升为85%。
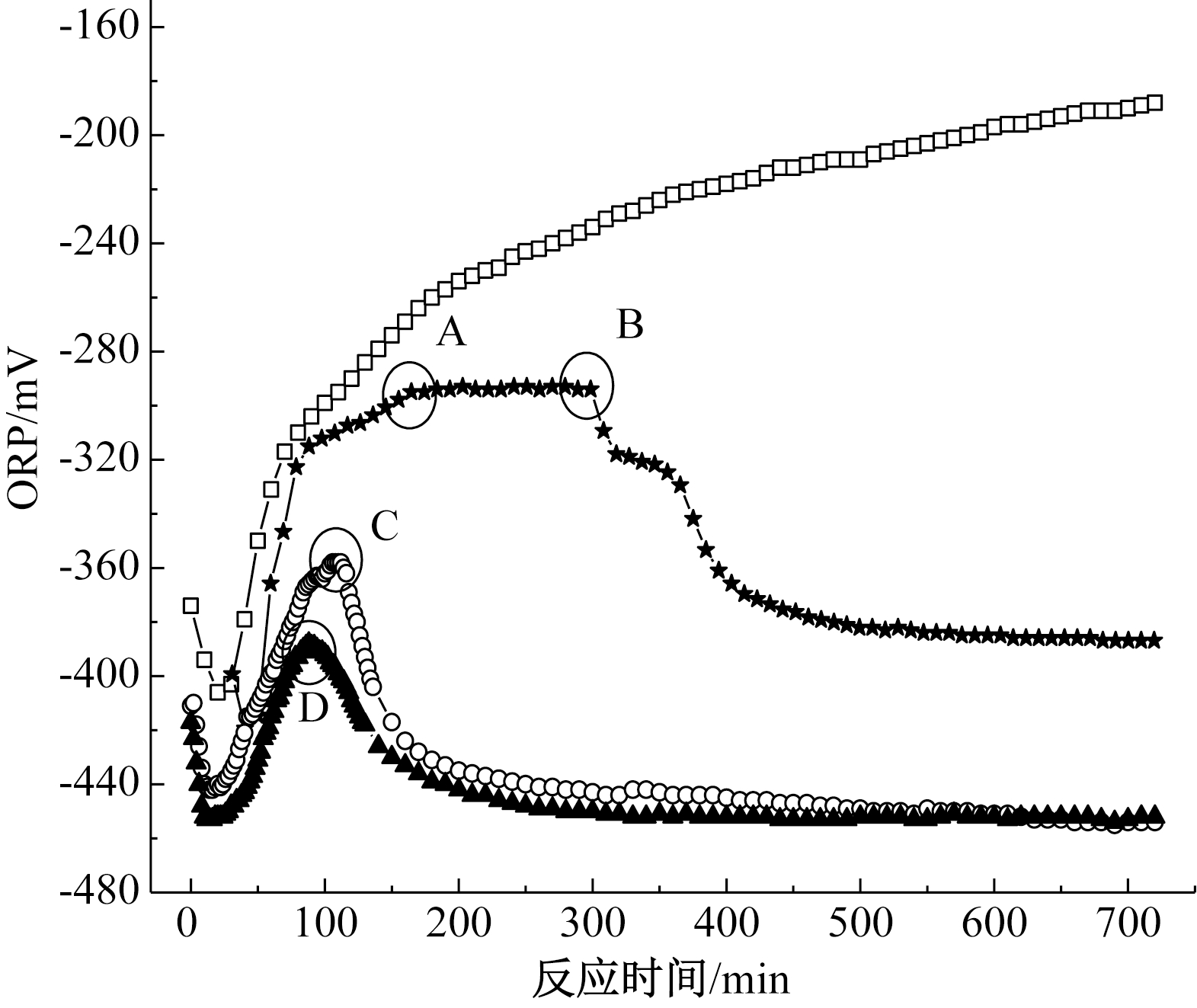
不同S/N下系统各组分浓度与ORP随时间的变化情况如图3所示。ORP与系统中氧化还原物质的种类、浓度以及发生的氧化还原反应的类型有关,因此,在污水处理工艺中可以利用ORP来观察和控制反应进程[24,25]。在n(S)/n(N)=1∶1时,电子供体不足,系统中有![]() 积累,此时ORP保持一直上升的趋势。而在n(S)/n(N)=1.3∶1时,120 min时
积累,此时ORP保持一直上升的趋势。而在n(S)/n(N)=1.3∶1时,120 min时![]() 反应完全,此时ORP对应图3的A点,出现一个拐点,称其为
反应完全,此时ORP对应图3的A点,出现一个拐点,称其为![]() 膝点。随后ORP保持一个平台期,系统中
膝点。随后ORP保持一个平台期,系统中![]() 继续反应,在300 min反应完全,ORP又出现一个拐点,如图3的B点,称其为
继续反应,在300 min反应完全,ORP又出现一个拐点,如图3的B点,称其为![]() 膝点。至此,系统整个硫自养反硝化反应完毕,ORP开始下降。
膝点。至此,系统整个硫自养反硝化反应完毕,ORP开始下降。
![]() —n(S)/n(N)=1∶1;
—n(S)/n(N)=1∶1;![]() —n(S)/n(N)=1.3∶1;
—n(S)/n(N)=1.3∶1;![]() —n(S)/n(N)=1.5∶1;
—n(S)/n(N)=1.5∶1;![]() —n(S)/n(N)=1.7∶1。
—n(S)/n(N)=1.7∶1。
图3 不同S/N下系统ORP随时间的变化情况
Fig.3 The variation of ORP in the system under different S/N
继续增加S/N,在n(S)/n(N)=1.5∶1时,整个反应过程持续时间![]() 膝点A和
膝点A和![]() 膝点B重合为一点,如图3中的C点,此时系统内
膝点B重合为一点,如图3中的C点,此时系统内![]() 和
和![]() 同时反应完全,随后ORP开始下降。在n(S)/n(N)=1.7∶1时,整个反应过程持续时间<100 min,膝点D的ORP更低,低于-380 mV。在n(S)/n(N)=1.5∶1和n(S)/n(N)=1.7∶1时,系统同时存在硫自养反硝化和DNRA 2个反应过程,而ORP只有1个膝点。因此,ORP既可以间接指示系统内反应的进程,也可以间接指示反应的类型。
同时反应完全,随后ORP开始下降。在n(S)/n(N)=1.7∶1时,整个反应过程持续时间<100 min,膝点D的ORP更低,低于-380 mV。在n(S)/n(N)=1.5∶1和n(S)/n(N)=1.7∶1时,系统同时存在硫自养反硝化和DNRA 2个反应过程,而ORP只有1个膝点。因此,ORP既可以间接指示系统内反应的进程,也可以间接指示反应的类型。
有研究指出,在硫自养与异养混合亚硝酸盐反硝化过程中,ORP持续稳定在-400 mV以下时,也会出现DNRA现象[26]。在自养系统中,出现DNRA现象时ORP没有持续保持在-400 mV以下,但也保持在较低水平。DNRA过程每还原1 mol ![]() 转移8 mol电子,而反硝化转移5 mol电子[27],因此在硝酸盐受限和强还原条件下,DNRA过程比反硝化更具有优势[11,28]。
转移8 mol电子,而反硝化转移5 mol电子[27],因此在硝酸盐受限和强还原条件下,DNRA过程比反硝化更具有优势[11,28]。
1)在硫自养硝酸盐反硝化反应器中,控制适当的S/N可以实现硝酸盐和硫化物的同步高效去除。
2)S/N过高时,硫自养硝酸盐反硝化反应器中会出现DNRA的现象。在n(S)/n(N)=1.5∶1时,DNRA现象最明显。
3)ORP对系统的反应进程和反应类型均有一定的指示作用。在发生完整的硫自养反硝化反应时,会分别出现![]() 膝点和
膝点和![]() 膝点。而增大S/N时,系统同时存在硫自养反硝化和DNRA过程时,
膝点。而增大S/N时,系统同时存在硫自养反硝化和DNRA过程时,![]() 膝点和
膝点和![]() 膝点重合。
膝点重合。
4)在自养系统中处理高S/N废水时,进入生化池前,建议先对废水进行预处理,以去除一部分硫化物,防止DNRA过程的出现,保证脱氮效率。
[1] Sun Y, Nemati M.Evaluation of sulfur-based autotrophic denitrification and denitritation for biological removal of nitrate and nitrite from contaminated waters[J].Bioresour Technol, 2012, 114:207-216.
[2] Hamilton B S K.Have We overemphasized the role of denitrification in aquatic ecosystems? a review of nitrate removal pathways[J].Frontiers in Ecology and the Environment, 2007, 5(2):89-96.
[3] Diaz R J, Rosenberg R.Spreading dead zones and consequences for marine ecosystems[J].Science, 2008, 321: 926-929.
[4] Visser J M, Robertson L A, Van Verseveld H W, et al.Sulfur production by obligately chemolithoautotrophic Thiobacillus species[J].Applied and Environmental Microbiology, 1997, 63(6):2300-2305.
[5] Garcia-De-Lomas J, Corzo A, Portillo M C, et al.Nitrate stimulation of indigenous nitrate-reducing, sulfide-oxidising bacterial community in wastewater anaerobic biofilms[J].Water Research, 2007, 41(14):3121-3131.
[6] Cardoso R B, Sierra-Alvarez R, Rowlette P, et al.Sulfide oxidation under chemolithoautotrophic denitrifying conditions[J].Biotechnology and bioengineering, 2006, 95(6):1148-1157.
[7] Lv X M, Shao M F, Li J, et al.Nitrate removal with lateral flow sulphur autotrophic denitrification reactor[J].Environmental Technology, 2014, 35(21/24):2692-2697.
[8] Kleerebezem R, Mendez R.Autotrophic denitrification for combined hydrogen sulfide removal from biogas and post-denitrification[J].Water Science & Technology, 2002, 45(10):349-356.
[9] Behrendt A, Tarre S, Beliavski M, et al.Effect of high electron donor supply on dissimilatory nitrate reduction pathways in a bioreactor for nitrate removal[J].Bioresource Technology, 2014, 171(3):291-297.
[10] Dolejs P, Ladislav Paclík, Maca J, et al.Effect of S/N ratio on sulfide removal by autotrophic denitrification[J].Applied Microbiology and Biotechnology, 2015, 99(5):2383-2392.
[11] Brunet R C, Garcia-Gil L J.Sulfide-induced dissimilatory nitrate reduction to ammonia in anaerobic freshwater sediments[J].Fems Microbiology Ecology, 1996, 21(2):131-138.
[12] 殷士学, 陆驹飞.硝酸异化还原成铵的微生物学过程[J].微生物学通报, 1997,24(3):170-173.
[13] 李小平, 方涛, 敖鸿毅,等.东湖沉积物中dNaR活性和硝酸盐还原菌的垂向分布[J].中国环境科学, 2010, 30(2):228-232.
[14] Cole J A, Brown C M.Nitrite reduction to ammonia by fermentative bacteria: a short circuit in the biological nitrogen cycle[J].FEMS Microbiology Letters, 1980, 7(2):65-72.
[15] Mohan S B, Schmid M, Jetten M, et al.Detection and widespread distribution of the gene encoding nitrite reduction to ammonia, a short circuit in the biological nitrogen cycle that competes with denitrification[J].Fems Microbiology Ecology, 2004, 49(3):433-443.
[16] 张新艳.剩余污泥缺氧-好氧与单独好氧消化技术研究[D].西安:西安建筑科技大学, 2014.
[17] 郭瑜, 彭党聪, 张新艳,等.硝态氮为唯一氮源时异养微生物增长特性[J].环境工程学报, 2014, 8(3):882-886.
[18] 国家环境保护总局,水和废水监测方法编委会.水和废水监测分析方法.第4版[M].中国环境科学出版社, 2002.
[19] Reisman D J, Sundaram V, Al-Abed S R, et al.Statistical validation of sulfate quantification methods used for analysis of acid mine drainage[J].Talanta, 2007, 71(1):0-311.
[20] Mora M, Guisasola A, Gamisans X, et al.Examining thiosulfate-driven autotrophic denitrification through respirometry[J].Chemosphere, 2014, 113:1-8.
[21] Moraes B S, Souza T S O, Foresti E.Effect of sulfide concentration on autotrophic denitrification from nitrate and nitrite in vertical fixed-bed reactors[J].Process Biochemistry, 2012, 47(9):1395-1401.
[22] Dolejs P, Ladislav Paclík, Maca J, et al.Effect of S/N ratio on sulfide removal by autotrophic denitrification[J].Applied Microbiology and Biotechnology, 2015, 99(5):2383-2392.
[23] 李念, 乔蓉.浅谈硫化物对水中氨氮测定的干扰及其消除办法[J].金属材料与冶金工程, 2019, 47(1):49-51,64.
[24] 高大文, 王淑莹, 彭永臻,等.温度变化对DO和ORP作为过程控制参数的影响[J].环境科学, 2003, 24(1):63-69.
[25] Cheng H B, Kumar M, Lin J G.Interpretation of redox potential variation during biological denitrification using linear non-equilibrium thermodynamic model[J].International Biodeterioration & Biodegradation, 2012, 67:28-39.
[26] 刘双, 赵剑强, 王莎,等.硫自养与异养混合亚硝酸盐反硝化过程铵生成机制[J].环境工程学报,2019,13(6).
[27] Tiedje J M, Sexstone A J, Myrold D D, et al.Denitrification: ecological niches, competition and survival[J].Antonie Van Leeuwenhoek, 1982, 48(6):569-583.
[28] Tiedje J M.Ecology of denitrification and dissimilatory nitrate reduction to ammonium[J].Biology of Anaerobic Microorganisms, 1988,717:179-244.