0 引 言
随着我国经济快速发展,人为排放的大量氮素进入水体导致不同程度的富营养化,因此氮素的控制显得尤为重要[1]。生物脱氮技术因其高效经济的优势,成为近年来的研究热点。传统生物脱氮是由好氧条件下的自养硝化以及厌氧条件下的异养反硝化来共同完成的[2],在实际应用中往往由2个反应器组成,且其生物繁殖速率缓慢,难以维持较高的生物量,因而传统的生物脱氮技术对于天然水体的氮素去除有一定限制。特别是在冬季,如何在低温条件下实现水体氮素的高效去除是亟待解决的问题。因此,在好氧条件下实现冬季水体中氮素的去除成为研究热点。
20世纪80年代,Robertson[3]首次从废水脱硫和反硝化系统中分离出一株好氧反硝化菌Thiosphaera pantotropha,该菌株具有同步异养硝化-好氧反硝化的功能,打破了传统的脱氮理论,使脱氮过程在好氧条件下发生,这一研究发现为生物脱氮提供了新的技术可能性。且由于好氧反硝化菌具有生长快速[4]、耐贫营养[5,6]、耐溶解氧[7]等特点,使其成为当今的研究热点。由于温度是影响微生物活性的主要因素,而北方地区冬季漫长,天气寒冷的气候特征,实现高效稳定的生物脱氮较为困难,特别是针对天然水体的氮素去除。目前关于耐冷好氧反硝化菌的研究还很少,因此,对前期已分离的耐冷好氧反硝化菌的作用机理、分离方法、脱氮特性以及影响因素进行整理研究,为更好地开展低温下水体治理和生物修复提供参考。
1 耐冷好氧反硝化菌生物脱氮机理
好氧反硝化菌是一类在有氧条件下利用周质硝酸盐还原酶进行反硝化脱氮的异养微生物[8]。但目前对好氧反硝化的反应机理还存在不同观点,尤其是对耐冷好氧反硝化菌的作用机制报道更少。因此,从好氧反硝化菌的脱氮机理以及细菌的耐冷机制两方面来综合分析近年的研究结果。
1.1 好氧反硝化菌生物脱氮机理
主要从微环境理论、酶系统理论、协同呼吸理论3个方面分析阐述了好氧反硝化的作用机理,具体内容如下:
1)微环境理论认为:好氧反硝化现象的发生与溶解氧梯度有关[9]。这是由于氧扩散作用的限制,使微生物絮体内O2分布产生梯度,从而形成大环境的好氧区以及微环境的缺氧区和厌氧区,在好氧区内好氧异养菌、好氧硝化菌容易生长并成为优势菌;缺氧区和厌氧区内反硝化菌生长占优势,这种现象导致了宏观上好氧反硝化现象的发生[10]。
2)酶系统理论认为:整个反硝化过程涉及4种还原酶[11],分别为硝酸盐还原酶、亚硝酸盐还原酶、一氧化氮还原酶和一氧化二氮还原酶。相比厌氧反硝化菌,好氧反硝化菌的细胞内存在不受溶解氧抑制的反硝化酶系统[12]。研究表明:菌株的好氧反硝化能力与其特殊硝酸盐还原酶的表达密切相关,硝酸盐还原酶具有2种形式:一种是膜结合硝酸盐还原酶(membrane-bound nitrate reductase,M-Nar),在厌氧环境优先表达,但对氧分子敏感,有氧条件下其活性易受抑制;另一种周质硝酸盐还原酶(periplasmic nitrate reductase,P-Nar)则具有较强的耐氧能力。具体的好氧反硝化菌反硝化酶系统作用如图1所示。
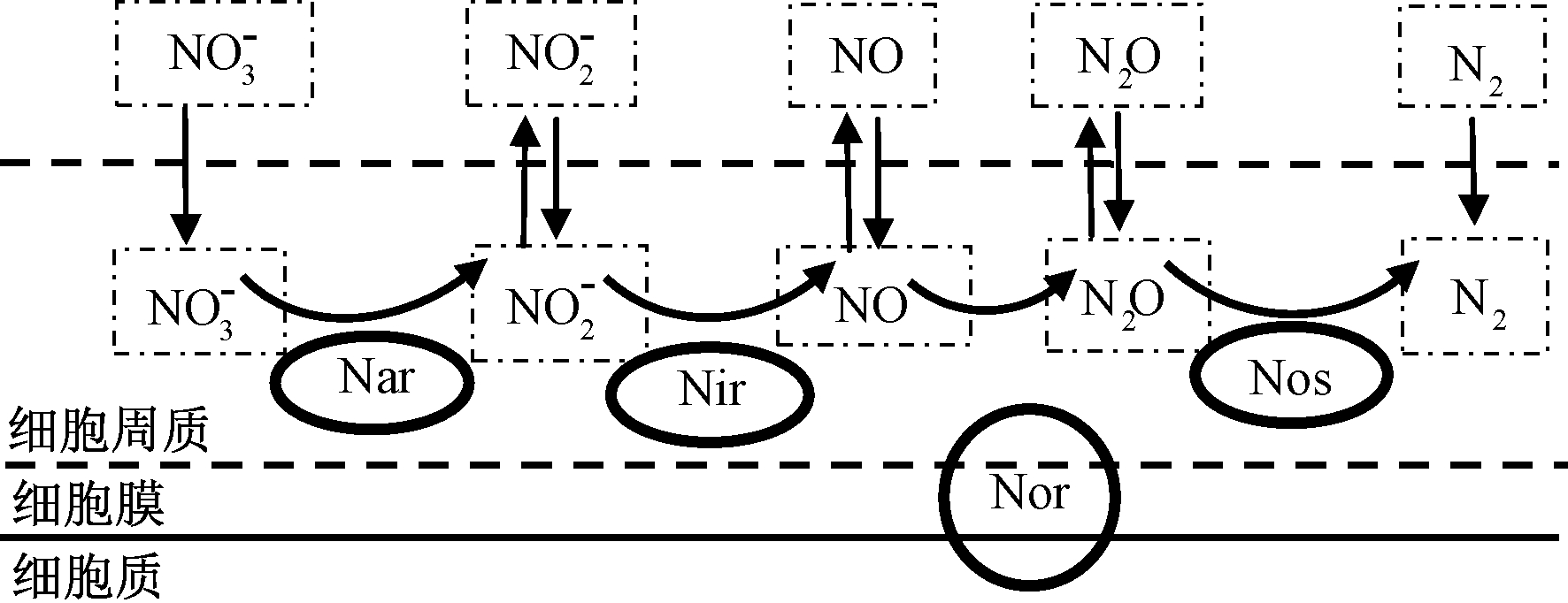
图1 好氧反硝化菌的反硝化酶系统示意
Fig.1 Schematic diagram of a denitrifying enzyme system of aerobic denitrifying bacteria
3)Robertson等[13]提出了协同呼吸理论。协同呼吸理论解释:在反硝化过程中分子氧和硝酸盐能同时作为电子的最终受体,即反硝化菌可以将电子从被还原的物质传递给O2,同时也可以传递给硝酸盐。在好氧反硝化过程中,电子在细胞色素c(Cyt c)和细胞色素aa3(Cyt aa3)传递,从而解除O2对反硝化电子呼吸链途径的抑制,使过剩的还原力通过周质硝酸盐还原酶传递给硝酸盐,将其还原[8]。因此,电子流可能同时传输到反硝化酶以及分子氧中,使好氧反硝化成为可能。具体好氧反硝化菌电子转移如图2所示。根据Wilson等[14]提出的细菌反硝化过程的电子传递模型可以清晰看出:硝酸盐和分子氧均可作为电子的最终受体,反硝化菌可以将电子从被还原物质传递给分子氧,同时也传输到反硝化酶进行反硝化[15]。

图2 好氧反硝化菌的电子转移示意
Fig.2 A schematic diagram of electron transfer of aerobic denitrifying bacteria
1.2 细菌耐冷性机制
Ingraham等[16]将低温微生物分为2类:1)生活在低温且其最高生长温度≤20 ℃,最适温度为15 ℃,在0 ℃可生长繁殖的微生物称为嗜冷菌;2)最高生长温度>20 ℃,最适温度>15 ℃,在0~5 ℃可生长繁殖的微生物称为耐冷菌。耐冷菌能够在低温环境下生长繁殖,主要是因为在长期的进化过程中于菌体内形成一套完整的适冷机制。具体的适冷机制包括:细胞膜流动性、嗜冷酶特性、冷休克蛋白以及tRNA结构调控。
1.2.1 细胞膜流动性
细胞膜的流动性是每个细胞结构与功能的基础,生物的很多重要功能都是通过膜的流动性体现的,细胞膜的存在为胞内各种生理代谢提供了内环境[17]。温度是影响膜流动性的主要因素,在低温环境下膜的流动性显著降低,所以通过一定机制保持低温下膜的流动性非常重要。邱天等[18]研究表明:细胞膜上的脂类物质与膜的流动性相关,低温下会产生更多的不饱和脂肪酸和支链脂肪酸,有利于增加细胞内膜的流动性。如果温度升高,将会影响脂肪酸的生成,在外部环境的刺激下,耐冷细菌可以通过调节细胞膜磷脂中的不饱和脂肪酸含量以适应外部极端环境。
1.2.2 嗜冷酶特性
嗜冷酶又称低温酶、冷活性酶或适冷酶,是长期在低温条件下仍具有较高催化活性和底物亲和力的一类酶,其适应特性是在低温下的高周转率和高催化效率[19]。Feller等[20]研究表明:嗜冷酶可以保证低温下底物与酶活性位点的充分结合,从而保证嗜冷菌正常的新陈代谢过程。在适冷酶的结构中,盐桥数量减少、疏水核内芳香环相互作用减弱、脯氨酸与精氨酸残基数量减少、酶疏水性减弱,使酶与溶剂的相互作用增强,有利于酶分子柔性增加[21],提高酶分子结构全部或局部的柔韧性[22]。因此,可以使酶分子在低耗能情况下能产生具有催化活性的构象变化,进而在低温下容易被底物诱导产生催化作用[23]。
1.2.3 冷休克蛋白
冷休克蛋白的产生是源于耐冷细菌的自身调节机制,当温度骤降时,细胞就会产生冷休克蛋白来应对外部变化,产生的蛋白数量与降温的剧烈程度呈正相关[24],这种适应温度骤降的生理反应称为“冷休克反应”。常温微生物没有冷休克蛋白,受低温冲击时不会产生该蛋白,而耐冷微生物在低温条件下往往能产生大量的冷休克蛋白来应对低温环境,因此,冷休克蛋白对低温细菌的适应能力发挥很大的作用[25]。但目前的研究成果未对冷休克蛋白对适冷微生物的低温适应性的影响做出较好解释,需做进一步研究。
1.2.4 tRNA结构调控
tRNA的成分组成对微生物的稳定性具有重要的影响[26]。tRNA中鸟嘌呤(G)和胞嘧啶(C)含量越高,其稳定性越高,流动性越差,若tRNA通过修饰,增加尿嘧啶(T)和腺嘌呤(A)在核苷酸中的比例,可以提高tRNA的流动性,同时会引起稳定性的下降,进而影响蛋白质的合成。Araki[27]研究发现,适冷菌可以在低温下保持高的生长速率,而且耐冷菌的蛋白质降解速率比中温菌要快得多。蛋白质的迅速转换是适冷菌节省能量的途径之一, 特别是在贫营养的情况下,加快蛋白质降解可以迅速为蛋白质的合成提供氨基酸。
综上,目前关于耐冷好氧反硝化菌作用机理的研究欠缺,所以综合好氧反硝化菌的作用机理和细菌的耐冷性机制进行阐述,建议后续开展好氧反硝化菌在低温环境中进行好氧反硝化脱氮的作用机理方面的探索研究。
2 耐冷好氧反硝化细菌的筛选方法
目前关于耐冷好氧反硝化菌的筛选方法如下:
1)培养基驯化法。Xu等[28]采用醋酸钠为碳源的异养硝化培养基及以KNO3和NaNO2的好氧反硝化培养基进行富集驯化得到恶臭假单胞菌Y-9;He等[29]采用添加溴百里酚蓝(BTB)的反硝化培养基(DM)和Luria-Bertani培养基(LB),在碱性废水中成功分离出一株阿氏节杆菌属Y-10;Yao等[30]采用L-天冬酰胺为碳源加入改良的BTB培养基和微量元素筛选出一株不动杆菌属HA2。
2)间歇曝气法。好氧反硝化菌可同时利用O2和![]() 好氧、缺氧的频繁转换有利于其在竞争中取得优势地位,成为优势菌种[31]。Huang等[32]在松花江低温的环境下,通过间歇曝气成功筛选出不动杆菌Y16耐冷好氧反硝化菌;何腾霞等[33]从灌溉水稻土壤中控制其溶解氧筛选出一株耐冷恶臭假单胞菌Y-12;Chen等[34]从CASS反应器活性污泥中筛选分离出一株气单胞菌属HN-02。
好氧、缺氧的频繁转换有利于其在竞争中取得优势地位,成为优势菌种[31]。Huang等[32]在松花江低温的环境下,通过间歇曝气成功筛选出不动杆菌Y16耐冷好氧反硝化菌;何腾霞等[33]从灌溉水稻土壤中控制其溶解氧筛选出一株耐冷恶臭假单胞菌Y-12;Chen等[34]从CASS反应器活性污泥中筛选分离出一株气单胞菌属HN-02。
3)其他方法。Zou等[35]采用间歇进人造废水培养,从SBR中取出的污泥成功筛选出在10 ℃下可进行好氧反硝化反应的菌群。利用呼吸制剂 KCN 来筛选好氧反硝化细菌,即在反硝化培养基中加入 KCN,同时对培养基曝气。KCN 可终止呼吸链中电子向氧分子的传递,从而抑制能利用氧作为电子受体的呼吸反应[36]。
综上,目前主要利用培养基富集驯化和间歇曝气的方法进行筛选,尚缺少其他高效耐冷型好氧反硝化菌的筛选方法。因此,应继续开展这方面的研究工作,为以后应用好氧反硝化技术进行水体氮素去除储备必要的菌株。
3 主要菌种
总结了近5年已分离获得的耐冷好氧反硝化功能的菌株(表1),主要分属副球菌属(Paracoccus)、假单胞菌属(Pseudomonas)、产碱杆菌属(Alcaligenes)和芽孢杆菌属(Bacillus)等,以假单胞菌属较多。蔡茜等[37]从冬水田中分离出1株耐冷耐碱蒙氏假单胞菌H97,在15 ℃下TN去除速率为0.81 mg/(L·h);王兆阳等[38]从垃圾渗滤液活性污泥中筛选分离出一株假单胞菌GL19,在15 ℃下TN去除率为96.5%。Yang等[39]从实验室规模的生物反应器中得到的生物活性炭样品,经培养后筛选出1株紫色杆菌M-11,可在2 ℃下对![]() 去除率达到89%;Qu等[40]从苯胺污染的地下水中筛选出1株假单胞菌AN-1,在10 ℃中对
去除率达到89%;Qu等[40]从苯胺污染的地下水中筛选出1株假单胞菌AN-1,在10 ℃中对![]() 降解速率为0.27 mg/(L·h);目前已筛选分离的菌株大多为细菌,而对真菌等其他类型鲜有报道。
降解速率为0.27 mg/(L·h);目前已筛选分离的菌株大多为细菌,而对真菌等其他类型鲜有报道。
表1 近5年(2013—2018)筛选的耐冷好氧反硝化细菌
Table 1 Cold resistance aerobic denitrifying bacteria selected in 2013—2018
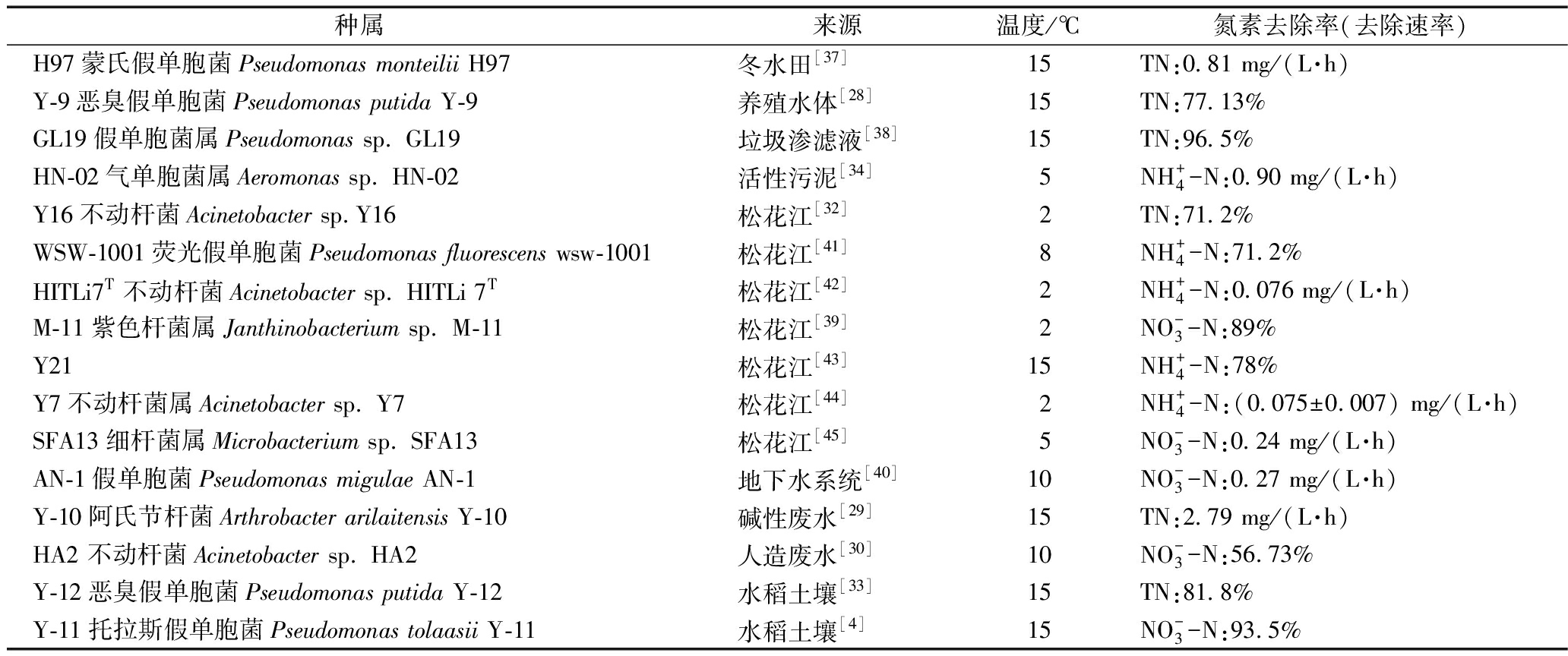
种属来源温度/℃氮素去除率(去除速率)H97蒙氏假单胞菌Pseudomonas monteilii H97冬水田[37]15TN:0.81 mg/(L·h)Y-9恶臭假单胞菌Pseudomonas putida Y-9养殖水体[28]15TN:77.13%GL19假单胞菌属Pseudomonas sp. GL19垃圾渗滤液[38]15TN:96.5%HN-02气单胞菌属Aeromonas sp. HN-02活性污泥[34]5NH+4-N:0.90 mg/(L·h)Y16不动杆菌Acinetobacter sp.Y16松花江[32]2TN:71.2%WSW-1001荧光假单胞菌Pseudomonas fluorescens wsw-1001松花江[41]8NH+4-N:71.2%HITLi7T不动杆菌Acinetobacter sp. HITLi 7T松花江[42]2NH+4-N:0.076 mg/(L·h)M-11紫色杆菌属Janthinobacterium sp. M-11松花江[39]2NO-3-N:89% Y21松花江[43]15NH+4-N:78%Y7不动杆菌属Acinetobacter sp. Y7松花江[44]2 NH+4-N:(0.075±0.007) mg/(L·h)SFA13细杆菌属Microbacterium sp. SFA13松花江[45]5NO-3-N:0.24 mg/(L·h)AN-1假单胞菌Pseudomonas migulae AN-1地下水系统[40]10NO-3-N:0.27 mg/(L·h)Y-10阿氏节杆菌Arthrobacter arilaitensis Y-10碱性废水[29]15TN:2.79 mg/(L·h)HA2 不动杆菌Acinetobacter sp. HA2人造废水[30]10NO-3-N:56.73% Y-12恶臭假单胞菌Pseudomonas putida Y-12水稻土壤[33]15TN:81.8%Y-11托拉斯假单胞菌Pseudomonas tolaasii Y-11水稻土壤[4]15NO-3-N:93.5%
4 耐冷好氧反硝化细菌的影响因素
在微生物脱氮过程中,C/N、溶解氧(DO)、温度、pH值是其主要影响因素。
4.1 碳氮比(C/N)
C/N对菌株的生长和降解特性有显著影响[45]。蔡茜等[37]研究的蒙氏假单胞杆菌H97,当C/N上升至15时,平均反硝化速率为1.05 mg/(L·h),TN平均去除速率为0.7 mg/(L·h),该菌对![]() 和TN去除率分别达到99.13%和61.42%。王兆阳等[38]分离得到的GL19在C/N为5时,
和TN去除率分别达到99.13%和61.42%。王兆阳等[38]分离得到的GL19在C/N为5时,![]() 及TN的去除率仅为55.4%、35.1%。当C/N增大到15时,
及TN的去除率仅为55.4%、35.1%。当C/N增大到15时,![]() 去除率达到100%,对应TN去除率为96.9%。Huang等[32]将C/N控制在2时,Y16表现出最高的NH3-N去除率约为65%。菌株的多样性及代谢机理的不同,所需的最适C/N也不同。因此,需要针对目标水体的具体水质特征进行相应的C/N的影响因素研究。
去除率达到100%,对应TN去除率为96.9%。Huang等[32]将C/N控制在2时,Y16表现出最高的NH3-N去除率约为65%。菌株的多样性及代谢机理的不同,所需的最适C/N也不同。因此,需要针对目标水体的具体水质特征进行相应的C/N的影响因素研究。
4.2 溶解氧(DO)
DO影响生物絮体微环境和反硝化酶系[8]。硝化过程涉及4种反硝化酶,其合成和活性均受DO的控制,其中硝酸盐还原酶的耐氧能力最强,而N2O或NO的生成几乎被DO完全抑制,研究证实N2O还原酶的ρ(DO)<0.2 mg/L,硝酸盐还原酶在ρ(DO)>4 mg/L时受到抑制[46,47]。Yao等[48]在10 ℃下逐渐增加耐冷好氧反硝化菌群中DO,至6 mg/L进行富集,然后在10 ℃、160 r/min下培养![]() 去除速率达到9.6 mgN/(gSS·h)。He等[33]分离得到的恶臭假单胞菌Y-12由50 r/min升高至200 r/min时,
去除速率达到9.6 mgN/(gSS·h)。He等[33]分离得到的恶臭假单胞菌Y-12由50 r/min升高至200 r/min时,![]() 去除率由86.6%升至99.9%,TN去除率由40.8%升至79.1%。该菌株在ρ(DO)=8 mg/L时仍发生反硝化作用,这与亚硝酸盐还原酶在ρ(DO)为1~3.6 mg/L时是极其敏感的研究观点不同[49],也证实了在ρ(DO)>3.6 mg/L时仍可发生反硝化作用。这与Huang等[32]研究结果相似,当转速为160 r/min、ρ(DO)=(5.84±0.02)mg/L时,TN去除率最高约为71.2%。上述研究可为开展针对景观水体耐冷好氧反硝化菌的后续研究提供理论参考。
去除率由86.6%升至99.9%,TN去除率由40.8%升至79.1%。该菌株在ρ(DO)=8 mg/L时仍发生反硝化作用,这与亚硝酸盐还原酶在ρ(DO)为1~3.6 mg/L时是极其敏感的研究观点不同[49],也证实了在ρ(DO)>3.6 mg/L时仍可发生反硝化作用。这与Huang等[32]研究结果相似,当转速为160 r/min、ρ(DO)=(5.84±0.02)mg/L时,TN去除率最高约为71.2%。上述研究可为开展针对景观水体耐冷好氧反硝化菌的后续研究提供理论参考。
4.3 温 度
耐冷好氧反硝化菌从低温环境分离出后进行特性分析,主要研究其在2~20 ℃条件下的效能。环境温度<10℃时,微生物的活性和生长速率会大幅降低,从而使污水脱氮的效果受到影响[50,51]。Qin等[52]在2~20 ℃下培养,并在2 ℃、5~168 h时细菌量增长到最大值。Zou等[35]将驯化得到的低温硝化菌群与好氧反硝化菌群结合使用,10℃下以铵盐作为氮源时,反应24 h时NH3-N去除率达到100%,48 h时TN去除率达到80%;且其在有氧条件下对活性污泥进行短期低温驯化,得到具有低温脱氮效果的异养硝化-好氧反硝化菌群[48]。庞长泷等[53]驯化富集了1组耐低温好氧反硝化菌群,在10 ℃下,采用聚氨酯泡沫负载该好氧反硝化菌并投加到SBR反应器中,结果表明,NH3-N去除率达到93.35%,TN去除率达到78.59%。Zhou等[54]通过对水库中好氧反硝化菌进行原位强化,强化后的好氧反硝化菌在4~12 ℃下表现出良好的脱氮特性,30 d的水体TN去除率达到(38.33±1.50)%。研究表明,温度的变化对好氧反硝化菌的生物量、脱氮速率以及去除率都产生一定的影响。
4.4 pH值
好氧反硝化菌适应的pH范围一般为中性或偏碱性,当pH<5或>10时,好氧反硝化菌不具有生长活性[55]。Xu等[28]的研究表明:恶臭假单胞菌Y-9在pH<6时,会完全抑制该菌的反硝化活性;当pH为7时,其![]() 和TN去除率最大,48 h内其去除率分别达到100%和59.97%,当再继续增大pH至9时,TN去除率则会下降。而蔡茜等[37]研究发现:当pH为7.0~11.0时,菌株H97能很好生长,对
和TN去除率最大,48 h内其去除率分别达到100%和59.97%,当再继续增大pH至9时,TN去除率则会下降。而蔡茜等[37]研究发现:当pH为7.0~11.0时,菌株H97能很好生长,对![]() 和TN的去除率较高,尤其pH=9.0时,该菌对
和TN的去除率较高,尤其pH=9.0时,该菌对![]() 和TN的去除率分别达到99.07%和91.78%。Zheng等[56]对耐冷反硝化菌枯草芽孢杆菌S1-1的研究表明:初始pH由6.0增大到7.5时,TN去除率由25%升高到约30%,当再次增大pH到偏碱性条件下时,该菌基本不再具有脱氮能力。pH对不同菌株的影响差异较大,因此应对不同环境下的好氧反硝化菌进行pH的探讨。
和TN的去除率分别达到99.07%和91.78%。Zheng等[56]对耐冷反硝化菌枯草芽孢杆菌S1-1的研究表明:初始pH由6.0增大到7.5时,TN去除率由25%升高到约30%,当再次增大pH到偏碱性条件下时,该菌基本不再具有脱氮能力。pH对不同菌株的影响差异较大,因此应对不同环境下的好氧反硝化菌进行pH的探讨。
4.5 其他因素
氮源是好氧反硝化菌的另一个影响因素,Chen等[34]从活性污泥中分离出的气单胞菌属HN-02,当![]() 分别作为唯一氮源时,在24 h内TN的去除率从高到低依次是
分别作为唯一氮源时,在24 h内TN的去除率从高到低依次是![]() 从初始值约150 mg/L降至25 mg/L。此外该项研究还表明:重金属离子对好氧反硝化菌去除NH3-N的影响,在Cu2+和Zn2+的含量低于0.5 mg/L时,并未出现明显抑制,在1~2 mg/L时Cu2+抑制现象明显。Yang等[39]从松花江分离出的紫色杆菌M-11对不同的碳源进行了研究比较,在2 ℃下24 h内,当甘油和柠檬酸钠分别作为唯一碳源时NH3-N的去除率分别可达90%和93%;而对甲醇、乙醇和蔗糖的利用很少,NH3-N去除率在20%以下。因此,要广泛开展耐冷好氧反硝化菌的影响因素研究,为以后对耐冷好氧反硝化菌进行脱氮性能优化提供必要的影响因素数据参考。
从初始值约150 mg/L降至25 mg/L。此外该项研究还表明:重金属离子对好氧反硝化菌去除NH3-N的影响,在Cu2+和Zn2+的含量低于0.5 mg/L时,并未出现明显抑制,在1~2 mg/L时Cu2+抑制现象明显。Yang等[39]从松花江分离出的紫色杆菌M-11对不同的碳源进行了研究比较,在2 ℃下24 h内,当甘油和柠檬酸钠分别作为唯一碳源时NH3-N的去除率分别可达90%和93%;而对甲醇、乙醇和蔗糖的利用很少,NH3-N去除率在20%以下。因此,要广泛开展耐冷好氧反硝化菌的影响因素研究,为以后对耐冷好氧反硝化菌进行脱氮性能优化提供必要的影响因素数据参考。
5 耐冷好氧反硝化菌脱氮技术应用研究
5.1 废水处理
目前耐冷好氧反硝化菌主要用于废水处理方面,使硝化和反硝化过程可以在同一个反应器中进行,加速反应进程,减少基建投资。由于反硝化过程中产生的碱度可以部分补偿硝化过程中损失的碱度,能使系统中pH值相对稳定[57]。王兆阳等[38]筛选出具有耐冷特性的GL19假单胞菌属能够对![]() 进行快速高效的去除,可应用于不同含氮水质废水的脱氮处理。何腾霞等[58]研究的恶臭假单胞菌Y-9在15 ℃、100 r/min下对
进行快速高效的去除,可应用于不同含氮水质废水的脱氮处理。何腾霞等[58]研究的恶臭假单胞菌Y-9在15 ℃、100 r/min下对![]() 达到100%去除,主要应用于冷水鱼类养殖水体中。庞长泷等[53]将好氧反硝化菌群与聚氨酯载体结合后,在10 ℃的条件下快速启动SBR反应器处理生活污水,实现了NH3-N、TN和有机物的高效同步去除。Yao等[30]研究的HA2可在10 ℃反应器中将人造废水中的COD和NH3-N去除,并证明在低C/N下不会成为限制细菌生长的因素,在废水处理中展现出很好的适应性。
达到100%去除,主要应用于冷水鱼类养殖水体中。庞长泷等[53]将好氧反硝化菌群与聚氨酯载体结合后,在10 ℃的条件下快速启动SBR反应器处理生活污水,实现了NH3-N、TN和有机物的高效同步去除。Yao等[30]研究的HA2可在10 ℃反应器中将人造废水中的COD和NH3-N去除,并证明在低C/N下不会成为限制细菌生长的因素,在废水处理中展现出很好的适应性。
5.2 景观水体处理
何腾霞等[33]在长期淹没的水稻土壤中分离出的1株恶臭假单胞杆菌Y-12,用未灭菌的景观水进行摇瓶实验,在15 ℃下,48 h内对初始值分别为0.53,10.42 mg/L的![]() 和TN的去除率分别为37.7%和51.5%,菌株Y-12在治理低温景观水体方面具有潜力。目前应用于景观水体的好氧反硝化菌较少,因此应在这方面加强研究。
和TN的去除率分别为37.7%和51.5%,菌株Y-12在治理低温景观水体方面具有潜力。目前应用于景观水体的好氧反硝化菌较少,因此应在这方面加强研究。
5.3 饮用水水源水体处理
饮用水水源关乎人类的生存,尤其在极度缺水的北方,对饮用水水源污染的治理更重要,但在给水方面应用好氧反硝化菌的技术还较少。黄廷林等[59]对得到的单一菌进行菌源重组,得到T1菌在菌投量为0.1 mg/L时,反硝化速率最快,总无机氮(total inorganic nitrogen, TIN)去除率达到56%;T2菌的菌投量为0.2 mg/L时,TIN去除率达60%。该研究还证实了在菌剂投放后能在有效氯浓度较低的情况下被杀灭,对饮用水水质不会构成威胁。Qin等[60]研究在季节性变化的自然情况下,在生物强化活性炭反应器(BEAC)中应用异养硝化-好氧反硝化菌(不动杆菌HRBLi16、HITLi7)后,NH3-N去除率达到(69.2±28.6)%,并能稳定运行,为饮用水的处理提供新的思路。此外,Huang等[32]从松花江分离出耐低温的不动杆菌Y16,在C/N为2时,NH3-N去除率达到约65%,且在好氧时最终将氮转化成N2,可以作为治理微污染水源水的候选菌株。
6 展 望
好氧反硝化菌从发现、分离到应用于实际工程中是生物脱氮技术的重大进步,但目前关于好氧反硝化菌的研究仍处于起步阶段,其分离出的耐冷好氧反硝化菌菌株数量较少,且其耐性机制还在探索期,对其特性研究还不够深入。现在大多将分离出的耐冷好氧反硝化菌用于污水处理,而对其他水体中氮素的去除还欠缺,因此寻求适合北方冬季水体的高效耐冷好氧反硝化菌是当前解决该问题的关键所在。
因此,今后重点开展以下3方面的研究:1)基于目标水体水质特征的高效耐冷好氧反硝化菌富集驯化筛选技术的构建,分离出更多的高效菌株,丰富菌株信息库的储备;2)将分子生物学技术与微生物技术相结合,深入研究不同耐受性好氧反硝化的作用机制,探索脱氮关键控制基因;3)研究不同耐冷好氧反硝化菌的影响因素,建立不同菌株的脱氮效能优化模型,从而指导实际应用。
[1] Padhi S K, Tripathy S, Mohanty S, et al.Aerobic and heterotrophic nitrogen removal by Enterobacter cloacae CF-S27 with efficient utilization of hydroxylamine[J].Bioresource Technology, 2017, 232:285-296.
[2] 冯叶,杨立中,陈进斌,等.废水生物脱氮低温硝化研究进展[J].水处理技术, 2014, 40(3): 5-10.
[3] Robertson L.Thiosphaera pamtotropha gen, nov.sp.nov., a facultatively anaerobic, facultatively autotrophic sulphur bacterium[J].Microbiology, 1983, 129(9): 2847-2855.
[4] He T X, Li Z L, Sun Q, et al.Heterotrophic nitrification and aerobic denitrification by Pseudomonas tolaasii Y-11 without nitrite accumulation during nitrogen conversion[J].Bioresource Technology, 2016, 200(1): 493-499.
[5] Kozlowski J A, Kits K D, Stein L Y.Comparison of nitrogen oxide metabolism among diverse ammonia-oxidizing bacteria[J].Frontiers in Microbiology, 2016, 7(e00094).
[6] 周石磊,黄廷林,张海涵,等.贫营养好氧反硝化菌群的筛选及源水脱氮特性[J].环境工程学报, 2016,10(6): 2955-2961.
[7] Alzate Marin J C, Caravelli A H, Zaritzky N E.Nitrification and aerobic denitrification in anoxic-aerobic sequencing batch reactor[J].Bioresource Technology, 2015, 200:380-387.
[8] 丁炜,朱亮,徐京,等.好氧反硝化菌及其在生物处理与修复中的应用研究进展[J].应用与环境生物学报, 2011,17(6): 923-929.
[9] Pochana K, Keller J.Study of factors affecting simultaneous nitrification and denitrification (SND)[J].Water Science & Technology, 1999, 39(6): 61-68.
[10] 梁炜,詹颖.好氧反硝化菌的分离及应用研究进展[J].广东化工, 2016, 43(12): 105-107.
[11] 王薇,蔡祖聪,钟文辉,等.好氧反硝化菌的研究进展[J].应用生态学报, 2007, 18(11): 2618-2625.
[12] 吴松维,孙华,吴伟祥,等.好氧反硝化脱氮作用研究进展[J].科技通报, 2008, 24(5): 727-730.
[13] Robertson L A, Van Niel E W J, Torremans R A M, et al.Simultaneous nitrification and denitrification in aerobic chemostat cultures of Thiosphaera pantotropha[J].Applied and Environmental Microbiology, 1988, 54(11): 2812-2818.
[14] Wilson P L, Bouwer J E.Biodegradation of aromatic compounds under mixed oxygen/denitrifying conditions: a review[J].Journal of Industrial Microbiology and Biotechnology, 1997, 18(2):116-130.
[15] 魏巍.微污染水源扬水曝气强化原位生物脱氮特性与试验研究[D].西安:西安建筑科技大学, 2011.
[16] Ingraham J L, Stokes J L.Psychrophilic bacteria[J].Bacteriol Rev, 1959, 39(2): 144-167.
[17] B H, S P.细胞微生物学[M].北京:人民军医出版社, 2001.
[18] 邱天,杨基先,崔迪,等.适冷微生物研究进展及应用现状[J].环境科学与技术, 2012, s1): 124-127.
[19] 陈秀兰,张玉忠,高培基.适冷微生物及其适冷机制研究进展[J].中国生物工程杂志, 2003, 23(2): 86-90.
[20] Feller G, Arpigny J L, Narinx E, et al.Molecular adaptations of enzymes from psychrophilic organisms[J].Comparative Biochemistry & Physiology Part A Physiology, 1997, 118(3): 495-499.
[21] D’Amico S, Claverie P, Collins T, et al.Molecular basis of cold adaptation[J].Philosophical Transactions of the Royal Society of London, 2002, 357(1423): 917-925.
[22] 麻微微,马放,岳秀丽,等.嗜冷产甲烷菌及其冷适应机制的研究进展[J].中国沼气, 2015, 33(2): 3-7.
[23] Kasana R C, Gulati A.Cellulases from psychrophilic microorganisms: a review[J].Journal Basic Microbiology, 2011, 51(6): 572-579.
[24] 王辉,丁协刚,李世文,等.冷休克蛋白的生物学功能研究进展[J].中华临床医师杂志(电子版), 2015, 9(8): 119-125.
[25] Morita R Y.Psychrophilic bacteria[J].Bacteriol Rev, 1975, 39(2): 144-167.
[26] 张抒杨,胡征,陶冶,等.耐冷细菌适应低温机制研究进展及应用[J].山东化工, 2017, 46(17): 63-65,69.
[27] Araki T.An analysis of the effect of changes in growth temperature on proteolysis in vivo in the psychrophilic bacterium Vibrio sp.strain ANT-300[J].Journal of General Microbiology, 1992, 138(10): 2075-2082.
[28] Xu Y, He T X, Li Z L, et al.Nitrogen removal characteristics of Pseudomonas putida Y-9 capable of heterotrophic nitrification and aerobic denitrification at low temperature[J].Biomed Research International, 2017, 2017(10): 1429018.
[29] He T X, Li Z L.Identification and denitrification characterization of a novel hypothermia and aerobic nitrite-denitrifying bacterium, Arthrobacter arilaitensis strain Y-10[J].Desalination & Water Treatment, 2015, 1-9.
[30] Yao S, Ni J R, Ma T, et al.Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp.HA2[J].Bioresource Technology, 2013, 139(13): 80-86.
[31] 杜立刚,张聪琳,陈宝玉.好氧反硝化生物脱氮技术研究进展[J].能源与环境, 2015, 42(4): 66-68.
[32] Huang X F, Li W G, Zhang D Y, et al.Ammonium removal by a novel oligotrophic Acinetobacter sp.Y16 capable of heterotrophic nitrification-aerobic denitrification at low temperature[J].Bioresource Technology, 2013, 146(10): 44-50.
[33] 何腾霞,李振轮,徐义.耐冷亚硝酸盐型反硝化细菌Pseudomonas putida Y-12脱氮特性[J].环境科学学报, 2015, 35(10): 3071-3077.
[34] Chen M X, Wang W C, Ye F, et al.Impact resistance of different factors on ammonia removal by heterotrophic nitrification-aerobic denitrification bacterium Aeromonas sp.HN-02[J].Bioresource Technology, 2014, 167: 456-461.
[35] Zou S Q, Yao S, Ni J R.High-efficient nitrogen removal by coupling enriched autotrophic-nitrification and aerobic-denitrification consortiums at cold temperature[J].Bioresource Technology, 2014, 161(s3/4): 288-296.
[36] 孔庆鑫,李君文,王新为,等.一种新的好氧反硝化菌筛选方法的建立及新菌株的发现[J].应用与环境生物学报, 2005, 11(2): 222-225.
[37] 蔡茜,何腾霞,冶清,等.耐冷嗜碱蒙氏假单胞菌H97的鉴定及其好氧反硝化特性[J].环境科学, 2018,39(7):3314-3320.
[38] 王兆阳,陈国耀,姜珂,等.1株耐冷兼性嗜碱好氧反硝化菌的分离鉴定及反硝化特性[J].环境科学, 2014, 35(6): 2341-2348.
[39] Yang M, Lu D W, Qin B D, et al.Highly efficient nitrogen removal of a coldness-resistant and low nutrient needed bacterium, Janthinobacterium sp.M-11[J].Bioresource Technology, 2018, 256:366-373.
[40] Qu D, Wang C, Wang Y F, et al.Heterotrophic nitrification and aerobic denitrification by a novel groundwater origin cold-adapted bacterium at low temperatures[J].Rsc Advances, 2014, 5(7): 5149-5157.
[41] Zhang S M, Sha C Q, Jiang W, et al.Ammonium removal at low temperature by a newly isolated heterotrophic nitrifying and aerobic denitrifying bacterium Pseudomonas fluorescens wsw-1001[J].Environmental Technology Letters, 2015, 36(19): 2488-2494.
[42] Zheng Z J, Zhang D Y, Li W G, et al.Substrates removal and growth kinetic characteristics of a heterotrophic nitrifying-aerobic denitrifying bacterium, Acinetobacter harbinensis HITLi7T at 2 ℃[J].Bioresource Technology, 2018,259:286-293.
[43] Huang X F, Li W G, Zhang D Y, et al.Characteristics and the basic kinetics of ammonium removal by heterotrophic nitrifying bacteria at low temperature[J].Advanced Materials Research, 2013, 807/809:327-331.
[44] Li W G, Huang X F, Zhang D Y, et al.Identification of low-temperature oligotrophic and heterotrophic nitrifying bacteria and safety tests with ICR mice[J].Pakistan Journal of Zoology, 2014, 46(5): 1295-1302.
[45] Zhang D Y, Li W G, Huang X F, et al.Removal of ammonium in surface water at low temperature by a newly isolated Microbacterium sp.strain SFA13[J].Bioresource Technology, 2013, 137(6): 147-152.
[46] Huang H K, Tseng S K.Nitrate reduction by Citrobacter diversus under aerobic environment[J].Applied Microbiology & Biotechnology, 2001, 55(1): 90-94.
[47] Kumar M, Lin J G.Co-existence of anammox and denitrification for simultaneous nitrogen and carbon removal: strategies and issues[J].Journal of Hazardous Materials, 2010, 178(1/2/3): 1-9.
[48] Yao S, Ni J R, Chen Q, et al.Enrichment and characterization of a bacteria consortium capable of heterotrophic nitrification and aerobic denitrification at low temperature[J].Bioresource Technology, 2013, 127(1): 151-157.
[49] KöRner H, Zumft W G.Expression of denitrification enzymes in response to the dissolved oxygen level and respiratory substrate in continuous culture of Pseudomonas stutzeri[J].Applied & Environmental Microbiology, 1989, 55(7): 1670-1676.
[50] 陈中祥,曹广斌,杨谦,等.低温硝化细菌的筛选及特性研究[J].江苏农业科学, 2011, 39(4): 284-286.
[51] Rodriguezcaballero A, Hallin S, PåHlson C, et al.Ammonia oxidizing bacterial community composition and process performance in wastewater treatment plants under low temperature conditions[J].Water Science & Technology, 2012, 65(2): 197.
[52] Qin W, Li W G, Huang X F, et al.A proteomic analysis of heterotrophic nitrifying bacterium Acinetobacter sp.HITLi7T adaptation to low temperature using two-dimensional difference gel electrophoresis approach[J].International Biodeterioration & Biodegradation, 2016, 113:113-119.
[53] 庞长泷, 陈翰, 李昂,等.低温好氧反硝化菌群强化生活污水脱氮效能[J].哈尔滨工业大学学报, 2014, 46(12): 45-52.
[54] Zhou S L, Huang T L, Zhang H H, et al.Nitrogen removal characteristics of enhanced in situ indigenous aerobic denitrification bacteria for micro-polluted reservoir source water[J].Bioresource Technology, 2016, 201:195-207.
[55] Ren Y X, Yang L, Liang X.The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium, Acinetobacter junii YB[J].Bioresource Technology, 2014, 171:1-9.
[56] Zheng H Y, Liu Y, Sun G D, et al.Denitrification characteristics of a marine origin psychrophilic aerobic denitrifying bacterium[J].Journal of Environmental Sciences, 2011, 23(11): 1888-1893.
[57] Hippen A, Rosenwinkel K H, Baumgarten G, et al.Aerobic deammonification: A new experience in the treatment of waste waters [J].Water Science & Technology, 1997, 35(10): 111-120.
[58] 何腾霞,李振轮.耐冷好氧亚硝酸盐型反硝化细菌的鉴定及脱氮特性研究[J].生物技术通报, 2015, 31(10): 191-198.
[59] 黄廷林,李娜,张海涵,等.耐低温贫营养好氧反硝化菌群脱氮特性及安全性[J].环境工程学报, 2013, 7(7): 2419-2423.
[60] Qin W, Li W G, Gong X J, et al.Seasonal-related effects on ammonium removal in activated carbon filter biologically enhanced by heterotrophic nitrifying bacteria for drinking water treatment[J].Environmental Science and Pollution Research, 2017, 24(24): 19569-19582.