0 引 言
人工湿地利用物理、化学以及生物的协同作用以达到高效处理废水的目的,除了污水处理,还具有生物多样性保护和洪水调蓄等生态服务功能[1,2]。赵红[3]于2003年研究得出,渭河流经耿镇断面时其水质已属Ⅴ类。而西安皂河人工湿地示范工程处理污水源于渭河支流——皂河。
一些研究发现,湿地中的芦苇对重金属有明显的吸收作用[4-6]。Elise等[5]对香蒲和芦苇2种植物的研究得出,芦苇去除重金属的效率高于香蒲;植物对重金属的吸收还与植物根部、微生物以及填料所构成的根际环境有关;研究还表明,植物的地上生物量随着季节变化而改变,但各季节植物地下部位(根部)累积重金属量大于地上部位(茎和叶)的累积量。董志成等[6]研究了芦苇各部位(根、叶和茎)中Zn、Cu、Pb、Cr和Cd的分布特征。
目前,野外研究人工湿地对重金属去除较少;同时,研究中人工湿地处理的污水大多为城市生活污水、工业废水等高浓度废水,对人工湿地处理含低重金属污染负荷的河流的研究甚少,且缺乏对干旱半干旱地区低重金属负荷条件下人工湿地系统植物中重金属迁移特性研究,研究西安皂河人工湿地示范工程中芦苇对重金属的吸收和累积具有实际意义。
1 试验与方法
1.1 试验区概况
试验场地为二级表流人工湿地,详见文献[7]中试验概况介绍。该湿地栽植芦苇和香蒲,即沿进水方向左右两边分别种植香蒲和芦苇;湿地长约107 m,填充的基质为沙子和铝污泥,其中湿地前段基质为沙子,靠近出水位置30 m段基质为铝污泥,湿地工艺流程如图1所示。将一级反应池命名为A池,二级反应池为B池,(A+B)池构成整个二级表流人工湿地。
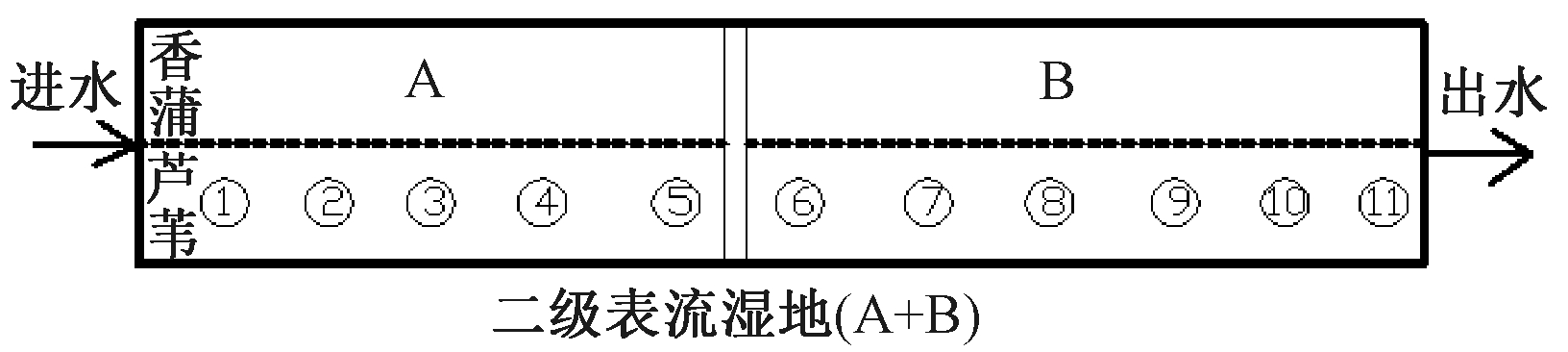
图1 湿地工艺流程示意
Fig.1 The schematic diagram of the surface flow wetland
1.2 样品采集及测试分析
在湿地中共布置11处采样点,每采样处采集4株高度相近的芦苇,采样时节为夏季,此时芦苇处于前生殖生长期。采集样品为水样、芦苇和底泥,1~8采样点处湿地的基质为沙子,9~11采样点处基质为铝污泥。在湿地周边的高尔夫球场旁采集自然生长的芦苇样本作为对照样本。芦苇样本采用马弗炉灰化,基质样本采用密闭高压消解[8]。重金属测定仪器为ICP-OES电感耦合等离子体发射光谱仪。
2 结果与讨论
2.1 芦苇不同组织中重金属的沿程分布
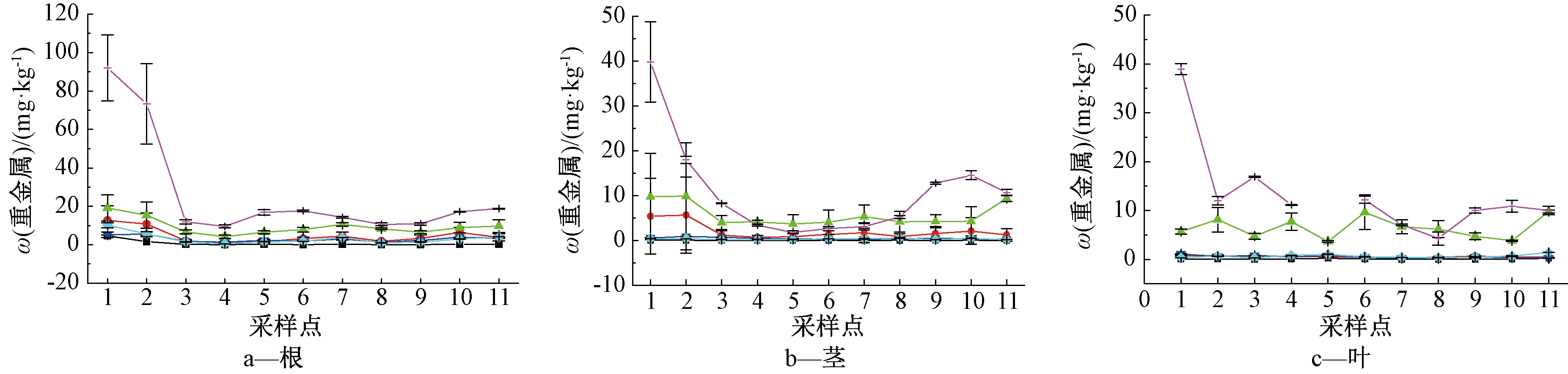
通过试验测定,芦苇各部位(根、茎、叶)中重金属的沿程分布见图2。
![]() —Cd;
—Cd;![]() —Cr;
—Cr;![]() —Cu;
—Cu;![]() —Ni;
—Ni;![]() —Pb;
—Pb;![]() —Zn。
—Zn。
图2 芦苇根茎叶中重金属沿程分布
Fig.2 The distribution of heavy metals in reed with distance
由图2a可知:芦苇根中Cd、Cr、Cu、Ni、Pb和Zn的沿程分布,在反应池开始前3个采样点处下降明显,随后3点处沿程略有上升;6种重金属在二级表面流中的前半段有略微下降,而在后半段沿程略有上升趋势。
由图2b可知:芦苇茎中Zn的质量分数在一级表流池中沿程下降,在二级表流池中却表现出沿程上升的趋势,即填料为铝污泥处芦苇茎中ω(Zn)偏高;茎中ω(Cu)和ω(Cr)在前3个采样点处略有下降趋势,随后沿程趋于稳定;ω(Cd)、ω(Ni)和ω(Pb)基本趋于稳定。
由图2c可知:叶中6种重金属的质量分数基本趋于稳定。
芦苇各部位中ω(Zn)和ω(Cu)较高,ω(Cd)最低;芦苇根和茎中Zn、Cu和Cr在离进水较近30 m处的质量分数沿程下降趋势明显。而Lesage等[9]指出,植物中重金属浓度随距离的变化其差异不明显。
2.2 芦苇不同组织中重金属元素的质量分数
芦苇不同组织中重金属元素质量分数如表1所示。
表1 芦苇根茎叶及根际基质中重金属的平均质量分数
Table 1 Average mass fraction of heavy metals in root, stem, leaf and rhizosphere matrix of reed mg/kg
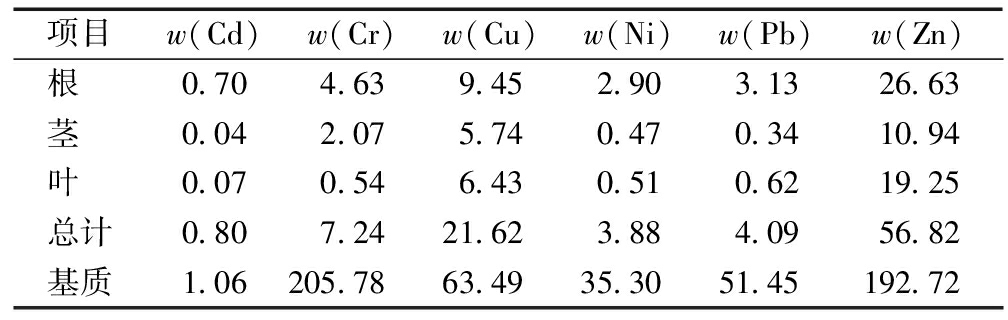
项目w(Cd)w(Cr)w(Cu)w(Ni)w(Pb)w(Zn)根0.704.639.452.903.1326.63茎0.042.075.740.470.3410.94叶0.070.546.430.510.6219.25总计0.807.2421.623.884.0956.82基质1.06205.7863.4935.3051.45192.72
由表1可知:芦苇根中重金属平均质量分数顺序为Zn>Cu>Cr>Pb>Ni>Cd;芦苇茎中的顺序为 Zn>Cu>Cr>Ni>Pb>Cd;芦苇叶中的顺序为Zn>Cu>Pb>Cr>Ni>Cd。ω(Cd)最低,仅为0.04~0.70 mg/kg。
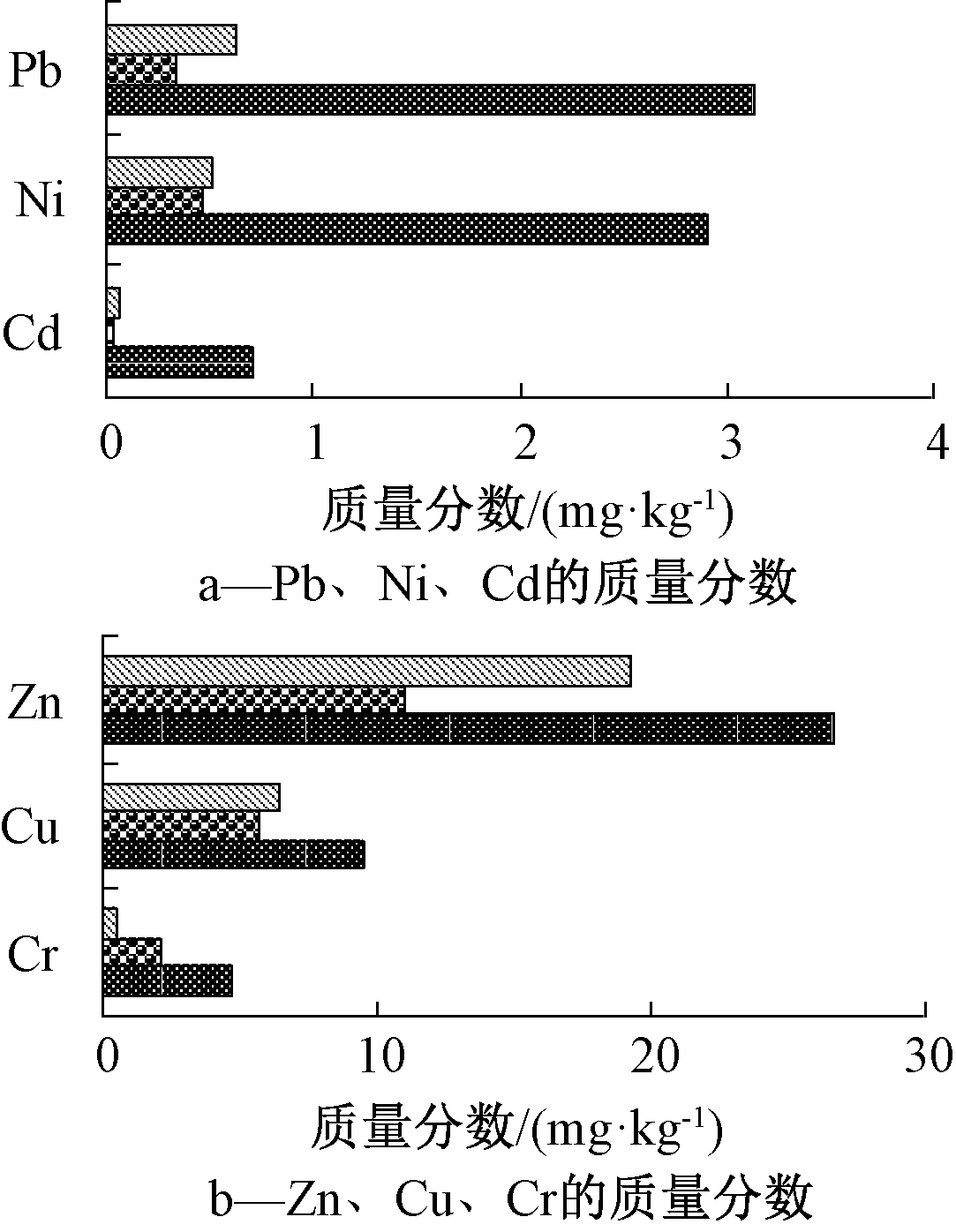
重金属元素在芦苇不同组织中的分布特征见图3。可知:同种元素在芦苇根中质量分数较高,且同一组织中不同重金属的质量分数相差较大。
![]() 叶;
叶;![]() 茎;
茎;![]() 根。
根。
图3 芦苇根茎叶中重金属的质量分数分布特征
Fig.3 Distribution characteristics of heavy metals in root, stem, leaf of reed
2.3 不同组织对重金属的吸收和累积
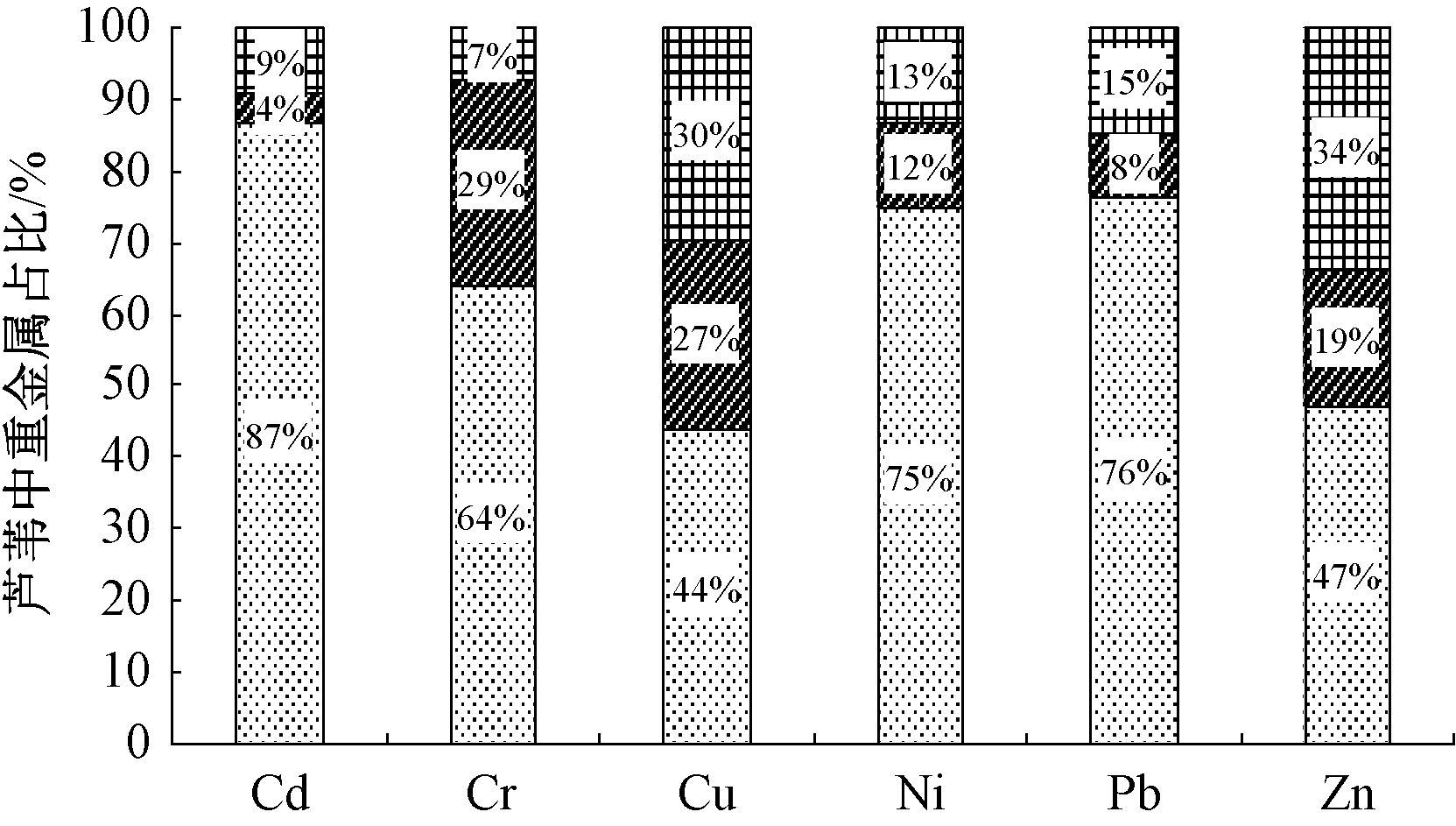
芦苇根部更易于吸收和累积重金属[9],皂河湿地示范工程中的芦苇也遵循这一规律。另外,Bonanno等[10]发现,重金属在植物中分布浓度排序为根>根茎>叶>茎。杨舒[11]指出,芦苇中Cu、Cd、Pb和Zn的含量排序为根>叶>茎。据图4芦苇不同组织中重金属占比可知,芦苇中重金属分布呈现两种模式。
![]() 叶;
叶;![]() 茎;
茎;![]() 根。
根。
图4 芦苇不同组织中重金属的占比
Fig.4 The distribution percentage of heavy metals in different tissues of reed
由图4可知:芦苇根中Cd、Cr、Ni以及Pb的占比较高,茎中Cr以及Cu占比较大,而芦苇叶中Cu、Zn占比较高;芦苇中Pb、Zn、Cd、Cr以及Ni的占比排序均为根>叶>茎,而Cu的分布显示为根>茎>叶。董志成等[6]发现:芦苇中Zn、Cu以及Cd的分布特征为根>叶>茎;芦苇中Pb和Cr的分配特征为根>茎>叶;可能与芦苇自身性质,以及生长的环境,重金属各自性质不同相关[12]。Romheld[13]在研究中提出:禾本科植物根系分泌的麦根酸类在活化湿地基质中难溶性Fe时,Cu、Zn、Cd及Mn等也被活化,故重金属的生物富集能力增强。
整体来看,芦苇地上部分(茎和叶)所含Cu和Zn的比例较大,故定期收割茎和叶对Cu和Zn的去除相对明显。
2.4 芦苇对重金属的生物富集和转移特征
植物对重金属富集和转移能力采用生物富集系数和转移系数进行评价。生物富集系数是指根中与基质中重金属量的比值,简称BCF(表2);转移系数即茎/叶中与根中重金属量的比值,简称TF(表3—4)。
表2 芦苇中6种重金属生物富集指数(BCF)
Table 2 The bio-concentrating factors of heavy metals in reed (BCF)
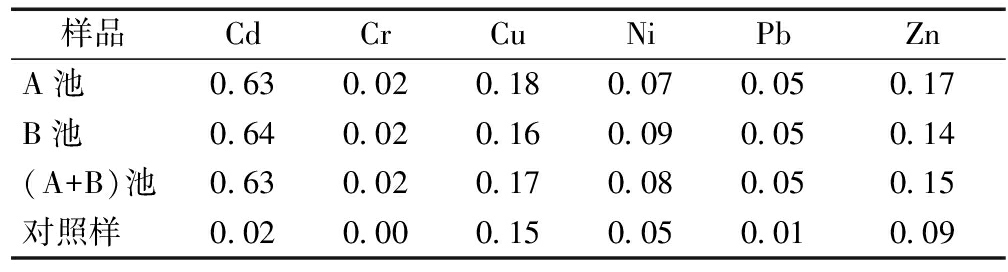
样品CdCrCuNiPbZnA池0.630.020.180.070.050.17B池0.640.020.160.090.050.14(A+B)池0.630.020.170.080.050.15对照样0.020.000.150.050.010.09
由表2可知:湿地中芦苇根的BCF顺序为Cd>Cu>Zn>Ni>Pb>Cr。Cd最容易被芦苇根富集,Cu和Zn的富集能力相当。系统中A池和B池中的BCF差距不大,说明水环境对重金属的富集效果影响较小。
表3 芦苇茎中6种重金属迁移指数(TF)
Table 3 The translocation factors of heavy metals in stem of reed (TF)
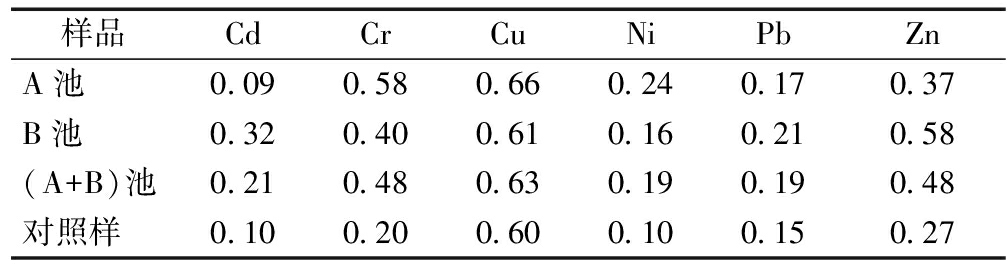
样品CdCrCuNiPbZnA池0.090.580.660.240.170.37B池0.320.400.610.160.210.58(A+B)池0.210.480.630.190.190.48对照样0.100.200.600.100.150.27
表4 芦苇叶中6种重金属迁移指数(TF)
Table 4 The translocation factors of heavy metals in leaf of reed (TF)
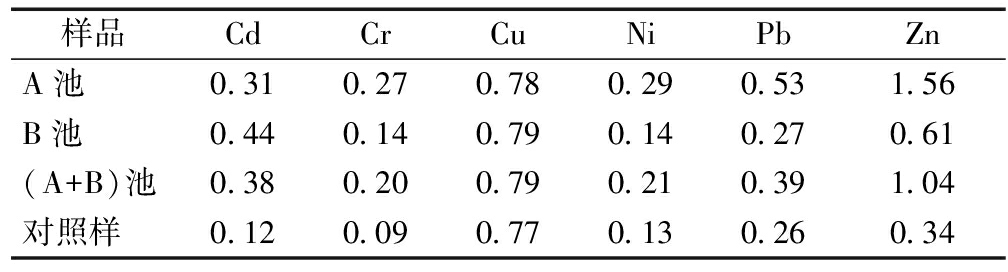
样品CdCrCuNiPbZnA池0.310.270.780.290.531.56B池0.440.140.790.140.270.61(A+B)池0.380.200.790.210.391.04对照样0.120.090.770.130.260.34
Zn的高生物利用度增强了其在根中的富集能力[14]。Hua[15]和He[16]]等发现,与单一Cd在相同浓度的土壤中存在的情况相比,当土壤中同时存在Zn和Cd,可以增加有效态Cd的浓度。本研究也得到与上述相同的结论。
由表3—4可看出:芦苇中Cu、Pb、Cd、Ni以及Zn的TF值均显示为叶>茎,只有Cr的TF值为叶<茎。且Zn、Cu、Cr、Pb、Cd和Ni的TF范围分别为0.37~1.56、0.61~0.79、0.14~0.58、0.17~0.53、0.09~0.44、0.16~0.29。可知,芦苇中Zn、Cu和Cr的迁移能力略强于Cd、Ni和Pb。芦苇根中Cd不易向茎和叶中转移,却有研究证明Cd在湿地中易被转移及富集[17];芦苇根中Cr向茎和叶的移动能力较强,生长季节直接决定着植物茎以及叶中Cr浓度,在生长季节开始时,植物地上部分的 Cr浓度很低,但在生长季节结束时 Cr的积累能力显著增加[18],研究中采集的芦苇样本处于生长末期,故芦苇地上部位Cr的浓度较高;Pb向地上部分迁移较弱,其他研究得出,Pb倾向于在植物根部累积,从根部向茎和叶中迁移的能力较弱[19];与Pb相反,Cu 具有较强的从根部迁移到茎和叶的能力,此结论与Vymazal等[19]的研究结果不一致,可能是由于高浓度 Cu 环境影响根中Cu的代谢,从而使茎叶中Cu浓度发生改变[18,19];与Yeh和MacFarlane等[20,21]研究结论相同的是:芦苇中Zn的转移能力较强。
由表2—4可知:芦苇对照样BCF和TF均小于湿地内植物,表明人工湿地内生长的芦苇从基质中富集重金属以及从根部向地上部分迁移重金属的能力大于在自然界水体中生长的芦苇[22]。
综上所述,芦苇根容易富集Cd和Cu;Cu、Pb、Cd、Ni以及Zn均容易由根向叶的迁移,且Cu和Zn从芦苇根向地上部位的移动能力较强。
3 结 论
1)研究区芦苇中重金属沿程分布如下:芦苇中Zn和Cu含量较高,Zn沿程变化趋势较为明显;湿地植物对重金属的去除主要发生在流入水附近约30 m的区域。
2)芦苇各组织中Pb、Zn、Cd、Cr以及Ni的占比顺序均为根>叶>茎,而Cu的占比顺序为根>茎>叶。
3)芦苇根容易富集Cd和Cu,对Cr富集能力较弱;Cu、Pb、Cd、Ni和Zn容易由芦苇根向叶迁移,且Cu和Zn从根向地上部位的迁移能力较强。
[1] 刘冬,张慧泽,徐梦佳.我国人工湿地污水处理系统的现状探析及展望[J].环境保护,2017,45(4):25-28.
[2] 朱加宾,李冰,侯诒然,等.人工湿地不同植物根系及基质重金属富集特征及其与环境因子相关性[J].上海海洋大学学报,2018,27(4):531-542.
[3] 赵红.渭河水质评价及污染防治对策[J].西北水资源与水工程,2003,14(1):28-31.
[4] 赵丹慧,李琦,王清波,等.种植4种植物的模拟人工湿地对污水中4种重金属的去除效果[J].湿地科学,2019,17(2):255-260.
[5] Elise G,Xavier L,Océane C,et al.The bioaccumulation performance of reed and cattails in a constructed treatment wetland for removal of heavy metals in landfill leachate treatment (Etueffont,France)[J].Water, Air, & Soil Pollution, 2012, 223(4):1723-1741.
[6] 董志成,鲍征宇,谢淑云,等.湿地芦苇对有毒重金属元素的抗性及吸收和累积[J].地质科技情报,2008,27(1):80-84.
[7] 葛光环.表流人工湿地中重金属的迁移及累积规律研究[D].西安:长安大学,2014.
[8] 吴江瑛.西安市道路路域土壤重金属赋存形态研究[D].西安:长安大学,2013.
[9] E Lesage,D P L Rousseau, E Meers, et al.Accumulation of metals in the sediment and reed biomass of a combined constructed wetland treating domestic wastewater [J].Water, Air, & Soil Pollution, 2007, 183(1/2/3/4): 253-264.
[10] G Bonanno,R LoGiudice.Heavy metal bioaccumulation by the organs of Phragmites austral-is (common reed)and the potential use as contamination indicators [J].Ecological Indicators, 2010, 10: 639-645.
[11] 杨舒.重金属Cu、Cd、Pb、Zn在人工湿地中的形态分布与转化[D].兰州:兰州大学,2011.
[12] 葛光环,寇坤,陈爱侠.湿地系统中植物和基质对重金属去除贡献的研究现状[J].当代化工, 2013, 42(7): 1006-1008.
[13] Romheld V.The role of phytosiderophores in acquisition of iron and other micro nutrients in graminaceous species:an ecological approach[J].Plant and Soil,1991,130:127-134.
[14] 李冰,舒艳,李科林,等.人工湿地宽叶香蒲对重金属的累积与机理[J].环境工程学报,2016,10(4):2099-2108.
[15] Hua L,Bai L Y,Wei D P,etal.Effects of interaction by organic manure-Cd-Zn on Cd,Zn formation in soil and wheat growth [J].Chin J Envir Sci,2002,22(4):346-350.
[16] He M C,Wang Z J,Tang H X.Pollution and ecological risk assessment for heavy metals in sediments of Le’an River[J].Envir Sci,1999,20(1):7-10.
[17] Tam N F Y, Wong Y S.Retention and distribution of heavy metals in mangrove soils receiving wastewater [J].Env Poll, 1996, 94: 283-291.
[18] Moffat A S.Plants proving their worth in toxic metal cleanup [J].Science, 1995, 269:302-303.
[19] Vymazal J,Svehla J.Trace metals in Phragmites australis and Phalaris arundinacea growing in constructed and natural wetlands[J].Science of the Total Environment, 2007,380 (1/3):154-162.
[20] Yeh T Y,Chou C C.Heavy metal removal within pilot-scale constructed wetlands receiving river water contaminated by confined swine operations[J].Desalination, 2009, 249(1):368-373.
[21] Mac Farlane G R, Koller C E, Blomberg S.P.Accumulation and partitioning of heavy metals in mangroves: a synthesis of field-based studies[J].Chemosphere, 2007, 69:1454-1464.
[22] 宁可佳.重金属在新型复合型人工湿地中的去除、迁移及累积规律[D].重庆:重庆大学.2011.