0 引 言
塑料及其制品在人类生活中占据非常重要的位置,在各行各业乃至日常生活中使用范围甚广,随着人们对塑料制品的依赖程度越来越高,生产规模的逐渐扩大,全球每年塑料制品的生产量超3.2亿t,21世纪被描述为“塑料时代”。塑料及其制品的迅速发展让人们的生活方式变得更加简洁便利,但与此同时,大量废弃塑料垃圾没有得到正确有效的处理。塑料在风力、洋流的作用下,在水体中长距离迁移,从高山到平原陆地,从河流湖泊到深海沉积物,对全球水环境造成了严重污染[1]。
近年来,环境塑料特别是微塑料污染逐渐发展成为人们关注的新热点之一。塑料产量每年都在增加,这也使得塑料垃圾在环境中不断积累。在环境中,大块塑料会降解成更小的碎片(<5 mm),这些小碎片通常被称为微塑料,降解过程包含化学和物理过程,主要涉及光降解、氧化、水解降解和机械粉碎等[2]。20世纪70年代,在开阔水域发现了第一批<5 mm的微塑料颗粒。最近的研究证实了塑料微粒的降解过程不会在微米级停止的猜想,塑料微粒会继续分解形成纳米塑料颗粒。与基于相同材料的宏观大塑料颗粒相比,这种纳米颗粒通常表现出不同的物理和化学性质。此外,其与生物体之间的相互作用也可能大不相同。因此,微塑料和纳米塑料之间的差异不容忽视[3]。
与塑料微粒一样,纳米塑料能够吸附并携带对环境具有潜在生物毒性的疏水性化学物质,比如,多氯联苯、环境激素和杀虫剂等[4]。但是由于纳米塑料尺寸更小,比表面积更大,往往会吸附更多的有害物质。因为纳米塑料颗粒的性质与尺寸息息相关,研究纳米塑料与环境的相互作用,特别是与生物体的相互作用,对于评估其对人体的危害非常重要。然而,目前的研究更多关注微塑料对水生环境和人体健康的影响,对于纳米塑料的研究还相对较少,其理应获得较多的关注。虽然水体环境中纳米塑料长期影响仍然难以预测,但其将不可避免地给社会带来更大的挑战。本文对纳米塑料及其对环境和人类健康的影响的现有研究进行综述,并分析现有的检测技术,旨在为后续的研究提供参考。
1 纳米塑料对水生环境的影响
与环境中的大塑料和微塑料一样,纳米塑料颗粒也会对水生环境产生负面影响。近年来,利用聚苯乙烯(PS)纳米颗粒进行模拟的几项实验研究表明,各种生物体,如浮游动物、藻类、水蚤和贻贝等,会摄取纳米塑料颗粒或将其吸附到生物体表面[5,6]。Sun等[7]对比了50 nm的纳米塑料在80 mg/L下,对海洋中嗜碱盐单胞菌的氧化应激毒性。该研究发现,胺改性的PS纳米颗粒对细菌的氧化应激毒性比未改性的纳米颗粒高。Brandts等[8]的研究表明,即使在实验设置的最低浓度下,PS纳米塑料也会引发贻贝的氧化损伤。Della等[9]的实验研究表明,在海胆胚胎中,1~50 μg/mL的氨基改性PS纳米塑料的积累会导致基因表达和胚胎毒性的改变。
Greven等[10]报道了纳米塑料对鱼类先天免疫系统的影响,表明鱼类对PS和聚碳酸酯纳米颗粒的应激反应可能干扰鱼类种群的抗病性。Lu等[11]测试了PS塑料在斑马鱼体内的吸收和累积,并研究了其对肝脏的毒性作用。结果表明,暴露7 d后,鱼鳃、肝脏和肠道中均有小粒径的塑料颗粒累积,而大粒径的塑料颗粒只存在于鱼鳃和肠道中。组织病理学分析表明,5 μm和70 nm PS塑料颗粒均可引起鱼肝脏炎症和脂肪积累。PS纳米塑料还能显著提高超氧化物歧化酶和过氧化氢酶的活性,说明其可诱导氧化应激。此外,代谢组学分析结果表明,暴露于PS纳米塑料环境下可引起鱼肝脏代谢过程的改变,并干扰脂肪和能量代谢。
Wegner等[12]将蓝色贻贝暴露于不同浓度的纳米PS和不同浓度的藻类中饲养,研究了30 nm PS颗粒对蓝色贻贝摄食行为的影响。当纳米PS存在时,蓝贻贝的过滤活性降低,这表明纳米PS会给蓝色贻贝的摄食行为带来负面影响。Mattsson等[13]证明了纳米塑料颗粒会降低水生浮游动物的存活率,穿透鱼类的血脑屏障,并导致其行为障碍。Mattsson团队首次发现纳米塑料颗粒与脑组织之间的直接相互作用,这可能是顶级消费者行为障碍背后的机制之一。
综上,纳米塑料可以被生物体摄入,积累在体内,并沿着食物链转移。纳米塑料对生物体的生长、发育和繁殖都有影响,扰乱了机体的正常代谢。对生物体的毒性作用主要取决于纳米塑料的表面化学性质和粒径。正电荷纳米塑料和负电荷纳米塑料对细胞正常生理活性的影响更为显著,粒径较小的纳米塑料更容易穿透细胞膜,在组织和细胞中积累,从而产生更大的毒性作用。此外,由于比表面积大,具有疏水性等特点,纳米塑料颗粒极有可能与其周围环境发生相互作用,吸附并携带对环境具有潜在生物毒性的疏水性化学物质。这会改变纳米塑料的物理化学性质,也会改变其在水环境中的迁移过程。所以在以后实验研究中,为了尽可能模拟自然条件,需考虑在这种情况下,纳米塑料对水生环境的影响。此外,目前还缺乏关于纳米塑料(和被吸附的污染物)在食物链上转移,在环境中积累和与生物体相互作用的研究。另外,很多研究中纳米塑料的有害作用都是使水生动物暴露在高于环境浓度几个数量级的纳米塑料浓度下被证实的,尚缺乏接近环境浓度下的相关研究。
2 纳米塑料对人体健康的影响
纳米塑料对环境特别是人类健康可能存在的危害和风险已引起关注。纳米塑料在人体内的副作用包括细胞毒性、引发炎症和激发活性氧产生等。许多使用人类细胞系的体外研究表明,聚合物纳米颗粒有可能激活人体先天免疫系统,诱导炎症反应,或促进氧化应激过程。
Brown等[14]以PS为研究对象,考察了其尺寸与引发炎症反应间的关系,研究结果表明:粒径较小的纳米塑料颗粒会导致人类A549肺细胞的IL-8基因表达明显增加,而用其他较大粒径塑料颗粒处理的对照组没有出现该现象。Forte等[15]研究了胃腺癌细胞对未改性PS纳米颗粒的摄取动力学,发现即使PS纳米颗粒不带电,也会影响细胞活力、炎症基因表达和细胞形态。Xia等[16]认为30 nm PS纳米塑料会诱导巨噬细胞大囊泡形成,阻断了内吞系统中囊泡的运输,以及细胞分裂所需的规则蛋白的分布,从而导致巨噬细胞双核化。黏蛋白对PS纳米颗粒毒理学影响的研究结果表明:胺改性57 nm PS颗粒与黏蛋白之间的相互作用明显,会使黏蛋白发生聚集,诱导肠上皮细胞死亡[17]。Liu等[18]进一步研究证实PS纳米颗粒能够诱导人类细胞中活性氧的产生。
由于纳米塑料性质稳定,降解困难,容易在组织和细胞中积累,会引起机体代谢紊乱和局部炎症。尤其对于肠道疾病患者,炎症感染引起的组织通透性改变会显著增加纳米塑料的转运和吸收,从而进一步增加暴露风险。最近,研究人员已经开始意识到纳米塑料对人类健康的潜在影响。纳米塑料对人体的直接和间接影响的研究已逐渐展开。然而,这些研究的实验对象仅限于模型细胞和生物体,所研究的纳米塑料的形状和组成相对单一。因此,进一步的研究应着眼于普通生物体或食物链中的纳米塑料污染,从而能够准确、全面地评估纳米塑料对人类健康的影响。
3 纳米塑料的检测技术
纳米塑料颗粒体积小,其与环境有机物的化学成分类似,因此在环境样品或复杂的生物基质中对其进行可靠的识别和检测富有挑战。对塑料聚合物颗粒进行检测对于分析环境样品中纳米塑料具有重要意义,一方面,可以确定系统中是否存在纳米塑料;另一方面,可以获得颗粒的额外化学特性,例如是否有相关添加剂存在[19,20]。在微塑料分析中,振动光谱通常与光学显微镜结合提供成像,从而能够分析单个颗粒的性质。这种方法能够提供大量关于颗粒大小、尺寸分布和几何形状等信息。然而,随着粒径的减小(<10 μm),这种方法越来越不适用,这主要是由于小尺寸颗粒数量增加以及仪器检测限等原因。随着红外光谱和拉曼光谱技术越来越自动化,其显微镜图像可以提供颗粒数量、尺寸分布和化学特性等信息[21,22]。气相色谱-质谱技术可以同时分析塑料的聚合物类型和样品中的有机或无机添加剂及其在样品中的质量,却是一种破坏性的分析技术,无法提供聚合物颗粒的尺寸、形状和数量等信息。常用技术的优、缺点见表1。
表1 纳米塑料检测方法及比较
Table 1 Comparison of identification & determination methods of nanoplastics
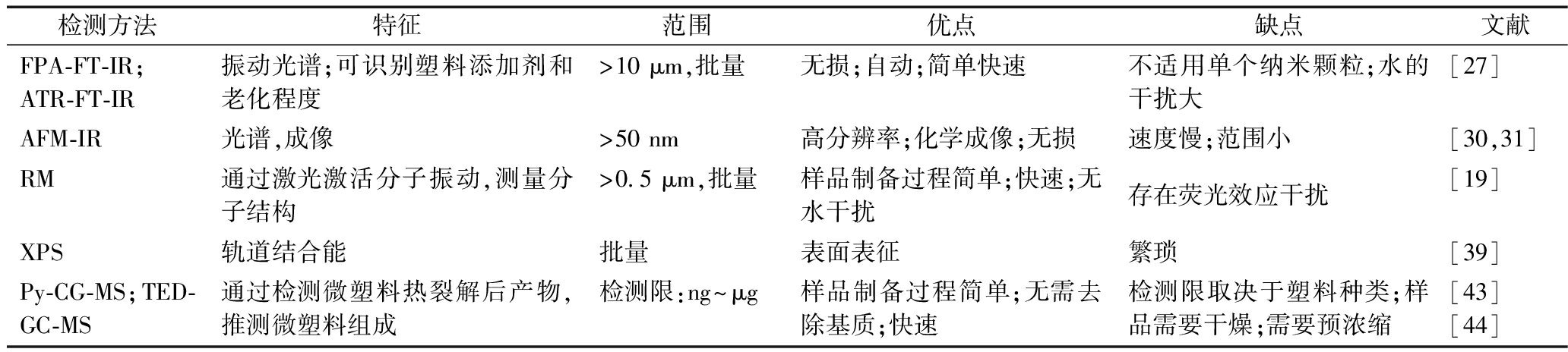
检测方法特征范围优点缺点文献FPA-FT-IR;ATR-FT-IR振动光谱;可识别塑料添加剂和老化程度>10 μm,批量无损;自动;简单快速不适用单个纳米颗粒;水的干扰大[27]AFM-IR光谱,成像>50 nm高分辨率;化学成像;无损速度慢;范围小[30,31]RM通过激光激活分子振动,测量分子结构>0.5 μm,批量样品制备过程简单;快速;无水干扰存在荧光效应干扰[19]XPS轨道结合能批量表面表征繁琐[39]Py-CG-MS;TED-GC-MS通过检测微塑料热裂解后产物,推测微塑料组成检测限:ng~μg样品制备过程简单;无需去除基质;快速检测限取决于塑料种类;样品需要干燥;需要预浓缩[43][44]
3.1 红外光谱(FT-IR)
红外光谱(FT-IR)是微塑料分析中最常用的光谱技术,用红外光照射样品会激发振动跃迁,从而产生独特的光谱,根据光谱图像可以识别样品种类[23,24]。FT-IR中的一些特殊化学键(如羰基)可以反应聚合物表面的氧化程度,进而用于判断塑料老化度。FT-IR主要应用于2种工作模式:衰减全反射(ATR-FT-IR)和焦平面阵列(FPA-FT-IR),需根据测试样品的尺寸、形状和厚度等特性进行选择[25,26]。
由于FT-IR单粒子分析的尺寸检测限在10 μm内,因此FT-IR只能用于纳米塑料的批量分析[26]。有研究对悬浮液进行过滤干燥后,利用衰减全反射红外光谱技术分析获得的固态样品,发现洗面奶中含有聚乙烯(PE)纳米塑料[27]。这项检测需要几mg干燥粉末,悬浮液干燥后的粉末中颗粒数量多达1010个。另一种利用FT-IR检测纳米塑料的方法是制备含有样品的KBr压片[28]。由于混合物的光谱是其各个组分的叠加光谱,所以FT-IR技术能够识别混合物中各个组分。但是环境样品中通常含有大量不同的聚合物,需要对其FT-IR进行反卷积,这对数据分析提出了巨大的挑战[29]。如果检测前,能够根据材料的密度或者表面物理化学性质对样品进行提纯,可以大大减少数据分析的工作量。
为了在空间分辨率低于衍射极限时,能够记录化学图像,FT-IR常与原子力显微技术(AFM)联用,可得到50 nm范围内的光谱信息[30,31]。由于该方法对选定区域进行图像处理,因此很难实现对多个颗粒进行分析,主要适用于对特定的纳米颗粒进行检测。
3.2 拉曼光谱(RM)
拉曼光谱(RM)技术利用激光的非弹性散射产生特定的光谱图来识别和鉴定塑料颗粒[20,32,33]。该技术与FT-IR互为补充,也可以明确地识别塑料颗粒的化学组成。由于RM的光源不需要红外光,可以使用较短波长(如532 nm)的激光器,从而能够获得更高的空间分辨率,因此,RM可用于分析<1 μm的微塑料颗粒[34,35]。
与AFM-IR一样,RM也可与AFM耦合,用于纳米级样品成像,光谱信息的空间分辨率为10 nm[36-38]。在尖端增强拉曼光谱(TERS)中,由于局部表面等离子体和避雷针效应,涂覆了银或金的尖端能够使拉曼信号增强。TERS常被用于研究薄膜中聚合物共混物之间的相互作用,也可用于分析纳米塑料。然而,用于分析纳米塑料的可靠性仍有待考察,因为表面等离子体信号的增强很大程度上取决于样品和探针尖端的距离。在实际环境中,塑料颗粒表面的有机物可能会阻碍RM识别。
3.3 X射线光电子能谱(XPS)
X射线光子的能量为1000~1500 eV,不仅可使分子的价电子电离,还可以激发内层电子,内层电子的能级受分子环境的影响很小[39]。同一原子的内层电子结合能在不同分子中相差很小,具有特征性。XPS不仅为化学研究提供分子结构和原子价态方面的信息,还能为材料研究提供各种化合物的元素组成和含量、化学状态、分子结构、化学键方面的信息。有研究利用XPS技术确定护肤品中初级PS亚微米塑料颗粒和初级PE纳米塑料颗粒的化学组成。单独使用XPS技术可能无法明确地识别纳米塑料的类型,但是XPS可以通过样品表面氧元素含量变化判断纳米塑料被氧化的程度[40]。此外,XPS技术还被用于分析纳米塑料对污水厂微生物胞外聚合物的影响。
3.4 气相色谱-质谱法(GC-MS)
除了光谱学,聚合物的质谱鉴定是微塑料分析中另一种常用的方法,提供聚合物的质量分数而不是粒子数的信息。主要有2种类型:1)热解气相色谱-质谱法(Py-GC-MS),通常是将单个质量>350 μg的塑料颗粒放置于热解管,在惰性气体的环境中进行热降解,分析热降解产物,从而判断其化学组成[41];2)热吸附解吸气相色谱质谱法(TED-GC-MS),允许在不去除有机质的情况下分析环境样品(样品质量高达20 mg)中的塑料颗粒[42]。该技术在进行GC-MS分析前,先进行样品的热萃取和固相吸附,避免了人工筛选,是其与Py-GC-MS技术的主要区别。近期,北大西洋副热带环流环境中首次观测到亚微米和纳米塑料,使用的检测技术就是Py-GC-MS[43]。通过与参考数据库的比较和主成分分析,检测出PE、PS、聚酯类(PET)和聚氯乙烯(PVC)等塑料。一些研究证实,Py-GC-MS与错流超滤、非对称流场流分馏等技术结合可有效检测纳米塑料。
然而,这些技术均存在检测限(LODs)问题,如果不进行预浓缩,则可能因为LODs过高以致不能用于检测纳米塑料。Mintening等[44]报道了PS纳米塑料悬浮液的LOD为4 mg/L,而通过错流超滤预浓缩后,其LOD可降低到20 μg/L。据预测,纳米塑料的质量在环境样品中非常低,所以预浓缩对于检测纳米塑料至关重要。因为没有环境中纳米塑料含量的数据,所以很难进行准确的预浓缩。Gigault等[45]的研究中,预浓缩100倍就足以检测出纳米塑料的特征分解产物。
Py-GC-MS和TED-GC-MS比光谱分析速度快,但不能提供颗粒大小、数量、尺寸分布以及形貌和聚集情况等信息。这些信息必须通过非对称流场流分馏-多角度光散射或动态光散射等其他粒子表征技术才能获得。这说明纳米塑料检测需要将多种技术结合才能获得更多信息。
上述用于分析纳米塑料的光散射和光谱技术对杂质都比较敏感,因此含有纳米塑料的实际源水和废水样品需要进行预处理,以去除杂质并便于检测和鉴定纳米塑料[46]。酶消化法、Fenton试剂法和过氧化物氧化法是消除微塑料样品中有机物和无机物污染的常用方法[47-50]。据了解,化学溶剂,如过氧化物会影响有机材料,也包括纳米塑料,对于尺寸细小、比表面积较大的纳米塑料,该影响不可忽略,因此酶消化法是最合适的选择。尽管检测前通常对样品进行了纯化,但考虑到纳米塑料形状不规则、表面化学性质复杂和尺寸分散性高等特点,仍需对分析过程进行优化。目前,已经形成几种表征实际水基质(如海洋沉积物、污泥和废水)中微塑料的方法[51-54]。然而,纳米塑料的分析仍然受到大多数分析技术的微米级分辨率的限制,需建立有效的水环境中纳米塑料的测定、定量和评估方法。
4 结论和展望
塑料材料是人类目前面对的最大的环境污染源之一。近年来的研究表明,塑料降解过程会导致纳米塑料的形成。由于塑料材料的不可降解性,纳米塑料将在水体环境中不断累积。随着研究深入,人们逐渐意识到纳米塑料对水生生物的毒性效应。与尺寸较大的微塑料相比,纳米塑料可以克服水生生物肠道组织的阻挡,可能最终进入人类食物链并危害人体健康。因此,增加对水体环境中纳米塑料的研究具有重要意义。
关于水体环境中纳米塑料的毒理学及检测技术研究现状与展望主要归纳为以下几点:
1)目前纳米塑料的毒理学实验,多是围绕单个细胞或者生物体展开的,缺乏纳米塑料在食物链中传递效应的研究,无法为预防和减缓纳米塑料对水生环境和人体健康带来的危害提供准确的依据。
2)目前纳米塑料被摄入后,促进其携带的化学物质被人体吸收的程度尚不明确。因此,未来在其负载污染物的生物富集作用方面还应投入更多的关注,建立从种群、个体、组织器官、细胞到基因等不同水平的生态学指标体系,服务于纳米塑料污染的生态与健康风险评估和基准制定。
3)由于技术和方法的限制,很难从环境样品中获得纳米塑料。因此,研究大塑料颗粒分解成纳米塑料的降解过程和速率是十分必要和迫切的。实验室进行稳定同位素标记实验研究过程是可行的。在控制条件下,可以实现降解塑料的粒度分离,并在纳米尺度上测定碎片含量。该过程可反映自然环境中不同粒径塑料的存在,并估算出降解后纳米塑料的含量,从而近似评估其生态效应。
4)有关纳米塑料毒性效应的研究缺乏统一的判断标准,存在暴露时间较实际情况低和暴露剂量较环境浓度高等问题,需要进行更多的试验来研究低剂量或环境剂量以及长期接触纳米塑料的影响。大多数关于纳米塑料毒性和风险评估的研究使用PS材料,可能误解纳米塑料对生态系统毒性。因此,需要结合环境中纳米塑料污染的实际现状,进一步研究纳米塑料的毒性效应。
5)在检测技术方面,各种方法仍然存在自身的不足和局限,在今后的研究中,要不断改进,并不断尝试寻找更加准确、便捷的分析技术。
[1] 杨婧婧, 徐笠, 陆安祥, 等.环境中微(纳米)塑料的来源及毒理学研究进展[J].环境化学, 2018,37(3):383-396.
[2] 王彤, 胡献刚, 周启星.环境中微塑料的迁移分布、生物效应及分析方法的研究进展[J].科学通报, 2018,63(4):385-395.
[3] Lehner R, Weder C, Petri-Fink A, et al.Emergence of nanoplastic in the environment and possible impact on human health[J].Environmental Science & Technology, 2019,53(4):1748-1765.
[4] Alimi O S, Budarz J F, Hernandez L M, et al.Microplastics and nanoplastics in aquatic environments: aggregation, deposition, and enhanced contaminant transport[J].Environmental Science & Technology, 2018,52(4):1704-1724.
[5] Booth A M, Hansen B H, Frenzel M, et al.Uptake and toxicity of methylmethacrylate-based nanoplastic particles in aquatic organisms[J].Environmental Toxicology and Chemistry, 2016,35(7):1641-1649.
[6] Bhattacharya P, Lin S, Turner J P, et al.Physical adsorption of charged plastic nanoparticles affects algal photosynthesis[J].Journal of Physical Chemistry C, 2010,114(39):16556-16561.
[7] Sun X M, Chen B J, Li Q F, et al.Toxicities of polystyrene nano- and microplastics toward marine bacterium Halomonas alkaliphila[J].Science of the Total Environment, 2018,642:1378-1385.
[8] Brandts I, Teles M, Goncalves A P, et al.Effects of nanoplastics on Mytilus galloprovincialis after individual and combined exposure with carbamazepine[J].Science of the Total Environment, 2018,643:775-784.
[9] Della Torre C, Bergami E, Salvati A, et al.Accumulation and embryotoxicity of polystyrene nanoparticles at early stage of development of sea urchin embryos paracentrotus lividus[J].Environmental Science & Technology, 2014,48(20):12302-12311.
[10] Greven A, Merk T, Karagoez F, et al.Polycarbonate and polystyrene nanoplastic particles act as stressors to the innate immune system of fathead minnow (pimephales promelas)[J].Environmental Toxicology and Chemistry, 2016,35(12):3093-3100.
[11] Lu Y F, Zhang Y, Deng Y F, et al.Uptake and accumulation of polystyrene microplastics in zebrafish (danio rerio)and toxic effects in liver[J].Environmental Science & Technology, 2016,50(7):4054-4060.
[12] Wegner A, Besseling E, Foekema E M, et al.Effects of nanopolystyrene on the feeding behavior of the blue mussel (Mytilus edulis L.)[J].Environmental Toxicology and Chemistry, 2012,31(11):2490-2497.
[13] Mattsson K, Johnson E V, Malmendal A, et al.Brain damage and behavioural disorders in fish induced by plastic nanoparticles delivered through the food chain[J].Scientific Reports, 2017,7(11452).
[14] Brown D M, Wilson M R, Macnee W, et al.Size-dependent proinflammatory effects of ultrafine polystyrene particles: a role for surface area and oxidative stress in the enhanced activity of ultrafines[J].Toxicol Appl Pharmacol, 2001,175(3):191-199.
[15] Forte M, Iachetta G, Tussellino M, et al.Polystyrene nanoparticles internalization in human gastric adenocarcinoma cells[J].Toxicology in Vitro, 2016,31:126-136.
[16] Xia L, Gu W H, Zhang M Y, et al.Endocytosed nanoparticles hold endosomes and stimulate binucleated cells formation[J].Particle and Fibre Toxicology, 2016,13(1):63.
[17] Inkielewicz-Stepniak I, Tajber L, Behan G, et al.The role of mucin in the toxicological impact of polystyrene nanoparticles[J].Materials, 2018,11(5):724.
[18] Liu X D, Tian X D, Xu X, et al.Design of a phosphinate-based bioluminescent probe for superoxide radical anion imaging in living cells[J].Luminescence, 2018,33(6):1101-1106.
[19] Ivleva N P, Wiesheu A C, Niessner R.Microplastic in aquatic ecosystems[J].Angewandte Chemie-International Edition, 2017,56(7):1720-1739.
[20] Kaeppler A, Fischer D, Oberbeckmann S, et al.Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both?[J].Analytical and Bioanalytical Chemistry, 2016,408(29):8377-8391.
[21] Araujo C F, Nolasco M M, Ribeiro A M P, et al.Identification of microplastics using Raman spectroscopy: Latest developments and future prospects[J].Water Research, 2018,142:426-440.
[22] Primpke S, Lorenz C, Rascher-Friesenhausen R, et al.An automated approach for microplastics analysis using focal plane array (FPA)FTIR microscopy and image analysis[J].Analytical Methods, 2017,9(9):1499-1511.
[23] Gü M, Lö J, Kuczera M, et al.Focal plane array detector-based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples[J].Environmental Chemistry, 2015,12(5):563-581.
[24] Renner G, Schmidt T C, Schram J.Characterization and quantification of microplastics by infrared spectroscopy[J].Comprehensive Analytical Chemistry, 2017,75:67-118.
[25] Sven H, P K T.Instrumental analysis of microplastics:benefits and challenges[J].Analytical and Bioanalytical Chemistry, 2018,410(25):6343-6352.
[26] Simon M, van Alst N, Vollertsen J.Quantification of microplastic mass and removal rates at wastewater treatment plants applying Focal Plane Array (FPA)-based Fourier Transform Infrared (FT-IR)imaging[J].Water Research, 2018,142:S1061750149.
[27] Hernandez L M, Yousefi N, Tufenkji N.Are there nanoplastics in your personal care products?[J].Environmental Science & Technology Letters, 2017,4(7):280-285.
[28] Li J F, Wang J J, Liu S C, et al.Role of extracellular polymeric substances in the acute inhibition of activated sludge by polystyrene nanoparticles[J].Environmental Pollution, 2018,238:859-865.
[29] Lu S H, Zhu K R, Song W C, et al.Impact of water chemistry on surface charge and aggregation of polystyrene microspheres suspensions[J].Science of the Total Environment, 2018,630:951-959.
[30] Dazzi A, Prater C B, Hu Q C, et al.AFM-IR: combining atomic force microscopy and infrared spectroscopy for nanoscale chemical characterization[J].Applied Spectroscopy, 2012,66(12):1365-1384.
[31] Dazzi A, Prater C B.AFM-IR: technology and applications in nanoscale infrared spectroscopy and chemical imaging[J].Chemical Reviews, 2017,117(7):5146-5173.
[32] Ribeiro-Claro P, Nolasco M M, Araújo C.Characterization of microplastics by Raman spectroscopy[J].Comprehensive Analytical Chemistry, 2017,75:119-151.
[33] Araujo C F, M N M, P R A M, et al.Identification of microplastics using Raman spectroscopy: latest developments and future prospects[J].Water Research, 2018,142:426-440.
[34] Imhof H K, Laforsch C, Wiesheu A C, et al.Pigments and plastic in limnetic ecosystems: a qualitative and quantitative study on microparticles of different size classes[J].Water Research, 2016,98:64-74.
[35] Schymanski D, Goldbeck C, Humpf H, et al.Analysis of microplastics in water by micro-Raman spectroscopy: release of plastic particles from different packaging into mineral water[J].Water Research,2018,129:154-162.
[36] Yeo B S, Amstad E, Schmid T, et al.Nanoscale probing of a polymer-blend thin film with tip-enhanced Raman spectroscopy[J].Small, 2009,5(8):952-960.
[37] Schmid T, Opilik L, Blum C, et al.Nanoscale chemical imaging using tip-enhanced Raman spectroscopy: a critical review[J].Angewandte Chemie International Edition, 2013,52(23):5940-5954.
[38] Kumar N, Mignuzzi S, Su W, et al.Tip-enhanced Raman spectroscopy: principles and applications[J].Epj Techniques and Instrumentation, 2015,2(1):9.
[39] Foerch R, Beamson G, Briggs D.XPS valence band analysis of plasma-treated polymers[J].Surface & Interface Analysis, 1991,17(12):842-846.
[40] Davide M, Paola S, Gianvito C, et al.Laser ablation as a versatile tool to mimic polyethylene terephthalate nanoplastic pollutants: characterization and toxicology assessment[J].ACS Nano, 2018:8b-1331b.
[41] Fries E, Dekiff J H, Willmeyer J, et al.Identification of polymer types and additives in marine microplastic particles using pyrolysis-GC/MS and scanning electron microscopy[J].Environmental Science Processes & Impacts, 2013,15(10):1949-1956.
[42] Dümichen E, Eisentraut P, Bannick C G, et al.Fast identification of microplastics in complex environmental samples by a thermal degradation method[J].Chemosphere, 2017,174:572-584.
[43] Ter Halle A, Jeanneau L, Martignac M, et al.Nanoplastic in the North Atlantic subtropical gyre[J].Environmental Science & Technology, 2017,51(23):13689-13697.
[44] Mintenig S M, S B U P, A K A, et al.Closing the gap between small and smaller: towards a framework to analyse nano- and microplastics in aqueous environmental samples[J].Environmental Science: Nano, 2018,5(7):1640-1649.
[45] Gigault J, Halle A T, Baudrimont M, et al.Current opinion: what is a nanoplastic?[J].Environmental Pollution, 2018,235:1030-1034.
[46] Wang W F, Wang J.Investigation of microplastics in aquatic environments: an overview of the methods used, from field sampling to laboratory analysis[J].TrAC Trends in Analytical Chemistry, 2018, 108: 195-202.
[47] Loder M G J, Imhof H K, et al.Enzymatic purification of microplastics in environmental samples[J].Environmental Science & Technology, 2017, 51 (24): 14283-14292.
[48] Hurley R R, Lusher A L, Olsen M, et al.Validation of a method for extracting microplastics from complex, Organic-Rich, Environmental Matrices[J].Environmental Science & Technology, 2017, 52 (13): 7409-7417.
[49] Tagg A, Harrison J P, et al.Fenton’s reagent for the rapid and efficient isolation of microplastics from wastewater[J].Chemical Communication, 2017, 53 (2): 372-375.
[50] Lares M, Ncibi M C, Sillanpää M, et al.Occurrence, identification and removal of microplastic particles and fibers in conventional activated sludge process and advanced MBR technology[J].Water Research, 2018, 133: 236-246.
[51] Harrison J P, Ojeda J J, et al.The applicability of reflectance micro-Fourier-transform infrared spectroscopy for the detection of synthetic microplastics in marine sediments[J].Science of the Total Environment, 2012, 416: 455-463.
[52] Primpke S, Lorenz C, et al.An automated approach for microplastics analysis using focal plane array (FPA)FTIR microscopy and image analysis[J].Analytical Methods, 2017, 9 (9): 1499-1511.
[53] Sun J, Dai X H, Wang Q L, et al.Microplastics in wastewater treatment plants: Detection, occurrence and removal[J].Water Research, 2019, 152: 21-37.
[54] Tagg A S, Sapp M, Harrion J P, et al.Identification and quantification of microplastics in wastewater using focal plane array-based reflectance micro-FT-IR imaging[J].Analytical Chemistry, 2015, 87 (12): 6032-6040.