0 引 言
我国餐厨垃圾处理方法主要是厌氧消化、好氧堆肥和饲料化。厌氧消化技术由于处理效率高,在实现废物资源化利用的同时可产生清洁能源(生物天然气),日益受到重视。鉴于餐厨垃圾含有部分难降解有机物,水解速率慢[1];油脂含量高[2-4],易造成厌氧消化被长链脂肪酸抑制[5],而油脂可用于制作生物柴油进行高值化利用[6]等原因,“湿热除油+厌氧消化”成为我国餐厨垃圾处理的主流技术。
湿热处理通过90~120 ℃的高温蒸汽作用改变餐厨垃圾的理化性质,实现油、水、固三相分离的预处理方法。湿热处理可有效缩短餐厨垃圾的水解时间,改变物料中蛋白质、碳水化合物及油脂的理化性质[6]。其中,湿热温度和时间显著影响预处理的效果,适当升高湿热温度和延长湿热时间能促进油脂溶出、蛋白质和碳水化合物水解[7],从而影响物料C/N。在前期研究和相关文献均发现,经湿热除油后的餐厨垃圾固相C/N为10.6~15.6[8],显著低于生物处理的适宜C/N要求(20~30),由此导致经湿热除油后的餐厨垃圾在较高有机负荷下进行厌氧消化时极易出现氨氮抑制,造成挥发性脂肪酸(VFAs)累积,最终导致系统崩溃。本文对餐厨垃圾厌氧消化氨氮抑制产生的机理和缓解办法进行总结,包括厌氧消化氨氮抑制的微生物原理、影响系统游离氨(FAN)的浓度因素,以及目前采用的减缓氨氮抑制的技术措施,最后对解除餐厨垃圾厌氧消化氨氮抑制的研究方向进行展望,以期为实际工程的正常运行提供参考。
1 厌氧消化氨氮抑制的微生物原理
1.1 氨氮抑制微生物活性的原理
氨氮是蛋白质、尿素和核酸厌氧消化的最终产物,体系总氨氮(TAN)包括游离氨(FAN)和铵离子(ANC)。其中,FAN比ANC对厌氧消化微生物产生的毒害作用更为强烈。氨氮浓度升高会导致多种微生物协同代谢的厌氧消化过程失衡,中间代谢产物VFAs大量累积,影响厌氧消化系统稳定性,最终体系pH下降甚至酸化,反应器内甲烷产量大幅下降甚至不再产气[9]。
FAN和ANC两者存在的转化关系如下:
![]()
(1)
氨氮对厌氧消化体系微生物的抑制是由FAN和ANC共同作用造成的。FAN的微生物抑制作用包括[10]:1)直接抑制微生物的产甲烷过程;2)导致微生物细胞内质子失衡或缺钾;3)改变细胞内pH;4)增加细胞的能量需求;5)抑制特定的酶促反应。而ANC可直接抑制产甲烷酶促反应[10],见图1。
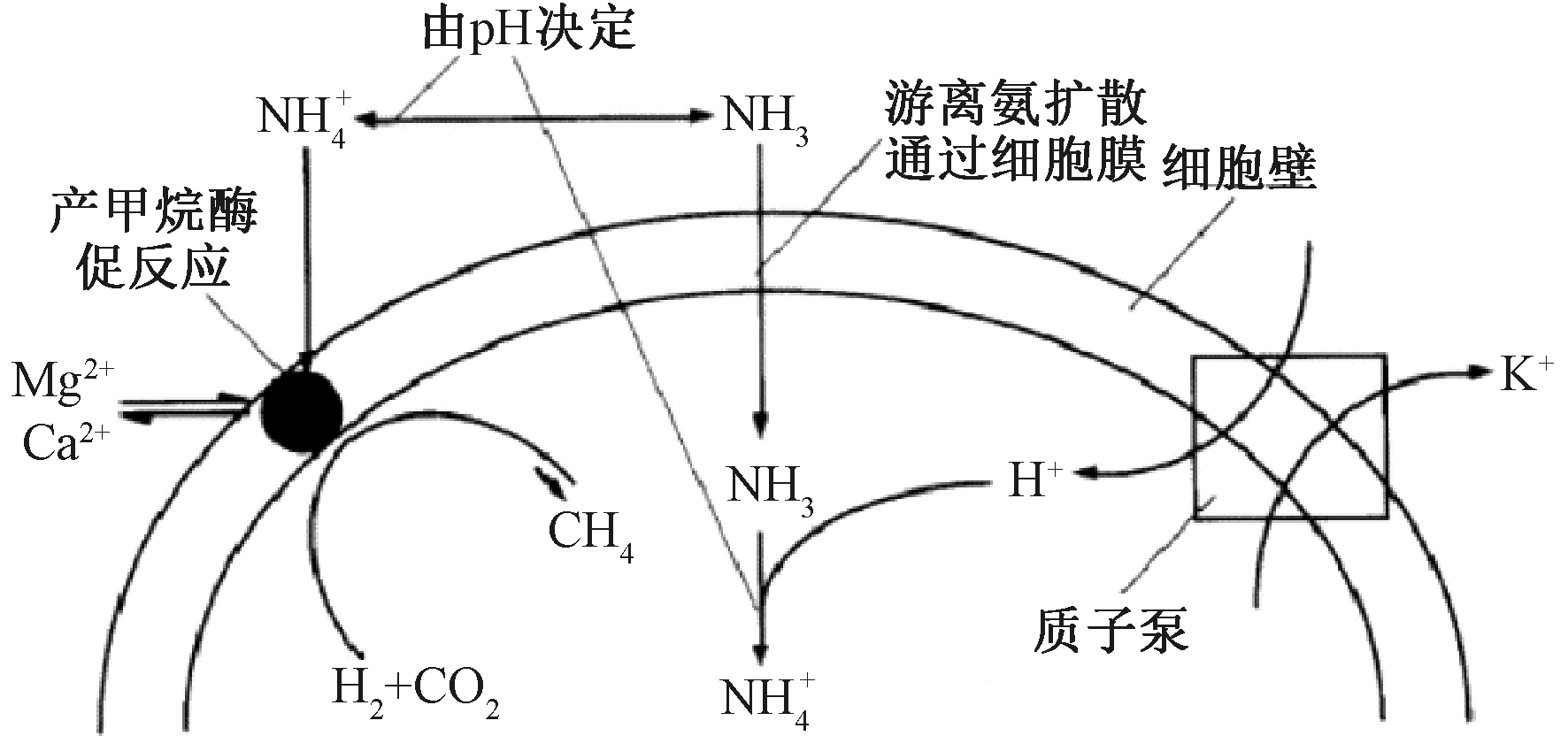
图1 氨氮对产甲烷菌可能的抑制机理[10]
Fig.1 Possible mechanism of ammonia inhibition on methanogens
1.2 氨氮抑制时反应器内微生物群落结构变化
厌氧消化系统中存在水解菌、酸化菌、产乙酸菌和产甲烷菌4类微生物,其中,产甲烷菌受氨氮(尤其FAN)抑制最严重。产甲烷菌的类型主要包括氢营养型产甲烷菌、乙酸营养型产甲烷菌和互营乙酸发酵型产甲烷菌。一般认为,FAN对乙酸营养型产甲烷菌的抑制作用比氢营养型产甲烷菌大,且乙酸营养型产甲烷菌群中的Methanosaetaceae比Methanosarcinaceae对FAN更敏感,因为Methanosarcinaceae在高FAN条件下也能较稳定存在[11]。氨氮浓度升高时,微生物群落结构会从乙酸营养型向互营乙酸发酵型转变[12]。
1.3 影响系统FAN浓度的因素
TAN与FAN之间的浓度关系如下[13]:
![]()
(2)
式中:FAN为游离氨浓度,mg/L;TAN为总氨氮浓度,mg/L;T为热力学温度,K。由式(2)可知:FAN的浓度主要取决于TAN、pH和温度。pH和温度增加均会导致反应器中FAN增加。
1.3.1 pH值
FAN和ANC浓度存在电离平衡,当厌氧消化系统pH升高时,会引起ANC向FAN转变,导致TAN中FAN的比例升高,进而加剧产甲烷菌受抑制程度,导致VFAs累积。此时,如果反应器内的碱度不足,则VFAs增加又引起pH下降,使FAN浓度降低,这就是FAN、VFAs和pH之间相互作用导致的“稳态抑制”[9]。在上述过程中,厌氧消化过程仍能进行,但体系的甲烷产率下降。Zeeman等[14]研究牛粪高温厌氧消化时发现,由于FAN的抑制作用,3000 mg/L TAN即影响反应器稳定性,但若将体系pH由7.5降至7时,甲烷产率提高3倍。Fernandes等[15]经计算也发现,在T=35 ℃的中温厌氧条件下,反应器由pH=7升至pH=8时,FAN占TAN的比例由<1%提高至10%,此时甲烷产率显著下降,二者呈现明显的相关性。因此,为了减少氨氮对厌氧消化系统的影响,需要将pH控制在较低的范围内,又要同时保证产甲烷菌对这个pH范围的适应性。
1.3.2 温 度
温度是影响系统FAN浓度的另一个重要因素,除了影响FAN浓度,它还通过影响微生物生长速率影响厌氧消化过程[16]。升高体系温度会提高微生物生长速率,同时由于物质分解速率加快也会增加厌氧消化系统的FAN浓度。与中温厌氧消化系统相比,高温厌氧消化系统内部的微生物生长速率和有机质分解速度更快[17],但是系统内TAN和FAN的浓度也更高,氨氮抑制现象更易出现,系统也更不稳定。Angelidaki等[18]研究了T=40~60 ℃,TAN=2500~6000 mg/L条件下的反应器连续运行状况,结果表明,TAN=6000 mg/L的反应器在运行温度为55 ℃时,随着反应器运行温度降低,氨氮抑制逐渐减弱,沼气产量逐渐上升,工艺更加稳定。Massé等[19]运行猪粪低温厌氧消化反应器时,发现温度从10 ℃升高到20 ℃时,FAN浓度从62 mg/L升高至185 mg/L,同时体系pH从7.89升至8.03。当温度进一步升高至35 ℃时,FAN浓度将增加至304~448 mg/L。综上,低温厌氧消化系统的FAN浓度较低,产甲烷菌受到的抑制较弱,但是由于温度低,微生物的生长速度和分解有机质的能力有所下降,因此如何提高富氮物料的厌氧消化系统在低温条件下的物质代谢速率成为缓解氨氮抑制的一个热点问题。
2 减缓氨氮抑制措施
2.1 提高进料C/N
一般情况下,进料C/N控制在20~30是厌氧消化等生物处理的适宜条件。C/N过低,氮源相对过剩,氨氮累积造成氨氮抑制,进而引发酸积累,反应器会因氨氮抑制和酸积累等多重因素而崩溃[20]。通过预处理、共消化等手段可提高物料C/N,进而达到有效减缓氨氮抑制的目的。
2.1.1 改变湿热预处理条件
改变湿热预处理条件能改变餐厨垃圾的C/N比。一方面,湿热预处理的条件不同,餐厨垃圾中糖类、蛋白质水解和油脂的溶出不同,经湿热除油后的餐厨垃圾C/N也不同;另一方面,湿热预处理温度>100 ℃时,餐厨垃圾中的蛋白质和淀粉等水解产生的氨基酸和还原糖会发生美拉德反应生成蛋白黑素[21],因微生物难以代谢利用不能进入厌氧消化系统,因此进料中可被微生物利用的C、N将发生变化。对于N而言,转化为氨氮的N将有一定程度的减少。Tampio等[21-22]对比研究了经过160 ℃湿热预处理和未进行预处理的餐厨垃圾厌氧消化过程,2个反应器的TAN浓度分别约为1200,3000 mg/kg,FAN浓度分别约为100,300 mg/kg。但湿热预处理也会造成C的损失,160 ℃湿热处理后的餐厨垃圾进行厌氧消化的甲烷产率比未进行预处理的降低5%~10%。Ding等[23]对餐厨垃圾进行100~200 ℃处理后厌氧发酵,也发现了相同现象。因此,通过优化餐厨垃圾湿热预处理的时间和温度等参数,在保证厌氧消化效率的前提下,提高反应器进料的实际C/N,从而达到减缓氨氮抑制的目的;该方法是基于对现有工艺路线的改进和提高,成本最低,效果最为显著。
2.1.2 共消化
通过共消化的方式来优化进料C/N也是减缓氨氮抑制的有效途径。由于湿热除油后的餐厨垃圾C/N低,进行共消化时一般选用C/N高的厨余、秸秆和果蔬等物料,将C/N调至适宜进行厌氧消化的范围,进而提高甲烷产率。王金辉[8]将餐厨垃圾和厨余垃圾共消化(二者质量比为2∶1),与餐厨垃圾单独厌氧消化相比,共消化容积产气率和气体甲烷含量均有所提高:进料负荷为100 kg/d(湿物料)时,容积产气率和甲烷含量分别达到2.13 m3/(m3·d)和63%,甲烷产率增加26.4%。周祺等[24]将餐厨垃圾与玉米秸秆进行批式共消化,结果表明,混合后C/N为20,初始有机负荷率为45 gVS/L时,甲烷产率最大(311.83 mL/gVS),比餐厨垃圾单独厌氧消化增加36.7%。吕琛等[25]将餐厨垃圾和果蔬进行不同混合比例的共消化,发现果蔬与餐厨垃圾混合比例为5∶8(质量比)时,沼气产率最大(737.3 mL/gVS),比餐厨垃圾单独进行厌氧消化产气量提高3.5%(表1)。综上,厨余垃圾、秸秆和果蔬等都具有较高的C/N,都能与餐厨垃圾形成很好的互补,减少酸积累,缩短厌氧发酵停滞时间并增加系统稳定性。该方法成本低、容易实现且不需要大型设备,一般适用于生物质废物来源丰富,需要同时处理餐厨垃圾及其他垃圾的综合处理,为了反应器良好运行,在前期就需进行优化设计的情景。当反应器处于严重的氨氮抑制时,不适用该方法[26]。
2.2 微生物驯化
高浓度氨氮会直接影响厌氧消化微生物活性,特别是产甲烷菌活性。根据微生物对环境具有适应性的特点,可通过逐步提高反应器内氨氮浓度对产甲烷菌进行驯化,进而逐步提高其对氨氮的耐受能力[17]。而对于厌氧微生物群落逐步适应广泛的氨氮浓度范围的原因,是细菌群落中产生了新的菌群还是原始菌群对高浓度的适应则有待进一步研究[27-28]。
一般情况下,未经驯化的厌氧微生物对TAN和FAN的耐受阈值浓度分别为1700~7000 mg/L和53~1450 mg/L[29]。在牛粪高温厌氧消化过程中,Zeeman等[14]发现,未进行驯化的污泥在TAN浓度1700 mg/L时受到抑制,而驯化后的污泥在氨氮浓度为3300 mg/L时才受抑制。Fotidis等[30]也发现相似的趋势,未驯化的微生物体系对TAN的耐受阈值是5000 mg/L,而驯化后的微生物体系的对TAN耐受阈值提高可至7000 mg/L。表2总结了关于驯化对微生物耐受氨氮的浓度范围,可见微生物经过驯化后能提高其对氨氮的耐受能力。
表1 餐厨垃圾共消化与单独厌氧消化对比
Table 1 Comparison of food waste and anaerobic co-digestion
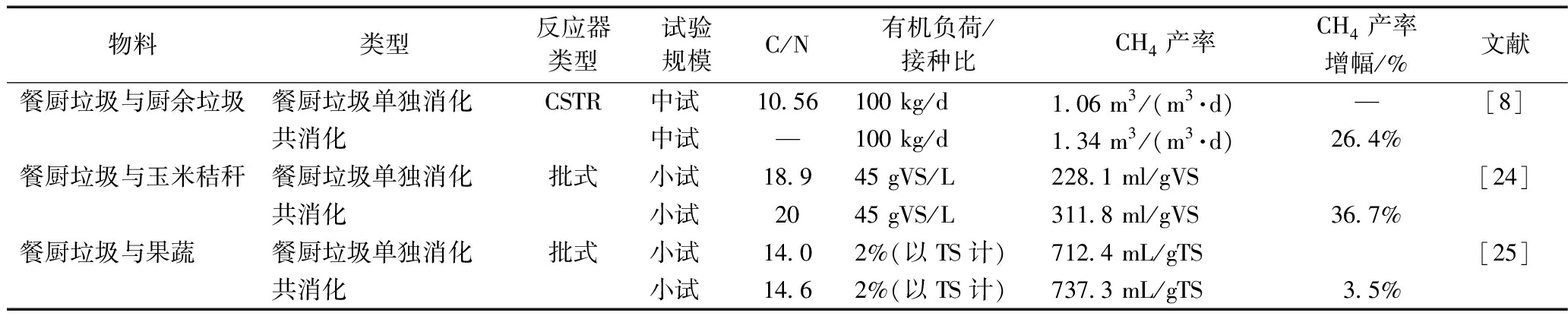
物料类型反应器类型试验规模C/N有机负荷/接种比CH4产率CH4产率增幅/%文献餐厨垃圾与厨余垃圾餐厨垃圾单独消化CSTR中试10.56100 kg/d1.06 m3/(m3·d)—[8]共消化中试—100 kg/d1.34 m3/(m3·d)26.4%餐厨垃圾与玉米秸秆餐厨垃圾单独消化批式小试18.945 gVS/L228.1 ml/gVS[24]共消化小试2045 gVS/L311.8 ml/gVS36.7%餐厨垃圾与果蔬餐厨垃圾单独消化批式小试14.02%(以TS计)712.4 mL/gTS[25]共消化小试14.62%(以TS计)737.3 mL/gTS3.5%
表2 微生物驯化后的物料厌氧消化氨氮浓度
Table 2 List of anaerobic digestion ammonia concentration of domesticated microorganisms
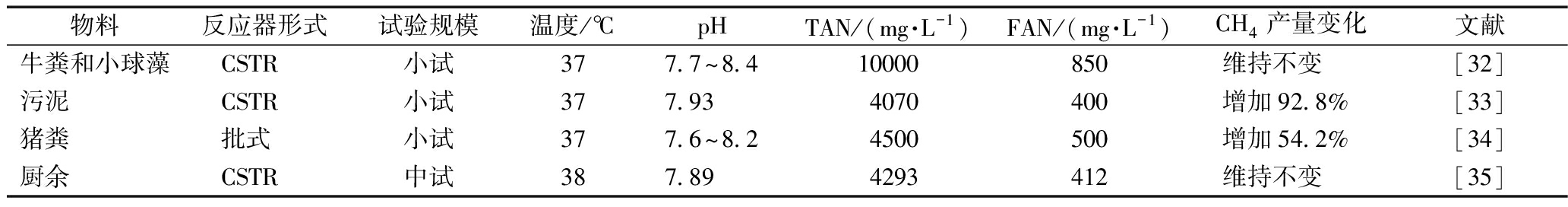
物料反应器形式试验规模温度/℃pHTAN/(mg·L-1)FAN/(mg·L-1)CH4产量变化文献牛粪和小球藻CSTR小试377.7~8.410000850维持不变[32]污泥CSTR小试377.934070400增加92.8%[33]猪粪批式小试377.6~8.24500500增加54.2%[34]厨余CSTR中试387.894293412维持不变[35]
注:TAN和FAN表示驯化后适应浓度。
另一方面,经过驯化的微生物可作为微生物功能菌剂加入到厌氧消化反应器中,从而增强反应器耐受氨氮能力,提高厌氧消化系统稳定性。Fotidis等[31]利用对氨氮耐受能力较高的互营乙酸发酵产甲烷菌属(SAO)Methanoculleus spp.和氢营养型产甲烷菌(Methanoculleus bourgensis),在高氨氮浓度(4 g/L)下对粪便和有机物共同连续厌氧消化,相比于添加单一菌属的对照组,混合功能菌群的加入使体系甲烷产率增加31.8%,提高了反应器在高氨氮下的甲烷产率。上述结果表明,生物添加技术可以在不影响反应器正常运行情况下,调节反应器耐受氨氮的能力,但寻找适应环境快且生长速度快的耐受氨氮微生物是生物添加技术的难点。
2.3 氨氮去除
通过一定技术手段将体系内产生的氨氮去除是缓解体系氨氮抑制的另外一种快速有效的方法,短时间内能显著降低体系内氨氮浓度,包括投加添加剂、进行氨吹脱等。
2.3.1 添加剂
添加剂能通过吸附作用和离子交换作用去除液相中的氨氮,同时也能通过改变微生物与底物的附着关系,提高微生物对底物的降解能力和产气效率。其中,沸石、膨润土和鸟粪石等是已见报道的添加剂。沸石的主要作用为通过吸附和离子交换去除液相ANC,以及对微生物进行固定[36,37]。Milan等[38]比较了钾基、钠基、钙基和镁基等不同类型沸石对养猪废水中氨氮的吸附去除效果,发现钠基沸石对氨氮的去除效果最好,吸附10 h对氨氮去除能力即达到91%。Tao等[39]发现,加入斜发沸石和强酸型阳离子交换树脂对污泥厌氧消化液的氨氮去除率分别为50%和70%,显著缓解体系的氨氮抑制。Wang等[40]使用鸟粪石处理以蛋白质为原料的两级厌氧消化系统的氨氮抑制问题,经鸟粪石处理后TAN降低70%以上,甲烷产率增加41.7%。Angelidaki等[41]对出现产气抑制的牛粪厌氧消化反应器添加膨润土后,反应器甲烷产率恢复到稳定产沼水平。综上,添加剂不仅依靠其强大的离子交换能力去除反应系统中的氨氮,还能改变微生物与底物附着状态,提高厌氧消化效率增加甲烷产率,但这类添加剂对反应器和管道系统的抗堵塞性能提出了新要求,需慎用。
2.3.2 氨吹脱
氨吹脱是厌氧消化过程去除氨氮的另外一种常用方法。通过同时提高体系pH和温度并不断搅拌等方法,使厌氧消化系统中FAN尽可能地进入空气,而从厌氧消化系统去除。其中,侧流吹脱是去除氨氮的有效方式。Pedizzi等[42]对富氮物料厌氧消化体系使用空气侧流吹脱,2个反应器的氨氮浓度分别从1.1~4.2 g/L和2~4.5 g/L降至0.6 g/L以下。然而,空气吹脱会对厌氧消化微生物产生危害,因此Bousek等[43]提出使用烟气作为侧流吹脱的空气替代,从而减少氧气对厌氧发酵产生的抑制,同时烟气的潜热在后续的气提单元中还能得到重复利用。但该项技术目前仅限于实验室和中试阶段,大规模应用由于造价和运行费用高昂而面临困难。
3 结束语
我国餐厨垃圾经“湿热除油”工艺处理后C/N会出现下降,再进行厌氧消化时极易出现氨氮抑制的问题。FAN对厌氧消化系统的影响大,其浓度主要受pH和温度影响。对国内外相关研究进行归纳总结可知,缓解氨氮抑制的方法主要包括以下4个方面:1)提高物料C/N。通过调整湿热预处理的温度和时间,或通过与高C/N物料(如厨余、秸秆和果蔬等)进行共消化,提高物料C/N。2)厌氧消化参数控制。调节厌氧消化过程pH,可减少厌氧消化系统中FAN产生,减少氨氮抑制;相比高温厌氧消化,中温及低温厌氧消化受到的氨氮抑制影响更小。3)厌氧消化氨去除。氨氮浓度过高后,通过加入添加剂或进行氨吹脱,直接对体系氨氮进行去除。4)微生物驯化。反应器运行初期选定合适的驯化方式驯化微生物逐步适应高氨氮水平,必要时使用添加剂进行辅助驯化。
上述方法中,鉴于运行成本和设施造价等考虑,提高物料的C/N和进行微生物氨氮驯化是解决氨氮抑制的主要常用方法,也将是未来的重要研究方向。
[1] Ariunbaatar J, Panico A, Esposito G, et al.Pretreatment methods to enhance anaerobic digestion of organic solid waste[J].Applied Energy, 2014,123:143-156.
[2] Li Y Y, Jin Y Y, Li J H, et al.Effects of thermal pretreatment on degradation kinetics of organics during kitchen waste anaerobic digestion[J].Energy, 2017,118:377-386.
[3] 农传江,徐智,汤利,等.餐厨垃圾特性及处理技术分析[J].环境工程,2014,32(增刊1):626-629.
[4] 郝春霞,陈灏,赵玉柱.餐厨垃圾厌氧发酵处理工艺及关键设备[J].环境工程,2016,34(增刊1):691-695.
[5] Vaidya R, Boardman G D, Novak J T, et al.Effect of high strength food wastes on anaerobic co-digestion of sewage sludge[J].Water Environment Research, 2018,90(4):293-306.
[6] Ren L H, Nie Y F, Liu J G, et al.Impact of hydrothermal process on the nutrient ingredients of restaurant garbage[J].Journal of Environmental Sciences (China), 2006,18(5):1012-1019.
[7] Jin Y Y, Li Y Y, Li J H.Influence of thermal pretreatment on physical and chemical properties of kitchen waste and the efficiency of anaerobic digestion[J].Journal of Environmental Management, 2016,180:291-300.
[8] 王金辉.餐厨垃圾固相物料干式厌氧消化处理研究[D].宁波:宁波大学,2017.
[9] Shi X C, Lin J, Zuo J N, et al.Effects of free ammonia on volatile fatty acid accumulation and process performance in the anaerobic digestion of two typical bio-wastes[J].Journal of Environmental Sciences, 2017,55(5):49-57.
[10] Kayhanian M.Ammonia inhibition in high-solids biogasification: an overview and practical solutions[J].Environmental Technology, 1999,20(4):355-365.
[11] Fotidis I A, Karakashev D, Angelidaki I.The dominant acetate degradation pathway/methanogenic composition in full-scale anaerobic digesters operating under different ammonia levels[J].International Journal of Environmental Science and Technology, 2014,11(7):2087-2094.
[12] Schnürer A, Nordberg Å.Ammonia, a selective agent for methane production by syntrophic acetate oxidation at mesophilic temperature[J].Water Science and Technology, 2008,57(5):735-740.
[13] Hansen K H, Angelidaki I, Ahring B K.Anaerobic digestion of swine manure Inhibitionby ammonia [J].Water Research, 1998,32(1):5-12.
[14] Zeeman G, Wiegant W M, Koster-Treffers M E, et al.The influence of the total-ammonia concentration on the thermophilic digestion of cow manure[J].Agricultural Wastes, 1985,14(1):19-35.
[15] Fernandes T V, Keesman K J, Zeeman G, et al.Effect of ammonia on the anaerobic hydrolysis of cellulose and tributyrin[J].Biomass and Bioenergy, 2012,47:316-323.
[16] Rajagopal R, Massé D I, Singh G.A critical review on inhibition of anaerobic digestion process by excess ammonia[J].Bioresource Technology, 2013,143:632-641.
[17] Chen Y, Cheng J J, Creamer K S.Inhibition of anaerobic digestion process: a review[J].Bioresource Technology, 2008,99(10):4044-4064.
[18] Angelidaki I, Ahrino B K.Anaerobic thermophilic digestion of manure at different ammonia loads: effect of temperature[J].Water Reasearch, 1994,28(3):727-731.
[19] Massé D I, Masse L, Croteau F.The effect of temperature fluctuations on psychrophilic anaerobic sequencing batch reactors treating swine manure[J].Bioresource Technology, 2003,89(1):57-62.
[20] Resch C, Wörl A, Waltenberger R, et al.Enhancement options for the utilisation of nitrogen rich animal by-products in anaerobic digestion[J].Bioresource Technology, 2011,102(3):2503-2510.
[21] Tampio E, Ervasti S, Paavola T, et al.Anaerobic digestion of autoclaved and untreated food waste[J].Waste Management, 2014,34(2):370-377.
[22] Tampio E, Ervasti S, Rintala J.Characteristics and agronomic usability of digestates from laboratory digesters treating food waste and autoclaved food waste[J].Journal of Cleaner Production, 2015,94:86-92.
[23] Ding L, Cheng J, Qiao D, et al.Investigating hydrothermal pretreatment of food waste for two-stage fermentative hydrogen and methane co-production[J].Bioresource Technology, 2017,241:491-499.
[24] 周祺,刘研萍,邹德勋,等.餐厨垃圾与玉米秸秆联合厌氧消化产甲烷性能的试验研究[J].中国沼气, 2014, 32(1):27-31.
[25] 吕琛,袁海荣,王奎升,等.果蔬垃圾与餐厨垃圾混合厌氧消化产气性能[J].农业工程学报, 2011, 27(增刊1):91-95.
[26] 胡崇亮,张栋,戴翎翎,等.厌氧消化过程氨抑制研究进展[J].环境工程,2016,34(12):23-27.
[27] Park J, Yoon J, Kumar G, et al.Effects of acclimation and pH on ammonia inhibition for mesophilic methanogenic microflora[J].Waste Management, 2018, 80:218-223.
[28] Tian H L, Fotidis I A, Mancini E, et al.Acclimation to extremely high ammonia levels in continuous biomethanation process and the associated microbial community dynamics[J].Bioresource Technology, 2018, 247:616-623.
[29] Ren Y Y, Yu M, Wu C F, et al.A comprehensive review on food waste anaerobic digestion: research updates and tendencies[J].Bioresource Technology, 2018,247:1069-1076.
[30] Fotidis I A, Karakashev D, Kotsopoulos T A, et al.Effect of ammonium and acetate on methanogenic pathway and methanogenic community composition[J].FEMS Microbiology Ecology, 2013,83(1):38-48.
[31] Fotidis I A, Wang H, Fiedel N R, et al.Bioaugmentation as a solution to increase methane production from an ammonia-rich substrate[J].Environmental Science & Technology, 2014,48(13):7669-7676.
[32] Tian H L, Fotidis I A, Mancini E, et al.Acclimation to extremely high ammonia levels in continuous biomethanation process and the associated microbial community dynamics[J].Bioresource Technology, 2018,247:616-623.
[33] Chen S S, He J, Wang H Y, et al.Microbial responses and metabolic pathways reveal the recovery mechanism of an anaerobic digestion system subjected to progressive inhibition by ammonia[J].Chemical Engineering Journal, 2018,350:312-323.
[34] Yang Y, Yang F, Huang W W, et al.Enhanced anaerobic digestion of ammonia-rich swine manure by zero-valent iron: with special focus on the enhancement effect on hydrogenotrophic methanogenesis activity[J].Bioresource Technology, 2018,270:172-179.
[35] Gao S M, Zhao M X, Chen Y, et al.Tolerance response to in situ ammonia stress in a pilot-scale anaerobic digestion reactor for alleviating ammonia inhibition[J].Bioresource Technology, 2015,198:372-379.
[36] Krakat N, Demirel B, Anjum R, et al.Methods of ammonia removal in anaerobic digestion: a review[J].Water Science and Technology, 2017,76(8):1925-1938.
[37] 霍永杰,汤化伟,程志磊,等.沸石对氨氮吸附的研究[J].环境工程,2015,33(增刊1):244-247.
[38] Milan Z, Sánchez E, Weiland P, et al.Ammonia removal from anaerobically treated piggery manure by ion exchange in columns packed with homoionic zeolite[J].Chemical Engineering Journal, 1997,66(1):65-71.
[39] Tao B, Donnelly J, Oliveira I, et al.Enhancement of microbial density and methane production in advanced anaerobic digestion of secondary sewage sludge by continuous removal of ammonia[J].Bioresource Technology, 2017,232:380-388.
[40] Wang H, Zhang Y F, Angelidaki I.Ammonia inhibition on hydrogen enriched anaerobic digestion of manure under mesophilic and thermophilic conditions[J].Water Research, 2016,105:314-319.
[41] Angelidaki I, Ahring B K.Effect of the clay mineral bentonite on ammonia inhibition of anaerobic thermophilic reactors degrading animal waste[J].Biodegradation, 1993,3(4):1923-1929.
[42] Pedizzi C, Lema J M, Carballa M.Enhancing thermophilic co-digestion of nitrogen-rich substrates by air side-stream stripping[J].Bioresource Technology, 2017,241:397-405.
[43] Bousek J, Scroccaro D, Sima J, et al.Influence of the gas composition on the efficiency of ammonia stripping of biogas digestate[J].Bioresource Technology, 2016,203:259-266.