0 引 言
我国是农业大国,2014年我国的农作物秸秆资源总量达到8.97亿t[1]。秸秆资源经济合理化的利用是实现我国由传统农业向现代农业转变的重要保证之一。但秸秆中含有大量的木质纤维素,难以被生物降解,通过热化学的方式可先转化为合成气(主要成分为CO、H2),进而通过厌氧消化将合成气转化为高附加值产品(乙酸、丁酸)[2-3]。其中,乙酸作为一种重要的有机化工原料被广泛应用于轻纺、医药、印染等不同行业。因此,利用微生物将合成气转化为乙酸具有重要的现实意义[4-5]。
在众多影响厌氧发酵过程的因素中,pH和温度是较为关键的两个。Xu等[6]的研究表明初始pH为中性时有利于乙酸的生成,但Rao等[7]的研究则表明碱性pH值有利于合成气转化为挥发性脂肪酸(VFA)。产酸最佳pH不同可能是由于反应条件、底物、接种物的差异所导致。此外,在合成气厌氧发酵制取乙酸的过程中,产甲烷过程需要受到抑制。但目前通过外力加热,或通过添加酸、碱等抑制产甲烷菌[8]等方法成本较高,且对产甲烷菌的抑制时间较短。研究表明,维持碱性的发酵条件可以长期有效抑制产甲烷菌活性[9-10]。温度对厌氧发酵过程同样会产生显著影响,此前对合成气产乙酸的研究主要集中在中温条件[11-13]。然而前人研究表明,中温条件(35~38℃)为产甲烷菌的最适生长温度,同型产乙酸菌的最适温度为20℃左右[14]。因此,确定最适宜的pH和温度条件对合成气高效定向产乙酸具有重要意义。
本文研究了不同恒定碱性pH和温度对合成气厌氧转化乙酸的影响,并在此基础上进行长期运行,探究高效定向的发酵条件,为实现合成气厌氧发酵制取乙酸的工业化应用提供参考。
1 实验部分
1.1 接种物和底物
接种污泥取自北京市某中温污水处理厂。实验前将接种物在120 ℃下热处理1 h,用于抑制产甲烷菌的活性。合成气由人工配制,主要成分为H2(50%)、CO2(25%)、CO(25%)。此外,为维持厌氧发酵系统的稳定运行,向反应器中添加标准营养液[15],其主要成分包含葡萄糖、碳酸氢钠与其他元素。
1.2 实验设计
间歇实验在500 mL厌氧发酵瓶中进行,在反应瓶中加入50 mL的接种物,用营养液调整体积至150 mL,葡萄糖浓度为3 g/L。利用自动滴定器加入4 mol/L的NaOH溶液来调节混合液的pH分别保持恒定为9.0和10.0。使用N2(第1阶段)或合成气(第2阶段)驱除瓶中残余的氧气后,迅速用丁基橡胶塞将反应瓶密封,置于2个摇床中,发酵温度分别为20 ℃(C)和37 ℃(Z),实验共设置Z-9、Z-10、C-9、C-10处理组,摇床的振荡速率为150 r/min。间歇实验共运行23 d。反应过程中定期量取气体体积,用气相色谱仪分析气体组成。为了确保实验的准确性,每个样品均重复3次。
连续实验在6 L的CSTR反应器(图1)中进行,在反应器中加入1.5 L的接种物,添加营养液使工作体积为5 L,葡萄糖负荷为0.33 g/(L·d)。不同阶段合成气通入量分别为0,1,2,3,5 L/d。水力停留时间(HRT)为3 d,用NaOH溶液调控反应器维持pH恒定为9.0。
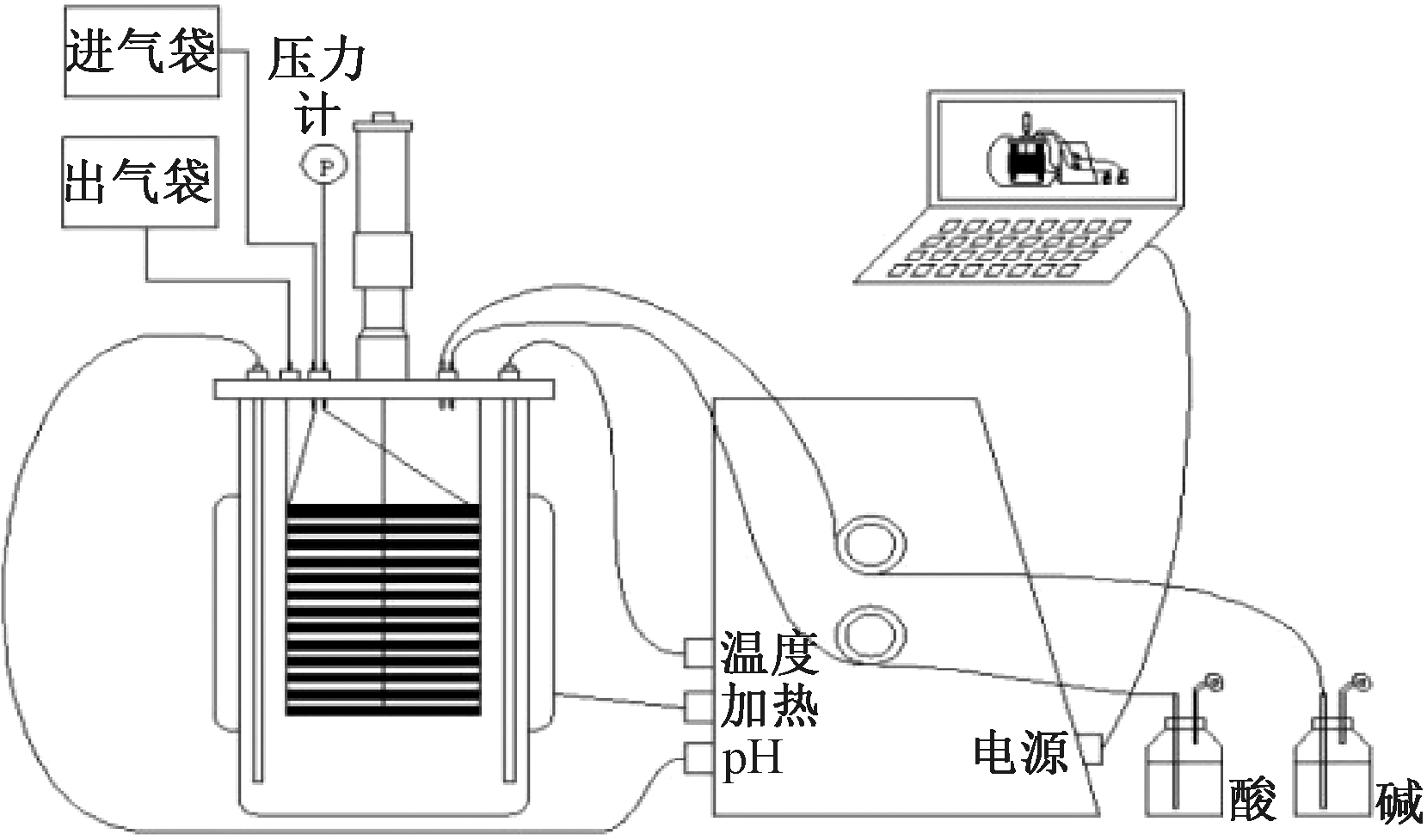
图1 CSTR反应器示意
Fig.1 Experimental instrument
1.3 分析方法
分析液体样品前,在10000 r/min下离心10 min,用0.22 μm的滤膜过滤,滤液用以测定还原糖、可溶性化学需氧量(SCOD)、VFA(包含乙酸、丙酸、异丁酸、正丁酸、异戊酸)及乙醇。其中,还原糖采用苯酚-硫酸法测定[16],SCOD采用标准方法测定[17]。VFA和乙醇检测用安捷伦气相色谱仪(Agilent,7890A)FID 检测器,配以毛细管柱DB-wax(30 m×530 μm×1.0 μm),N2为载气,流速为10 mL/min,进样体积为1.0 μL。气体(包含H2、CO2、CH4、CO)检测采用安捷伦气相色谱仪(Agilent, 7890B)配TCD检测器,使用氦气作为载气,检测器和柱温温度分别为220 ℃和60 ℃。pH测定使用le438 pH电极(Mettler Toledo, 美国)。体系中压力的变化使用3151 WAL-BMP压力感应器(WAL Mess-und Regelsysteme GmbH, 德国)进行测定,通过压力法测量反应器内的产气体积,体积的计算见式(1)[17]:
![]()
(1)
式中:Vgas为气体的体积,L;ΔP为绝对压力差,Pa;Vhead为反应器顶部空间,L;C为摩尔体积,22.4 L/mol;T为绝对温度,K;R为通用气体常数,83.14 L·Pa/(K·mol)。
2 结果与讨论
2.1 不同pH和温度对微生物吸收合成气定向产酸的影响
图2为不同温度和pH下,各反应器在通气前(阶段Ⅰ)和通气后(阶段Ⅱ)的产酸变化过程。

![]() 乙酸;
乙酸;![]() 丙酸;
丙酸;![]() 丁酸;
丁酸;![]() 戊酸。
戊酸。
图2 不同温度和pH下TVFA的浓度和组成
Fig.2 The concentration and composition of TVA in different temperatures and pH
阶段Ⅰ中,pH和温度对累积产酸的影响非常显著。在中温条件下,pH从9.0提高至10.0时,挥发性脂肪酸总量(TVFA)由6638.6 mg/L(Z-9)降低至5482.9 mg/L(Z-10)。在室温条件下,pH从9.0提高至10.0时,TVFA由5315.1 mg/L(C-9)降低至3724.6 mg/L(C-10)。中温条件下TVFA含量比室温条件下TVFA含量分别高24.9%(pH为9)和47.2%(pH为10)。虽然Z-10与C-9中的TVFA含量比Z-9中TVFA的含量低17%~19%(P<0.05),但是葡萄糖降解率在这3个反应器中均>90%。C-10中TVFA含量最低,原因主要是因为葡萄糖的降解率只有70%。
通入合成气后(阶段Ⅱ),在中温条件下,Z-9和Z-10的TVFA含量分别达到9487.2 mg/L和6333.3 mg/L,与阶段Ⅰ相比TVFA含量分别增加了42.9%和15.5%。在室温条件下,C-9和C-10的TVFA含量分别达到8527.1 mg/L和6144.8 mg/L,与阶段Ⅰ相比增加了60.4%和65.0%。通入合成气后,各组葡萄糖降解率无明显变化,这表明合成气的通入不会抑制微生物对葡萄糖的吸收转化,这也与之前的研究相符[18]。
表1为不同阶段下各反应器TVFA组成和气体转化。可知:阶段Ⅰ中,在Z-9,Z-10,C-9和C-10中乙酸均是最主要产物,分别占TVFA的67.5%、70.5%、74.9%、77.3%。在通入合成气后(阶段Ⅱ),乙酸含量顺序为:Z-9>C-9>C-10>Z-10。这说明pH为9的条件更适宜微生物转化合成气高效定向产乙酸。Z-9中的乙酸含量为7326.7 mg/L,占TVFA的77.2%,与阶段Ⅰ相比增长了63%。C-9中的乙酸含量为7149.6 mg/L,这比Z-9中乙酸含量低了2%,这可能是由于微生物在室温条件下活性要稍低于中温条件,但乙酸含量在TVFA的占比可达83.8%。因此,在中、室温条件下均适宜微生物转化合成气制取乙酸。
H2和CO的转化率在4个反应器内差异较大,其具体转化效率见表1。在所有反应器中,pH为9的反应器中H2和CO的转化率均高于pH为10的反应器。其中,C-9反应器得到最高的合成气转化率(H2:99%,CO:92%),Z-9中H2和CO的转化率也均超过90%。合成气转化率与TVFA和乙酸增长的数据相吻合。上述实验结果表明,pH 9更适宜微生物转化合成气制取乙酸。相关研究也表明,通常情况下多数原核生物适宜在中性条件下(pH 6~9)生长,产乙酸菌在pH 7~9的条件下具有较高的活性[19-20]。
表1 不同阶段下各反应器的TVFA组成和气体转化
Table 1 The performance of reactors in different stages
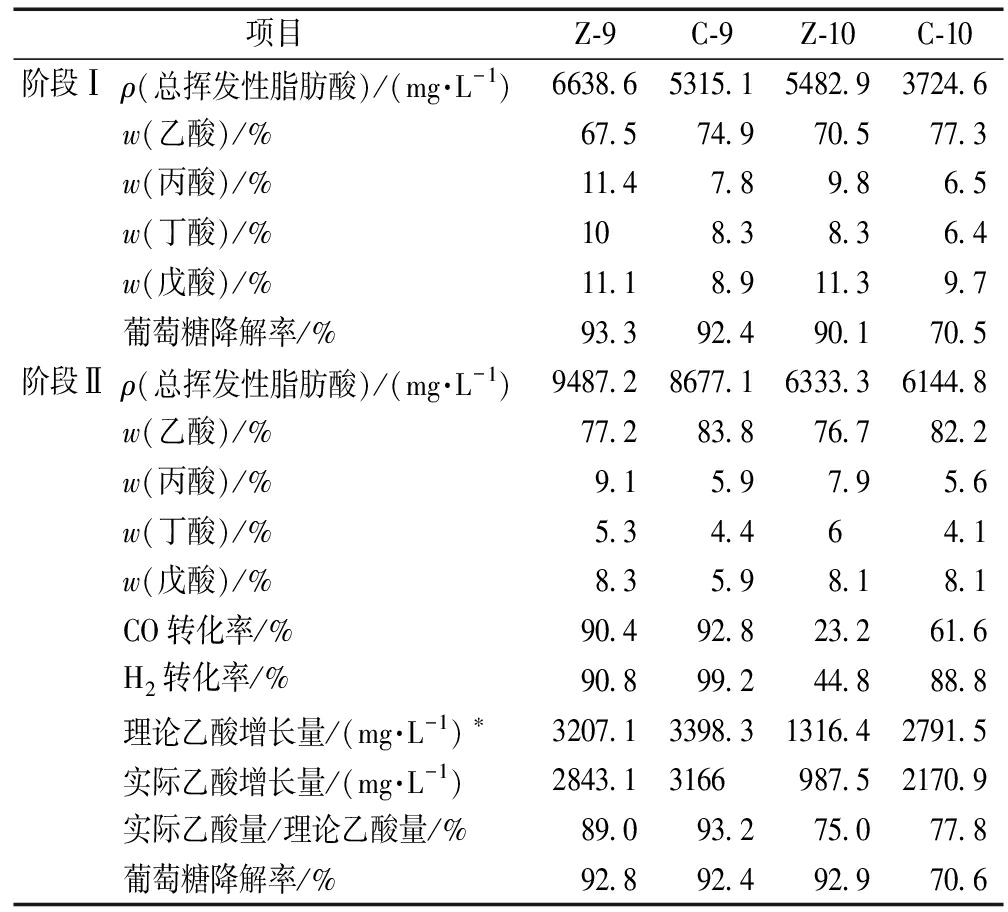
项目Z-9C-9Z-10C-10阶段Ⅰρ(总挥发性脂肪酸)/(mg·L-1)6638.65315.15482.93724.6w(乙酸)/%67.574.970.577.3w(丙酸)/%11.47.89.86.5w(丁酸)/%108.38.36.4w(戊酸)/%11.18.911.39.7葡萄糖降解率/%93.392.490.170.5阶段Ⅱρ(总挥发性脂肪酸)/(mg·L-1)9487.28677.16333.36144.8w(乙酸)/%77.283.876.782.2w(丙酸)/%9.15.97.95.6w(丁酸)/%5.34.464.1w(戊酸)/%8.35.98.18.1CO转化率/%90.492.823.261.6H2转化率/%90.899.244.888.8理论乙酸增长量/(mg·L-1)∗3207.13398.31316.42791.5实际乙酸增长量/(mg·L-1)2843.13166987.52170.9实际乙酸量/理论乙酸量/%89.093.275.077.8葡萄糖降解率/%92.892.492.970.6
注:*根据(4CO+2H2O→CH3COOH+2CO2和4H2+2 CO2→CH3COOH+2H2O)可知,理论上4 mol H2或4 mol CO可以制备1 mol乙酸。
2.2 合成气通入量对微生物定向产酸的影响
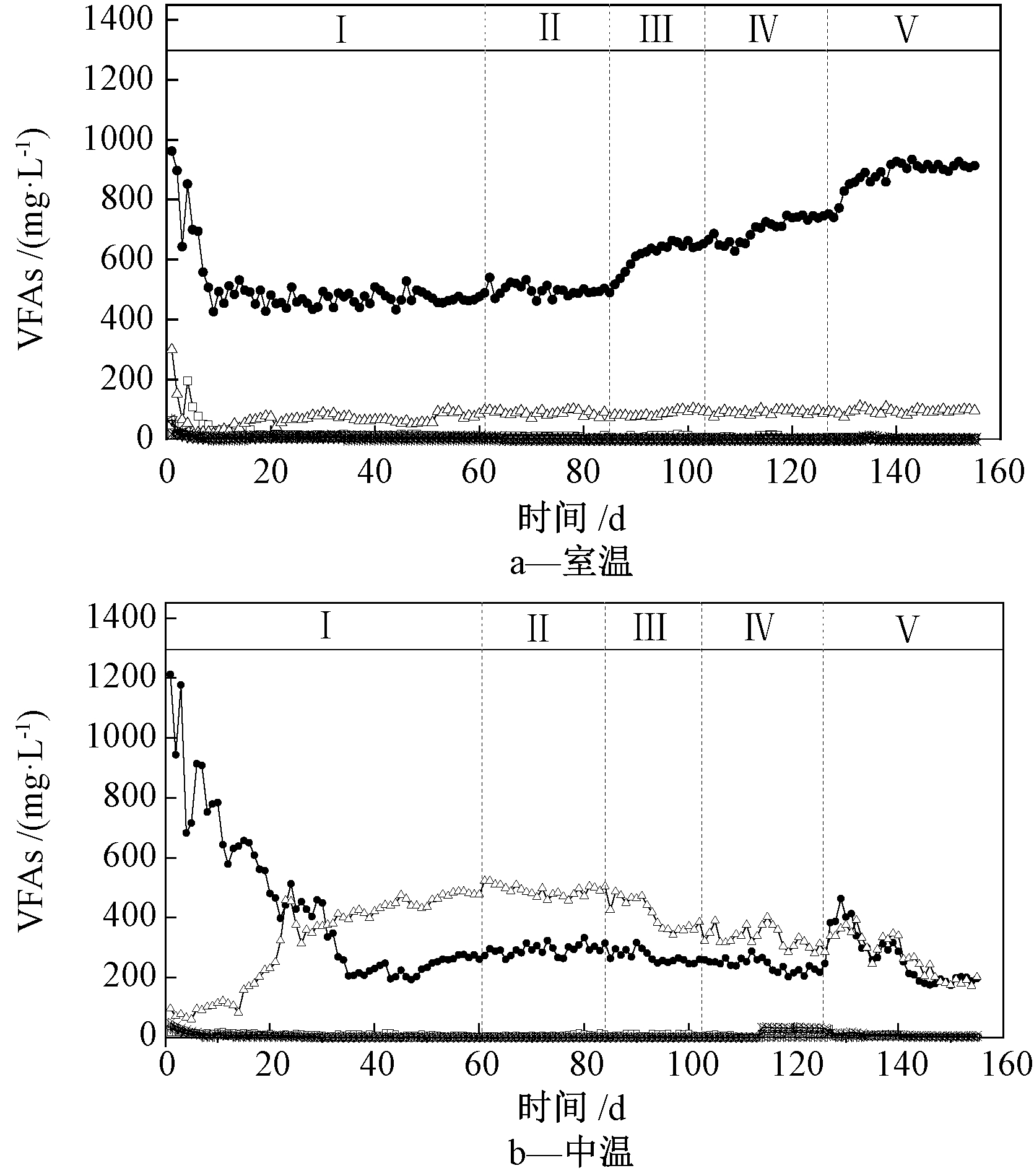
根据间歇实验的结果,在CSTR反应器中进行混合微生物转化合成气制取乙酸的连续实验,探究合成气生物转化制取乙酸长期稳定运行的可行性。图3为不同温度下,通入不同体积合成气后液相中VFA的浓度。合成气在阶段Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ的通入量分别为0,1,2,3,5 L/d。
![]() —乙醇;
—乙醇;![]() —乙酸;
—乙酸;![]() —丙酸;
—丙酸;![]() —异丁酸;
—异丁酸;![]() —正丁酸;
—正丁酸;![]() —异戊酸。
—异戊酸。
图3 室温和中温下不同运行阶段VFA/乙醇产量
Fig.3 The concentration of VFA at different operating stages at room temperature and mesophilic temperature
阶段Ⅰ中,室温(C)、中温(Z)条件的TVFA含量分别为749.2,551.1 mg/L,说明单纯以葡萄糖为发酵基质时,中温比室温更有利于葡萄糖降解产酸,这与间歇实验的结果相吻合。如图4所示:从阶段Ⅱ开始至阶段Ⅴ,随着体系中通入合成气量的增加,室温系统产酸量整体呈上升趋势。阶段Ⅱ至阶段Ⅴ,室温反应器中的TVFA含量分别为580.4,736.8,828.6,1003.7 mg/L。
然而,中温反应器在阶段Ⅱ至阶段Ⅴ的TVFA含量分别为796.3,634.2,580.4,385.8 mg/L。从阶段Ⅲ开始,中温系统产酸量呈下降趋势,TVFA含量不断降低。通过对系统产甲烷情况进行监测(图5),发现在通入2 L合成气后,体系内开始有甲烷生成,随着通气量的增长,甲烷产量不断增长,这与体系内产酸量不断下降相吻合。本实验也说明了在中温pH为9的条件下,即使是经过高温灭菌,长时间培养后产甲烷菌的活性也可能得到恢复。Zhang等[21]通过添加2-溴乙烷磺酸钠来抑制合成气产甲烷过程,但其作用效果是短暂的。因此,控制合适的pH和温度对微生物转化合成气高效定向制取乙酸至关重要。
![]() 乙酸;
乙酸;![]() 丙酸;
丙酸;![]() 其他。
其他。
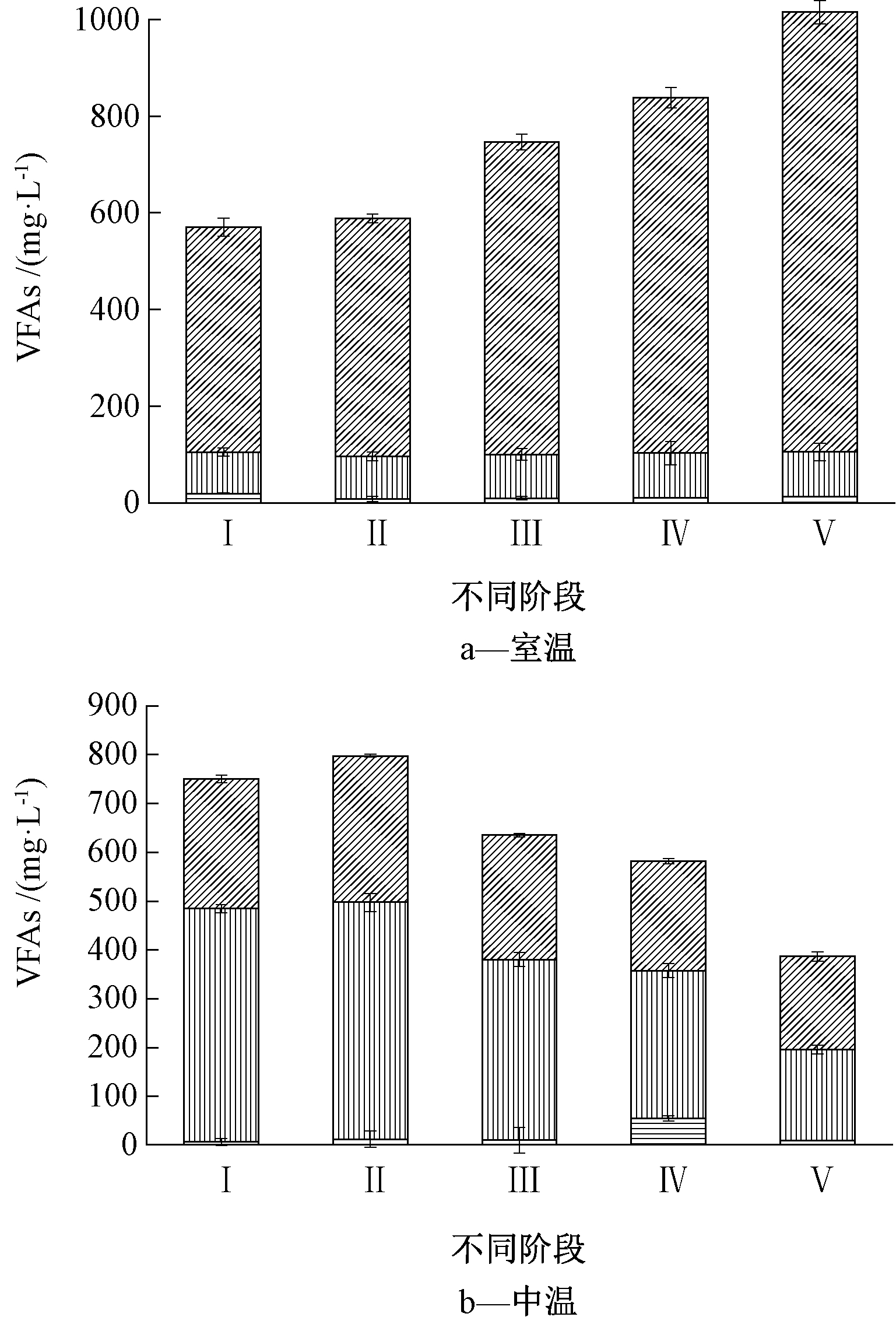
图4 不同运行阶段稳定时期的VFA浓度
Fig.4 The concentration of VFA at stable-state in different operating stages
由图4还可看出:在阶段Ⅰ室温反应器中的乙酸含量为465.5 mg/L,占TVFA的84.5%;而中温反应器的乙酸含量为265.5 mg/L,占TVFA的35.4%,丙酸含量为480 mg/L,占TVFA的63.8%。经过长期运行,室温条件更有利于反应定向产乙酸,而中温条件则有利于朝定向产丙酸的方向发展。在阶段Ⅱ至阶段Ⅴ通入不同体积的合成气后,室温反应器A的乙酸含量分别为492.2,646.4,735.7,910.6 mg/L,分别占TVFA的84.5%、84.8%、87.7%、90.7%,乙酸占比不断提升,说明提高通气量对体系定向产乙酸有促进作用。此外,整个过程中产甲烷菌的活性受到完全抑制。如表2所示,在通入合成气后,室温反应器C和中温反应器Z在阶段Ⅱ至阶段Ⅴ对合成气的消耗都达到95%以上。此外,为了探究乙酸增加与合成气消耗是否有关,计算了实际产乙酸量与理论产乙酸量的比值。消耗合成气的理论产乙酸量利用反应式(1)和(2)来计算。通过计算发现在室温条件下,实际产乙酸量与理论产乙酸量的比值均在90%以上,这表明消耗的合成气基本都转化为乙酸。中温反应器中,甲烷的生成导致乙酸含量的降低,因此实际转化率难以计算。此外,对于该系统中甲烷的生成途径(乙酸转化/合成气转化)还需要进一步研究。综上所述,室温和pH恒定为9的发酵条件适宜微生物利用合成气定向制取乙酸,也表明微生物转化合成气高效定向制取乙酸是可以长期稳定运行的。
4CO+2H2O→CH3COOH+2CO2
(1)
4H2+2CO2→CH3COOH+2H2O
(2)

![]() —Z-CH4;
—Z-CH4;![]() —C-CH4。
—C-CH4。
图5 中温和室温条件下不同运行阶段的甲烷产量
Fig.5 CH4 production in different operating stages under room temperature and mesophilic temperature
表2 不同阶段合成气吸收转化的情况
Table 2 Syngas consumption during the process of fermentation at different stages under mesophilic condition and psychrophilic condition
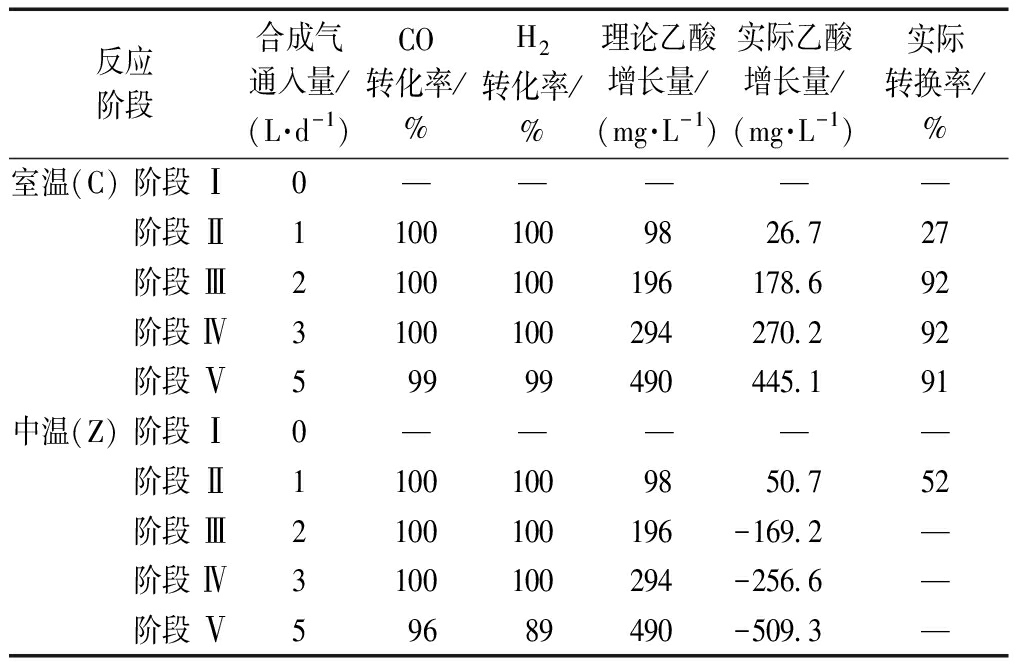
反应阶段合成气通入量/(L·d-1)CO转化率/%H2转化率/%理论乙酸增长量/(mg·L-1)实际乙酸增长量/(mg·L-1)实际转换率/%室温(C)阶段 Ⅰ0—————阶段 Ⅱ1100 100 9826.727阶段 Ⅲ2100 100 196178.692阶段 Ⅳ3100 100 294270.292阶段 Ⅴ599 99 490445.191中温(Z)阶段 Ⅰ0—————阶段 Ⅱ1100 100 9850.752阶段 Ⅲ2100 100 196-169.2—阶段 Ⅳ3100 100 294-256.6—阶段 Ⅴ596 89 490-509.3—
3 结 论
1)本研究表明,pH和温度均对合成气定向产乙酸有明显的影响。间歇实验结果表明,相比于pH为10,pH为9更有利于微生物转化合成气定向产乙酸,中温和室温条件均适于微生物转化合成气定向制取乙酸。
2)连续实验表明,当pH恒定为9时,室温比中温的发酵条件更有利于反应转化合成气定向制取乙酸。在室温且pH恒定为9的发酵条件下,随着体系中合成气通入量的增加,CO和H2的转化率均在90%以上,且无甲烷产生。在此条件下,VFA的含量也随着合成气通入量的增加而增加,且乙酸在产物中的占比均在90%以上。而中温且pH恒定为9的发酵条件下,甲烷开始产生并逐渐增加,即使是经过高温灭菌,长时间培养后产甲烷菌的活性会得到恢复。
综上所述,室温且pH恒定为9的发酵条件适宜微生物利用合成气定向制取乙酸,在此条件下,微生物转化合成气高效定向制取乙酸具有长期运行稳定性。
[1] 张崇尚, 刘乐, 陆岐楠, 等.中国秸秆能源化利用潜力与秸秆能源企业区域布局研究[J].资源科学, 2017, 39(3):473-481.
[2] Guiot S R, Ruxandra C, Ga⊇L C.Potential of wastewater-treating anaerobic granules for biomethanation of synthesis gas[J].Environmental Science & Technology, 2011, 45(5):2006-2012.
[3] Luo G,Wang W, Angelidaki I.Anaerobic digestion for simultaneous sewage sludge treatment and CO biomethanation: process performance and microbial ecology[J].Environmental Science & Technology, 2013, 47(18):10685-10693.
[4] Fast A G, Schmidt E D, Jones S W, et al.Acetogenic mixotrophy: novel options for yield improvement in biofuels and biochemicals production[J].Current Opinion Biotechnology, 2015, 33:60-72.
[5] Bredwell M D,Srivastava P,Worden R M.Reactor design issues for synthesis-gas fermentations[J].Biotechnology Progress, 2010, 15(5):834-844.
[6] Xu S Y, Fu B, Zhang L J, et al.Bioconversion of H2/CO2 by acetogen enriched cultures for acetate and ethanol production: the impact of pH[J].World Journal of Microbiology & Biotechnology, 2015, 31(6):941-950.
[7] Kundiyana D K, Wilkins M R, Prasanth M, et al.Effect of temperature, pH and buffer presence on ethanol production from synthesis gas by “Clostridium ragsdalei”[J].Bioresource Technology, 2011, 102(10):5794-5799.
[8] Wan J J, Jing Y H, Zhang S C, et al.Mesophilic and thermophilic alkaline fermentation of waste activated sludge for hydrogen production: focusing on homoacetogenesis[J].Water Research, 2016, 102:524-532.
[9] Zhao Y X, Chen Y G, Zhang D, et al.Waste activated sludge fermentation for hydrogen production enhanced by anaerobic process improvement and acetobacteria inhibition: the role of fermentation pH[J].Environmental Science & Technology, 2010, 44(9):3317-3323.
[10] Rao Y, Wan J J, Liu Y F, et al.A novel process for volatile fatty acids production from syngas by integrating with mesophilic alkaline fermentation of waste activated sludge[J].Water Research, 2018, 139:372-380.
[11] Datar R P,Rajagopalan SLewis R S.Formation of ethanol from carbon monoxide via a new microbial catalyst[J].Biomass & Bioenergy, 2002, 23(6):487-493.
[12] Heiskanen H,Virkajärvi IViikari L.The effect of syngas composition on the growth and product formation of Butyribacterium methylotrophicum[J].Enzyme & Microbial Technology, 2007, 41(3):362-367.
[13] Guyader N, Jingling L, Lewis A S, et al.Ethanol and acetate production from synthesis gas via fermentation processes using anaerobic bacterium,Clostridium ljungdahlii[J].Biochemical Engineering Journal,2005,27(2):110-119.
[14] Alla N N, Kornelia Z, Francisco V, et al.Evidence for the existence of psychrophilic methanogenic communities in anoxic sediments of deep lakes[J].Applied Environmeatal Microbiology, 2003, 69(3):1832-1835.
[15] Treu L, Campanaro S, Kougias P G, et al.Untangling the effect of fatty acids addition at species level revealed different transcriptional responses of the biogas microbial community members[J].Environmental Science & Technology, 2016, 50(11):6079-6090.
[16] Herbert D,Philipps PStrange R.Carbohydrate analysis[J].Methods Enzymol.B, 1971, 5(680):265-277.
[17] Li Y Q, Zhang R H, Chen C, et al.Biogas production from co-digestion of corn stover and chicken manure under anaerobic wet, hemi-solid, and solid state conditions[J].Bioresource Technology, 2013, 149:406-412.
[18] Jing Y H, Campanaro S, Kougias P, et al.Anaerobic granular sludge for simultaneous biomethanation of synthetic wastewater and CO with focus on the identification of CO-converting microorganisms[J].Water Research, 2017, 126(1):19-28.
[19] Kundiyana D K, Wilkins M R, Maddipati P, et al.Effect of temperature, pH and buffer presence on ethanol production from synthesis gas by “Clostridium ragsdalei”[J].Bioresource Technology, 2011, 102(10):5794-5799.
[20] Liu C, Luo G, Wang W, et al.The effects of pH and temperature on the acetate production and microbial community compositions by syngas fermentation[J].Fuel, 2018, 224:537-544.
[21] Zhang F, Ding J, Zhang Y, et al.Fatty acids production from hydrogen and carbon dioxide by mixed culture in the membrane biofilm reactor[J].Water Research, 2013, 47(16):6122-6129.