0 引 言
对氨基苯胂酸,又称阿散酸,是一种新型的有机砷化合物,被广泛地应用于禽类和养猪业的动物饲料添加剂中[1]。然而,近几年人们发现禽畜体内的阿散酸90%都会以原形形式通过粪便和尿液排泄到环境中[2],并且在生物和非生物作用下降解为高毒性无机砷(如砷酸盐),严重污染土壤和地下水[3],砷会使接触到的生物体易发生癌变[4]以及其他非癌症疾病[5],砷污染最终通过食物链进入人体,从而对人体造成极大伤害[6]。吸附法被认为是一种去除溶液中砷污染可行的方法。近几年,利用吸附技术去除阿散酸已成为研究热点[7-11]。尖晶石铁氧体因其具有多功能特性、可承受性和磁性分离能力等,作为水净化材料应用的首选[12]。本研究使用酒糟作为生物炭原材料,采用共沉淀法将铁酸锰负载得到生物炭负载铁酸锰吸附剂(MFB-MCs),并通过扫描电镜图(SEM)和透射电镜图(TEM)分析MFB-MCs的微观结构和外貌形态,研究溶液初始pH值、吸附剂量、温度等对阿散酸的吸附影响,以期建立1种高效、经济的阿散酸修复技术,为阿散酸的吸附去除提供更有效的方法。
1 实验部分
1.1 主要试剂
一水硫酸锰(MnSO4·H2O,分析纯,99.7%)、六水三氯化铁(FeCl3·6H2O,分析纯,99.7%)、盐酸(HCl,优级纯,99.99%)和4-(二甲氨基)苯甲醛(C9H11NO,分析纯,99.7%)均购自国药集团化学试剂有限公司;阿散酸(C6H8AsNO3,优级纯,99.99%)购于梯希爱化成工业发展有限公司;酒糟来自酒鬼酒股份有限公司;实验用水均为超纯水。
阿散酸标准溶液的配制方法:准确称量1 g阿散酸粉末,用超声波超声加热至完全溶解,定容至1 L容量瓶中,得到1 g/L的阿散酸标准溶液,常温下避光保存备用。
4-(二甲氨基)苯甲醛溶液的配制方法:准确称取2.5 g 4-(二甲氨基)苯甲醛粉末,用体积比为1∶9盐酸溶液溶解后定容至250 mL容量瓶中,得到1 g/L 4-(二甲氨基)苯甲醛溶液,常温下避光保存备用。
1.2 生物炭负载铁酸锰的制备
实验采用共沉淀法制备MFB-MCs新型复合材料[13]。准确称量5.000 g酒糟置于100 mL超纯水中,在25 ℃水浴恒温下磁力搅拌30 min,混合均匀后加入3.380 g MnSO4·H2O和10.812 g FeCl3·6H2O持续搅拌,待固体全部溶解完全后逐滴加入5 mol/L NaOH调节pH。将得到的混合溶液放置到电热恒温鼓风干燥箱中,60 ℃恒温加热4 h。随后,将得到的沉淀物用超纯水冲洗多次,把未反应以及反应完成的可溶性盐冲洗干净,再次置于干燥箱中,100 ℃恒温干24 h。之后,得到的固体倒入石英舟,在充满N2管式炉中,以升温速率为5 ℃/min,以25 mL/L流量持续充入氮气,恒温时间为60 min,温度为700 ℃条件下,煅烧材料1 h,待炉温冷却至室温后,取出样品,研磨过100目筛,最后用超纯水冲洗材料至中性,烘干备用,得到MFB-MCs。
1.3 实验方法
将100 mL实验瓶中装入50 mL阿散酸污染水溶液(20 mg/L)置于水浴中,恒温振荡5~1440 min,测定不同反应时间MFB-MCs材料对阿散酸的吸附去除效果,除进行阿散酸的吸附动力学实验之外,其他取样时间均相同。实验优化参数设置为:溶液初始pH值为2.0~11.0,MFB-MCs纳米复合材料投加量为0.2~3 g/L,温度为25~45 ℃,反应时间为5~1440 min,阿散酸初始质量浓度为5~300 mg/L。实验反应后用0.45 μm水系微孔滤膜过滤,取一定量上清液置于10 mL的离心管中待测。
1.4 分析方法
使用紫外可见分光光度计(Shimadzu, UV1900, Japan)分析实验反应后溶液剩余阿散酸吸光值;使用扫描电子显微镜(SEM: SEC, SNE-4500M, Korea)对MFB-MCs进行微观结构表征;使用透射电子显微镜(TEM: FEI,Tecnai G2 20,America)对MFB-MCs进行外貌形态表征。
2 结果与讨论
2.1 生物炭负载铁酸锰表征结果
通过MFB-MCs扫描电子显微镜SEM的结果可看出(图1a):铁酸锰和生物炭较好地负载在一起,材料表面附有多孔结构,颗粒状物体广泛分布于孔内及表面。磁性粒子之间的范德华力、磁偶极相互作用等在一定程度上导致纳米粒子的团聚[14]。MFB-MCs透射电镜TEM如图1b所示。通过观察发现,新制备MFB-MCs分散效果较好,有一定的水溶性和分散性,为吸附反应提供了较多的活性点位[15]。

图1 MFB-MCs扫描电子显微镜和透射电镜
Figure 1 Scanning electron microscopy (SEM) and transmission electron microscopy (TEM) of MFB-MCs
2.2 溶液初始pH值对吸附性能的影响
溶液初始pH为2.0~11.0,MFB-MCs对阿散酸的吸附效果如图2所示。可知:当pH=2.0时,阿散酸的吸附最为显著,去除率达到89%以上;随着溶液pH值的升高,阿散酸去除率逐渐降低至34%以下,表明溶液初始pH值对MFB-MCs吸附阿散酸的效果影响较大。溶液初始pH值在吸附过程中不仅影响吸附剂的表面电荷、活性位点等,而且还对吸附物的电离程度和结构构成影响,从而影响吸附剂对吸附物质的吸附效果[9]。在初始pH为2.0时,溶液中主要存在H+和H3O+,其促进了MFB-MCs对阿散酸的吸附。因此,选择以溶液初始pH=2.0进行后续实验。

![]() —去除率;
—去除率; ![]() —剩余阿散酸浓度。
—剩余阿散酸浓度。
图2 pH值对阿散酸去除率的影响
Figure 2 Effect of pH value on removal of p-arsanilic acid
2.3 吸附剂量对吸附性能的影响
吸附剂投加量对阿散酸吸附影响结果如图3所示。可知:随着MFB-MCs投加量的增多,阿散酸的去除率增大,剩余阿散酸浓度逐渐减少。在吸附剂投加量增多的同时,阿散酸接触到吸附剂的表面积逐渐变大,活性位点增多[9],促进了MFB-MCs对阿散酸的吸附。在吸附剂投加量为1 g/L时,阿散酸去除率达到84%以上,之后随着吸附剂量的增多,去除率上升幅度变缓。综合考虑经济效益等因素,本文采用1 g/L 作为吸附剂最佳投入量。
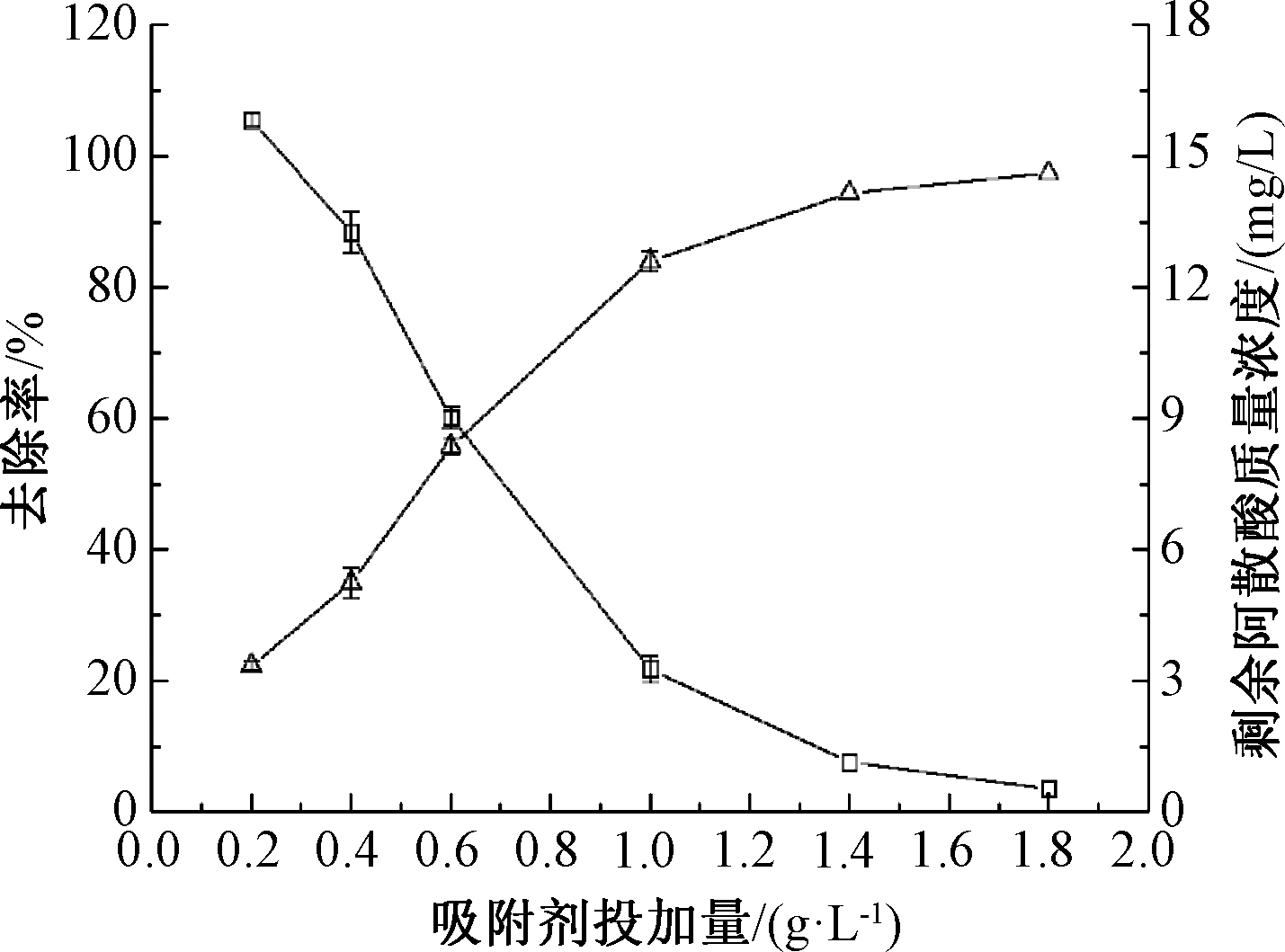
![]() —去除率;
—去除率; ![]() —剩余阿散酸浓度。
—剩余阿散酸浓度。
图3 吸附剂量投加对阿散酸去除率的影响
Figure 3 Effect of adsorption dose on removal of p-arsanilic acid
2.4 温度对吸附性能的影响
温度对MFB-MCs材料吸附阿散酸影响效果如图4所示。可知:随着温度的升高,MFB-MCs吸附剂对阿散酸的去除率先升高后降低。当温度从25 ℃提高至35 ℃时,阿散酸去除率由75.43%升高至80.08%,继续提高温度到45 ℃,阿散酸去除率降低至77.73%。温度对阿散酸的吸附影响分为2个方面:当温度较低时,温度的升高使得吸附反应速率加快,从而促进了MFB-MCs对阿散酸的吸附过程;随着温度的持续升高,阿散酸的解吸能力增强[16],吸附效果反而降低,实验测得最佳实验室规模吸附反应温度为35 ℃,考虑到实际应用中经济性,实验温度确定为25 ℃。
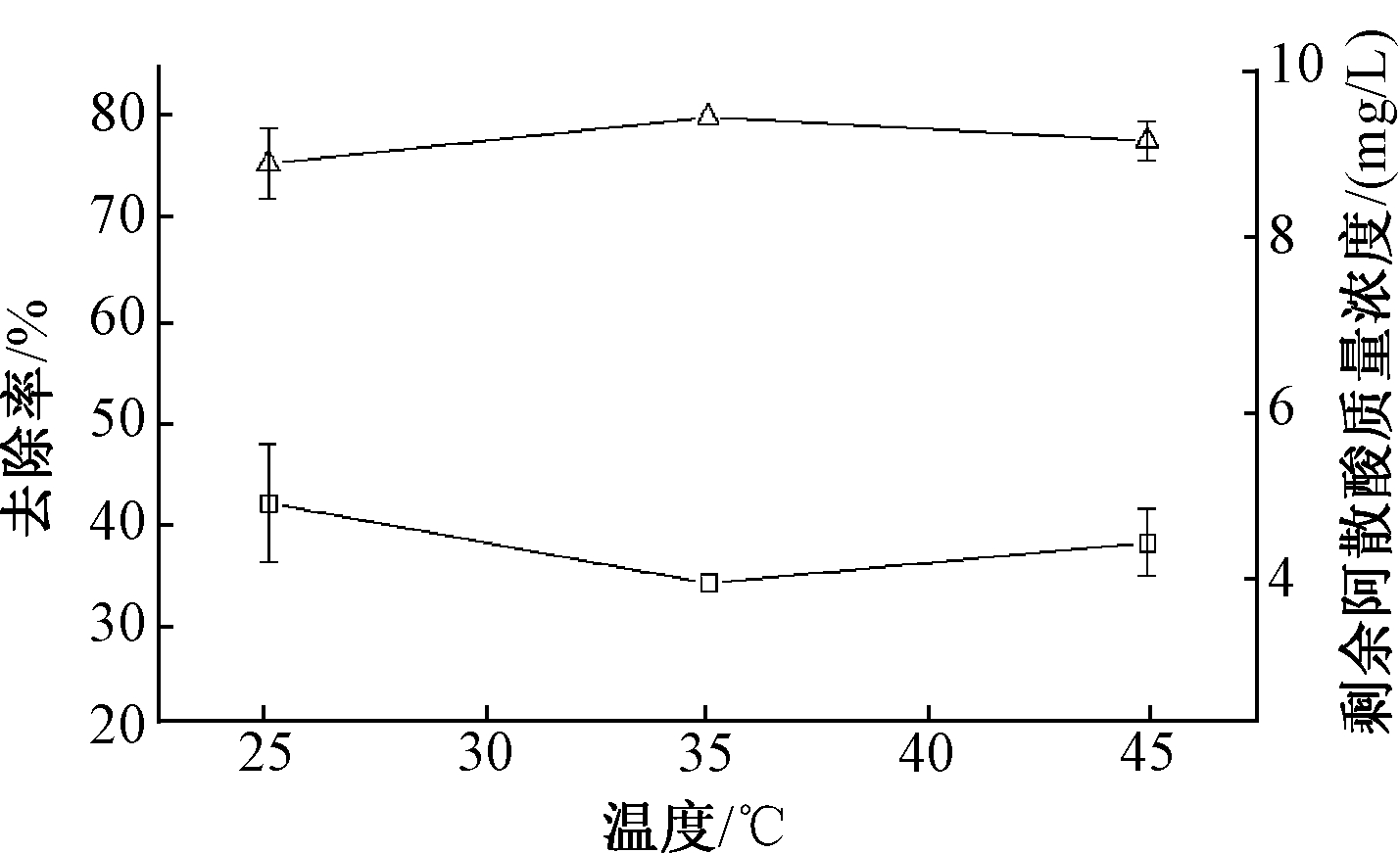
![]() —去除率;
—去除率; ![]() —剩余阿散酸浓度。
—剩余阿散酸浓度。
图4 温度对阿散酸去除率的影响
Figure 4 Effect of temperature on removal of p-arsanilic acid
2.5 吸附动力学
在温度为25 ℃,溶液pH=2.0,阿散酸初始浓度为20 mg/L,吸附剂投加量为1 g/L的条件下,不同吸附时间对MFB-MCs吸附阿散酸的影响如图5所示。可知:随着吸附时间的增加,MFB-MCs对阿散酸去除率不断增大,当吸附时间达到1440 min后,MFB-MCs对阿散酸去除率达到82.27%。在吸附开始前360 min,MFB-MCs的吸附位点较多[17],且阿散酸浓度较大,去除速率较快。随着吸附时间的延长,吸附剂表面被阿散酸包裹,MFB-MCs表面活性吸附位点减少,且剩余阿散酸浓度越来越低,吸附逐渐减慢,去除率逐渐平缓,实验最终选择吸附时间为1440 min。
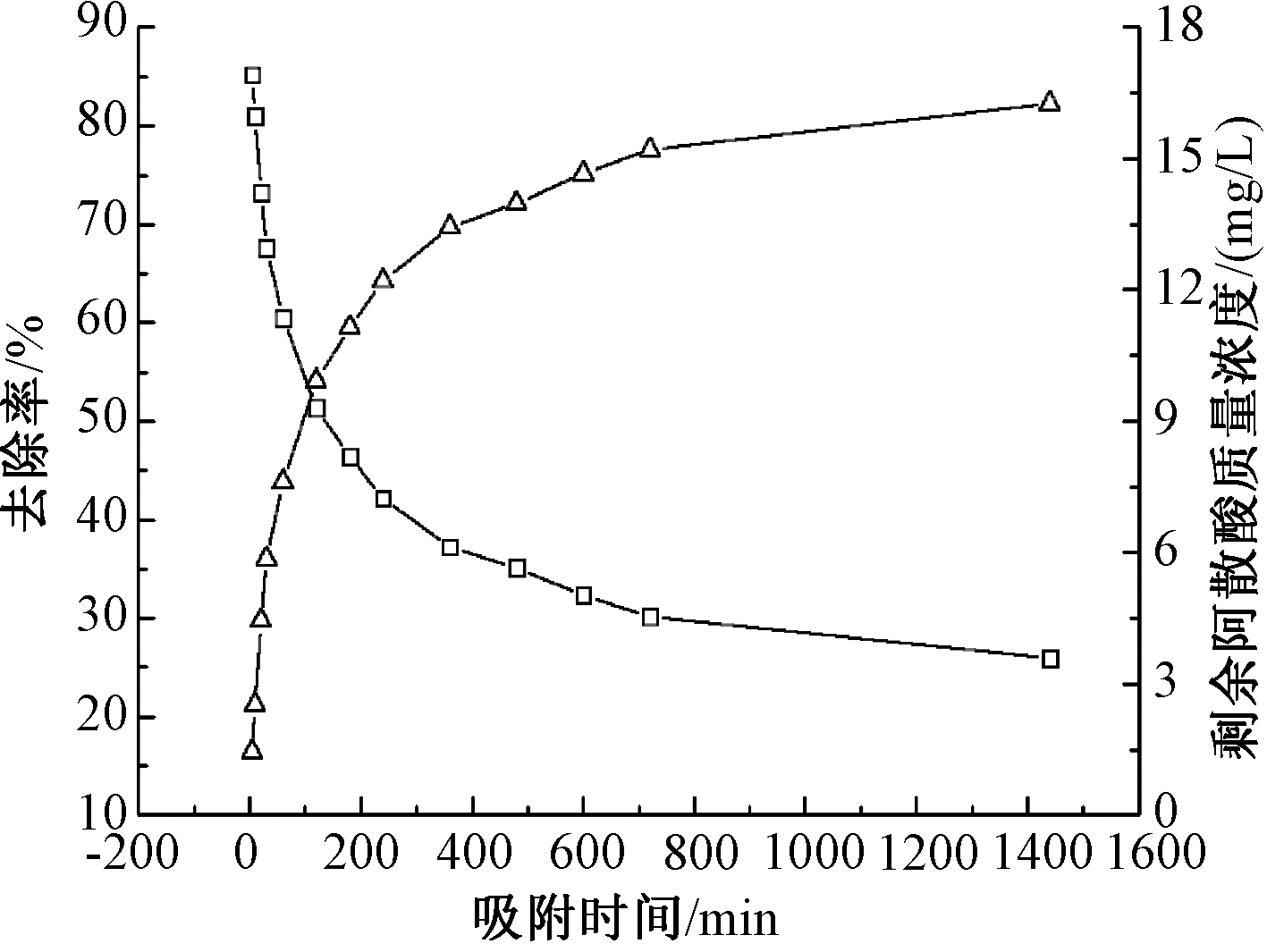
![]() —去除率;
—去除率; ![]() —剩余阿散酸浓度。
—剩余阿散酸浓度。
图5 吸附时间对阿散酸去除率的影响
Figure 5 Effect of adsorption time on removal of p-arsanilic acid
为进一步研究MFB-MCs吸附剂对阿散酸的吸附规律,本实验采用伪一级动力学方程和伪二级动力学方程拟合阿散酸吸附实验的动力学数据。
伪一级动力学方程为:
(1)
伪二级动力学方程为:
(2)
式中:t为吸附反应时间,min;qe为吸附达到平衡时吸附剂的吸附容量,mg/g;qt为t时刻吸附剂的吸附容量,mg/g;k1为伪一级动力学吸附速率常数,min-1;k2为伪二级动力学吸附速率常数,g/(mg·min)。
MFB-MCs对初始浓度20 mg/L阿散酸溶液的吸附动力学拟合曲线如图6、7所示。可知:![]() 准二级动力学公式拟合效果更好。相关拟合动力学参数如表1所示。伪一级动力学模型qe与实验数据qm差距较大,而伪二级动力学模型qe更接近实验值,说明MFB-MCs吸附阿散酸过程更符合伪二级反应动力学,吸附速率主要受化学吸附控制。
准二级动力学公式拟合效果更好。相关拟合动力学参数如表1所示。伪一级动力学模型qe与实验数据qm差距较大,而伪二级动力学模型qe更接近实验值,说明MFB-MCs吸附阿散酸过程更符合伪二级反应动力学,吸附速率主要受化学吸附控制。

图6 MFB-MCs吸附阿散酸的伪一级动力学拟合曲线
Figure 6 Pseudo-first-order kinetics fitting curve of MFB-MCs adsorbing p-arsanilic acid
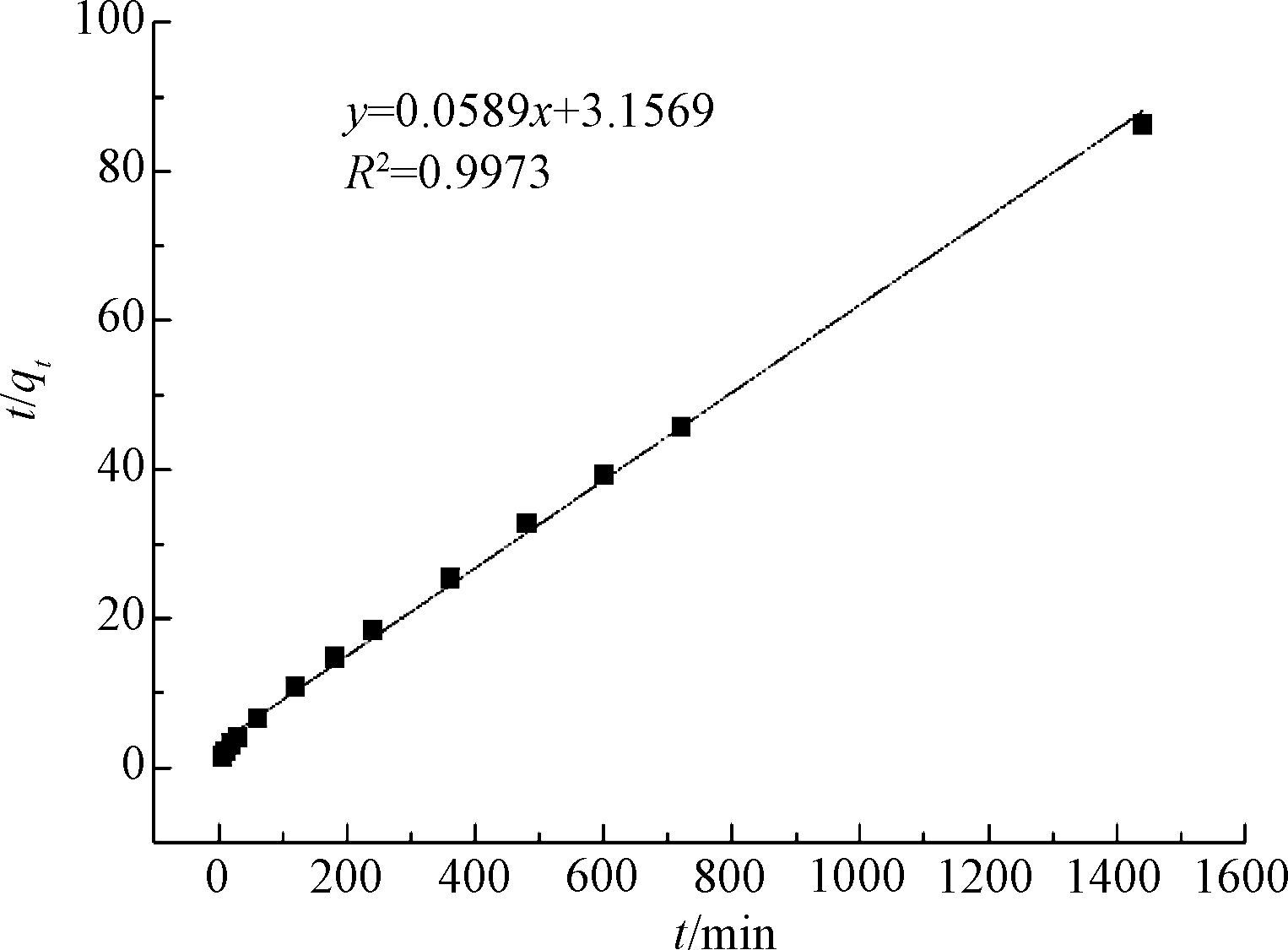
图7 MFB-MCs吸附阿散酸的伪二级动力学拟合曲线
Figure 7 Pseudo-second-order kinetics fitting curve of MFB-MCs adsorbing p-arsanilic acid
表1 MFB-MCs吸附阿散酸的动力学参数
Table 1 Kinetic parameters for adsorption of p-arsanilic acid by MFB-MCs

实验值qm/(mg/g)伪一级动力学模型伪二级动力学模型k1/(×10-3)qe/(mg/g)R2k2/(×10-3)qe/(mg/g)R216.665.98789.48220.94971.098916.97790.9973
2.6 吸附等温线
实验在温度25 ℃,溶液初始pH=2.0,吸附量为1 g/L,阿散酸初始浓度对MFB-MCs吸附效果的影响如图8所示。可知:随着阿散酸初始浓度的升高,去除率逐渐降低。由MFB-MCs的吸附情况可知,当阿散酸浓度为5 mg/L时,其去除率>70%,随着浓度的增加,阿散酸去除率降低至62%以下。这是因为阿散酸浓度较小时,MFB-MCs吸附位点较多,阿散酸基本被完全吸附,随着阿散酸浓度的升高,MFB-MCs活性位点相对阿散酸较少,吸附剂的有效吸附点位逐渐被占用,吸附速率降低。当阿散酸初始浓度为300 mg/L时,平衡时MFB-MCs对阿散酸去除率为27.3%。

![]() —去除率;
—去除率;![]() —吸附容量。
—吸附容量。
图8 初始浓度对阿散酸去除率的影响
Figure 8 Effect of initial concentration on removal of p-arsanilic acid
为了进一步了解吸附剂材料与阿散酸之间的相互作用机制,运用Langmuir和Freundlich吸附等温模型(如式(3)、(4)所示)对吸附过程进行了拟合。
(3)
式中:qe为吸附平衡时吸附剂的吸附容量,mg/g;qmax为最大吸附容量,mg/g;ce为吸附后阿散酸的溶液浓度,mg/L;kL为Langmuir模型常数,L/mg。
(4)
式中:qe为吸附平衡时吸附剂的吸附容量,mg/g;ce为吸附后阿散酸的溶液浓度,mg/L;kF为Freundlich模型常数,![]() 为吸附强度的无量纲常数。
为吸附强度的无量纲常数。
采用吸附等温线Langmuir和Freundlich模型对吸附过程的拟合曲线结果如图9、10所示。根据拟合结果可看出:Freundlich模型方程相关系数R2远远大于Langmuir模型相关系数R2值,表明Freundlich模型方程更适用于拟合MFB-MCs对阿散酸的吸附过程。MFB-MCs吸附阿散酸等温方程拟合参数如表2所示,Langmuir模型拟合结果qm与实验所得数据差距较大,故吸附剂对阿散酸的吸附属于多层吸附。

图9 Langmuir等温吸附模型拟合曲线
Figure 9 Fitting curve of Langmuir isothermal adsorption model
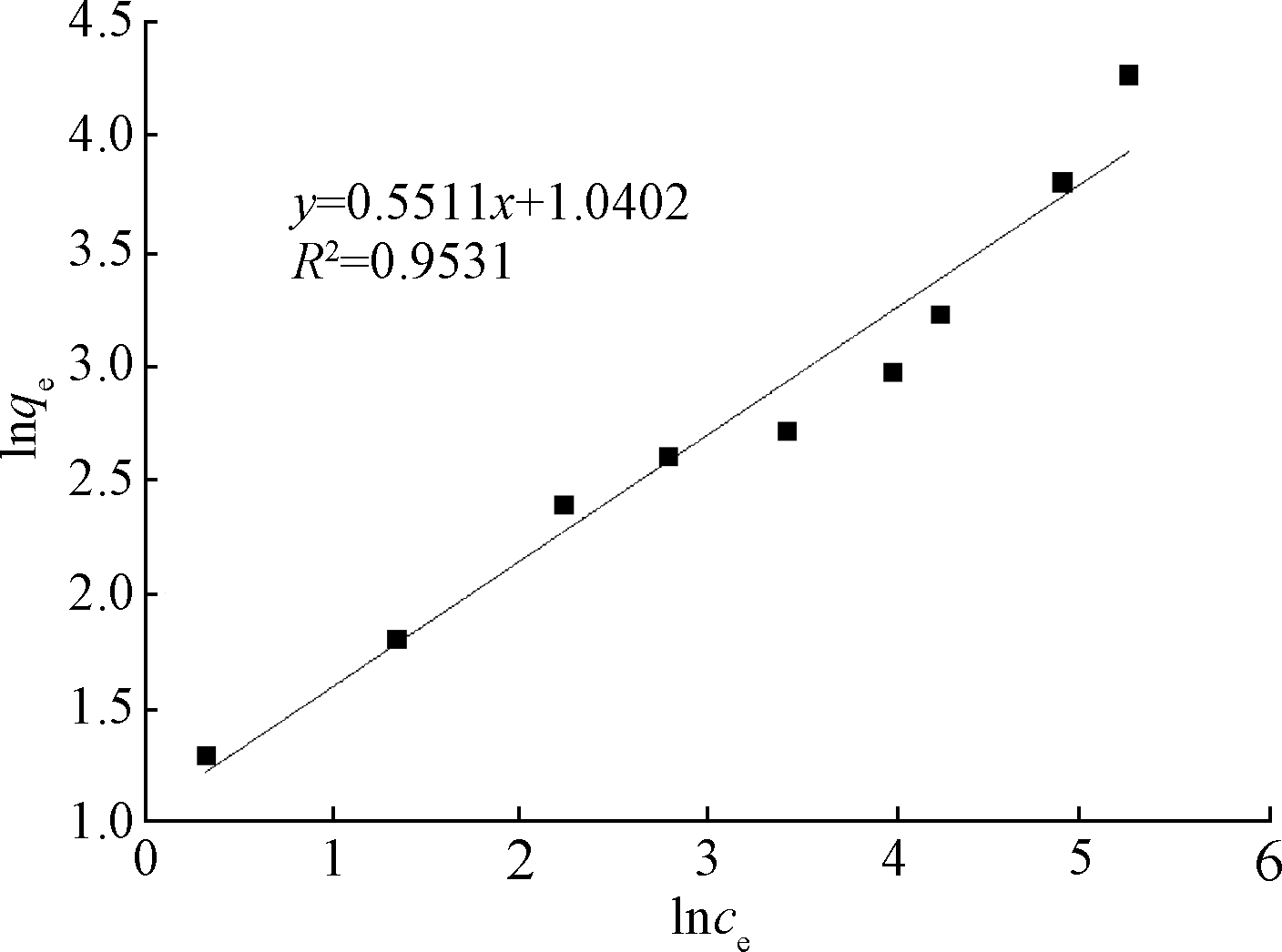
图10 Freundlich等温吸附模型拟合曲线
Figure 10 Fitting curve of Freundlich isothermal adsorption model
表2 MFB-MCs吸附阿散酸等温方程拟合参数
Table 2 Isothermal equation fitting parameters for adsorption of arsanilic acid by MFB-MCs
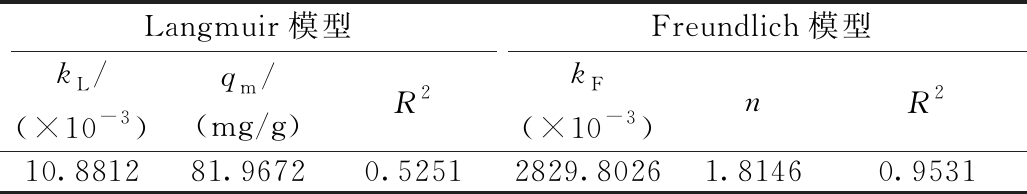
Langmuir模型Freundlich模型kL/(×10-3)qm/(mg/g)R2kF(×10-3)nR210.881281.96720.52512829.80261.81460.9531
3 结 论
1)采用共沉淀法成功制备了MFB-MCs。通过SEM和TEM分析可知:MFB-MCs属于纳米级,表面呈多孔结构,有一定的水溶性和分散性能,保证了MFB-MCs本身的吸附能力,尖晶石铁氧体为MFB-MCs提供了一定的磁选性能。
2)溶液初始pH值、吸附剂量、温度、时间均对MFB-MCs吸附阿散酸的效果产生影响。本研究中最佳吸附条件为:初始pH=2.0,吸附剂量为1 g/L,温度为25 ℃,吸附时间为1440 min,初始浓度为20 mg/L阿散酸去除率达到82.27%。
3)MFB-MCs对阿散酸的吸附过程符合伪二级动力学模型,主要受化学吸附控制。同时符合Fredundlich等温线模型,属于多分子层吸附。
[1] 刘玉坤,郑星,陈勐,等. 铝易拉罐/Fe(Ⅱ)/O2体系降解对氨基苯胂酸的机理[J]. 环境工程学报,2017,11(3):1417-1422.
[2] 何万领,李晓丽,常会庆,等. 不同水平阿散酸粪肥对水稻生长发育及砷积累的影响[J]. 植物营养与肥料学报,2018,24(4):1088-1096.
[3] 何万领,李晓丽,杨肖娥,等. 阿散酸在土壤中的降解与形态变化[J]. 环境工程学报,2018,12(1):198-205.
[4] WANG H L, HU Z H, TONG Z L, et al. Effect of arsanilic acid on anaerobic methanogenic process: kinetics, inhibition and biotransformation analysis[J]. Biochemical Engineering Journal,2014,91:179-185.
[5] FISHER D J, YONKOS L T, STAVER K W. Environmental concerns of roxarsone in broiler poultry feed and litter in Maryland, USA[J]. Environmental Science and Technology,2015,49(4):1999-2012.
[6] 耿安静,王旭,陈岩,等. 有机胂阿散酸的研究现状及潜在风险[J]. 农产品质量与安全,2017(5):87-91.
[7] CHATTERJEE S, DE S. Adsorptive removal of arsenic from groundwater using chemically treated iron ore slime incorporated mixed matrix hollow fiber membrane[J]. Separation and Purification Technology,2017,179:357-368.
[8] HU Q S, LIU Y L, GU X Y, et al. Adsorption behavior and mechanism of different arsenic species on mesoporous MnFe2O4 magnetic nanoparticles[J]. Chemosphere,2017,181:328-336.
[9] JOSHI T P, ZHANG G, JEFFERSON W A, et al. Adsorption of aromatic organo-arsenic compounds by ferric and manganese binary oxide and description of the associated mechanism[J]. Chemical Engineering Journal,2017,309:577-587.
[10] 王亚娇. 有机砷对厌氧消化的影响及其吸附去除研究[D].合肥:合肥工业大学,2016.
[11] 苏立强,尤嘉,王丽博,等. 阿散酸磁性分子印迹聚合物的制备及其应用[J]. 理化检验(化学分册),2018,54(4):373-378.
[12] 李铮,雷鸣. 铁氧体及其复合材料对水体中氨基苯胂酸去除效能的研究[J]. 中国资源综合利用,2018,36(11):11-13.
[13] JUNG K W, LEE S, LEE Y J. Synthesis of novel magnesium ferrite (MgFe2O4)/biochar magnetic composites and its adsorption behavior for phosphate in aqueous solutions[J]. Bioresource Technology,2017,245:751-759.
[14] WANG W, DING Z, CAI M, et al. Synthesis and high efficiency methylene blue adsorption of magnetic PAA/MnFe2O4 nanocomposites[J]. Applied Surface Science,2015,346:348-353.
[15] ZHENG S, JIANG W J, CAI Y, et al. Adsorption and photocatalytic degradation of aromatic organoarsenic compounds in TiO2 suspension[J]. Catalysis Today,2014,224:83-88.
[16] LV Y C, ZHANG R S, ZENG S L, et al. Removal of p-arsanilic acid by an amino-functionalized indium-based metal-organic framework: adsorption behavior and synergetic mechanism[J]. Chemical Engineering,2018,339:359-368.
[17] 梅向阳,王耀,朱丽云,等. 氨基化锰铁氧体纳米粒子的制备及吸附Pb2+和Cd2+性能研究[J].化学通报,2019,82(2):144-150.