0 引 言
厌氧氨氧化(anaerobic ammonium oxidation,Anammox)是1种高效低耗的生物脱氮工艺,自养型厌氧氨氧化(anaerobic ammonium oxidation bacteria, AnAOB)菌群在无氧条件下以亚硝酸盐为电子受体,氨氮作为电子供体进行反应,最终转化为氮气。相比于传统硝化-反硝化工艺,Anammox工艺能减少60%的曝气量,90%的污泥产量,且无需外加碳源,目前全球范围内已经有超过110座投入实际运行的Anammox工艺污水处理厂[1]。Anammox脱氮过程涉及多种菌属,其中主要功能菌AnAOB菌群生长缓慢,对环境要求高,生物量倍增时间长达11 d,给该工艺的大规模工程化应用带来了困难[2]。因此,如何选择合适的接种污泥以及反应器构型,快速富集AnAOB 菌实现工艺稳定运行,成为Anammox工艺高效运行的关键[3,4]。上流式厌氧反应器具有污泥截留能力强,能够高效截留微生物并耐冲击负荷,AnAOB菌群多样性分布较好等优点。而C/N含量低、氧含量少的接种污泥,有利于培养富集AnAOB菌[5]。厌氧颗粒污泥生物量增长缓慢,常用侧流接种法,即接种高氨氮浓度下成熟的AnAOB污泥,以实现厌氧氨氧化反应器的快速启动[1,6],但厌氧颗粒污泥自启动厌氧氨氧化反应器的脱氮效果和微生物群落结构特性以及侧流接种法对其影响尚不明确[7]。
在接种厌氧颗粒污泥的上流式反应器R1和接种厌氧颗粒污泥与成熟Anammox污泥混合物的上流式反应器R2中进行AnAOB菌群的培养,从而考察污泥培养过程中脱氮效率。在培养成功的基础上,逐步提高基质浓度,考察进水负荷对系统脱氮性能的影响。通过高通量测序技术对不同污泥体系中的微生物群落结构进行分析,考察不同接种物启动厌氧氨氧化反应时对微生物群落结构的影响。
1 实验部分
1.1 接种污泥及进水基质
接种污泥分别来自某造纸厂厌氧颗粒污泥和实验室高氨氮浓度下培养成熟的Anammox污泥。厌氧颗粒污泥和成熟的Anammox污泥的VSS分别为0.068,0.074 g/g。
实验进水皆为实验室配水,R1和R2反应器进水相同,配水基质包括氮源、矿物质和微量元素。其成分为:CaCl2·2H2O为5.6 mg/L,KH2PO4为10 mg/L,MgSO4·7H2O为300 mg/L,KHCO3为500 mg/L,微量元素溶液1为1.25 mL/L,微量元素溶液2为1.25 mL/L。其中,微量元素溶液1:EDTA为5000 mg/L,FeSO4为5000 mg/L。微量元素溶液2:EDTA为15000 mg/L,ZnSO4·7H2O为430 mg/L,CoCl2·6H2O为240 mg/L,MnCl2·4H2O为990 mg/L,CuSO4·5H2O为250 mg/L,NiCl2·6H2O为190 mg/L,Na2SeO4·10H2O为210 mg/L,H3BO4为14 mg/L,NaMoO4·2H2O为220 ![]() 分别由NH4Cl和NaNO2提供。
分别由NH4Cl和NaNO2提供。
1.2 实验装置与运行
实验装置采用上流式厌氧反应器,采用玻璃制成,高度为40 cm,直径为6 cm,有效体积为1 L。反应器外侧有水浴夹套,控制温度在(30±1) ℃。反应器采用铝箔纸盖住避光,并通过蠕动泵控制进水流速,反应器见图1。水力停留时间为12 h,进水pH为7.8~8.2,ρ(DO)<0.2 mg/L。

图1 上流式厌氧氨氧化反应器构型
Figure 1 Structure of the up-flow anaerobic ammonium oxidation reactor
实验过程中运行2套反应器,包括“自培养反应器”R1(仅接种厌氧颗粒污泥)和“混合培养反应器”R2(接种厌氧颗粒污泥和成熟Anammox污泥的混合污泥)。R1中接种约400 mL的厌氧颗粒污泥,R2中接种约100 mL的Anammox成熟污泥和约300 mL的厌氧颗粒污泥。R1和R2启动初期(0~140 d)采用低负荷进水,保持![]() 和
和![]() 分别为40,53 mg/L,启动运行稳定之后(140~290 d)逐渐提升进水
分别为40,53 mg/L,启动运行稳定之后(140~290 d)逐渐提升进水![]() 至130 mg/L(详见图2、图3),从而考察不同进水负荷对反应器性能的影响。
至130 mg/L(详见图2、图3),从而考察不同进水负荷对反应器性能的影响。
R1和R2体系的比厌氧氨氧化活性采用摇瓶实验测定[8]。在稳定运行第110天时,分别从R1和R2中取得混合污泥样品,以40 mg/L的![]() 溶液和
溶液和![]() 溶液作为基质,分别进行摇瓶实验并分析比厌氧氨氧化活性。批次实验在装有200 mL泥水混合液的血清瓶(250 mL)中进行,以氨氮作为基准,计算每个反应器的比厌氧氨氧化活性。
溶液作为基质,分别进行摇瓶实验并分析比厌氧氨氧化活性。批次实验在装有200 mL泥水混合液的血清瓶(250 mL)中进行,以氨氮作为基准,计算每个反应器的比厌氧氨氧化活性。
1.3 测试项目与方法
氨氮![]() 采用纳氏试剂分光光度法(HJ 535—2009)测定。硝酸盐氮
采用纳氏试剂分光光度法(HJ 535—2009)测定。硝酸盐氮![]() 亚硝酸盐氮
亚硝酸盐氮![]() 采用离子色谱法测定。总氮(TN)的采用哈希(HACH)试剂法测定。总悬浮颗粒(MLSS)及其有机组分(MLVSS)采用国标法测定。胞外聚合物(extracellular polymeric substance,EPS)含量采用TOC法(EPSTOC)测定[9]。
采用离子色谱法测定。总氮(TN)的采用哈希(HACH)试剂法测定。总悬浮颗粒(MLSS)及其有机组分(MLVSS)采用国标法测定。胞外聚合物(extracellular polymeric substance,EPS)含量采用TOC法(EPSTOC)测定[9]。
反应体系运行稳定后,TN去除率稳定在80%左右。在第220 天时取出R1和R2中的污泥,通过高通量测序技术比较2个体系微生物群落结构。由于水样中单位体积的样品含有的细菌和真菌的数量比较少,提取之前必须先富集样品中的菌量。混匀原始样品,取4 mL液体样品,分多次加入灭菌的2 mL离心管中,10000 r/min室温离心3 min。将上层液弃置,并将离心管倒置于吸水纸上1 min,直至无液体流出。DNA的具体提取步骤参照OMEGA试剂盒E.Z.N.A Mag-Bind Soil DNA Kit的试剂盒使用说明书,DNA提取后利用琼脂糖凝胶检测其完整性,点样浓度分别为54 ng/μL(R1)和40.9 ng/μL(R2)。PCR扩增主要分为2次。在第1轮扩增前,首先对基因组DNA进行精确定量,以确定PCR反应应加入的DNA量,主要利用 Qubit 2.0 DNA检测试剂盒实现。该轮PCR所用的引物已经融合了Miseq测序平台的V3—V4通用引物:341F引物(CCCTACACGACGCTCT TCCGATCTG)和805R引物(GACTGGAGTTCCTTG GCACCCGAGAATTCCA);第2轮扩增则引入Illumina桥式PCR兼容引物。对于细菌和古菌扩增的PCR产物和正常扩增片段在400 bp以上的PCR产物,选用0.6倍的磁珠(Agencourt AMPure XP)处理。对于真菌PCR产物和其他扩增片段<400 bp的PCR产物,选用0.8倍的磁珠处理。再次利用Qubit2.0 DNA检测试剂盒对纯化后的DNA精确定量,以方便按照1∶1的等量混合后测序。等量混合时,每个样品DNA量取10 ng,最终上机测序浓度为20 pmol。
2 结果与讨论
2.1 接种污泥及进水基质
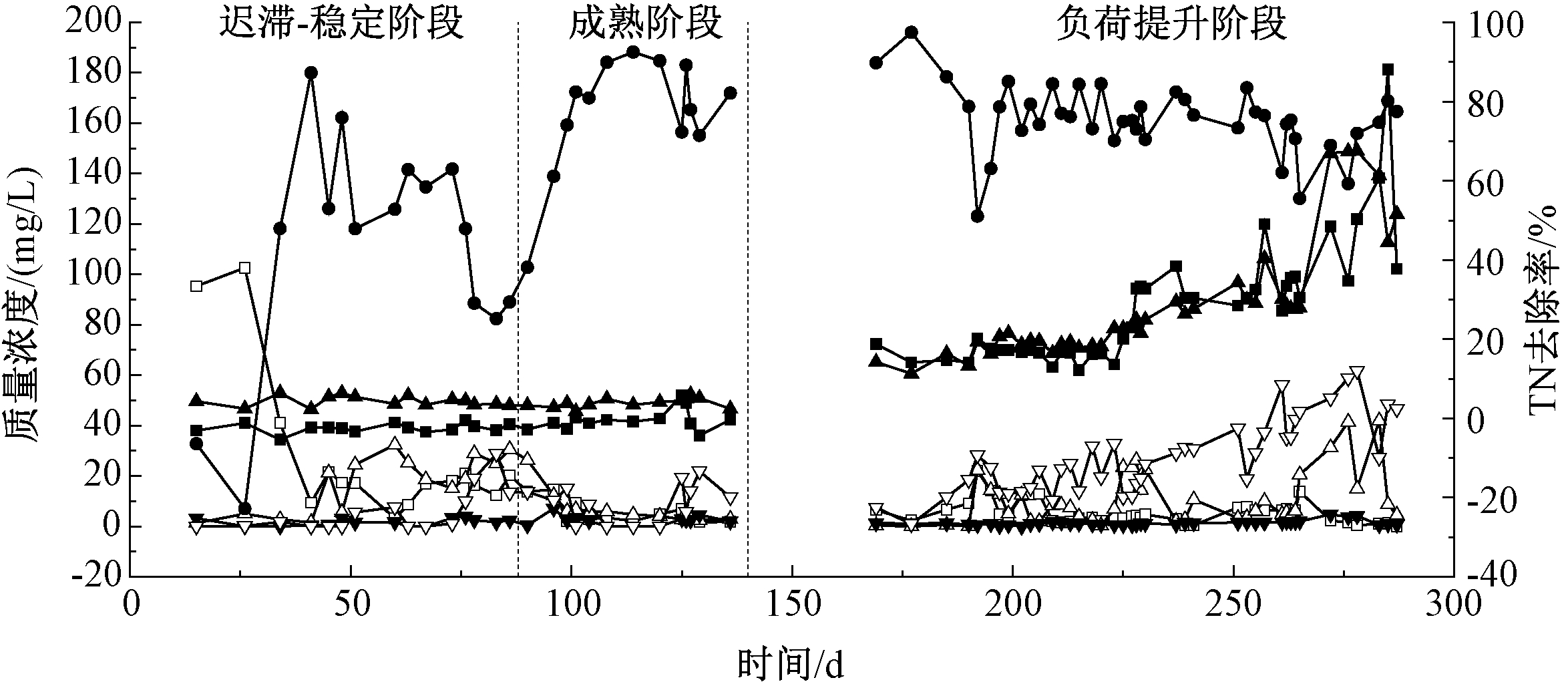
图2为接种厌氧颗粒污泥启动厌氧氨氧化反应器过程中进出水![]() 及
及![]() 的变化过程(0~290 d)。根据脱氮效果将整个培养过程分为迟滞-稳定阶段(0~88 d)、成熟阶段(88~140 d)
的变化过程(0~290 d)。根据脱氮效果将整个培养过程分为迟滞-稳定阶段(0~88 d)、成熟阶段(88~140 d)
和负荷提升(140~290 d)3个阶段。启动前期(0~50 d),进水中的![]() 不仅没有参与反应,而且由于厌氧颗粒污泥细胞解体的作用,导致出水
不仅没有参与反应,而且由于厌氧颗粒污泥细胞解体的作用,导致出水![]() 浓度高于进水,这一发现与于英翠等[10]研究启动厌氧氨氧化过程时报道的现象一致。在这一阶段,出水
浓度高于进水,这一发现与于英翠等[10]研究启动厌氧氨氧化过程时报道的现象一致。在这一阶段,出水![]() mg/L,且无
mg/L,且无![]() 生成。考虑到厌氧颗粒污泥中含有丰富的功能菌群,除了产甲烷古菌以外,反硝化细菌也是常见的菌群[11]。故进水中
生成。考虑到厌氧颗粒污泥中含有丰富的功能菌群,除了产甲烷古菌以外,反硝化细菌也是常见的菌群[11]。故进水中![]() 可能是被厌氧颗粒污泥中的反硝化菌利用进行反硝化作用而被去除。这说明在此阶段,AnAOB还未成为主导的菌群。运行50~88 d,出水
可能是被厌氧颗粒污泥中的反硝化菌利用进行反硝化作用而被去除。这说明在此阶段,AnAOB还未成为主导的菌群。运行50~88 d,出水![]() 浓度逐渐下降,而出水
浓度逐渐下降,而出水![]() 浓度则逐渐升高,出水
浓度则逐渐升高,出水![]() 浓度也有了明显升高,最高时达到30 mg/L,从而导致TN去除率的下降。但此现象表明,反应器中逐渐出现了厌氧氨氧化菌,达到去除
浓度也有了明显升高,最高时达到30 mg/L,从而导致TN去除率的下降。但此现象表明,反应器中逐渐出现了厌氧氨氧化菌,达到去除![]() 和
和![]() 的目的,同时有
的目的,同时有![]() 生成。反应器R1整体趋于稳定状态,故为迟滞-稳定阶段。随着运行时间的延长(88~140 d),出水
生成。反应器R1整体趋于稳定状态,故为迟滞-稳定阶段。随着运行时间的延长(88~140 d),出水![]() 和
和![]() 浓度逐渐降低并保持在15 mg/L以下,
浓度逐渐降低并保持在15 mg/L以下,![]() 和
和![]() 的平均去除率也达到85%以上。
的平均去除率也达到85%以上。![]() 出水浓度虽然有所波动,但明显高于迟滞阶段,故为成熟阶段。与前一阶段相比,成熟阶段TN去除率大幅提高,从29.4%(87 d)逐渐升高并稳定在80%左右(101 d)。在进入成熟阶段之后,R1和R2的
出水浓度虽然有所波动,但明显高于迟滞阶段,故为成熟阶段。与前一阶段相比,成熟阶段TN去除率大幅提高,从29.4%(87 d)逐渐升高并稳定在80%左右(101 d)。在进入成熟阶段之后,R1和R2的![]() 和
和![]() 均逐渐趋于理论值1.32和0.26,这表明厌氧氨氧化反应器成功启动。
均逐渐趋于理论值1.32和0.26,这表明厌氧氨氧化反应器成功启动。
为进一步研究进水负荷对厌氧氨氧化反应器脱氮性能的影响,如图2所示逐渐提升进水![]() 和
和![]() 至130 mg/L(140~290 d)。其中,反应器在稳定运行140 d时因春节假期暂停运行,污泥保存20 d后重新启动反应器。随着进水氮负荷的提升,
至130 mg/L(140~290 d)。其中,反应器在稳定运行140 d时因春节假期暂停运行,污泥保存20 d后重新启动反应器。随着进水氮负荷的提升,![]() 和
和![]() 去除率变化不大,稳定在90%以上,而TN去除率在70%左右。
去除率变化不大,稳定在90%以上,而TN去除率在70%左右。
![]() —进水
—进水![]() 出水
出水![]() 进水
进水![]() 出水
出水![]() 进水
进水![]() 出水
出水![]() 去除率。
去除率。
图2 自培养反应器R1脱氮效率随运行时间变化
Figure 2 Nitrogen removal efficiency of reactor R1 varies with operating time
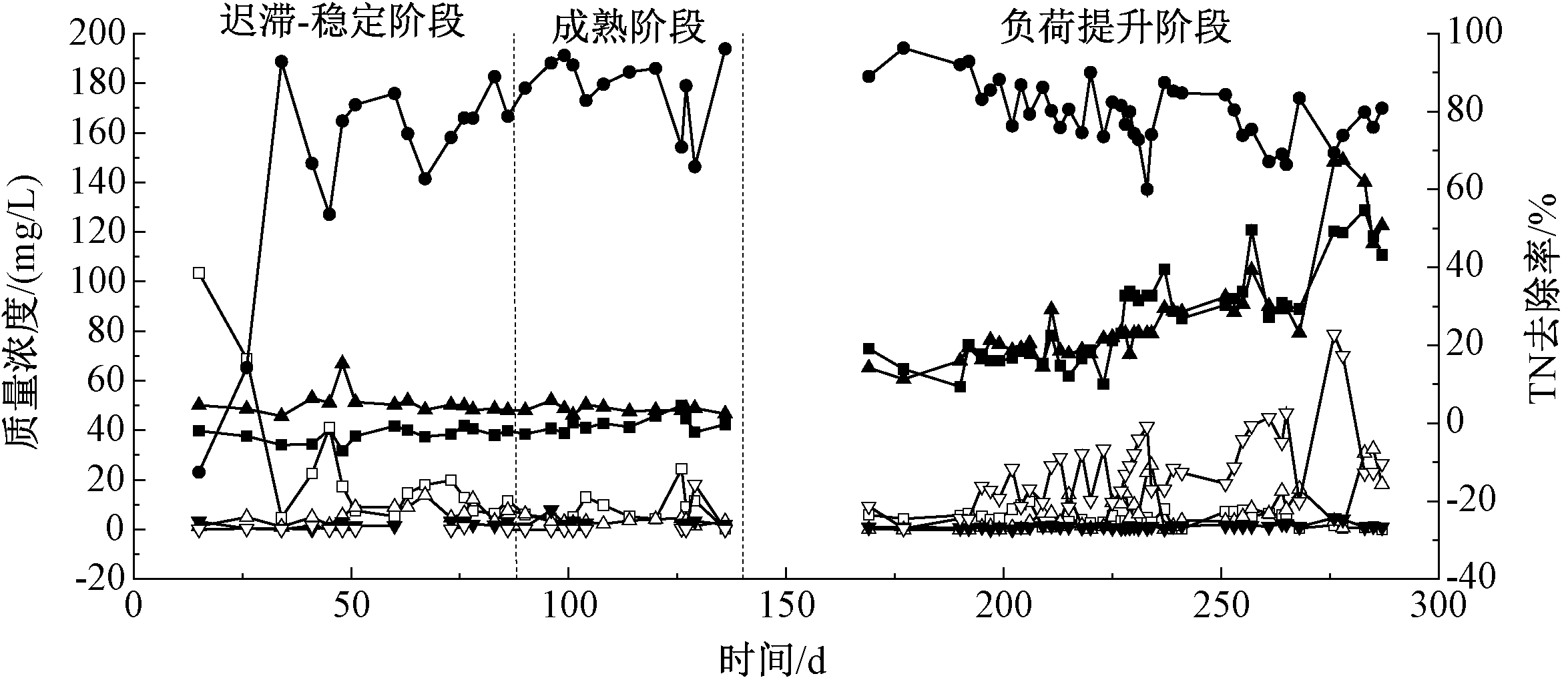
混合接种反应器R2中![]() 和TN去除率随培养时间变化的情况如图3所示。在迟滞-稳定阶段(0~88 d),出水
和TN去除率随培养时间变化的情况如图3所示。在迟滞-稳定阶段(0~88 d),出水![]() 逐渐下降,出水
逐渐下降,出水![]() 则逐渐升高,
则逐渐升高,![]() 去除率逐渐升高到90%以上,
去除率逐渐升高到90%以上,![]() 去除率保持在较高水平(70%~90%)。在整个启动过程中,出水
去除率保持在较高水平(70%~90%)。在整个启动过程中,出水![]() 浓度一直保持在较低水平,
浓度一直保持在较低水平,![]() 去除率保持在90%以上。这说明外接成熟AnAOB污泥可以快速启动厌氧氨氧化反应。
去除率保持在90%以上。这说明外接成熟AnAOB污泥可以快速启动厌氧氨氧化反应。
![]() —进水
—进水![]() 出水
出水![]() 进水
进水![]() 出水
出水![]() 进水
进水![]() 出水
出水![]() 去除率。
去除率。
图3 混合接种反应器R2脱氮效率随运行时间变化
Figure 3 Nitrogen removal efficiency of reactor R2 varies with operating time
负荷提升阶段(140~290 d),进水![]() 和
和![]() 浓度逐渐升高,R2反应器中出现与R1 类似的现象,即出水
浓度逐渐升高,R2反应器中出现与R1 类似的现象,即出水![]() 仍维持在较低水平,而出水
仍维持在较低水平,而出水![]() 和
和![]() 浓度随着负荷提升逐渐增高,并且波动较大。
浓度随着负荷提升逐渐增高,并且波动较大。
2.2 进水负荷对厌氧氨氧化反应器脱氮性能的影响
表1反映了进水氮容积负荷(NLR)提升时反应器各阶段![]() 去除率以及平均氮去除量之比(定义为:
去除率以及平均氮去除量之比(定义为:![]() 和
和![]() 由表1可以看出:R1和R2的
由表1可以看出:R1和R2的![]() 去除率均保持在较高水平,达到90%以上,并随着进水氮容积负荷提升(R1:0.29~0.49 kg/(m3·d)和R2:0.29~0.47 kg/(m3·d)而略有升高(R1:90.2%→96.8%和R2:93.2%→96.9%)。但TN去除率随着进水氮容积负荷提升则呈现略微下降的趋势(R1:75.5%→73.1%和R2:82.9%→74.6%)。
去除率均保持在较高水平,达到90%以上,并随着进水氮容积负荷提升(R1:0.29~0.49 kg/(m3·d)和R2:0.29~0.47 kg/(m3·d)而略有升高(R1:90.2%→96.8%和R2:93.2%→96.9%)。但TN去除率随着进水氮容积负荷提升则呈现略微下降的趋势(R1:75.5%→73.1%和R2:82.9%→74.6%)。
表1 进水氮容积负荷提升时反应器的脱氮性能和EPS浓度
Table 1 Nitrogen removal performance and EPS contents at each stage of the reactor when the influent nitrogen volume load increased
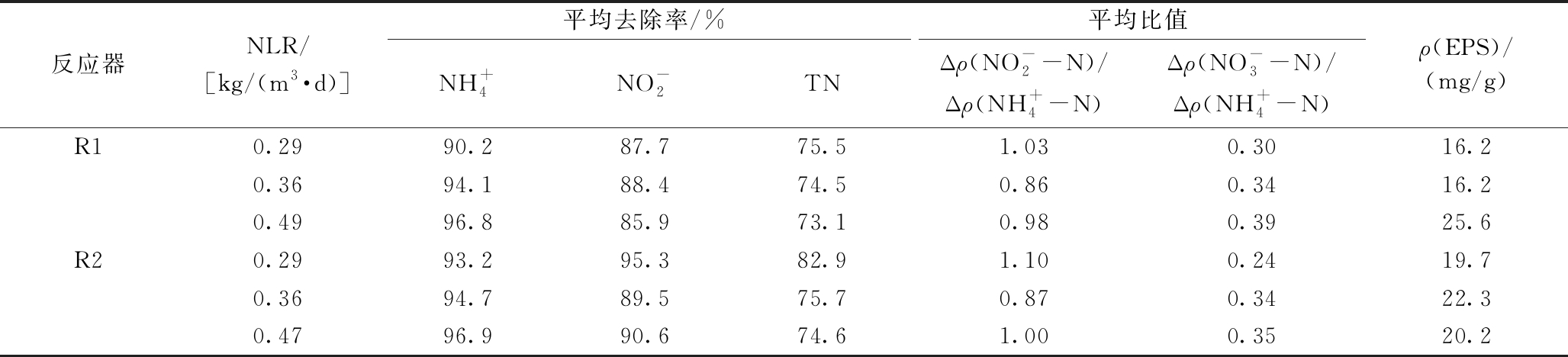
反应器NLR/[kg/(m3·d)]平均去除率/%平均比值NH+4NO-2TNΔρ(NO-2-N)/Δρ(NH+4-N)Δρ(NO-3-N)/Δρ(NH+4-N)ρ(EPS)/(mg/g)R10.2990.287.775.51.030.3016.20.3694.188.474.50.860.3416.20.4996.885.973.10.980.3925.6R20.2993.295.382.91.100.2419.70.3694.789.575.70.870.3422.30.4796.990.674.61.000.3520.2
除了反应器的脱氮情况外,表1还考察了进水氮负荷对胞外聚合物EPS的影响。EPS对颗粒污泥的形成起着重要作用。可知:增大进水氮容积负荷提高了R1和R2中污泥的EPS值,其中R1上升较多。这从一定程度上反映了R1污泥可进一步固定其颗粒形态,保持良好的沉降性能。
2.3 微生物群落结构分析
高通量测序结果表明,R1中有1585种OTU,而R2中共有2056种OTU(operational taxonomic unit),两者有455个重合的分类单元。这反映了2个系统的微生物群落存在一定的相似性,都存在可以实现高效脱氮的菌落,但显然接种成熟的厌氧氨氧化污泥的R2反应器中微生物的多样性更丰富。Alpha多样性指数也进一步表明,R2体系中细菌的多样性更加丰富。R1和R2菌门水平分布如图4所示:2个体系中主要有浮霉菌门(Planctomycetes,10%~20%)、变形菌门(Proteobacteria,>30%)、绿弯菌门(Chloroflexi,20%),还存在厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)和拟杆菌门(Bacteroidetes)等(相对丰度<5%)。这一群落结构与大多厌氧氨氧化研究结果一致,相对丰度占据主导地位的菌门为变形菌门、绿弯菌门和浮霉菌门[12,13]。

![]() Others;
Others; ![]() Bacteroidetes;
Bacteroidetes; ![]() Acidobacteria;
Acidobacteria; ![]() Firmicutes;
Firmicutes; ![]() Ignavibacteriae;
Ignavibacteriae; ![]() Planctomycetes;
Planctomycetes; ![]() Chloroflexi;
Chloroflexi; ![]() Proteobacteria。
Proteobacteria。
图4 R1、R2中细菌菌门水平丰度
Figure 4 Abundance of bacteria phylum in R1 and R2
厌氧氨氧化菌所在的浮霉菌门的发现,进一步证实了Anammox反应器启动成功。R1中浮霉菌门的丰度(9.54%)远低于R2(20.32%),这主要是由于R2中接种了成熟的Anammox污泥。但由于AnAOB难以实现纯菌培养,研究中也常发现Anammox体系中的浮霉菌门AnAOB丰度不高。例如,在稳定处理低基质浓度污水的UASB反应器中发现,变形菌门丰度(41.9%)远高于浮霉菌门(3.1%)[14]。变形菌门是R1和R2体系中丰度最高的菌门,相对丰度均达到30%以上。其中,Betaproteobacteria亚纲在变形菌门中占比最高,分别达到59%和61%,该亚纲下主要有与氮循环有关的Thiobacillus、Nitrosomonas、Simplicispira、Nitrosospira等菌属,这也与Bae等[13]的研究相一致。
为考察丰度相对较高菌属的代谢途径及在体系中所起到的作用,本研究在菌门分析的基础上,进一步进行了菌属分析。
图5总结了R1和R2体系中相对丰度>1%的菌属。可知:2个反应器中丰度>1%的菌属种类重合度极高。但在相对占比含量方面仍有所差异。由图5可知:R1中主要的AnAOB为Candidatus Kuenenia(下文称“K菌”),其丰度占总菌属比例的7.92%;R2中的优势AnAOB为Candidatus Brocadia(下文称“B菌”),其丰度占总菌属比例的15.64%。同时,R2中也检测到K菌(丰度为3.02%)。据报道,不论在自然生态系统还是人工生态系统,B菌和K菌都是最为常见的AnAOB菌属[15]。B菌是R策略生长菌(生长速率大但基质亲和力低)[16],K菌是K策略生长菌(生长速率小但基质亲和力高)[17]。因此,对于高效高负荷的污水处理系统来说,B菌为优势菌属,而处理低浓度![]() 废水时K菌则为优势菌属。在本研究中,进水
废水时K菌则为优势菌属。在本研究中,进水![]() 为50~150 mg/L,属于低基质浓度范围,故自培养体系R1中含有较多的K菌。这与任君怡等[12]、孙佳晶等[18]在厌氧氨氧化反应器启动实验中发现培养富集的厌氧氨氧化菌属于K菌的结果一致。而R2中由于接种了成熟的厌氧氨氧化污泥,污泥接种前培养体系原水
为50~150 mg/L,属于低基质浓度范围,故自培养体系R1中含有较多的K菌。这与任君怡等[12]、孙佳晶等[18]在厌氧氨氧化反应器启动实验中发现培养富集的厌氧氨氧化菌属于K菌的结果一致。而R2中由于接种了成熟的厌氧氨氧化污泥,污泥接种前培养体系原水![]() 浓度较高,故R2体系中含有较多的B菌,而体系中存在的一定比例的K菌则表明低基质浓度的进水也逐渐将其筛选出来,但尚未成为优势菌属。
浓度较高,故R2体系中含有较多的B菌,而体系中存在的一定比例的K菌则表明低基质浓度的进水也逐渐将其筛选出来,但尚未成为优势菌属。

图5 R1、R2中细菌菌属水平丰度
Figure 5 Abundance of bateria genus in R1 and R2
R1和R2的比厌氧氨氧化活性分别为1.49,1.68 g/(g·d),但是R2中的AnAOB丰度约为R1的2倍。结果说明:厌氧污泥培养出来的厌氧氨氧化系统比厌氧污泥接种成熟AnAOB后培养的系统,在相同AnAOB丰度下有更高的比厌氧氨氧化活性,可能具备更好的脱氮潜力。
R2中反硝化菌属Thiobacillus的丰度高于R1,表明R2体系有更强的反硝化能力。R1体系中检测到Nitrosomonas(亚硝化单胞菌)菌属的存在。该菌属是典型的AOB菌,从属于Betaproteobacteria亚纲,其模式菌种为Nitrosomonas eutropha[19],它也是目前亚硝酸菌中代谢途径最丰富的菌种[20]。DO浓度较低时,该菌可能起着厌氧条件下氨氧化的功能[20]。
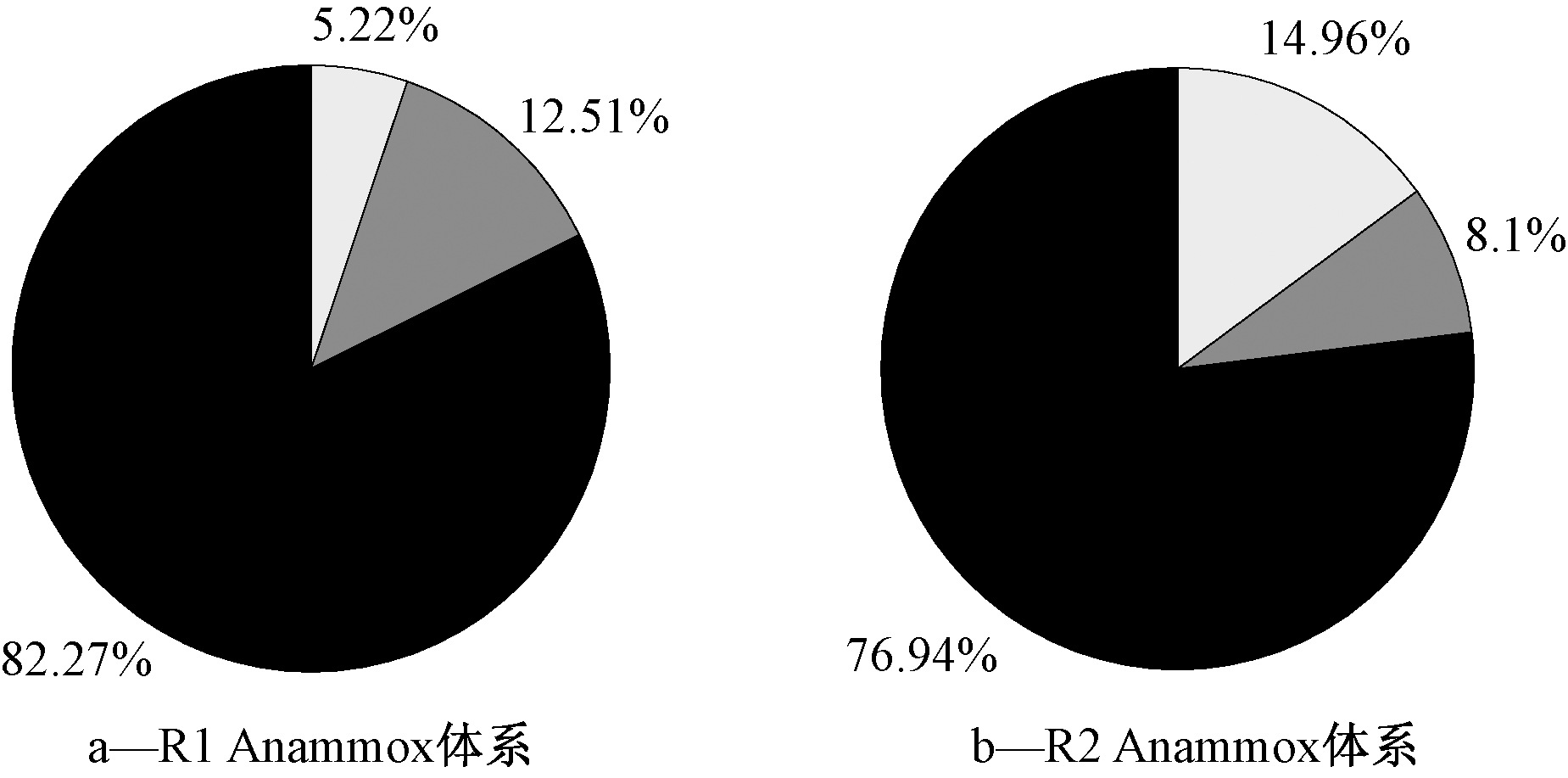
R1和R2体系中还存在着以Bellilinea、Longilinea和Litorilinea为代表的异养菌属。图6展示了R1和R2体系中丰度>1%的细菌菌属中AnAOB及自养菌和异养菌比例分布。可知:R1中AnAOB丰度小于R2,但R1中自养菌和异养菌的丰度均高于R2,这可能是由于R1中Candidatus K菌丰度相比于R2较高,该菌种代谢时对碳的固定需要在其他异养菌群的作用下完成。
![]() AnAOB;
AnAOB; ![]() 自养菌;
自养菌; ![]() 异养菌。
异养菌。
图6 体系中丰度>1%的细菌菌属中AnAOB及自养菌和异养菌比例分布
Figure 6 Proportion distribution of AnAOB, autotrophic and heterotrophic bacteria with abundance >1%
3 结 论
1)R1的AnAOB主要为Candidatus Kuenenia(K菌),其丰度占总菌属比例的7.92%,Candidatus Brocadia(B菌)为R2中主要的AnAOB,其丰度为15.64%。K菌代谢时碳的固定需要在其他异养菌群的作用下完成,因此R1体系中的异养菌属相对丰度更高。
2)外接成熟的AnAOB污泥相比于仅接种厌氧颗粒污泥,能更快速地启动厌氧氨氧化反应,更早获得较高的总氮去除率,但是会引起Candidatus Brocadia富集。而通过厌氧污泥培养得到的主要AnAOB为Candidatus Kuenenia,其在较低丰度的情况下仍能保持相当的脱氮效率,其具有长期培养的潜力。
3)在R1和R2中,随着进水氮负荷的提升,![]() 去除率变化不大,而
去除率变化不大,而![]() 及TN去除率波动明显,R2平均TN去除率下降较多。增大进水氮容积负荷提高了R1和R2中污泥的EPS值,R1上升更加明显。这从一定程度上反映了无外加成熟AnAOB污泥的厌氧颗粒污泥自培养体系可以更好地适应进水氮负荷冲击。
及TN去除率波动明显,R2平均TN去除率下降较多。增大进水氮容积负荷提高了R1和R2中污泥的EPS值,R1上升更加明显。这从一定程度上反映了无外加成熟AnAOB污泥的厌氧颗粒污泥自培养体系可以更好地适应进水氮负荷冲击。
[1] MAO N, REN H, GENG J, et al. Engineering application of anaerobic ammonium oxidation process in wastewater treatment[J]. World Journal of Microbiology and Biotechnology, 2017, 33(8), 153.
[2] Kuenen J G. Anammox bacteria: from discovery to application[J]. Nature Reviews Microbiology, 2008, 6(4):320-326.
[3] 赵宗升, 赵云霞, 陈智均, 等. 厌氧氨氧化菌接种污泥的选择培养过程研究[J]. 环境工程学报, 2007, 1(2):39-42.
[4] 张少辉, 郑平, 华玉妹. 反硝化生物膜启动厌氧氨氧化反应器的研究[J]. 环境科学学报, 2004,24(2):220-224.
[5] 徐师,张大超,肖隆文,等.厌氧氨氧化反应快速启动方法的研究进展[J].环境工程,2018,36(6):18-21,168.
[6] 张鹏达,王少坡,郭文利,等.厌氧氨氧化在城市污水主流处理工艺中的应用[J].工业水处理,2018,38(10):1-6.
[7] JANIS E B, DAMIEN J B, OLIVER J S, et al. Modelling anaerobic, aerobic and partial nitritation-anammox granular sludge reactors: a review[J]. Water Research, 2019, 149:322-341.
[8] DAPENA-MORA A, FERNANDEZ I, CAMPOS J L, et al. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production[J]. Enzyme and Microbial Technology, 2007, 40(4):859-865.
[9] 薛秀玲, 樊国峰, 李吉安. 活性污泥中EPS的2种测定方法及其对膜通量的影响[J]. 环境工程学报, 2013,7(9):3466-3470.
[10] 于英翠, 高大文, 陶彧, 等. 利用序批式生物膜反应器启动厌氧氨氧化研究[J]. 中国环境科学,2012,32(5):843-849.
[11] 李晓惠, 许艳广. 厌氧颗粒污泥同时反硝化与产甲烷的研究[J]. 辽宁科技学院学报, 2009, 11(3):20-22.
[12] 任君怡,陈林艺,李慧春,等.不同种泥的厌氧氨氧化反应器的启动及动力学特征[J]. 环境科学,2019,40(3):1405-1411.
[13] BAE H, CHUNG Y C, JUNG J Y. Microbial community structure and occurrence of diverse autotrophic ammonium oxidizing microorganisms in the anammox process[J]. Water Science and Technology, 2010, 61(11):2723-2732.
[14] 李滨, 赵志瑞, 马斌, 等. 克隆文库方法分析厌氧氨氧化反应器中细菌群落结构[J]. 环境科学与技术, 2012, 35(12):159-164,179.
[15] 贾方旭, 彭永臻, 杨庆. 厌氧氨氧化菌与其他细菌之间的协同竞争关系[J]. 环境科学学报, 2014, 34(6):1351-1361.
[16] PUYOL D, CARVAJAL-ARROYO J M, GARCIA B, et al. Kinetic characterization of Brocadia spp-dominated anammox cultures[J]. Bioresource Technology, 2013, 139:94-100.
[17] van der STAR W R L, MICLEA A I, van DONGEN U G J M, et al. The membrane bioreactor: A novel tool to grow anammox bacteria as free cells[J]. Biotechnology and Bioengineering, 2008, 101(2):286-294.
[18] 孙佳晶, 张蕾, 陈晓波, 等.上流式厌氧污泥床反应器中厌氧氨氧化脱氮性能的研究[J].环境污染与防治,2015,37(2):47-51,58.
[19] KOOPS H P, BÖTTCHER B, MÖLLER U C, et al. Classification of eight new species of ammonia-oxidizing bacteria[J]. Microbiol, 1991, 137(7):1689-1699.
[20] 王舜和, 汪群慧, 王建龙, 等. N.eutropha的缺氧代谢途径研究进展[J]. 给水排水, 2007,33(增刊1):68-71.