随着我国城镇化速度的加快、工业化发展和人民生活水平的提高,城市生活垃圾量也随之增长。而填埋仍然是我国的主流生活垃圾处置工艺。垃圾堆放填埋过程中产生的垃圾渗滤液成分复杂且浓度高,若不经处理直接排放到环境中,将会造成严重的环境污染,甚至威胁人类健康[1]。本实验以活性污泥系统为研究对象,通过筛选分离得到1株具有脱氮除磷能力的光合细菌,以其为生物强化菌种投加到SBR反应器中,研究该菌株对垃圾渗滤液的处理效果,并采用高通量技术解析光合细菌对活性污泥系统中生物群落结构的影响,旨在研究光合细菌强化处理垃圾渗滤液前后,活性污泥中微生物群落结构变化。
光合细菌富集培养基为改良的RCVBN富集培养基,其成分如下:DL-苹果酸 4 g,K2HPO4 0.3 g,MgSO4·7H2O 0.12 g,(NH4)2SO4 1 g,CaCl2·2H2O 0.075 g,EDTA 0.02 g,生物素0.015 g,维生素B1 0.001 g,烟酸0.001 g,微量元素溶液1 mL,超纯水1000 mL,pH为7.0[2]。培养基于121 ℃、1×105 Pa下灭菌20 min。
微量元素溶液:ZnSO4·7H2O 0.02 g,MnCl2·4H2O 0.006 g,H3BO3 0.06 g,CoCl2·6H2O 0.04 g,CuCl2·2H2O 0.002 g,超纯水1000 mL,pH为7.0。
采用SBR反应器作为活性污泥系统主体,反应器结构见图1。
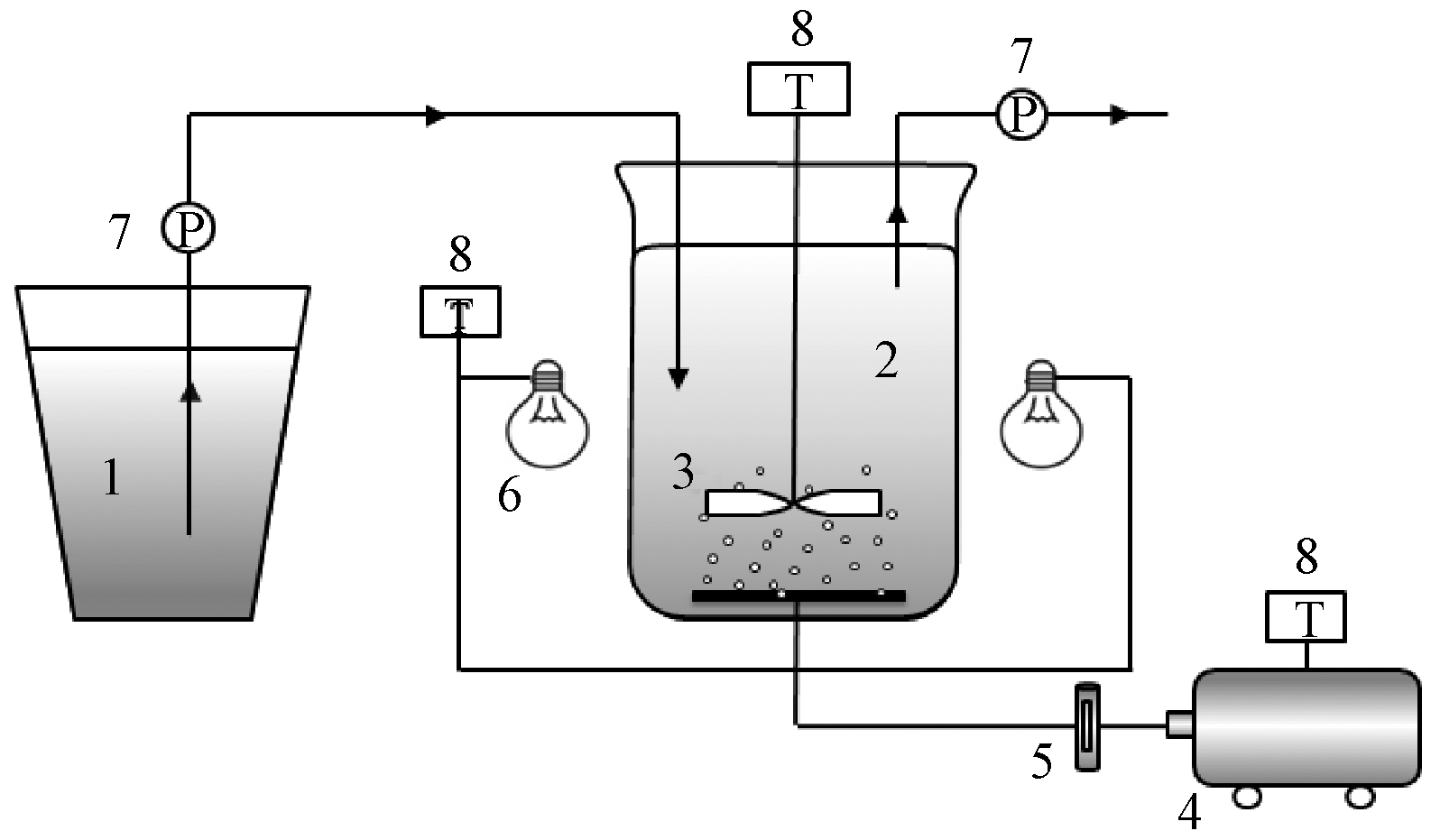
1—进水桶; 2—反应器主体; 3—搅拌器; 4—曝气机; 5—空气流量计; 6—照明灯; 7—蠕动泵; 8—计时器。
图1 活性污泥系统SBR反应器示意
Figure 1 Schematic diagram of the activated sludge SBR system
SBR反应器由有机玻璃制成,总容积为2 L,放置磁力搅拌器,并添加曝气头,保证曝气搅拌时ρ(DO)为2 mg/L左右。采用蠕动泵进水,进水10 min,同时开始曝气搅拌。以静置12 h,搅拌曝气12 h的方式运行,静置时进行光照,黑暗时进行曝气搅拌。每24 h于静置阶段取上清液,取样后以蠕动泵排出1/3~1/4的上清液,再以蠕动泵进水,继续运行。环境温度约为30 ℃。设置2组平行的SBR反应器,其中实验组按5%(体积分数)的投加量加入已培养好的R1菌液,对照组不加菌液。实验周期为15 d。
实验接种污泥为实验室运行良好的活性污泥,ρ(MLSS)为3790 mg/L,所用垃圾渗滤液来自北京市垃圾填埋场渗滤液处理站,为UASB出水。主要水质指标如下:ρ(COD)为![]() 为140~250 mg/L,ρ(TP)为20~40 mg/L,pH为7.6~8.0。
为140~250 mg/L,ρ(TP)为20~40 mg/L,pH为7.6~8.0。
1.4.1 水质及污泥指标测定
实验阶段进出水![]() 和TP及MLSS等指标的测定方法如表1所示。
和TP及MLSS等指标的测定方法如表1所示。
表1 指标测定项目及方法
Table 1 Main analytical items and methods
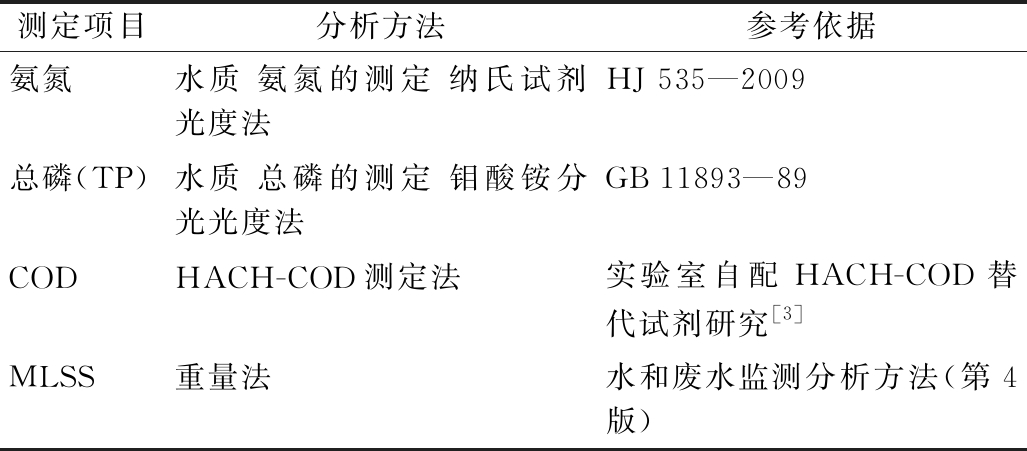
测定项目分析方法参考依据氨氮水质 氨氮的测定 纳氏试剂光度法HJ 535—2009总磷(TP)水质 总磷的测定 钼酸铵分光光度法GB 11893—89CODHACH-COD测定法实验室自配HACH-COD替代试剂研究[3]MLSS重量法水和废水监测分析方法(第4版)
1.4.2 污泥样品采集及测序
实验周期结束后,取实验与对照活性污泥置于50 mL 离心管中,于5000 r/min下离心15 min后弃去上清液,未投加光合细菌的对照组编号为Sa,投加光合细菌的实验组编号为Sb。活性污泥DNA的提取使用OMEGA土壤DNA基因组提取试剂盒(Soil DNA Kit),按照其说明书所描述步骤操作。样品DNA储存于-80 ℃下。污泥DNA提取后进行PCR扩增,扩增区域选择16S rDNA V3—V4区,引物采用该区域通用引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)。PCR反应条件为:95 ℃预反应3 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸45 s,反应循环27次,72 ℃延伸10 min,4 ℃下保存备用。高通量测序委托上海美吉生物医药有限公司完成,利用细菌16S rDNA V3—V4区的特点,完成文库构建后利用Illumina MiSeq测序平台测序。
经富集、分离和纯化,从垃圾渗滤液中筛选出1株既能在光照厌氧下又能在黑暗好氧条件下生长良好的革兰氏阴性菌,经形态学和分子生物学鉴定,该菌株为沼泽红假单胞菌(Rhodopseudomonas palustris),命名为R1。经初步检测其具有去除![]() 和TP的效果,在光照厌氧条件下,对
和TP的效果,在光照厌氧条件下,对![]() 和TP去除率分别为76.210%、56.252%和82.726%;在黑暗好氧条件下,其去除率分别为73.261%、43.348%和92.282%。
和TP去除率分别为76.210%、56.252%和82.726%;在黑暗好氧条件下,其去除率分别为73.261%、43.348%和92.282%。
由于原处理工艺中经过两级厌氧反应器后出水生化性和污泥沉降性较差,且后续生化反应器中生物相破坏严重,MBR膜堵塞严重,故选择光合细菌作为生物强化菌种投入活性污泥系统中,考察其对系统的强化作用。
SBR反应器运行期间,对进出水的![]() 和TP浓度进行测定,如图2所示。可知:进水ρ(COD)为1000~2500 mg/L,实验组出水ρ(COD)平均值为229.022 mg/L,平均去除率为83.091%,对照组出水ρ(COD)平均值为417.511 mg/L,平均去除率为69.305%。这说明系统投加菌剂后可在一定程度上抵抗进水冲击负荷,对活性污泥系统有一定稳定作用。
和TP浓度进行测定,如图2所示。可知:进水ρ(COD)为1000~2500 mg/L,实验组出水ρ(COD)平均值为229.022 mg/L,平均去除率为83.091%,对照组出水ρ(COD)平均值为417.511 mg/L,平均去除率为69.305%。这说明系统投加菌剂后可在一定程度上抵抗进水冲击负荷,对活性污泥系统有一定稳定作用。
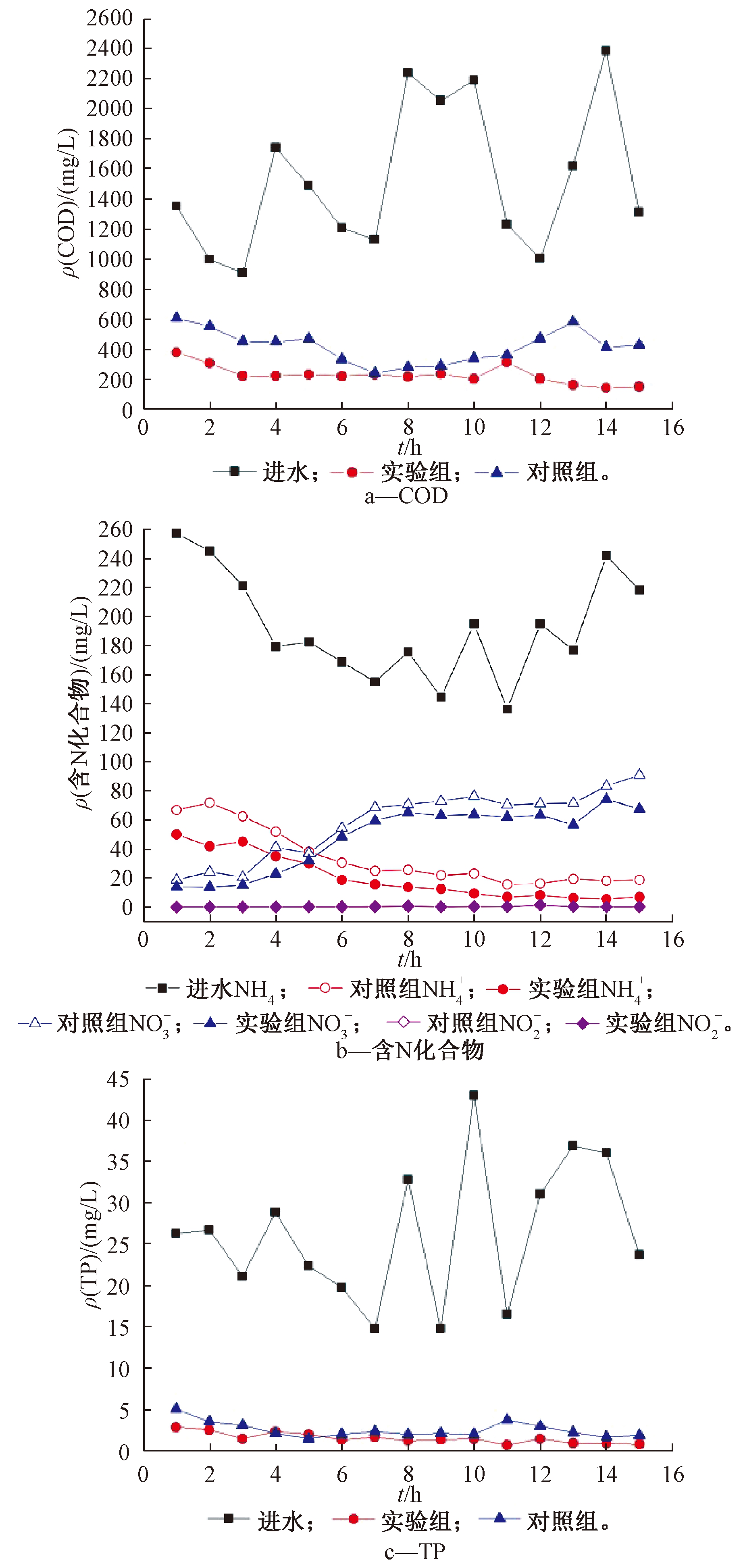
图2 SBR反应器进出水![]() 和TP的变化
和TP的变化
Figure 2 Changes of COD, ![]() and TP in influent and effluent of the SBR reactor
and TP in influent and effluent of the SBR reactor
由图2b可知:进水![]() 为140~250 mg/L,对照组出水平均值为33.354 mg/L,平均去除率为82.953%,实验组出水平均值为20.563 mg/L,实验后期10~15 d出水
为140~250 mg/L,对照组出水平均值为33.354 mg/L,平均去除率为82.953%,实验组出水平均值为20.563 mg/L,实验后期10~15 d出水![]() 平均值降低至6.688 mg/L,平均去除率为89.795%。同时,实验后期对照组的
平均值降低至6.688 mg/L,平均去除率为89.795%。同时,实验后期对照组的![]() 积累量约为80 mg/L,实验组约为60 mg/L,且实验组和对照组均有极少量
积累量约为80 mg/L,实验组约为60 mg/L,且实验组和对照组均有极少量![]() 积累。
积累。![]() 和
和![]() 的累积现象可能是由于活性污泥系统中的硝化细菌进行硝化反应将
的累积现象可能是由于活性污泥系统中的硝化细菌进行硝化反应将![]() 转化为
转化为![]() 后,系统内缺乏可利用的碳源导致反硝化作用无法进行。
后,系统内缺乏可利用的碳源导致反硝化作用无法进行。
由图2c可知:进水ρ(TP)为20~40 mg/L,对照组出水ρ(TP)平均值为2.511 mg/L,平均去除率为89.283%,实验组出水平均值为1.508 mg/L,平均去除率为93.704%,且较为稳定。
采用F检验法对2组的![]() 和TP出水浓度数据进行统计学分析,结果表明,对于出水COD和TP,实验组数据的差异性为极显著(P<0.01),对于
和TP出水浓度数据进行统计学分析,结果表明,对于出水COD和TP,实验组数据的差异性为极显著(P<0.01),对于![]() 有显著性差异(P<0.05),说明光合细菌的投加显著提高了活性污泥系统对
有显著性差异(P<0.05),说明光合细菌的投加显著提高了活性污泥系统对![]() 和TP的去除效果。从统计学意义上看,光合细菌R1的添加对活性污泥系统具有强化作用,提高了活性污泥系统对垃圾渗滤液有机物去除及脱氮除磷效果。
和TP的去除效果。从统计学意义上看,光合细菌R1的添加对活性污泥系统具有强化作用,提高了活性污泥系统对垃圾渗滤液有机物去除及脱氮除磷效果。
实验初期,实验室运行良好的活性污泥ρ(MLSS)为3790 mg/L,反应器运行期间未进行排泥,运行 15 d后对照组ρ(MLSS)为9578 mg/L,实验组为7530 mg/L。对比可见,投加了光合细菌的污泥浓度明显小于对照组,污泥产量较小,证实了已有研究所述的光合细菌不产生剩余污泥的理论[4],这可在一定程度上节省剩余污泥处理成本。
2.3.1 Illumina Miseq高通量测序结果分析
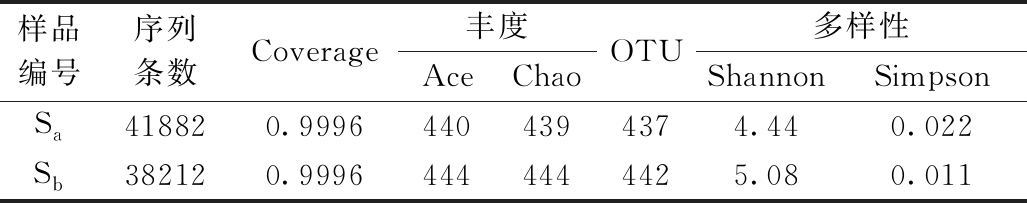
利用高通量测序技术得到样品Sa和Sb的序列数,通过MiSeq高通量测序平台共读出80094条有效序列,Sa与Sb的有效序列分别为38212条和41882条,样品覆盖率均为99.96%,说明样品的测序深度合适,所得到的数据能够很好地反映环境中微生物群落结构的真实信息。
2.3.2 微生物丰度及多样性分析
丰度指数与多样性指数用于表征样品中的微生物多样性,其中,Chao指数和Ace指数用于估算样品中的OTU数目,数值越大,表明样品中的物种越丰富。Simpson指数和Shannon指数则反映样品中物种的多样性和均匀度,Simpson指数数值越大,说明生物群落多样性越低;而Shannon指数数值越大,说明生物群落多样性越高。样品多样性指数见表2(OTU相似度为97%),可知添加了光合细菌后,活性污泥系统中的微生物群落复杂程度和群落多样性有所提高。
表2 生物多样性指数统计
Table 2 Statistical table of biodiversity indexes
样品编号序列条数Coverage丰度AceChaoOTU多样性ShannonSimpsonSa418820.99964404394374.440.022Sb382120.99964444444425.080.011
2.3.3 微生物群落结构分析
对Sa和Sb 2个样本间的物种丰度差异进行比较,通过此分析可获得优势物种在2个对比样本中的差异显著性。从物种的相对丰度来看,投加光合细菌后,红假单胞菌属Rhodopseudomonas占明显优势,且主要优势菌属间的P值均<0.005,说明投加光合细菌前后,种群结构有显著差异,光合细菌的投加对种群结构影响较大。
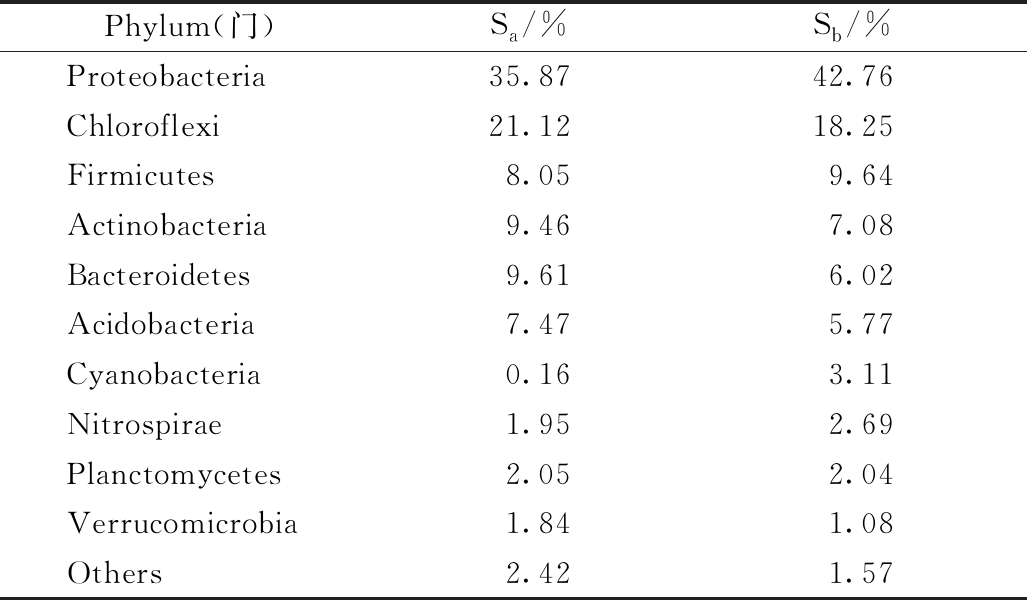
2个样品DNA经高通量测序后得到OTU序列,对其进行分类学分析,可获得门水平上微生物的组成和相对丰度,对照组和实验组污泥样品各检测出11个菌门,如表3所示。变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)为最优势菌门,其次依次为放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、蓝细菌门(Cyanobacteria)、硝化螺菌门(Nitrospirae)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)等。选取门水平上相对丰度>1%的优势菌门列于表3中。可见,2组污泥样品中各优势菌门种类较为一致,在丰度上有所差别,其中Sa中的优势菌门为变形菌门(35.87%)、绿弯菌门(21.12%)、拟杆菌门(9.61%)、酸杆菌门(9.46%)、厚壁菌门(8.05%);Sb中的优势菌门为变形菌门(42.76%)、绿弯菌门(18.25%)、厚壁菌门(9.64%)、酸杆菌门(7.08%)、拟杆菌门(6.02%)。
在污水处理系统中,变形菌门(Proteobacteria)菌群为一类优势菌群[5],大多数为兼性或专性厌氧的革兰氏阴性,并且多数反硝化微生物和脱氮细菌均属于变形菌门[6]。绿弯菌门(Chloroflexi)菌群在活性污泥系统中有较好的生物除磷作用[7],也为污泥菌胶团提供了支撑骨架[8]。厚壁菌门(Firmicutes)菌群为一类能够产生芽孢,可抵抗极端环境的革兰氏阳性菌,细胞壁肽聚糖含量较高,其分类下的芽孢杆菌纲(Clostridia)可能与难降解有机质有关[9]。拟杆菌门(Bacteroidetes)菌群是一类化能有机营养菌,能够降解复杂有机物,是降解COD的主要菌群[5]。此外,2组污泥中还存在一定的蓝细菌门(Cyanobacteria)菌群,而Sb中蓝细菌的丰度(3.11%)高于Sa(0.16%),推测是由于反应器在一定时间段内处于光照下,所添加的光合细菌R1促进了蓝细菌的生长。2组反应器中还具有一定比例的浮霉菌门(Planctomycetes)菌群,其分类下的部分菌属具有厌氧氨氧化功能,但大多数为化能异养菌,能够在厌氧条件下进行发酵作用[9-10]。由于本实验反应器为间歇运行,静置期间为厌氧状态,形成了适宜该类菌群生长的环境。
表3 门水平相对丰度(相对丰度>1%)
Table 3 Relative abundance of Phylum levels (relative abundance>1%)
Phylum(门)Sa/%Sb/%Proteobacteria35.8742.76Chloroflexi21.1218.25Firmicutes8.059.64Actinobacteria9.467.08Bacteroidetes9.616.02Acidobacteria7.475.77Cyanobacteria0.163.11Nitrospirae1.952.69Planctomycetes2.052.04Verrucomicrobia1.841.08Others2.421.57
2.3.4 优势菌群及功能菌群分析
为进一步研究反应器中微生物的群落结构,对各样品在属水平上的相对丰度进行分析,属水平上相对丰度>1%的优势菌属如图3所示。可以看出:Sa中优势菌属有Anaerolineaceae(7.02%)、Xanthomonadaceae(5.22%)、Blastocatellaceae(5.22%)、Hydrogenophaga(3.42%)、Acidimicrobiales(3.28%)、SBR2076(3.26%)、Caldilineaceae(3.05%)、JG30-KF-CM45(3.03%)、Nitrosomonadaceae(2.64%)、Saprospiraceae(2.38%)、Novosphingobium(2.34%)、Hyphomicrobium(2.27%)、Peptococcaceae(2.13%)等,共约有22个菌属,Sb中优势菌属有Rhodopseudomonas(11.56%)、Anaerolineaceae(4.28%)、Xanthomonadaceae(3.82%)Blastocatellaceae(3.77%)、JG30-KF-CM45(3.66%)、Caldilineaceae(3.32%)、SBR2076(3.14%),Cyanobacteria(3.11%)、Peptococcaceae(2.72%)、Nitrospira(2.69%)、Acidimicrobiales(2.49%)、Nitrosomonadaceae(2.46%)等,共约有24个菌属。

![]() Sa;
Sa; ![]() Sb。
Sb。
图3 属水平相对丰度(相对丰度>1%)
Figure 3 Relative abundance of Genus levels (relative abundance>1%)
由图3可知:Sb中相对丰度明显高于Sa的菌属有Acinetobacter、Bdellovibrio、Cyanobacteria、Exiguobacterium、Limnobacter、Nitrosomonadaceae、Peptococcacea、Planctomycetaceae和Terrimonas。这些相对丰度较高的优势菌群各自具有一定的特性,能够去除水体中不同的污染物质。
1)有机物去除优势菌群。
暖绳菌属(Caldilineaceae)是一类具有水解发酵作用的菌群,能够降解醋酸、丙酮酸、油酸和糖类有机物[11]。蛭弧菌属(Bdellovibrio)是一类能“吃掉”细菌的细菌,能够寄生于致菌体内并导致其裂解,具有净化水体的作用。汪红等[12]将蛭弧菌与污水混合培养,验证了蛭弧菌对污水中致病细菌有较好的净化效果。微小杆菌属(Exiguobacterium)是一类革兰氏阳性、无芽孢的兼性厌氧菌,其具有分解复杂有机物、转化重金属的能力,并能够耐受极端环境[13]。有研究表明,Limnobacter菌属是一类能够氧化硫代硫酸盐和苯酚的异养细菌[6,14]。Chen等[15]在甲烷厌氧氧化过程中富集培养出Limnobacter,发现其参与了糖酵解途径、柠檬酸循环及香茅醇的降解过程。
2)脱氮优势菌群。
Bordacs[16]对生物除磷曝气系统中的活性污泥微生物进行研究,结果表明,不动杆菌属(Acinetobacter)是优势除磷菌群,其还具有反硝化脱氮作用。浮霉状菌属(Planctomycetaceae)包括一类在厌氧条件下能够将NH3-N转化为N2的菌群[17]。Terrimonas属于拟杆菌门的鞘脂杆菌纲,是一类好氧革兰氏阴性细菌,能够还原![]() 本实验中Sb中的亚硝化单胞菌属(Nitrosomonas)丰度高于Sa,硝化螺菌属(Nitrosospira)的丰度与Sa基本持平,表明进行生物强化的活性污泥系统中氨氧化菌群丰度得到提高。常见的反硝化细菌有产碱杆菌属(Alcaligenes)、不动杆菌属(Acinetobacter)、芽孢杆菌属(Bacillus)、副球菌属(Paracoccus)、假单胞菌属(Pseudomonas)、黄单胞菌属(Xanthomonadaceae)、盐杆菌属(Halobacterium)、陶厄氏菌属(Thauera)等[6, 19],而在本实验污泥中仅检测出不动杆菌属(Acinetobacter)、黄单胞菌属(Xanthomonadaceae)和低丰度的假单胞菌属(Pseudomonas),其中黄单胞菌属(Xanthomonadaceae)在Sa中所占比例为5.41%,在Sb中所占比例为3.82%,假单胞菌属(Pseudomonas)在Sa中所占比例为0.05%,在Sb中所占比例为0.33%,推测是由于垃圾渗滤液的特殊性所致。
本实验中Sb中的亚硝化单胞菌属(Nitrosomonas)丰度高于Sa,硝化螺菌属(Nitrosospira)的丰度与Sa基本持平,表明进行生物强化的活性污泥系统中氨氧化菌群丰度得到提高。常见的反硝化细菌有产碱杆菌属(Alcaligenes)、不动杆菌属(Acinetobacter)、芽孢杆菌属(Bacillus)、副球菌属(Paracoccus)、假单胞菌属(Pseudomonas)、黄单胞菌属(Xanthomonadaceae)、盐杆菌属(Halobacterium)、陶厄氏菌属(Thauera)等[6, 19],而在本实验污泥中仅检测出不动杆菌属(Acinetobacter)、黄单胞菌属(Xanthomonadaceae)和低丰度的假单胞菌属(Pseudomonas),其中黄单胞菌属(Xanthomonadaceae)在Sa中所占比例为5.41%,在Sb中所占比例为3.82%,假单胞菌属(Pseudomonas)在Sa中所占比例为0.05%,在Sb中所占比例为0.33%,推测是由于垃圾渗滤液的特殊性所致。
3)除磷优势菌群。
常见的优势除磷菌群有不动杆菌属(Acinetobacter)、肠球菌属(Enterococcus)、气单胞菌属(Aeromonas)和棒杆菌属(Corynebacterium)[9]。本实验中仅检测出不动杆菌属(Acinetobacter)。此外,暖绳菌属(Caldilineaceae)[20]及异养硝化-好氧反硝化菌如假单胞菌属(Pseudomonas)[21]也具有除磷作用。
综上所述,光合细菌R1的添加提高了以上优势菌群和功能菌群的相对丰度,在其共同作用下,投加光合细菌R1的活性污泥系统表现出较好的有机物去除及脱氮除磷效果。
1)经富集、分离和纯化,从垃圾渗滤液中筛选出1株既能在光照厌氧下又能在黑暗好氧条件下生长良好的革兰氏阴性菌,经形态学和分子生物学鉴定,该菌株为沼泽红假单胞菌(Rhodopseudomonas palustris),命名为R1,其具有去除![]() 和TP的能力。
和TP的能力。
2)向活性污泥SBR工艺中投加光合菌以处理垃圾渗滤液,结果表明,投加光合细菌的实验组活性污泥系统出水ρ(COD)和ρ(TP)平均分别为229.022,1.508 mg/L,实验后期(10~15 d)出水![]() 平均为6.688 mg/L。添加光合细菌能够有效强化活性污泥系统的脱氮除磷效果,并有效减少污泥产量,降低处理成本。
平均为6.688 mg/L。添加光合细菌能够有效强化活性污泥系统的脱氮除磷效果,并有效减少污泥产量,降低处理成本。
3)通过高通量测序技术对实验组和对照组污泥中的微生物群落结构进行分析,发现实验组中的优势菌门为变形菌门(42.76%)、绿弯菌门(18.25%)、厚壁菌门(9.64%)、酸杆菌门(7.08%)、拟杆菌门(6.02%)。其中,有机物去除功能菌为Caldilineaceae、Bdellovibrio、Exiguobacterium、Limnobacter,脱氮功能菌为Acinetobacter、Planctomycetaceae、Terrimonas、Nitrosomonas,Pseudomonas和除磷功能菌为Acinetobacter、Caldilineaceae和Pseudomonas的丰度均高于对照组。结果表明,添加的光合细菌R1不仅能够稳定存在于活性污泥系统中,且可有效改善活性污泥系统中微生物群落结构,提升其去除有机物及脱氮除磷的性能。
[1] 聂发辉, 李文婷, 刘占孟. 垃圾渗滤液处理技术的研究进展 [J]. 华东交通大学学报, 2013(2): 21-27.
[2] ZHOU Q, ZHANG G M, ZHENG X, et al. Biological treatment of high ![]() wastewater using an ammonia-tolerant photosynthetic bacteria strain (ISASWR2014)[J]. Chinese Journal of Chemical Engineering, 2015, 23(10): 1712-1715.
wastewater using an ammonia-tolerant photosynthetic bacteria strain (ISASWR2014)[J]. Chinese Journal of Chemical Engineering, 2015, 23(10): 1712-1715.
[3] 吉芳英, 杨琴, 罗固源. 实验室自配HACH-COD替代试剂研究[J]. 给水排水, 2003(1):20-23.
[4] 黄翔峰, 李春鞠, 章非娟. 光合细菌的特性及其在废水处理中的应用[J]. 中国沼气, 2005(1):28-34.
[5] VEDLER E, HEINARU E, JUTKINA J, et al. Limnobacter sp. as newly detected phenol-degraders among Baltic Sea surface water bacteria characterised by comparative analysis of catabolic genes [J]. Systematic and Applied Microbiology, 2013, 36(8): 525-532.
[6] 吉芳英, 陈思, 刘娜. 污水处理中微生物反硝化脱氮过程及代谢规律 [J]. 四川理工学院学报(自然科学版), 2013, 26(4): 10-14.
[7] KRAGELUND C, LEVANTESI C, BORGER A, et al. Identity, abundance and ecophysiology of filamentous Chloroflexi species present in activated sludge treatment plants [J]. Fems Microbiology Ecology, 2007, 59(3): 671-82.
[8] LARSEN P, NIELSEN J L, OTZEN D, et al. Amyloid-like adhesins produced by floc-forming and filamentous bacteria in activated sludge [J]. Applied & Environmental Microbiology, 2008, 74(5): 1517.
[9] 信欣, 管蕾, 姚艺朵, 等. 低DO下AGS-SBR处理低COD/N生活污水长期运行特征及种群分析 [J]. 环境科学, 2016, 37(6): 2259-2265.
[10] 侯爱月, 李军, 卞伟, 等. 不同短程硝化系统中微生物群落结构的对比分析 [J]. 中国环境科学, 2016, 36(2): 428-36.
[11] ZHOU Z, QIAO W M, XING C, et al. A micro-aerobic hydrolysis process for sludge in situ reduction: performance and microbial community structure.[J]. Bioresource Technology, 2014, 173:452-456.
[12] 汪红, 徐政, 于正洋, 等. 蛭弧菌对污水生物净化效果的实验观察 [J]. 实验技术与管理, 2014, 31(4): 54-56.
[13] 张莹, 石萍, 马炯. 微小杆菌Exiguobacterium sp.及其环境应用研究进展 [J]. 应用与环境生物学报, 2013, 5): 898-904.
[14] LU H, SATO Y, FUJIMURA R, et al. Limnobacter litoralis sp. nov., a thiosulfate-oxidizing, heterotrophic bacterium isolated from a volcanic deposit, and emended description of the genus Limnobacter [J]. International Journal of Systematic & Evolutionary Microbiology, 2011, 61(2): 404-407.
[15] CHEN Y, FENG X, HE Y, et al. Genome Analysis of a Limnobacter sp. Identified in an Anaerobic Methane-Consuming Cell Consortium[J]. Frontiers in Marine Science, 2016, 3.
[16] BORDACS L, CHIESA S C. Carbon flow patterns in enhanced biological phosphorus accumulating activated sludge culture[J]. Water Science Technology, 1989, 21: 387-396.
[17] 贾方旭, 彭永臻, 王衫允, 等. 厌氧氨氧化菌细胞的超微结构及功能 [J]. 应用与环境生物学报, 2014, 20(5): 944-954.
[18] 曾妮. 污水处理厂微生物群落结构及 胞外聚合物组分分析 [D]. 重庆:重庆大学, 2015.
[19] 陈燕, 刘国华, 范强, 等. 活性污泥法中细菌多样性综述 [J]. 环境保护科学, 2015, 41(4): 70-78.
[20] MENG J, LI J L, LI J Z, et al. Efficiency and bacterial populations related to pollutant removal in an upflow microaerobic sludge reactor treating manure-free piggery wastewater with low COD/TN ratio [J]. Bioresource Technology, 2016, 201:166.
[21] 严子春, 史登峰, ISEGHAYAN N. 富铁填料强化A/O-曝气生物滤池工艺的脱氮除磷效果 [J]. 环境污染与防治, 2017, 39(11): 1186-1188.