砷是自然界中广泛存在的一种原生质毒物[1],在水环境中主要以As(Ⅲ)和As(Ⅴ)2种形式存在,As(Ⅲ)比As(Ⅴ)的毒性更强,且更难从水中去除[2]。砷不但会危及神经系统、心血管系统和免疫系统,长期暴露下甚至会引发皮肤、肺脏等肿瘤问题[3]。各环保组织已将饮用水中砷的最大含量由原来的50 μg/L修订为10 μg/L[4]。可见,砷污染越来越受到人们的广泛关注。
目前,去除砷的方法有离子交换法、化学沉淀法和吸附法等[5],其中吸附法由于操作简便且去除率高,已成为热门的除砷方法之一。常用的吸附材料有含铁矿物及其复合物[6]、活性材料[7]和稀土金属[8]等。镧作为1种储存量较大且价格经济的稀土元素之一,可有效吸附部分阴离子。例如,陆岩等[8]将La2O3作为吸附剂,研究了其对![]() 的吸附;Fang等[9]制备出1种La(OH)3纳米棒,对
的吸附;Fang等[9]制备出1种La(OH)3纳米棒,对![]() 的吸附能力高达171 mg/L。但目前利用含镧材料吸附重金属尤其是As(Ⅲ)的研究还较少。且由于La2O3的制备过程易发生团聚,吸附效果不理想,在吸附剂的制备过程中,添加适当比例的表面活性剂,降低颗粒表面张力,可使得吸附剂的团聚现象得到改善。本文通过引入十六烷基三甲基溴化铵(CTMAB),在室温下采用简单的化学沉淀法,制备出具有粒径较小且分散性较好的La2O3纳米颗粒,研究了不同影响因素对La2O3纳米颗粒吸附As(Ⅲ)的影响,并探究了As(Ⅲ)的去除机理。
的吸附能力高达171 mg/L。但目前利用含镧材料吸附重金属尤其是As(Ⅲ)的研究还较少。且由于La2O3的制备过程易发生团聚,吸附效果不理想,在吸附剂的制备过程中,添加适当比例的表面活性剂,降低颗粒表面张力,可使得吸附剂的团聚现象得到改善。本文通过引入十六烷基三甲基溴化铵(CTMAB),在室温下采用简单的化学沉淀法,制备出具有粒径较小且分散性较好的La2O3纳米颗粒,研究了不同影响因素对La2O3纳米颗粒吸附As(Ⅲ)的影响,并探究了As(Ⅲ)的去除机理。
氯化镧(LaCl3·nH2O)、NaOH、HCl、CTMAB、无水乙醇,以上试剂均为分析纯,实验用水均为蒸馏水。
将一定量的CTMAB和6.80 g LaCl3·nH2O加入150 mL蒸馏水中,超声至CTMAB完全溶解。剧烈搅拌下,将250 mL NaOH溶液逐滴缓慢滴加到上述溶液中,直至溶液pH达到9~10。滴加完毕后继续搅拌30 min。室温下静置4 h,用蒸馏水和无水乙醇反复冲洗2~3次,然后在60 ℃下烘干,最后用管式电热炉在750 ℃下煅烧2 h,制得La2O3纳米颗粒。并通过改变CTMAB的添加量得到不同的La2O3纳米颗粒。La2O3纳米颗粒的制备过程可以用方程(1)和(2)表示:
LaCl3+3NaOH→La(OH)3+3NaCl
(1)
(2)
As(Ⅲ)储备液在500 mL容量瓶中使用亚砷酸钠配制而成。实验在含有100 mL蒸馏水的容积为120 mL高密度聚乙烯瓶中进行:准确称取一定量的La2O3和As(Ⅲ)储备液(未做特别说明处,As(Ⅲ)的初始浓度为20 mg/L,溶液pH为6,反应温度为30 ℃,La2O3投加量为0.4 g/L),加入反应瓶中,将其放入恒温振荡器中振荡(170 r/min)。在固定时间间隔取样,采用0.22 μm醋酸纤维滤膜过滤到取样瓶中,然后采用原子吸收分光光度计测定溶液中As(Ⅲ)浓度。
1.4.1 吸附动力学
La2O3纳米颗粒吸附As(Ⅲ)的动力学采用伪一级动力学模型和伪二级动力学模型来拟合[10]。
伪一级动力学:
(3)
伪二级动力学:
(4)
式中:qe为吸附质的平衡吸附量,mg/g;q2为吸附质在平衡时间的理论吸附量,mg/g;qt为t时刻时吸附质在吸附剂上的吸附量,mg/g;k1为伪一级速率常数;k2为伪二级平衡速率常数。
1.4.2 吸附等温线
采用 Freundlich 吸附等温模型和Langmuir 吸附等温模型对本实验进行模拟[11]。
Langmuir等温吸附模型:
(5)
Freundlich等温吸附模型:
lgqe=lgkf+nlgCe
(6)
式中:b为Langmuir等温吸附常数;qe为平衡时的吸附容量,mg/g;q0为吸附剂的理论最大吸附容量,mg/g;Ce为吸附达到平衡时目标污染物溶液浓度,mg/L;kf和n为Freundlich等温吸附常数。
通过投加不同质量的CTMAB [w(CTMAB)分别为0%、0.05%、0.1%、0.2%、0.3%、0.4%]制得6种La2O3纳米颗粒样品分别进行吸附实验,如图1所示。可知:随着制备过程中CTMAB含量的增加, As(Ⅲ)去除率逐渐增大,当w(CTMAB)为0.2%时,去除率达到85.36%,但是当w(CTMAB)>0.2%以后趋于平稳,当w(CTMAB)达到0.4%时,去除率反而减小。研究表明,通过添加表面活性剂后,颗粒的表面张力和表面吉布斯自由能降低,使得它们之间不易接近,防止颗粒团聚[12]。但表面活性剂浓度过高同样会导致颗粒间的团聚:加入过量表面活性剂后,前驱物可吸附表面活性剂分子,促进前驱物粒径变大;同时表面活性剂分子含有极性基团,可以同时吸附多个前驱物,使之发生团聚;而且会增强溶液的黏度,导致沉淀分离困难,不易洗净,同样无法起到有效分散的作用[13]。因此,在后续实验中,确定La2O3纳米颗粒吸附剂中CTMAB的质量分数为0.2%。
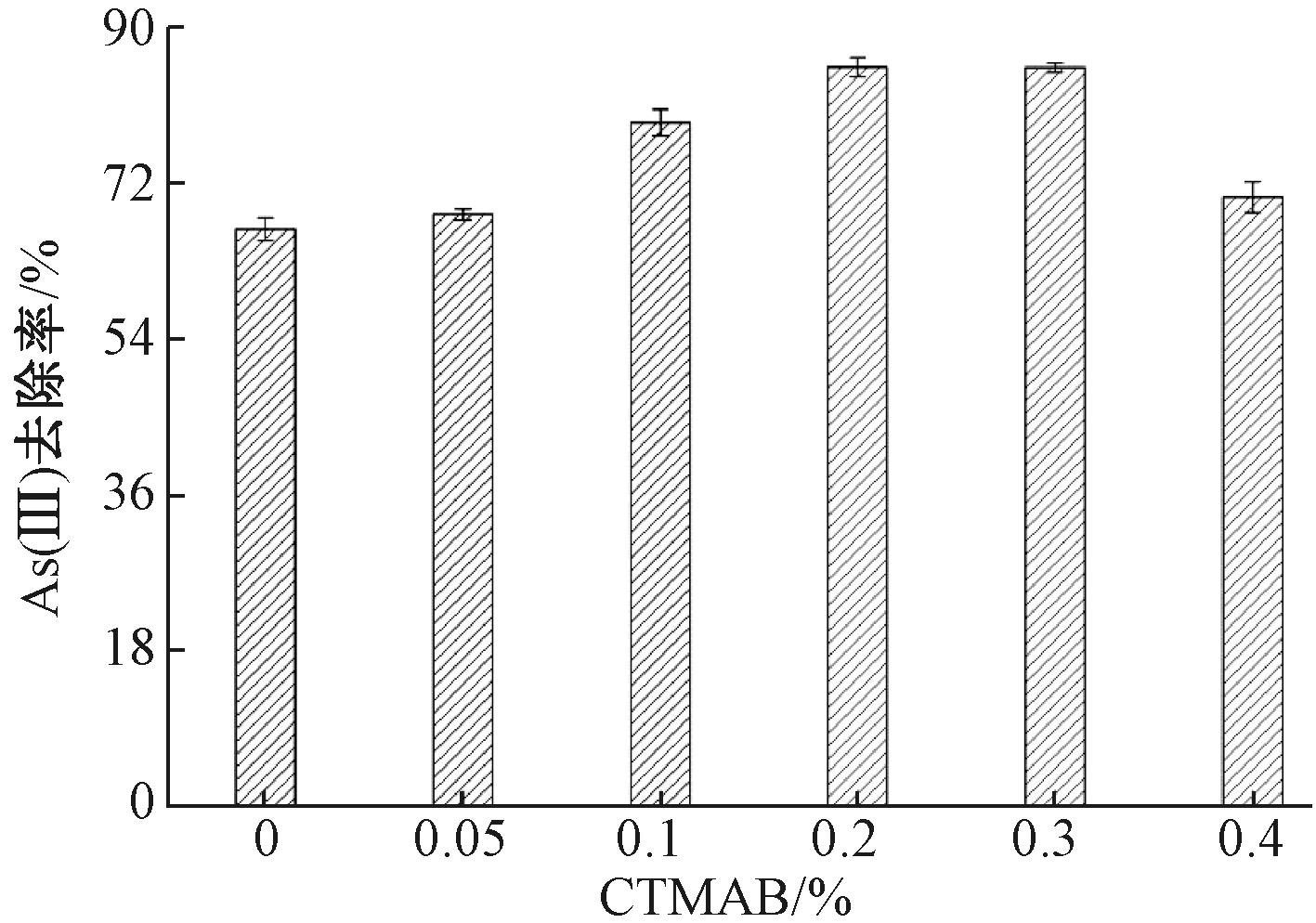
注:T=30 ℃,pH=6,ρ(La2O3)=0.4 g/L,ρ[As(Ⅲ)]=20 mg/L。
图1 不同CTMAB投加量对As(Ⅲ)去除率的影响
Figure 1 Effect of CTMAB dosage on As(Ⅲ) adsorption rate
采用X射线衍射分析(XRD)对La2O3纳米颗粒进行成分分析,表征结果如图2所示。可知:此XRD图和标准谱图中的La2O3衍射数据基本保持一致,衍射峰强度较高且较尖锐,在2θ=26.094°、29.946°、39.488°和46.034°等位置出现的10个衍射峰分别与La2O3的(100)、(011)、(012)、(100)等10种晶面对应[14],除此之外没有观察到其他物质的峰,这表明本实验制得吸附剂中La2O3纯度极高。
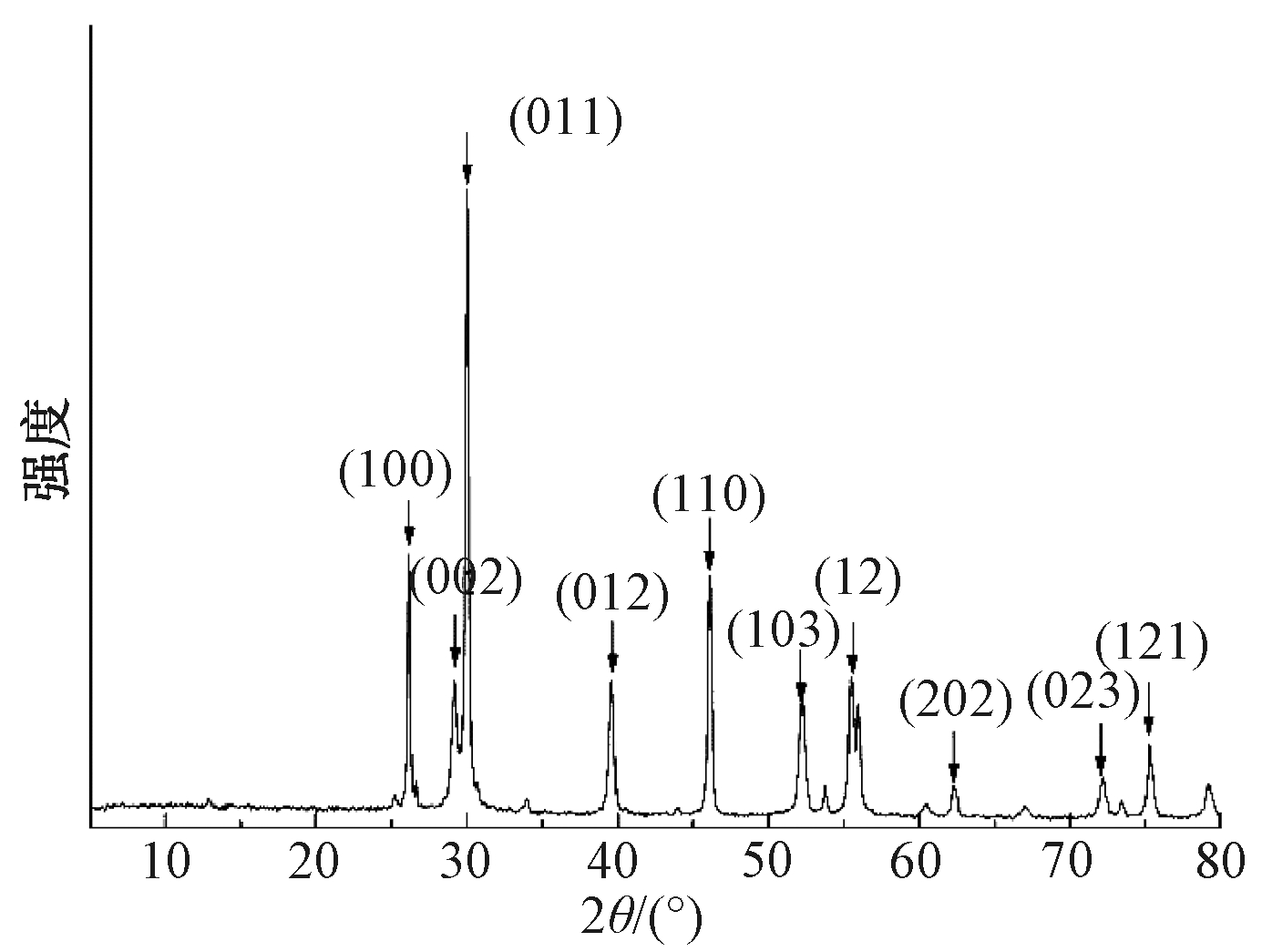
图2 加入0.2%CTMAB的La2O3纳米颗粒的XRD图谱
Figure 2 X-ray diffraction pattern of La2O3 nanoparticles with 0.2% CTMAB added
采用扫描电子显微镜 (SEM)对La2O3纳米颗粒进行形貌分析见图3。由图3a可看出:未加入CTMAB时,La2O3呈絮状团聚在一起,不能清晰分辨出颗粒的结构和形态。而由图3b可清晰地看到,La2O3是1种圆片状结构的颗粒,粒径为50~100 nm。加入0.2%的CTMAB后, La2O3的纳米颗粒分明,可以清晰地分辨出其颗粒结构和形貌。由此可知,La2O3的团聚现象得到了较大程度的改善。因此,加入CTMAB有利于La2O3的分散,从而增大了吸附剂与As(Ⅲ)的接触面积,增强了对As(Ⅲ)的吸附。

图3 投加CTMAB前后纳米La2O3的SEM扫描电镜图像
Figure 3 SEM images of La2O3 nanoparticles before and after 0.2% CTMAB added
采用比表面积分析仪(BET)对La2O3纳米颗粒进行分析。由图4a可知:La2O3纳米颗粒的氮吸附-解吸等温线为Ⅳ型,且在P/P0=0.8处出现H3型滞后环,表明La2O3是1种介孔材料[15]。由图4b可知:La2O3纳米颗粒孔径分布在2.44~50.00 nm,分布范围较宽,其比表面积、平均孔径和孔体积分别为19.00 m2/g、18.65 nm和0.077 cm3/g。根据氮吸附-解吸等温线和IUPAC 的分类法可知[16],La2O3纳米颗粒是1种具有典型介孔结构的纳米材料。
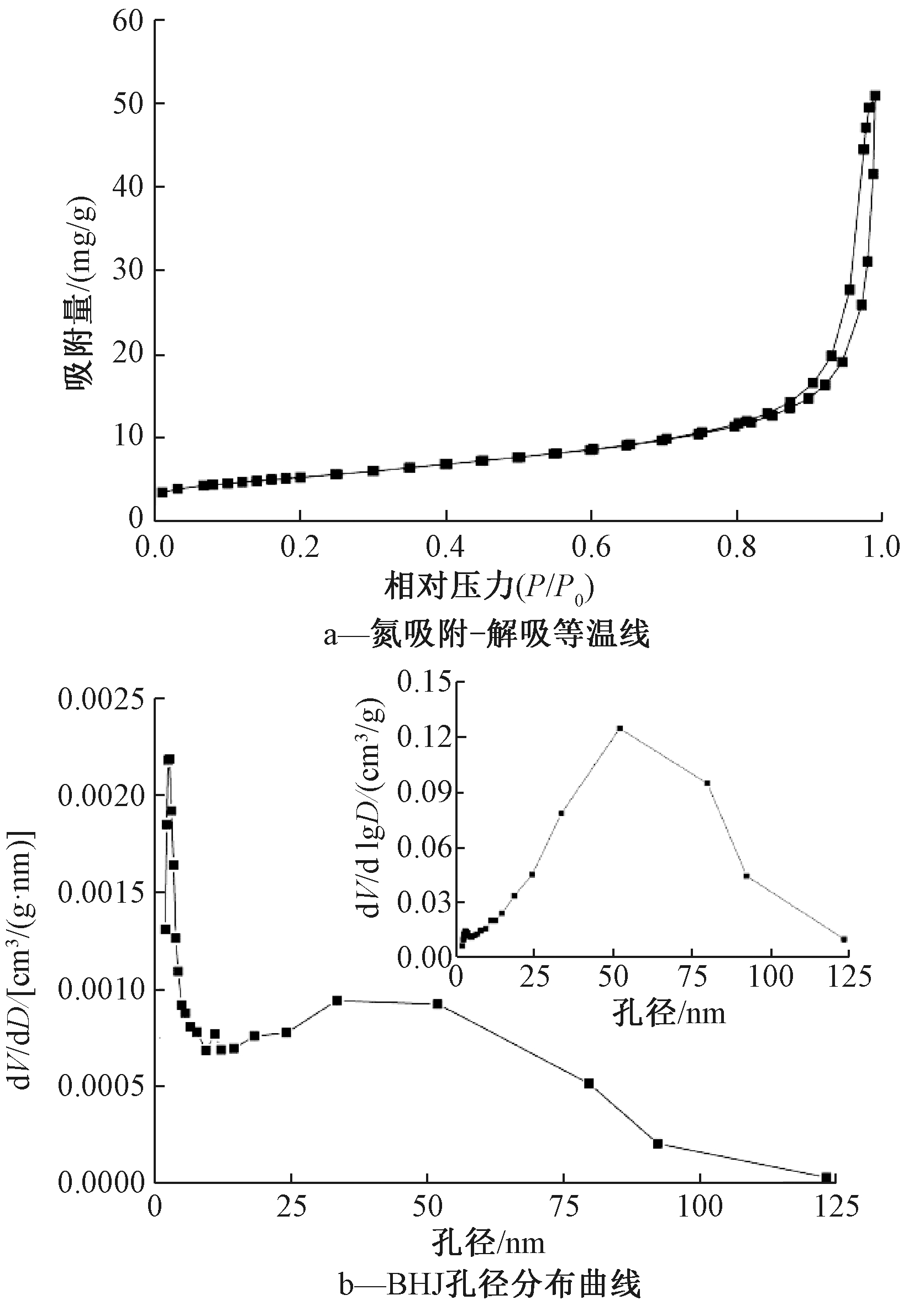
图4 加入0.2%CTMAB的La2O3纳米颗粒的氮吸附-解吸等温线及BHJ孔径分布曲线
Figure 4 Nitrogen desorption adsorption isotherm and BHJ pore size distribution curve of the La2O3 with 0.2% CTMAB added
为探究La2O3纳米颗粒的最佳投加量,实验选取4个不同的投加量(0.3,0.4,0.5,0.7 g/L)分别进行吸附实验,结果如图5所示。可知:La2O3纳米颗粒投加量从0.3 g/L增加到0.7 g/L时,As(Ⅲ)去除率从66.6%增加到94.2%,这是因为随着投加量的增加,La2O3纳米颗粒的活性位点数量增加,因此去除率增大。而La2O3的单位吸附量随着其投加量的增加逐渐减小,依次为44.4,42.7,34.1,26.9 mg/g,当投加量>0.4 g/L时, La2O3的单位吸附量降幅较大,这是因为当吸附剂过量后,产生了多余的活性位点,导致单位吸附量减小;另外,吸附剂上的表面官能团之间可能存在相互作用,同样会导致活性位点的减少,使得单位吸附量减小。因此,本研究选取0.4 g/L为La2O3纳米颗粒的最佳投加量。在实际应用中,应根据经济效益和实际情况决定La2O3纳米颗粒的最佳投加量,以达到最佳效果。
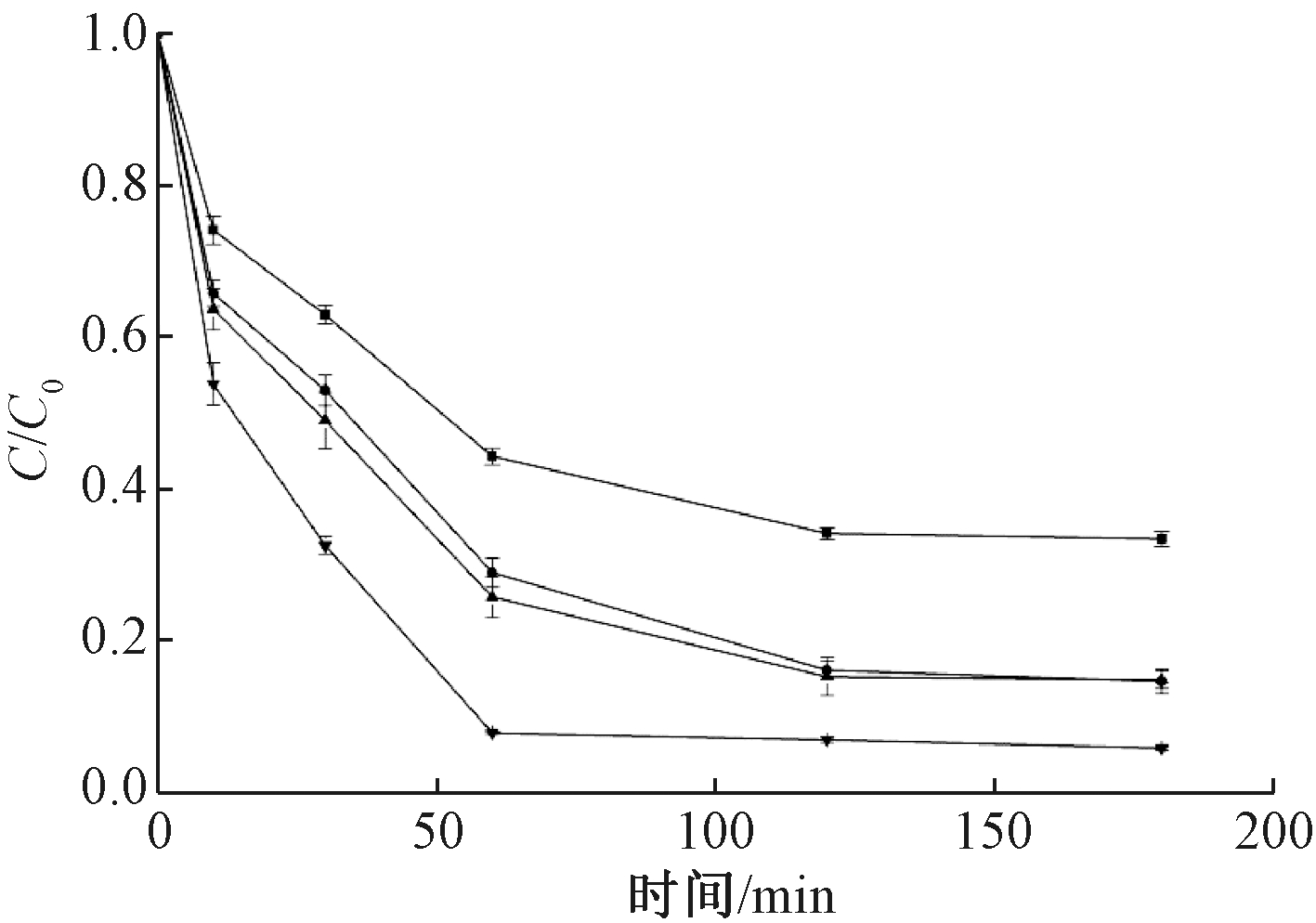
![]() —0.3 g/L;
—0.3 g/L; ![]() —0.4 g/L;
—0.4 g/L; ![]() —0.5 g/L;
—0.5 g/L; ![]() —0.7 g/L。
—0.7 g/L。
注:T=30 ℃,pH=6,ρ[As(Ⅲ)]=20 mg/L。
图5 La2O3纳米颗粒投加量对As(Ⅲ)去除率的影响
Figure 5 Effect of La2O3 nanoparticles dosage on As(Ⅲ) adsorption rate
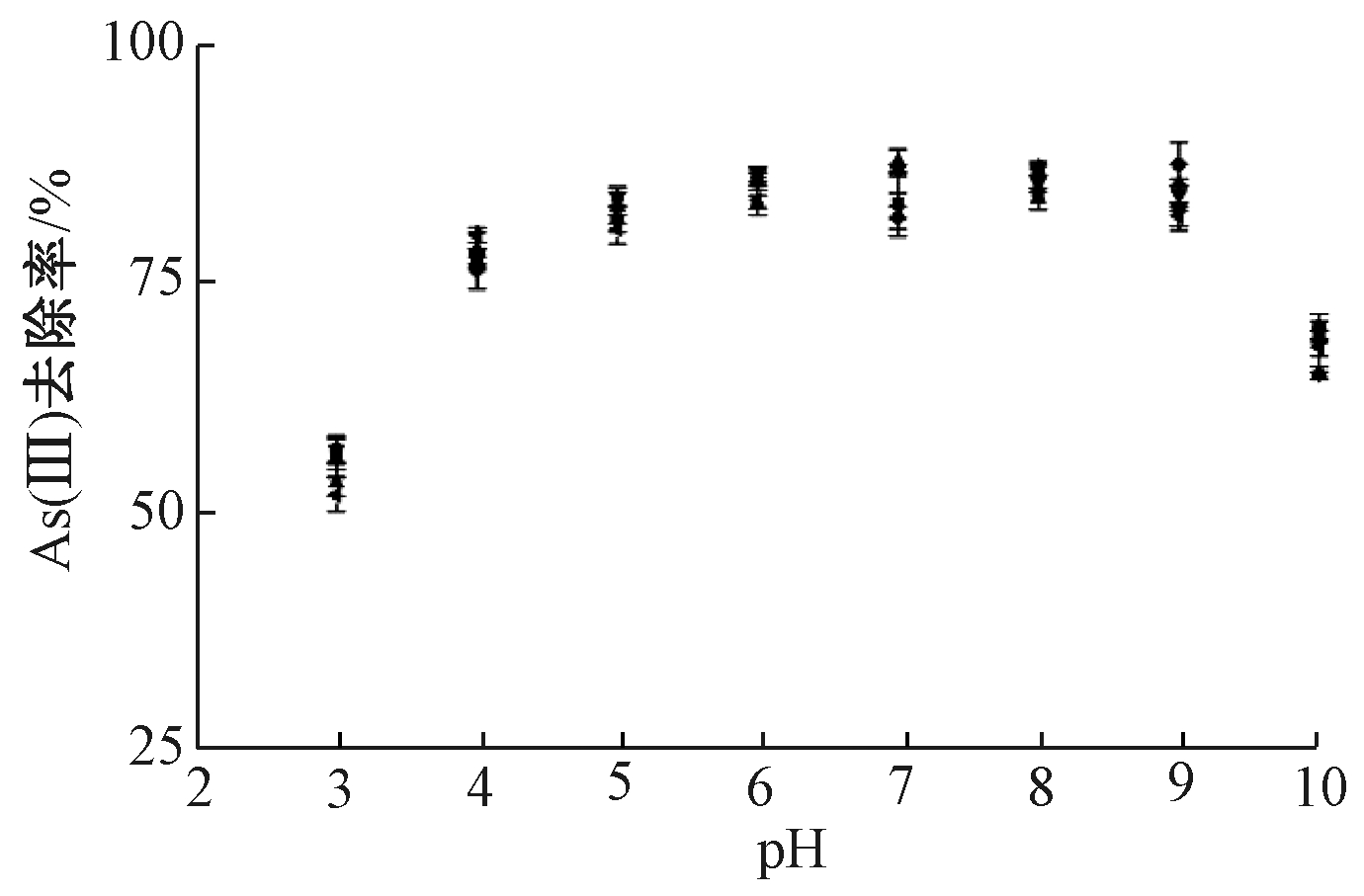
图6为不同溶液pH值条件下,La2O3纳米颗粒吸附As(Ⅲ)的情况。当pH为3时,去除率只有55.85%;当pH增大时,去除率逐渐增大,在pH为5~9时可达85.36%;而当pH从9升高至10时,As(Ⅲ)吸附又受到抑制。研究表明:当金属氧化物与弱酸盐发生吸附时,氧化物能达到的最大吸附量通常会出现在弱酸盐的解离常数pka1附近[17]。而亚砷酸盐作为1种弱酸盐,pka1为9.2[18],所以在pH=9附近,As(Ⅲ)去除率达到最大值。另外,La2O3的等电点为7~8[6],当溶液pH>7时,La2O3纳米颗粒表面会带负电,溶液中的亚砷酸盐同时也带负电,使得两者之间的库伦斥力增加,产生电荷排斥,导致As(Ⅲ)去除率降低。因此,最佳适用pH值为5~9。
![]() —0 mg/L NaNO3;
—0 mg/L NaNO3; ![]() —0.085 mg/L NaNO3;
—0.085 mg/L NaNO3; ![]() —0.85 mg/L NaNO3;
—0.85 mg/L NaNO3; ![]() —8.5 mg/L NaNO3;
—8.5 mg/L NaNO3;![]() —17 mg/L NaNO3。
—17 mg/L NaNO3。
注:T=30 ℃,pH=6,La2O3=0.4 g/L,ρ[As(Ⅲ)]=20 mg/L。
图6 pH值和离子强度对As(Ⅲ)去除率的影响
Figure 6 Effect of solution pH and ionic strength on As(Ⅲ) adsorption rate
实验采用NaNO3(0.085,0.85,8.5,17 mg/L)作为离子强度调节剂加入反应中,探究离子强度对As(Ⅲ)吸附的影响如图6所示。可知:与未加入NaNO3比,加入不同浓度NaNO3后As(Ⅲ)去除率基本保持不变,说明离子强度对La2O3纳米颗粒吸附As(Ⅲ)基本无影响。研究表明:当吸附对离子强度不敏感时,说明吸附质与吸附剂之间存在化学键(一般为配位共价键),形成内层络合物;当去除率随着离子强度的增加而减小时,说明吸附质与吸附剂之间存在非化学键作用,形成外层络合物[19]。由此可知,La2O3纳米颗粒与As(Ⅲ)通过内层吸附形成了内层络合物。
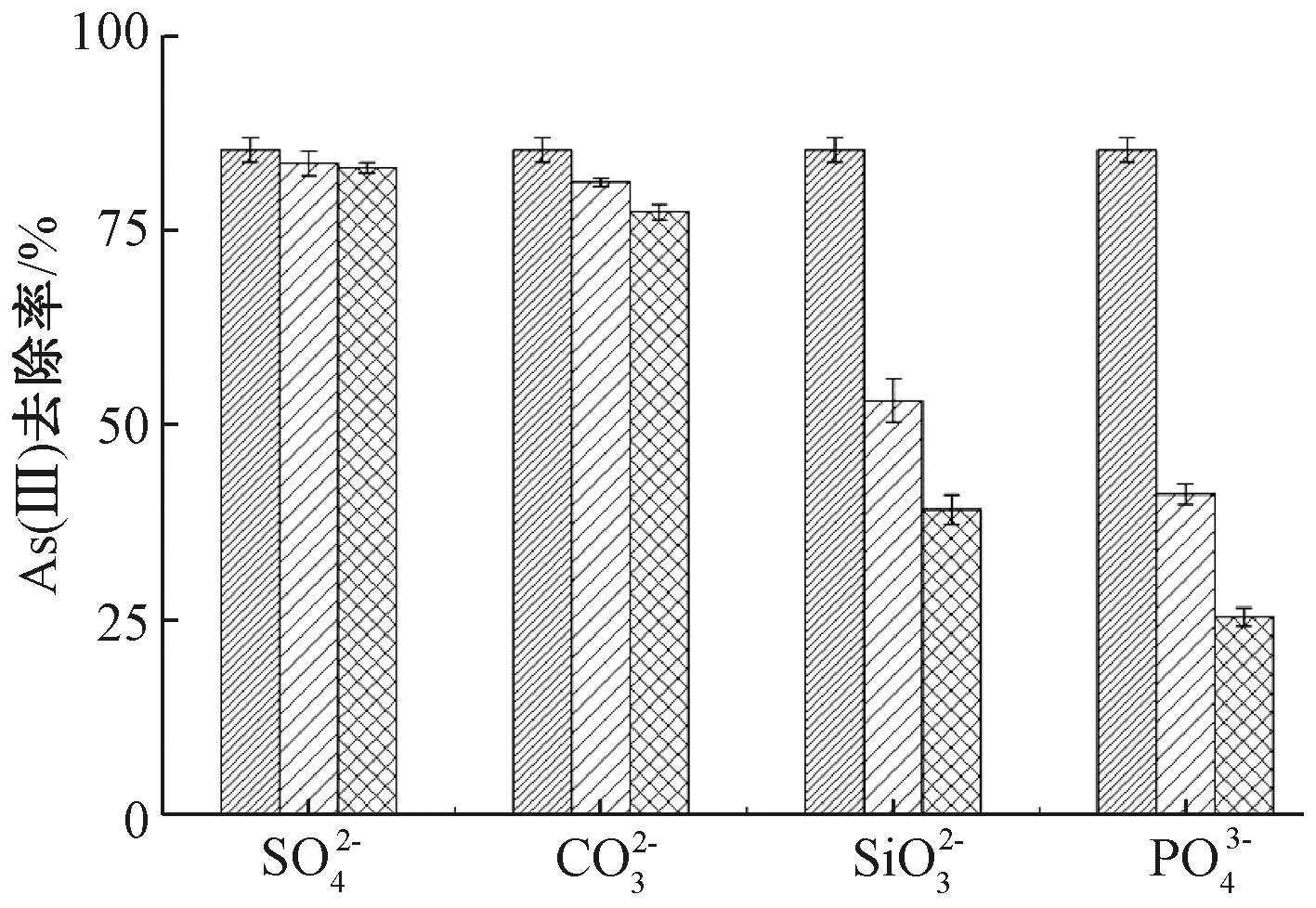
实验探究了不同浓度(0,1,10 mmol/L)的共存离子![]() 和
和![]() 对La2O3纳米颗粒吸附As(Ⅲ)的影响,如图7所示。可知:
对La2O3纳米颗粒吸附As(Ⅲ)的影响,如图7所示。可知:![]() 和
和![]() 的存在对As(Ⅲ)的吸附基本无影响。而
的存在对As(Ⅲ)的吸附基本无影响。而![]() 和
和![]() 对As(Ⅲ)吸附影响较大,当
对As(Ⅲ)吸附影响较大,当![]() 和
和![]() 的浓度分别从0增加到10 mmol/L时,As(Ⅲ)去除率分别从85.36%减少到39.14%和25.36%。这是因为在元素周期表中,磷与砷位于同一主族的相邻位置,而硅与砷则位于对角线位置[20],所以
的浓度分别从0增加到10 mmol/L时,As(Ⅲ)去除率分别从85.36%减少到39.14%和25.36%。这是因为在元素周期表中,磷与砷位于同一主族的相邻位置,而硅与砷则位于对角线位置[20],所以![]() 和
和![]() 的性质与亚砷酸根的分子结构、化学性质都十分相似,它们均会与As(Ⅲ)竞争La2O3纳米颗粒表面上有限的吸附活性位点,导致其对As(Ⅲ)去除率下降。因此,在实际含砷废水中若
的性质与亚砷酸根的分子结构、化学性质都十分相似,它们均会与As(Ⅲ)竞争La2O3纳米颗粒表面上有限的吸附活性位点,导致其对As(Ⅲ)去除率下降。因此,在实际含砷废水中若![]() 和
和![]() 含量较高,可对废水进行前处理,增设化学沉淀池用于
含量较高,可对废水进行前处理,增设化学沉淀池用于![]() 和
和![]() 的共去除。传统钙盐(如CaCl2等)可将可溶性
的共去除。传统钙盐(如CaCl2等)可将可溶性![]() 和
和![]() 转化为不溶性沉淀物,将它们从废水中分离[21]。Kong等[22]研发出1种将废酸与FGD石膏结合的新型工艺,也可将
转化为不溶性沉淀物,将它们从废水中分离[21]。Kong等[22]研发出1种将废酸与FGD石膏结合的新型工艺,也可将![]() 和
和![]() 从水中除去,确保La2O3纳米颗粒对As(Ⅲ)的吸附效果。
从水中除去,确保La2O3纳米颗粒对As(Ⅲ)的吸附效果。
![]() 0 mmol/L;
0 mmol/L; ![]() 1 mmol/L;
1 mmol/L; ![]() 10 mmol/L。
10 mmol/L。
注:T=30 ℃,pH=6,ρ(La2O3)=0.4 g/L,ρ[As(Ⅲ)]=20 mg/L。
图7 共存阴离子对As(Ⅲ)去除率的影响
Figure 7 Effect of coexisting anions on As(Ⅲ) adsorption rate
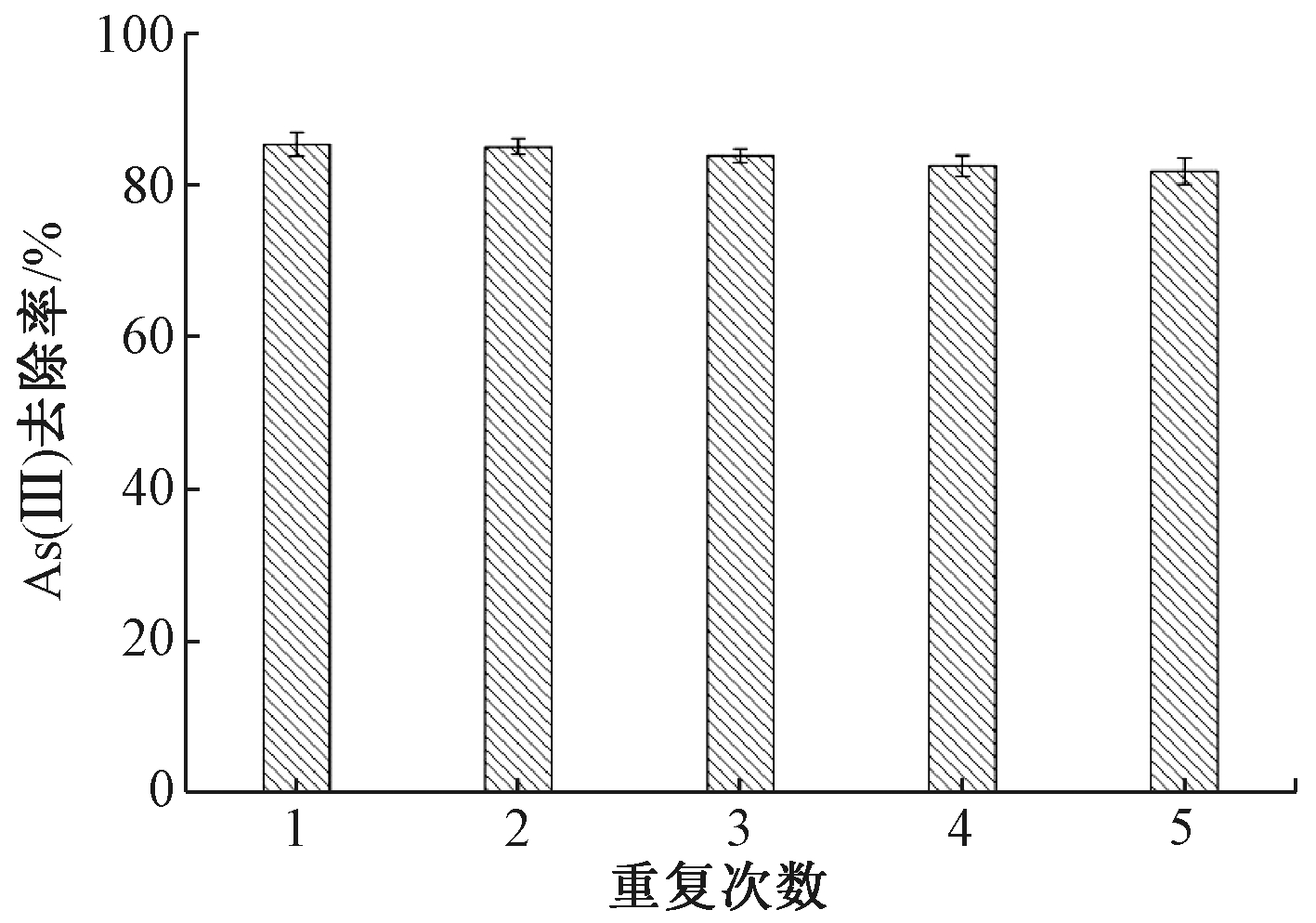
为探究La2O3纳米颗粒的再生性能,实验将4 mg/L NaOH作为洗脱剂,对La2O3材料进行吸附—解吸—再生实验,实验重复5次,结果如图8所示。可知:随着解吸重复次数的增加,La2O3纳米颗粒对As(Ⅲ)吸附依然有较高的去除率,无明显衰减,分别达到85.36%、85.02%、83.82%、82.52%、81.85%,说明La2O3纳米颗粒在重复利用5次后,仍然具有较稳定的As(Ⅲ)吸附性能。这表明La2O3纳米颗粒具有较强的机械强度和耐磨强度,La2O3纳米颗粒再生性能良好,是1种较有前景的新型纳米吸附材料。
注:T=30 ℃,pH=6,ρ(La2O3)=0.4 g/L,ρ[As(Ⅲ)]=20 mg/L。
图8 La2O3纳米颗粒重复使用时对As(Ⅲ)吸附性能影响
Figure 8 Adsorption performance of La2O3 in reuse experiments
2.7.1 吸附动力学
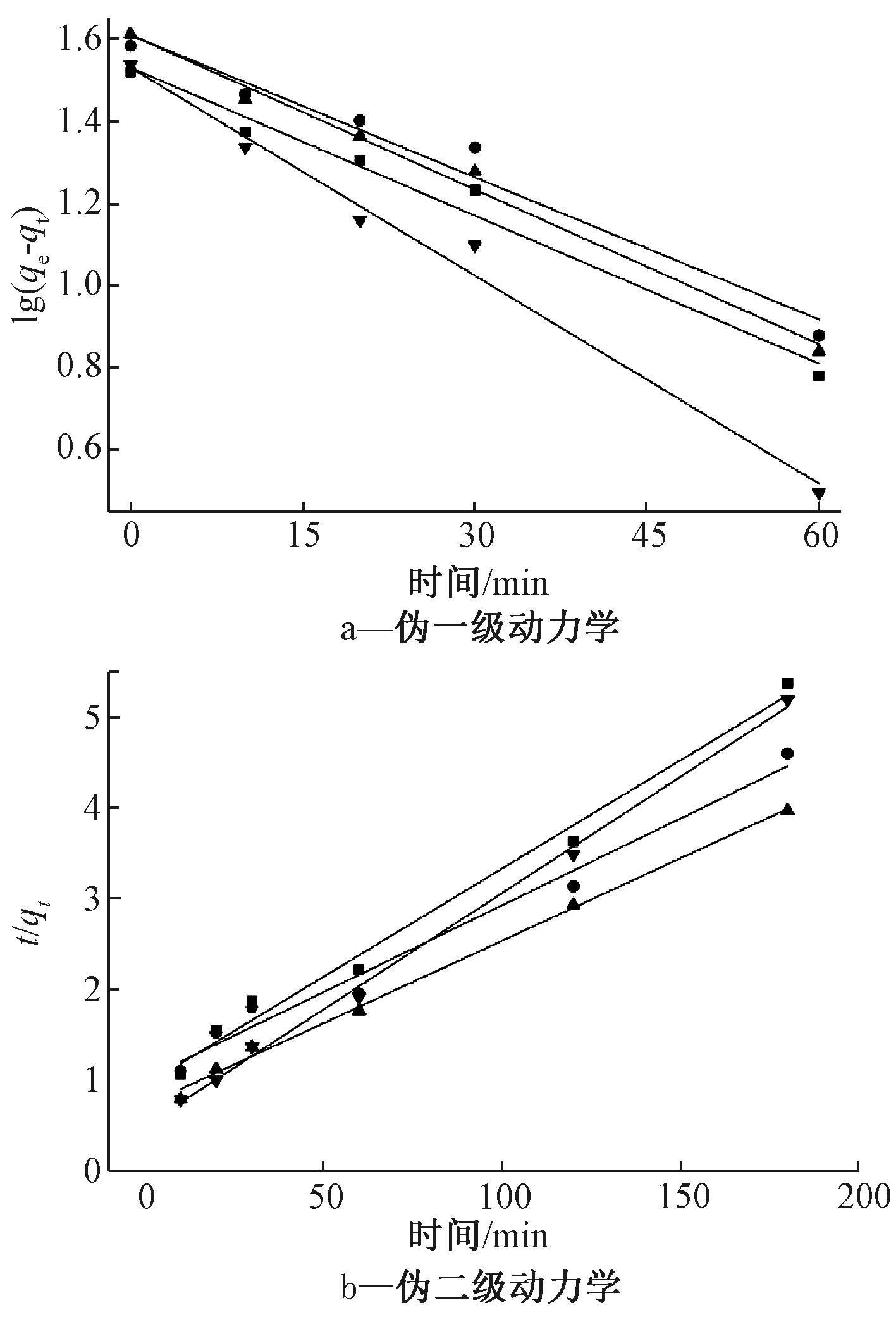
采用伪一级和伪二级动力学来描述不同投加量下La2O3纳米颗粒吸附As(Ⅲ)的过程,结果如图9a、b所示,动力学参数如表1所示。从表1中的拟合相关性系数R2可看出:与伪一级相比,伪二级的R2更高,因此,伪二级动力学能够更好地描述As(Ⅲ)在La2O3纳米颗粒表面的吸附过程。伪二级动力学以化学吸附为基础的[23],说明La2O3纳米颗粒吸附As(Ⅲ)的过程是化学吸附过程。
吸附剂投加量:![]() —0.3 g/L;
—0.3 g/L; ![]() —0.4 g/L;
—0.4 g/L; ![]() —0.5 g/L;
—0.5 g/L; ![]() —0.7 g/L。
—0.7 g/L。
注:T=30 ℃,pH=6,ρ[As(Ⅲ)]=20 mg/L。
图9 La2O3纳米颗粒吸附As(Ⅲ)动力学拟合结果
Figure 9 Pseudo-first-order and Pseudo-second-order kinetics analysis of As(Ⅲ) adsorption on La2O3 nanoparticles
表1 吸附动力学拟合参数
Table 1 Adsorption kinetics fitting parameters
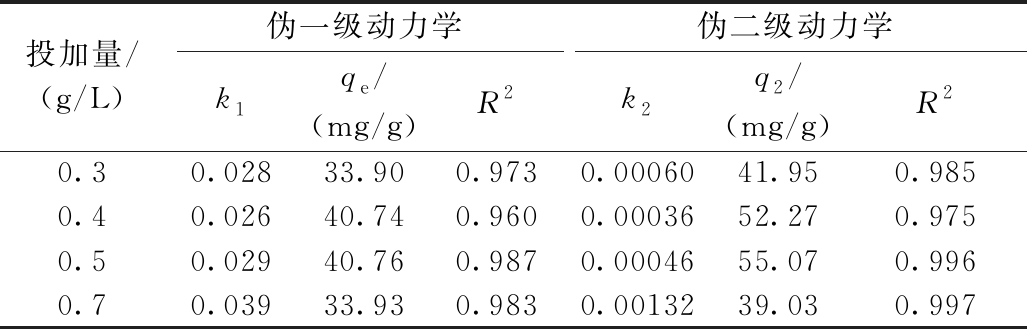
投加量/(g/L)伪一级动力学伪二级动力学k1qe/(mg/g)R2k2q2/(mg/g)R20.30.02833.900.9730.0006041.950.9850.40.02640.740.9600.0003652.270.9750.50.02940.760.9870.0004655.070.9960.70.03933.930.9830.0013239.030.997
2.7.2 吸附等温线
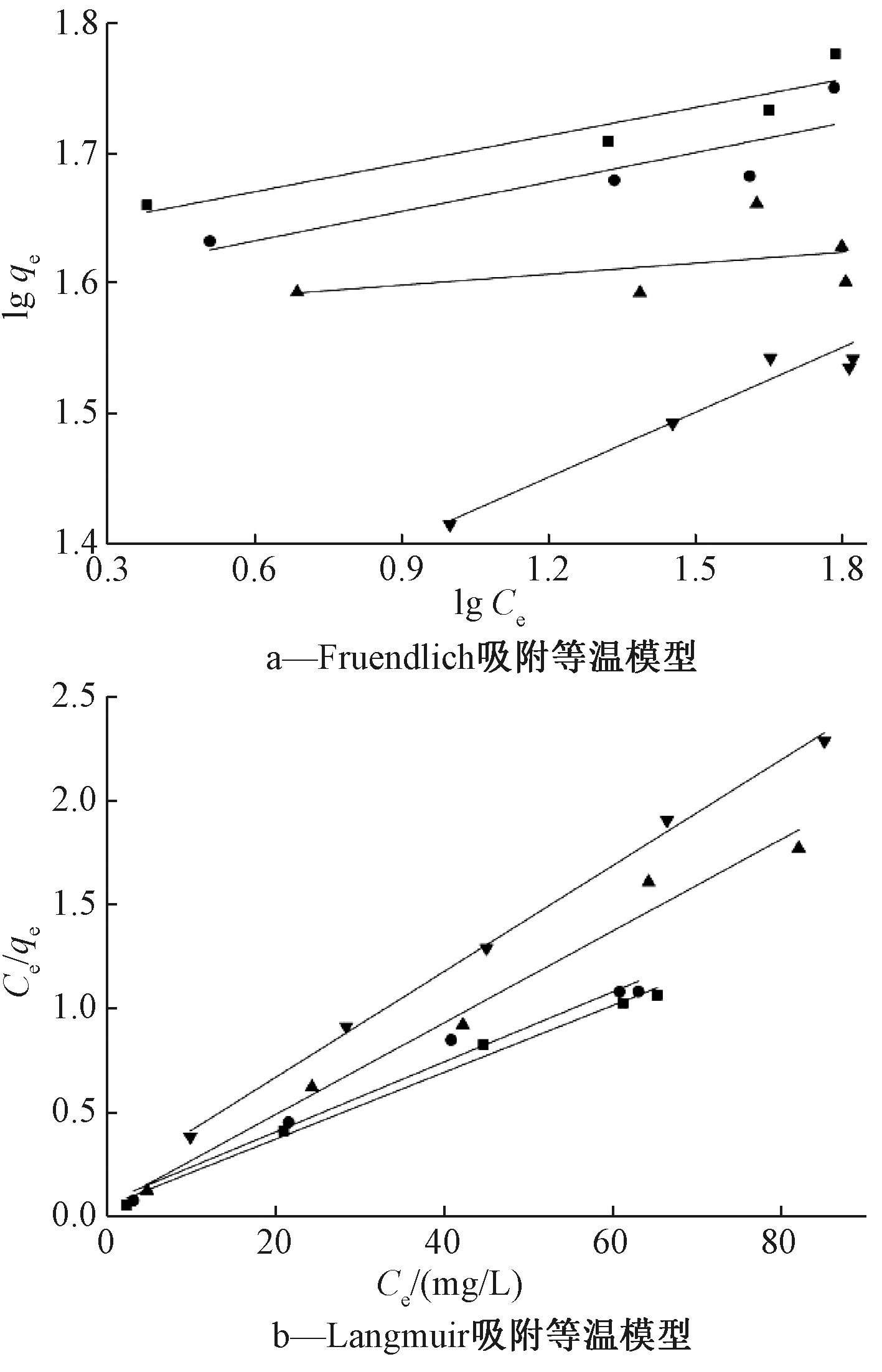
采用Fruendlich吸附模型和Langmuir吸附等温模型对La2O3纳米颗粒在不同As(Ⅲ)初始浓度(20,40,60,80,100 mg/L)和不同温度(20,30,40,50 ℃)下对As(Ⅲ)吸附进行模拟,结果如图10所示,相关参数如表2所示。从相关性系数R2可看出:Langmuir吸附等温模型比Freundlich吸附等温模型能更好地模拟La2O3纳米颗粒对As(Ⅲ)的吸附,说明该吸附过程为均匀界面上的单分子层吸附。通过Langmuir模型计算,可得到La2O3纳米颗粒在30 ℃时对As(Ⅲ)的最大单位吸附量q0为45.5 mg/g。表3为一些As(Ⅲ)吸附剂的最大吸附容量。可知:与其他As(Ⅲ)吸附剂相比,La2O3纳米颗粒具有相对较大的吸附量[2,24-26]。由此可知,La2O3纳米颗粒制备过程简单,经济成本较低,对As(Ⅲ)处理效果较好且其再生性能良好,在实际应用中可作为可循环吸附材料对弱酸、弱碱或中性废水中的重金属砷进行有效去除,是有前景的新型吸附材料。
研究表明,阴、阳离子在金属氧化物表面的吸附是通过机械络合作用产生的[27]。在金属氧化物的表面层中,金属离子具有较小的配位数,表现为路易斯酸,在干燥氧化物表面上出现路易斯酸点位,当存在水时,表面金属离子首先倾向于配位水分子,对大多数氧化物,水分子的离解性化学吸着导致金属氧化物表面羟基化,从而与吸附质之间发生化学吸附[28]。根据伪二级动力学可知,La2O3纳米颗粒对As(Ⅲ)的吸附为化学吸附,与以上结论相吻合。由此可知,La2O3纳米颗粒表面存在羟基团La—OH, 这些基团与As—OH反应,在La2O3纳米颗粒表面形成了高度羟基化的亚砷酸盐内层络合物从而被去除[29],这些内层络合物可能为单齿单核或双齿双核络合物[29],当溶液为酸性到中性时,由于有La3+浸出[6],它还会与亚砷酸根离子发生沉淀反应,生成沉淀从溶液中除去。而当溶液为碱性时,La3+浸出极少,可忽略不计,溶液中以络合作用为主。综上所述,La2O3纳米颗粒对As(Ⅲ)的吸附过程可用以下方程表示:
温度:![]() —50 ℃;
—50 ℃; ![]() —40 ℃;
—40 ℃; ![]() —30 ℃;
—30 ℃; ![]() —20 ℃。
—20 ℃。
注:pH=6,ρ(La2O3)=0.4 g/L。
图10 La2O3纳米颗粒吸附As(Ⅲ)的吸附等温模型
Figure 10 Fruendlich and Langmuir adsorption isothermal of As(Ⅲ) adsorption on La2O3 nanoparticles
表2 吸附等温模型拟合参数
Table 2 Fitting parameters of adsorption isothermal model
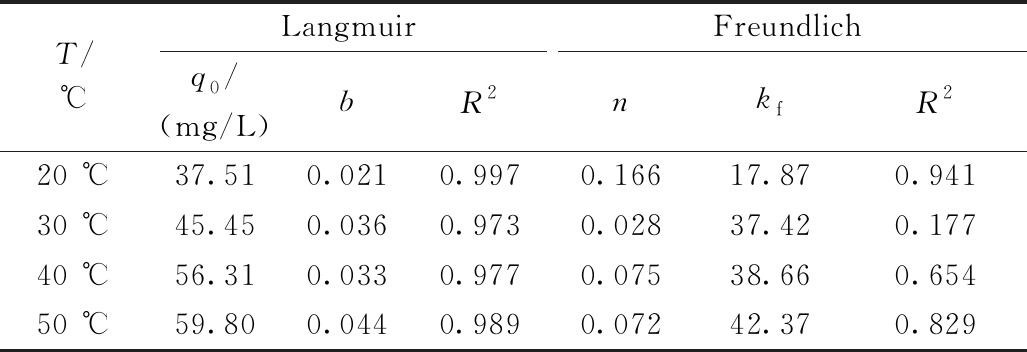
T/℃LangmuirFreundlichq0/(mg/L)bR2nkfR220 ℃37.510.0210.9970.16617.870.94130 ℃45.450.0360.9730.02837.420.17740 ℃56.310.0330.9770.07538.660.65450 ℃59.800.0440.9890.07242.370.829
表3 La2O3纳米颗粒与其他吸附剂As(Ⅲ)吸附量对比
Table 3 Comparison of As(Ⅲ) adsorption capacity between La2O3 nanoparticles and other adsorbents
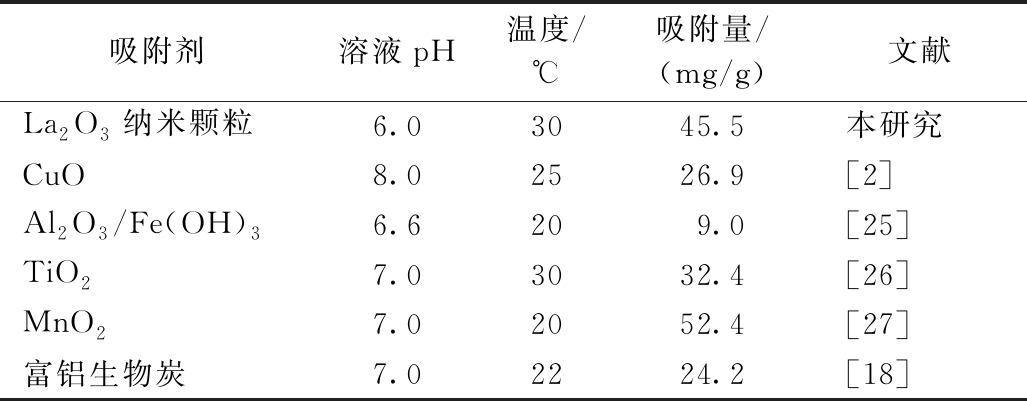
吸附剂溶液pH温度/℃吸附量/(mg/g)文献La2O3纳米颗粒6.03045.5本研究CuO8.02526.9[2]Al2O3/Fe(OH)36.6209.0[25]TiO27.03032.4[26]MnO27.02052.4[27]富铝生物炭7.02224.2[18]
羟基团La—OH和As—OH反应形成单齿单核内层络合物:
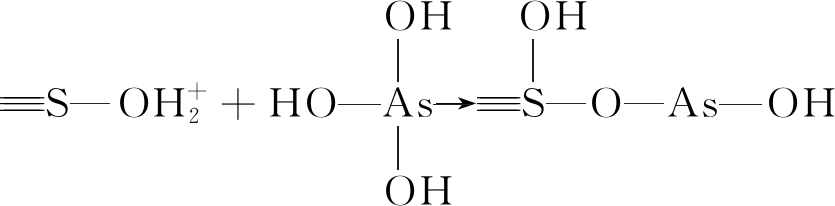
(7)
羟基团La—OH和As—OH反应形成双齿双核内层络合物:

(8)
当溶液为酸性到中性时,镧离子与亚砷酸根离子发生沉淀反应:
(9)
1)本研究所制得的纯度较高且晶型完好,粒径为50~100 nm。加入0.2%CTMAB后,As(Ⅲ)去除率最高,可达85.36%,实验La2O3纳米颗粒的最佳投加量为0.4 g/L。
2)当溶液pH在5~9时As(Ⅲ)去除率较高,达到85.36%。该吸附是通过内层吸附作用形成了内层络合物。共存阴离子![]() 和
和![]() 对吸附有较大影响,当溶液中的
对吸附有较大影响,当溶液中的![]() 和
和![]() 浓度增加到10 mmol/L时,As(Ⅲ)去除率从85.36%分别降低至39.14%和25.36%。吸附动力学和吸附等温模型表明,La2O3纳米颗粒对As(Ⅲ)的吸附过程是在均匀界面上的单分子层化学吸附,La2O3纳米颗粒吸附As(Ⅲ)的理论最大吸附量为45.5 mg/g。
浓度增加到10 mmol/L时,As(Ⅲ)去除率从85.36%分别降低至39.14%和25.36%。吸附动力学和吸附等温模型表明,La2O3纳米颗粒对As(Ⅲ)的吸附过程是在均匀界面上的单分子层化学吸附,La2O3纳米颗粒吸附As(Ⅲ)的理论最大吸附量为45.5 mg/g。
3)La2O3纳米颗粒对As(Ⅲ)的去除机理可能为:La2O3纳米颗粒表面羟基化后形成的羟基基团La—OH与As(Ⅲ)反应,形成了单齿单核或双齿双核络合物,当溶液pH为3~7时,镧离子还会与亚砷酸根离子生成沉淀,将As(Ⅲ)从溶液中去除。
[1] HUO J B, XU L, YANG J E, et al. Magnetic responsive Fe3O4-ZIF-8 core-shell composites for efficient removal of As(Ⅲ) from water[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2018,539: 59-68.
[2] MARTINSON C A, REDDY K J. Adsorption of arsenic(Ⅲ) and arsenic(Ⅴ) by cupric oxide nanoparticles[J]. Journal of Colloid and Interface Science, 2009,336(2):406-411.
[3] RASHEED H, KAY P, SLACK R, et al. Human exposure assessment of different arsenic species in household water sources in a high risk arsenic area[J]. Science of the Total Environment, 2017,584/585: 631-641.
[4] SUNYER A, VINALS J. Arsenate substitution in natroalunite: a potential medium for arsenic immobilization. Part 1: synthesis and compositions[J]. Hydrometallurgy, 2011,109(1/2):54-64.
[5] GENZ A, KORNMULLER A, JEKEL M. Advanced phosphorus removal from membrane filtrates by adsorption on activated aluminium oxide and granulated ferric hydroxide[J]. Water Research, 2004,38(16):3523-3530.
[6] ZHANG W, FU J, ZHANG G S, et al. Enhanced arsenate removal by novel Fe-La composite (hydr)oxides synthesized via coprecipitation[J]. Chemical Engineering Journal, 2014,251:69-79.
[7] SENTHILKUMAAR S, KALAAMANI P, PORKODI K, et al. Adsorption of dissolved Reactive red dye from aqueous phase onto activated carbon prepared from agricultural waste[J]. Bioresource Technology, 2006,97(14):1618-1625.
[8] 陆岩, 刘艳磊, 姜恒, 等. 氧化镧对磷酸根的吸附及其机理研究[J]. 化工科技,2014,22(1): 45-48.
[9] FANG L P, WU B L, CHAN J K M, et al. Lanthanum oxide nanorods for enhanced phosphate removal from sewage: a response surface methodology study[J]. Chemosphere, 2018, 192: 209-216.
[10] YAO Y, GAO B, INYANG M, et al. Removal of phosphate from aqueous solution by biochar derived from anaerobically digested sugar beet tailings[J]. Journal of Hazardous Materials, 2011,190(1/2/3):501-507.
[11] 安风霞, 冯欢, 刘景亮, 等. 氧化锆-磁性壳聚糖对F-的吸附性能研究[J]. 环境工程, 2018,36(2):60-65.
[12] BAIG Z, MAMAT O, MUSTAPHA M, et al. Surfactant-decorated graphite nanoplatelets (GNPs) reinforced aluminum nanocomposites: sintering effects on hardness and wear[J]. International Journal of Minerals Metallurgy and Materials, 2018,25(6):704-715.
[13] 韩陈. 纳米氧化镧和纳米氧化钼的制备及应用[D]. 上海:华东师范大学, 2009: 69.
[14] Pounder Diffract File, JCPDS Internat[S]. USA: Centre Diffract. Data, PA, 2001:19073-3273.
[15] 李虹, 吕小凡, 马溢阳, 等. 超声协同Fe0@Fe3O4降解四氯化碳[J].环境科学学报, 2018,38(7):2650-2658.
[16] DUWTE F, MALDONADO-H DAR F J, PÉREZ-CADENAS A F, et al. Fenton-like degradation of azo-dye Orange Ⅱ catalyzed by transition metals on carbon aerogels[J]. Applied Catalysis B: Environmental, 2009, 85(3/4):139-147.
DAR F J, PÉREZ-CADENAS A F, et al. Fenton-like degradation of azo-dye Orange Ⅱ catalyzed by transition metals on carbon aerogels[J]. Applied Catalysis B: Environmental, 2009, 85(3/4):139-147.
[17] ZHANG L F, ZHU T Y, LIU X, et al. Simultaneous oxidation and adsorption of As(Ⅲ) from water by cerium modified chitosan ultrafine nanobiosorbent[J]. Journal of Hazardous Materials, 2016,308:1-10.
[18] DING Z H, XU X B, PHAN T, et al. High adsorption performance for As(Ⅲ) and As(Ⅴ) onto novel aluminum-enriched biochar derived from abandoned Tetra Paks[J]. Chemosphere, 2018,208:800-807.
[19] LI R H, LI Q, GAO S A, et al. Exceptional arsenic adsorption performance of hydrous cerium oxide nanoparticles: Part A. Adsorption capacity and mechanism[J]. Chemical Engineering Journal, 2012,185/1/6:127-135.
[20] CHEN J, WANG J Y, ZHANG G S, et al. Facile fabrication of nanostructured cerium-manganese binary oxide for enhanced arsenite removal from water[J]. Chemical Engineering Journal, 2018, 334: 1518-1526
[21] KANG J H, SUN W, HU Y H, et al. The utilization of waste by-products for removing silicate from mineral processing wastewater via chemical precipitation[J]. Water Research, 2017,125:318-324.
[22] KANG J H, HU Y H, SUN W, et al. Utilisation of FGD gypsum for silicate removal from scheelite flotation wastewater[J]. Chemical Engineering Journal,2018, 341:272-279.
[23] LI H, RU J Y, YIN W, et al. Removal of phosphate from polluted water by lanthanum doped vesuvianite[J]. Journal of Hazardous Materials, 2009,168(1):326-330.
[24] HLAVAY J, POLYAK K. Determination of surface properties of iron hydroxide-coated alumina adsorbent prepared for removal of arsenic from drinking water[J]. Journal of Colloid and Interface Science, 2005,284(1):71-77.
[25] BANG S, PATEL M, LIPPINCOTT L, et al. Removal of arsenic from groundwater by granular titanium dioxide adsorbent[J]. Chemosphere, 2005,60(3):389-397.
[26] LENOBLE W, LACLAUTRE C, SERPAUD B, et al. As(Ⅴ) retention and As(Ⅲ) simultaneous oxidation and removal on a MnO2-loaded polystyrene resin[J]. Science of the Total Environment, 2004,326(1/2/3):197-207.
[27] YU Y, WANG C H, GUO X, et al. Modification of carbon derived from Sargassum sp. by lanthanum for enhanced adsorption of fluoride[J]. Journal of Colloid and Interface Science, 2015,441: 113-120.
[28] 邓春玲. 稀土吸附剂废水深度脱磷[D]. 昆明:昆明理工大学,2002: 119.
[29] MEMON S Q, MEMON N, SOLANGI A R, et al. Sawdust: a green and economical sorbent for thallium removal[J]. Chemical Engineering Journal, 2008,140(1/2/3): 235-240.