0 引 言
我国塑料制品的总产量已突破4×108 t/a,居世界第2位。塑料的使用周期通常比较短,40%的塑料在使用1~2年后便被丢弃[1],当前我国人均塑料消费量达到46 kg,略高于世界40 kg的平均水平[2]。采用填埋法处理塑料会占用大面积土地;焚烧法测难以避免产生二噁英等有害物[1]。此外,我国稻壳年产量超过5.6×108 t,直接使用燃烧法的热利用率较低,仅为50%~60%[3]。热解法可有效地对固体废物进行减量化和无害化,以抑制二噁英的产生,其产物还可以作为化学品或燃料加以回收利用,是有前景的一种固废处理技术[4]。其中,孙翔等[5]还发现热解相对于生物处理方式在经济规模上存在一定优势。
鉴于热解处理法的特点,塑料作为理想的共反应物,通常在生物质的催化热解中加入[6-9]。通过改变混合比例可以降低共热解时的活化能,增加产物热解油的产率[10-14]。样品带来的热滞后现象还会导致最大失重速率的后移,因此升温速率也是较为重要的一个因素[15-17]。有研究人员在共热解研究中未采用动力学方法进行分析[18-20],其研究结果可能与实际情况存在偏差[21]。
对于稻壳与PVC的共热解,本文将从混合比例与升温速率2个方面探究两者共热解的特性。为提高结果的可信度,分别利用Coats-Redfern、Ozawa、Friedman 3种方法分别对稻壳与PVC共热解过程进行动力学分析,计算不同升温速率以及转化率下的活化能,将每种方法结果对比,以揭示稻壳和PVC的共热解的动力学特征。
1 共热解实验与数据分析方法
1.1 实验样品
将稻壳置于105 ℃的干燥箱干燥 8 h,粉碎并利用分样筛筛分至60~100 目。PVC来源于中联塑化公司,去离子水浸泡15 min,然后脱水干燥待用。对样品进行的工业分析结果如表1所示。
表1 稻壳与PVC的工业分析
Table 1 Proximate analysis of rice husk and PVC %

样品MadAadFCadVad稻壳9.109.3913.2768.24PVC——88.2411.76
1.2 实验条件
热重实验采用日本岛津公司DTG-60(H)开展,称取样品(10+0.5) mg置于热重仪坩埚中。实验开始前,先通15 min N2置换出热重仪反应中的空气。热解过程中设置N2流量为100 mL/min,以设定的升温速度从常温升至800 ℃后实验结束。
1.3 3种动力学分析方法
1.3.1 Coats-Redfern法
多相反应的动力学方程式为:
(1)
(2)
式中:α为物质转化率;k为速率常数;f(α)为反应机理函数;t为时间;W0为起始质量;Wt为t时的质量;Wf为最终质量。对式(1)积分得
(3)
式中:G(α)为机理函数的积分形式;β=dT/dt,为升温速率;A为指前因子;E为活化能;R为摩尔气体常数,8.31 J/(mol·K)。
最后用 Coats-Redfern法积分得:
(4)
若升温速率β一定,以ln[g(α)/T2]对1/T作图,即可求出反应表观活化能E和指前因子A。常用的固体反应动力学机理函数如表2所示。
表2 常用的固体反应动力学机理函数[22]
Table 2 Common kinetic mechanism functions of solid reactions

反应机理函数反应机理g(α)D1一维扩散α2D2二维扩散α+(1-α)ln(1-α)D3三维扩散(Jander方程)[1-(1-α)1/3]2D4三维扩散(G-B方程)1-2α/3-(1-α)2/3C1一级化学反应-ln(1-α)C2二级化学反应(1-α)-1 -1A2随机成核和随后生长(n=1/2)[-ln(1-α)]1/2A3随机成核和随后生长(n=1/3)[-ln(1-α)]1/3R2相边界反应(n=1/2)1-(1-α)1/2R3相边界反应(n=1/3)1-(1-α)1/3P1Mampel Power法则(n=1)αP2Mampel Power法则(n=1/2)α1/2P3Mampel Power法则(n=1/3)α1/3P4Mampel Power法则(n=1/4)α1/4
1.3.2 Ozawa法
相较Coats-Redfern法,Ozawa法不涉及反应机理选择,可以在反应机理未知的情况下计算活化能,避免了因为反应机理选择不当带来的误差。但此法需要3个以上的β值[23],其对温度积分的近似,会令结果产生一定的误差。将k=Aexp(-E/RT)代入式(1),则:
(5)
对于一般的简单反应f(α)=(1-α)n,将β=dT/dt代入式(5)中,得:
(6)
对式(6)积分变换得Ozawa公式:
(7)
当α一定时,F(α)为定值,可在不同升温速率下,选择相同转化率α的实验数据取平均值,lg β对1/T作图,由直线斜率可确定α时的活化能。
1.3.3 Friedman法
Friedman法为等转化率微分法,将式(6)取对数,可得弗里德曼方程,可用于计算动力学参数而不需要数学模型,详见式(8):
(8)
通过绘制ln(dα/dt)-1/T曲线,可使用斜率计算动力学参数A和E[17],分析过程中主要观察质量变化速率而不是温度[24]。
2 热解结果与讨论
2.1 稻壳和PVC的单独及混合热解特性
样品失重率定义为:
式中:M0、Mt分别为热解初始时刻与t时刻的样品质量分数。
选取稻壳和PVC质量比为1∶1(下文称“混合比”),升温速率为20 ℃/min时的数据进行对比。如图1所示:稻壳的热解分为2个阶段:第1阶段为220~400 ℃,为稻壳中的纤维素和半纤维素分解以及木质素碳化;第2阶段即400 ℃之后,主要为少量木质素的热解,研究人员在研究稻壳热解时也发现类似的热解现象[25-26]。PVC热解第1阶段(330 ℃)存在1个峰值较小的肩峰,根据前人研究推测为苯和HCl造成的[27]。第2阶段为400~560 ℃,Nandini认为[28]发生的反应是一些结构上的重整如同分异构化、交联和芳香化等[29]。观察稻壳与PVC共热解的
DTG曲线,发现稻壳的第1个失重峰,与PVC热解的第1个失重峰重合且前者的峰面积更大,表明了稻壳起始与PVC共热解的过程中,PVC的第1阶段热解使稻壳热解温度降低且促进了热解的失重,两者共热解存在显著的相互促进作用。
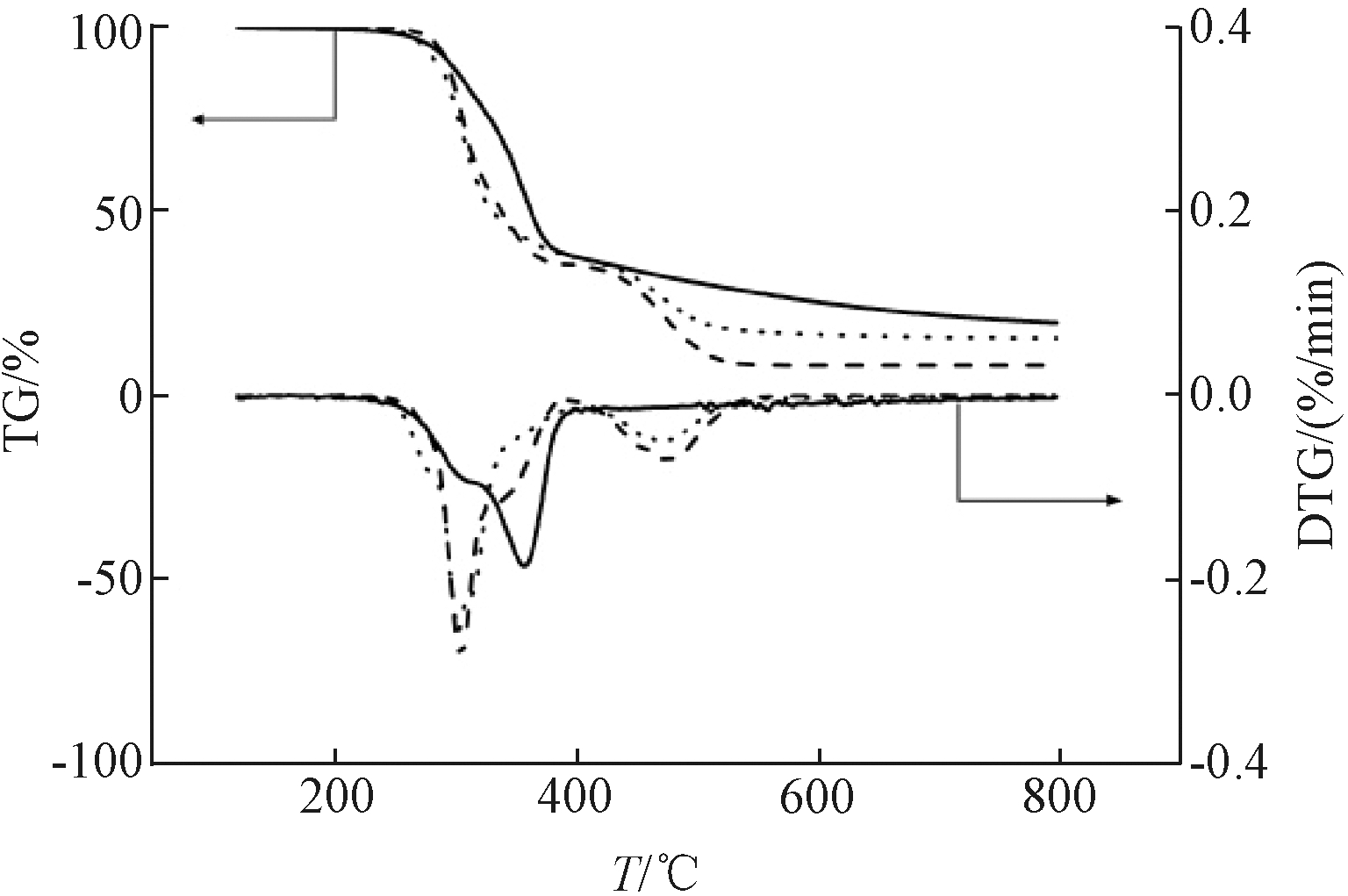
——稻壳; -----PVC; ……稻壳+PVC。
图1 稻壳和PVC及其混合物的TG/DTG曲线
Figure 1 TG/DTG curve of rice husk,PVC and their mixtures
2.2 混合比例对稻壳与PVC共热解的影响
图2为20 ℃/min升温速率下,不同稻壳与PVC混合比例的热重曲线及计算值。计算值由稻壳与PVC在同样热解条件下的单独实验值按线性比例计算所得,实验值为稻壳和PVC实际共热解曲线。对比图2的TG曲线可发现280~350 ℃温度段内,实验值的失重速率明显大于计算值,证明稻壳与PVC存在明显的促进作用。在400 ℃之前,实验值曲线只有1个DTG峰,而计算值曲线有2个DTG峰,两峰重合说明稻壳的热解温度提前。在煤与稻壳共热解的实验中也发现类似现象[10]。实验2、3中,PVC含量增大到50%及以上时,观察300 ℃的DTG曲线可看出:实验1波峰<0.3%/min,实验2与实验3波峰>0.3%/min,说明稻壳与PVC混合比为2∶1时,失重速率达到最大,该趋势与李厚洋等[19]在实验中得到的结论一致,适当增加生物质比重可以促进热解。
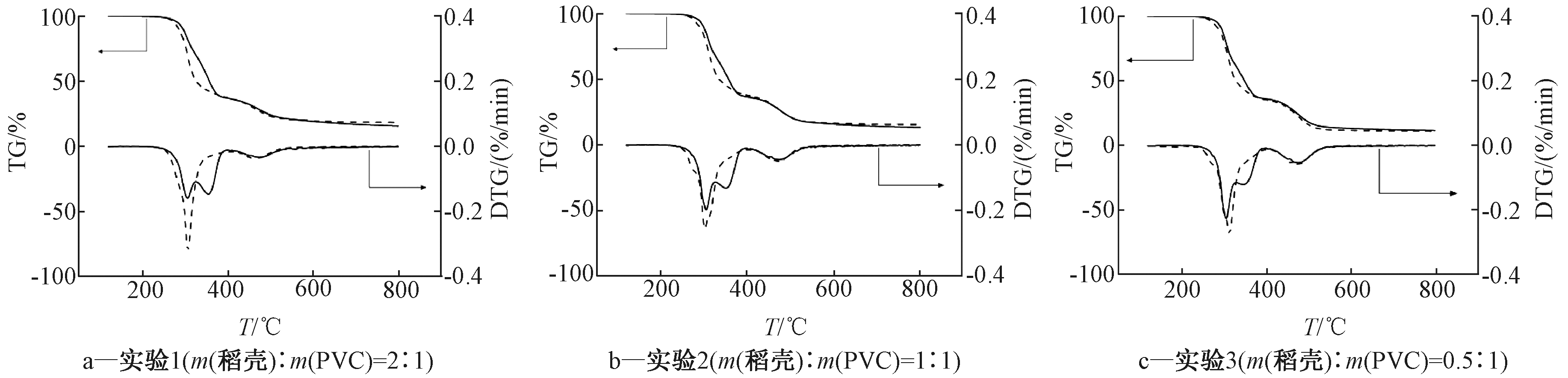
——计算值; ……实验值。
图2 稻壳与PVC以不同比例混合后共热解的TG、DTG曲线
Figure 2 The TG and DTG curves of co-pyrolysis of rice husk and PVC with different mixing ratio
2.3 升温速率对稻壳与PVC共热解的影响
图3为5,10,20,30,40 ℃/min 5种升温速率下稻壳与PVC共热解的TG和DTG的曲线。对比发现,随着升温速率的提高,失重曲线向高温侧移动,即在达到相同失重的情况下,所需的热解温度也升高。肖卓炳等[15]在麦秆热解的研究中发现了相同的趋势。此外,升温速率受到外界因素如仪器内壁、内部试样间导热等的影响,导致热滞后现象加重,曲线向高温侧发生移动使峰面积增大[27]。
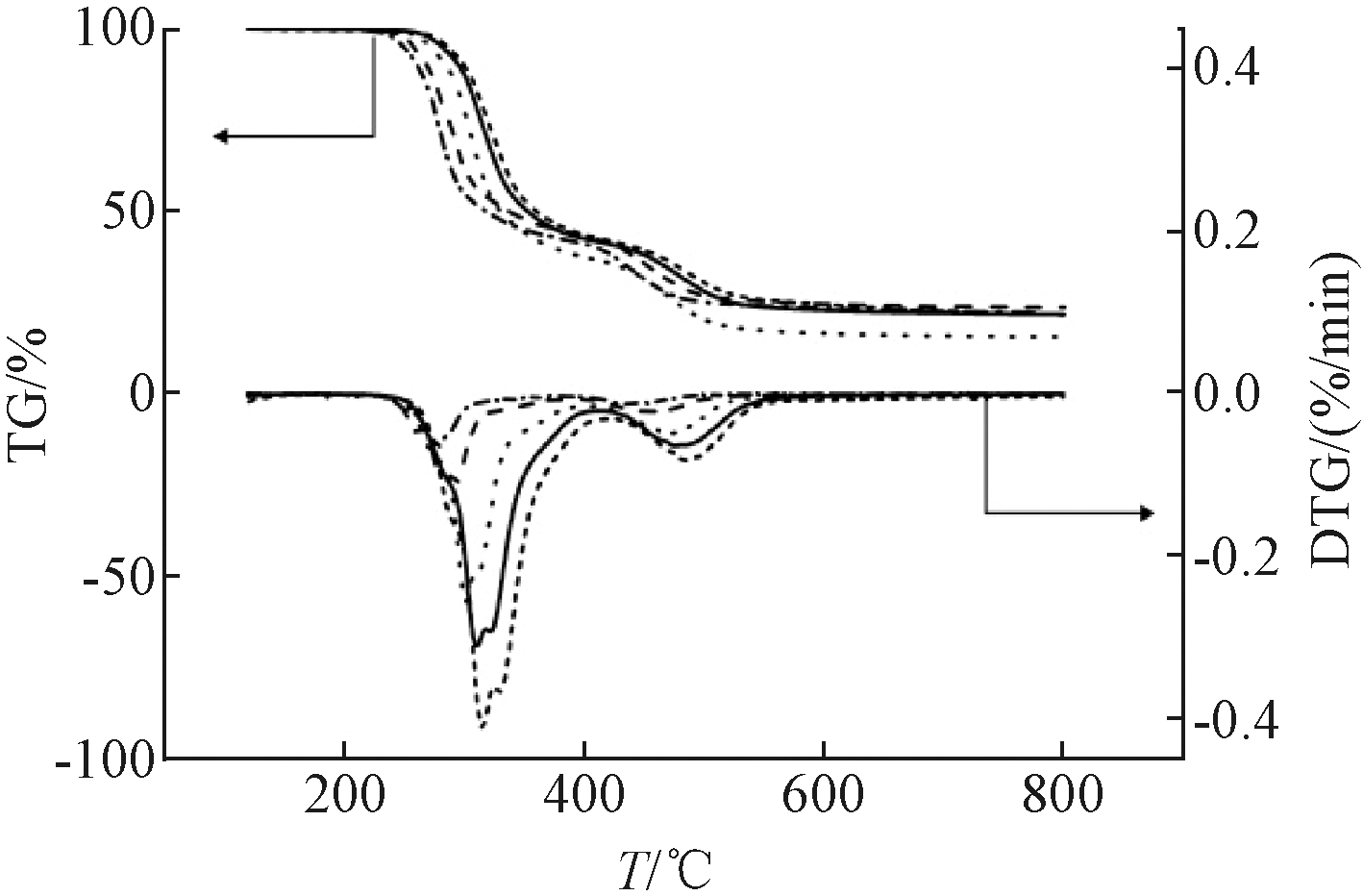
—·—5 ℃/min; ----10 ℃/min; ……20 ℃/min;——30 ℃/min; ┅┅40 ℃/min。
图3 不同升温速率下稻壳与PVC共热解的曲线比较
Figure 3 TG and DTG curves of co-pyrolysis of rice husk and PVC under different heating rate
2.4 共热解反应动力学分析
2.4.1 Coats-Redfern法
1)稻壳与PVC共热解的反应动力学机理函数的探究。
代入不同反应机理函数后求取相关性值,如表3所示,得到3个热解温度阶段的拟合曲线,将3个阶段的相关性值求取平均。对比发现,C1函数的整体线性拟合的相关性系数最高,R平均值为0.9934。其中第1和第2热解阶段偏向于一级化学反应动力学控制。第3热解阶段D2函数拟合度最好,反应过程倾向于二维扩散控制。
表3 稻壳与PVC共热解在14种机理函数下的相关性系数
Table 3 Correlation coefficiencies of co-pyrolysis of rice husk and PVC by 14 mechanism functions
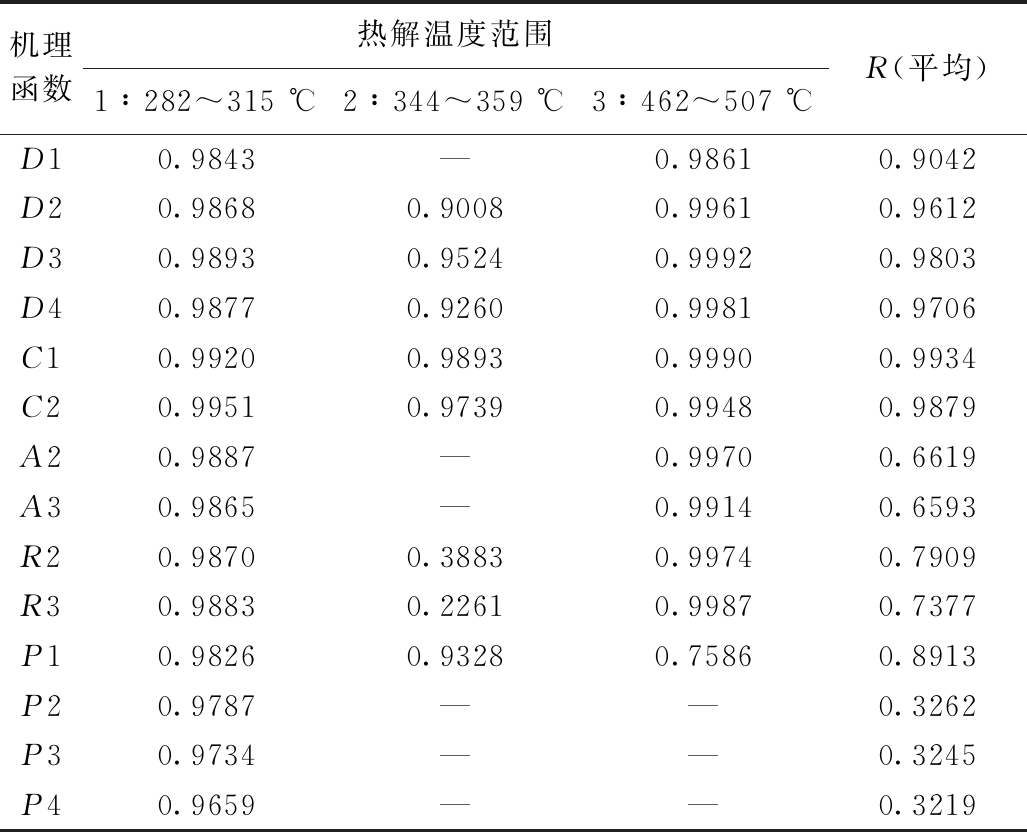
机理函数热解温度范围1∶282~315 ℃2∶344~359 ℃3∶462~507 ℃R(平均)D10.9843—0.98610.9042D20.98680.90080.99610.9612D30.98930.95240.99920.9803D40.98770.92600.99810.9706C10.99200.98930.99900.9934C20.99510.97390.99480.9879A20.9887—0.99700.6619A30.9865—0.99140.6593R20.98700.38830.99740.7909R30.98830.22610.99870.7377P10.98260.93280.75860.8913P20.9787——0.3262P30.9734——0.3245P40.9659——0.3219
注: — 表示计算出的活化能为负值,属异常。
2)稻壳与PVC单独热解和共热解的活化能变化的研究。
对比表4中的单组分热解和共热解的活化能发现:第1阶段温度范围内共热解的活化能低于PVC单独热解的活化能,对于稻壳则相反。综合来看,第1阶段中共热解活化能比PVC单独热解时明显降低,反应活性增强,反应变得更容易进行,在该反应阶段下稻壳对PVC热解存在促进作用。共热解第2阶段中PVC的活化能相对于PVC和稻壳单独热解时的活化能都减小了,说明稻壳和PVC的共热解存在一定的协同热解作用。严东等[10]通过计算稻壳与煤共热解现象也有类似发现。
表4 稻壳和PVC单独和共热解时的活化能
Table 4 Activation energy of mono-pyrolysis and co-pyrolysis of rice husk and PVC
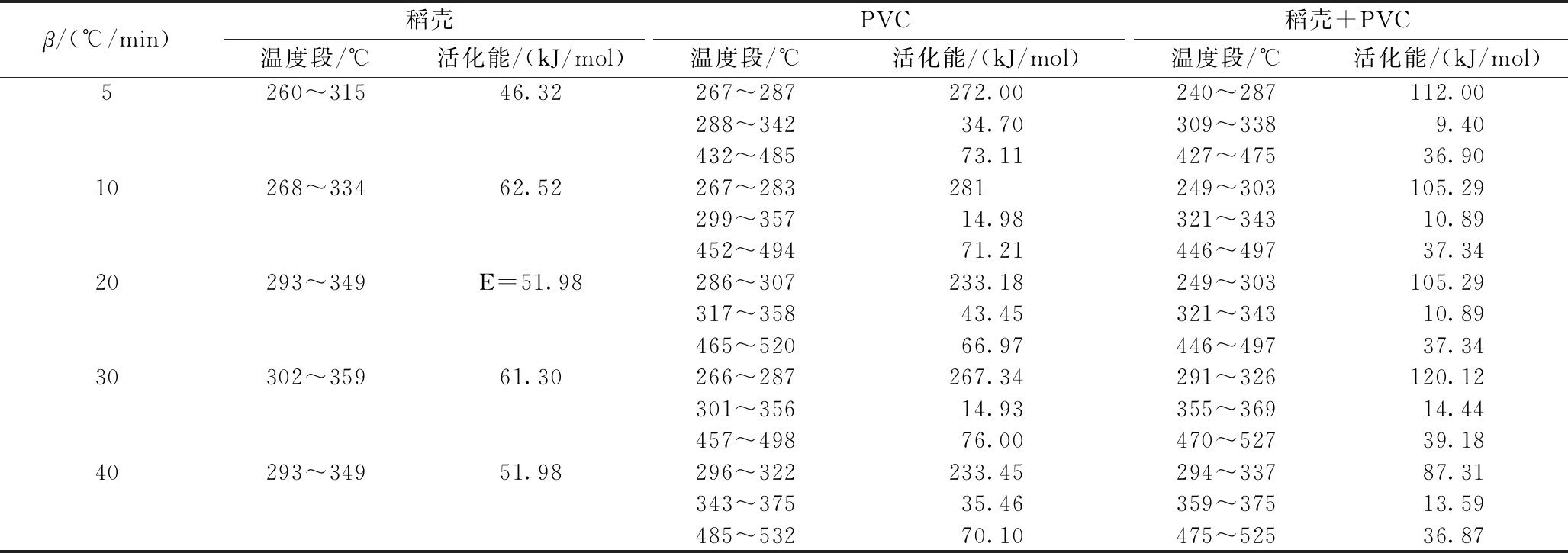
β/(℃/min)稻壳PVC稻壳+PVC温度段/℃活化能/(kJ/mol)温度段/℃活化能/(kJ/mol)温度段/℃活化能/(kJ/mol)5 260~31546.32267~287272.00240~287112.00288~34234.70309~3389.40432~48573.11427~47536.9010268~33462.52267~283281249~303105.29299~35714.98321~34310.89452~49471.21446~49737.3420293~349E=51.98286~307233.18249~303105.29317~35843.45321~34310.89465~52066.97446~49737.3430302~35961.30266~287267.34291~326120.12301~35614.93355~36914.44457~49876.00470~52739.1840293~34951.98296~322233.45294~33787.31343~37535.46359~37513.59485~53270.10475~52536.87
3)升温速率对稻壳与PVC共热解动力学参数的影响。
表5为不同升温速率下稻壳与PVC混合热解的数据代入机理函数C1求得的活化能E和指前因子A。结果表明:在升温速率<30 ℃/min时,稻壳与PVC共热解的3个阶段活化能和指前因子随着升温速率的增加而增大;升温速率为40 ℃/min时,稻壳与PVC共热解3个阶段的活化能和指前因子最小,稻壳与PVC共热解在这一条件下需要的平均能量最低,反应更容易进行,表明适当增加升温速率可以有效促进共热解反应进行。孙云娟等[17]研究煤与生物质共热解时发现了相同趋势,但是不明显,推测是热滞后现象所造成。
表5 由Coats-Redfern方法计算得到的不同升温速率下的稻壳与PVC共热解动力学参数
Table 5 Kinetic parameters of co-pyrolysis of rice husk and PVC under different heating rates by Coats-Redfern method
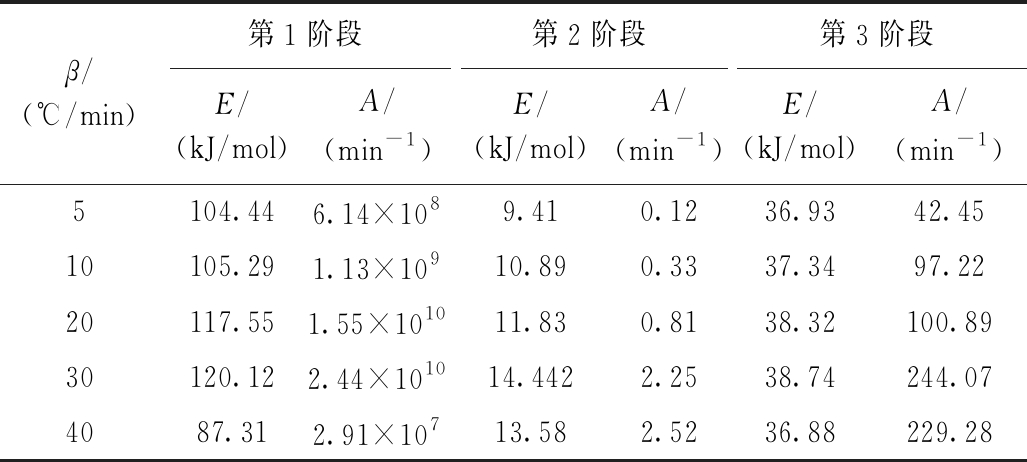
β/(℃/min)第1阶段第2阶段第3阶段E/(kJ/mol)A/(min-1)E/(kJ/mol)A/(min-1)E/(kJ/mol)A/(min-1)5104.446.14×1089.410.1236.9342.4510105.291.13×10910.890.3337.3497.2220117.551.55×101011.830.8138.32100.8930120.122.44×101014.4422.2538.74244.074087.312.91×10713.582.5236.88229.28
2.4.2 Ozawa法
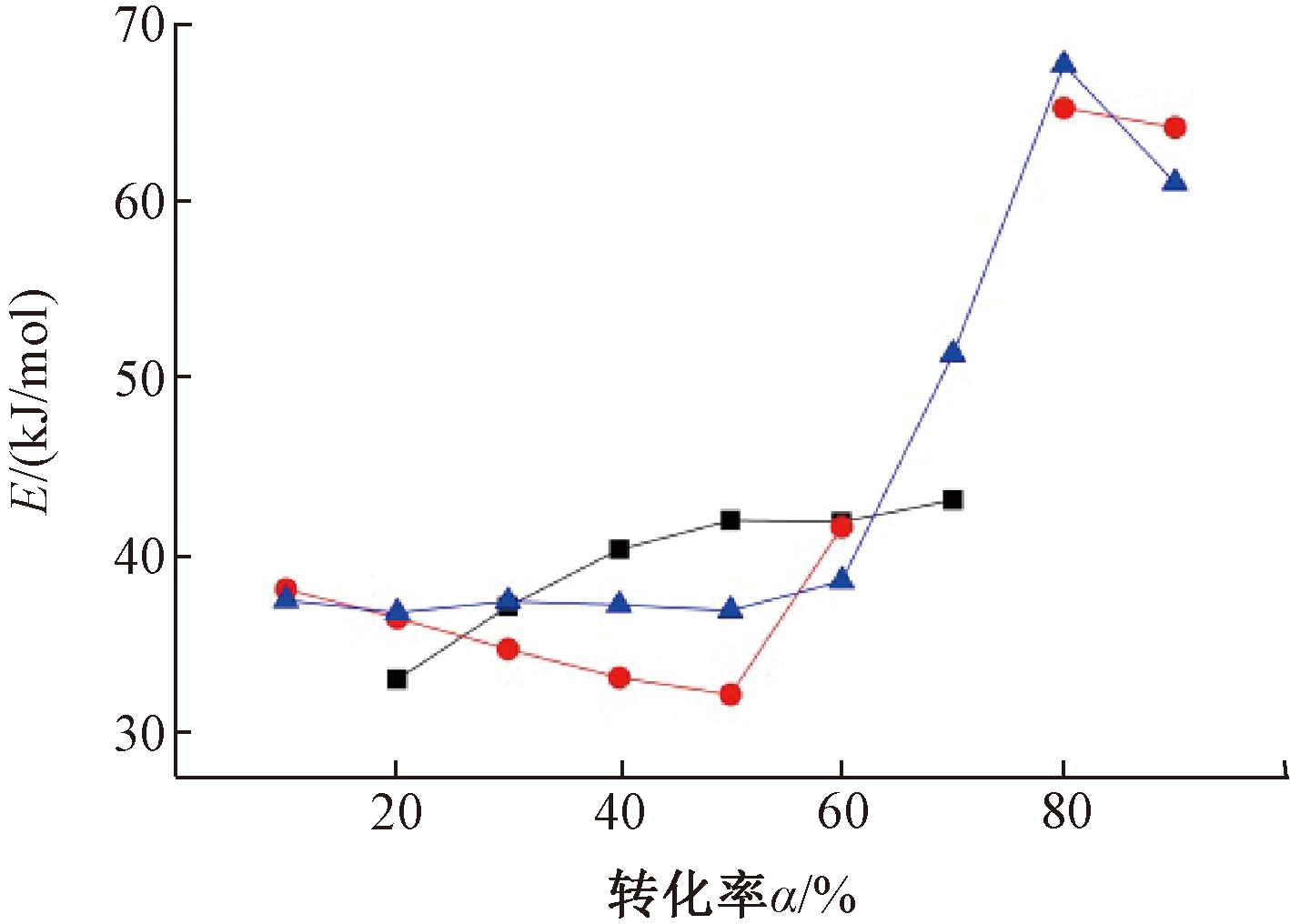
在各升温速率下,选择相同转化率的实验数据,以lg β对1/T作图。观察表6和图4发现:共热解的协同作用主要发生在转化率为20%~60%阶段,在这个区间内活化能普遍较低,为30~40 kJ/mol。在转化率达到60%以后,活化能曲线波动较大,邓娜[23]对医疗废物热解的研究中也发现了同样的变化趋势。将稻壳和PVC的单独热解曲线与两者共热解的曲线整体进行对比,发现共热解曲线波动较大,表明共热解存在多种反应相互影响,体现了共热解的复杂性。在转化率为40%~60%阶段,共热解的活化能值平均为37.60 kJ/mol,低于稻壳平均活化能41.45 kJ/mol,印证了稻壳与PVC在共热解时存在促进作用,使得混合物的热解反应更易进行。
2.4.3 Friedman法
表7为由Friedman法计算的热解活化能随转化率20%增加到80%的变化。当转化率<50%时,共热解活化能在110~120 kJ/mol。但是当转换率超过50%时,活化能突然增大,达到150 kJ/mol。余荣台[29]在研究磷酸铵镁的热解研究中,使用Friedman法得到了相同的变化趋势。但Friedman法无法求出稻壳单独热解时在80%处的活化能,证明其拟合准确性不如前2种方法,推测该方法求出的活化能普遍较大也是因为其拟合程度不足,数学模型无法适用于该热解进程。马明硕等[21]使用多种方法进行动力学分析时也发现Friedman法误差较大,拟合性不足。但是根据数据的变化趋势依然可以证实稻壳与PVC在第1阶段共热解过程中存在促进作用。
表6 由Ozawa法得到的稻壳、PVC、稻壳与PVC共热解的活化能
Table 6 Kinetic parameters of mono-pyrolysis and copyrolysis of rice husk and PVC by Ozawa method
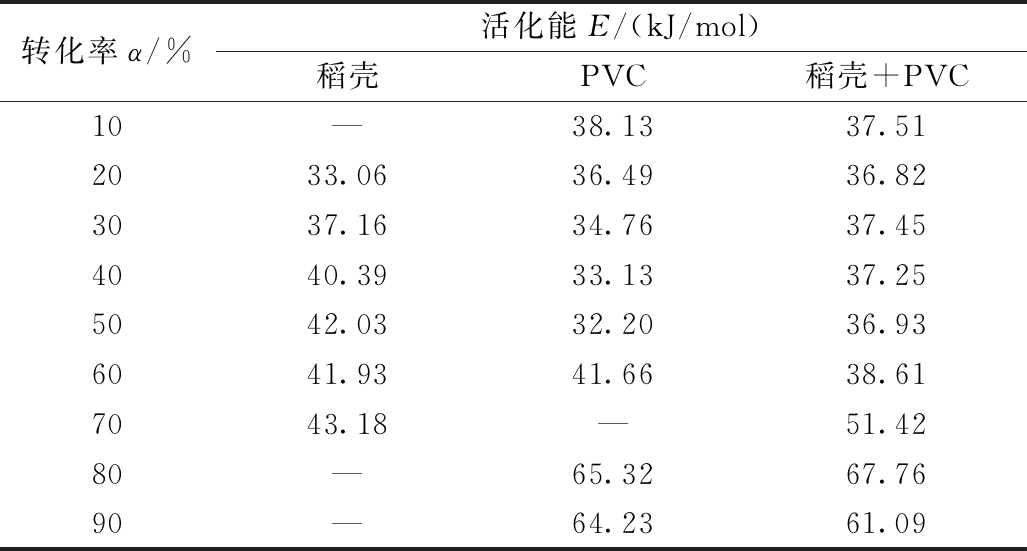
转化率α/%活化能E/(kJ/mol)稻壳PVC稻壳+PVC10—38.1337.512033.0636.4936.823037.1634.7637.454040.3933.1337.255042.0332.2036.936041.9341.6638.617043.18—51.4280—65.3267.7690—64.2361.09
![]() —稻壳;
—稻壳;![]() —PVC;
—PVC;![]() —稻壳+PVC。
—稻壳+PVC。
图4 Ozawa方法中稻壳和PVC单独热解与共热解的活化能随转化率的变化关系
Figure 4 Variation of activation energy of mono-pyrolysis and copyrolysis of rice husk and PVC with conversion rate by Ozawa method
表7 根据Friedman法计算稻壳、稻壳与PVC共热解的活化能
Table 7 Activation energy of mono-pyrolysis of rice husk and copyrolysis of rice husk and PVC by Friedman method
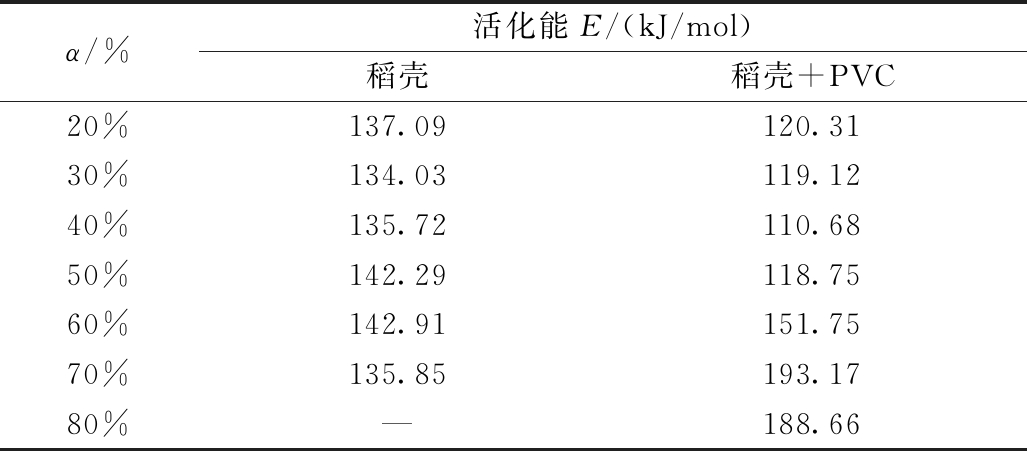
α/%活化能E/(kJ/mol)稻壳稻壳+PVC20%137.09120.3130%134.03119.1240%135.72110.6850%142.29118.7560%142.91151.7570%135.85193.1780%—188.66
注:—表示无法拟合成直线,无法求出对应的活化能。
3 结 论
1)本文对稻壳与PVC共热解行为、机理进行了研究,结果表明,稻壳与PVC共热解存在相互促进的作用。
2)升温速率为20 ℃/min,稻壳与PVC混合比为2∶1时,促进效果最显著,反应速率最快。
3)通过Coats-Redfem 积分法分析发现,稻壳、PVC共热解相互促进作用主要在PVC热解的第1阶段内发生。在选取的升温速率范围内,40 ℃/min时稻壳与PVC共热解的活化能最小。Ozawa法较其他2种方法求出的活化能值低,为30~60 kJ/mol。Friedman微分法计算得到的图像拟合程度相对较差,共热解活化能在数值上普遍低于20 kJ/mol,依然可说明促进作用的存在。
4)3种动力学分析方法对于共热解过程拟合程度有差异,导致计算得到的活化能不同,但皆可证明稻壳与PVC共热解存在有促进作用。两者共热解反应更偏向于化学反应动力学控制。
[1] 刘义彬, 马晓波, 陈德珍,等. 废塑料典型组分共热解特性及动力学分析[J].中国电机工程学报, 2010, 30(23):56-61.
[2] 唐赛珍.我国塑料废弃物资源化现状及前景[J].新材料产业,2011(10):62-67.
[3] 田水泉, 张立科, 杨风岭,等. 生物质能源化学转化技术与应用研究进展[J]. 安徽农业科学, 2011, 39(3):1645-1648.
[4] 车德勇, 蒋文强. 基于TG-FTIR分析的稻壳热解特性实验[J]. 中国农机化学报, 2016, 37(5):241-247.
[5] 孙翔, 黄如晖, 朱婧霖, 等. 基于DEA模型的农村生活垃圾处理工程环境及经济效益评估[J]. 农业工程学报, 2018, 34(16):190-197.
[6] ZHANG H Y, NIE J L, XIAO R, et al. Catalytic co-pyrolysis of biomass and different plastics (polyethylene, polypropylene, and polystyrene) to improve hydrocarbon yield in a fluidized-bed reactor[J]. Energy & Fuels, 2014, 28(3):1940-1947.
[7] LU C B, SONG W L, LIN W G. Kinetics of biomass catalytic pyrolysis[J]. Biotechnology Advances, 2009, 27(5):583-587.
[8] ZHOU H, LONG Y Q, MENG A H, et al. Thermogravimetric characteristics of typical municipal solid waste fractions during co-pyrolysis[J]. Waste Management, 2015, 38:194-200.
[9] 唐一菁, 王肖杭, 王东科,等. 淀粉和聚氯乙烯交互作用对热解焦油特性的影响[J]. 化工学报, 2017, 68(5):2049-2056.
[10] 严东, 周敏, 宋利强. 煤与稻壳共热解热重分析及动力学[J]. 化学工程, 2012, 40(9):60-63.
[11] HASSAN H, LIM J K, HAMEED B H. Recent progress on biomass co-pyrolysis conversion into high-quality bio-oil[J]. Bioresource Technology, 2016,221:645-655.
[12] BURRA K G, GUPTA A K. Kinetics of synergistic effects in co-pyrolysis of biomass with plastic wastes[J]. Applied Energy, 2018, 220:408-418.
[13] ZHANG X S, LEI H W, ZHU L, et al. Thermal behavior and kinetic study for catalytic co-pyrolysis of biomass with plastics[J]. Bioresource Technology, 2016,220:233-238.
[14] PARADELA F, PINTO F, GULYURTLU I, et al. Study of the co-pyrolysis of biomass and plastic wastes[J]. Clean Technologies and Environmental Policy, 2009, 11(1):115-122.
[15] 肖卓炳, 郭瑞轲, 郭满满. 麦秆的热解特性研究及其动力学分析[J]. 化学世界, 2013, 54(12):705-709.
[16] 何佳佳, 邱朋华, 吴少华. 升温速率对煤热解特性影响的TG/DTG分析[J]. 节能技术, 2007, 25(4):321-325.
[17] 孙云娟,薄剑春,王燕杰,等. Coats-Redfern积分法研究生物质与煤单独热解和共热解动力学特性[J]. 林产化学与工业, 2014, 34(5):8-14.
[18] 孙运兰, 朱宝忠, 祝易松. 生物质与废塑料共热解的研究进展[J]. 能源研究与管理, 2009(1):11-15.
[19] 李厚洋, 李刚, 张秀丽, 等. 添加秸秆对废橡胶/塑料共热解制油特性的影响[J]. 环境工程学报, 2015, 9(3):1417-1421.
[20] 李文, 田福军, 李保庆. 塑料与煤低温共焦化产物分析[J]. 中国矿业大学学报, 2000, 29(2):155-159.
[21] 马明硕, 曾晓丹, 高艳, 等. 粘胶基炭纤维热解特性及几种动力学方法研究[J]. 材料导报, 2014, 28(8):148-152.
[22] 张彬,张鹏,王文举.碱金属催化稻壳热解动力学研究[J].化学与生程,2016,33(12):34-37.
[23] 邓娜.医疗废物热解特性及动力学模型研究[D].天津:天津大学,2005.
[24] MISHRA R K, MOHANTY K. Pyrolysis kinetics and thermal behavior of waste sawdust biomass using thermogravimetric analysis[J]. Bioresource Technology, 2017, 251:63-74.
[25] 车德勇, 李少华, 张锐,等. 稻壳热解特性及动力学研究[J]. 电站系统工程, 2012, 28(4):5-7.
[26] 杨素文,丘克强.益阳地区7种生物质热解动力学特性研究.林产化学与工业[J].2009,29(4):39-44.
[27] 师奇松, 陈喆. 聚氯乙烯的热解特性和热解动力学的研究[J]. 北京石油化工学院学报, 2009, 17(1):1-4.
[28] NANDINI C. Thermal decomposition of poly(vinyl chloride) [J]. Journal of Polymer Science A, Polymer Chemistry, 1994,32(7):1225-1237.
[29] 余荣台. 磷酸铵镁热解产物循环沉氨过程研究[D].南京:南京大学, 2014.