0 引 言
聚羟基脂肪酸酯(polyhydroxyalkanoates,PHA)是一种生物可降解的聚合物,性能与石油基材料相似,作为传统塑料的替代品而备受关注。自1923年PHA首次被发现后[1],国内外诸多研究机构对其进行了长达几十年的研究[2]。目前产品成本是PHA生产中的一个重要制约因素,PHA聚合物的价格是传统聚合物的4~10倍,高昂的价格限制了PHA材料的发展[3]。餐厨废油处置是我国目前面临的重要问题[4],涉及食品安全、环境健康等诸多领域,处理不当易给人类健康、社会发展和环境保护带来负面影响[5]。餐厨废油作为生产PHA的原料可以有效地降低生产成本,又可以为餐厨废油高值化利用开辟一条新途径。
在合成PHA的细菌中,Cupriavidus necator(C. necator)能够以油脂、脂肪酸和葡萄糖等物质为底物合成PHA且有很高的产量,是生产PHA的优良菌种,在以往的研究中被广泛应用[6, 7]。学者对于利用C. necator合成PHA的研究多关注如何提高PHA产量,关于代谢机理方面的探讨较少。Fukui等[8]利用代谢组学方法研究了Ralstonia eutropha H16在聚羟基链烷酸酯生产的不同生长阶段代谢物的差异;Jin等[9]研究了Halomonas sp. KM-1的代谢物变化与PHB产量之间的关系,旨在通过优化培养基和代谢工程来改善PHB的产生。但影响PHA合成的关键代谢物尚不清晰,因此对C. necator代谢物的分析有助于进一步探明反应机理,从而提高PHA合成量。气相色谱与质谱联用仪(GC-MS)是一种可靠的分析糖、脂肪酸和氨基酸等代谢物的技术,并且经过大量实验证明,能够准确地对代谢物进行定量分析[10]。
PHA生物合成代谢过程中受到多种因素的影响[11],pH是其中的主要因素之一,同一微生物在不同pH范围内合成的物质会存在差异。pH的变化除直接影响细菌的生长外,还通过影响培养基中物质的离子化程度,间接影响PHA的合成[11]。在PHA的众多聚合物中,聚羟基丁酸脂(PHB)是目前研究最广泛的一种物质,同时也是C. necator最主要的合成物质。本研究比较了在不同pH值条件下同一生长期内细胞内代谢物的变化,基于代谢组学研究代谢物与PHB产量之间的相关性,以期为提高合成PHB的产量提供参考。
1 实验部分
1.1 碳源的选取
餐厨废油的实验样品取自北京工商大学食堂,经过离心处理去除固体杂质,置于冰箱中低温保存。
1.2 培养基
1)种子培养基:蛋白胨10 g/L,牛肉膏5 g/L,NaCl 5 g/L,pH 7.0。
2)发酵培养基:(NH4)2SO3 1.0 g/L,Na2HPO4·12H2O 11.1 g/L,MgSO4·7H2O 0.2 g/L,KH2PO4 1 g/L,微量元素溶液1 mL/L(9.7 g FeCl3、7.8 g CaCl2、0.156 g CuSO4·5H2O、0.199 g CoCl2、0.11 g NiCl2、0.062 g CrCl2溶解于1 L 0.1 mol/L的HCl溶液中)[12],餐厨废油为25 mL/L,菌液接种量为3%。
1.3 菌株来源
本实验菌种为C. necator (DSM428),购自中国普通微生物菌种保藏管理中心,编号1.7092。
1.4 合成PHB实验
将保藏的菌种接种入经高温灭菌处理的种子培养基进行活化培养,培养时间8 h。然后探究不同pH对C. necator生长的影响,设置pH梯度为6、7、8、9,温度30 ℃,摇床转速180 r/min,装液量为100 mL/250 mL锥形瓶,将种子培养基中的菌液接种到经高温灭菌的发酵培养基中,培养72 h,测定发酵液中PHB的产量及菌体干重。每组实验设置5组平行。
1.5 细胞干重的测定
取40 mL细菌发酵液于50 mL离心管中,置于高速冷冻离心机中进行离心处理,设置转速6000 r/min,离心操作10 min;蒸馏水洗涤2次,继续离心以去除残存的培养基。用95%的乙醇洗去浮油,弃去上清液,将样品置于-20 ℃冰箱冷藏12 h,后置于真空冷冻干燥机中24 h至恒重,称量得细胞干重。
1.6 PHB含量的测定
将冷冻干燥后的样品转移到消解管中,加入2 mL 三氯甲烷和2 mL苯甲酸-甲醇溶液,摇匀混合,置于105 ℃的烘箱中进行甲酯化处理4 h,取出冷却30 min,加入1 mL蒸馏水,剧烈振荡1 min,静置30 min 待样品分层后,吸取1 mL下层有机相置于进样瓶中,利用气相色谱仪测定[8]。
气相色谱仪为Agilent 7890 A。进样量为1 μL;进样口温度设定为250 ℃;N2作为载气,流速设定为30 mL/min,分流比为25∶ 1;采用FID检测器,温度设定为250 ℃;初始柱温为80 ℃,停留时间1 min,然后以8 ℃/min的速度升温至240 ℃,保持1 min。
1.7 样品预处理
从锥形瓶中取样品2 mL,立即加入2 mL(-30 ℃)的甲醇淬灭使代谢反应停止。然后加入20 μg 核糖醇作为内标。向甲醇/水混合溶液里加入2 mL(-30 ℃)的氯仿使细胞壁破碎,从而使酶变性。样品振荡10 min,6000 r/min离心10 min,使水/甲醇和氯仿相分开。待提取的代谢物质存在于水/甲醇相中。将样品放入真空冷冻干燥机中以除去痕量水。
样品衍生化:在冻干的样品中加入浓度为20 mg/mL 的溶解在吡啶中的甲氧胺盐酸盐50 μL,在30 ℃条件下肟化90 min,随后用100 μL的MSTFA(甲基三甲基甲硅烷基三氟乙酰胺)和1%的三甲基氯硅烷在37 ℃下硅烷化30 min。最后将反应结束的样品放入微量进样瓶中进行GC/MS测定[10]。
1.8 代谢物分析
采用GC/MS(7890A-5975C,Agilent)对代谢物进行测定分析。前入口、检测器和源的温度分别设置为250,250,230 ℃。载气为氦气,流速为1 mL/min。进样器分流比为1∶100,溶剂延迟为2 min。柱温设定为80 ℃,保持1 min,然后以10 ℃/min速度升温至300 ℃,保持1 min。质谱仪在70 eV的电子碰撞电离模式下操作。采用全谱扫描,其质量扫描范围m/z为50~600,质谱数据库参照NIST库[13]。
2 结果与讨论
2.1 pH对C. necator发酵产PHB的影响
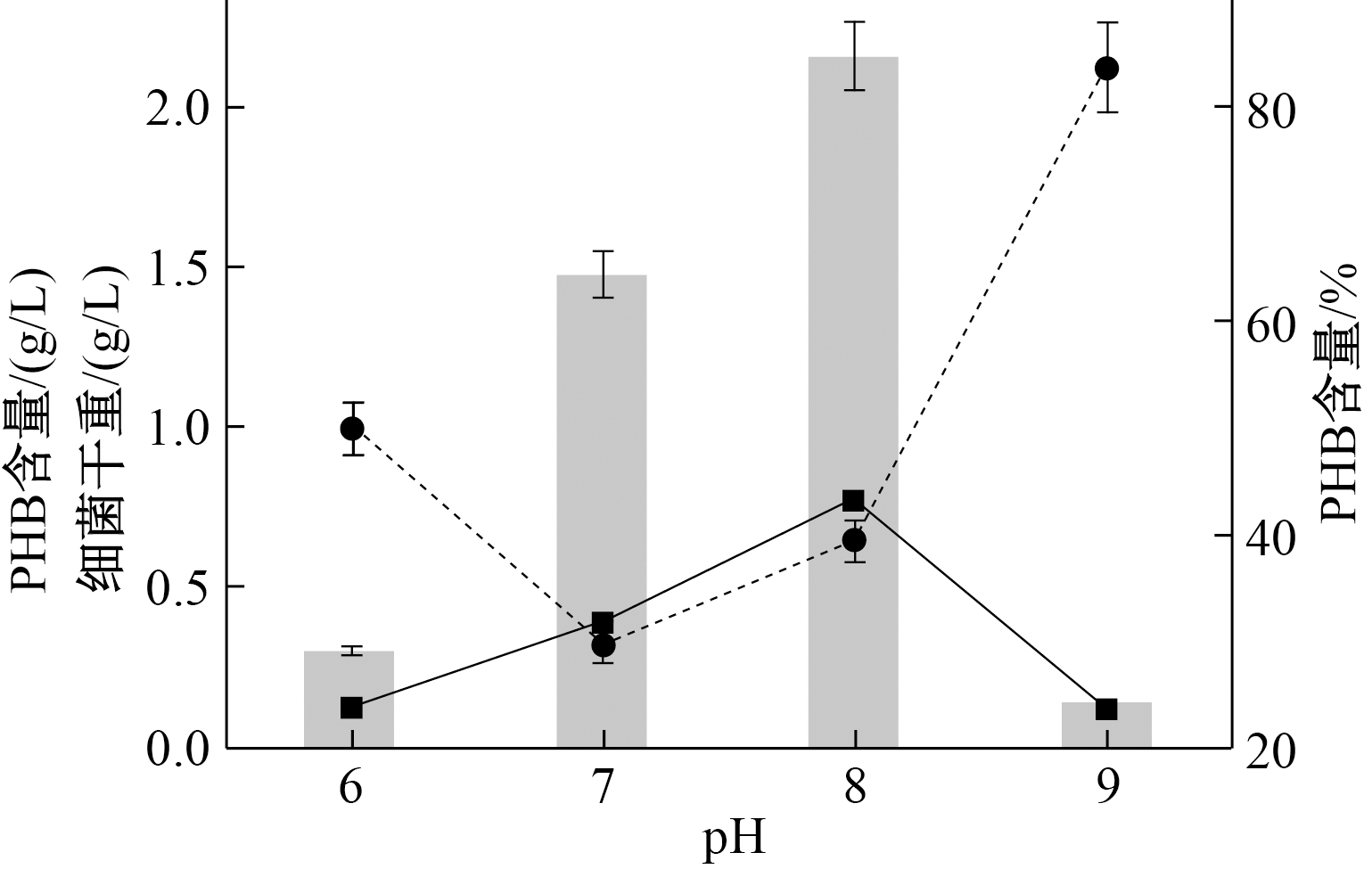
细胞干重、PHB产量和PHB含量随着培养基初始pH变化的情况见图1。细菌干重在pH值为8时达到最大值2.16 g/L,在pH为6和9时,细菌干重非常低,与pH为7和8时相差较大,可见偏酸和碱性环境都不利于C. necator的生长,而pH为8的发酵环境对C. necator的生长最为有利。PHB的产量随着pH值的升高呈先上升后下降的趋势,在pH值为8时达到最大值0.77 g/L,其变化趋势与细胞干重的变化趋势一致,表明碳源用于细菌生长的同时参与PHB的合成。PHA含量随着pH的升高呈先下降后升高的趋势,在pH为7时达到最低值29.5%,在pH为9时达到最大值83.7%,但从PHB产量来看,pH为8时更有利于合成PHB。由图1可看出:弱碱性的环境更适于C. necator的生长。崔有为等[14]的研究表明,不同微生物的最适pH范围不同,pH过高过低均会抑制微生物对底物的利用能力。pH为8时得到最大PHB产量,可见在此条件下,更有利于废油水解为游离脂肪酸,从而易于被微生物转化利用,这与之前的研究结果相符合[15,16]。
![]() ┅PHB含量%;
┅PHB含量%; ![]() —PHB产量(g/L);
—PHB产量(g/L);![]() 细菌干重(g/L)。
细菌干重(g/L)。
图1 pH对C. necator合成PHB的影响
Figure 1 Influence of pH on PHB synthesis of C. necator
2.2 差异代谢物分析
2.2.1 统计学分析
使用Simca-P 14.1软件进行多元统计分析,在统计分析之前对数据进行单位方差标准化转换(UV scaling),用R2(所解释的模型差异)和Q2(所预测的模型差异)值对模型质量进行检验,理论上当R2和Q2越接近于1,说明模型的拟合度越好,反之则越差。通常二者值高于0.5,则表示情况较好,同时要求两个数值差别不能太大[17]。
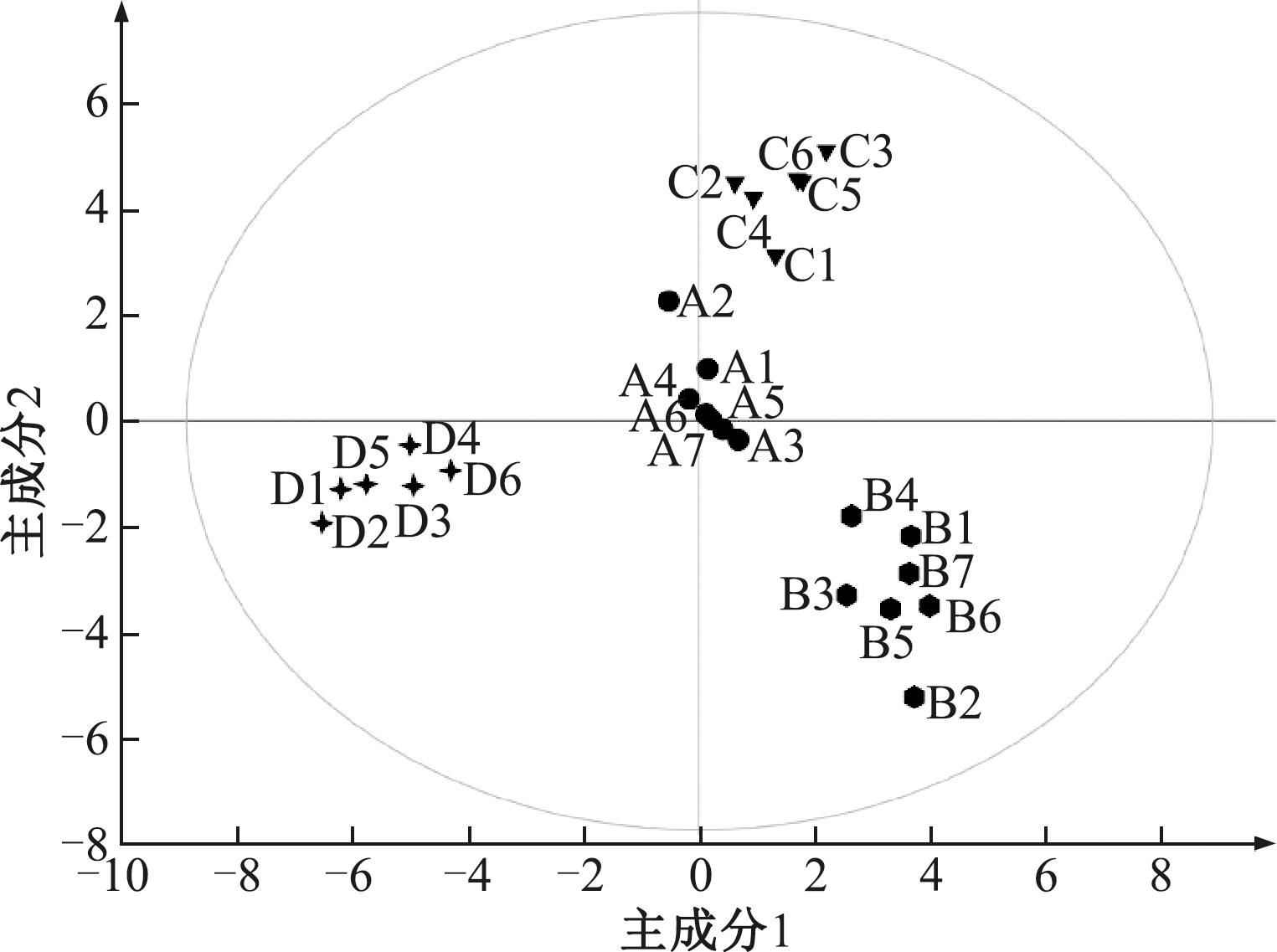
首先对pH为6、7、8和9的4组代谢物的GC/MS谱数据进行PLS-DA分析(偏最小二乘判别分析),见图2。该模型的R2值为0.93,Q2值为0.87,说明PLS-DA模型对4组代谢物的表型差异具有一定的解释和预测能力的情况下,未发生过拟合现象。由图2可看出:沿第1主成分方向(利用最小二乘法得到1条所有样品距离该直线残差平方和最小的线,该线的方向为第1主成分方向,体现了样品间最大差异),在4组样本得到很好区分,且pH为9实验组与其他3组的差别最为显著。
![]() A—pH 6;
A—pH 6;![]() B—pH 7;
B—pH 7;![]() C—pH 8;
C—pH 8;![]() D—pH 9。
D—pH 9。
图2 基于GC/MS分析的不同pH条件下PLS-DA得分图
Figure 2 PLS-DA score plots for different pH conditions based on GC/MS metabolic profiles
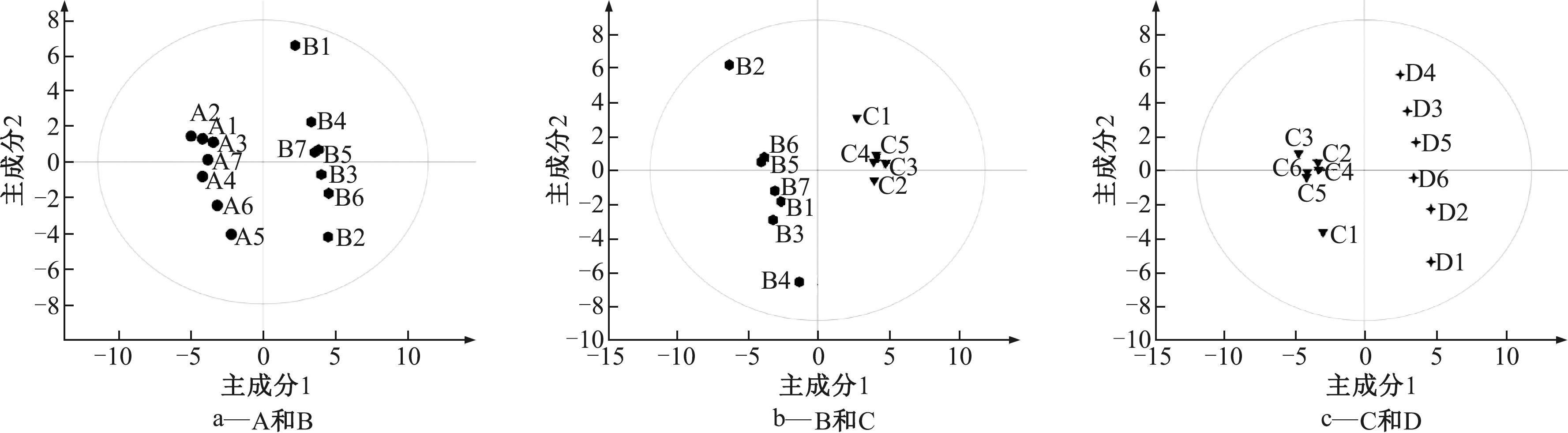
继而将pH6和pH7、pH7和pH8、pH8和pH9分成3组,将其代谢数据进行比较分析,分别建立PLS-DA模型。由图3a可看出:pH6和pH7之间得到了良好的区分,并且pH6组内差异较小,pH7组内出现一定差异,说明随着pH的升高,C. necator的体内代谢物水平发生一定程度的改变;由图3b和图3c两个模型中也能看出:pH7和pH8之间以及pH8和pH9之间也都产生明显区分,pH9组内差异较大,与pH7类似,而pH8组间差异并不明显。上述对比结果表明,相邻2组样本组间差异显著,pH变化引起细菌代谢水平变化显著。表1中的模型参数可以说明模型的可靠性,不存在过拟合现象,印证了之前的分析。
PLS-DA模型表明,随着pH的升高,C. necator体内代谢物水平发生了显著变化,pH对于发酵产物的影响以及微生物的新陈代谢会产生一定的影响。同时也说明pH的改变可以调控C. necator积累PHB的发酵过程。
![]() A:pH 6;
A:pH 6;![]() B:pH 7;
B:pH 7;![]() C:pH 8;
C:pH 8;![]() D:pH 9。
D:pH 9。
图3 相邻2组之间对比的PLS-DA得分图
Figure 3 PLS-DA score plots for comparison between two adjacent groups
表1 分组模型参数
Table 1 Parameters of the models in PLS-DA of three groups
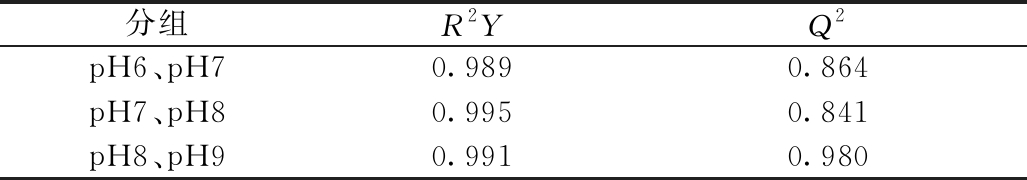
分组R2YQ2pH6、pH70.9890.864pH7、pH80.9950.841pH8、pH90.9910.980
2.2.2 重要代谢物分析
变量权重重要性排序值(VIP值)是用以筛选对模型贡献度大的变量,一般将VIP值>1并且在载荷图中离原点距离较大的点选为潜在影响因子[18]。结合图4和图5,经过对比分析,存在11种物质对代谢水平影响比较显著,分别为鸟氨酸、延胡索酸、β-D-葡萄糖、戊二酸、肌醇、丁酸、甘氨酸、L-天冬酰胺、d-葡萄糖、L-苏氨酸和缬氨酸。上述物质是影响PHB合
成的潜在生物标志物。
2.3 代谢途径分析
分别在初始pH为6、7、8、9的情况下培养C. necator,结合代谢产物检测结果以及KEGG数据库(https://www.kegg.jp/kegg/pathway.html)进行代谢途径分析。图6所示为细菌在合成PHB时细胞内代谢物水平随pH改变的变化情况。可知:C. necator代谢产生PHB涉及EMP途径、TCA循环、乙醛酸循环以及氨基酸的合成和代谢。
餐厨废油被微生物摄入后,经水解反应生成甘油和脂肪酸,脂肪酸发生β-氧化反应,在脂酰CoA合成酶的作用下与乙酰CoA发生反应生成脂酰CoA,脂酰CoA经脱氢和水化作用生成(R)-3-羟基脂酰CoA,进一步催化反应生成PHB;同时,甘油反应生成磷酸二羟丙酮,进一步生成3-磷酸甘油酸,进入EMP途径,产生磷酸烯醇丙酮酸,进一步反应生成丙酮酸,丙酮酸代谢途径产生的乙酰CoA补充进入PHB合成途径。以丁酸的合成代谢为例,丁酸含量变化为随着pH变化降低,与PHB的含量大致呈负相关性。由此可推断,餐厨废油在微生物体内代谢为丁酸,后又合成PHB。研究表明,丁酸可以作为合成PHB的碳源[19],加之在KEGG数据库中,微生物的丁酸降解过程存在合成PHB的通路。因此可以推测,在中性偏碱的环境下,丁酸的代谢途径更多地通向PHB合成。

![]() 差异代谢物;
差异代谢物;![]() 代谢物。
代谢物。
图4 不同pH下代谢物分布载荷
Figure 4 PLS-DA loading plot with different pH based on GC/MS metabolic profiles
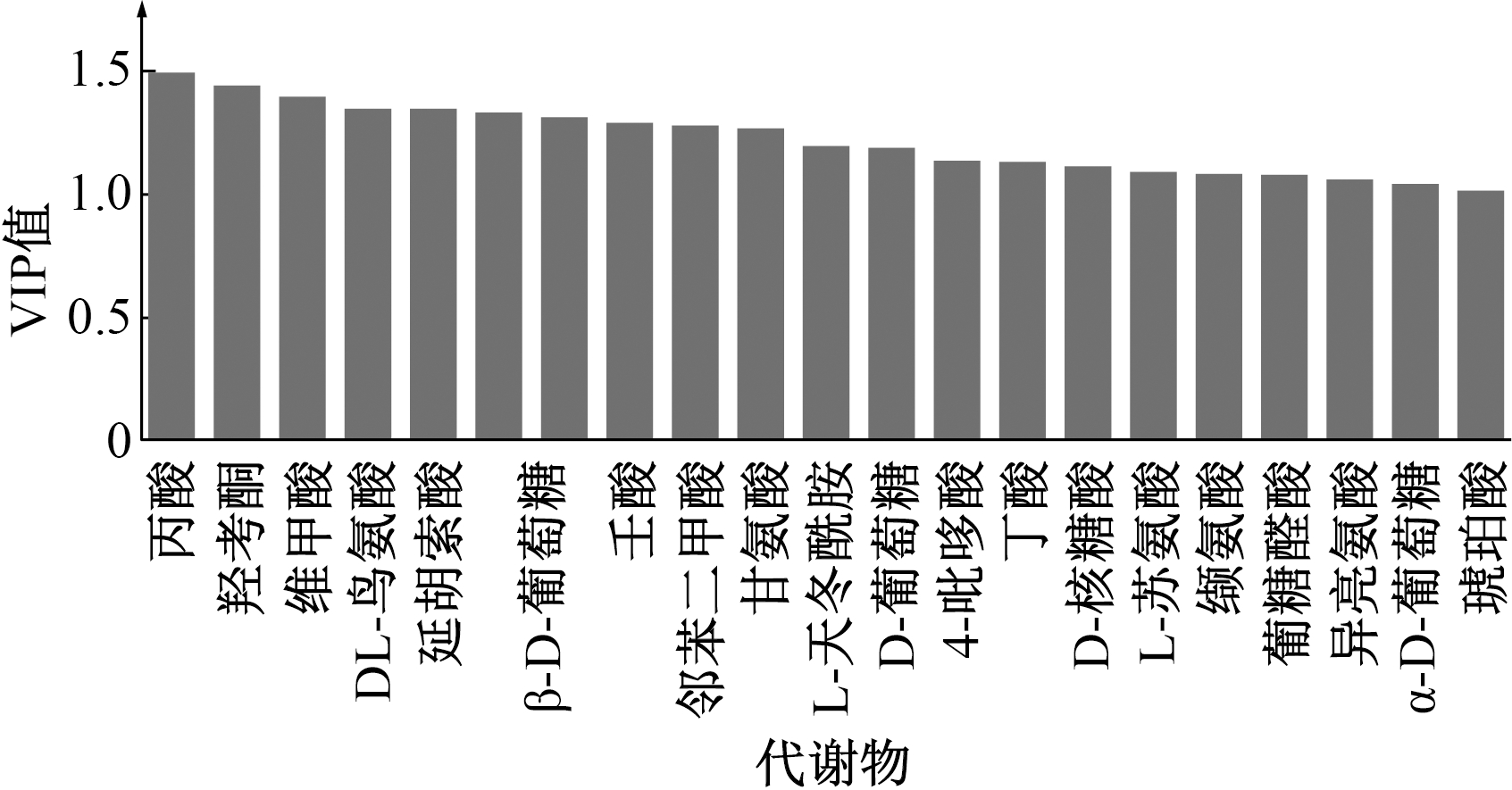
图5 C. necator代谢物VIP值分布
Figure 5 VIP plot for the metabolites of C. necator
对于其他中间代谢物,β-D-葡萄糖、苹果酸、缬氨酸、丙氨酸等物质随着PHB产量的提高而表现出同步上升,α-D-葡萄糖、甘油、L-天冬酰胺、天冬氨酸、甘氨酸、丙酮酸、赖氨酸、酪氨酸、琥珀酸、谷氨酸、鸟氨酸、α-酮戊二酸、L-苏氨酸、乙醛酸、延胡索酸、丝氨酸等物质则表现出与PHB变化相反的趋势。在氨基酸合成的过程中,氨基化作用涉及α-酮酸的反应,而细胞中能够生成α-酮酸的物质有α-酮戊二酸、丙酮酸、谷氨酸和延胡索酸。由图6可见,谷氨酸、α-酮戊二酸的含量同步下降,丙酮酸含量也基本呈下降趋势,可以推测在此阶段内丙酮酸向TCA循环转化通量降低,向乙酰辅酶A的转化增加,从而导致PHB合成量升高。Alagesan等[20]的研究表明,NADH和NADPH的含量在营养限制的条件下增加,导致异柠檬酸合酶和异柠檬酸脱氢酶受抑制,从而将碳通量导向PHB合成,与当前推测一致。而苏氨酸、甘氨酸、赖氨酸、L-天冬酰胺和天冬氨酸的含量也同步下降,这4种物质涉及氨基酸合成过程中的前体转化途径,同时,丙酮酸含量的降低可能导致草酰乙酸含量的降低,从而抑制了TCA循环与氨基酸转化的通路,相对促进了丙酮酸向PHB的转化。Castillo等[21]的研究表明,外界环境压力存在时,由磷酸烯醇丙酮酸羧激酶催化的草酰乙酸向磷酸烯醇丙酮酸转化的补缺反应代谢通量增加,也印证了本研究物质含量的变化趋势。

注:图中柱状图横坐标为pH 6、pH 7、pH 8、pH 9,纵坐标为物质含量,单位为mg/L。
图6 代谢通路模型路径分析
Figure 6 Scheme of metabolic pathways analysis
作为TCA循环的重要物质,延胡索酸在pH9时表现出较高的水平,而此时PHB的含量非常低,在其他阶段的含量变化并不明显。由此可以推测,在利于细菌生长和PHB合成的情况下,延胡索酸持续转化,因此其浓度呈现稳定较低水平;在碱性环境下,微生物的生命活动受到抑制,TCA循环通路减弱,同时乙酰辅酶A向PHB转化的通路也相应受到抑制,从而导致了延胡索酸的积累和PHB合成的减少。乙醛酸含量变化与PHB合成相反,之前的研究表明[22,23],乙醛酸循环作为TCA循环的回补途径,存在乙醛酸向苹果酸的合成,后在NADP依赖的苹果酸脱羧酶作用下催化苹果酸合成丙酮酸,从而促进PHB的合成。
综上所述,结合PLS-DA分析得出具有显著性差异的物质,可以推测甘氨酸、鸟氨酸、苏氨酸、天冬酰胺和延胡索酸会对PHB的产量产生较大程度的影响。
3 结 论
1)将C. necator在培养基初始pH为6、7、8、9的条件下进行发酵培养,分析结果表明,pH为8时最适宜细菌生长,细胞干重达到2.16 g/L,此时PHB的产量达到最大值,为0.77 g/L。
2)提取各组细菌代谢物,利用GC/MS进行分析,由PLS-DA分析得出存在鸟氨酸、延胡索酸、β-D-葡萄糖、戊二酸、肌醇、丁酸、甘氨酸、L-天冬酰胺、d-葡萄糖、L-苏氨酸和缬氨酸11种物质对代谢水平影响比较显著。通过分析KEGG的代谢通路图绘制的代谢网络图发现,甘氨酸、鸟氨酸、苏氨酸、天冬酰胺和延胡索酸5种物质通过TCA循环途径、氨基酸合成代谢以及丙酮酸合成降解等途径对C. necator合成PHB有较为显著的影响。
[1] MACRAE R M, WILKINSON J F. Poly-β-hyroxybutyrate metabolism in washed suspensions of bacillus cereus and bacillus megaterium[J]. Microbiology, 1958, 19(1): 210-222.
[2] 王攀, 邱银权, 陈锡腾,等. 以餐厨垃圾水解酸化液为碳源合成PHA研究[J]. 环境工程, 2018, 36(6): 145-149.
[3] 王攀, 邱银权, 陈锡腾,等. 利用餐厨垃圾水解酸化液合成PHA:耐盐菌的筛选及其产PHA特性[J]. 环境工程, 2018, 36(4): 78-82.
[4] 胡朝华, 张蕾, 张又弛,等. 非均相高效催化剂在餐厨废油转化生物柴油中的应用[J]. 环境工程, 2016, 34(9): 105-109.
[5] 任连海, 聂永丰, 刘建国. 利用餐厨废油制取生物柴油的影响因素研究[J]. 环境科学学报, 2013, 33(4): 1104-1109.
[6] GAHLAWAT G, SONI S K. Valorization of waste glycerol for the production of poly (3-hydroxybutyrate) and poly (3-hydroxybutyrate-co-3-hydroxyvalerate) copolymer by Cupriavidus necator and extraction in a sustainable manner[J]. Bioresource Technology, 2017, 243: 492-501.
[7] KOLLER M, MARSALEK L, DIAS M M D S, et al. Producing microbial polyhydroxyalkanoate (PHA) biopolyesters in a sustainable manner[J]. New Biotechnology, 2017, 37: 24-38.
[8] IM D K, YUN S H, JUNG J-Y, et al. Comparison of metabolite profiling of Ralstonia eutropha H16 phaBCA mutants grown on different carbon sources[J]. Korean Journal of Chemical Engineering, 2017, 34(3): 797-805.
[9] MARUDKLA J, LEE W C, WANNAWILAI S, et al. Model of acetic acid-affected growth and poly(3-hydroxybutyrate) production by Cupriavidus necator DSM 545[J]. Journal of Biotechnology, 2018, 268: 12-20.
[10] JIN Y X, SHI L H, KAWATA Y. Metabolomics-based component profiling of Halomonas sp. KM-1 during different growth phases in poly (3-hydroxybutyrate) production[J]. Bioresource Technology, 2013, 140: 73-79.
[11] MONTIEL-JARILLO G, CARRERA J, Eugenia Suarez-Ojeda M. Enrichment of a mixed microbial culture for polyhydroxyalkanoates production: effect of pH and N and P concentrations[J]. Science of the Total Environment, 2017, 583: 300-307.
[12] OH Y H, LEE S H, JANG Y-A, et al. Development of rice bran treatment process and its use for the synthesis of polyhydroxyalkanoates from rice bran hydrolysate solution[J]. Bioresource Technology, 2015, 181: 283-290.
[13] TSUGAWA H, TSUJIMOTO Y, ARITA M, et al. GC/MS based metabolomics: development of a data mining system for metabolite identification by using soft independent modeling of class analogy (SIMCA)[J]. BMC Bioinformatics, 2011, 12(1): 131.
[14] 崔有为, 张宏宇. pH对嗜盐混合菌发酵挥发性有机酸混合物合成PHA的影响[J]. 化工学报, 2016, 67(10): 4431-4438.
[15] HUANG L K, LIU C, LIU Y J, et al. The composition analysis and preliminary cultivation optimization of a PHA-producing microbial consortium with xylose as a sole carbon source[J]. Waste Management, 2016, 52: 77-85.
[16] 曹蒙, 缪恒锋, 赵明星,等. 脂肪酶强化水解餐厨油脂促进厌氧消化[J]. 食品与生物技术学报, 2018, 37(9): 977-986.
[17] 阿基业, 何骏, 孙润彬. 代谢组学数据处理:主成分分析十个要点问题[J]. 药学学报, 2018, 53(6): 929-937.
[18] SHIROLKAR A, CHAKRABORTY S, MANDAL T, et al. Plasma metabolomics reveal the correlation of metabolic pathways and Prakritis of humans[J]. Journal of Ayurveda and Integrative Medicine, 2018, 9(2): 113-122.
[19] RAZA Z A, ABID S, BANAT I M. Polyhydroxyalkanoates: characteristics, production, recent developments and applications[J]. International Biodeterioration & Biodegradation, 2018, 126: 45-56.
[20] ALAGESAN S, MINTON N P, MALYS N. 13C-assisted metabolic flux analysis to investigate heterotrophic and mixotrophic metabolism in Cupriavidus necator H16[J]. Metabolomics, 2017, 14(1): 9.
[21] CASTILLO T, HEINZLE E, PEIFER S, et al. Oxygen supply strongly influences metabolic fluxes, the production of poly(3-hydroxybutyrate) and alginate, and the degree of acetylation of alginate in Azotobacter vinelandii[J]. Process Biochemistry, 2013, 48(7): 995-1003.
[22] RAM REZ-TRUJILLO J A, DUNN M F, SU
REZ-TRUJILLO J A, DUNN M F, SU REZ-RODR
REZ-RODR GUEZ R, et al. The Sinorhizobium meliloti glyoxylate cycle enzyme isocitrate lyase (AceA) is required for the utilization of poly-beta-hydroxybutyrate during carbon starvation[J]. Annals of Microbiology, 2016, 66(2): 921-924.
GUEZ R, et al. The Sinorhizobium meliloti glyoxylate cycle enzyme isocitrate lyase (AceA) is required for the utilization of poly-beta-hydroxybutyrate during carbon starvation[J]. Annals of Microbiology, 2016, 66(2): 921-924.
[23] BORJIAN F, HAN J, HOU J, et al. The methylaspartate cycle in haloarchaea and its possible role in carbon metabolism[J]. The ISME Journal, 2016, 10(3): 546-557.