0 引 言
当今,在经济高速发展、人口总量庞大的背景之下,我国环境负荷日趋增加,环境质量标准和污染物排放标准日益严苛,可供利用的水资源越发紧缺,并且环境中出现的新型污染物,如全氟有机化合物(PFOCs)、个人护理品(PPCPs)、微塑料(MPs)、内分泌干扰物(EDCs)等,呈现出多样、复杂、难生物降解、持续风险等特点。在此背景下,传统生物处理越发难以将一些废水处理至回用或者排放的标准。因此,高级氧化技术成为研究热点。
高级氧化技术(AOPs)是指通过产生具有较高氧化电位的![]() 等活性自由基,将难降解的大分子有机物氧化成低毒或无毒的小分子物质,甚至矿化为CO2和H2O的技术[1]。AOPs的优点为:氧化能力强,如·OH的氧化还原电位为2.80 V;反应速率快,与大多数有机物的反应速率常数为106~109 mol/(L·s);可改善废水的可生化性,·OH可通过亲电加成、夺氢、电子转移等方式将大分子有机物分解为短链的小分子有机物,提高BOD5/COD值(B/C值);二次污染少,可将污染物矿化;适用范围广,·OH对有机分子几乎无选择性。
等活性自由基,将难降解的大分子有机物氧化成低毒或无毒的小分子物质,甚至矿化为CO2和H2O的技术[1]。AOPs的优点为:氧化能力强,如·OH的氧化还原电位为2.80 V;反应速率快,与大多数有机物的反应速率常数为106~109 mol/(L·s);可改善废水的可生化性,·OH可通过亲电加成、夺氢、电子转移等方式将大分子有机物分解为短链的小分子有机物,提高BOD5/COD值(B/C值);二次污染少,可将污染物矿化;适用范围广,·OH对有机分子几乎无选择性。
根据活性物种的产生方式或条件不同,AOPs可分为Fenton氧化、臭氧催化氧化、光催化氧化、电化学氧化、湿式氧化以及超临界水氧化等。经过多年发展,AOPs已成功应用于废水中难降解污染物的去除,既可作为深度处理技术,也可作为生物法的预处理技术。
目前,国内外已有大量关于AOPs的研究与应用案例,涉及不同AOPs的能耗评价[2],各种AOPs产生活性物种的效率比较[3],总结了各种技术的优缺点[4],探讨了运行条件、影响因素、污染物降解机理、·OH的形成机制等[5-9]。本文着重介绍Fenton氧化法、臭氧氧化法、光催化氧化法、电化学法氧化、物理氧化法,从方法原理、影响因素、优缺点、发展方向等方面进行系统地归纳论述,开展了关于理论-技术-应用之间的发展与未来的思考。
1 Fenton氧化法
1.1 Fenton氧化法的基本原理
目前,Fenton法广泛应用于医药化工、精细化工、医药卫生、环境污染治理等领域。在废水处理中,Fenton试剂对污染物的去除机理可分为自由基氧化机理和混凝机理。其中,自由基氧化机理是在酸性条件下,通过Fe2+催化H2O2产生·OH,如式(1)所示;所生成的·OH可以加成到有机污染物的碳碳双键、苯环等不饱和键中,也可以通过夺取N—H、O—H、C—H键上的氢原子生成R·,如式(2)所示;在有氧条件下,R·会快速地与O2结合产生ROO·,ROO·会夺取其他RH上的H,直至裂解为小分子有机酸或矿化为CO2和H2O,如式(3)所示[10]。在这些复杂的自由基反应体系中,存在大量的竞争反应,如式(4)—(11)所示。其中式(4)—(6)表明,Fe3+能通过H2O2和HO2·被还原成Fe2+,以此实现Fe2+和Fe3+的部分循环;但是,由于式(1)的反应速率常数远大于式(4),因此仍需不断补充Fe2+;另外,·OH的淬灭或转化为其他氧化活性较低的自由基(如HO2·,O2·-等),是制约其矿化效率的重要原因,如式(8)—(11)所示:
·OH+H2O k=63 mol/(L·S)
(1)
·OH+RH→R·+H2O
K=107~109 mol/(L·s)
(2)
R·+O2→ROO·→…→CO2+H2O
(3)
Fe3++H2O2→Fe2++HO2·+H+
K=0.002~0.01 mol/(L·s)
(4)
Fe3++HO2·→Fe2++O2+H+
K=2×103 mol/(L·s)
(5)
Fe3++R·→Fe2++R+
(6)
R·+H2O2→·OH+ROH
(7)
·OH+Fe2+→Fe3++OH-
K=3.2×108 mol/(L·s)
(8)
·OH+H2O2→HO2·+H2O
K=2.7×107 mol/(L·s)
(9)
·OH+HO2·→O2+H2O
K=1×1010 mol/(L·s)
(10)
·OH+·OH→H2O2
K=4.2×109 mol/(L·s)
(11)
此外,体系中会存在具有凝聚作用的铁水络合物,其参加反应情况如式(12)—(14)所示[11]:
2[Fe(H2O)5OH]2+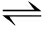 [Fe2(H2O)8(OH)2]4++2H2O
[Fe2(H2O)8(OH)2]4++2H2O
(12)
[Fe2(H2O)8(OH)2]4++H2O
[Fe2(H2O)7(OH)3]3++H3O+
(13)
[Fe2(H2O)7(OH)3]3++[Fe(H2O)5OH]2+
[Fe3(H2O)7(OH)4]5++5H2O
(14)
1.2 Fenton氧化技术的影响因素
Fenton氧化技术的处理效果主要受温度、pH值、无机阴离子、Fe2+及H2O2浓度的影响。反应动力学表明,升温会提高正、副反应速率,适当升温可激活自由基,但同时也会加快H2O2的分解,一般在30 ℃左右为宜[12]。
由式(1)可知:过高的pH值不利于产生·OH且会产生Fe(OH)3沉淀;当pH<2时,Fe2+会以[Fe(H2O)6]2+形式存在,据报道该形态与H2O2的反应速率较[Fe(H2O)5OH]2+更慢,且过低的pH值会抑制式(4)、式(5)的进行,影响Fe2+和Fe3+循环,pH一般控制在2~4为宜,最佳pH值约为3[13]。
此外,![]() 等阴离子可能会与Fe2+、Fe3+产生络合,使之不能有效地催化H2O2分解为
等阴离子可能会与Fe2+、Fe3+产生络合,使之不能有效地催化H2O2分解为![]() 等无机阴离子会参与争夺·OH生成氧化活性更低的自由基,不利于污染物矿化[14]。
等无机阴离子会参与争夺·OH生成氧化活性更低的自由基,不利于污染物矿化[14]。
Fe2+及H2O2浓度及比例也会影响·OH产量。当ρ(Fe2+)/ρ(H2O2)>2时,反应初期以式(1)为主要反应,迅速产生大量·OH,其产生速率高于消耗速率,导致过量的·OH发生积聚或与其他物种发生竞争反应;当ρ(Fe2+)/ρ(H2O2)=1时,反应初期以式(1)和式(4)为主,由于·OH与有机物的反应速率高于H2O2或Fe2+,因此抑制了式(8)—(9)的进行。当ρ(Fe2+)/ρ(H2O2)<<1时,由于缺乏Fe2+,·OH产生量少,而且H2O2对·OH具有淬灭作用[15]。
1.3 Fenton氧化技术的优缺点
Fenton 氧化技术兼具凝聚作用,无须外界额外提供能量,操作简便,可控性强,具有经济性。但传统Fenton法的·OH产生速率低,体系中存在大量的竞争反应;该技术需要在酸性条件下进行,出水需要调至中性,导致消耗大量药剂,增加处理费用,同时产生大量铁泥,增加了出水COD、色度并造成二次污染的风险,运输和储存H2O2需要较高的费用,存在安全风险[16]。
1.4 Fenton氧化技术的发展
针对传统Fenton法的缺陷,学者们把光场、电场、超声波等引入Fenton体系,并研究其他可能替代Fe2+的过渡金属,如铈、钴、锰、铜等[17]。目前,类Fenton技术主要包括光Fenton法、电Fenton法、超声Fenton法及无铁Fenton法。
1.4.1 光Fenton法
Ruppert等[18]首次将近紫外光引入Fenton体系,发现近紫外光或可见光可大幅提高4-CP的去除效率,证明光辐射可提高·OH的生成速率,加快污染物降解效率。光Fenton氧化机理认为:在λ<300 nm的光照条件下,H2O2将发生光解产生·OH,该反应可提高H2O2的利用率,如式(15)所示[19];Fe3+络合物在紫外或近紫外光照下发生光还原,产生Fe2+和·OH,其光量子产率与照射波长有关,该反应不但可提高·OH产量,还将加快体系中Fe3+和Fe2+的循环,减少Fe2+的投加量,如式(16)所示[20];此外,紫外或可见光辐射还可以诱导某些污染物与Fe 3+的络合物发生光降解,如式(17)所示[21]:
H2O2+hυ→2·OH
(15)
Fe(OH)2++hυ→Fe2++·OH
(16)
2[Fe(C2O4)n](3-2n)++hυ→2Fe2++
(2n-1)(C2O4)2-+2CO2
(17)
在应用方面,Feng等[22]在光照条件下,使用黏土负载铁的纳米复合材料催化H2O2对活性红废水进行脱色、矿化,初始浓度为100 mg/L的活性红废水在最优条件下处理30 min即可完全脱色,2 h时TOC去除率可达76%。Elmolla等[23]在n(COD)∶n(H2O2)∶n(Fe2+)为1∶3∶0.3,pH=3,365 nm紫外光照射下,降解104 mg/L阿莫西林、105 mg/L氨比西林、103 mg/L氯洒西林,2 min内可实现抗生素的完全降解,10 min内B/C值由0上升至0.37,50 min后,COD、DOC去除率分别为80.8%和58.4%。Malato等[24]探究了光催化降解敌草隆、吡虫啉、杀螨脒和灭多威,在30 W/m2光照,维持H2O2、Fe2+浓度分别为15,0.05 mol/L的条件下,4种农药达到TOC降解率90%时,所需时间分别为159,187,105,368 min。Hermosilla等[25]分别采用Fenton和光Fenton处理垃圾渗滤液,在优化条件下,二者均能达到70%的COD和TOC去除率,但传统Fenton法需多消耗32倍的铁盐,且产生更多的铁泥。
在实际工程应用中,光Fenton法比传统Fenton法更高效,比电Fenton法更为节能,对有机物的降解速率比非均相光催化反应高3~5倍。但该技术仍存在一些问题,例如光利用率不高;由于Fe3+与有机物的络合物不易吸收光子,故只适宜处理中低浓度废水[26]。因此,可通过研究光活性强的物种,如Fe3+和草酸络合物、Fe3+和柠檬酸络合物等,或联合电场、超声波等,以及结合新型反应器,以提高光能利用率和污染物降解的效能。
1.4.2 电Fenton氧化技术
电Fenton氧化技术利用电化学方法产生H2O2,加速还原Fe3+来强化Fenton氧化。其特点是在阳极产生ROS或直接氧化污染物;在供氧、酸性介质条件下,于阴极原位产生H2O2,并将Fe3+还原为Fe2+,分别如式(18)—(19)所示。其中,式(18)的标准电位(E0=0.695 V/SHE)低于四电子还原的竞争反应(见式(20))(E0=1.23 V/SHE),因此式(18)优先进行[27]:
O2(g)+2H++2e-→H2O2
(18)
Fe3++e-→Fe2+
(19)
O2(g)+4H++4e-→2H2O
(20)
Liu等[28]将纳米铁负载在活性炭纤维表面作为阴极,在中性条件下通以1.2 V的电压,将ρ(COD)为200 mg/L的城市污水处理2 h后降到70 mg/L,COD去除率达到65%。方建章等[29]以石墨为电极,阴极表面通入纯氧原位产生H2O2,以Na2SO4溶液为电解质,加入0.5 g/L的FeSO4·7H2O,在pH=2.5,E=6 V条件下,降解酸性铬兰K染料废水,处理1 h后,脱色率和COD去除率分别为74.1%、57.9%;处理2 h后,脱色率和COD去除率分别为92.9%、71.3%。Kurt等[30]采用牺牲阳极的电Fenton氧化降解ρ(COD)为2810 mg/L的制革废水,比较了不同pH、H2O2剂量、电功率条件下COD去除率及能耗情况,发现pH=3时处理效果最佳,COD去除率超过70%,而在中性条件下COD去除率>60%;在ρ(H2O2)为1670 mg/L,电功率为15 W的中性介质下,处理10 min后COD去除率达到58%,电耗为3.8 kW·h/kg(COD)。
相较于传统Fenton技术,电Fenton技术的优势在于利用电能和氧气原位产生H2O2,避免了H2O2运输与储存;同时,可在阴极将Fe3+还原为Fe2+,节省Fe2+的投加量;而向阴极曝气(氧气或空气)也能起到搅拌作用;另外,除了自由基氧化之外,还存在阳极氧化、电吸附、电絮凝等,协同作用显著提高了去除有机物的能力[31]。但是,电Fenton技术仍存在一些缺陷,例如,受制于气体在电解液中的传质,H2O2的生成速率低;受制于竞争反应,产生H2O2的极限电流密度为6.4 A/m2[32];对pH值要求苛刻等。针对这些缺陷,应着重研究比表面积大、能高效电催化氧气原位产生H2O2的新型电极,如多孔石墨、活性炭纤维等;发展能效更高的三维电极电Fenton技术及其反应器。另外,关注如何扩大适用pH值范围,如通过络合剂对Fenton试剂进行改性、采用过硫酸盐代替H2O2等。
1.4.3 超声Fenton氧化技术
将超声波(20~1700 kHz)与Fenton法结合,可加快H2O2分解为·OH的速率,如式(21)所示。此外,超声空化作用对污染物有一定降解作用,且能促进体系介质的混合与传质,该技术可运用于处理诸多难生物降解污染物,如有机染料、药物等。
H2O2+US→2·OH
(21)
戴丽雅等[33]应用该技术处理工业染料中间体废水,考察了pH、温度、超声波功率、ρ(Fe2+)/ρ(H2O2)等条件对COD去除的影响,在最佳条件下反应40 min后,COD降解率为92.26%,色度由800倍降为1倍。Ma等[34]分别采用超声和超声Fenton降解浓度为20 mg/L的卡巴呋喃废水,超声降解2 h后,卡巴呋喃的降解率超过40%,但是TOC去除率<15%,说明大部分卡巴呋喃被氧化为中间体,而用超声Fenton法处理30 min后卡巴呋喃的降解率为99%,且TOC去除率高于40%。
1.4.4 无铁Fenton氧化技术
制约Fenton法发展的因素之一为酸性介质条件,该因素也被视为其突破点之一。为了满足催化剂和H2O2之间的电子转移,优先考虑将多价态,沉淀pH范围较高,且高价态可以充当H2O2氧化剂、低价态可以充当H2O2还原剂的元素作为理想Fenton催化剂。目前,可满足上述条件的元素有Ce、Cr、Co、Cu、Mn、Al等,其中,Ce、Cr、Cu成为催化反应的关键循环步骤,分别如式(22)—(28)所示。这些元素可在中性甚至碱性条件下催化H2O2分解为·OH。
Ce3++H2O2→Ce4++·OH+OH-
(22)
Ce4++H2O2→Ce3++HO2·+H+
(23)
Cr4++H2O2→Cr5++·OH+OH-
(24)
Cr5++H2O2→Cr6++·OH+OH-
(25)
Cr6++ne-→Cr(6-n)+(n=1~3)
(26)
Cu2++H2O2→Cu++HO2·+H+
(27)
Cu++H2O2→Cu2++·OH+OH-
(28)
在应用方面,Gabriel等[35]采用无铁Fenton技术处理含PAHs废水,催化剂CuSO4浓度为10 mmol/L,且氧化剂H2O2浓度为0.1 mol/L时,降解浓度均为10 mmol/L的菲、荧蒽和芘,结果发现,在室温下处理24 h,3种PAHs的降解率均超过80%。Ben-Moshe等[36]研究了纳米级CuO对H2O2的催化活性并用于去除有机污染物,结果表明,在c(H2O2)为0.05 mol/L和pH=4~9时,处理20 min后即可完全降解浓度约为500 μg/L的菲和35 mg/L的甲草胺。Fathy等[37]采用MnO2/MWCNT纳米复合催化剂催化H2O2降解RB19染料废水,在催化剂用量为0.2 g/L、pH=6条件下,处理2 h后可将浓度为50 mg/L的RB19染料完全降解。
目前,金属溶出和毒性是制约某些元素如Cr、Cu等作为Fenton催化剂大规模应用的重要因素。因此,发展稳定难溶出、催化活性高、使用pH范围宽的非均相催化剂,是Fenton系统可持续发展的方向,如MOFs、金属负载的活性炭、沸石或石墨烯等。
2 臭氧氧化/催化氧化法
2.1 臭氧氧化法的基本原理
20世纪末,随着高频高压电晕放电的应用,O3相关技术应用及产业规模快速发展。目前,臭氧氧化技术早已成为水处理领域中极具发展及应用前景的技术。臭氧氧化过程可分为直接氧化和间接氧化。由O3的电子结构可知:O3既可作为亲电试剂,也可作为亲核试剂,臭氧两端的氧原子还可发生环加成反应。因此,臭氧直接氧化机理可分为亲电反应、亲核反应以及加成反应。O3直接氧化存在选择性,面对饱和脂肪族等有机物,O3难以直接将其氧化;并且O3性质不稳定,会自行分解并释放出热量,如式(29)所示:
O3→1.5 O2+144.45 kJ
(29)
臭氧间接氧化是指在水溶液中,O3与OH-等作用产生·OH,再通过·OH氧化污染物。目前,关于O3在水体中链式分解的解释主要有TFG和SBH机理。在碱性条件下,O3与OH-的反应主要以TFG模式进行,关键步骤如式(30)—(34)所示[38];而在弱酸性及中性条件下,则主要以SBH模式进行,关键步骤如式(35)—(37)所示[39]。二者之间的差别在于链引发的方式不同,SBH模式为单电子转移过程,TFG模式为两电子转移过程。
K=120 mol/(L·s)
(30)
K=1.5×106 mol/(L·s)
(31)
![]()
(32)
O3+O2·-→O3-·+O2
K=(1.6±0.2)×109 mol/(L·s)
(33)
K=15 mol/(L·s)
(34)
K=140 mol/(L·s)
(35)
![]()
Ka=5.2×1010 mol/(L·s),
Kb=3.7×104 s-1
(36)
HO3·→·OH+O2
K=1.1×108 mol/(L·s)
(37)
后来根据不同实验结果对这2个机理进行修正,发展出SBH-1998、SBH-2009、TFG-2009和NGF等机理[40]。周鹏等[40]利用Acuchem软件模拟了O3链式分解过程,当pH=5和pH=7时,C-SBH-1998与实际结果拟合良好,当pH=10.5时,C-TFG-2009与实际结果拟合良好。
2.2 臭氧氧化法的影响因素
臭氧氧化法主要受pH、温度、O3投加量/投加方式、淬灭剂等影响。由反应原理可知:pH值影响O3与污染物的反应机制及反应动力学,酸性条件下O3与污染物的反应主要以直接氧化为主,反应速率常数k为10-1~102 mol/(L·s),当pH<4时,间接氧化作用可忽略不计;而在碱性条件下,主要以间接氧化为主,k为106~109 mol/(L·s)。当介质处于弱酸性与中性时,间接氧化以SBH模式为主;当处于碱性时,间接氧化以TFG模式为主。
温度影响O3在水体中的溶解度、稳定性及反应速率,升温会导致溶解度下降并加快O3分解,但升温有利提高反应速率。O3投加量直接影响污染物的降解效果。一般而言,增大O3投加量,污染物去除率会逐渐提高,但随着O3投加量的增加增幅逐渐减小,故O3投加量存在一个效果与经济均较佳的范围,因此要根据反应体系条件、处理目标、处理对象等确定;另外,还需要考虑到溴酸盐、甲醛等臭氧化副产物的生成问题。
投加方式影响传质过程。常见的投加方式有预投加、中间投加等。研究表明,多点布气和增加布气点数有助于O3传质,但当布气点数高于3个点时,传质效率无明显提高并容易导致出水O3浓度过高[41]。介质自由基淬灭剂如![]() 等会与污染物分子形成竞争,降低氧化效率。在实际应用中,可以通过加强预处理减少淬灭剂含量。
等会与污染物分子形成竞争,降低氧化效率。在实际应用中,可以通过加强预处理减少淬灭剂含量。
2.3 臭氧氧化法的优缺点
臭氧氧化技术的独特优势在于兼具消毒、脱色除臭的效果。可通过破坏致病菌的代谢酶、遗传物质或细胞膜的通透性等将微生物杀灭,其杀菌能力优于氯消毒,此外,O3可破坏碳氮双键、偶氮等发色或助色基团,还能氧化去除氨、硫化氢、甲硫醇等恶臭气体;无二次污染,剩余O3会自行分解并增加水体中的溶解氧;曝气有搅拌作用,可均匀物料、强化传质效果。
该技术面临的困境主要体现在O3产量低且利用率低、臭氧化副产物、设备腐蚀等方面。目前,生产O3的方法有介质阻挡放电法、紫外线法、电解法等,应用最广泛的介质阻挡放电法所产生的O3量不超过10%,大约85%的能量变为热量,能量浪耗严重且高温加剧O3分解。此外,气相O3浓度低和反应器传质效果差导致O3利用率低,可通过优化两相接触方式及其内部构件,如鼓泡扩散式、静态混合式、射流式、膜接触式、逆流接触式等,采用促传剂,降低表面张力,增加气泡溶解度,或外加电场、超声场等方式提高O3利用率。
O3还能将水体中Br-氧化为具有潜在致癌作用的溴酸盐,GB 5749—2006《生活饮用水卫生标准》中规定饮用水中溴酸根浓度不得超过0.01 mg/L;O3氧化有机物的过程中可能产生醛类如甲醛、乙醛、乙二醛等副产物,对人体产生危害。此外,O3还会对设备、管道部件等造成腐蚀。
2.4 臭氧氧化法的发展
结合物理场和投加均相或非均相催化剂可强化O3分解为自由基。其中,电场、光辐射等物理场向O3提供能量,使其激发分解为自由基,还可通过非均相或均相催化剂催化O3分解。
2.4.1 均相臭氧催化氧化法
Hewes等[42]发现,在Fe2+、Mn2+、Ni2+或者Co2+存在下,TOC去除率比O3单独氧化时更高。Bhat等[43]利用针铁矿催化O3氧化氯苯,发现比单独氧化更为高效。这些发现引起了人们对臭氧催化剂的广泛关注。目前,均相臭氧催化剂主要是一些过渡金属,如Cu2+、Zn2+、Fe2+、Mn2+、Ni2+、Co2+等。均相催化O3的机理主要有2类。
一类是金属离子直接催化O3分解,通过一系列电子转移过程产生·OH。例如,以Fe2+作为催化剂时,它会与O3形成中间体FeO2+,与H2O产生·OH,也可将Fe2+氧化为Fe3+,如式(38)—(40)所示[44]。Mn2+、Co2+、Ni2+催化O3的过程如式(41)—(46)所示[45-47]:
Fe2++O3→FeO2++O2
K=8.2×105 mol/(L·s)
(38)
FeO2++H2O→Fe3++·OH+OH-
K=1.3×10-2 mol/(L·s) (39)
FeO2++Fe2++2H+→2Fe3++H2O
(40)
Mn2++O3+H+→Mn3++·OH+O2
(41)
Co2++O3+H2O→Co(OH)2++·OH+O2
(42)
O3+·OH→HO2·+O2
(43)
Co(OH)2++HO2·→Co2++H2O+O2
(44)
Ni2++O3+H2O→Ni(OH)2++·OH+O2
(45)
Ni(OH)2++HO2·→Ni2++H2O+O2
(46)
通过比较不同金属对O3的催化过程,Wu等[48]总结了过渡金属均相催化O3的总反应式,如式(47)所示;当催化剂过量时,反而会淬灭·OH降低氧化效率,如式(48)所示。
M(n-1)++O3+H+→Mn++·OH+O2
(47)
M(n-1)++·OH→Mn++OH-
(48)
另一类均相催化O3机理是金属离子与有机物或者O3进行配位反应而促进O3和有机物的反应[49]。Pines等[50]在pH=6时,采用Co2+催化O3氧化草酸时发现存在另一种非自由基的反应路径:首先形成CoC2O4的络合物,再由O3氧化为Co(C2O4)+,该中间体易分解为Co3+和![]() 被O3、O2等氧化,如式(49)—(52)所示:
被O3、O2等氧化,如式(49)—(52)所示:
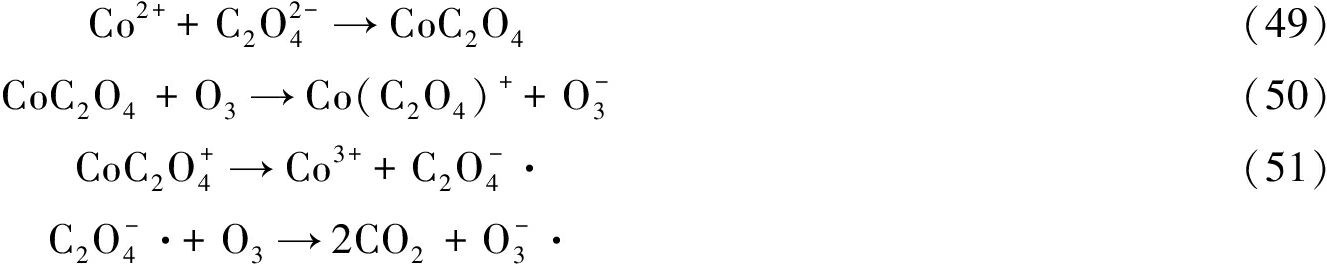
(52)
与其他O3氧化法类似,均相催化O3的反应路径及氧化效率与介质pH、O3浓度、催化剂投加量有关。一般地,均相催化反应的效率高于非均相催化反应,但由于均相催化剂主要以溶解态存在,回收难度大,需不断补充,一些催化剂流失可能会带来新的环境风险。
2.4.2 非均相臭氧催化氧化法
多年来,非均相催化剂的研究一直是O3氧化领域的热点。通常,非均相臭氧催化剂可分成金属氧化物(CuO、Fe2O3、MnO2、Al2O3等)、碳基材料(CNTs、石墨烯等)、矿物质、黏土、蜂窝陶瓷及以上材料的相互耦合。红外测试表明:低温下O3在氧化物表面存在物理吸附、与表面质子化羟基形成氢键或静电吸附、与Lewis位点发生化学吸附形成表面氧原子[51]。目前,非均相催化O3机理可分为自由基介导和非自由基介导,前者又可进一步分为自由基机理、氧空位机理、表面氧自由基机理等,后者主要指络合机理。
自由基机理认为,O3与氧化物表面羟基发生吸附分解产生![]() 和HO2·,并通过电子转移生成·OH氧化有机分子,如式(53)、(33)、(36)、(37)所示,CeO2、Al2O3等遵循该机理[52]。
和HO2·,并通过电子转移生成·OH氧化有机分子,如式(53)、(33)、(36)、(37)所示,CeO2、Al2O3等遵循该机理[52]。
![]()
(53)
氧空位机理认为,金属氧化物表面存在许多晶格缺陷,这些缺陷可能影响O3的分解路径,其中,磁性多孔尖晶石结构MeFe2O4含有大量氧空位(Me为金属元素,有Ni、Mn、Co等)。以NiFe2O4为例,当O3在氧化物表面发生化学吸附时,部分Ni2+被氧化为Ni3+,并产生![]() 与
与![]() 通过电子转移产生·OH,晶格氧将Ni3+还原为Ni2+,自身变成O2,形成空穴,在富氧条件下,空穴导电将O2还原为晶格氧,完成循环,如式(54)—(57)所示[53]:
通过电子转移产生·OH,晶格氧将Ni3+还原为Ni2+,自身变成O2,形成空穴,在富氧条件下,空穴导电将O2还原为晶格氧,完成循环,如式(54)—(57)所示[53]:
Ni2+—Fe2O4—OH-+O3→Ni2+—Fe2O4—OH-—O3
(54)
![]()
(55)
4Ni3++2O2-→4Ni2++O2
(56)
O2+4e-→2O2-
(57)
表面氧自由基机理认为,对于n型氧化物,O3在其表面吸附会生成氧自由基[43],其标准氧化电位为2.42 V,高于O3,有助于氧化有机分子。
络合机理认为,因过渡金属具有空的d轨道,而大部分有机物含有苯环、双键等电子云密度高的官能团,二者间易于形成金属有机配合物,O3与配合物反应而实现有机分子的氧化[54]。例如,采用CeO2负载CuO处理草酸时发现Cu(Ⅱ)会与![]() 形成络合物,二价铜草酸络合物被O3氧化为极不稳定的三价铜草酸络合物,在配体分子内发生电子转移重新形成Cu(Ⅱ)并产生强还原性的
形成络合物,二价铜草酸络合物被O3氧化为极不稳定的三价铜草酸络合物,在配体分子内发生电子转移重新形成Cu(Ⅱ)并产生强还原性的![]() 被O2、O3氧化,如式(58)—(60)所示[55]:
被O2、O3氧化,如式(58)—(60)所示[55]:
![]()
(58)
![]()
(59)
![]()
(60)
可见,非均相臭氧催化剂表面的活性位点为Lewis位点和表面含氧官能团,如表面羟基。可控性调节这2种催化位点被认为是臭氧催化剂研究的前沿方向之一。研究发现,通过Ti掺杂可提高γ-Al2O3催化剂表面Lewis位点强度,原因是Al-O-Ti键的生成,由于Al的电负性强于Ti,Al-O-Ti键的电子云密度偏向Al,使Ti表现出缺电子特性,Ti的价态由掺杂前+3上升为掺杂后的+4,即增强了表面Lewis位点强度[56]。
在实际工程中,该技术表现出较强的应用潜力。洪浩峰等[57]将CuO、NiO等金属氧化物负载在蜂窝陶瓷、活性炭、活性氧化铝等载体上催化O3氧化印染废水,发现采用活性炭负载Fe、Cu、Mn、Ni、Ba的氧化物处理该废水均有效果,载铁型催化剂活性较高,在O3浓度为10 mg/L,pH=6的条件下,处理1 h后,COD去除率达到86%,且重复使用12次后,去除率仍可达到86%。Zhang等[58]将焦化污泥制成生物炭催化O3降解0.1 L浓度为0.2 g/L的苯酚废水,在催化剂量为1 g/L,O3浓度和流量分别为14 mg/L和1 L/min的条件下处理0.5 h,苯酚降解率可达95.4%,而O3单独降解率仅为58.2%。Wu等[59]采用CTAB修饰后的NiO催化氧化焦化废水的生物出水,在pH=7.1,ρ(O3)为30 mg/L,流量为1 L/min,催化剂投加量为2 g/L,ρ(COD)为90 mg/L,ρ(TOC)为30 mg/L的条件下,处理1 h后UV254降低97%,7 h后TOC去除率达到100%,且催化剂在连续重复使用5次后,矿化率依然在95%以上。Martins等[60]采用Mn-Ce-O及N-150催化O3降解制药废水中的新诺明和双氯灭痛,相比于O3单独降解,每毫克O3可处理的COD量由0.067 mg增至0.10 mg。
非均相臭氧催化技术受催化剂及其表面性质、pH、有机分子的性质等因素影响。催化剂性质如晶胞大小、比表面积、表面活性位点的数量以及零电点等,主要受制备方法及条件的影响。Zhang等[61]分别采用水热法和溶胶凝胶法合成ZnFe2O4用于降解苯酚废水,发现水热法制备的ZnFe2O4具有更大的比表面积和更强的催化活性,在pH=6.38,ρ(O3)为14 mg/L,流量为1 L/min,ρ(苯酚)为300 mg/L的条件下,O3单独氧化处理0.5 h后,苯酚去除率达到63.4%;在相同条件下,采用溶胶凝胶法制备的催化剂催化氧化苯酚后,其去除率并无显著提高,而采用水热法制备的ZnFe2O4催化氧化后,苯酚去除率高达92.6%。
pH影响非均相催化反应的路径。Beltrán等[62]研究发现,当pH=2~6时,O3在催化剂表面吸附分解为氧原子,与H2O生成·OH,若以S代表催化剂表面的活性位点,反应如式(61)—(64)所示。当pH>6时,体系中OH-在催化剂上形成表面羟基,进而催化O3生成·OH,反应如式(65)—(68)所示。另外,体系pH与催化剂的零电点(pHPZC)之间的关系将影响催化剂表面羟基形态及O3吸附。当pH![]() 的形式存在,更有利于O3吸附;当pH>pHPZC,催化剂表面羟基发生去质子化,主要以—O-的形式存在,分别如式(69)—(70)所示[63]:
的形式存在,更有利于O3吸附;当pH>pHPZC,催化剂表面羟基发生去质子化,主要以—O-的形式存在,分别如式(69)—(70)所示[63]:
O3+S O3—S
O3—S
(61)
O3—S O—S+O2
O—S+O2
(62)
O3+O—S S+2O2
S+2O2
(63)
O—S+H2O S+·OH+OH-
S+·OH+OH-
(64)
OH-+S HO—S
HO—S
(65)
O3+HO—S ·O3—S+·OH
·O3—S+·OH
(66)
·O3—S ·O—S+O2
·O—S+O2
(67)
![]()
(69)
HO—S+OH- SO-+H2O
SO-+H2O
(70)
相较于均相臭氧催化剂,非均相臭氧催化剂具有容易回收、可重复利用、成本较低、改良空间大等优点,在去除难生物降解的有机污染物方面极具应用潜力。
目前,臭氧氧化技术的发展方向是增强O3传质以提高利用率,以及提高O3转化为·OH的效率。从宏观上,体现为新型臭氧反应器和催化剂的研发。新型反应器的开发方面,主要围绕O3的原位产生、气体的均匀分布、梯级利用及微气泡应用。催化剂方面,集中在金属氧化物、分子筛或碳基材料的掺杂以及催化材料的形貌调控,如在沸石负载铈、铁、锰等氧化物,金属掺杂于碳纳米管,金属氧化物修饰另一种金属氧化物等。
3 光催化氧化
3.1 光催化氧化法的基本原理
光催化技术目前主要应用于空气净化、土壤修复、水处理领域。光降解可分为直接光解和间接光解。直接光解是指在光作用下,有机物吸收光能发生分解或达到激发态与其他物质反应。间接光解是指介质中某些物质吸收光能后达到激发态,诱导有机分子发生反应。间接光解还分为非催化和催化过程,前者多采用氧化剂如H2O2、O3等,在光照下产生活性物种降解污染物;后者则是光催化氧化过程,它是指在光照下,通过加入催化剂,使催化剂受到激发产生电子-空穴对,吸附在表面的O2、H2O在电子-空穴对作用下生成·OH等;它还可分为均相催化和非均相催化,前者主要以Fe2+或Fe3+、H2O2为介质,通过光Fenton反应生成·OH等。后者则采用TiO2、WO3、Fe2O3等半导体材料通过光催化作用降解有机污染物。以研究最为广泛的TiO2为例,当照射光子能量等于或超过其禁带宽度(3.2 eV)时,光激发电子由价带进入导带,产生强氧化性的空穴,可夺取表面羟基、H2O或有机分子的电子,使之活化。此外,具有强还原性的电子可结合表面吸附的O2生成![]() 结合电子、H+原位生成H2O2,电子还可与H2O2作用直接生成·OH,如式(71)—(76)所示[64]。但是,若催化剂表面没有电子和空穴捕获剂,则电子和空穴将在几ns内复合,如式(77)所示:
结合电子、H+原位生成H2O2,电子还可与H2O2作用直接生成·OH,如式(71)—(76)所示[64]。但是,若催化剂表面没有电子和空穴捕获剂,则电子和空穴将在几ns内复合,如式(77)所示:
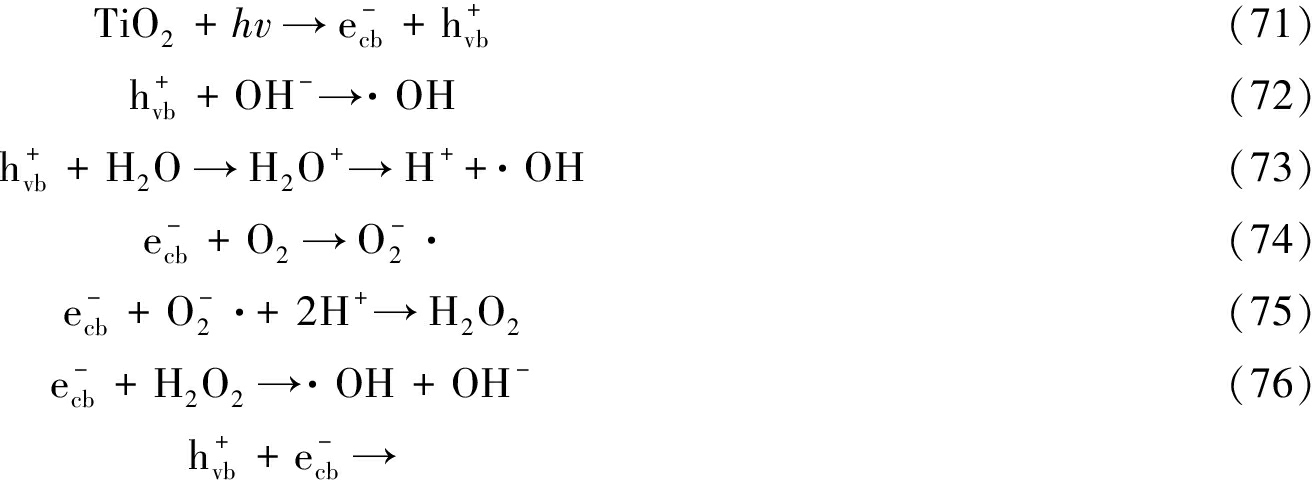 热量
热量
(77)
3.2 光催化氧化法的影响因素
影响该过程的因素主要有光强、pH、催化剂性质及用量、盐分等。由光催化原理可知:光子能量需要≥半导体的禁带宽度,电子才可激发跃迁至导带。另外,光强还可能影响降解速率。Vinodgopal等[65]研究表明,当光强<1×10-5mol/(m2·s)时,降解速率与光强存在线性关系,当光强>2×10-5 mol/(m2·s)时,降解速率与光强的平方根呈线性关系,但当光强>6×10-5 mol/(m2·s)时,可能存在中间体的竞争性复合,导致降解速率无法提高。
就催化剂而言,pH值影响半导体带边电位的移动,增加pH值有利于增强导带电子的还原能力。就有机物而言,pH值影响有机分子的溶解性和表面荷电。
催化剂晶相及其颗粒大小等因素对光催化均有影响,例如在TiO2的3种晶型中,锐钛矿型的表面活性位点较多,因而具有更高的光催化活性[66]。当颗粒直径<10 nm时,由于量子尺寸效应,导致能带变宽,吸收光谱蓝移,有助于提高催化活性[67]。催化剂用量存在着最佳范围,一定条件下,增加催化剂用量,光利用率、光催化降解效率均有增加;但过量催化剂可能影响溶液的透光性,降低光的利用率[68]。
盐分对光催化的影响与盐的种类及反应条件有关,影响机制主要为盐分与有机分子、H2O或OH-等发生竞争性吸附甚至是竞争性反应[66]。
3.3 非均相光催化氧化法的优缺点
相较于其他技术,非均相光催化氧化的优势在于能有效吸收部分太阳光,减少光能输入,且催化剂自身具有高化学稳定性、廉价、无毒等特点;反应条件温和,无须高温、高压;此外,光催化设备结构简单、容易操作。
但该技术仍未实现大规模工业化应用,主要受制于光利用率低、光催化效率低、透光性影响、催化剂流失等问题。例如,TiO2只吸收λ<387 nm的光辐射,该部分能量只占太阳光的小部分,未能充分利用太阳能,并且还受季节、昼夜、天气等因素影响,难以稳定运行;此外,其光量子效率低,不超过4%,但通过对TiO2进行改性后,光量子效率可提高至92%[69]。低反应速率、电子-空穴对的高复合率是导致光催化效率低的重要原因。另外,当有机物浓度过高时,废水透光性下降会导致光催化效率降低。该技术还面临着催化剂回收问题,减少催化剂流失,可有效减缓对环境的二次污染带来的经济效益,因而催化剂固定化技术得到发展及重视,可将其制成膜状负载于空心球、沙子、玻璃等载体,以减少流失。
3.4 光催化氧化法的应用及发展
在应用方面,You等[70]采用1 g/L的Bi2O3-TiO2在可见光(λ>420 nm,100 mW/cm2)下还原和降解100 mL浓度分别为20 mg/L和5 mg/L的Pb(Ⅱ)与DBP废水,单独处理4 h后,去除率均为23%,远高于Bi2O3和TiO2单独催化的效果;此外,在相同条件下处理Pb(Ⅱ)和DBP的混合废水,Pb(Ⅱ)和DBP的去除率分别为39%和43%,归因于光生电子和空穴的有效分离。Baran等[71]探究了一系列Pt、Cr改性的TiO2在可见光下光催化降解VOCs,在Cr2O72--TiO2催化作用下22 h内可将浓度为0.9 mmol/L的丙酮完全矿化。Li等[72]采用1 g/L的2D无机配位聚合物![]() 在可见光(15.5 W/m2)下降解亚甲基蓝和焦化废水。处理50 mL浓度为50 mg/L的亚甲基蓝废水25 min后,降解率为85%;处理10 h后,焦化废水的ρ(TOC)从1365 mg/L降至121 mg/L。Li等[73]还采用吸电子基团对MIL-101(Fe)和UIO-66进行一系列改性并用于光催化降解100 mL浓度为1 mg/L的含菲废水,在紫外光照射、催化剂投加量为0.5 g/L的条件下处理2 h后,MIL-101(Fe)-OH可光催化降解99.98%的菲,同时证明了将没有参与配位的吸电子基团引入MOFs中可调节光催化剂电负性,从而提高光催化性能。
在可见光(15.5 W/m2)下降解亚甲基蓝和焦化废水。处理50 mL浓度为50 mg/L的亚甲基蓝废水25 min后,降解率为85%;处理10 h后,焦化废水的ρ(TOC)从1365 mg/L降至121 mg/L。Li等[73]还采用吸电子基团对MIL-101(Fe)和UIO-66进行一系列改性并用于光催化降解100 mL浓度为1 mg/L的含菲废水,在紫外光照射、催化剂投加量为0.5 g/L的条件下处理2 h后,MIL-101(Fe)-OH可光催化降解99.98%的菲,同时证明了将没有参与配位的吸电子基团引入MOFs中可调节光催化剂电负性,从而提高光催化性能。
目前,光催化的发展方向在于研发新型光反应器和半导体光催化剂。在催化剂方面,通过掺杂金属(Ag、Pt等)、半导体金属氧化物(Fe2O3、CdS等)、无机原子(N、C、S等)等方式,以拓宽其吸收光谱范围,减缓电子-空穴对复合,例如,利用SnO2导带电位低于TiO2,而价带电位高于TiO2的特点,将二者耦合作为电极后,TiO2光生电子传至SnO2的导带,SnO2的空穴陷于TiO2的价带,有效抑制电子-空穴对复合[65]。在反应器设计方面,光源分为紫外光和可见光源,可见光源较为节能,但光能利用率普遍不高,故现阶段一般采用氙灯、汞灯等紫外光源;光照方式分为聚光型及非聚光型;催化剂的负载方式有悬浮型和固定型;反应器的形状主要有平板式、箱式、管式等。目前,光反应器正朝着高效、大型、透光良好、操作简单、经济投资及运行的方向发展。
4 电化学氧化
4.1 电化学氧化法的基本原理
随着AOPs的兴起,出现了利用电化学方法处理废水的技术。目前,该类技术发展了许多稳定高效的电极材料,DSA 电极(dimension stable anodes)、BDD 电极(boron-doped diamond anodes)、Ebonex 电极、NTA 电极(nanotube arrays)等。
电化学氧化是指利用电场直接氧化或间接产生![]() 等自由基降解污染物。其机制主要分为阳极直接氧化和间接自由基氧化。前者是指吸附在阳极的有机分子因失去电子而被氧化,但降解能力有限;后者是指通过电极反应产生
等自由基降解污染物。其机制主要分为阳极直接氧化和间接自由基氧化。前者是指吸附在阳极的有机分子因失去电子而被氧化,但降解能力有限;后者是指通过电极反应产生![]() 等自由基或O3、H2O2等氧化剂氧化有机分子。在水相中,H2O在阳极表面被氧化成吸附态的·OH,也可能分解产生O2、H2O2等。此外,还可能使阳极材料进一步转化为更高价的氧化态MO,如式(78)—(83)所示[74]:
等自由基或O3、H2O2等氧化剂氧化有机分子。在水相中,H2O在阳极表面被氧化成吸附态的·OH,也可能分解产生O2、H2O2等。此外,还可能使阳极材料进一步转化为更高价的氧化态MO,如式(78)—(83)所示[74]:
M+H2O→M(·OH)+H++e-
(78)
M(·OH)+R→M+xCO2+yH2O+H++e-
(79)
2 M(·OH)→2 M+H2O2
(80)
2 M(·OH)→2 M+O2+2H++2e-
(81)
M(·OH)→MO+H++e-
(82)
MO+R→M+RO
(83)
4.2 电化学氧化法的影响因素
电化学氧化过程主要受电极材料、操作条件、介质条件等影响。电极材料的性质可从催化活性、反应速率、竞争反应等方面直接影响对污染物的降解性能,不同电极材料,其反应速率可能发生数量级的变化。另外,选择析氧电位较高的电极材料可避免因发生析氧反应而浪费能量。关键性操作条件包含电流密度、电极间距。孙凤坤[75]在采用电化学法降解磺胺二甲基嘧啶时发现,在相同时间内,电流密度越大,单位时间内·OH产量越大,去除率越高;电极间距在1~2 cm时,去除率不断提高,在2~5 cm时逐渐降低,电极间距过小容易发生浓差极化,过大导致反应速率下降,因此一般取1~2 cm为宜。介质条件如电解质浓度、pH、其他离子等均会对污染物降解效率产生影响。电解质有导电作用,电解质浓度过低导致降解速率降低,提高浓度有利于增强导电、提高电压效率。pH对体系中离子的存在形态、有机分子的表面荷电情况、电极寿命等均有影响,pH值对不同类型的电极和污染物影响机制不同。体系中其他离子如![]() 等具有竞争作用,但其在阳极产生氧化性较弱的
等具有竞争作用,但其在阳极产生氧化性较弱的![]() 也有助于去除污染物。
也有助于去除污染物。
4.3 电化学氧化法的优缺点
电化学氧化法的优势在于可去除全氟有机物(PFOCS),回收高浓度、有价值的金属,既避免二次污染,又带来经济效益;此外,污染物降解途径多样,兼具杀菌、电吸附等作用;且反应器占地小、操作简单、反应条件温和、可控性好,可根据有机负荷实时调节电流、电压等条件。
该技术的突破口在于解决电极污染和寿命、反应器设计、设备投资及运行成本等。在实际应用中,电极易受污染,导致活性降低,需要定期清洗、维护。若采用可溶性电极,使用寿命短、难回收、易对环境造成污染且电流效率低。在工程应用方面,缺乏传质均匀、运行稳定的大型电化学反应器,而且电极材料昂贵,耗电量高,大部分处在10~60 kW·h/m3。
4.4 电化学氧化法的应用及发展
Moraes等[76]采用TiO2-RuO2钛电极电解垃圾渗滤液,在电流密度为116 mA/cm2条件下处理3 h后,COD、TOC、色度、氨氮去除率分别为73%、57%、86%、49%。Liu等[77]采用自制的脉冲电晕放电装置降解焦化废水及其生物尾水,结果表明,在脉冲频率为800 Hz时,原水苯酚浓度由611 mg/L降至227 mg/L,硫氰酸盐浓度由348 mg/L降至64 mg/L,B/C值由0.14升至0.43,能效为常规臭氧氧化的3~4倍。Eleotério等[78]采用不同掺比的DSA电极降解初始ρ(COD)为670 mg/L且含抗生素的工业废水,在电流密度为40 mA/cm2、0.5 mol/L的Na2SO4下处理4 h后,溴己新、新诺明、甲氧苄啶的COD降解率分别为58%、48%、40%。
就该技术所面临的问题,通过耦合Fenton试剂、光照、超声等手段,以提高其氧化能力及处理范围。在机理方面,探讨不同类型污染物的降解机理,以针对特定、毒害强且难降解的废水设计专属的电极或反应器。目前,主要技术瓶颈在于电流效率低及电极寿命短,突破口在于电极材料、反应器的研发。常见的电极有DSA电极、BDD电极等。DSA电极是在金属基体如Ti、Zr上沉积SnO2、PbO2、IrO2等金属氧化物膜,其具有良好的催化活性,但析氧、析氯电位较低,且加工时因热膨胀系数不同,涂层与基体间易存在裂缝而脱落。针对前者,可通过金属掺杂提高析氧电位,如Ti/SnO2-Sb2O5、Ti/RuO2-Gd等;针对后者,在基体与涂层间添加中间层,以提高电极寿命[79]。BDD电极具有较高的催化活性及抗腐蚀能力,电流效率通常为51%~90%[80];在高温、硫酸浓度为3 mol/L,电流密度为10000 A/m2的条件下,电极寿命仍有264 h,但成本昂贵,造价为12000~18000 欧元/m2,是DSA电极的10倍[79]。目前,已研发出廉价、导电良好、耐腐蚀性强,但使用寿命短的Ebonex电极以及成本低廉、催化性能极高的蓝色TiO2纳米管电极(NTA)和亚氧化钛等电极,但这些新型电极的操作条件、工业化制备、环境影响仍不清晰,需要继续探索加以完善。在反应器设计方面,需考虑的因素有传质、传热、反应动力学、电极表面电流密度和电动势分布等,这些因素在反应器放大后可产生重要影响。虽然处理效率的小幅提升看似微不足道,但可能对节省吨水处理成本产生重要意义。目前,三维电极反应器解决了传统二维电极反应器的传质距离远、低电流效率等问题,COD降解率提升了10%~50%,且节能效果明显[81],但反应器内电压、电流分布不均匀、且容易发生电极堵塞等问题还需进一步解决。
5 物理氧化技术
在AOPs中,借助高温、高压、超声波、等离子体等物理作用导致介质性质变化或特殊作用产生自由基,该类技术主要包含湿式氧化法、超临界水氧化法和超声氧化法。其中,由于超声波主要作为传质和氧化的辅助手段而与其他AOPs联合应用,如超声Fenton技术、超声电化学技术等,鲜有单独应用,因此主要介绍前2种技术。
5.1 湿式氧化法(WAO)
早期WAO主要应用于处理市政污泥、回收造纸黑液中的碱液等。目前,国外已在含氰废水、垃圾渗滤液、煤气化废水等领域出现工业化应用,在我国总体处于试验阶段[68]。
湿式氧化在温度为150~320 ℃,压力为0.5~20 MPa下,以O2或空气作为氧化剂将有机分子矿化或分解至可生物降解的形态。其过程主要包含氧传质及化学反应,而化学反应过程普遍认为是自由基反应作为主导,分为引发、传递及淬灭阶段。在引发阶段,高温下O2和有机分子发生夺氢反应产生R·和HO2·[82];还有观点认为,O2在高温高压下分解为O·,与H2O反应产生·OH也是一条重要途径,如式(84)—(87)所示[83]。自由基传递阶段极其复杂,主要降解反应如式(2)、(3)、(88)、(89)所示。由于存在自由基之间的淬灭反应,其主要终止反应如式(90)—(92)所示。
RH+O2→R·+HO2·
(84)
RH+HO2·→R·+H2O2
(85)
O2→2O·
(86)
O·+H2O→2·OH
(87)
ROO·+RH→R·+ROOH
(88)
H2O2+RH→R·H2O+·OH
(89)
R·+R·→R-R
(90)
ROO·+R·→ROOR
(91)
ROO·+ROO·→ROH+R1COR2+O2
(92)
WAO法主要受温度、压力、氧化剂量、污染物性质及反应时间等影响。高温除了能加快氧化反应速率、降低液体黏度外,当温度超过150 ℃时,升温反而能增加氧气在水中的溶解度且高于室温下的溶解度,但是过高的温度将带来能耗及经济上的负担,故一般为150~280 ℃,压力影响氧分压和介质密度,若总压力过小导致氧分压不足,则氧传质将是控制步骤;此外,当压力升高时,水密度增大,相当于浓缩污染物,故降解率也有所提高,但对设备、能耗的要求也大大提高[84]。
在应用方面,王健[85]采用Co/Bi催化剂湿式催化氧化初始ρ(TOC)为443 mg/L的垃圾渗滤液,在220 ℃、1 MPa氧分压下处理2 h,TOC去除率接近70%。马明[84]分别采用湿式氧化及催化湿式氧化技术降解初始ρ(COD)为14 g/L含油废水,在305 ℃、14 MPa、H2O2投加量为200 mg/L的条件下处理9 min后,COD降解率达到81.5%;而在288 ℃、LiOH催化剂投加量为133 mg/L的条件下、H2O2投加量为188 mg/L,处理7 min后,COD降解率升至99%。
可见,该技术具有降解效率高、反应时间短、无须特殊氧化剂的优势。多数WAO工艺可在水力停留时间为0.5~1 h内,将高浓度废水COD降解80%以上,并改善废水的可生化性。由于采用O2作为氧化剂,故对环境友好且廉价易得。但是该技术要求高温高压,且中间产物大都为小分子有机酸,易腐蚀设备,对设备材料要求苛刻,投资费用很高。由于需要高温高压,故该技术仅适用于处理小流量高浓度废水。
基于上述问题,发展了湿式过氧氧化技术、催化湿式氧化技术。湿式过氧氧化技术是通过投加氧化电位更高的氧化剂来提高氧化效率,如H2O2、O3等。催化湿式氧化技术则是通过投加Cu2+、Fe2+、Co2+、CuO、CeO2等催化剂以降低反应所需的温度及压力。
5.2 超临界水氧化法(SCWO)
SCWO作为1种新型的绿色水处理技术,已在处置工业废料、剩余污泥、各类难降解废水上获得突破,而且也出现了多样的工业化集成设备和一些大型公司,如Modec、Organo等。
超临界水氧化技术是在温度为374 ℃、压力为22.05 MPa的条件下,利用超临界水的特殊性质,将有机污染物完全矿化,氮、硫等氧化为最高价态的盐[86]。超临界水的特点为低密度(临界点时密度为0.3 g/cm3)、低介电常数(临界点时约为5,接近非极性)、低黏度(低于3×10-4 Pa·s,高扩散性);低表面张力使气液相界面消失,传质迅速且均匀[87]。SCWO主要是自由基反应过程,其自由基反应与WAO相似,也有观点认为SCWO有别于WAO,因为超临界温度高于部分有机物的燃点而导致氧化燃烧[88]。
在应用方面,蔡毅等[89]在650 ℃、28 MPa、过氧比为2的条件下,处理初始ρ(COD)为128 g/L、ρ(氰化物)为1 g/L的丙烯腈剧毒废水,降解3 min后COD和氰化物几乎完全去除。马承愚等[90]在400 ℃、26 MPa、过氧比为2的条件下,处理初始ρ(COD)为22357 mg/L的垃圾渗滤液,处理250 s后COD降解率达到99.61%。赵保国等[91]在600 ℃、25 MPa、过氧条件下处理ρ(COD)为17094 mg/L的二硝基甲苯废水,降解2 min后,COD降解率达到99.83%。
可见,该技术的优势在于反应速率快、停留时间短、氧化效率极高、无二次污染。一般在1~10 min内可将有机物矿化,使重金属氧化固定,矿化率高达99.99%。由于降解彻底,排出物无须进一步处理即可填埋,且出水可回用。此外,当有机物含量>2%时,可利用反应热实现热量自补偿而无须外加热量。当前,阻碍该项技术大规模工业化的问题是盐沉积、设备腐蚀和传热问题。由于超临界水接近非极性,无机盐溶解度小,故进水及反应产生的盐分容易析出,造成堵塞;可通过对进水脱盐等预处理措施、反应器的结构优化改善盐沉积的问题,如逆流式反应器、离心式反应器、液化固体流化床等。高温高压、高浓度O2、酸性物质、盐分会对反应器造成严重的化学腐蚀,足够强度且耐腐蚀的材料或适宜催化剂是目前SCWO需要突破的关键点。
6 总 结
通过介绍5类经典AOPs产生活性物种的机理,从影响因素、优缺点2方面对各技术特征进行讨论,同时,根据其中的限制因素,展望了各技术的发展方向并举例介绍了它们在环境领域中的应用,以期呈现出AOPs的原理—技术—应用的基本脉络。目前,Fenton法和臭氧氧化法因其技术成熟,经济性优异,应用较为广泛;但随着对光催化、电化学、物理氧化研究的不断深入以及配套材料、反应器的逐步成熟,这些技术会逐渐得到应用并形成各自的工业装备及应用体系。
产生活性物种的方法有投加氧化剂、催化剂以及引入物理场等,AOPs的总体发展方向是合理利用各自的优势,对多种技术手段进行耦合,例如光Fenton、电Fenton、湿式催化氧化等。针对需要完善的具体技术,例如,在臭氧催化氧化、光催化氧化技术中,不断寻找高效、易回收的催化剂;在Fenton体系中,致力于药剂的替换和减量等。尽管经历了相当长时间的发展,AOPs仍然存在诸多尚未解决的问题,例如,在复杂的机理分析方面,尤其是催化氧化方面,一些活性物种的产生机理还存在争议,对许多污染物的降解历程还不明晰;技术方面集成化与产业化有待形成,具体表现为臭氧发生器的低产率、热损失、高能耗问题,超临界水氧化反应器材料抗腐蚀以及盐沉积问题,光催化氧化的量子效率在反应器上的表达问题等,工艺和材料的结合仍然成为技术产业化的瓶颈。
推测未来的高级氧化法趋向于寻求更多的新原理及其耦合以及更广泛的应用领域。前者包括生物氧化与还原、催化氧化、化学氧化与还原、电化学氧化、空化与超声波、电子束伽马辐照、等离子体、光催化氧化与还原、光化学降解、亚临界与超临界氧化等;后者涉及工业废水、地下水、自来水的净化与消毒处理,市政污水、医疗废水、垃圾渗滤液、污泥脱水,土壤修复过程中新兴污染物的转化等。此外,模型、材料、测量/监控、反应器和工程工艺等方向的新开发将成为AOPs技术发展的动力,AOPs与生物技术、膜技术等的结合,可以满足日益严格的环保法规与公众健康要求,成为一些领域传统处理技术的替代技术。
[1] GLAZE W H. Drinking-water treatment with ozone[J]. Environmental Science & Technology, 1987, 21(3): 224-230.
[2] MIKLOS D B, REMY C, JEKEL M, et al. Evaluation of advanced oxidation processes for water and wastewater treatment: a critical review[J]. Water Research, 2018, 139: 118-131.
[3] ROSENFELDT E J, LINDEN K G, CANONICA S, et al. Comparison of the efficiency of ·OH radical formation during ozonation and the advanced oxidation processes O3/H2O2 and UV/H2O2[J]. Water Research, 2006, 40(20): 3695-3704.
[4] STASINAKIS A S. Use of selected advanced oxidation processes (AOPs) for wastewater treatment: a mini review[J]. Global Nest Journal, 2008, 10(3): 376-385.
[5] AKPAN U G, HAMEED B H. Parameters affecting the photocatalytic degradation of dyes using TiO2-based photocatalysts: a review[J]. Journal of Hazardous Materials, 2009, 170(2): 520-529.
[6] BOCZKAJ G, FERNANDES A. Wastewater treatment by means of advanced oxidation processes at basic pH conditions: a review[J]. Chemical Engineering Journal, 2017, 320: 608-633.
[7] PIGNATELLO J J, OLIVEROS E, MACKAY A. Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemistry[J]. Critical Reviews in Environmental Science & Technology, 2006, 36(1): 1-84.
[8] OTURAN M A, AARON J J. Advanced oxidation processes in water/wastewater treatment: principles and applications: a review[J]. Critical Reviews in Environmental Science & Technology, 2014, 44(23): 2577-2641.
[9] WANG J L, XU L J. Advanced oxidation processes for wastewater treatment: formation of hydroxyl radical and application[J]. Critical Reviews in Environmental Science & Technology, 2012, 42(3): 251-325.
[10] CHENG M, LAI C, LIU Y, et al. Metal-organic frameworks for highly efficient heterogeneous Fenton-like catalysis[J]. Coordination Chemistry Reviews, 2018, 368: 80-92.
[11] LIN S H, LO C C. Fenton process for treatment of desizing wastewater[J]. Water Research, 1997, 31(8): 2050-2056.
[12] 陈传好,谢波,任源,等. Fenton试剂处理废水中各影响因子的作用机制[J]. 环境科学, 2000, 21(3): 93-96.
[13] KAVITHA V, PALANIVELU K. Destruction of cresols by Fenton oxidation process[J]. Water Research, 2005, 39(13): 3062-3072.
[14] 李春娟. 芬顿法和类芬顿法对水中污染物的去除研究[D]. 哈尔滨:哈尔滨工业大学, 2009.
[15] YOON J, LEE Y, KIM S. Investigation of the reaction pathway of ·OH radicals produced by Fenton oxidation in the conditions of wastewater treatment[J]. Water Science & Technology, 2001, 44(5): 15-21.
[16] 张旋,王启山. 高级氧化技术在废水处理中的应用[J]. 水处理技术, 2009, 35(3): 24-28.
[17] 刘晶冰,燕磊,白文荣,等. 高级氧化技术在水处理的研究进展[J]. 水处理技术, 2011, 37(3): 11-17.
[18] RUPPERT G, BAUER R, HEISLER G. The photo-Fenton reaction: an effective photochemical wastewater treatment process[J]. Journal of Photochemistry & Photobiology A Chemistry, 1993, 73(1): 75-78.
[19] ELMOLLA E S, CHAUDHURI M. Degradation of amoxicillin, ampicillin and cloxacillin antibiotics in aqueous solution by the UV/ZnO photocatalytic process[J]. Journal of Hazardous Materials, 2010, 173(1): 445-449.
[20] BENKELBERG H J, WARNECK P. Photodecomposition of iron(Ⅲ) hydroxo and sulfato complexes in aqueous solution: wavelength dependence of OH and ![]() quantum yields[J]. Journal of Physical Chemistry, 1995, 99(14): 5214-5221.
quantum yields[J]. Journal of Physical Chemistry, 1995, 99(14): 5214-5221.
[21] WANG Z H, MA W H, CHEN C C, et al. Photochemical coupling reactions between Fe(Ⅲ)/Fe(Ⅱ), Cr(Ⅵ)/Cr(Ⅲ), and polycarboxylates: inhibitory effect of Cr species[J]. Environmental Science & Technology, 2008, 42(19): 7260-7266.
[22] FENG J Y, HU X J, YUE P L, et al. Discoloration and mineralization of Reactive Red HE-3B by heterogeneous photo-Fenton reaction[J]. Water Research, 2003, 37(15): 3776-3784.
[23] ELMOLLA E, CHAUDHURI M. Optimization of Fenton process for treatment of amoxicillin, ampicillin and cloxacillin antibiotics in aqueous solution[J]. Journal of Hazardous Materials, 2009, 170(2): 666-672.
[24] MALATO S, BLANCO J, CáCERES J, et al. Photocatalytic treatment of water-soluble pesticides by photo-Fenton and TiO2 using solar energy[J]. Catalysis Today, 2002, 76(2): 209-220.
[25] HERMOSILLA D, CORTIJO M, HUANG C P. Optimizing the treatment of landfill leachate by conventional Fenton and photo-Fenton processes[J]. Science of the Total Environment, 2009, 407(11): 3473-3481.
[26] 张乃东,郑威. Fenton法在水处理中的发展趋势[J]. 化工进展, 2001, 20(12): 1-3.
[27] FOLLER P C, BOMBARD R T. Processes for the production of mixtures of caustic soda and hydrogen peroxide via the reduction of oxygen[J]. Journal of Applied Electrochemistry, 1995, 25(7): 613-627.
[28] LIU Z P, ZHONG X, AI Z H. Treatment of municipal sewage by electro-Fenton reaction using a nanoscale Fe/ACF composites cathode[J]. Journal of Huazhong Normal University, 2008,1:65-67.
[29] 方建章,李浩,雷恒毅. 电生成Fenton试剂处理染料废水[J]. 化工环保, 2004, 24(4): 284-287.
[30] KURT U, APAYDIN O, GONULLU M T. Reduction of COD in wastewater from an organized tannery industrial region by Electro-Fenton process[J]. Journal of Hazardous Materials, 2007, 143(1/2): 33-40.
[31] 田法. EDTA改性电-Fenton反应降解DMP的研究[D]. 南昌:南昌大学, 2007.
[32] QIANG Z M, CHANG J H, HUANG C P. Electrochemical generation of hydrogen peroxide from dissolved oxygen in acidic solutions[J]. Water Research, 2002, 36(1): 85-94.
[33] 戴丽雅,张宏波,王谦,等. 超声-芬顿法降解工业染料中间体废水[J]. 水处理技术, 2017(4): 76-78,84.
[34] MA Y, SUNG C. Investigation of carbofuran decomposition by a combination of ultrasound and Fenton process[J]. Sustainable Environment Research, 2010, 20(4): 213-219.
[35] GABRIEL J, SHAH V, NESMERAK K, et al. Degradation of polycyclic aromatic hydrocarbons by the copper(Ⅱ)-hydrogen peroxide system[J]. Folia Microbiologic, 2000, 45(6): 573-575.
[36] BEN-MOSHE T, DROR I, BERKOWITZ B. Oxidation of organic pollutants in aqueous solutions by nanosized copper oxide catalysts[J]. Applied Catalysis B: Environmental, 2009, 85(3): 207-211.
[37] FATHY N A, EL-SHAFEY S E, EL-SHAFEY O I, et al. Oxidative degradation of RB19 dye by a novel γ-MnO2/MWCNT nanocomposite catalyst with H2O2[J]. Journal of Environmental Chemical Engineering, 2013, 1(4): 858-864.
[38] NEMES A, Fã BIã N I N, GORDON G. Experimental aspects of mechanistic studies on aqueous ozone decomposition in alkaline solution[J]. Ozone Science & Engineering, 2000, 22(3): 287-304.
[39] BUEHLERR E, STAEHELIN J, HOIGNE J. Ozone decomposition in water studied by pulse radiolysis. 1. perhydroxyl (HO2)/hyperoxide ![]() as intermediates[J]. The Journal of Physical Chemistry, 1984, 88(12): 2560-2564.
as intermediates[J]. The Journal of Physical Chemistry, 1984, 88(12): 2560-2564.
[40] 周鹏,张静,李旺,等. 天然水体中臭氧链式分解模拟研究[J]. 黑龙江大学自然科学学报, 2013, 30(5): 658-663.
[41] 袁蓉芳,田烨,施春红,等. 臭氧接触池臭氧投加方式的优化[J]. 环境科学研究, 2013, 26(9): 1014-1021.
[42] HEWES C G, DAVISON R R. Renovation of waste water by ozonation[J]. Water, 1972,69:71-80.
[43] BHAT N N, GUROL M D. Oxidation of chlorobenzene by ozone and heterogeneous catalytic ozonation[C]∥27th industrial waste mid-at-lantic conference. bethlehem, PA, USA, 1995: 371.
[44] KASPRZYK-HORDERN B, ZIó EK M, NAWROCKI J. Catalytic ozonation and methods of enhancing molecular ozone reactions in water treatment[J]. Applied Catalysis B: Environmental, 2003, 46(4): 639-669.
EK M, NAWROCKI J. Catalytic ozonation and methods of enhancing molecular ozone reactions in water treatment[J]. Applied Catalysis B: Environmental, 2003, 46(4): 639-669.
[45] MA J, GRAHAM N J D. Preliminary investigation of manganese-catalyzed ozonation for the destruction of atrazine[J]. Ozone Science & Engineering, 1997, 19(3): 227-240.
[46] PINES D S, RECKHOW D A. Effect of dissolved cobalt(Ⅱ) on the ozonation of oxalic acid[J]. Environmental Science & Technology, 2002, 36(19): 4046.
[47] RAKITSKAYA T L, ENNAN A A, GRANATYUK I V, et al. Kinetics and mechanism of low-temperature ozone decomposition by Co-ions adsorbed on silica[J]. Catalysis Today, 1999, 53(4): 715-723.
[48] WU C H, KUO C Y, CHANG C L. Homogeneous catalytic ozonation of C.I. Reactive Red 2 by metallic ions in a bubble column reactor[J]. Journal of Hazardous Materials, 2008, 154(1): 748-755.
[49] 朱秋实,陈进富,姜海洋,等. 臭氧催化氧化机理及其技术研究进展[J]. 化工进展, 2014, 33(4): 1010-1014.
[50] PINES D S, RECKHOW D A. Effect of dissolved cobalt(Ⅱ) on the ozonation of oxalic acid[J]. Environmental Science & Technology, 2002, 36(19): 4046-4051.
[51] BULANIN K M, LAVALLEY J C, Tsyganenko A A. IR spectra of adsorbed ozone[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 1995, 101(2/3): 153-158.
[52] FARIA P C C, óRFãO J J M, PEREIRA M F R. A novel ceria-activated carbon composite for the catalytic ozonation of carboxylic acids[J]. Catalysis Communications, 2008, 9(11): 2121-2126.
[53] REN Y M, DONG Q, FENG J, et al. Magnetic porous ferrospinel NiFe2O4: a novel ozonation catalyst with strong catalytic property for degradation of di-n-butyl phthalate and convenient separation from water[J]. Journal of Colloid & Interface Science, 2012, 382(1): 90-96.
[54] KASPRZYK-HORDERN B, ANDRZEJEWSKI P, BROWSKA A D J M, et al. MTBE, DIPE, ETBE and TAME degradation in water using perfluorinated phases as catalysts for ozonation process[J]. Applied Catalysis B: Environmental, 2004, 51(1): 51-66.
[55] ZHANG T, LI W W, CROUé J P. A non-acid-assisted and non-hydroxyl-radical-related catalytic ozonation with ceria supported copper oxide in efficient oxalate degradation in water[J]. Applied Catalysis B Environmental, 2012, 121/122(25): 88-94.
[56] BING J S, HU C, ZHANG L L. Enhanced mineralization of pharmaceuticals by surface oxidation over mesoporous γ-Ti-Al2O3 suspension with ozone[J]. Applied Catalysis B Environmental, 2017, 202: 118-126.
[57] 洪浩峰,潘湛昌,徐阁,等. 活性炭负载催化剂臭氧催化氧化处理印染废水研究[J]. 工业用水与废水, 2010, 41(3): 29-33.
[58] ZHANG F Z, WU K Y, ZHOU H T, et al. Ozonation of aqueous phenol catalyzed by biochar produced from sludge obtained in the treatment of coking wastewater[J]. Journal of Environmental Management, 2018,224: 376-386.
[59] WU K Y, ZHANG F Z, WU H Z, et al. The mineralization of oxalic acid and bio-treated coking wastewater by catalytic ozonation using nickel oxide[J]. Environmental Science and Pollution Research, 2018, 25(3): 2389-2400.
[60] MARTIUS R C, CARDOSO M, DANTAS R F, et al. Catalytic studies for the abatement of emerging contaminants by ozonation[J]. Journal of Chemical Technology & Biotechnology, 2015, 90(9): 1611-1618.
[61] ZHANG F Z, WEI C H, HU Y, et al. Zinc ferrite catalysts for ozonation of aqueous organic contaminants: phenol and bio-treated coking wastewater[J]. Separation and Purification Technology, 2015, 156(2): 625-635.
[62] BELTRáN F J, RIVAS F J, FERNáNDEZ L A, et al. Kinetics of catalytic ozonation of oxalic acid in water with activated carbon[J]. Industrial & Engineering Chemistry Research, 2002, 41(25): 6510-6517.
[63] ZHANG T, LI C J, MA J, et al. Surface hydroxyl groups of synthetic α-FeOOH in promoting ·OH generation from aqueous ozone: Property and activity relationship[J]. Applied Catalysis B: Environmental, 2008, 82(1): 131-137.
[64] RAO Y F, CHU W. Reaction mechanism of linuron degradation in TiO2 suspension under visible light irradiation with the assistance of H2O2[J]. Environmental Science & Technology, 2009, 43(16): 6183-6189.
[65] VINODGOPAL K, KAMAT P V. Enhanced rates of photocatalytic degradation of an azo dye using SnO2/TiO2 coupled semiconductor thin films[J]. Environmental Science & Technology, 1995, 29(3): 841-845.
[66] 雷乐成. 水处理高级氧化技术[M]. 哈尔滨:哈尔滨工业大学出版社, 2007.
[67] 宋爽. 纳米二氧化钛光催化氧化技术处理垃圾渗滤液的研究[D]. 西安:长安大学, 2010.
[68] 刘祥英,邬腊梅,柏连阳,等. TiO2光催化降解农药研究新进展[J]. 中国农学通报, 2010, 26(12): 203-208.
[69] LIU M, INDE R, NISHIKAWA M, et al. Enhanced photoactivity with nanocluster-grafted titanium dioxide photocatalysts[J]. ACS Nano, 2014, 8(7): 7229-7238.
[70] YOU S Z, HU Y, LIU X C, et al. Synergetic removal of Pb(Ⅱ) and dibutyl phthalate mixed pollutants on Bi2O3-TiO2 composite photocatalyst under visible light[J]. Applied Catalysis B: Environmental, 2018,232:288-298.
[71] BARAN T, MACYK W. Photocatalytic oxidation of volatile pollutants of air driven by visible light[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2012, 241(4): 8-12.
[72] LI S X, FENG Z T, HU Y, et al. In-situ synthesis and high-efficiency photocatalytic performance of Cu(Ⅰ)/Cu(Ⅱ) inorganic coordination polymer quantum sheets[J]. Inorganic Chemistry, 2018, 57(21): 13289-13295.
[73] LI S X, SUN S L, WU H Z, et al. Effects of electron-donating groups on the photocatalytic reaction of MOFs[J]. Catalysis Science & Technology, 2018, 8(6): 1696-1703.
[74] MARTINEZ-HUITLE C A, BRILLAS E. Decontamination of wastewaters containing synthetic organic dyes by electrochemical methods: a general review[J]. Applied Catalysis B: Environmental, 2009, 87(3/4): 105-145.
[75] 孙凤坤. 电化学氧化法去除磺胺二甲基嘧啶及其产物研究[D].邯郸: 河北工程大学, 2018.
[76] MORAES P B, BERTAZZOLI R. Electrodegradation of landfill leachate in a flow electrochemical reactor[J]. Chemosphere, 2005, 58(1): 41-46.
[77] LIU M, PREIS S, KORNEV I, et al. Pulsed corona discharge for improving treatability of coking wastewater[J]. Journal of Environmental Sciences, 2018, 64(2): 306-316.
[78] ELEOTéRIO I C, FORTI J C, de Andrade A R. Electrochemical treatment of wastewater of veterinary industry containing antibiotics[J]. Electrocatalysis, 2013, 4(4): 283-289.
[79] 樊广萍,谢江坤,李睦,等. 电化学氧化技术在废水处理中的应用研究[J]. 净水技术, 2016,35(6): 30-36.
[80] CHEN X M, GAO F R, CHEN G H. Comparison of Ti/BDD and Ti/SnO2-Sb2O5 electrodes for pollutant oxidation[J]. Journal of Applied Electrochemistry, 2005, 35(2): 185-191.
[81] ZHANG C, JIANG Y H, LI Y L, et al. Three-dimensional electrochemical process for wastewater treatment: a general review[J]. Chemical Engineering Journal, 2013, 228(14): 455-467.
[82] LUCK F. Wet air oxidation: past, present and future[J]. Catalysis Today, 1999, 53(1): 81-91.
[83] SHIBAEVA I V, METALITSA D I, DENISOV E T. Oxidation of phenol with molecular oxygen in aqueous solution-2[J]. Kinetics & Catalysis, 1969, 10(6): 1022-1026.
[84] 马明. 湿式氧化法处理含油废水研究[D]. 大庆:东北石油大学, 2017.
[85] 王健. 催化湿式氧化降解垃圾渗滤液模拟废水的研究[D]. 长春:吉林大学, 2008.
[86] 石德智,张金露,胡春艳,等. 超临界水氧化技术处理污泥的研究与应用进展[J]. 化工学报, 2017, 68(1): 37-49.
[87] 吴锦华,韦朝海. 催化超临界水氧化废水处理技术的研究进展[J]. 环境工程, 2002, 20(4): 7-10.
[88] SERIKAWA R M, USUI T, NISHIMURA T, et al. Hydrothermal flames in supercritical water oxidation: investigation in a pilot scale continuous reactor[J]. Fuel, 2002, 81(9): 1147-1159.
[89] 蔡毅,马承愚,彭英利,等. 超临界水氧化法处理丙烯腈剧毒废水的实验研究[J]. 工业水处理, 2006, 26(3): 42-44.
[90] 马承愚,朱飞龙,彭英利,等. 超临界水氧化法处理垃圾渗滤液的试验研究[J]. 中国给水排水, 2008, 24(1): 102-104.
[91] 赵保国,刘玉存,常双君. 超临界水氧化处理二硝基甲苯废水研究[J]. 火炸药学报, 2007, 30(2): 71-74.