0 引 言
我国存在严重的水资源短缺、水环境污染等问题, 制约着社会的可持续发展[1,2]。而污水再生利用是解决这一问题的重要战略和必要途径[3,4]。污水经过再生后可广泛应用于农业灌溉、景观水体、城市绿化和工业用水等多种用途[5,6]。污水再生处理工艺众多,其中反渗透(reverse osmosis,RO)工艺能截留除水分子以外几乎所有污染物,具有产水水质稳定、脱盐率高、有机物去除率高、可自动化控制、占地面积小等优势[7-10],因而被广泛应用于高品质再生水的生产[11,12]。
在反渗透工艺流程中,除反渗透膜单元外,还包括复杂的预处理系统和加药系统,以防止膜污堵[13],保障反渗透工艺长期稳定运行[14]。反渗透膜的主要污堵机理包括颗粒物/胶体污堵、无机结垢、有机物污堵和生物污堵。在不同种类的污堵中,生物作用是造成反渗透膜膜面污堵的重要原因,因为生物能利用有机物生长,同时分泌有机物造成更严重的污堵[15,16]。研究表明,生物污堵是反渗透系统运行过程中最重要的问题之一[13,17]。膜面形成生物膜污堵的过程为:随着细菌在膜面的附着、吸附和再生长,以及胞外多聚物的分泌,会形成生物膜;当生物膜达到一定厚度和膜表面覆盖度,造成产水量下降时,即形成生物污堵[18,19]。
膜面的微生物会分泌一系列代谢产物,其中最重要的是胞外多聚物(extracellular polymeric substances,EPS)。EPS由多糖、蛋白质、核酸等物质组成,是生物膜的骨架结构,决定生物膜的物理特性,包括物质传输、吸附特性及稳定性[20-23]。EPS污染层会导致流体过膜阻力升高,从而降低反渗透膜通量;并且EPS中的多糖类物质更容易吸附到反渗透膜上[24]。另外,前期研究表明,不同种属细菌的EPS组成和膜污堵特性差异巨大,EPS中大分子量物质是导致RO膜污堵的关键组分[25]。
反渗透膜污堵会导致膜通量下降、进水压力上升、能源消耗增加等问题,酸性副产物还会导致膜的生物降解[26-28]。同时生物污堵较难控制,由于RO膜不能接触氧化剂,细菌易在膜面再生长,清洗难度也较大。
目前,氯消毒是控制RO膜生物污堵常用的预处理方式。但是氯消毒对于控制反渗透膜污堵并不总是有效的,甚至有加重污堵的实例[29]。前期研究表明,氯消毒不能完全杀灭二级出水中的细菌,并且会改变剩余细菌群落结构,影响细菌的分泌产物,进而影响膜污堵特性[30]。然而,现有研究仅揭示了氯消毒能改变再生水中微生物群落结构,进而可能造成更严重的膜污堵现象,尚未系统研究其他消毒方法对膜污堵的控制效果。
与氯消毒相比,从消毒副产物控制、运行和投资费用等来看,紫外线消毒是相对安全、经济的消毒方式,近年来其在污水和再生水消毒中的应用越来越广泛[31-32]。然而,紫外线消毒对污水再生处理反渗透膜生物污堵的影响目前未见报道。并且,现有研究仅确定了微生物分泌产物EPS是造成反渗透膜污堵的重要原因[25],尚未深入研究消毒方法及剂量对微生物EPS的产生及污堵特性的影响程度。
针对上述问题,本研究全面探索了紫外线消毒对再生水中细菌的生长特性、群落结构和分泌特性的影响,从而为城市污水再生处理反渗透系统前处理工艺的选择提供理论指导。
1 材料与方法
1.1 实验试剂与仪器
实验试剂:水样,取自北京某再生水厂膜生物反应器(membrane bio-reactor,MBR)工艺出水,取样后置于10 L桶中,在4 ℃条件下保存;R2A琼脂,北京安鑫康科技有限公司;琼脂粉,北京翰隆达科技发展有限公司;氯化钠,国药集团化学试剂北京有限公司;改良型lowry 法蛋白浓度测定试剂盒(Modified Lowry Protein Assay Kit),赛默飞世尔科技(中国)有限公司;蒽酮,赛谱锐思(北京)科技有限公司;硫酸,北京蓝弋化工产品有限责任公司;葡萄糖(分析纯),天津市鼎盛鑫化工有限公司。
主要仪器:HPS-280生化培养箱;日立CR22G高速离心机;岛津TOCVCPH型总有机碳分析仪;酶标仪(MD SpectraMax M5);日立F7000型荧光分光光度计。
1.2 紫外线消毒
紫外线剂量的计算公式为[33]:
UV剂量(mJ/cm2)=平均光强(mW/cm2)×
水因子×时间(s)
(1)
其中:
水因子=(1-10-al)/alln10
(2)
式中:a为1 cm液层厚度时的吸收度,cm-1;l为容器中液层厚度,cm。
由式(1)可看出:通过控制紫外线照射时间可以调节紫外线消毒剂量。将20 mL MBR工艺二级出水置于底面直径为6 cm的圆柱形玻璃皿中,其液层厚度为1 cm。根据目前污水再生处理工艺中常用的紫外线剂量[34],设置本研究的紫外线剂量为0,20,40,80 mJ/cm2,分别消毒水样。
1.3 分析方法
1.3.1 微生物生长特性的分析方法
将经过不同剂量紫外线消毒后的水样分别接种至300 mL标准R2A培养基,在150 r/min摇床上25 ℃条件下培养至稳定期,此期间定期用酶标仪测定各组的OD600,并绘制细菌生长曲线,分析其生长特性。
1.3.2 微生物群落结构与多样性的分析方法
将培养至稳定期的菌液离心去除培养基后送样进行16SrRNA高通量测序,分析紫外线消毒对再生水中微生物群落结构的影响。根据测定结果绘制成的群落组成柱状图分析各组的群落结构,根据测定的α多样性指数(observed species、Shannon、Simpson指数)分析其物种多样性。
1.3.3 微生物分泌特性的分析方法
将培养至稳定期的菌液离心去除培养基并提取EPS,测定EPS总量(DOC)和各组分含量(蛋白质、多糖),以及其分子量分布,并进行三维荧光光谱分析。将培养后洗去培养基的细菌稀释成溶液进行平膜实验,评价紫外线消毒前后细菌溶液对反渗透膜的污堵潜势。
1.4 反渗透系统
为研究紫外线消毒后水中细菌经培养后形成的溶液对反渗透膜污堵潜势,在实验室搭建平膜错流反渗透系统模拟装置。操作条件为:将海德能Proc 10型号反渗透膜(低压膜)切割为直径32 mm、面积为8.04 cm2的圆形膜片,操作方式为浓水无回流,恒定压力为1.2 MPa,进水流量为1.0 mL/min,平均错流速度为21 cm/s,初始通量约为60 L/(m2·h),每组总进水量约为3 L。将剂量为80 mJ/cm2的紫外线消毒后的水样接种至标准R2A培养基培养至稳定期,离心去除培养基,用去离子水振荡重悬后再离心洗去培养基,将所得菌液稀释至3 L作为实验组进水。将未经紫外线消毒的MBR工艺出水水样进行上述相同步骤操作后作为空白对照组进水。未经紫外线消毒的MBR工艺出水水样水质情况如表1所示。将系统过水通量下降程度作为评价指标,评价紫外线消毒对反渗透膜生物污堵潜势的影响。
表1 未经紫外线消毒的水样水质
Table 1 Water quality of the water sample
without UV disinfection

水质指标ρ(DOC)/(mg/L)电导率/(μS/cm)浊度/NTUpH数值3.5±0.2967±490.33±0.057.5±0.2
反渗透装置所处温度为室温(在25 ℃左右波动),利用传感器监测实时温度数据并采用计算机收集记录。过水通量(J)基于Arrhenius方程由温度数据修正,并按式(3)计算[35]:
![]()
(3)
式中:J为t时刻的过水通量,m3/(m2·s);Δm为该时间点前后30 min反渗透出水总质量之差,kg;ρ为进水密度,103 kg/m3;A为反渗透膜片面积,8.04×10-4 m2;Δt为时间差,3600 s;T为该时间点的温度,℃。过水通量(J)经温度修正后,根据反渗透系统运行前3030 min的初始通量(J0)对其进行归一化处理。所得标准化通量为J/J0。通过系统过水通量(J/J0)下降程度作为评价指标评价紫外线消毒对反渗透膜生物污堵潜势的影响。
2 结果与讨论
2.1 紫外线消毒后再生水中细菌的生长特性
在不同紫外线剂量下,对MBR出水进行消毒。将消毒后的水样涂平板,检测消毒效果,结果如表2所示。可知:未消毒水样中存在大量细菌;紫外线剂量为20 mJ/cm2时消毒效果有限;经过较高剂量(40,80 mJ/cm2)紫外线消毒后,水样中仍有细菌存活。这一结果与氯消毒效果相似,水样中的残余细菌随氯剂量增大而减少,但高剂量下仍有细菌存活[30]。
表2 不同剂量紫外线消毒效果
Table 2 Disinfection effect under different UV doses
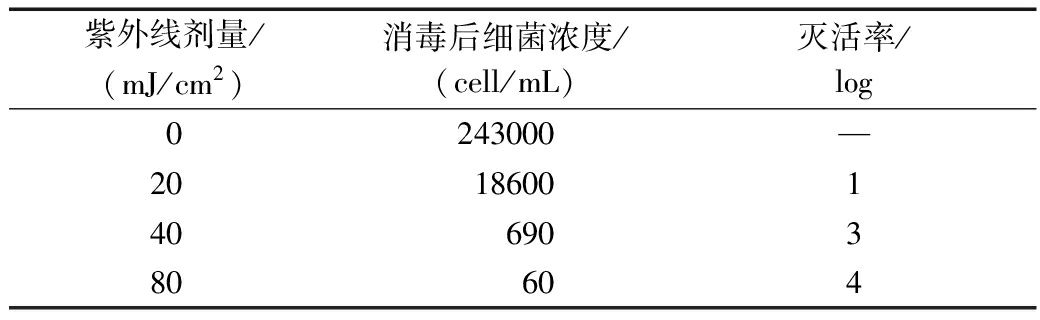
紫外线剂量/(mJ/cm2)消毒后细菌浓度/(cell/mL)灭活率/log0243000—2018600140690380604
将各剂量紫外线消毒后的水样接种至标准R2A培养基培养,水中细菌生长曲线如图1所示。可知:由于紫外线消毒后接种细菌量减少,细菌生长的迟滞期延长;且紫外线剂量为40,80 mJ/cm2时,不仅细菌生长的迟滞期变得更长,达到稳定期后的细菌数量也分别比未经过紫外线消毒的对照组降低18.6%和19.2%。

紫外线剂量/(mJ/cm2): ![]() —0;
—0; ![]() —20;
—20; ![]() —40;
—40; ![]() —80。
—80。
图1 不同紫外线剂量下再生水中细菌的生长曲线
Figure 1 Growth curve of microorganisms in reclaimed water
under different UV doses
2.2 紫外线消毒对再生水中细菌群落结构的影响
测定不同剂量紫外线消毒后再生水中细菌的群落结构,结果如图2所示。
由图2a可知:门水平上,在进行较高剂量紫外线消毒(40,80 mJ/cm2)后,拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)细菌的相对丰度降低至可忽略不计,空白对照组与紫外线剂量为80 mJ/cm2的实验组拟杆菌门的相对丰度分别为3.05%和0.01%,厚壁菌门相对丰度分别为18.71%和0.24%;而变形菌门(Proteobacteria)的相对丰度大大提高,两实验组变形菌门相对丰度分别为78.19%和99.71%。
由图2b可知:纲水平上,在进行较高剂量紫外线消毒(40,80 mJ/cm2)后,杆菌纲(Bacilli)、α-变形菌纲(Alphaproteobacteria)、黄质菌纲(Flavobacteriia)细菌的相对丰度降低至可忽略不计。空白对照组与紫外线剂量为80 mJ/cm2的实验组杆菌纲的相对丰度分别为18.68%和0.23%;而β-变形菌纲(Betaproteobacteria)的相对丰度有所提高,两实验组β-变形菌纲的相对丰度分别为26.99%和72.41%。
由图2c可知:属水平上,在进行较高剂量紫外线消毒(40,80 mJ/cm2)后,芽孢杆菌属(Bacillus)细菌的相对丰度降低至可忽略不计。空白对照组与紫外线剂量为80 mJ/cm2的实验组芽孢杆菌属相对丰度分别为18.63%和0.21%;而詹森菌属(Janthinobacterium)细菌的相对丰度有所提高,两实验组詹森菌属相对丰度分别为24.62%和66.94%。

图2 不同紫外线剂量下再生水中细菌的群落结构
Figure 2 Microbial community structure and alpha diversity in
reclaimed water under different UV doses
以上结果表明,在较高紫外线剂量(40,80 mJ/cm2)下,变形菌门、β-变形菌纲、γ-变形菌纲、假单胞菌属和詹森菌属为主要微生物类群,可能对紫外线消毒具有较强抗性,应重点关注这些种属细菌对于反渗透膜生物污堵的影响;而厚壁菌门、杆菌纲、芽孢杆菌属、柠檬酸杆菌属、金黄杆菌属紫外抗性较弱。有研究指出,氯消毒后黄质菌纲的相对丰度明显提高[30],而紫外线消毒后黄质菌纲的相对丰度大大降低,因此可考虑开发协同消毒方式。
不同紫外线剂量下再生水中微生物α多样性指数如图3所示。可知:与未经过紫外线消毒的空白对照组相比,各实验组的observed species、Shannon、Simpson指数均有所降低。这说明紫外线消毒降低了水中微生物的多样性。该结果与氯消毒后微生物群落多样性降低相似[30]。
2.3 紫外线消毒后再生水中细菌的分泌特性
紫外线消毒前后,细菌的EPS分泌量及EPS中蛋白、多糖含量如图4所示。可知:经过低剂量(20 mJ/cm2)的紫外线消毒后,剩余细菌产生的EPS量明显减少;然而在紫外线照射强度为80 mJ/cm2时,水中剩余细菌产生的EPS量反而增加,甚至超过未消毒对照组水样中细菌的EPS产生量,但其中蛋白质、多糖含量均未增加。与上述细菌数量变化以及群落结构变化结合来看,在经过高剂量紫外线消毒后,水中细菌数量减少,但是其产生的EPS量增加。这一结果也说明了紫外线消毒能够改变水中剩余细菌种类,但能够产生更多EPS的细菌相对丰度反而增加,这可能是造成后续反渗透系统污堵加重的原因。
测定EPS的三维荧光特性,结果如图5所示。图中Ⅰ区代表酪氨酸或色氨酸氨基酸,Ⅱ区代表酪氨酸或色氨酸蛋白质,Ⅲ区代表多糖类物质,Ⅳ区代表富里酸,Ⅴ区代表多环芳烃类腐殖酸,Ⅵ区代表聚羧酸盐型腐殖酸[35]。由图5可看出:紫外线消毒剂量为20 mJ/cm2时,各物质浓度与其他各组相比都更低,总荧光强度积分也最低,且Ⅴ区和Ⅵ区代表的腐殖酸类物质极少。而紫外线消毒剂量为40,80 mJ/cm2时,各物质浓度与未经过紫外线消毒的空白对照组相比均更高,总荧光强度积分也最高。这一结果与上述EPS中DOC含量测定结果对比发现,在紫外线消毒剂量较高时,EPS中荧光物质含量也较高。

![]() —observed species指数;
—observed species指数; ![]() shannon指数;
shannon指数; ![]() simpson指数。
simpson指数。
图3 不同紫外线剂量下再生水中微生物α多样性指数
Figure 3 Alpha diversity in reclaimed water under different UV doses

![]() DOC;
DOC; ![]() —蛋白;
—蛋白; ![]() —多糖。
—多糖。
图4 不同紫外线剂量下再生水中细菌EPS各组分浓度变化
Figure 4 Concentrations of microbial EPS components under
different UV doses
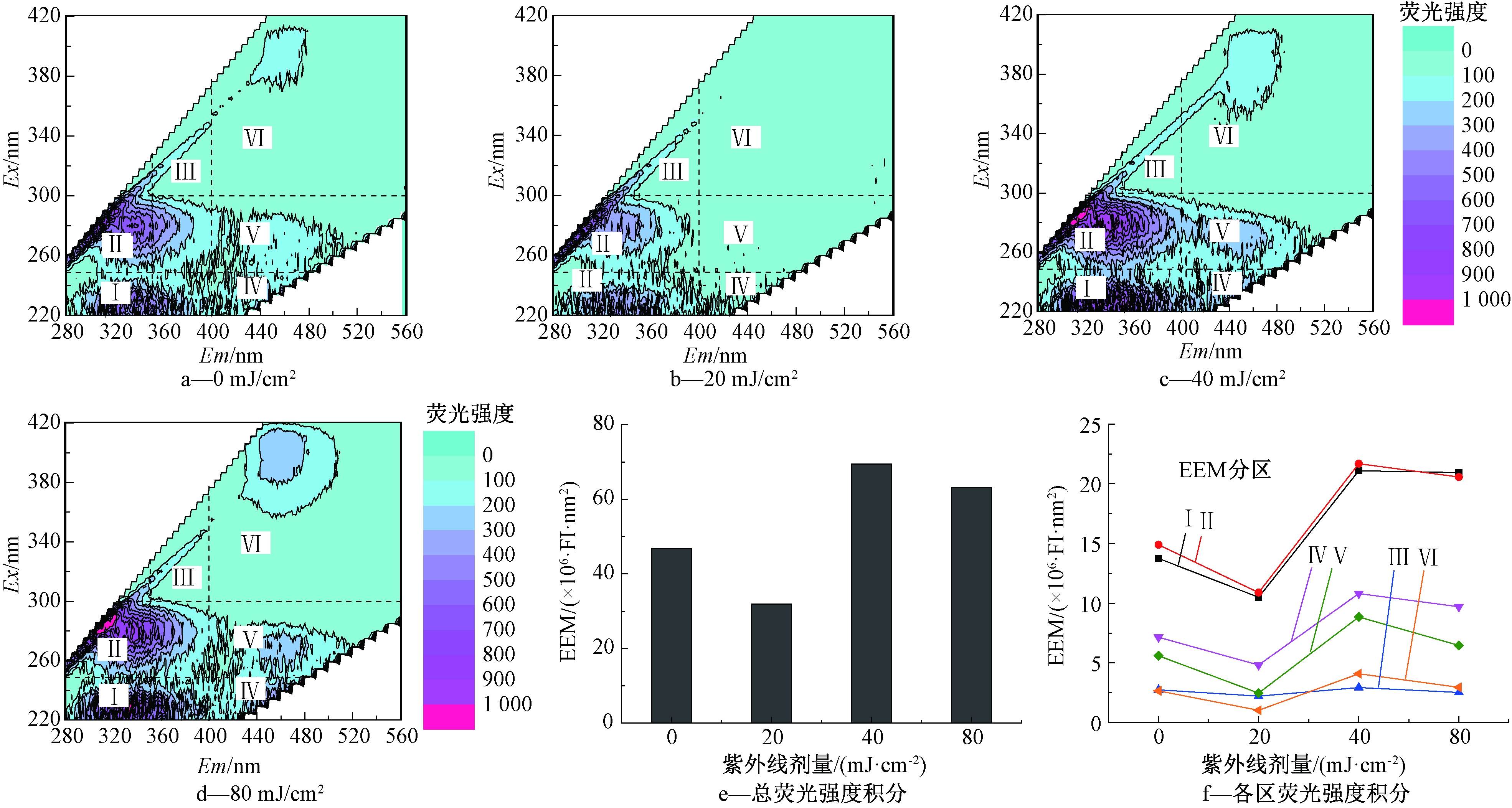
图5 不同紫外线剂量下再生水中细菌EPS三维荧光分布及荧光强度积分
Figure 5 Characteristics and integral of fluorescence intensity in EPS under different UV doses
将提取出的EPS溶液进行分子量分布的测定,结果如图6所示。Lyko等[36]及Zhang等[37]的研究发现:污泥中EPS组分经高效凝胶排阻色谱(HPSEC)分析,大致可以按分子量从大到小被划分为3类,分别是大分子的多糖和蛋白质类物质、腐殖酸类物质以及细胞构筑物、有机酸类小分子物质。由图6可看出:根据UV检测器的信号强弱,在紫外线消毒剂量为80 mJ/cm2时,细菌的EPS中主要是分子量接近于100 kDa的大分子物质;而未经过紫外线消毒的空白对照组中,EPS中的主要组分为分子量接近于10 kDa。这一结果表明,经过紫外线消毒后,水中细菌产生的EPS中大分子物质显著增多。有研究表明,氯消毒后剩余细菌分泌的EPS量以及其中大分子物质量均增多[30],这也与紫外线消毒后的现象相似。

紫外线剂量/(mJ/cm2): ---0; ——80。
图6 紫外线消毒前后再生水中细菌EPS的分子量分布特征
Figure 6 Molecular weight distribution of EPS
before and after UV disinfection
紫外线消毒前后水中细菌经培养后离心洗去培养基,将所得菌液稀释至相同倍数,所得溶液的反渗透膜污堵潜势如图7所示。可知:将MBR出水经80 mJ/cm2紫外线消毒预处理后,膜通量反而下降,膜污堵问题加重。这一结果与上述细菌的EPS产生量以及分子量分布特征相呼应,在紫外线剂量为80 mJ/cm2时,细菌EPS产生量大于未经过紫外线消毒的空白对照组,且其中大分子物质含量增多,因此加重了反渗透膜的污堵问题。

紫外线剂量/(mJ/cm2):![]() 0;
0;![]() 80。
80。
图7 紫外线消毒前后细菌溶液对RO膜的污堵特性
Figure 7 Fouling characteristics of RO membrane by
bacterial solution before and after UV disinfection
3 结 论
1) 紫外线消毒后,存活细菌再培养时其生长迟滞期变长,稳定期细菌数量在40,80 mJ/cm2剂量下分别比对照组降低18.6%和19.2%。
2) 紫外线消毒降低了水中微生物的多样性。在较高紫外线剂量(40,80 mJ/cm2)下,变形菌门、β-变形菌纲、詹森菌属的相对丰度显著增加。应重点关注这些种属细菌对于反渗透膜生物污堵的影响。
3) 紫外线消毒后,水中剩余细菌产生的EPS量(DOC)及其中荧光物质含量随紫外线剂量增大先减少后增多;在80 mJ/cm2的剂量下,消毒后细菌的EPS分泌量甚至超过未消毒对照组水样中的细菌。
4) 80 mJ/cm2紫外线剂量消毒后,水中细菌产生的EPS中大分子物质增多,其反渗透膜的污堵潜势显著增大。
[1] LI W, LIU Z F, HE C Y, et al. Water shortages raised a legitimate concern over the sustainable development of the drylands of northern China: evidence from the water stress index[J]. Science of The Total Environment, 2017,590:739-750.
[2] 王浩, 王建华. 中国水资源与可持续发展[J]. 中国科学院院刊,2012,27 (3):352-358.
[3] 仇付国. 污水再生利用发展趋势及其风险评价[J]. 大众科技,2005(4):85-86.
[4] 胡洪营. 再生水水质安全评价与保障原理[M]. 北京:科学出版社,2011:515.
[5] 李国新, 颜昌宙, 李庆召. 污水回用技术进展及发展趋势[J]. 环境科学与技术,2009,32 (1):79-83.
[6] 曲炜. 我国污水处理回用发展历程及特点[J]. 中国水利,2013(23):50-52.
[7] BARTELS C, WILF M, ANDES K, et al. Design considerations for wastewater treatment by reverse osmosis[J]. Water Science and Technology, 2005a, 51(6/7): 473-482.
[8] BELLONA C, DREWES J E. Viability of a low-pressure nanofilter in treating recycled water for water reuse applications: a pilot-scale study[J]. Water Research, 2007, 41(17):3948-3958.
[9] DEL PINO M P, DURHAM B. Wastewater reuse through dual-membrane processes: opportunities for sustainable water resources[J]. Desalination, 1999, 124(1):271-277.
[10] SINGH R. Analysis of energy usage at membrane water treatment plants[J]. Desalination and Water Treatment, 2011, 29(1/2/3):63-72.
[11] WESTERHOFF P, MOON H, MINAKATA D, et al. Oxidation of organics in retentates from reverse osmosis wastewater reuse facilities[J]. Water Research, 2009,43(16):3992-3998.
[12] 孙迎雪, 胡洪营, 汤芳, 等. 城市污水再生处理反渗透系统RO浓水的水质特征[J]. 环境科学与技术,2015,38(1):72-79.
[13] KHEDR M G. Membrane fouling problems in reverse osmosis desalination applications[J]. Journal of Water Reuse & Desalination, 2000, 10(3):8-17.
[14] TAM L S, TANG T W, LAU G N, et al. A pilot study for wastewater reclamation and reuse with MBR/RO and MF/RO systems[J]. Desalination, 2007, 202(1/2/3):106-113.
[15] FLEMMING H C. Reverse osmosis membrane biofouling[J]. Experimental Thermal and Fluid Science, 1997,14(4):382-391.
[16] GREENLEE L F, LAWLER D F, FREEMAN B D, et al. Reverse osmosis desalination: water sources, technology, and today′s challenges[J]. Water Research, 2009, 43(9):2317-2348.
[17] FLEMMING H C, SCHAULE G, GRIEBE T, et al. Biofouling:the Achilles heel of membrane processes[J]. Desalination, 1997, 113(2):215-225.
[18] MATIN A, KHAN Z, ZAIDI S, et al. Biofouling in reverse osmosis membranes for seawater desalination: phenomena and prevention[J]. Desalination, 2011,281:1-16.
[19] TANG F, HU H Y, SUN L J, et al. Fouling characteristics of reverse osmosis membranes at different positions of a full-scale plant for municipal wastewater reclamation[J]. Water Research, 2016,90:329-336.
[20] BRANDA S S, VIK Å, FRIEDMAN L, et al. Biofilms: the matrix revisited[J]. Trends in Microbiology, 2005,13(1):20-26.
[21] MAYER C, MORITZ R, KIRSCHNER C, et al. The role of intermolecular interactions: studies on model systems for bacterial biofilms[J]. International Journal of Biological Macromolecules, 1999,26(1):3-16.
[22] SHENG G P, YU H Q, LI X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: a review[J]. Biotechnology Advances, 2010,28(6):882-894.
[23] TSUNEDA S, AIKAWA H, HAYASHI H, et al. Extracellular polymeric substances responsible for bacterial adhesion onto solid surface[J]. FEMS Microbiology Letters, 2003,223(2):287-292.
[24] HERZBERG M, KANG S, ELIMELECH M. Role of extracellular polymeric substances (EPS) in biofouling of reverse osmosis membranes[J]. Environmental Science & Technology, 2009,43(12):4393-4398.
[25] 于童. 污水再生处理反渗透膜面细菌生物污堵潜势研究[D]. 北京:清华大学,2018.
[26] JIANG S X, LI Y N, LADEWIG B P. A review of reverse osmosis membrane fouling and control strategies[J]. Science of the Total Environment, 2017,595:567-583.
[27] PANDEY S R, JEGATHEESAN V, BASKARAN K, et al. Fouling in reverse osmosis (RO) membrane in water recovery from secondary effluent: a review[J]. Reviews in Environmental Science and Bio/Technology, 2012,11(2):125-145.
[28] VROUWENVELDER J, VAN DER KOOIJ D. Diagnosis, prediction and prevention of biofouling of NF and RO membranes[J]. Desalination, 2001,139(1):65-71.
[29] KHAN M T, HONG P Y, NADA N, et al. Does chlorination of seawater reverse osmosis membranes control biofouling?[J] Water Research, 2015,78:84-97.
[30] WANG Y H, WU Y H, TONG X, et al. Chlorine disinfection significantly aggravated the biofouling of reverse osmosis membrane used for municipal wastewater reclamation[J]. Water Research, 2019,154:246-257.
[31] LAZAROVA V, SAVOYE P, JANEX M L, et al. Advanced wastewater disinfection technologies: state of the art and perspectives[J]. Water Science and Technology, 1999,40(4/5):203-213.
[32] HIJNEN W A M, BEERENDONK E F, MEDEMA G J. Inactivation credit of UV radiation for viruses, bacteria and protozoan (oo)cysts in water: a review[J]. Water Research, 2006, 40(1):3-22.
[33] BOLTON J R, LINDEN K G. Standardization of methods for fluence (UV dose) determination in bench-scale UV experiments[J]. Journal of Environmental Engineering, 2003,129(3):209-215.
[34] 郭美婷. 污水紫外线消毒中病原指示菌的复活特性及控制方法研究[D]. 北京:清华大学,2008.
[35] WANG Y H., WU, Y.H., TONG, X., et al. Chlorine disinfection significantly aggravated the biofouling of reverse osmosis membrane used for municipal wastewater reclamation[J]. Water Research, 2019, 154: 246-257.
[36] WANG Z P, ZHANG T. Characterization of soluble microbial products (SMP) under stressful conditions[J]. Water Research, 2010,44(18):5499-5509.
[37] LYKO S, WINTGENS T, AL-HALBOUNI D, et al. Long-term monitoring of a full-scale municipal membrane bioreactor: characterisation of foulants and operational performance[J]. Journal of Membrane Science, 2008,317(1):78-87.
[38] ZHANG W J, CAO B D, WANG D S, et al. Variations in distribution and composition of extracellular polymeric substances (EPS) of biological sludge under potassium ferrate conditioning: effects of pH and ferrate dosage[J]. Biochemical Engineering Journal, 2016,106:37-47.