0 引 言
水利工程是现代社会发展的重要基础设施[1],人类通过建设水工构筑物,能够对大自然的水资源进行控制和调配[2],从而防治水旱灾害,确保人类的生产和生活安全。水工构筑物大多由混凝土或钢筋混凝土修建而成,被称为水工混凝土构筑物(hydraulic concrete structures, HCS)。水工混凝土构筑物长期处于潮湿环境,表面易吸附水体中的营养物质,从而为微生物生长提供有利条件[3]。不同种类的微生物在构筑物表面分布广泛,并在一系列新陈代谢过程中生成有机酸与其他代谢产物,这些产物影响混凝土的结构完整性,进而危及水工混凝土构筑物的安全运行[4,5]。因此深入分析微生物群落对于水工混凝土构筑物的影响,是研究水利工程安全性的重点内容。
水环境微生物群落组成和多样性会受到不同环境因素的影响,如温度、pH、光照、营养物质和水动力条件等[6]。叶凝芳等[7]研究发现pH会影响微生物群落结构,在高pH条件下微生物群落多样性较高;陈燕等[8]通过长期观察,发现不同溶解氧环境下细菌群落结构存在较大差异;王子超[9]研究发现,水中盐度和金属离子含量会影响微生物的新陈代谢能力。此外,由于微生物群落多处在动态的水环境中,水动力对其生长的作用尤为重要。水动力条件的改变在一定程度上会影响微生物群落的形成、结构及其对营养物质的吸收能力[10]。以上研究表明,微生物在不同水环境下群落结构和功能迥异,对水工混凝土构筑物的腐蚀程度也存在潜在差异。因此,具体研究水动力条件对于构筑物表面微生物群落的影响,对研究水利工程设施的安全运行具有积极的理论和工程意义。
本研究设计制作水动力模拟装置,将混凝土试件及自然河水加至模拟装置内进行培养,利用高通量测序技术对不同实验条件下混凝土试件表面生长的微生物群落组成和分布特征及演替过程进行表征,并对环境因素和微生物群落结构组成的相关关系进行探究,旨在为保障水工混凝土构筑物结构的耐久性提供一定的理论基础。
1 实验部分
1.1 实验装置
本研究设计并制作的水动力模拟装置(图1a)主要分为上下2层结构。上层为试验反应区(图1b),主体部分通过挡水板分为2个部分,即动水区域和静水区域,其中挡水板底部开孔以保证两部分水流联通,动水区域由潜水泵提供水动力条件(控制水动力条件为8 h/d、水流速度约3 m/s的流动反应[11])。下层为储水箱,通过潜水泵及水管与上层反应区保持联通。装置内实验水体取自南京秦淮河水,并定期更换。动水区域和静水区域各设置16组混凝土试件作为平行样品。

图1 水动力实验装置
Figure 1 The hydrodynamic simulator
1.2 研究方法
1.2.1 实验运行方式
本研究将准备好的混凝土试件同时半浸置于水动力模拟装置上层反应区,并设置4组实验条件,即动水组(flowing water, FW组)、静水组(static water, SW组)、动水对照组(flowing water-blank, FWB组)和静水对照组(static water-blank, SWB组)。其中,2组对照组以混凝土试件表面没有微生物生长为控制条件,需要定期将其混凝土试件取出,使用75%的乙醇对其表面进行灭菌,再使用去离子水连续冲洗30 min后,置于紫外灯下进一步灭菌。
1.2.2 微生物样品采集
对模拟反应器中动水组(FW组)与静水组(SW组)中混凝土试件表面形成的生物膜为对象进行采样送检。每次采样时,使用无菌刮刀在3块混凝土试件表面生物膜区域刮取微生物样品,并将其直接混合作为该次采样的1份平行样品,然后将其置于无菌滤膜上,并密封至2 mL离心管,转移至-80 ℃的冰箱内进行保存,以便于后续高通量测序分析和数据处理。在335 d培养期内,每隔约50 d采样1次,每次采集2份混合平行样品,共采集6次获得24份微生物样品,并进行编号,见表1。
表1 实验动水组和静水组样品编号
Table 1 Numbers of samples in flowing water and static
water groups

对应采样次数及时间编号(动水组)编号(静水组)第1次:第48天FW1-1, 2SW1-1, 2第2次:第110天FW2-1, 2SW2-1, 2第3次:第165天FW3-1, 2SW3-1, 2第4次:第225天FW4-1, 2SW4-1, 2第5次:第280天FW5-1, 2SW5-1, 2第6次:第335天FW6-1, 2SW6-1, 2
1.2.3 混凝土质量损失测定
本研究使用的混凝土试件以水工混凝土构筑物常用的C30标准进行制备。选择符合GB 175—1992《硅酸盐水泥、普通硅酸盐水泥》、GB 1344—1999《矿渣硅酸盐水泥、火山灰质硅酸盐水泥和粉煤灰硅酸盐水泥》标准要求的水泥原料,依据JGJ 55—2000(J 64—2000)《普通混凝土配合比设计规程》,按照水、水泥(硅酸盐水泥,标号PO 42.5)、砂、石子质量比为 0.38∶1∶1.11∶2.72进行混凝土试件的制备。
为比较分析水工混凝土在不同条件下的腐蚀程度,本研究对不同条件下混凝土试件的质量损失进行测定,分别在实验开始前后对混凝土试件进行称重,具体操作如下:将混凝土试件用70%的乙醇溶液浸泡30 min,使用去离子水漂洗30 min并浸泡48 h以去除微生物残留[12],随后将其置于75 ℃的烘箱内烘干48 h,待冷却到室温恒重后进行质量测定[13]。每次称重选取8份平行试件,最终结果取其平均值。
1.3 分析方法
1.3.1 高通量测序法
本研究将微生物样品DNA于实验室内进行提取和初检,提取使用FastDNA Spin Kit(MP Biomedicals,美国)试剂盒并按照其方法进行提取,所得DNA进行1%的琼脂糖凝胶电泳检测,初检合格的DNA将其原始生物膜样品送至上海凌恩生物科技有限公司进行V3—V4变量区的高通量测序。
1.3.2 理化性质测定
采用多参数式水质分析仪(HQ30 d,Hach,美国)测定水质参数水温(T)、溶解氧(DO)、电导率(cond)。采用平面pH复合电极(E-201-P,INESA,中国)测定混凝土表面pH。水样BOD5(870型,南京科环分析,中国)在每次微生物样品采集时原位测定,水样总氮(TN)采用过硫酸钾氧化-紫外分光光度法测定,氨氮(NH3-N)用纳氏试剂分光光度法测定,化学需氧量(CODMn)采用酸性高锰酸钾滴定法测定。以上指标平行测定3次,结果见表2。
表2 微生物采样时原位水体理化性质
Table 2 Physicochemical parameters of raw water samples when being collected

采样次数表面pH温度/℃ρ(DO)/(mg/L)电导率/(μS/cm)ρ(NH3-N)/(mg/L)ρ(TN)/(mg/L)ρ(TP)/(mg/L)ρ(CODMn)/(mg/L)ρ(BOD5)/(mg/L)第1次8.42±0.2617.4±0.25.59±0.56642±182.21±0.092.75±0.080.69±0.044.58±0.182.26±0.11第2次8.13±0.5821.5±0.34.43±0.65484±241.18±0.062.91±0.130.48±0.085.52±0.223.39±0.13第3次7.80±0.3123.2±0.43.96±0.41553±311.84±0.141.72±0.180.32±0.053.02±0.311.95±0.24第4次7.83±0.2121.0±0.34.03±0.58411±131.67±0.112.29±0.090.53±0.045.36±0.242.15±0.16第5次7.86±0.3419.6±0.26.46±0.78789±212.82±0.082.43±0.120.58±0.075.66±0.283.08±0.12第6次7.91±0.4615.2±0.47.12±0.63704±172.39±0.052.52±0.050.78±0.065.14±0.333.19±0.18
注:水质参数以平均值±标准差表示(n=3)。
2 结果与讨论
2.1 水工混凝土表面生物膜形成及质量损失
2.1.1 表面生物膜形成规律
本研究对模拟水动力装置中混凝土试件表面的生物膜形成过程及变化进行了追踪,如图2所示。在实验过程中,各组混凝土试件表面均观察到生物膜逐渐成熟的过程。实验前30 d内,由于混凝土自身孔隙溶液pH过高,限制了微生物的定植活性,各组混凝土表面均没有明显可见的生物膜出现[14]。实验过程中,动水组混凝土表面生物膜的形成速率明显更快,并且从第165天起定植面积逐渐大于静水组,这可能是由于动水组存在适当的水流扰动,有助于水体中营养物质的流动和混合,促进了微生物吸收环境中自身代谢所需的营养物质[15]。各组混凝土试件表面生物膜起初均形成于水位线附近(第48天),可能原因是此处为气水交界处,存在较为丰富的溶解氧,以往研究也证明溶解氧会显著影响微生物群落组成和多样性[16]。在2组对照组中,混凝土试件表面的孔隙和空洞均存在一定程度的扩大,其中动水对照组更为明显,说明动水条件对混凝土试件表面结构损伤的影响较为显著。
2.1.2 混凝土试件质量损失规律
研究对实验期间水工混凝土的质量损失进行了定量分析,得到各混凝土试件的平均质量损失值(以百分比计),具体结果见表3。研究发现,动水组的质量损失程度均高于静水组,其平均质量损失高约0.6%,说明动水条件可能会加强水工混凝土的结构损伤,以往研究证实水流冲刷等水动力条件是导致水工构筑物结构损伤的关键因素之一[17]。而与对照组相比,动水组和静水组的平均质量损失均较高(约1.1%),表明表面微生物群落对混凝土材料造成了一定程度的破坏。水动力作用下的混凝土质量损失要略低于微生物腐蚀作用,这可能是由于混凝土试件存在于水环境中,一定程度上影响了混凝土表面的微生物作用。

图2 水工混凝土表面形貌变化
Figure 2 Variation of appearance on surface of hydraulic concrete
表3 不同组别下各混凝土试件平均质量损失
Table 3 The average mass loss of concrete specimens
in different groups
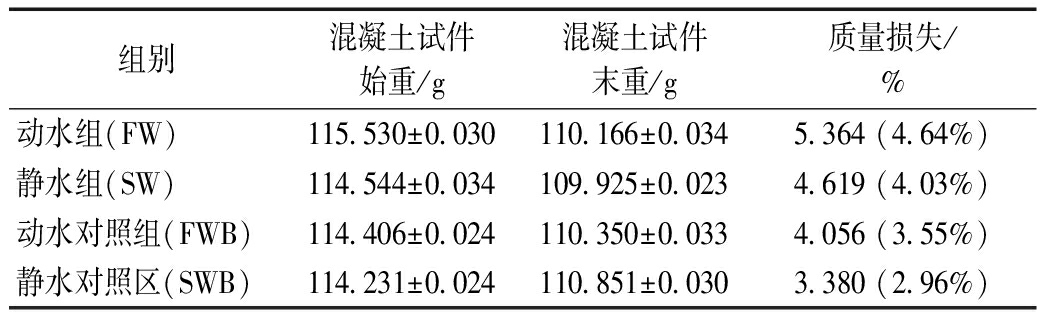
组别混凝土试件始重/g混凝土试件末重/g质量损失/%动水组(FW)115.530±0.030110.166±0.0345.364 (4.64%)静水组(SW)114.544±0.034109.925±0.0234.619 (4.03%)动水对照组(FWB)114.406±0.024110.350±0.0334.056 (3.55%)静水对照区(SWB)114.231±0.024110.851±0.0303.380 (2.96%)
注:混凝土试件质量值以平均值±标准差表示(n=8)。
将具有最高质量损失程度的动水组和具有最低质量损失程度的静水对照组相对比,可推断混凝土试件的质量损失主要由水动力条件和微生物作用共同导致,其中微生物作用更为明显。前期研究发现,污水管网中混凝土处于较封闭的厌氧环境下,其质量损失甚至可高达50%[18]。相比之下,水工混凝土构筑物所处的水体环境通常较为开放且水质较好,所受腐蚀程度也相对较低[19]。但在长期服役过程中,水动力因素(自然和人为的水量调配等)及微生物(表面生物膜的长时间附着)的共同作用,将会对整个水工构筑物的结构安全产生巨大的潜在威胁。
2.2 水工混凝土表面微生物群落分布特征
2.2.1 表面微生物群落多样性
在实验室初期凝胶电泳检测中,静水组SW1-2样品由于PCR扩增产物浓度较低,无法对提取到的DNA序列信息进行有效足量的扩增,因此,在后续微生物分析中,主要对剩余23个样品进行了生物信息分析,各多样性指数见表4。研究表明:动水组和静水组下微生物群落的OTU数量、辛普森指数(Simpson指数)等多样性指标均随时间呈明显且一致的变化趋势。早期(第1次采样)微生物样品,OTU数量较低,且较小,此时微生物易受混凝土材料自身形成的初始高碱性条件(表面pH一般为11~13)影响,生长情况明显受限[14]。采样中期(第2、3次采样)的微生物样品OTU数量及辛普森指数明显上升,说明此时混凝土表面已形成较为成熟的生物膜,这可能是由于前期定植的微生物群落通过系列新陈代谢活动降低了混凝土材料的pH值,逐渐形成了有利于微生物繁殖的生存环境。采样后期(第4~6次采样),各组微生物样品的OTU数量接近,说明经过长时间培养,水工混凝土表面微生物群落多样性最终趋于稳定。
表4 动水组与静水组各微生物样本多样性指数
(97%相似水平)
Table 4 Diversity indexes of microbial samples in flow
water group and static water group

样品名称OTU数量辛普森指数OTU覆盖情况样品名称OTU数量辛普森指数OTU覆盖情况FW1-11610.57110.9981SW1-14030.36380.9946FW1-211070.95630.9870SW2-112350.96270.9852FW2-110100.89890.9943SW2-211340.93580.9851FW2-214830.98120.9848SW3-111310.97170.9854FW3-17510.75790.9900SW3-29150.96450.9874FW3-27190.75260.9912SW4-17990.88760.9896FW4-17100.81040.9895SW4-28500.89650.9880FW4-28270.82670.9888SW5-16760.83310.9905FW5-16910.74330.9898SW5-26380.78810.9907FW5-28050.79920.9887SW6-15920.84730.9916FW6-16400.83830.9913SW6-25820.82400.9912FW6-26610.83350.9907
图3为样品整体多样性指数分析,水动力因素未显著影响微生物群落多样性指数分布,但动水组间各样本中微生物群落的丰富度、均匀度及等指数分布在一定区域内更为集中;而静水组较为离散,这表明在动水条件下,水工混凝土表面形成的微生物群落组成及分布特征更加稳定、均一。

图3 组间微生物多样性指数
Figure 3 Intergroup microbial diversity index map
2.2.2 表面微生物群落结构组成和分布特征
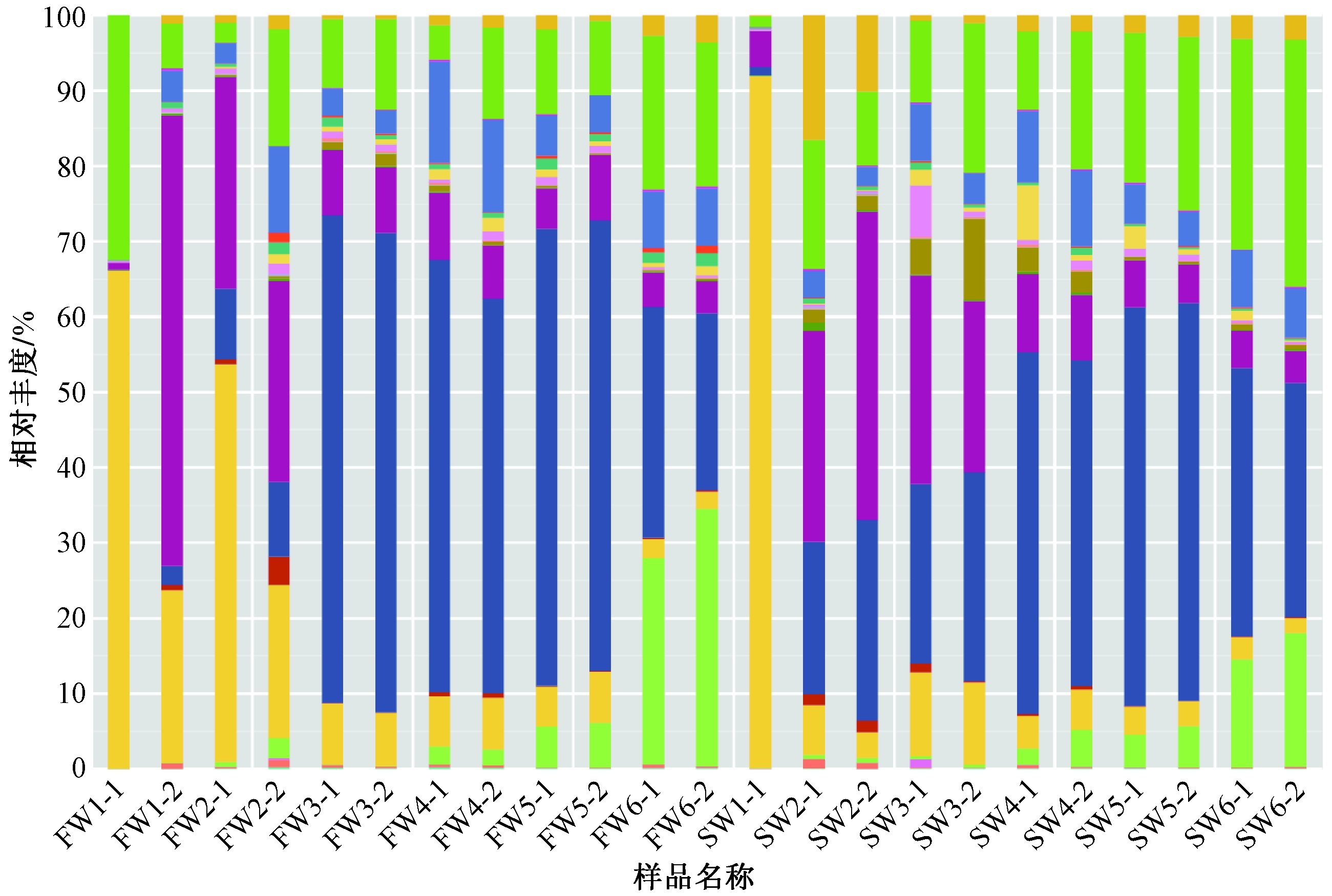
图4给出了基于门水平分析的水工混凝土表面微生物的群落组成。结果表明,在各组微生物样品中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteriodetes)是优势菌门。其中,变形菌门和放线菌门的平均相对丰度分别为65.2%和15.1%,与以往研究报道的变形菌门及放线菌门在混凝土环境中广泛存在且相对丰度最高[19]吻合。
此外,随着培养时间发展,变形菌门在不同时间段内其组成也具有一定差异。早期采样(第1、2次采样)中,α变形菌纲(Alphaproteobacteria)和γ变形菌纲(Gammaproteobacteria)的相对丰度最高,这两种变形菌纲下通常存在海洋螺菌目等耐盐性海洋微生物群落,对于早期混凝土材料本身的高盐碱环境具有更强适应性。而在采样后期(自第3次采样起),环境pH逐渐下降,此时β变形菌纲(Betaproteobacteria)相对丰度逐渐上升,成为变形菌门中的优势菌纲。已有研究证实,β变形菌纲具有多种代谢途径,包括众多好氧或兼性细菌菌属,适应多种生存环境[20]。无论水动力条件如何,水工混凝土表面微生物群落组成和多样性均随时间呈现逐渐升高后降低的趋势。
尽管在优势菌及其相对丰度的变化趋势方面,动水组和静水组并无明显差异,但是随着时间的推移,部分细菌相对丰度的变化趋势在静水条件下比动水条件更为平缓,且更为明显。例如,静水组中放线菌门的相对丰度由初始48 d的1.5%上升至335 d的30.4%,但在动水组中这一变化趋势并不明显。这一现象可能说明了动水条件下混凝土表面微生物群落结构和组成趋于稳定的速率更快,进而与静水条件相比,动水环境下水工混凝土将更早地遭受微生物腐蚀。
![]() Acidobacteria;
Acidobacteria; ![]() Actinobacteria;
Actinobacteria; ![]() Armatimonadetes;
Armatimonadetes; ![]() Bacteroidetes;
Bacteroidetes; ![]() Chlorobi;
Chlorobi; ![]() Chloroflexi;
Chloroflexi; ![]() Cyanobacteria;
Cyanobacteria; ![]() Deinococcus-Thermus;
Deinococcus-Thermus; ![]() Firmicutes;
Firmicutes; ![]() Fusobacteria;
Fusobacteria; ![]() Gemmatimonadetes;
Gemmatimonadetes; ![]() Hydrogenedentes;
Hydrogenedentes; ![]() Nitrospirae;
Nitrospirae; ![]() Planctomycetes;
Planctomycetes; ![]() Alphaproteobacteria;
Alphaproteobacteria; ![]() Betaproteobacteria;
Betaproteobacteria; ![]() Deltaproteobacteria;
Deltaproteobacteria; ![]() Epsilonproteobacteria;
Epsilonproteobacteria; ![]() Gammaproteobacteria;
Gammaproteobacteria; ![]() Saccharibacteria;
Saccharibacteria; ![]() Spirochaetae;
Spirochaetae; ![]() Tenericutes;
Tenericutes; ![]() Verrucomicrobia;
Verrucomicrobia; ![]() Others。
Others。
图4 水工构筑物生物膜细菌占比前10的菌门分布(变形菌门基于纲水平)
Figure 4 Relative abundance of bacteria from biofilms classified at the phylum level as top 10
2.3 水工混凝土表面微生物群落结构组成和环境因子的相关关系
在实际情况中,除了动水条件会一定程度上影响水工混凝土表面微生物群落组成和多样性,水工混凝土所在水体中的环境因子(pH、温度、营养物质和氮磷含量等)也会影响微生物群落的结构组成[21]。本研究对影响演替过程中细菌群落组成的生态过程进行量化[22,23]。前期研究表明,影响和控制微生物群落组成、结构及演替的机制多为生态确定性过程或随机性过程,主要包括同质选择、变量选择、同质扩散和扩散限制等生态过程[22],而同质选择和变量选择均是由环境选择主导下带来的微生物群落组成变化[23]。图5a表明,本研究中微生物演替过程主要由同质选择和变量选择进行解释(两者概率分别为60.87%和32.81%),表明环境因素对水工构筑物表面微生物群落的形成及演替过程十分重要。
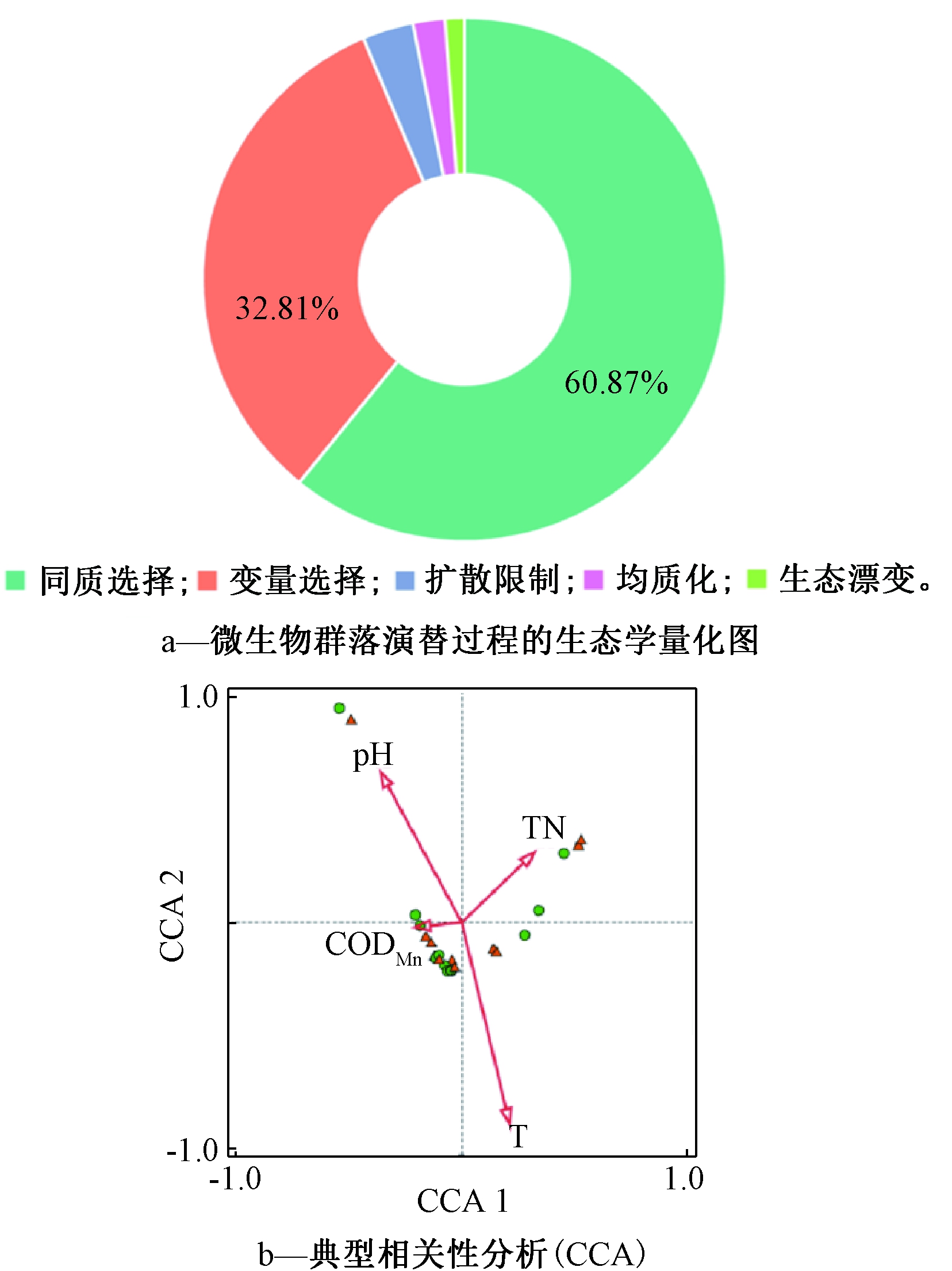
图5 水工混凝土表面微生物群落和环境因子的相关性分析
Figure 5 Analysis of correlation between microbial communities
and environmental factors on surface of HCS
研究采用典型相关分析(CCA)方法,对表面微生物群落组成和环境因子进行了相关性分析(图5b),水环境中相关理化性质监测见表2。研究发现,水工混凝土表面微生物群落构成与多种环境因子密切相关。其中,混凝土表面pH为最显著相关因子(r=-0.3279,P<0.05),其次为TN(r=0.2938,P<0.05)、温度(r=0.1932,P<0.05)、CODMn(r=-0.1889,P<0.05)。结果表明,表面微生物群落组成受动水组与静水组的影响无显著差异,影响微生物群落组成的主要因素是混凝土表面pH。前期研究结果证实了pH值的微小改变也会对微生物群落的丰富度带来直接影响[10],而较高的pH值将通过影响细菌群落结构分布而加剧微生物在混凝土表面及内部定植的困难程度[14]。
3 结 论
1)在335 d实验周期内,动静水条件下混凝土试件表面均观察到生物膜逐渐成熟的过程。研究中混凝土试件的质量损失主要由微生物作用和水动力条件共同导致,其中微生物作用更为显著。
2)动静水条件下水工混凝土表面微生物群落的多样性指标均随时间变化呈现出较为明显的先升高后降低的变化趋势;且变形菌门、放线菌门和拟杆菌门是所有菌门中的优势菌门。但在动水条件下混凝土表面微生物群落可在更短的时间内趋于稳定。
3)水工混凝土构筑物所在水体中的环境因素也会影响表面微生物群落的组成结构,其中表面pH、温度、TN、CODMn的影响最为显著。
[1] LIU J G, ZANG C F, TIAN S Y, et al. Water conservancy projects in China: achievements, challenges and way forward[J]. Global Environmental Change, 2013, 23(3):633-643.
[2] 张楚汉, 王光谦. 我国水安全和水利科技热点与前沿[J]. 中国科学: 技术科学, 2015, 45(10):1007-1012.
[3] SU H Z, HU J, YANG M, et al. Assessment and prediction for service life of water resources and hydropower engineering[J]. Natural Hazards, 2015, 75(3):3005-3019.
[4] GRENGG C, MITTERMAYR F, BALDERMANN A, et al. Microbiologically induced concrete corrosion: a case study from a combined sewer network[J]. Cement and Concrete Research, 2015, 77:16-25.
[5] 张小伟, 张雄. 混凝土微生物腐蚀防治研究现状和展望[J]. 材料保护, 2005, 38(11):44-48.
[6] Hager W H, Boes R M. Hydraulic structures: a positive outlook into the future[J]. Journal of Hydraulic Research, 2014, 52(3):299-310.
[7] 叶凝芳, 何品晶, 吕凡. 厌氧发酵过程pH对微生物多样性和产物分布的影响[J]. 应用与环境生物学报, 2007, 13(2):238-242.
[8] 陈燕, 刘国华, 范强,等. 不同溶解氧条件下A/O系统的除碳脱氮效果和细菌群落结构变化[J]. 环境科学, 2015, 36(7):2610-2616.
[9] 王子超. 盐度和重金属对序批式生物反应器性能及微生物群落结构影响的研究[D]. 青岛:中国海洋大学, 2014.
[10] OSORIO V, PROIA L, RICART M, et al. Hydrological variation modulates pharmaceutical levels and biofilm responses in a Mediterranean river[J]. Science of the Total Environment, 2014, 472:1052-1061.
[11] CLOETE T E, WESTAARD D, VAN VUUREN S J. Dynamic response of biofilm to pipe surface and fluid velocity [J]. Water Science and Technology, 2003, 47(5):57-59.
[12] ZHANG Y, GUO H X, CHENG X H. Role of calcium sources in the strength and microstructure of microbial mortar[J]. Construction and Building Materials, 2015, 77:160-167.
[13] AL-THAWADI S, CORD-RUWISCH R, BOUOUDINA M. Consolidation of sand particles by nanoparticles of calcite after concentrating ureolytic bacteria in situ[J]. International Journal of Green Nanotechnology, 2012, 4(1):28-36.
[14] JIANG G, KELLER J, BOND P L. Determining the long-term effects of H2S concentration, relative humidity and air temperature on concrete sewer corrosion[J]. Water Research, 2014, 65:157-169.
[15] GROBBELAAR J U. Turbulence in mass algal cultures and the role of light/dark fluctuations[J]. Journal of Applied Phycology, 1994, 6(3):331-335.
[16] 杨学志, 王一了, 夏晓虹,等. 溶解氧对晚期垃圾渗滤液短程硝化及微生物群落结构变化的影响[J]. 环境污染与防治, 2012, 34(11):14-19.
[17] 郑佳. 水工建筑混凝土腐蚀与危害因素探讨[J]. 城市建设理论研究: 电子版, 2014, 26(4):2874-2875.
[18] LING A L, ROBERTSON C E, HARRIS J K, et al. High-resolution microbial community succession of microbially induced concrete corrosion in working sanitary manholes[J]. Plos One, 2015, 10(3):e0116400.
[19] 刘若秀. 大坝水环境对坝体混凝土的腐蚀评价[J]. 东北水利水电, 2015, 33(11):33-35.
[20] YOON J H, KIM B C, PARK Y H. Planomicrobium [M]∥Whitman W B, Rainery F, Kāmpfer Y,et al.Bergey’s Manual of Systematics of Archaea and Bacteria.New Jersey: John Wiley & Sons InC, 2015.
[21] GORBUSHINA A A. Life on the rocks[J]. Environmental Microbiology, 2007, 9(7):1613-1631.
[22] STEGEN J C, LIN X, KONOPKA A E, et al. Stochastic and deterministic assembly processes in subsurface microbial communities [J]. ISME Journal, 2012, 6(9):1653-1664.
[23] STEGEN J C, LIN X, FREDRICKSON J K, et al. Quantifying community assembly processes and identifying features that impose them [J]. ISME Journal, 2013, 7(11):2069-2079.