0 引 言
污泥是废水处理过程的副产品,目前,中国每年城市处理厂产生的污泥超过2500万t(含水率为80%),产生了巨大的环境负担[1]。城市污水污泥的处置和利用问题受到人们的广泛关注,并已被确定为“未来的废物问题”[2]。污泥的常规处理方法有固定/稳定处理、卫生填埋法、燃烧法、建筑材料的利用、厌氧消化法回收甲烷和氢气,以及作为肥料在农艺中的应用等[3]。然而,由于严格的法律法规,上述方法逐渐受限,因此,开发经济且环境友好的城市污泥处理方法成为研究热点。近年来,水热碳化(HTC)技术被认为是最具发展前途的污泥减量技术之一,引起了研究领域的广泛关注[4]。目前,国内外的研究主要集中在将原料水热碳化获得可用作有效吸附剂的生物炭[5]以及能源[6]。例如,Shao等[7]利用绿色垃圾水热得到的生物炭作为吸附剂;Khan等[8]利用污泥水热得到的生物炭作为土壤改良剂;Huang等[9]以藻类生物质为原料,采用水热碳化法制备的生物炭作为一种高效燃料。与其他热化学转化技术相比,HTC的处理温度低[10],更安全、经济,也被认为是一种病原体清除过程[11]。生物炭(Biochar)是一种具有较大比表面积、多孔结构、丰富活性位点的黑色炭。由于其原料来源广泛且制备方法简单,被作为吸附剂广泛应用于各个领域[12]。一般地,污水厂在生化阶段会加入含铁物质作为絮凝剂,二沉池的污泥也含有大量的铁元素,严重影响了生态环境和人类生活。因此,找到一种有效且廉价的污泥资源化方法是必要的。
本文以含FeSO4的二沉池活性污泥为原料,通过水热碳化法制备活性污泥生物炭(Fe-SSBC)。以Cd2+和Pb2+为目标污染物,来评价污泥水热制备的Fe-SSBC吸附重金属的效果。通过元素分析(EA)、X射线能谱分析(EDS)、傅里叶红外光谱分析(FTIR)、比表面积(BET)、X射线光电子能谱分析(XPS),磁性分析来表征样品。通过投加量、pH、吸附动力学、吸附等温线以及混合离子实验来探究Fe-SSBC的吸附性能。
1 试验部分
1.1 试剂与仪器
主要试剂:氯化镉(CdCl2,分析纯)、硝酸铅(Pb(NO3)2,分析纯)、硝酸(HNO3,分析纯)、盐酸(HCl,分析纯)、氢氧化钠(NaOH,分析纯)、二水氯化铜(CuCl2·2H2O,分析纯)、六水氯化镍(NiCl2·6H2O,分析纯)、氯化锌(ZnCl2,分析纯)、无水乙醇。
主要仪器:电感耦合等离子体光谱仪(Prodigy-ICP,上海沃珑仪器有限公司)、电热恒温鼓风干燥箱(DHG-9053A,上海齐欣科学仪器有限公司)、水热反应釜(YZHR-100,上海岩征实验仪器有限公司)、离心机(MULTIFUGE-X1R,赛默飞世尔科技(中国)有限公司)、循环水真空泵(SHZ-D(Ⅲ),上海江仪仪器有限公司)、pH测量计(METTLER TOLEDO,梅特勒-托利多仪器(上海)有限公司)、数显水浴恒温振荡器(SHZ-82A,常州市金坛科兴仪器厂)、电子天平(CP114,奥豪斯仪器(上海)有限公司)。
1.2 Fe-SSBC的制备
取自松江生活污水处理厂二沉池活性污泥(含FeSO4),沉淀4 h后,去除上清液。取1 L沉淀后的污泥,分装至16个50 mL的离心管中,每个离心管中装40 mL。以6000 r/min的转速离心15 min后,去除上清液,将污泥移入反应釜内胆中,并加入去离子水至80 mL,搅拌,使泥水充分混合。将装有内胆的反应釜移至烘箱中,在220 ℃条件下,反应4 h。待反应结束后,自然冷却至室温,将反应釜内胆中的混合物进行抽滤,并不断用去离子水和无水乙醇进行冲洗,直至流出的液体变澄清,将截留在滤膜上的固体物质移入烘箱中,65 ℃条件下干燥24 h,制得Fe-SSBC (Fe-sewage sludge biochar)。
1.3 Fe-SSBC的表征
利用元素分析仪(EA,Elmentar Vario EL Ⅲ)对生物炭表面的C、H、N含量进行分析;其他金属元素通过电感耦合等离子体光谱法(ICP-AES,Leeman Prodigy)确定;通过场发射扫描电子显微镜(FE-SEM,Hitachi S4800)获得生物炭的微形态图像,并用能量色散光谱仪(EDS)分析其表面元素组成;利用傅里叶红外显微成像光谱仪(FTIR,Nicolet6700)分析生物炭表面官能团组成;X射线散射仪(XRD,SAXSessmc2)用于检测样品可能存在的晶型结构;通过X射线光电子能谱仪(XPS,Escalab 250Xi)表征样品表面元素及其化学形态;生物炭的磁性通过精密磁测量系统(Lakeshore 7404)来表征。
1.4 Fe-SSBC吸附水中Cd2+和Pb2+的实验步骤
分别配制浓度为8 mg/L的CdCl2溶液和70 mg/L的Pb(NO3)2溶液,加入适量的1 mol/L的HCl和1 mol/L的NaOH,将pH分别调至5和6,各取250 mL重金属溶液放入250 mL锥形瓶中,再分别称取0.2,0.3 g Fe-SSBC加入锥形瓶中,移至摇床,调至转速为190 r/min,取样时间间隔为0 min、2 min、5 min、10 min、20 min、30 min、1 h、2 h、3 h、5 h。每次取样5 mL,过滤至10 mL离心管中,用2% HNO3冷藏保存,测定Cd2+和Pb2+浓度。
重金属去除率的计算式为:
重金属去除率=(C0-Ce)/C0×100%
(1)
去除能力的计算式为:
去除能力=V(C0-Ce)/m
(2)
式中:V为溶液体积,L;C0为重金属初始浓度,mg/L;Ce为重金属反应平衡后浓度,mg/L;m为Fe-SSBC的质量,g。
2 结果与讨论
2.1 Fe-SSBC的表征
Fe-SSBC的EDS元素分析谱图及表面元素分析结果如图1和表1所示,图中除了丰富的C、O元素外,同时出现了清晰的Fe元素吸收峰。由表1可知:Fe-SSBC表面Fe的含量较大,为141.29 mg/g。上述表征说明水热碳化后,铁成功地附着于生物炭上[13]。
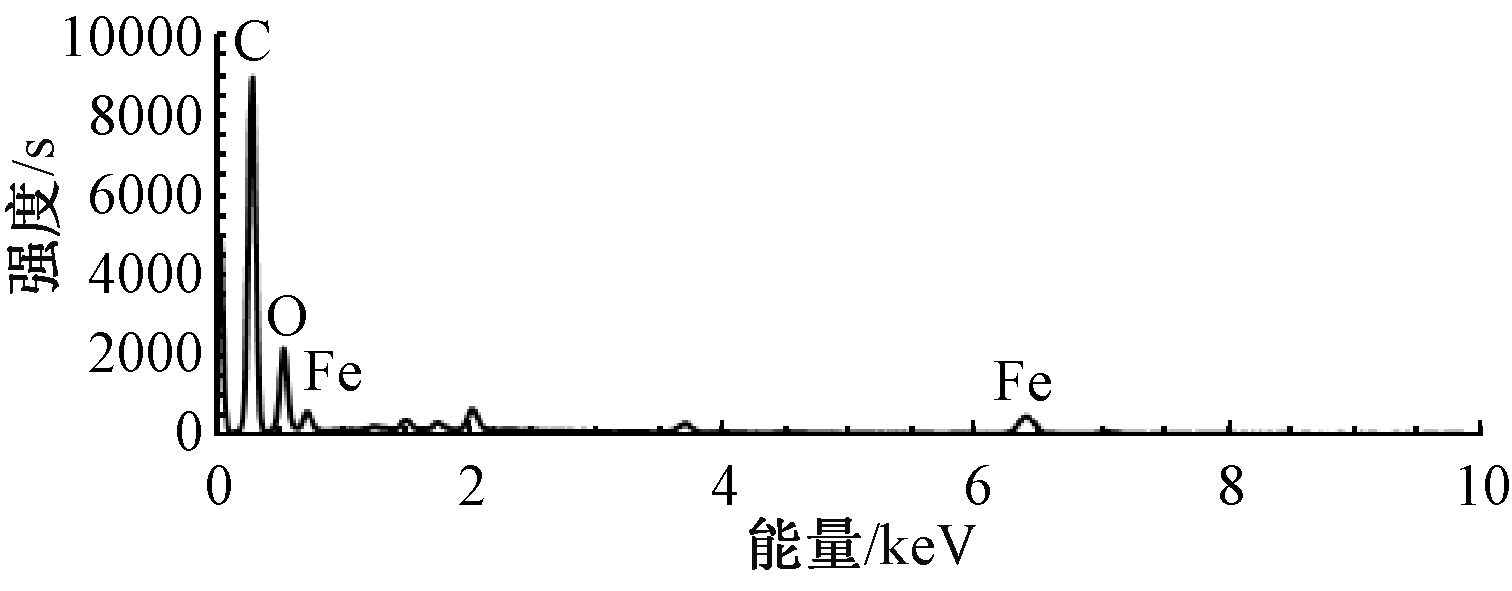
图1 Fe-SSBC的EDS图
Figure 1 EDS spectrum of Fe-SSBC
表1 Fe-SSBC的主要元素组成
Table 1 Elements composition of Fe-SSBC mg/g
w(C)w(H)w(N)w(Al)w(Ca)w(Fe)w(K)13.492.360.9919.246.19141.292.83
Fe-SSBC的XPS全范围图谱如图2a所示,在711.55,531.45,284.85 eV处分别检测到Fe、C、O。对705~730 eV的Fe 2p峰进行分峰,结果由图2b可知:Fe-SSBC样品中同时存在Fe2+和Fe3+,且Fe3+的峰强度明显高于Fe2+,说明Fe-SSBC中的铁主要以+3价为主要价态,这可能是由于不稳定的Fe2+在水热过程中被氧化所导致。

图2 Fe-SSBC的全范围XPS以及Fe 2p的分峰
Figure 2 Full scan XPS and Fe 2p peaking specturm of Fe-SSBC
图3为Fe-SSBC的吸附等温曲线及孔径分布图。在整个压力范围内曲线未出现拐点,低压区的吸附量少,但随着相对压力增高,吸附量显著增强,表现出有孔充填,同时出现了脱附滞后现象,进一步说明样品具有孔隙结构,但其孔径分布较宽。BET法测定的平均孔径约为32 nm,孔容积为0.99 mL/g, 且具有114.57 m2/g的比表面积,表现出一定的物理吸附性能。

图3 Fe-SSBC的吸附等温曲线及孔径分布
Figure 3 Adsorption volume and pore size distribution of Fe-SSBC
水热碳化法所制备的Fe-SSBC具有较强的铁磁性。图4为Fe-SSBC的磁滞回线图,其矫顽力和剩余磁化强度分别为0.0 Oe和0.0 emu/g,饱和磁化强度(Ms)达到16.7 emu/g,这足以通过外加磁场将其与水溶液分离。当将磁铁靠近含有Fe-SSBC的水溶液时,Fe-SSBC颗粒立即附着在靠近磁铁的瓶壁上,水同时变得透明,这有利于Fe-SSBC作为吸附剂的回收与再利用。

图4 Fe-SSBC的磁滞回线
Figure 4 Magnetic hysteresis loop of Fe-SSBC
2.2 Fe-SSBC吸附水中Cd2+和Pb2+的研究
2.2.1 Fe-SSBC吸附水中Cd2+和Pb2+的表征
Fe-SSBC的FT-IR红外谱图(图5)显示了其可能存在的化学键和官能团。可知:3000~3800 cm-1处的峰对应为H2O和M—OH上的O—H伸缩振动;2924 cm-1及2853 cm-1处峰分别为—CH3及—CH2—的伸缩振动;1637,1457,1088 cm-1处的峰分别对应的是C![]() O(羰基/羧基)、N—H和C—O(酚醛);在575,475 cm-1处出现了清晰的Fe—O峰[14]。由Fe-SSBC吸附Cd2+、Pb2+前后的FT-IR谱图可见,所有的官能团的强度都有所减弱。C—O的峰在吸附重金属后发生了偏移,由1088 cm-1偏移至1031,1030 cm-1;由Fe-SSBC的Fe—O峰(575 cm-1)在吸附后偏移至564,561 cm-1处;同时,Fe-SSBC的C
O(羰基/羧基)、N—H和C—O(酚醛);在575,475 cm-1处出现了清晰的Fe—O峰[14]。由Fe-SSBC吸附Cd2+、Pb2+前后的FT-IR谱图可见,所有的官能团的强度都有所减弱。C—O的峰在吸附重金属后发生了偏移,由1088 cm-1偏移至1031,1030 cm-1;由Fe-SSBC的Fe—O峰(575 cm-1)在吸附后偏移至564,561 cm-1处;同时,Fe-SSBC的C![]() O由吸附前的1637 cm-1偏移至吸附后的1632 cm-1。这可能是由于重金属Cd2+和Pb2+通过静电表面复合与生物炭上的含氧官能团反应,羟基、羧基等官能团与Cd2+、Pb2+发生了离子配位[15]。
O由吸附前的1637 cm-1偏移至吸附后的1632 cm-1。这可能是由于重金属Cd2+和Pb2+通过静电表面复合与生物炭上的含氧官能团反应,羟基、羧基等官能团与Cd2+、Pb2+发生了离子配位[15]。

图5 Fe-SSBC吸附Cd2+和Pb2+前后的FT-IR图
Figure 5 FT-IR spectra of Fe-SSBC before and after adsorption
of Cd2+ and Pb2+ adsorption
图6为Fe-SSBC吸附Cd2+和Pb2+后的XPS图中Fe 2p的分峰图。可知:吸附后Fe2+含量减少,且生成了1种新的含铁物质,推测为羟基氧化铁(FeOOH)[16]。
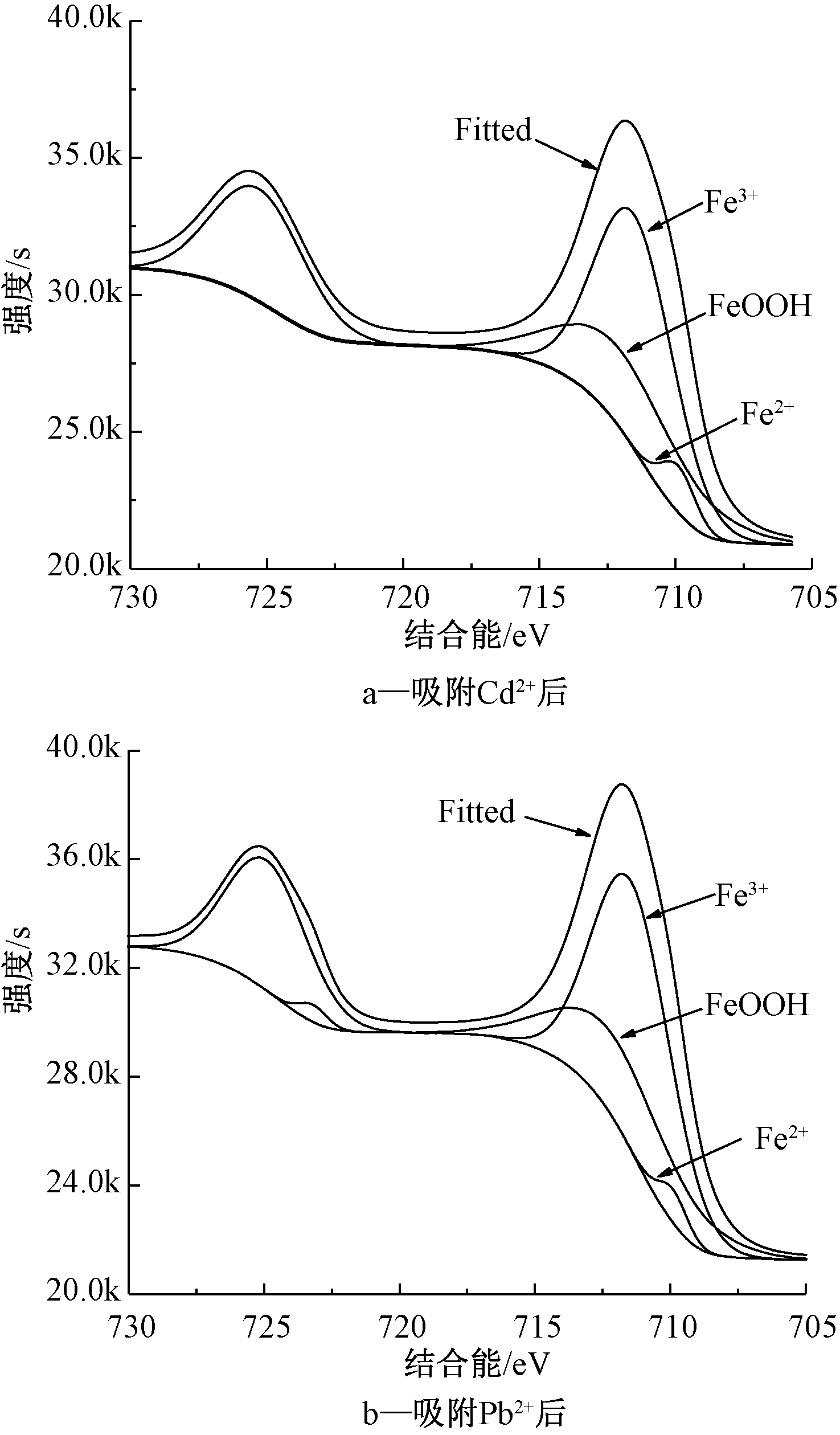
图6 Fe-SSBC吸附Cd2+和Pb2+后Fe 2p分峰
Figure 6 Fe2p peaking of Fe-SSBC after Cd2+ and Pb2+ adsorption
2.2.2 单因素吸附条件优化
1) Fe-SSBC投加量的影响。
吸附剂投加量是吸附过程的重要影响因素,它决定了系统的吸附剂-吸附物平衡。图7为其他条件不变的情况下,Fe-SSBC投加量梯度为0.05,0.1,0.2,0.25,0.3和0.5 g时对Cd2+和Pb2+的去除率。对Cd2+而言,当投加量从0.05 g增至0.2 g时,去除率迅速由28%提升到94%。之后继续增加投加量(0.2~0.5 g),去除率缓慢增至98%。投加量越大可提供的活性位点越多,有利于提高对重金属离子去除率,但因为重叠和聚集,并非所有活性位点都被有效利用[17]。由图7a可知:随着吸附剂投加量的增加,相应的去除能力从12 mg/g下降到4 mg/g。因而,在保证良好的吸附能力下,从节省吸附剂的用量角度出发,确定Fe-SSBC去除Cd2+的最佳投加量为0.2 g。图7b为吸附剂投加量对吸附Pb2+的影响。可知:随着吸附剂投加量的增加,去除率由20%持续上升,当投加量为0.5 g时,对Pb2+去除率基本达到100%。综合考虑到去除能力随着吸附剂投加量的增加而呈下降的趋势,将Fe-SSBC去除Pb2+的最佳投加量设定为0.3 g。
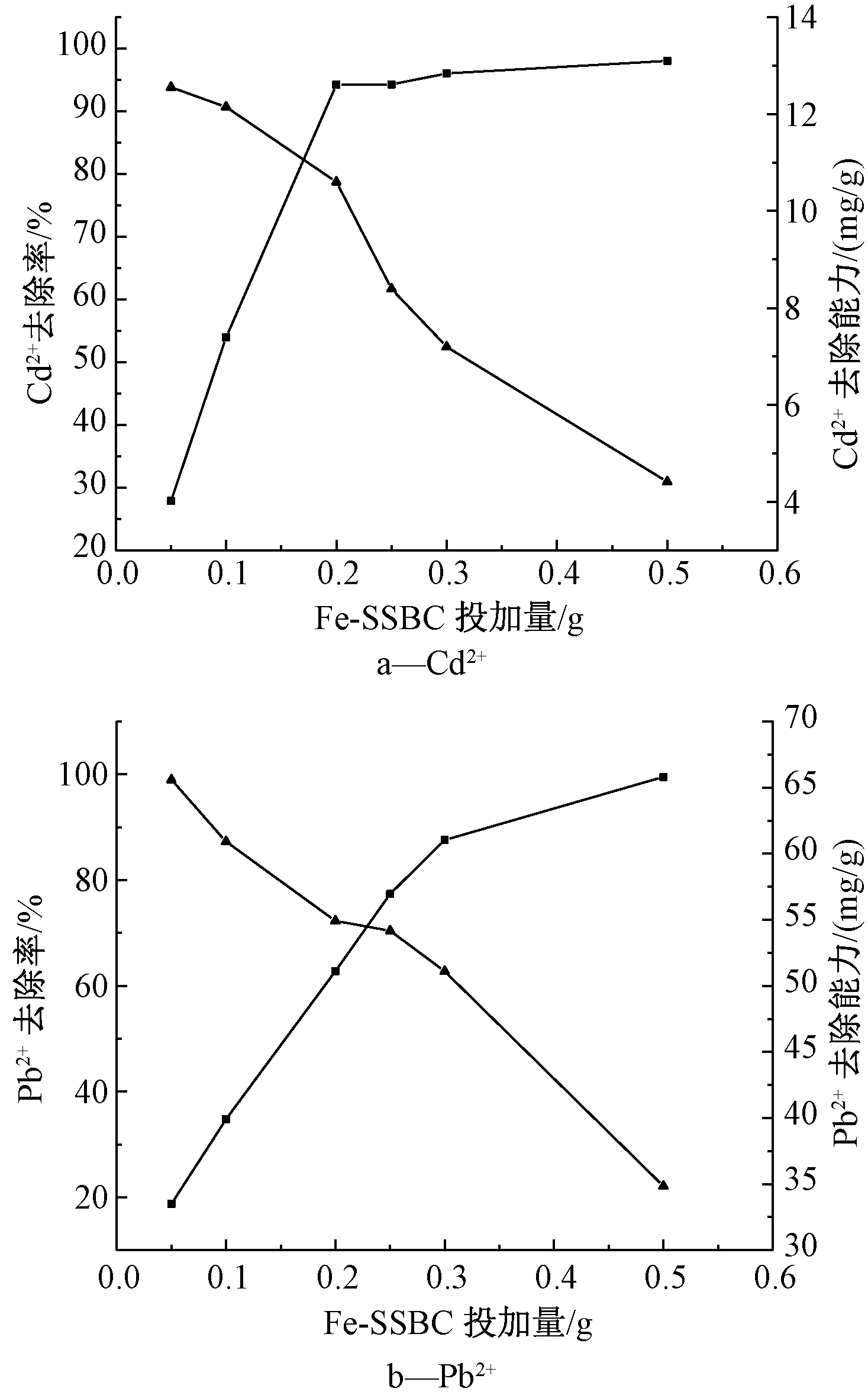
![]() —去除率;
—去除率; ![]() —去除能力
—去除能力
图7 Fe-SSBC投加量对Cd2+和Pb2+的去除率和去除能力的影响
Figure 7 Cd2+ and Pb2+ removal rate and capacity by Fe-SSBC
with different dosages
2) 溶液初始pH的影响。
溶液初始pH对吸附过程有显著影响,考虑到碱性条件下被吸附的Cd2+与Pb2+将有沉淀生成,故选取pH为2、3、4、5、6来探究其影响。如图8所示,pH的提高有利于增强吸附剂的吸附能力,这可能是由于H+会干扰羧基和羟基与重金属离子之间的螯合作用,减弱吸附效果。这一现象在吸附Cd2+时尤为明显(图8a),在pH≤3时去除能力极弱,当pH>4时,对Cd2+的去除能力显著提高,在pH=5时达到最高,为7.895 mg/g,随后略有下降。因而,吸附Cd2+的最佳pH为5。对Pb2+的吸附过程同样显示去除效果随pH值升高而增强的趋势(图8b),溶液的pH值从2升至6时,对Pb2+的去除能力提升了2倍以上,达到47.67 mg/g。当pH达到7时溶液中出现Pb(OH)2白色沉淀,因而,将Pb2+溶液的最佳pH确定为6。由表2、3可看出:在对2种重金属离子的吸附过程中,溶液的pH值都未发生较为明显的变化。
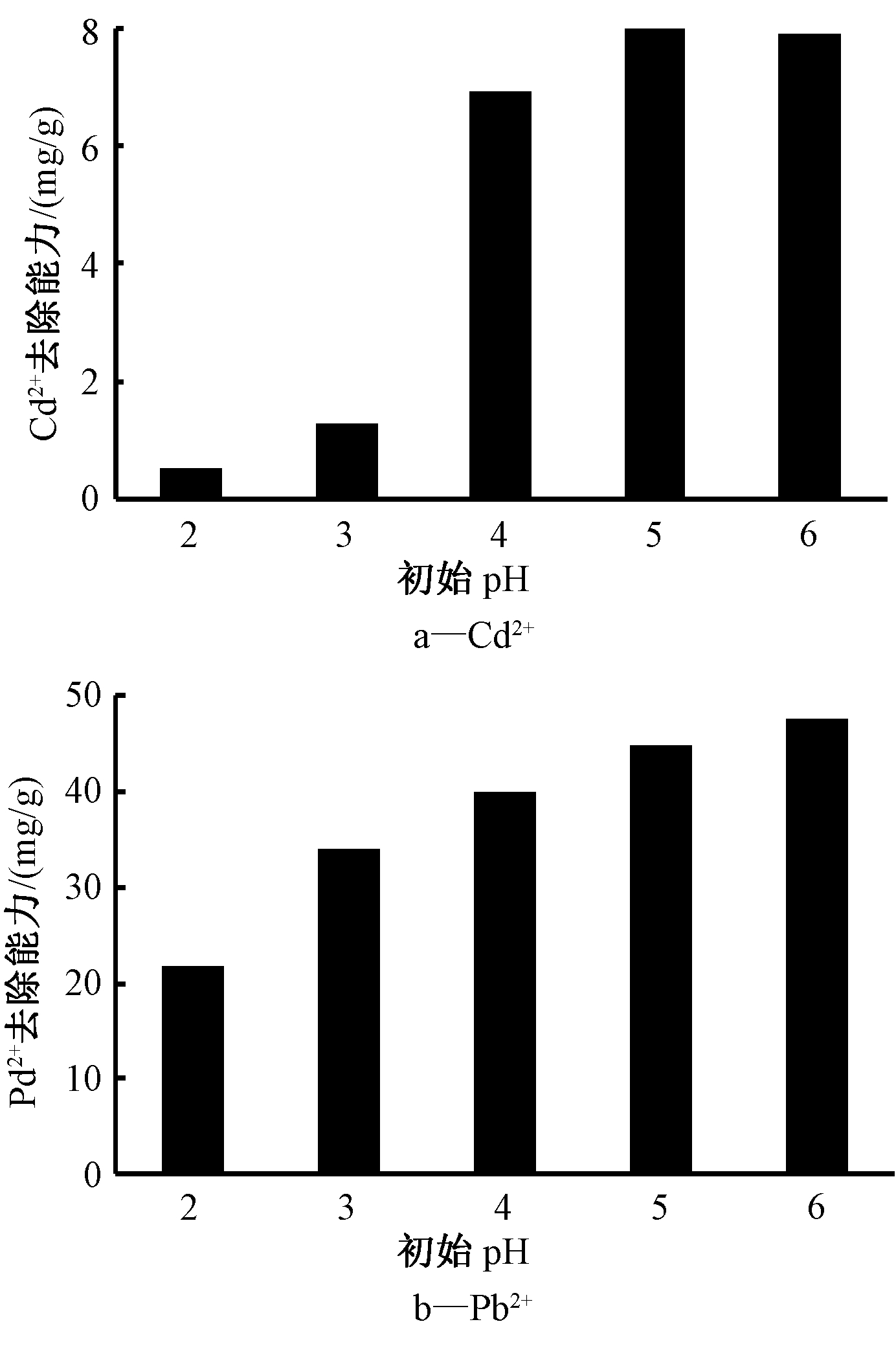
图8 pH对Cd2+、Pb2+的去除能力的影响
Figure 8 Influence of pH value Cd2+, Pb2+ removal capacity
表2 吸附Cd2+前后的pH
Table 2 pH value before and after Cd2+ adsorption
初始pH23456吸附后pH2.194.115.195.686.69
表3 吸附Pb2+前后的pH
Table 3 pH value before and after Pb2+ adsorption
初始pH23456吸附后pH2.3244.985.476.03
2.2.3 吸附动力学实验

![]() 实验值; ----准一级动力学拟合; ——准二级动力学拟合。
实验值; ----准一级动力学拟合; ——准二级动力学拟合。
图9 Fe-SSBC吸附Cd2+ 和Pb2+的动力学曲线
Figure 9 Adsorption kinetic curves for Cd2+ and Pb2+ on Fe-SSBC
Fe-SSBC去除Cd2+和Pb2+的吸附动力学如图9所示,该图表示Fe-SSBC上Cd2+和Pb2+的吸附量qt和时间t之间的关系。在5 min内,Cd2+和Pb2+的吸附量迅速达到了约40%,初始阶段的快速吸附可归因于离子交换和静电吸引[18]。本实验采用准一级和准二级吸附动力学模型拟合Fe-SSBC的吸附过程。模型公式如下:
准一级模型:
qt=qe(1-e-k1t)
(3)
准二级模型:
![]()
(4)
式中:qe和qt分别代表吸附平衡时和t时刻的吸附容量,mg/g;k1为准一级反应速率常数,min-1;k2为准二级反应速率常数,g/(min·mg); t为吸附时间,min。
表4为Fe-SSBC吸附Cd2+和Pb2+的准一级、准二级吸附动力学参数。可知:Fe-SSBC吸附Cd2+的准二级相关系数R2=0.99,可很好地拟合实验数据,说明该吸附过程的总体反应速率受化学吸附控制[19]。此外,Cd2+、Pb2+的准二级模型的平衡吸附量更接近实验数据。同时,结合BET分析(比表面积为114.57 m2/g),可能存在物理吸附。Fe-SSBC对Pb2+的吸附,准二级动力学拟合结果R2=0.99,与Cd2+相同,吸附机理主要受化学吸附控制,并存在物理吸附。
表4 Fe-SSBC吸附Cd2+和Pb2+的准一级和准二级参数
Stable 4 Kinetic parameters of pseudo-first order and
pseudo-second order of Fe-SSBC for Cd2+ and Pb2+

重金属C0/(mg/L)qe,exp/(mg/L)准一级动力学拟合准二级动力学拟合Pb2+6048.05qe=44.67 mg/gqe=51.14 mg/gK1=0.014K2=0.003R2=0.96R2=0.99Cd2+88.5qe=8.02qe=8.75K1=0.027K2=0.004R2=0.95R2=0.99
2.2.4 吸附等温线实验
图10为Fe-SSBC吸附Cd2+和Pb2+等温线拟合,随着初始浓度的增加,吸附量qt呈上升趋势,最终均趋于平衡,达到最大吸附量。采用Langmuir[20]和Freundlich[21] 2种吸附模型用于拟合本次实验数据。Langmuir和Freundlich吸附模型的公式如下:
Langmuir模型:
Ce/qe=Ce/qm+1/qmKL
(5)
Freundlich模型:
lgqe=lgKF+1/nFlgCe
(6)
式中:Ce为平衡时重金属离子浓度,mg/L;qe为平衡时单位质量Fe-SSBC吸附的重金属离子量,mg/g;qm为最大吸附容量,mg/g;KL为Langmuir常数,L/mg;

![]() 实验值; ----Langmuir; ——Freundlich。
实验值; ----Langmuir; ——Freundlich。
图10 Fe-SSBC吸附Cd2+和Pb2+的等温线
Figure 10 Adsorption isotherm for Cd2+ and Pb2+on Fe-SSBC
KF为Freundlich吸附容量,mg/g;nF为异质性因子。
如表5所示:Langmuir模型的相关系数更适合描述本实验的吸附过程,说明该吸附过程为单层吸附,整个吸附剂表面具有相同的吸附能力,且吸附质之间无相互作用。
表5 Fe-SSBC吸附Cd2+和Pb2+的Langmuir和
Freundlich参数
Table 5 Fitting parameters of Langmuir and
Freundlich model of Fe-SSBC adsorbing Cd2+ and Pb2+

重金属LangmuirFreundlichCd2+Qm=14.18 mg/gKF=5.81 mg/gKL=0.21 L/mgnF=4.60R2=0.99R2=0.96Pb2+Qm=59.50 mg/gKF=42.48 mg/gKL=0.11 L/mgnF=18.59R2=0.98R2=0.94
2.2.5 混合离子实验
为了模拟Fe-SSBC对实际废水中Pb2+和Cd2+的去除效果,进行了混合重金属阳离子实验。图11a为Fe-SSBC对单独Pb2+溶液和重金属离子混合溶液(HMs:Cd2+、Pb2+、Ni2+、Cu2+、Zn2+)中Pb2+的吸附,吸附条件为混合溶液1.29 g/L,pH为6。结果显示,共存离子对Pb2+的吸附影响很大,溶液中单独存在Pb2+时,其去除率接近100%,而混合溶液中只达到40%。图11b为Fe-SSBC对单独Cd2+溶液和混合离子溶液中Cd2+的吸附,吸附条件为混合溶液浓度为0.8 g/L,pH为5。结果表明,单独吸附时Cd2+去除效果接近100%,而混合溶液中Fe-SSBC对Cd2+几乎没有吸附。说明混合溶液中其他阳离子对Pb2+或Cd2+的吸附存在竞争,而且对Cd2+的影响最大。为了探究其他离子对Cd2+的影响,将Cd2+与其他离子(Pb2+、Ni2+、Cu2+、Zn2+)分别两两混合,吸附条件为样品0.2 g/L,pH为5。由图11c可以看到共存离子对Cd2+的竞争力顺序为Cu2+>Pb2+>Zn2+>Ni2+。
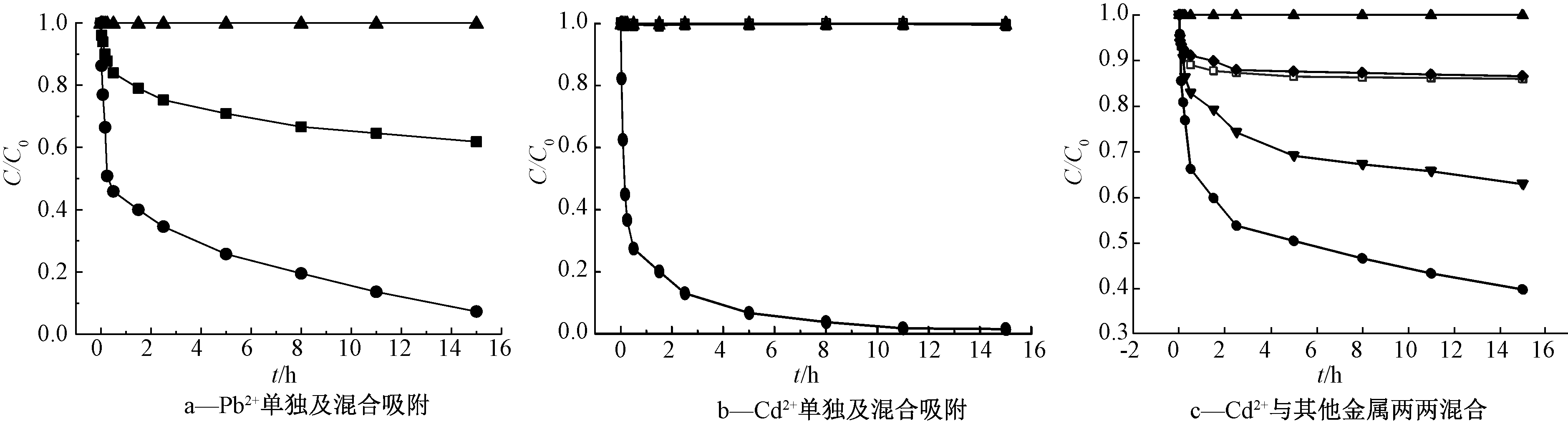
![]() —混合吸附;
—混合吸附; ![]() —对照组;
—对照组; ![]() —单独吸附;
—单独吸附; ![]() —Cd2-+Pd2;
—Cd2-+Pd2; ![]() —Cd2-+Ni2+;
—Cd2-+Ni2+; ![]() —Cd2-+Cu2+;
—Cd2-+Cu2+; ![]() —Cd2-+Zn2+。
—Cd2-+Zn2+。
图11 其他重金属离子对Fe-SSBC吸附Pb2+, Cd2+的影响
Figure 11 Influence of heavy metal ions on removal capacity of Pb2+, Cd2+by Fe-SSBC
3 结 论
1)以含有FeSO4的活性污泥为原料,采用水热碳化法,在220 ℃,4 h条件下成功制备出具有孔结构、比表面积大的磁性生物炭(Fe-SSBC),在较低能耗以及无污染条件下实现了污泥减量。
2)通过对Fe-SSBC进行各种物理表征,分析其表面结构组成和化学形态,初步判定其具有一定的吸附能力。通过对样品吸附Cd2+和Pb2+机理的研究,进一步表明Fe-SSBC有较好的吸附重金属能力,在投加量分别为0.8,1.2 g/L的条件下,Cd2+和Pb2+去除率均接近100%。同时还证明还原反应以及离子配位改变了样品表面官能团的结构,在吸附过程中占有较大作用。动力学和等温线实验证明,吸附过程主要受化学吸附控制且为单分子层吸附,前期吸附速率快。
3)通过模拟实际废水,以探讨Fe-SSBC的实际应用价值。实验结果表明:其处理实际废水的能力较弱,在Fe-SSBC投加量为0.3 g,pH为6时,Pb2+去除率只达到40%,而Cd2+在Fe-SSBC投加量为0.2 g,pH为5的条件下基本无去除。溶液中其他重金属阳离子对Cd2+和Pb2+有竞争性影响,相互影响机制还有待进一步探索。
[1] YUAN Y, YUAN T, WANG D M, et al. Sewage sludge biochar as an efficient catalyst for oxygen reduction reaction in an microbial fuel cell[J]. Bioresource Technology, 2013, 144:115-120.
[2] HWANG I H, OUCHI Y, MATSUTO T. Characteristics of leachate from pyrolysis residue of sewage sludge[J]. Chemosphere, 2007, 68(10):1913-1919.
[3] LU H L, ZHANG W H, YANG Y X, et al. Relative distribution of Pb2+ sorption mechanisms by sludge-derived biochar[J]. Water Research, 2012, 46(3): 854-862.
[4] ZHAI Y B, LIU X M, ZHU Y, et al. Hydrothermal carbonization of sewage sludge: the effect of feed-water pH on fate and risk of heavy metals in hydrochars[J]. Bioresource Technology, 2016, 218:183-188.
[5] LENG L J, YUAN X Z, HUANG H J, et al. Bio-char derived from sewage sludge by liquefaction: characterization and application for dye adsorption[J]. Applied Surface Science, 2015, 346:223-231.
[6] KIM D, LEE K, PARK K Y. Hydrothermal carbonization of anaerobically digested sludge for solid fuel production and energy recovery[J]. Fuel, 2014, 130:120-125.
[7] SHAO Y C, LONG Y Y, WANG H Y, et al. Hydrochar derived from green waste by microwave hydrothermal carbonization[J]. Renewable Energy, 2019, 135:1327-1334.
[8] KHAN SARDAR, CHAO C, WAQAS M, et al. Sewage sludge biochar influence upon rice (Oryza sativa L) yield, metal bioaccumulation and greenhouse gas emissions from acidic paddy soil[J]. Environmental Science & Technology, 2013, 47 (15):8624-8632.
[9] HUANG R X, TANG Y Z. Speciation dynamics of phosphorus during (Hydro) thermal treatments of sewage sludge[J]. Environmental Science & Technology, 2015, 49(24):14466-14474.
[10] ERDOGAN E, ATILA B, MUMME J, et al. Characterization of products from hydrothermal carbonization of orange pomace including anaerobic digestibility of process liquor[J]. Bioresource Technology, 2015, 196(7):35-42.
[11] LIBRA J A, RO K S, KAMMANN C, et al. Hydrothermal carbonization of biomass residuals: a comparative review of the chemistry, processes and applications of wet and dry pyrolysis[J]. Biofuels, 2011, 2(1):71-106.
[12] IFTHIKAR J, WANG J, WANG Q, et al. Highly efficient lead distribution by magnetic sewage sludge biochar: sorption mechanisms and bench applications[J]. Bioresource Technology, 2017, 238:399-406.
[13] LU H L, ZHANG W H, YANG Y X, et al. Relative distribution of Pb2+ sorption mechanisms by sludge-derived biochar[J]. Water Research, 2012, 46(3):854-862.
[14] PEGGY A O, DIMITRI V, ROOT R, et al. The influence of sulfur and iron on dissolved arsenic concentrations in the shallow subsurface under changing redox conditions[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101 (38):13703-13708.
[15] ZHANG F, WANG X, JI X H, et al. Efficient arsenate removal by magnetite-modified water hyacinth biochar[J]. Environmental Pollution, 2016, 216:575-583.
[16] HUANG D L, XUE W J, ZENG G M, et al. Immobilization of Cd in river sediments by sodium alginate modified nanoscale zero-valent iron: impact on enzyme activities and microbial community diversity[J]. Water Research, 2016, 106:15-25.
[17] CHEN T, ZHOU Z Y, HAN R, et al. Adsorption of cadmium by biochar derived from municipal sewage sludge: impact factors and adsorption mechanism[J]. Chemosphere, 2015, 134:286-293.
[18] KIM E J, LEE C S, CHANG Y Y, et al. Hierarchically structured manganese oxide-coated magnetic nanocomposites for the efficient removal of heavy metal ions from aqueous systems [J]. American Chemical Society, 2013, 5(19):9628-9634.
[19] ZHANG W, LO I M, TSANG D C. EDTA-enhanced washing for remediation of Pb-and/or Zn-contaminated soils[J]. Journal Environmental Engineering, 2006, 132:1282-1288.
[20] WANG P F, CAO M H, WANG C, et al. Kinetics and thermodynamics of adsorption of methylene blue by a magnetic graphene-carbon nanotube composite[J]. Applied Surface Science, 2014, 290:116-124.
[21] TANG L, YANG G D, ZENG G M, et al. Synergistic effect of iron doped ordered mesoporous carbon on adsorption-coupled reduction of hexavalent chromium and the relative mechanism study[J]. Chemical Engineering Journal, 2014, 239:114-122.