0 引 言
近年来,氢气被认为是一种极具潜力的可再生能源,其燃烧产物只有水,不会对环境造成污染。然而,地球上氢气自然储量很少,需要通过一定方法从其他物质中获取。光电化学是一种使用半导体光催化剂作为材料,利用其受光激发后会产生电子电洞的特性,进而使有机物分解产生氢气,此方法可在常温下进行反应,还具有较好的经济性和环境友好性[1]。
TiO2由于物理化学性质稳定、耐光腐蚀性强、环境友好等特点,得到广泛关注[2-3]。但TiO2无法高效利用可见光,而且反应过程中产生的电子空穴易复合,导致其光催化裂解产氢的效率较低[4,5]。有研究将TiO2制备为纳米材料钛纳米管(TNTs),其比表面积增加,可以吸附更多反应物从而提升反应速率[6,7]。掺杂元素可改善TiO2或TNTs的催化特性[8],有研究者发现,向TiO2中掺杂Pt元素可以一定程度上降低光生电子-空穴对的复合,并改变其吸收光谱至可见光频段[9,10]。然而,目前高效纳米材料的制备及向TNTs中掺杂元素的系统研究还相对较少。
本研究将TiO2通过微波水热法制备了TNTs,并对增加光催化剂的比表面积和掺杂元素Pt提高电子电洞分离效率对其光催化产氢过程进行了系统研究。采用光沉积法将金属Pt掺杂于TiO2和TNTs,制备了复合光催化剂Pt/TiO2和Pt/TNTs,采用扫描电子显微镜(SEM)、透射电子显微镜(TEM)、X射线衍射仪(XRD)和紫外-可见分光(UV-Vis)光度计对制备的光催化剂进行表征,优化了甲醇溶液浓度和Pt掺杂量对光催化产氢效率的影响,在最优条件下,比较了TiO2、TNTs、Pt/TiO2和Pt/TNTs在紫外光和可见光下的光催化剂产氢效率。
1 实验部分
1.1 材 料
TiO2(纯度≥99.5%)购自Evonik Industries AG(Germany),NaOH(纯度>99.5%)购自Sigma-aldrich(德国),CH3OH(纯度>99.8%)购自Uni-onward公司,HCl (纯度35%)和 H2PtCl6·6H2O(纯度98%)购自Nacalai Tesque, Inc.(日本)。
1.2 光催化剂制备
采用微波水热法制备TNTs,具体方法如下:0.6 g TiO2在70 mL的10 mol/L NaOH溶液中均匀搅拌40 min后,置于微波消解系统,在400 W和130 ℃的条件下处理3 h;得到的粉末用0.5 mol/L HCl溶液冲洗3次,去离子水冲洗4次;离心后冷冻干燥12 h(-58.8 ℃,1.5~3.5 kPa),获得TNTs。
复合催化剂Pt/TiO2和Pt/TNTs采用光沉积法制备,将1 g TiO2 或TNTs 悬浮于1 mol/L H2C2O4溶液,同时加入不同量的H2PtCl6·6H2O,控制Pt的质量分数为0.1%、0.5%、1.0%和5.0%,置于紫外线下(200 W,365 nm)处理3 h。悬浊液在8000 r/min下离心2 min,收集沉淀物冷冻干燥处理12 h(-58.8 ℃,1.5~3.5 kPa),得到光催化剂Pt/TiO2和Pt/TNTs。
1.3 光催化剂表征
催化剂粒径和结构采用TEM(Hitachi, H-7100, Japan)分析,催化剂晶体结构采用XRD(MAC Science MXP 18, Japan)分析。催化剂的吸收带采用紫外可见分光光度计测定(Cary 100nc, USA)。
1.4 光催化产氢性能实验
光催化反应装置为有效容积1.2 L的圆柱体不锈钢容器,中部内置的石英管中放置光源,反应装置上部设置气体采样口。500 mL不同体积分数的甲醇溶液(1%、10%、205、50%、100%)与0.25 g催化剂混合置于光催化反应器装置中,于紫外光(320~400 nm,250 W,Philips, Belgium)和可见光(400~700 nm,150 W,Philips, Belgium)下进行光催化产氢反应。反应过程中,通过反应器底部的磁力搅拌器持续搅拌混合液,以确保悬浮液的均匀性。考察甲醇溶液的浓度、Pt金属的掺杂量和不同光催化剂对产氢效率的影响。在取样口定时采集气体样(0, 0.5, 1, 2, 3 h),气体成分采用GC-TCD(GC1000 TCD)测定,氩气作为载气,载气流速为50 mL/min,进样器、柱温和检测器温度均为60 ℃。
2 结果与讨论
2.1 光催化剂表征结果
2.1.1 SEM
采用SEM观察催化剂表面的显微结构,推估催化剂的颗粒大小。图1分别为TiO2、Pt/TiO2、TNTs和Pt/TNTs的SEM照片。由图1a可知:TiO2颗粒直径约为30 nm,Pt/TiO2类似,因为利用光沉积法将Pt覆于TiO2上并不会破坏其本身结构,且两者颗粒粒径接近[11]。图1c为利用微波水热法制备的TNTs,可明显看出:其呈现不规则的管状结构,管长约为300 nm、管径约为30 nm,明显区别于其原始材料TiO2。图1d为Pt掺杂量为1%(质量比)时制备的Pt/TNTs,经光沉积法掺杂Pt后,TNTs仍维持管状结构并未受到破坏,同时可明显看到其管状结构上的金属颗粒。

图1 TiO2、Pt/TiO2、TNTs和Pt/TNTs样品的SEM照片
Figure 1 SEM images of pure TiO2 , Pt/TiO2, pure TNTs, and Pt/TNTs
SEM附加EDS可利用电子激发出的特性X光分析元素成分,从图2的EDS元素分析的结果可确定Pt确实已经负载在TiO2及TNTs上,催化剂中的Ti、O、Pt元素相对比例见表1。
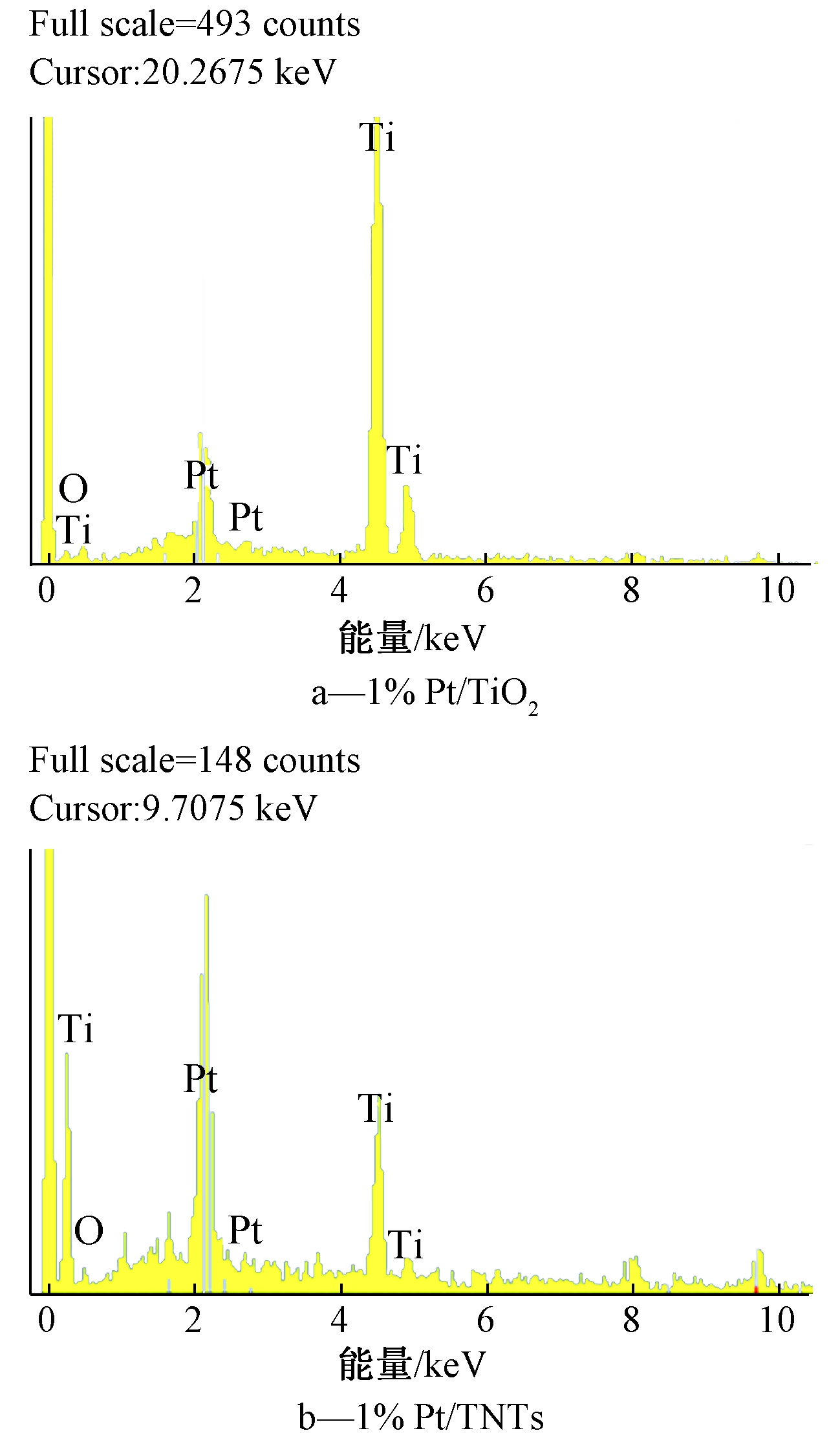
图2 1%Pt/TiO2、1%Pt/TNTs的EDS分析图谱
Figure 2 EDS images of 1%Pt/TiO2 and 1%Pt/TNTs
表1 SEM/EDS表面元素含量相对比例关系
Table 1 Relative proportionalities of elements on
surface of SEM/EDS

催化剂元素/%TiOPt1% Pt/TiO2673211% Pt/TNTs563014
由表1可知:Pt/TNTs上Pt的负载率明显高于Pt/TiO2,这是因为TNTs具有较高的比表面积。Ou等[12]也曾经指出,以微波水热法(与本研究相同反应条件)合成的TNTs,其比表面积约为256 m2/g,而TiO2仅为(50±1.5) m2/g。由此可推测,本研究所合成的TNTs与TiO2相比,确实有较高的比表面积。因此,在相同负载量与合成方法的条件下,TNTs能负载更多的Pt,具有更好的催化性能。
2.1.2 TEM
采用TEM来观察催化剂有助于研究样品的形貌和结构,图3分别为TiO2、Pt/TiO2、TNTs和Pt/TNTs的TEM照片。TiO2呈不规则形态,TNTs呈现管状结构,Pt/TiO2和Pt/TNTs的表面均存在微小颗粒,粒径为4~10 nm,依据Obregón等[13]的报道,本研究推测此颗粒为Pt金属。另外,对比图3c和3d可发现掺杂Pt后,TNTs的管状结构并未受到破坏,从而推测Pt不仅存在于TNTs表面,而且存在于其管状结构中。

图3 TiO2、Pt/TiO2、TNTs和Pt/TNTs样品的TEM照片
Figure 3 TEM images of pure TiO2 , Pt/TiO2, pure TNTs, and Pt/TNTs
2.1.3 XRD
图4为制备1%和10% Pt负载率的光催化剂的XRD图谱。峰A和R分别对应TiO2的锐钛矿相和金红石相。由图4a可知:TNTs的主要特征峰位于7.6°、27.5°和47.7°,且可看出掺杂1% Pt前后TiO2和TNTs颗粒的组成并没有太大变化。值得注意的是,Pt/TiO2和Pt/TNTs的XRD图谱中,在2θ=40°下未发现Pt的特征峰,这意味着Pt已经均匀分布于TiO2和TNTs上[11, 13],或者是Pt所占比例太低,峰不明显,或者颗粒太小以致晶型无法呈现[14]。为了确定掺杂在TiO2 和TNTs上的Pt是零价金属态还是氧化态,本研究使用光沉积法制备负载更高比例Pt的10% Pt/TiO2和10% Pt/TNTs,以期观察Pt的晶型,如图4b所示。在2θ=39.7°, 46.2°处均出现零价金属Pt的信号,说明光沉积法确实可将![]() 还原成Pt金属并沉积在TiO2或TNTs上。
还原成Pt金属并沉积在TiO2或TNTs上。
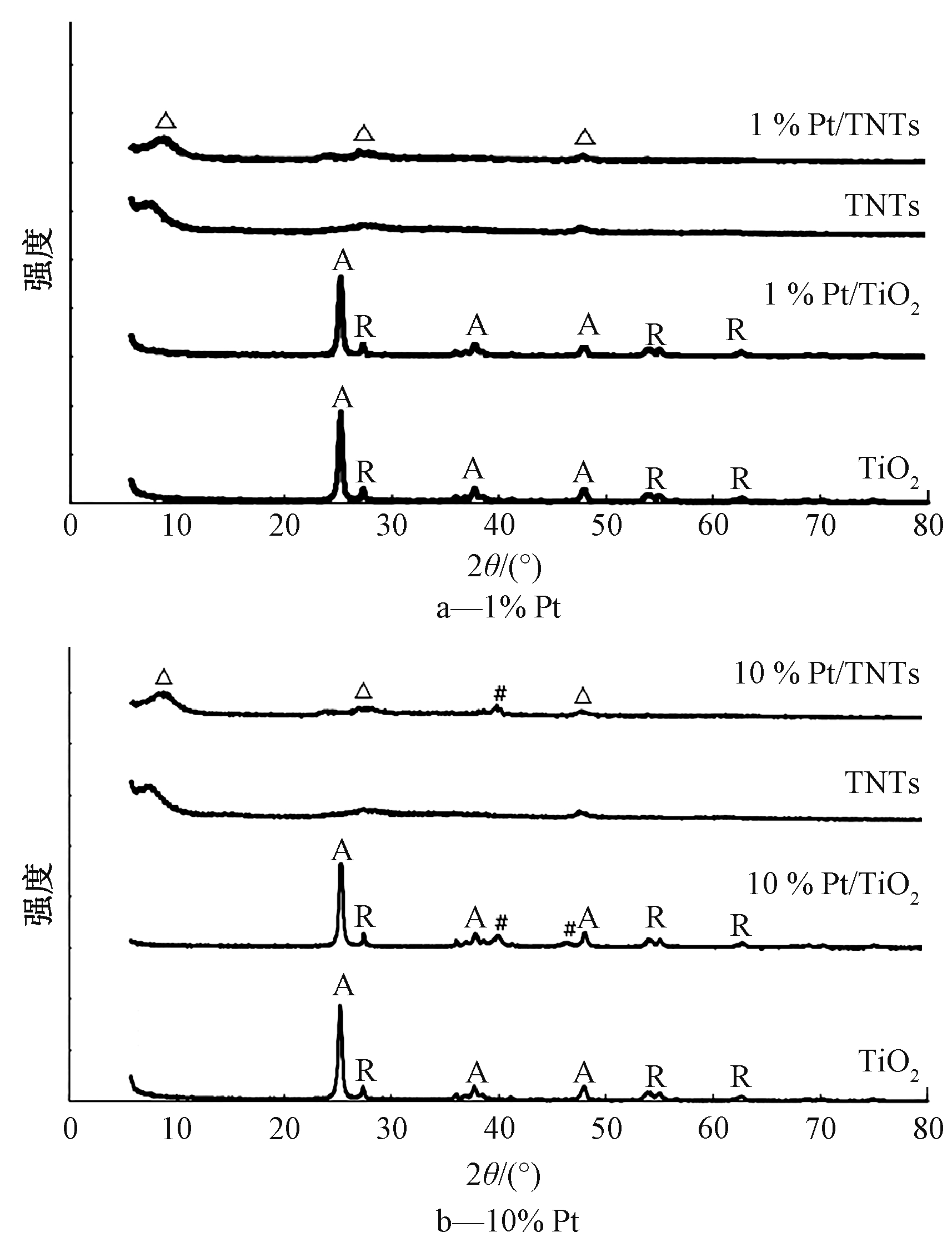
![]() — TNTs; A— 锐钛矿相; R— 金红石相; #— Pt。
— TNTs; A— 锐钛矿相; R— 金红石相; #— Pt。
图4 不同样品的X射线衍射图谱
Figure 4 XRD patterns of different samples
2.1.4 UV-Vis分析
图5为催化剂样品的紫外-可见吸收光谱图。可知:未掺杂改性的纯TiO2及利用微波水热法合成的TNTs的最大吸收峰分别为320,300 nm左右,整体吸收波长在紫外光区(200~400 nm)。掺杂Pt元素后,TiO2和TNTs的最大吸收波长分别为400,408 nm。表明光催化剂Pt/TiO2和Pt/TNTs吸收波长发生红移至可见光区域(400~700 nm),从而使光催化反应可以在可见光下进行。由于贵金属(如Pt)的费米能级低于TiO2,光激发的电子可以从高能导带转移至沉积在TiO2表面的金属颗粒,而光生空穴仍停留在TiO2的价带,这种方式可大大降低电子空穴与复合的概率,导致更高效的光催化反应[3,15-16]。

![]() TiO2;
TiO2; ![]() Pt/TiO2;
Pt/TiO2; ![]() Pt/TNTs;
Pt/TNTs; ![]() TNTs。
TNTs。
图5 不同样品的紫外-可见吸收光谱
Figure 5 UV-Vis absorption spectra of various samples
2.2 光催化性能
紫外光照射下,0.25 g TiO2在500 mL不同体积分数甲醇溶液中的催化产氢结果如图6所示。甲醇溶液是良好的空穴捕获剂,不同体积分数甲醇实验组的产氢量由大至小依次为:20%>50%>100%(纯甲醇)>10%>0%(纯水),20%甲醇浓度拥有最佳产氢效果,经3 h紫外光照射反应后累计产氢1473.9 μmol,平均每小时生成491.3 μmol/h。故可见此产氢系统需有适量的甲醇作为介质才能有效进行氧化还原反应[17]。
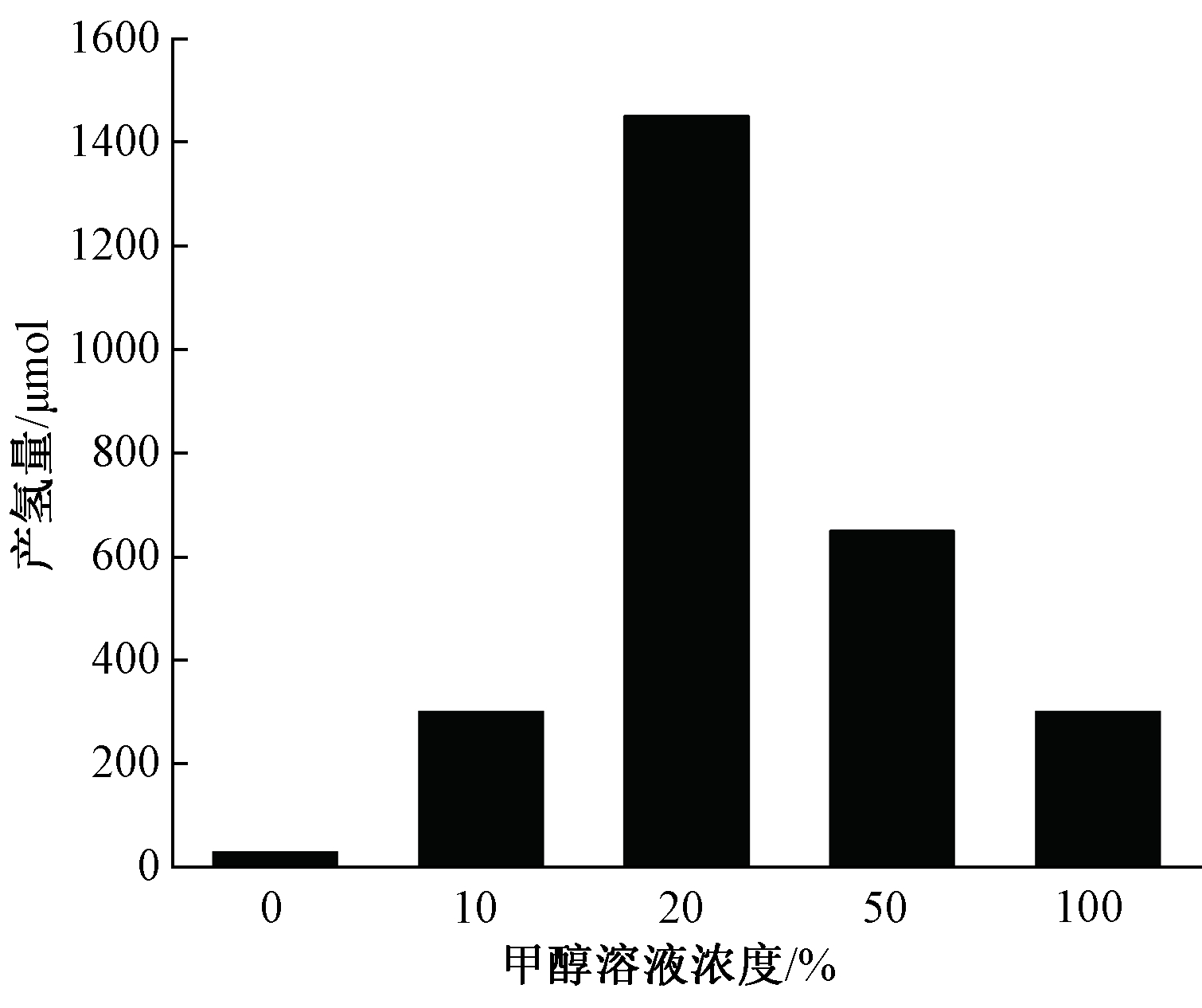
图6 甲醇浓度对紫外光下TiO2催化产氢的影响
Figure 6 Effect of methanol concentration on photocatalytic hydrogen
production over TiO2 for 3 h under UV light irradiation
Pt掺杂量对光催化产氢效率的影响如图7所示。可知:Pt掺杂量为1%(质量分数)时,制备的催化剂Pt/TiO2在紫外光和可见光下均可达到最高产氢量。低Pt负载率下,随着Pt负载量的增加产氢率随之增加,Pt可以捕获电子从而提高产氢率,向TiO2中掺杂的Pt可以提升光催化剂的活性和增加电子和空穴的分离周期。达到最高点后,随着Pt负载量的增加催化活性下降,其原因是过多的Pt纳米团簇聚集在TiO2表面,这些纳米团簇会屏蔽TiO2光敏表面和散射光线,降低有效的光照区域,从而降低了参加反应的电子和空穴的表面浓度[12]。以下研究中采用0.25 g催化剂,500 mL甲醇水溶液,1%Pt掺杂量考察不同催化剂的光催化效率。

![]() —UV;
—UV; ![]() —可见光。
—可见光。
图7 不同Pt掺杂量对Pt/TiO2紫外光下催化产氢效率的影响
Figure 7 Hydrogen production of Pt/TiO2 with different amount of
Pt in 20 vol% methanol solution under UV light irradiation
将最佳掺杂量1%的Pt以光沉积法分别掺杂于TiO2和TNTs上。图8为TiO2、TNTs、1%Pt/TiO2、1%Pt/TNTs 4种光催化剂于紫外光(图8a)及可见光(图8b)照射下反应3 h产氢量的比较。可以发现,将TiO2制成TNTs或掺杂Pt都可有效提高产氢量,1%Pt/TNTs产氢效果最佳,反应时间3 h可产约7000 μmol的氢气,产氢速率为2331 μmol/h。1%Pt/TNTs的产氢效果好于1%Pt/TiO2,其原因为TNTs具有较高的比表面积,可负载更多的Pt,使电子有效转移至金属上,降低电子电洞对再结合的概率,并增加光催化效果,促进产氢量增加。由图8b可见:光下产氢效果最好的催化剂同样是1%Pt/TNTs,产氢速率可达137.7 μmol/h。可见在相同掺杂方法及Pt掺杂量下,TNTs因具有较高的比表面积,在紫外光和可见光的条件下,1%Pt/TNTs的光催化效果均优于1%Pt/TiO2。
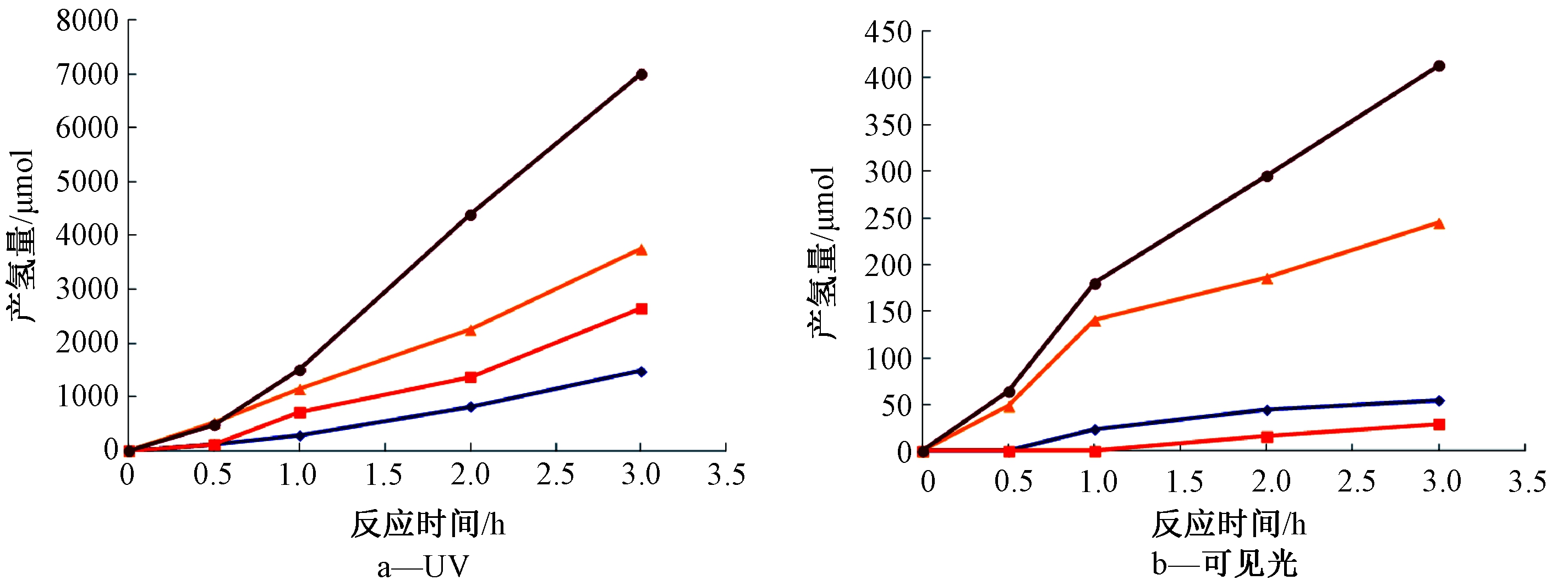
![]() —TiO2;
—TiO2; ![]() —TNTs;
—TNTs; ![]() —1%Pt/TiO2;
—1%Pt/TiO2; ![]() —1%Pt/TNTs。
—1%Pt/TNTs。
图8 TiO2、TNTs、1%Pt/TiO2和1%Pt/TNTs于紫外光和可见光下光催化产氢效率比较
Figure 8 Hydrogen productions of TiO2, TNTs, 1%Pt/TiO2 and 1%Pt/TNTs under UV and visible light irradiation
本研究的最佳产氢催化剂为1% Pt/TNTs,可见光照射下反应平均产氢率为137 μmol/h,为进一步了解本研究的产氢材料及其实验条件是否具有优势,将本研究成果与其他光电化学法产氢的文献中的产氢率进行比较,如表2所示。
表2 可见光下产氢率的文献对比
Table 2 Literature comparison of hydrogen production under visible light

光催化剂溶液灯源功率/W灯源波长λ/nm产氢率/(μmol/h)文献来源0.2%Pt/TiO2-xNx60% CH3OH 溶液400λ≥38079.1[18]CdS/TNTs0.35 mol/L Na2SO3 溶液0.25 mol/L Na2S 溶液300λ≥420100.0[19]1%Pt/WO3+1%Pt/ZrO2/TaON1.0 mol/L NaI 溶液300350≤λ≤80052.1[20]0.3% Pt/CdS/TiO230%(体积分数)甘油溶液500λ≥41816.25[7]2%石墨烯/CdS0.07 mol/L Na2SO3溶液0.05 mol/L Na2S 溶液450λ≥3804.9[21]0.01%Pt/CdS/TNTs+WO320 %(体积分数) HCOOH 溶液150350≤λ≤800852.5[22]1%Pt/TNTs20% CH3OH 溶液150350≤λ≤800137.7本研究
从表2比较结果可发现:本研究所用可见灯灯管的功率为150 W,相对于其他文献功率较低,但产氢率和文献相差不大,甚至高于某些文献。综上可知,本研究的产氢系统使用较低功率的灯管就能达到良好的产氢效果,具有较好的发展潜力。
3 结 论
1)由于具有更高的比表面积,TNTs可以负载更多的金属颗粒。
2)纯TiO2或TNTs均无法于可见光下反应产氢,经过Pt掺杂改性后的TiO2和TNTs可将其吸收光谱红移至可见光区,同时也利用金属对电子的强烈吸引力,抑制电子与电洞再结合,增加水解产氢的概率。
3)在紫外光或可见光的照射下,反应效果最佳的光催化剂均为Pt负载量为1%的Pt/TNTs,甲醇溶液体积分数为20%时,其紫外光和可见光下产氢率分别可达2331,137.7 μmol/h。对比其他文献可知,本研究中可见光下的产氢系统使用较低功率的灯管就能达到良好的产氢效果,具有一定的发展潜力。
[1] 兰隽如,周晓琴,李子富,等. 硅胶负载TiO2催化剂的制备与光催化效果[J]. 环境工程,2017,35(2):43-48.
[2] 李仁贵. 太阳能分解水制氢最近进展:光催化、光电催化及光伏-光电耦合途径[J]. 催化学报,2017,38(1):5-12.
[3] NI M, LEUNG M K H, LEUNG D Y C, et al. A review and recent developments in photocatalytic water-splitting using TiO2 for hydrogen production[J]. Renewable and Sustainable Energy Reviews, 2007, 11(3): 401-425.
[4] 张文博,邓德明. g-C3N4/TiO2复合光催化剂的制备及酸化改性[J]. 环境工程,2018,36(4):66-71.
[5] 谭璞,宋亚忠,吴剑铭,等. 二维共轭碳材料/TiO2复合光催化剂制备及表征[J]. 工业催化,2019,27(2):49-53.
[6] 张学敏,周北海,袁蓉芳,等. 金属掺杂对纳米管TiO2光催化去除水中罗丹明B的影响[J]. 环境工程,2015,33(增刊1):958-963.
[7] MELO M D, SILVA L A. Visible light-induced hydrogen production from glycerol aqueous solution on hybrid Pt-CdS-TiO2 photocatalysts[J]. Journal of Photochemistry and Photobiology a-Chemistry, 2011, 226(1): 36-41.
[8] 姜建辉,邓臣强,曹钰,等. Y和Si共掺杂纳米TiO2的制备及光催化性能[J]. 硅酸盐学报,2019,47(7):942-950.
[9] ZHANG D F. Visible light-induced photocatalysis through surface plasmon excitation of platinum-metallized titania for photocatalytic bleaching of rhodamine B[J]. Monatshefte Fur Chemie, 2012, 143(5): 729-738.
[10] 赵醒,胡彦杰,蒋洁超,等. 过渡金属原位掺杂Pt/TiO2的喷雾燃烧制备及其CO氧化性能[J]. 华东理工大学学报 (自然科学版),2018,44(6):823-830.
[11] SHOKRI M, HOSSEINI M G, KHOSRAVI M, et al. The preparation of Pt-modified TiO2 nanoparticles via microemulsions, and their application in photocatalytic removal of an azo dye[J]. Fresenius Environmental Bulletin, 2011, 20(4A): 1063-1068.
[12] OU H H, LO S L. Effect of Pt/Pd-doped TiO2 on the photocatalytic degradation of trichloroethylene[J]. Journal of Molecular Catalysis a-Chemical, 2007, 275(1/2): 200-205.
[13] OBREGóN S, COLóN G. Improved H2 production of Pt-TiO2/g-C3N4-MnOx composites by an efficient handling of photogenerated charge pairs[J]. Applied Catalysis B: Environmental, 2014,144, 775-782.
[14] CHOWDHURY P, MALEKSHOAR G, RAY M B, et al. Sacrificial hydrogen generation from formaldehyde with Pt/TiO2 photocatalyst in solar radiation[J]. Industrial & Engineering Chemistry Research, 2013, 52(14): 5023-5029.
[15] 徐敬博,吴音,张思源,等. 稀土元素掺杂对TiO2薄膜结构和光催化性能的影响[J]. 陶瓷学报,2019,40(1):14-17.
[16] 卢月洁,张美,毕先均. 微波水热法制备稀土元素铒掺杂TiO2光催化剂及光催化活性[J]. 工业催化,2017,25(2):27-32.
[17] GALINSKA A, WALENDZIEWSKI J. Photocatalytic water splitting over Pt-TiO2 in the presence of sacrificial reagents[J]. Energy & Fuels, 2005, 19(3): 1143-1147.
[18] LIN Y M,REI M H. Process development for generating high purity hydrogen by using supported palladium membrane reactor as steam reformer[J]. International Journal of Hydrogen Energy, 25 (3): 211-219.
[19] LI C L, YUAN J, HAN B Y, et al. TiO2 nanotubes incorporated with CdS for photocatalytic hydrogen production from splitting water under visible light irradiation[J]. International Journal of Hydrogen Energy, 2010,35 (13): 7073-7079.
[20] MAEDA K, HIGASHI M, LU D L, et al. Efficient nonsacrificial water splitting through two-Step photoexcitation by visible light using a modified oxynitride as a hydrogen evolution photocatalyst[J]. Journal of the American Chemical Society, 2010,132 (16): 5858-5868.
[21] LV X J, FU W F, CHANG H X, et al. Hydrogen evolution from water using semiconductor nanoparticle/graphene composite photocatalysts without noble metals[J]. Journal of Materials Chemistry, 2012, 22 (4): 1539-1546.
[22] YEH H M, LO S L, CHEN M J, et al. Hydrogen production from formic acid solution by modified TiO2 and titanate nanotubes in a twostep system under visible light irradiation[J]. Water Sci Technology, 2014, 69 (8): 1676-1681.