0 引 言
高剂量摄取氟化物会对人体健康产生非常不利的影响,目前我国饮用水氟污染十分严重[1,2],因此开展饮用水除氟研究,开发高效经济的除氟技术势在必行。
饮用水除氟应用最广泛的是吸附法,目前常见的吸附剂有活性氧化铝、稀土金属类氧化物、活性炭、二氧化钛等。其中,铝氧化物对氟离子的吸附容量较低,仅为5.96 mg/g,且过量摄入铝离子会导致人神经元退化[3,4];稀土金属类氧化物的氟离子吸附容量为7 mg/g,但该材料成本较高,不适合大规模工业生产和应用[5]。相比之下,二氧化钛具有安全无毒、化学性质稳定、成本低廉等优点,具有良好的除氟应用前景[6]。Babaeivelni等[7]用Degussa P25对氟离子进行吸附,最大吸附量为0.27 mg/g;Liang等[8]采用溶胶-凝胶法在500 ℃下煅烧合成了SiO2-TiO2,该吸附剂拟合最大吸附量为152.2 mg/g;Zeng等[9]通过水热法在500 ℃下煅烧后合成了TiO2,最大吸附氟容量为94.3 mg/g;Yan等[10]通过水解法在400 ℃下煅烧后合成了TiO2-La,最大吸附氟容量为78.4 mg/g。改变TiO2内部孔隙结构从而增大比表面积,促进晶型的产生与转变,而TiO2的制备过程通常需要高温煅烧[11-12]。然而高温煅烧不仅耗能,同时会造成表面羟基基团的损失,目前缺少便于生产实践的TiO2低温合成方法。本研究使用水解法在50 ℃下通过酸改性得到锐钛矿型的TiO2,研究了所合成TiO2材料的除氟性能,以及吸附剂投加量、溶液pH、共存阴离子、温度等因素对氟离子吸附性能的影响,分析了吸附动力学与热力学,为TiO2吸附剂材料的低能耗、大规模生产和应用提供理论支撑。
1 实验部分
1.1 试剂与仪器
PF-1-01型氟离子电极(雷磁上海仪电科学仪器股份有限公司),232-01型参比电极(雷磁上海仪电科学仪器股份有限公司),ZEY-200D型恒温圆周形振荡摇床(上海智诚分析仪器制造有限公司),ZNCL-B型磁力搅拌器(西安予辉仪器有限公司)。
主要试剂:钛酸四异丙酯、异丙醇、NaF、HNO3、NaOH均为分析纯(国药集团化学试剂有限公司),实验用水为去离子水。Degussa P25(无锡拓博达钛白制品有限公司)。
1.2 TiO2吸附剂材料的制备
TiO2的合成过程如下:A溶液为浓度0.1 mol/L的硝酸溶液;B溶液为4 mL异丙醇中加入10 mL钛酸四异丙酯,搅拌10 min。将200 mL的A溶液加热至50 ℃,搅拌状态下将B溶液逐滴缓慢加入A溶液中,得到白色的混合溶液。于50 ℃下持续搅拌2 h后关闭加热,搅拌至室温。将所得沉淀物抽滤、水洗,50 ℃烘干24 h,研磨后得到的产物即为TiO2样品。
1.3 材料表征
产物的晶型结构通过X’Pert PRO MRD型衍射仪(荷兰帕拉克公司)测定,采用Cu-Kα激发辐射法,电压为40 kV,电流为40 mA。产物的红外分析采用KBr压片法,通过BRUKER TENSOR 37傅里叶红外光谱仪(德国布鲁克公司)测定。产物的比表面积通过彼奥德SSA-4200孔径比表面积分析仪(北京彼奥德电子技术有限公司)测定,由液氮条件下N2吸脱附法计算得出。
1.4 吸附实验
用无水NaF和去离子水制备研究中使用的氟离子标准溶液。吸附剂样品在20 mL氟离子溶液中以200 r/min的速度振荡吸附。在吸附等温线实验中,将TiO2吸附剂加入至初始浓度为3,5,10,20,50,100 mg/L的氟离子溶液中,在25 ℃下振荡3 h。在吸附动力学实验中,在pH值为4的条件下,将TiO2吸附剂加入至初始浓度为6,10,20 mg/L的氟离子溶液中,在不同吸附时间(0~180 min)下测定溶液中吸附质的浓度,并应用不同动力学模型对实验结果进行分析。以上实验中,设置Degussa P25为对照组。在pH值为4的条件下,氟离子浓度为10 mg/L,考察浓度范围为10~100 mg/L的不同种类阴离子![]() 对吸附效率的影响。
对吸附效率的影响。
在吸附剂投加量对吸附性能的影响实验中,在pH值为4的条件下,投加量为0.5,1,1.5,2,2.5,3 g/L的吸附剂分别与浓度为5 mg/L的氟离子溶液反应,振荡3h。溶液pH对吸附性能的影响实验中,使TiO2吸附剂在5 mg/L的氟离子溶液中,于pH值为2,3,4,…,10下振荡3h,溶液pH值用0.1 mol/L的HNO3和NaOH溶液调节。在热力学实验中,在pH值为4的条件下,使TiO2吸附剂分别在5,10,20 mg/L的氟离子溶液中,于15,25,35,45 ℃下摇动3 h。通过氟离子选择性电极测定残留的氟离子浓度。根据式(1)—(2)计算吸附容量和除氟效率:
(1)
(2)
式中:Qe为平衡吸附量,mg/g;C0和Ce分别为初始和吸附平衡状态下的氟离子浓度,mg/L;η为除氟效率,%;m为所用吸附剂的质量,g;V为溶液体积,L。
2 结果与讨论
2.1 TiO2吸附剂的表征
图1为TiO2和Degussa P25的XRD图。合成锐钛矿型TiO2的XRD图中出现了对应锐钛矿相的(101)、(004)、(200)、(211)、(204)晶面峰[13],说明其为较纯的锐钛矿型TiO2;Degussa P25则为锐钛矿与金红石两种晶相的混合。在钛酸异丙酯的水解过程中,硝酸的加入可反应生成Ti(NO3)4,而Ti(NO3)4极不稳定,在水中迅速水解生成TiO2。当Ti(NO3)4浓度较低时,反应生成的是钛水合物Ti(OH)4,在XRD图谱中表现为无定形状态,且在强酸中易溶解[14]。因此,当加入酸量较大时,水解产物多为TiO2,即使不经过煅烧,其依然存在TiO2晶型,该研究实现了在低温50 ℃下通过酸改性合成锐钛矿型TiO2。

图1 TiO2与Degussa P25的XRD结果图
Figure 1 XRD patterns of the as-prepared TiO2 and Degussa P25
TiO2良好的吸附能力主要归因于其表面丰富的羟基基团[15]。本研究合成的TiO2材料与Degussa P25的FT-IR光谱如图2所示。可知:Degussa P25除了Ti—O键的特征吸收峰(400~800 cm-1)[16]外,无其他基团的吸收峰,TiO2较Degussa P25而言含有更丰富的有机基团。3377 cm-1左右的较强吸收峰为Ti—OH伸缩振动峰,1620 cm-1处为—OH特征振动峰[17],表明该样品表面因未煅烧保留了大量—OH,有利于吸附的进行。TiO2中1389 cm-1处对应于![]() 的N—O伸缩振动,来源于合成中的硝酸[18]。
的N—O伸缩振动,来源于合成中的硝酸[18]。
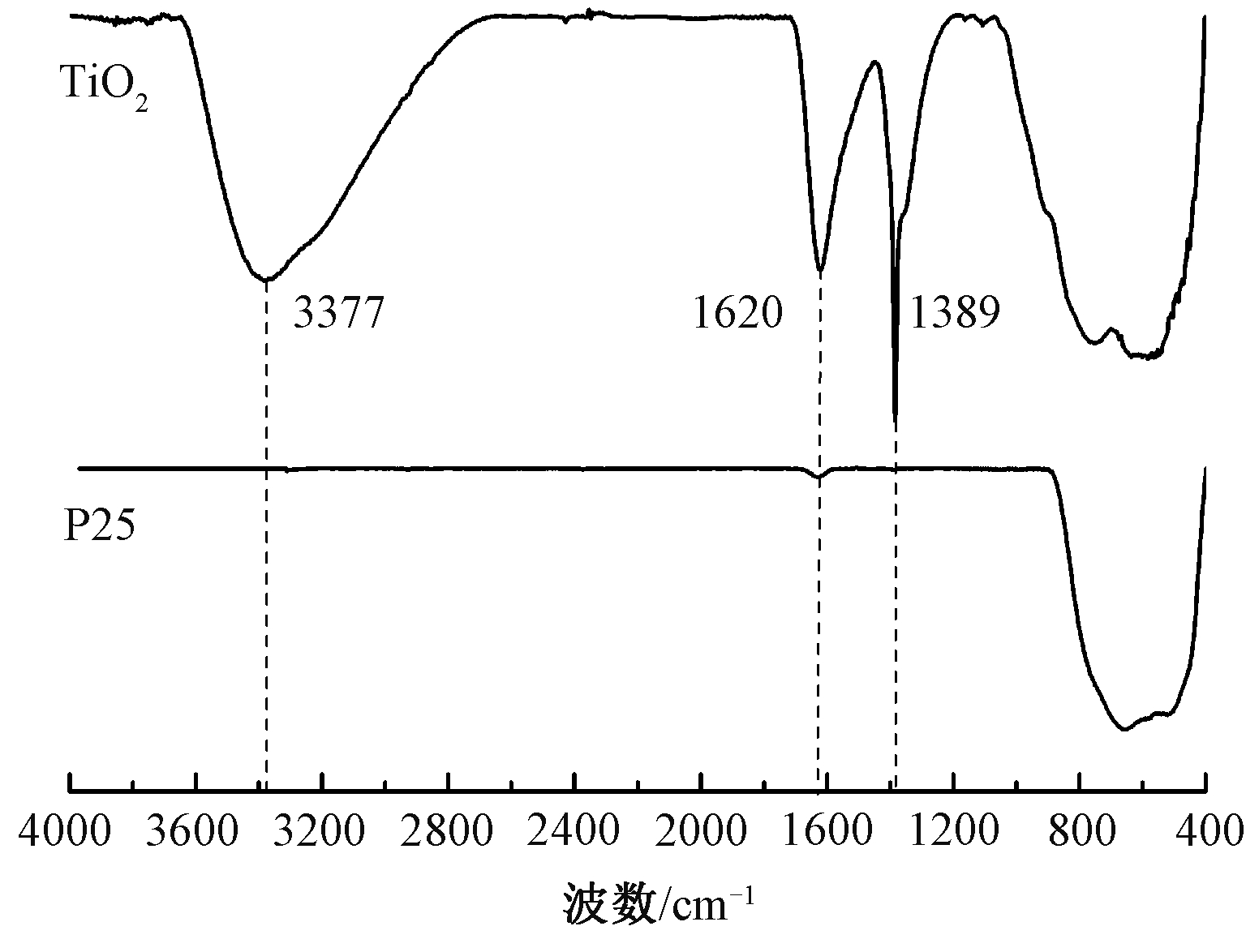
图2 TiO2与Degussa P25的红外谱图
Figure 2 FT-IR spectra of the as-prepared TiO2 and Degussa P25
本研究利用在77 K温度下对N2的吸脱附曲线,研究了TiO2及Degussa P25的比表面积(SBET)、孔容积(V)以及平均孔径(R)等参数,见表1。结果表明,所制备的TiO2的比表面积达到278.93 m2/g,远高于Degussa P25的55.32 m2/g,表明其具有更多的活性位点。
表1 TiO2与Degussa P25的BET参数
Table 1 The textural properties of the as-prepared
TiO2 and Degussa P25
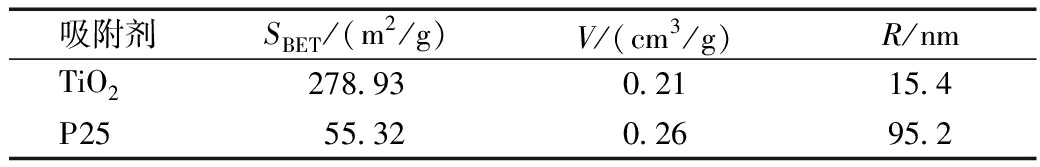
吸附剂SBET/(m2/g)V/(cm3/g)R/nmTiO2278.930.2115.4P2555.320.2695.2
2.2 吸附性能分析
2.2.1 吸附剂投加量的影响
吸附剂的投加量对于工程应用中的成本而言至关重要。吸附剂的投加量对水体中除氟效果的影响如图3所示。可知:当吸附剂投加量>1.0 g/L时,已具有较高的氟离子吸附率,去除率超过95%,随着吸附剂用量的进一步增加,去除率几乎不再增加。这是由于当溶液中氟离子含量一定时,TiO2投加量的增加会导致吸附活性位点的增加,而随着投加量的继续增加,单位吸附剂吸附氟离子的量显著下降。因此从节约成本方面考虑,本研究选取1.0 g/L作为后续实验中的吸附剂投加量。
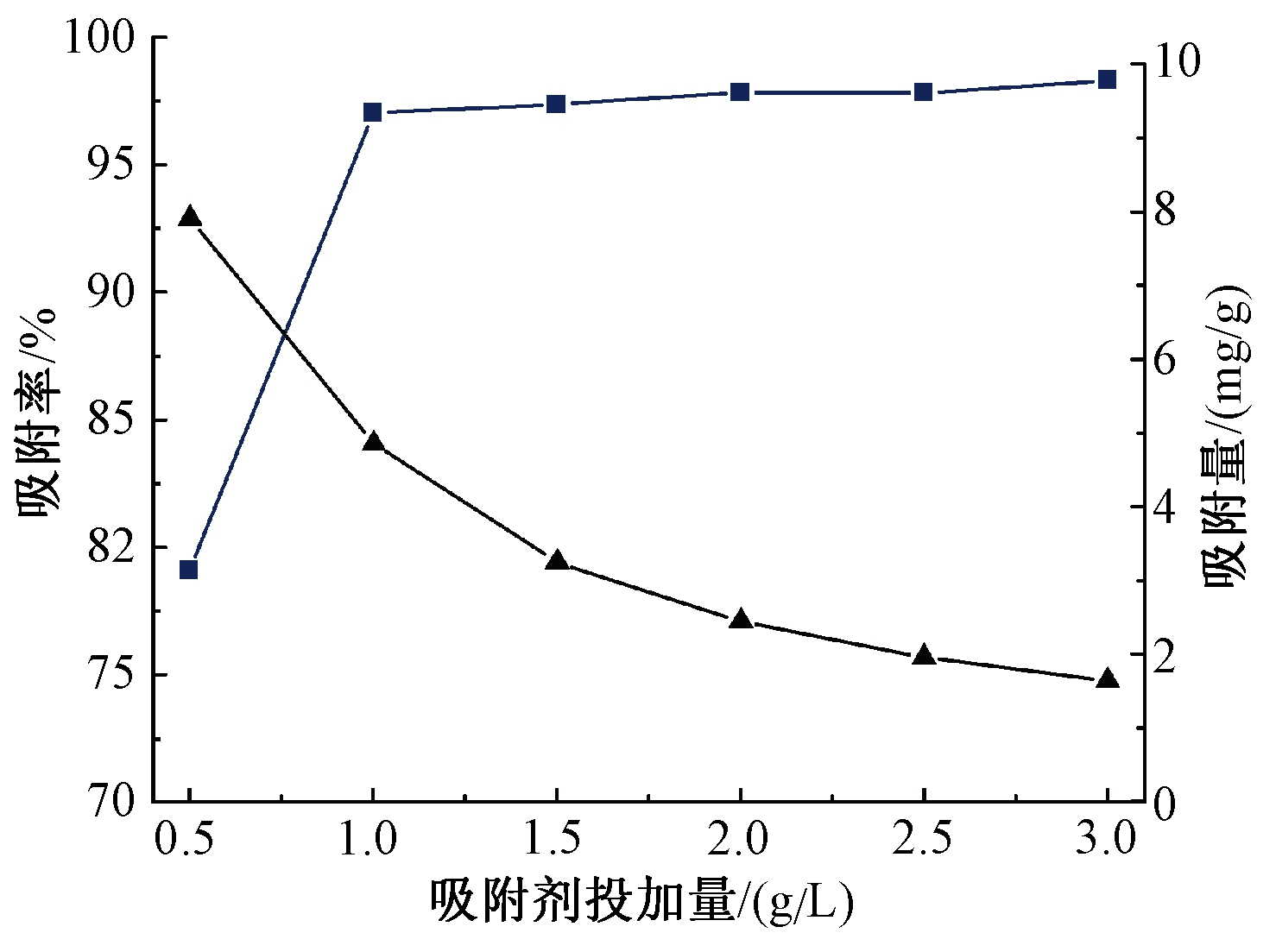
![]() —吸附率;
—吸附率; ![]() —吸附量。
—吸附量。
图3 TiO2投加量对吸附氟离子的影响(C0=5 mg/L,pH=4)
Figure 3 Effect of adsorbent dosage on the adsorption capacity
and removal efficiency of F- onto TiO2
2.2.2 pH的影响
图4为吸附剂投加量为1.0 g/L,初始氟浓度为5 mg/L,溶液不同pH值下TiO2的除氟率。可知:随溶液pH值上升,TiO2吸附效率逐渐降低。对于初始氟浓度为5 mg/L的氟溶液来说,投加1.0 g/L的TiO2后,当溶液pH为2~5时,除氟率都能达到85%以上,余氟浓度都能达到国家GB 5749—2006《生活饮用水卫生标准》对氟浓度的限值1.0 mg/L。这是因为TiO2对污染物的去除是利用其表面大量的羟基基团,羟基基团可以与氟离子发生静电吸附作用。当溶液呈碱性,OH-会与氟离子发生竞争作用,从而降低除氟效率;若溶液呈酸性,带正电荷的表面位点会增加氟离子的吸附量[9]。

图4 溶液pH对TiO2除氟率的影响
Figure 4 Effect of solution pH on the adsorption efficiency of TiO2 for F-
2.2.3 吸附等温线实验
TiO2与Degussa P25在pH为4,投加量为1.0 g/L,不同氟离子初始浓度下的平衡吸附量如图5所示,本研究使用Langmuir模型与Freundlich模型对数据进行拟合[19]。其中,Langmuir模型的吸附等温线见式(3):
(3)
式中:Qmax为吸附剂的最大吸附量,mg/g;KL为Langmuir吸附平衡常数,L/mg。
Freundlich模型的吸附等温线表达式见式(4):
(4)
式中:KF为Freundlich吸附平衡常数,mg1-n·Ln/g;1/n为与吸附亲和力相关的常数。
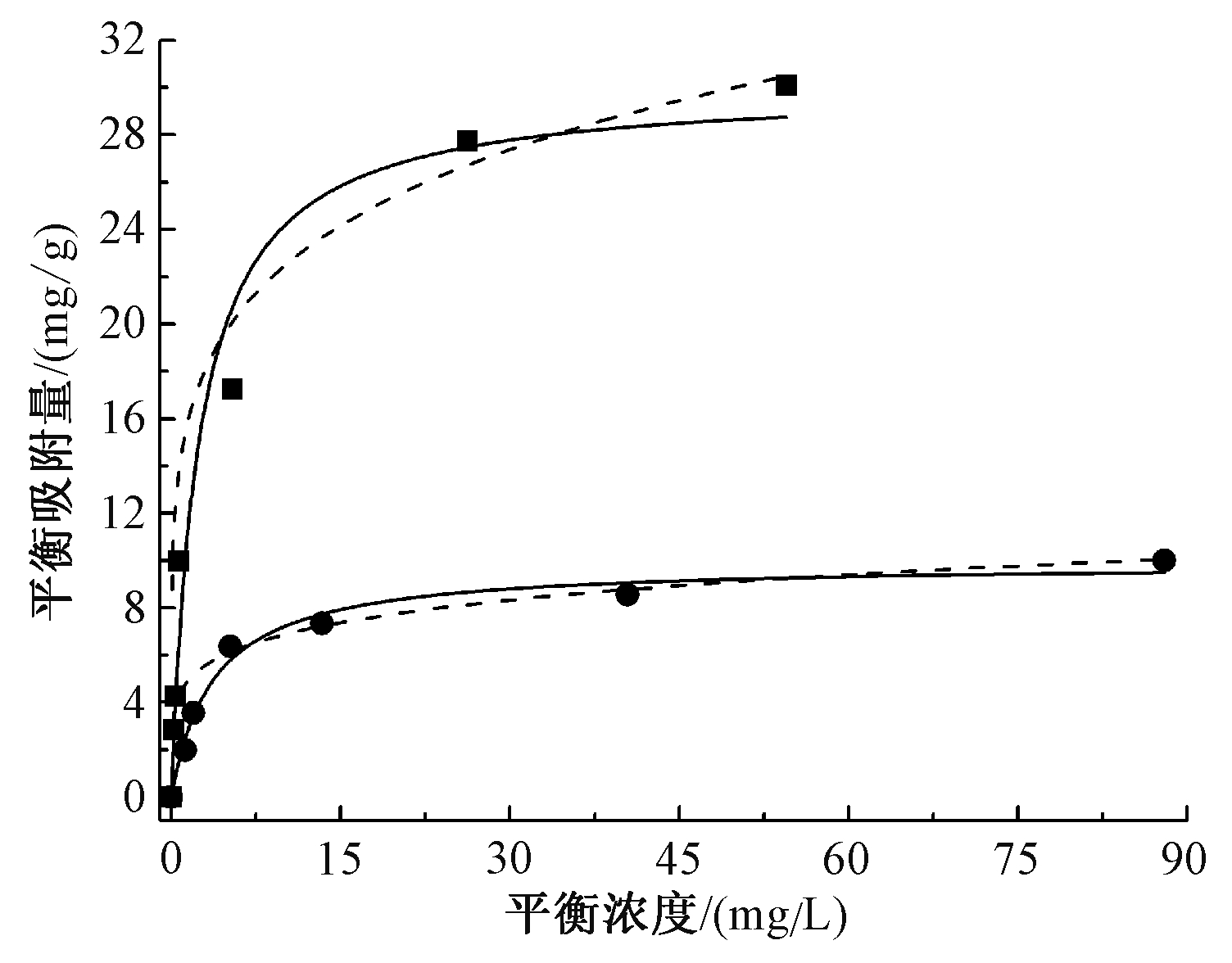
![]() TiO2;
TiO2;![]() P25; ——Langmuir模型; ----Freundlich模型。
P25; ——Langmuir模型; ----Freundlich模型。
图5 TiO2和Degussa P25的吸附等温线
Figure 5 Adsorption isotherms for F- onto TiO2 and Degussa P25
表2中列出了氟离子吸附等温线模型的相关参数,拟合Langmuir模型的相关系数(R2)大于Freundlich模型。表明Langmuir模型更适合于描述TiO2对氟离子的吸附行为,即TiO2的有效吸附位点是有限的,并且更趋向于单分子层吸附,当有效吸附位点被氟离子完全占据后,吸附过程出现了动态平衡[19]。通过比较发现,TiO2对氟离子的拟合最大吸附量可达30.02 mg/g,高于Degussa P25的9.89 mg/g,可以看出,TiO2的对氟离子吸附性能好于Degussa P25。另外,由表2可看出:Freundlich常数1/n为0.1~0.5,说明TiO2对氟离子的吸附过程较容易进行。
表2 Langmuir和Freundlich等温线模型拟合参数
Table 2 Adsorption equilibrium parameters acquired
from the Langmuir and Freundlich models in the
adsorption of F- onto the TiO2 and Degussa P25

吸附剂Langmuir 模型Freundlich 模型Qmax/(mg/g)KL/(L/mg)R2KF/(mg1-n·Ln/g)1/nR2TiO230.020.410.965914.830.180.8629P259.890.270.98154.590.170.8575
2.2.4 吸附动力学实验
吸附动力学主要研究吸附剂的吸附过程与吸附时间之间的关系,反映吸附速度与吸附动态平衡关系。本研究用准一级和准二级动力学模型对数据进行拟合[20]。其中,准一级动力学模型的表达式为式(5):
Qt=Qe(1-e-k1t)
(5)
式中:Qe为平衡吸附量,mg/g;Qt为t时刻的吸附量,mg/g;k1为准一级动力学模型的吸附速率常数,min-1。
准二级动力学模型的表达式为式(6):
(6)
式中:k2为准二级动力学模型的吸附速率常数,g/(mg·min)。
图6为pH为4,投加量为1.0 g/L,不同初始浓度下TiO2吸附氟离子的准一级和准二级动力学模型的拟合曲线,表3列出了动力学拟合参数。由图6可看出:在吸附的前20 min,氟离子的去除速率非常快,随后去除速率开始减缓,该吸附过程在30 min内即可达到吸附平衡。结合图6和表3可以看出,准一级动力学模型的拟合相关系数(R2)要高于准二级动力学模型,且准一级动力学拟合得到的Qe,1,拟合更接近实验值Qe,1,实验,说明TiO2对氟离子的吸附行为用准一级动力学模型描述更合适,反应速率与氟离子浓度呈线性相关。
研究离子的扩散机理有助于理解扩散过程对吸附速度的影响。氟离子在吸附剂内部的扩散过程可用Weber-Morris模型来描述,方程式如下:

![]() 6 mg/L;
6 mg/L;![]() 10 mg/L;
10 mg/L;![]() 20 mg/L; ——准一级动力学; ----准二级动力学。
20 mg/L; ——准一级动力学; ----准二级动力学。
图6 不同初始浓度下TiO2和Degussa P25的吸附动力学曲线(pH=4,投加量为1.0 g/L)
Figure 6 Contact time versus adsorption capacity of F- onto TiO2 and Degussa P25 at various initial concentrations
表3 不同初始浓度下TiO2和Degussa P25的吸附动力学参数
Table 3 Kinetic parameters obtained from the pseudo-first-order and pseudo-second-order models of F-adsorption
onto TiO2 and Degussa P25 at various initial concentrations

吸附剂C0/(mg/L)准一级动力学准二级动力学k1/min-1Qe,1,拟合/(mg/g)Qe,1,实验/(mg/g)R2k2/[g/(mg·min)]Qe,2/(mg/g)R2TiO260.145.885.870.97740.196.350.9430100.189.739.790.99920.2810.370.9847200.1918.0918.140.98320.2819.330.9522P2560.063.893.830.97270.074.440.9424100.056.246.200.98780.057.270.9794200.0810.5510.410.97840.1011.780.9516
(7)
式中:Ki为粒内扩散速率常数,mg/(g·min1/2);Ci为与厚度有关的边界层常数,Ci值越大,边界层对吸附的影响越大。
将吸附数据进行分段线性拟合,拟合曲线如图7所示。可以看出,该吸附过程为多阶段过程。第1阶段约为前3 min,包含吸附质通过边界层到达吸附剂表面的外扩散;第2阶段为3~6 min,发生在吸附剂孔隙内部,速率较低,起主要作用的是颗粒内扩散过程;第3阶段为6~14 min,是最后的平衡阶段。并且,图中直线都不经过原点,说明TiO2吸附氟离子的机理较为复杂,颗粒内扩散过程除吸附过程的控制步骤外,吸附剂周围液相边界层向粒子表面的扩散过程对其也存在影响。

![]() —6 mg/L;
—6 mg/L; ![]() —10 mg/L;
—10 mg/L; ![]() —20 mg/L。
—20 mg/L。
图7 TiO2吸附数据的Weber-Morris模型拟合
Figure 7 Weber-Morris model fitting results of TiO2
2.2.5 溶液中共存阴离子的影响
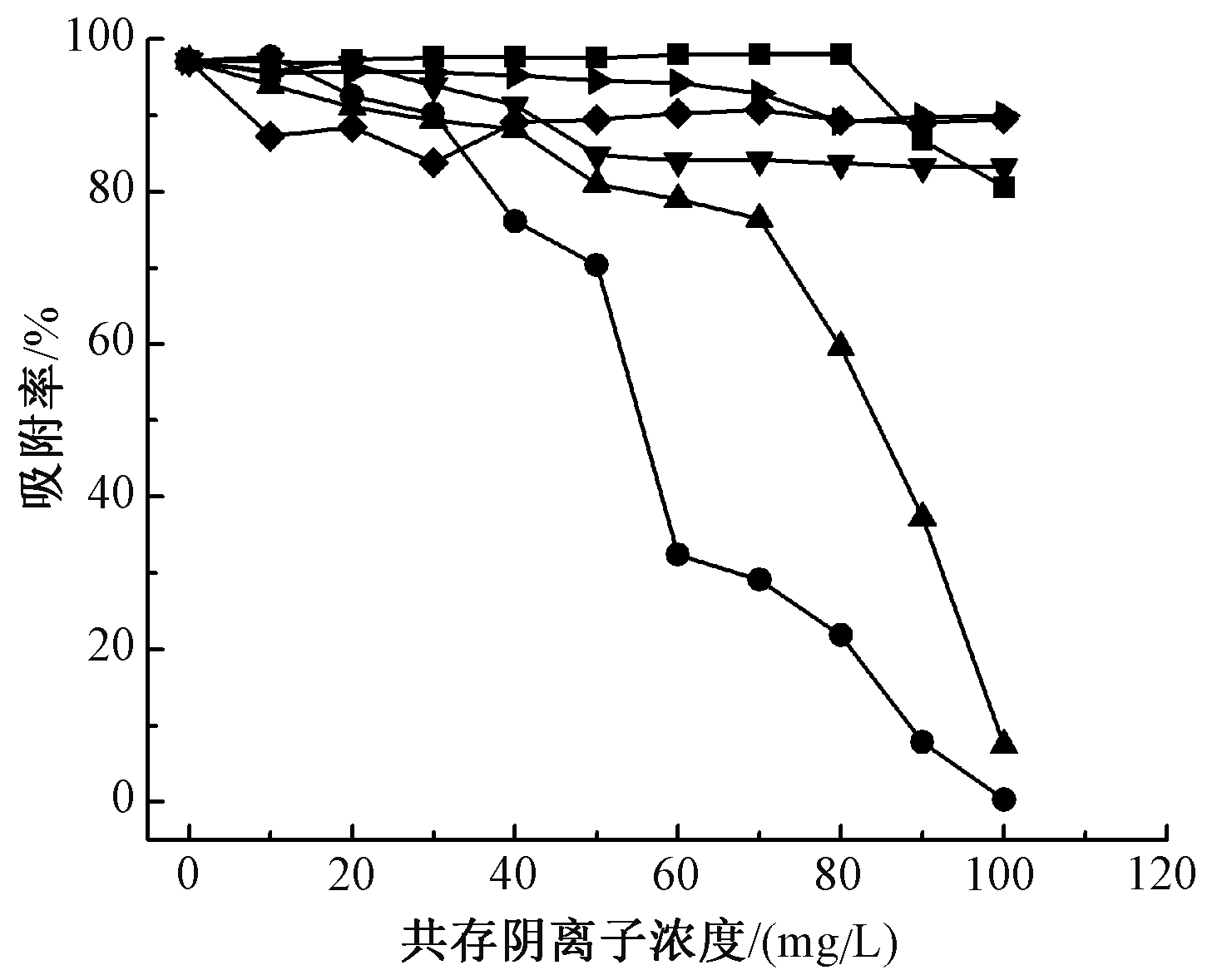
考虑到地下水中的其他阴离子会在同一活性位点与氟离子发生竞争,因此需要评估溶液中其他干扰离子对吸附剂除氟性能的影响。图8给出了地下水中常见的几种阴离子在不同浓度下对TiO2除氟吸附性能的影响。
![]()
![]()
图8 不同浓度的溶液共存阴离子对TiO2除氟的影响
(C0=10 mg/L,pH=4,投加量为1.0 g/L)
Figure 8 Effect of different concentrations of co-exist ions on the
adsorption of F- onto TiO2
由图8可知:当溶液中存在![]() 时,随着浓度的升高,TiO2对氟离子的吸附量有所降低,但降低趋势平缓,说明离子强度对吸附过程的影响是有限的。Hu等[21]经研究认为,离子强度对吸附的影响验证了静电作用的影响。当溶液中存在的
时,随着浓度的升高,TiO2对氟离子的吸附量有所降低,但降低趋势平缓,说明离子强度对吸附过程的影响是有限的。Hu等[21]经研究认为,离子强度对吸附的影响验证了静电作用的影响。当溶液中存在的![]() 超过50 mg/L时,除氟率随着阴离子浓度增加而显著降低。这是因为
超过50 mg/L时,除氟率随着阴离子浓度增加而显著降低。这是因为![]() 与
与![]() 会发生水解产生OH-,从而使得溶液pH升高,氟离子吸附效率降低,该实验结果也证实了pH对除氟的影响(第2.2.2节),与韩晓峰等[22]的实验结果相一致。
会发生水解产生OH-,从而使得溶液pH升高,氟离子吸附效率降低,该实验结果也证实了pH对除氟的影响(第2.2.2节),与韩晓峰等[22]的实验结果相一致。
2.2.6 温度的影响
通过吸附热力学实验,可以研究不同温度下吸附剂吸附过程的机理。焓变(ΔH,kJ/mol)、吉布斯自由能变化(ΔG,kJ/mol)和熵变(ΔS,kJ/(mol·K))等热力学参数可以通过热力学方程式(8)和式(9)来计算:
ΔG°=ΔH°-TΔS°=-RT ln KT
(8)
(9)
式中:R为通用气体常数,8.314 J/(mol·K);T为温度,K;KT为分配系数。
将288,298,308,318 K温度下,初始浓度为5,10,20 mg/L的吸附数据进行热力学拟合,相关热力学参数见表4。结果表明:不同温度下的ΔG值皆为负值,且温度越高,ΔG越小,表明该吸附过程是可行且自发的,温度越高,自发程度越大。ΔH值为正值,表明该吸附过程是吸热过程;ΔS值为正值,表明吸附过程为熵增的过程,即升高温度会加快氟离子的扩散速率,使得氟离子与表面吸附活性位点结合作用力增大,进而增加氟离子的吸附量。
表4 TiO2的吸附热力学参数
Table 4 Thermodynamic parameters of F- adsorption
onto TiO2
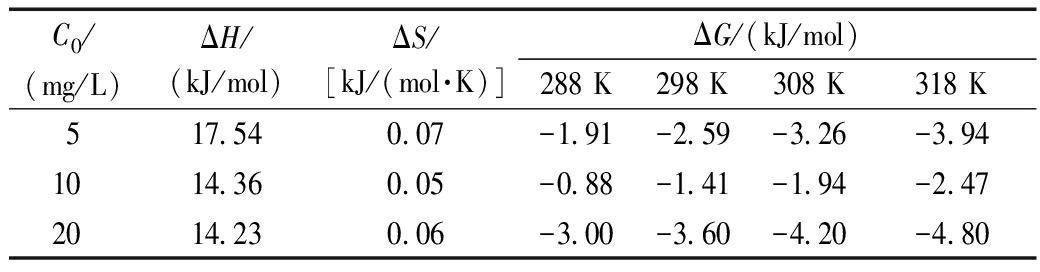
C0/(mg/L)ΔH/(kJ/mol)ΔS/[kJ/(mol·K)]ΔG/(kJ/mol)288 K298 K308 K318 K517.540.07-1.91-2.59-3.26-3.941014.360.05-0.88-1.41-1.94-2.472014.230.06-3.00-3.60-4.20-4.80
3 结 论
1)在50 ℃低温条件下,通过水解法得到锐钛矿型TiO2,表面有丰富的有机基团,比表面积为278.93 m2/g。
2)TiO2对氟离子具有较好的吸附性能,在pH值为2~5时,除氟率>85%。TiO2对氟离子的吸附过程在常温条件下符合Langmuir等温线模型,拟合出的最大吸附量为30.02 mg/g,高于Degussa P25的9.89 mg/g。动力学拟合结果表明,吸附过程符合准一级动力学模型。颗粒内扩散过程是氟离子吸附速率的控制步骤,但不是唯一的速率控制步骤。溶液中较高浓度的共存阴离子![]() 对F-吸附效率影响较大。
对F-吸附效率影响较大。
3)TiO2主要通过静电作用吸附氟离子,酸性条件更利于水中氟离子的去除。TiO2对氟离子的吸附过程是一个自发且吸热的过程。
[1] 朱其顺, 许光泉. 中国地下水氟污染的现状及研究进展[J]. 环境科学与管理, 2009, 34(1):42-44,51.
[2] 全国生活饮用水水质与水性疾病调查协作组. 中国生活饮用水地图集[M].北京:中国地图出版社,1990.
[3] 许乃才, 洪天增, 刘忠, 等. 介孔氧化铝的可控制备及优异除氟性能[J]. 材料导报, 2017, 31(6): 45-49.
[4] 杜鹏. 铝的过量摄入对人体影响分析研究[J]. 中国卫生产业, 2018, 15(13): 150-151.
[5] 胡东, 李坤, 孙富兴, 等. 负载氧化镧泡沫玻璃脱除水中氟离子[J]. 无机盐工业, 2016, 48(11): 52-56.
[6] ZHOU X T, JI H B, HUANG X J. Photocatalytic degradation of methyl orange over metalloporphyrins supported on TiO2 degussa P25[J]. Molecules, 2012, 17(12): 1149-1158.
[7] BABAEIVELNI K, KHODADOUST A P. Adsorption of fluoride onto crystalline titanium dioxide: effect of pH, ionic strength, and co-existing ions[J]. Journal of Colloid & Interface Science, 2013, 394(1): 419-427.
[8] LIANG S H, XUE Y W, GAO B, et al. Removal of fluoride from aqueous solution by TiO2-based composites[J]. Journal of the Taiwan Institute of Chemical Engineers, 2017, 74: 205-210.
[9] ZENG Y F, XUE Y W, LIANG S H, et al. Removal of fluoride from aqueous solution by TiO2 and TiO2-SiO2 nanocomposite[J]. Chemical Speciation & Bioavailability, 2017, 29(1): 25-32.
[10] YAN L, TU H W, CHAN T S, et al. Mechanistic study of simultaneous arsenic and fluoride removal using granular TiO2-La adsorbent[J]. Chemical Engineering Journal, 2017, 313: 983-992.
[11] 宗志芳, 杨麟, 张浩,等. 环境协调型Ce-La/TiO2复合材料的制备及光-湿-热性能[J]. 材料工程, 2018, 46(5): 145-150.
[12] 王江炎, 刘保顺, 中田一弥. 结晶度, {001}/{101}晶面比和Au负载对热处理TiOF2制备的锐钛矿TiO2光催化活性的影响[J]. 催化学报, 2019, 40(3): 403-412.
[13] CHEN X, TANG L J, YANG S, et al. A low-temperature processed flower-like TiO2 array as an electron transport layer for high-performance perovskite solar cells[J]. Journal of Materials Chemistry A, 2016, 4(17): 6521-6526.
[14] SUGIMOTO T, ZHOU X P. Synthesis of uniform anatase TiO2 nanoparticles by the gel-sol method: 2. adsorption of OH-ions to Ti(OH)4 gel and TiO2 particles[J]. Journal of Colloid & Interface Science, 2002, 252(2): 347-353.
[15] LV L, LI K, XIE Y T, et al. Enhanced osteogenic activity of anatase TiO2 film: surface hydroxyl groups induce conformational changes in fibronectin[J]. Materials Science & Engineering C, 2017, 78: 96-104.
[16] LI X Y, WANG D, CHENG G X, et al. Preparation of polyaniline-modified TiO2 nanoparticles and their photocatalytic activity under visible light illumination[J]. Applied Catalysis B:Environmental, 2008, 81(3/4): 267-273.
[17] KUMAR P M, BADRINARAYANAN S, Sastry M. Nanocrystalline TiO2 studied by optical, FTIR and X-ray photoelectron spectroscopy: correlation to presence of surface states[J]. Thin Solid Films, 2000, 358(1/2): 122-130.
[18] GóMEZ P C, GáLVEZ O, MOSTEO R G, et al. Clusters of atmospheric relevance: H2O/HCl/HNO3. Prediction of IR & MW spectra[J]. Physical Chemistry Chemical Physics, 2010, 12(18):4617-4624.
[19] FOO K Y, Hameed B H. Insights into the modeling of adsorption isotherm systems[J]. Chemical Engineering Journal, 2010, 156(1):2-10.
[20] KARUNANITHI R, YONG S O, DHARMARAJAN R, et al. Sorption, kinetics and thermodynamics of phosphate sorption onto soybean stover derived biochar[J]. Environmental Technology & Innovation, 2017, 8:113-125.
[21] HU Y Q, GUO T, YE X S, et al. Dye adsorption by resins: effect of ionic strength on hydrophobic and electrostatic interactions[J]. Chemical Engineering Journal, 2013, 228:392-397.
[22] 韩晓峰, 李红艳, 孟庆兰, 等. 负载镧镁活性氧化铝的制备及除氟性能研究[J]. 环境工程, 2015, 33(7):56-60,71.