0 引 言
近年来,水体重金属污染问题越来越受到人们的重视。藻类作为水体中常见的一种微生物,由于其对重金属具有一定的吸附能力,被认为是具有潜力的去除重金属材料[1, 2]。虽然藻类去除重金属具有效果好、操作简便和可再利用等优点[3],但是仍存在藻水分离难和后续处理不方便等问题[4]。藻类生物膜技术不但能有效解决上述问题,而且具有藻生物量大的特点,利用其去除重金属可达到更好效果[5]。Travieso等[6]使用覆盖有0.5 mm宽聚氨酯带的旋转滚筒来固定微藻,处理含有3 mg/L铁钴的人工合成废水,在2 r/min的恒定转速下间歇运行20 d,结果表明,10 d后藻类生物膜反应器对钴的去除率达到94.5%。Orandi等[7]将藻类微生物固定在光旋转生物反应器上处理矿山废水中的重金属,研究发现,其对Cu、Ni、Mn、Zn、Sb、Se、Co、Al等重金属的去除率达到20%~50%;Li等[8]利用丝藻形成藻类生物膜处理浓度为2~3 mg/L的模拟矿山含锌废水,发现锌的去除能力与生物量呈正相关,每克藻可吸附15~17 mg的锌。还有学者用鞘藻形成生物膜处理10 mg/L的含锌废水,在14 d的动态实验中,锌去除率达到97.7%[9]。综上,藻类生物膜技术可以有效处理重金属废水,但重金属对藻类生物膜生理响应研究鲜有报道。因此,本实验选用蛋白核小球藻形成藻类生物膜对不同初始浓度的镉废水进行研究,测定叶绿素a、硝酸还原酶、EPS等生理特性指标,分析在镉胁迫下蛋白核小球藻生物膜生理特性的变化情况,初步判定藻类生物膜对镉的耐受程度;同时,通过分析藻类生物膜对镉的去除效果,为藻类生物膜去除重金属镉的后续研究提供参考。
1 实验部分
1.1 实验材料
实验藻种:蛋白核小球藻(Chlorella pyrenoidosa),购自中国科学院武汉水生生物所。实验培养基:BG11培养基[10]。实验载体:立体弹性聚乙烯载体。
1.2 实验设计
1.2.1 藻的培养
将蛋白核小球藻在无菌环境下接种到配制好的BG11培养基,在温度为(25±2)℃、连续光照强度为3500 lux的条件下培养至对数生长期,此期间每天定时摇动3次。
1.2.2 藻类生物膜的制备
载体放入1 L烧杯中,加入900 mL BG11培养基,灭菌后无菌接种100 mL藻液,与藻的培养条件相同,直至在载体上形成稳定成熟的藻类生物膜。
1.2.3 生理响应及去除效果实验
称取一定量的氯化镉溶于纯水中,配制成1 g/L的镉储备液。分别取0,5,10,15,20 mL储备液,加入BG11培养基至1 L,配制成镉初始浓度为0,5,10,15,20 mg/L的实验废水。然后,用配制好的镉梯度系列实验废水一次性置换出烧杯中培养基,在温度(25±2)℃、连续光照强度约3500 lux条件下进行实验,每天定时取样测定藻类生物膜叶绿素a、EPS、硝酸还原酶以及水样中镉剩余浓度,实验周期为7 d。
1.3 指标检测方法
1)叶绿素a:乙醇-丙酮超声破碎法[11]。取10 mL样品进行抽滤,将抽滤后的滤膜剪碎后加入10 mL乙醇:丙酮体积比为1∶1的混合液,超声破碎30 min后置于暗处反应2~6 h,将暗反应后的混合液以4000 r/min的转速离心10 min,取上清液测定630,645,663,750 nm波长处吸光度。叶绿素a含量计算见式(1):
Chl.a=[11.64×(D663-D750)-2.16×
(D645-D750)+0.10×(D630-D750)V1]/Vδ
(1)
式中:Chl.a为叶绿素a含量,mg/L;D630、D645、D663、D750分别为相应波长处吸光度;V1为提取液定容体积,mL;V为水样体积,mL;δ为比色皿光程,cm。
2)EPS:苯酚-硫酸法[12]。取10 mL样品于离心管中,30 ℃下恒温水浴摇床振荡1 h,然后以4000 r/min转速离心10 min,取2 mL上清液(上清液1)于比色管中,移除剩余上清液;向沉淀中加入5 mL 0.01 mol/L的EDTA溶液,反应2 h后离心,取3 mL上清液(上清液2)与上清液1混合。向混合液中加入1 mL苯酚和5 mL浓硫酸,在100 ℃下水浴15 min,冷却后测定490 nm波长处吸光度。
3)硝酸还原酶:磺胺-萘胺分光光度法[13]。取5 mL样品进行超声破碎5 min,离心后取3 mL上清液作为提取液,向提取液中加入3 mL0.02 mol/L的KNO3溶液,暗反应30 min。向暗反应溶液中加入2 mL 1%磺胺和2 mL 0.02%萘胺,混匀静置30 min,在520 nm波长处测定水样吸光度。
4)镉剩余浓度:原子吸收分光光度法。取10 mL样品离心后抽取上清液,通过针孔滤头进行过滤,用原子吸收分光光度计测定过滤后水样中的镉浓度,并用式(2)计算去除率:
(2)
式中:a为去除率,%;ρ0为镉初始浓度,mg/L;ρ1为处理后镉剩余浓度,mg/L。
2 结果与讨论
2.1 镉对蛋白核小球藻生物膜叶绿素a的影响
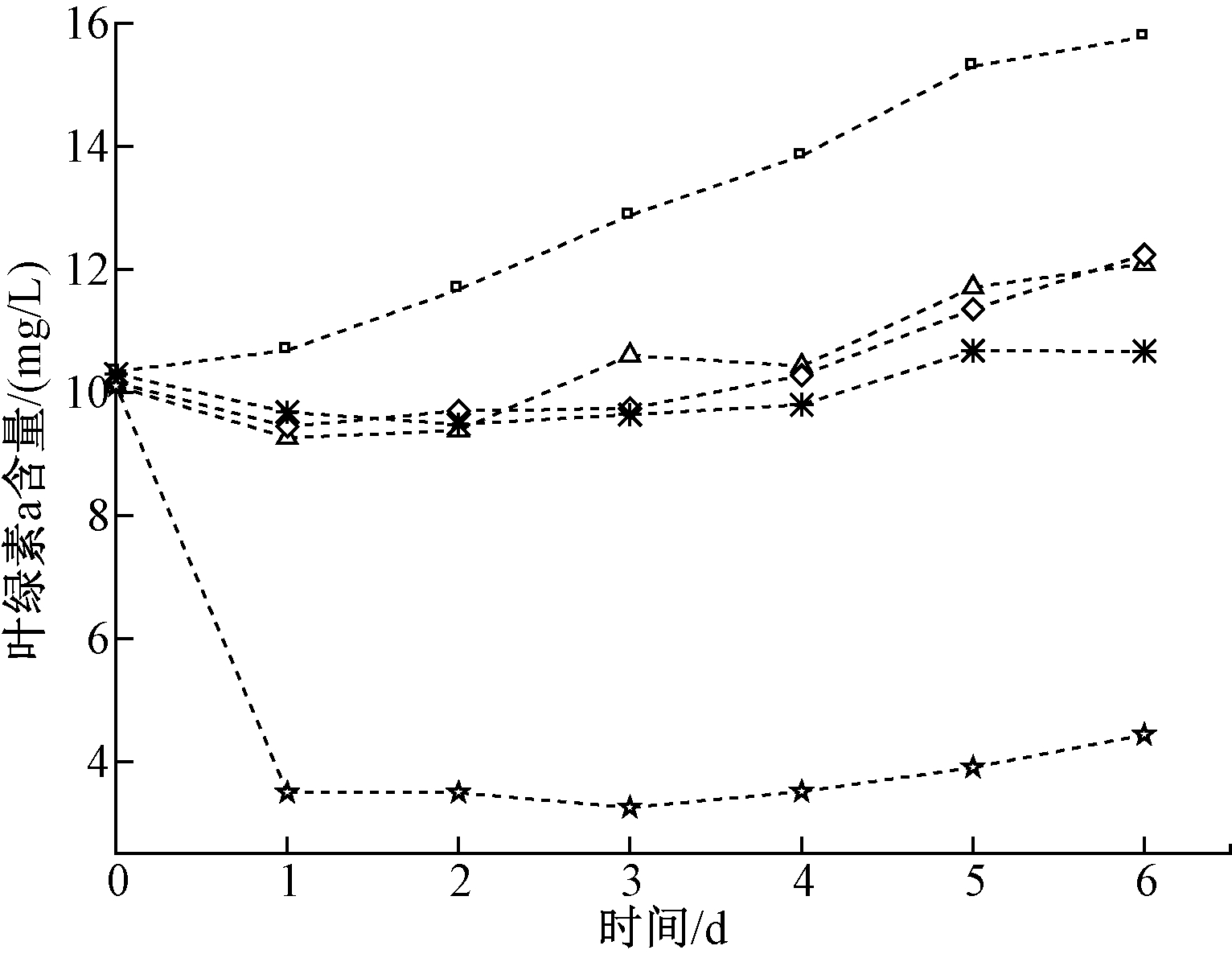
藻类生长量通常与其叶绿素含量呈一定比例[14],因此可用叶绿素a来表征藻类生长量。图1为蛋白核小球藻生物膜在镉胁迫下叶绿素a的变化。可知:除20 mg/L组之外,其他组叶绿素a含量均呈上升趋势,空白组、5 mg/L组、10 mg/L组、15 mg/L组叶绿素a含量增量分别为5.44,2.14,1.93,0.37 mg/L。从各组叶绿素a含量增量来看,在镉胁迫下蛋白核小球藻生物膜的生长受到抑制,并且抑制程度随着镉初始浓度升高而增强。也有研究发现,镉离子质量浓度越高,对铜绿微囊藻的生长抑制作用越明显[15]。20 mg/L组第2天的叶绿素a含量从10.1 mg/L降至3.49 mg/L,远低于其他组,推测可能是由于在较高的镉浓度中,藻类生物膜的生长受到极大的抑制,导致部分藻类生物膜死亡,从而使叶绿素a含量急速下降。在实验过程中,发现20 mg/L组的蛋白核小球藻生物膜出现发黄脱落的现象,验证了部分藻类生物膜死亡。刘璐等[16]研究也发现,镉离子浓度越高,对铜绿微囊藻和斜生栅藻的生长抑制越明显。
--![]() ---0 mg/L; --
---0 mg/L; --![]() ---5 mg/L; --
---5 mg/L; --![]() ---10 mg/L;
---10 mg/L;
--![]() ---15 mg/L; --
---15 mg/L; --![]() ---20 mg/L。
---20 mg/L。
图1 镉对蛋白核小球藻生物膜叶绿素a的影响
Figure 1 Effects of Cd on chlorophyll a in Chlorella pyrenoidosa biofilm
2.2 镉对蛋白核小球藻生物膜硝酸还原酶的影响
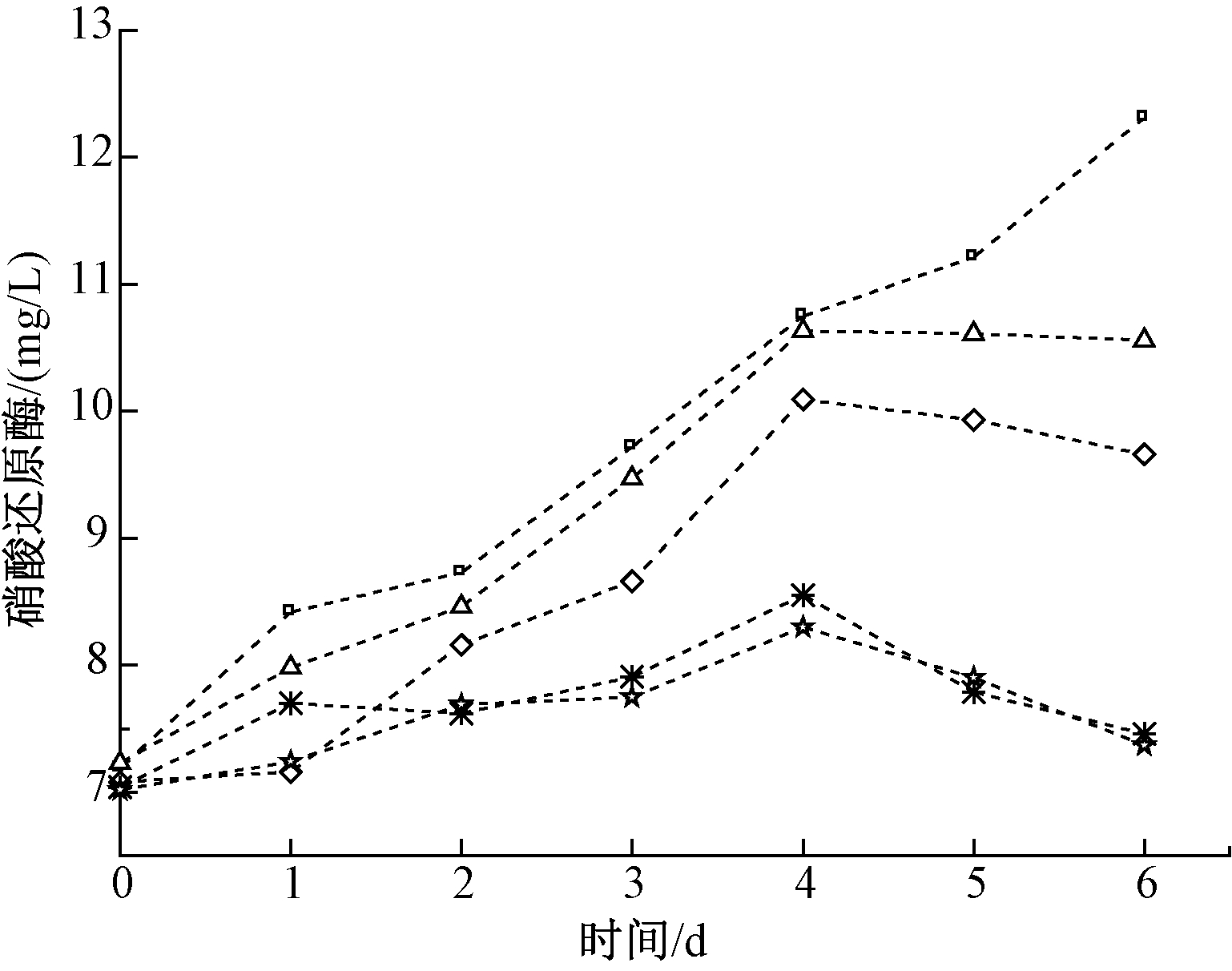
硝酸还原酶是藻类生理特性的表征指标,藻类通过硝酸还原酶将水体中的硝酸盐还原为亚硝酸盐,以供自身利用[17]。图2为蛋白核小球藻生物膜在镉胁迫下硝酸还原酶含量的变化情况。可知:在实验期间内,空白组的硝酸还原酶含量呈上升趋势,而其他组呈先升后降的现象。在实验前4 d, 5,10 mg/L组的硝酸还原酶增量分别为3.4,3.01 mg/L,高于15,20 mg/L组的增量1.51,1.28 mg/L;实验第5、6天,5,10 mg/L组的硝酸还原酶减量低于15,20 mg/L组。镉初始浓度越高,对蛋白核小球藻生物膜的硝酸还原酶含量的抑制作用越强。有研究表明,高浓度的铅离子会抑制螺旋藻硝酸还原酶活性[18]。
--![]() ---0 mg/L; --
---0 mg/L; --![]() ---5 mg/L; --
---5 mg/L; --![]() ---10 mg/L;
---10 mg/L;
--![]() ---15 mg/L; --
---15 mg/L; --![]() ---20 mg/L。
---20 mg/L。
图2 镉对蛋白核小球藻生物膜硝酸还原酶的影响
Figure 2 Effects of Cd on nitrate reductase in Chlorella
pyrenoidosa biofilm
2.3 镉对蛋白核小球藻生物膜EPS的影响
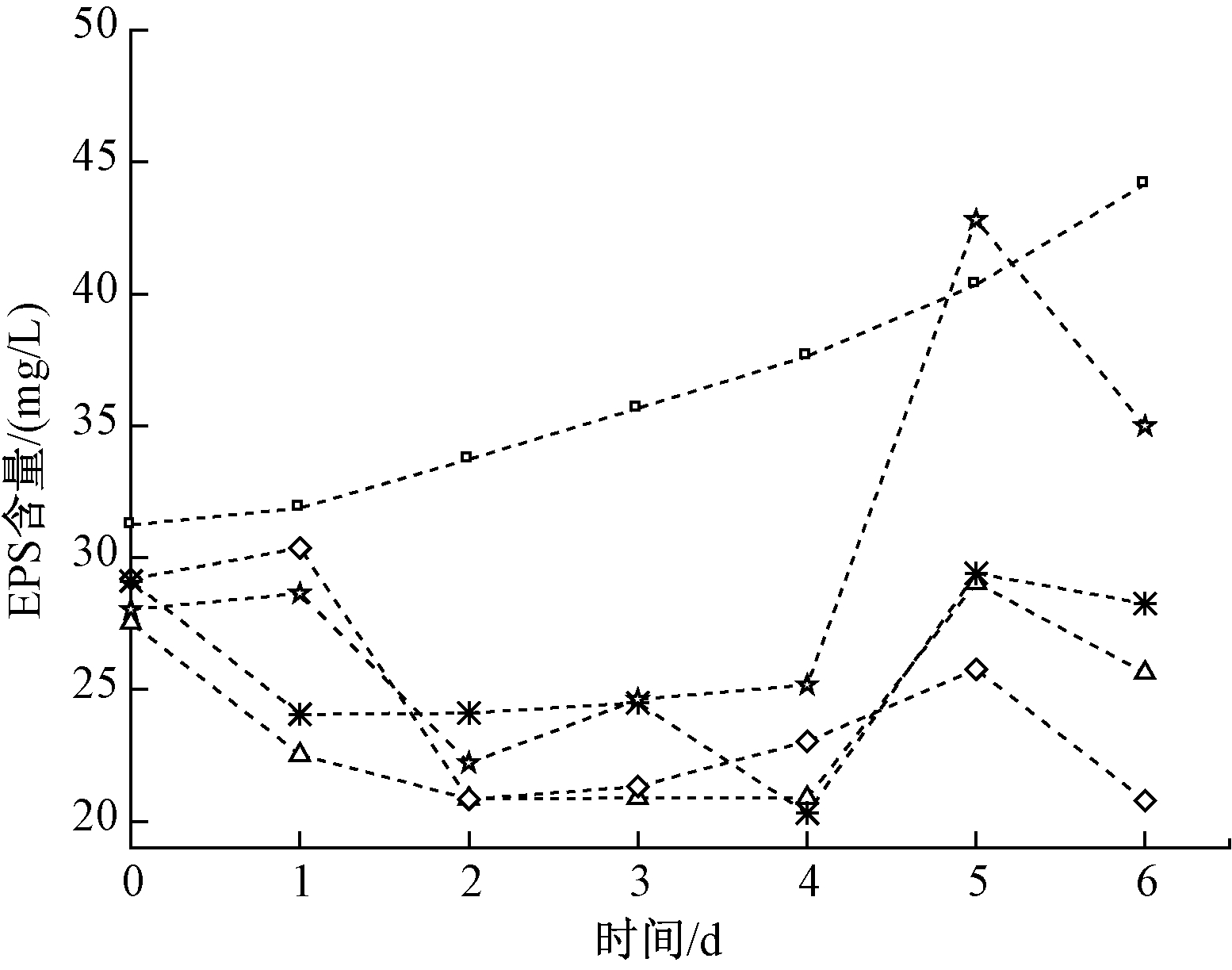
藻类吸附重金属主要是通过藻类分泌的EPS与重金属发生络合作用[19]。藻类生物膜能分泌更多的EPS,增强吸附重金属的能力。图3为在镉胁迫下蛋白核小球藻生物膜EPS含量变化。可知:空白组的EPS含量远高于其他组,说明在镉胁迫下蛋白核小球藻生物膜的活性受到抑制,EPS的分泌量减少。陈长平等[20]也发现Cd2+会对新月筒柱藻的EPS产生抑制作用。实验第4天,各实验组的EPS含量均有上升趋势,并在第5天达到最大值,说明藻类生物膜已经适应了镉胁迫,开始通过分泌EPS来阻止镉进入细胞内。其中,20 mg/L组由于部分死亡脱落的藻类生物膜以及藻细胞内多糖被释放,导致EPS含量显著增加,达到42.79 mg/L。因此,镉对蛋白核小球藻生物膜的EPS分泌具有抑制作用,但随着接触时间的增加,藻类生物膜开始适应镉胁迫,分泌少量EPS。
--![]() ---0 mg/L; --
---0 mg/L; --![]() ---5 mg/L; --
---5 mg/L; --![]() ---10 mg/L;
---10 mg/L;
--![]() ---15 mg/L; --
---15 mg/L; --![]() ---20 mg/L。
---20 mg/L。
图3 镉对蛋白核小球藻生物膜EPS的影响
Figure 3 Effects of Cd on extracellular polysaccharide in
Chlorella pyrenoidosa biofilm
2.4 蛋白核小球藻生物膜去除镉的效果
藻类对重金属具有吸附作用,从而达到去除重金属的效果[21, 22]。藻类生物膜主要是通过扩大藻类与重金属接触面积、增加藻生物量来提高其重金属去除率[23, 24]。图4为不同镉初始浓度下蛋白核小球藻生物膜对镉的去除率。各组的去除率均在实验第1天迅速升高,随后5 d内,5,10,15 mg/L组镉的去除率基本维持不变。20 mg/L组由于部分藻类生物膜死亡,导致藻类生物膜脱落,吸附的镉又被重新释放,镉的去除率有所下降。第6天各组的去除率为:5 mg/L组76.85%;10 mg/L组为84.5%;15 mg/L组为89.83%;20 mg/L组去除率为77.95%。由此可知,当镉初始浓度为15 mg/L时,蛋白核小球藻生物膜对其去除效果最好,去除率最高。

--![]() ---0 mg/L; --
---0 mg/L; --![]() ---5 mg/L; --
---5 mg/L; --![]() ---10 mg/L;
---10 mg/L;
--![]() ---15 mg/L; --
---15 mg/L; --![]() ---20 mg/L。
---20 mg/L。
图4 蛋白核小球藻生物膜对不同浓度镉去除效果
Figure 4 Removal of Cd by Chlorella pyrenoidosa biofilm at
different initial concentrations
3 结 论
1)镉会抑制蛋白核小球藻生物膜的叶绿素a及其硝酸还原酶的产生,并且抑制程度随着镉初始浓度的增大而增加。
2)蛋白核小球藻生物膜在镉胁迫下会抑制EPS的产生,但藻类生物膜适应镉胁迫后,镉会刺激藻类生物膜产生EPS来阻止镉的进入,从而导致EPS含量的上升。
3)蛋白核小球藻生物膜对镉具有较好的去除效果,当镉初始浓度为15 mg/L时去除率最高,达到89.83%。
[1] FLOUTY R, ESTEPHANE G. Bioaccumulation and biosorption of copper and lead by a unicellular algae Chlamydomonas reinhardtii in single and binary metal systems: a comparative study[J]. Journal of Environmental Management, 2012,111:106-114.
[2] 王碧荷, 王蕾, 贾元铭, 等. 微藻生物富集重金属的研究进展[J]. 环境工程, 2017,35(8):67-71.
[3] ANASTOPOULOS I, KYZAS G Z. Progress in batch biosorption of heavy metals onto algae[J]. Journal of Molecular Liquids, 2015,209:77-86.
[4] GUPTA V K, RASTOGI A. Biosorption of lead from aqueous solutions by green algae Spirogyra species: kinetics and equilibrium studies[J]. Journal of Hazardous Materials, 2008,152(1):407-414.
[5] FU F L, WANG Q. Removal of heavy metal ions from wastewaters: a review[J]. Journal of Environmental Management, 2011,92(3):407-418.
[6] TRAVIESO L, PELLON A, BENITEZ F, et al. BIOALGA reactor: preliminary studies for heavy metals removal[J]. Biochemical Engineering Journal, 2002,12(2):87-91.
[7] ORANDI S, LEWIS D M, MOHEIMANI N R. Biofilm establishment and heavy metal removal capacity of an indigenous mining algal-microbial consortium in a photo-rotating biological contactor[J]. Journal of Industrial Microbiology & Biotechnology, 2012,39(9):1321-1331.
[8] LI T Y, LIN G, PODOLA B, et al. Continuous removal of zinc from wastewater and mine dump leachate by a microalgal biofilm PSBR[J]. Journal of Hazardous Materials, 2015,297:112-118.
[9] LIU C X, HU Z Q, ZUO J L, et al. Removal of Zn(Ⅱ) from simulated wastewater using an algal biofilm[J]. Water Science and Technology, 2014,70(8):1383-1390.
[10] 晋利, 丁洁然, 杨知勋, 等. Zn2+对铜绿微囊藻生长及光合作用的影响[J]. 环境工程, 2018,36(7):77-80.
[11] 万修志. 提取测定淡水藻中叶绿素a的方法研究[D]. 济南:山东建筑大学, 2011.
[12] 张道勇,赵勇胜,潘响亮.胞外聚合物(EPS)在藻菌生物膜去除污水中Cd的作用[J].环境科学研究,2004,17(5):52-55.
[13] 朱宇轩. 蛋白核小球藻膜去除Cd(Ⅱ)的实验研究[D]. 南宁: 广西大学, 2018.
[14] SADEGHIAN A, CHAPRA S C, HUDSON J, et al. Improving in-lake water quality modeling using variable chlorophyll a/algal biomass ratios[J]. Environmental Modelling & Software, 2018,101:73-85.
[15] 张海涛, 郭西亚, 张杰, 等. 铜绿微囊藻对锌、镉胁迫的生理响应[J]. 江苏农业学报, 2019,35(1):33-41.
[16] 刘璐, 闫浩, 夏文彤, 等. 镉对铜绿微囊藻和斜生栅藻的毒性效应[J]. 中国环境科学, 2014,34(2):478-484.
[17] GULATI A, JAIWAL P K. Effect of NaCl on nitrate reductase, glutamate dehydrogenase and glutamate synthase in Vigna radiata calli[J]. Biologia Plantarum, 1996,38(2):177-183.
[18] 巩东辉, 王志忠, 季祥. 重金属铅胁迫下镧对螺旋藻生长及生理特性的影响[J]. 中国稀土学报, 2015(4):487-493.
[19] GARCIA-MEZA J V, BARRANGUE C, ADMIRAAL W. Biofilm formation by algae as a mechanism for surviving on mine tailings[J]. Environmental Toxicology and Chemistry, 2005,24(3):573-581.
[20] 陈长平, 徐华林, 梁君荣, 等. 镉离子对红树林底栖硅藻新月筒柱藻胞外多糖的影响[J]. 厦门大学学报(自然科学版), 2013,52(1):122-126.
[21] KIPIGROCH K. The use of algae in the process of heavy metal ions removal from wastewater[J]. Desalination and Water Treatment, 2018,134:289-295.
[22] FLOUTY R. Removal of Pb(Ⅱ) and Cu(Ⅱ) from aqueous solutions by Chlamydomonas reinhardtii: infrared and thermal analysis[J]. Environmental Engineering and Management Journal, 2015,14(4):871-877.
[23] HOH D, WATSON S, KAN E. Algal biofilm reactors for integrated wastewater treatment and biofuel production: a review[J]. Chemical Engineering Journal, 2016,287:466-473.
[24] SCHNURR P J, ESPIE G S, ALLEN D G. The effect of light direction and suspended cell concentrations on algal biofilm growth rates[J]. Applied Microbiology and Biotechnology, 2014,98(20):8553-8562.