0 引 言
活性污泥法是目前应用最广泛的污水生物处理技术,主要依靠活性污泥中微生物将污水中的污染物降解,达到净化污水的目的。活性污泥的菌群结构是实现污染物的去除和污水厂稳定运行的基础[1]。
近年来,高通量测序技术得到快速发展,该技术已被广泛应用于城市污水厂活性污泥中菌群结构的研究[2-5],并在非干旱寒冷地区活性污泥菌群结构中取得了大量的研究成果。但对干旱寒冷地区活性污泥菌群结构的研究报道比较少。
新疆地处欧亚大陆腹地,气候干旱。天山以北地区(北疆)是温带大陆性气候,冬季寒冷,气温最低可以达到-40 ℃,且冬季漫长,长达5~6个月,属于干旱寒冷地区。本文对北疆地区5座城市污水厂活性污泥中的菌群结构进行研究,以期为干旱寒冷地区污水厂运行调控提供理论支撑。
1 试验部分
1.1 试验样品
活性污泥样品分别取自阿勒泰市某污水厂(ALT)、克拉玛依市某污水厂(KLMY)、石河子市某污水厂(SHZ)、昌吉市某污水厂(CJ)和乌鲁木齐市某污水厂(WLMQ)。污水厂进水温度冬季在7~15 ℃,夏季在16~24 ℃。
5座污水厂均采用氧化沟工艺,进水水质均以生活污水为主。2016年1月至2018年7月,共采集了32个氧化沟好氧段活性污泥样品。其中,ALT 9个污泥样品,KLMY 4个污泥样品,SHZ 2个污泥样品,CJ 6个污泥样品,WLMQ 11个污泥样品。
污泥体积指数(sludge volume index,SVI)用于衡量污泥沉降性能,通常认为当SVI值大于150 mg/L时,污泥出现污泥膨胀现象[6]。ALT和SHZ污水厂活性污泥样品的SVI值在60~81 mg/L,表明这2座污水厂活性污泥的沉降性能良好。KLMY和CJ污水厂活性污泥样品的SVI值在187~278 mg/L,表明这2座污水厂活性污泥在研究期间一直处于污泥膨胀状态,污泥镜检显示为丝状菌污泥膨胀。WLMQ污水厂冬、春季污泥样品的SVI值在155~269 mg/L,夏季污泥样品的SVI值在89~100 mg/L,表明该厂出现了季节性污泥膨胀现象,而污泥镜检印证了该厂处于丝状菌污泥膨胀。
1.2 水质指标测定方法
COD采用重铬酸钾法;BOD5采用稀释与接种法;NH+4-N采用纳氏试剂分光光度法;TN采用碱性过硫酸钾消解-紫外分光光度法;TP采用钼酸铵分光光度法;水温采用温度计法。
1.3 菌群分析方法
对全部32个污泥样品进行了细菌16S rRNA V4-V5区域PCR扩增,引物为515F/907R。对KLMY 3个、CJ 4个、WLMQ 5个,共12个丝状污泥膨胀样品进行真菌18S的PCR扩增,真菌引物为SSU 0817F/1196R。
2 结果与分析
2.1 污水处理厂效果
5座污水厂的进、出水水质情况如表1所示。可知:5座污水厂的进水水质中污染物浓度高于山东、广东等城市污水厂的平均进水水质(ρ(COD)为219.97 mg/L,ρ(BOD5)为81.64 mg/L,ρ(NH+4-N)为22.83 mg/L,ρ(TN)为30.36 mg/L,ρ(TP)为3.70 mg/L)[7]。除了WLMQ出水中NH+4-N和TN在冬季时不能稳定达标外,其余4座污水厂的出水均可以稳定达到各自的设计出水标准。
表1 污水厂水质处理效果
Table 1 Water quality treatment effect of each sewage treatment plant mg/L
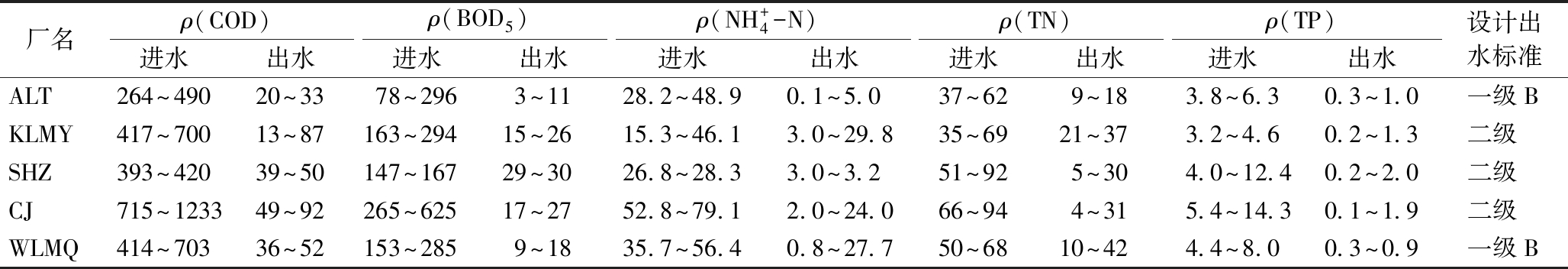
厂名ρ(COD)ρ(BOD5)ρ(NH+4-N)ρ(TN)ρ(TP)进水出水进水出水进水出水进水出水进水出水设计出水标准ALT264~49020~3378~2963~1128.2~48.90.1~5.037~629~183.8~6.30.3~1.0一级BKLMY417~70013~87163~29415~2615.3~46.13.0~29.835~6921~373.2~4.60.2~1.3二级SHZ393~42039~50147~16729~3026.8~28.33.0~3.251~925~304.0~12.40.2~2.0二级CJ715~123349~92265~62517~2752.8~79.12.0~24.066~944~315.4~14.30.1~1.9二级WLMQ414~70336~52153~2859~1835.7~56.40.8~27.750~6810~424.4~8.00.3~0.9一级B
2.2 细菌菌群分析
2.2.1 细菌多样性
细菌是活性污泥净化污水的主要承担者。32个污泥样品的细菌群落多样性如表2所示。细菌测序的有效序列在41391~43586,OTU在1029~2174。覆盖度指数Coverage均>0.980,表明数据可信度较高。Shannon指数、Chao指数、Heip指数分别用来衡量群落多样性、丰富度和均匀度。从表2可以看出:KLMY的Shannon指数、Chao指数、Heip指数均为最低,SHZ的Shannon指数、Chao指数、Heip指数均为最高。可能是因为KLMY常年出现丝状污泥膨胀,污泥膨胀会导致菌群结构多样性指数降低。有研究证明,污水厂进水水质对活性污泥系统中的菌群结构有较大影响[8]。SHZ进水中含有24%的工业废水,高于其他4座污水厂的相应比例,使得SHZ污水厂活性污泥的多样性最丰富。
表2 污泥样品中细菌多样性
Table 2 Diversity indices of bacterial communities in sludge
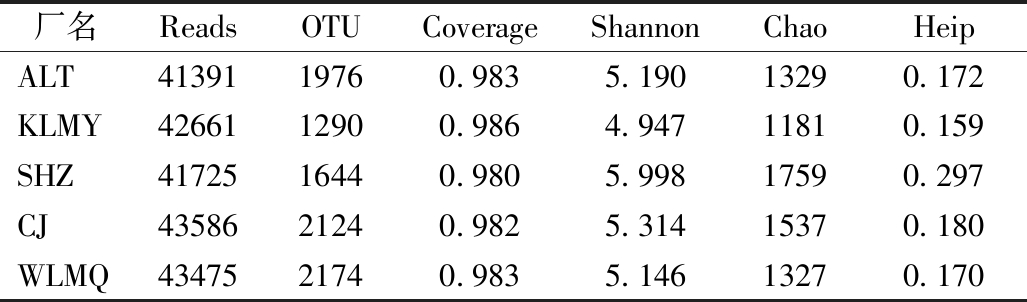
厂名ReadsOTUCoverageShannonChaoHeipALT4139119760.9835.19013290.172KLMY4266112900.9864.94711810.159SHZ4172516440.9805.99817590.297CJ4358621240.9825.31415370.180WLMQ4347521740.9835.14613270.170
2.2.2 OTU分布Venn图
Venn图能够用来统计污水厂中共有的和独有的OTU数目,较为直观地反映出活性污泥样品的OTU数目组成相似性及重叠情况。32个活性污泥样品在OTU水平上的韦恩图如图1所示。
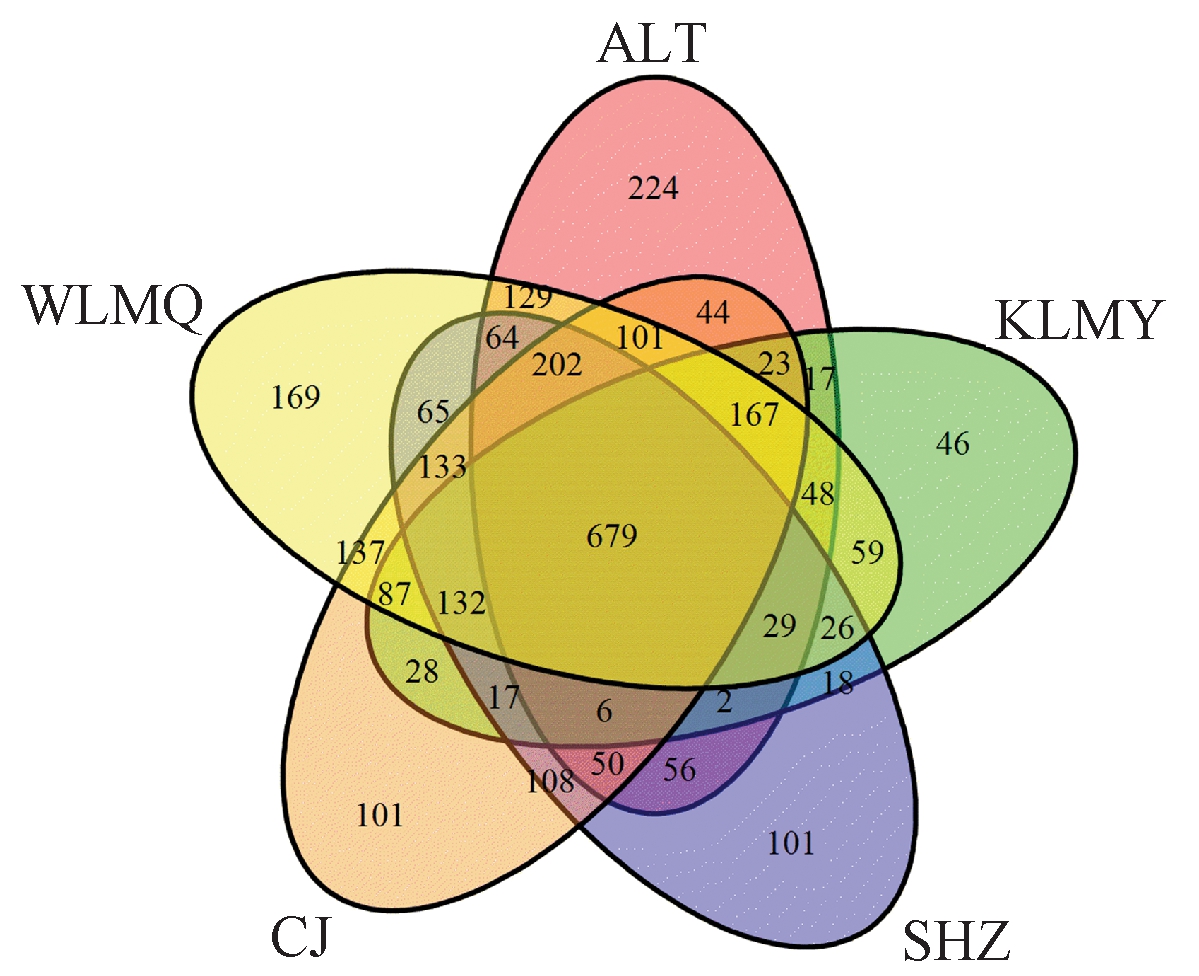
图1 活性污泥样本Venn图分析
Figure 1 Venn diagram of activated sludge sample
5座污水厂活性污泥中共有的OTU有679个, ALT、KLMY、SHZ、CJ和WLMQ独有的OTU数分别为224、46、101、101和169。其中,ALT独有的OTU数最多,推测原因,可能是ALT年平均进水水温最低,仅为10 ℃,活性污泥经长期低温驯化后,一些适应低温环境的微生物得以存活。而KLMY独有的OTU数最少,可能是该厂常年出现丝状污泥膨胀,造成细菌多样性降低。
2.2.3 细菌门水平群落结构
活性污泥细菌测序共获得43个细菌门。其中相对丰度超过0.1%的细菌门有22个,其相对丰度之和占活性污泥细菌群落总丰度的99.59%~99.87%。对相对丰度从大到小排序前10的细菌门进行分析, 如图2所示,相对丰度之和占细菌群落总丰度的96.21%~98.80%。变形菌门(Proteobacteria)的相对丰度为30.65%~43.12%,是活性污泥中相对丰度最高的细菌门。其次为拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria),厚壁菌门(Firmicutes)和浮霉菌门(Planctomycetes),相对丰度分别为21.15%~33.64%、5.02%~14.36%、2.97%~15.54%、2.96%~6.00%、0.75%~3.87%。与广州、浙江等非干旱寒冷地区的污水厂活性污泥的主要优势细菌门种类基本一致[9,10]。放线菌门(Actinobacteria)在发生丝状污泥膨胀的KLMY、CJ、WLMQ 3个污水厂活性污泥中的相对丰度达到11.69%~16.77%,而在污泥沉降性能良好ALT和SHZ污水厂活性污泥中的相对丰度为仅为2.97%~6.17%。研究表明放线菌门(Actinobacteria)相对丰度较高时会导致污泥膨胀[11]。

图2 细菌群落门水平上相对丰度
Figure 2 Relative abundances of different bacteria phylum
2.2.4 细菌属水平群落结构
活性污泥细菌测序共检测出838个细菌属,相对丰度>0.1%的细菌属共有253个,其相对丰度之和占活性污泥细菌群落总丰度的93.83%~95.84%。对相对丰度从大到小排序前50的细菌属进行分析,如图3所示,相对丰度之和占细菌群落总丰度的58.94%~68.44%。腐螺旋菌属(Saprospiraceae_norank)、丛毛单胞菌属(Comamonadaceae_unclassified)、微丝菌属(Microthrix)、黄杆菌属(Flavobacterium)和厌氧绳菌属(Anaerolineaceae_norank)是污泥样品中的优势细菌属,相对丰度分别为5.38%~18.30%、6.10%~11.82%、0.24%~9.52%、0.98%~3.26%和0.25~8.57%。其中,腐螺旋菌属(Saprospiraceae_norank)是常年出现丝状污泥膨胀的CJ和KLMY 2座污水厂污泥的相对丰度最高的细菌属,达到17.48%~18.30%,而在出现季节性丝状污泥膨胀的WLMQ污泥中,以及污泥沉降性能良好的ALT和SHZ污泥中的相对丰度仅为8.07%、8.23%和5.38%。研究发现,腐螺旋菌属(Saprospiraceae_norank)是活性污泥中一种较为常见的细菌属,在水温较低时大量增殖,能够导致污泥膨胀[12]。丛毛单胞菌属(Comamonadaceae_unclassified)在5座污水处理厂污泥中相对丰度分别为7.31%、11.82%、6.10%、6.67%、8.85%,相对丰度的变化规律不明显。研究表明微丝菌属(Microthrix)和黄杆菌属(Flavobacterium)均为易引起污泥膨胀最常见的丝状菌[13,14]。季节性丝状污泥膨胀WLMQ活性污泥中,微丝菌属(Microthrix)和黄杆菌属(Flavobacterium)相对丰度出现季节性变化,微丝菌属(Microthrix)夏季相对丰度为1.32%~6.08%,冬春季达到8.37%~18.74%,黄杆菌属(Flavobacterium)夏季相对丰度为0.38%~1.00%,冬春季达到4.03%~7.67%。厌氧绳菌属(Anaerolineaceae_norank)在污泥沉降性能良好ALT和SHZ相对丰度分别为8.57%和6.39%,而发生丝状污泥膨胀的WLMQ、CJ和KLMY相对丰度分别为1.48%、1.80%和0.25%,表明厌氧绳菌属(Anaerolineaceae_norank)有利于提高污泥沉降性能。据报道Dechloromonas、动胶菌属(Zoogloea)、Turneriella、Prosthecobacter、Nannocystis等为广州、浙江等地区的污水处理厂活性污泥中的优势细菌属[9,10],与干旱寒冷地区污水厂活性污泥的优势细菌属种类不同。

图3 细菌群落属水平相对丰度
Figure 3 Relative abundances of different bacteria genus
2.3 真菌菌群分析
2.3.1 真菌群落多样性
真菌在污水处理系统中能够降解多种化合物和有毒物质[15],在污水生物处理中起着至关重要的作用。
对出现丝状污泥膨胀的3座污水厂12个污泥样品进行了真菌测序,测序结果如表3所示。可见:Coverage指数均达到了0.999以上,表明数据可信度较高。真菌测序的OTU数、Shannon指数、Chao指数均明显低于细菌测序结果,与Wei等[16]的研究结果相同。
表3 污泥样品中真菌多样性
Table 3 Diversity indices of fungal communities in sludge

厂名ReadsOTUCoverageShannonChaoHeipKLMY424771251.0002.4681290.080CJ391801450.9993.1601650.151WLMQ450671490.9992.4701630.082
2.3.2 真菌门水平群落结构
活性污泥样品中共检测出38个真菌门,其中相对丰度>0.1%有13个,如图4所示,其相对丰度之和占活性污泥真菌群落总丰度的99.76%~99.87%。子囊菌门(Ascomycota)的是活性污泥中相对丰度最高的真菌门,相对丰度达到56.60%~72.68%。其次为担子菌门(Basidiomycota),相对丰度为15.77%~25.55%。目前对于污水厂膨胀污泥中真菌群落研究比较少,已报道的多为沉降性能正常活性污泥中真菌群落研究。研究发现,子囊菌门(Ascomycota)和担子菌门(Basidiomycota)也是非干旱寒冷地区沉降性能良好污水厂的污泥中优势真菌门,且子囊菌门(Ascomycota)是活性污泥中绝对优势真菌门[17]。
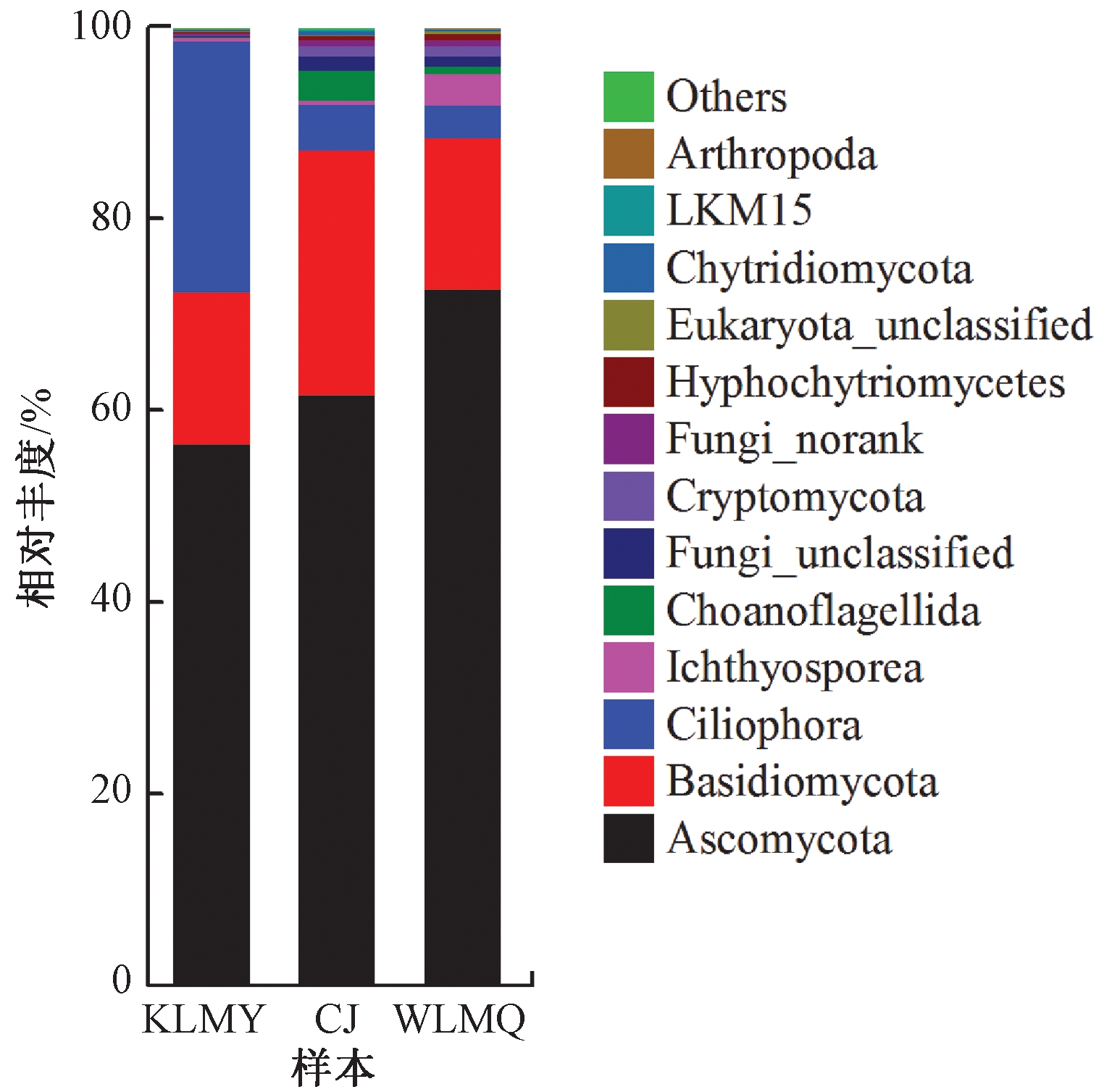
图4 真菌群落门水平上相对丰度
Figure 4 Relative abundances of different fungi phyla
2.3.3 真菌属水平群落结构
污泥样品共得到122个真菌属,相对丰度超过0.1%的真菌属有50个,其相对丰度之和占活性污泥真菌群落总丰度的98.85%~99.49%。对相对丰度从大到小排序前10的真菌属进行统计,如图5所示,相对丰度之和占活性污泥真菌群落总丰度的75.03%~90.46%。子囊菌属(Ascomycota_norank)、丝孢菌属(Trichosporon)、酵母菌属(Saccharomycetales_unclassified)、耐碱酵母菌(Galactomyces)、德巴利氏酵母菌属(Debaryomyces)和发菌属(Trichocomaceae_unclassified)是活性污泥中的优势真菌属,相对丰度分别为8.85%~35.74%、13.38%~20.15%、5.80%~10.21%、2.50%~8.37%、3.14%~7.19%和1.87%~10.24%。有研究表明,丝孢菌属(Trichosporon)过多不利于污泥沉降[18,19]。据报道青霉菌(Penicillium)、隐球菌属(Cryptococcus)、念珠菌属(Candida)、红酵母属(Rhodotorula)等为上海、山西、青海等地区沉降性能正常的污水处理厂活性污泥中的优势真菌属[17],与干旱寒冷地区膨胀污泥优势真菌属种类不同。

图5 真菌群落属水平上相对丰度
Figure 5 Relative abundances of different fungi genus
3 结 论
1)本研究所选取的北疆地区5座污水处理厂基本可以达到各自的设计出水标准,但其中3座污水处理厂运行中出现了污泥丝状膨胀。
2)5座北疆地区污水处理厂活性污泥中,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和绿弯菌门(Chloroflexi)是活性污泥的优势细菌门,放线菌门(Actinobacteria)在沉降性能良好的污泥中相对丰度为2.97%~6.17%,在丝状污泥膨胀中相对丰度达到11.69%~15.64%。季节性膨胀污泥中微丝菌(Microthrix)和黄杆菌(Flavobacterium)相对丰度呈现出季节性变化,常年膨胀的污泥中腐螺旋菌属(Saprospiraceae_norank)为优势细菌属,相对丰度达到17.48%~18.30%。
3)在出现丝状污泥膨胀的3座污水处理厂活性污泥中,丝状膨胀污泥中子囊菌门(Ascomycota)是优势真菌门,相对丰度为56.60%~72.68%。子囊菌属(Ascomycota_norank)和丝孢菌属(Trichosporon)是优势真菌属,相对丰度为8.85%~35.74%和13.38%~20.15%。
[1] SAUNDERS A M, ALBERTSEN M, VOLLERTSEN J, et al. The activated sludge ecosystem contains a core community of abundant organisms[J]. ISME Journal, 2016, 10(1): 11-20.
[2] GAO P, XU W L, SONTAG P, et al. Correlating microbial community compositions with environmental factors in activated sludge from four full-scale municipal wastewater treatment plants in Shanghai, China[J]. Applied Microbiology and Biotechnology 2016, 100(10): 4663-4673.
[3] QIN H, JI B, ZHANG S F, et al. Study on the bacterial and archaeal community structure and diversity of activated sludge from three wastewater treatment plants[J]. Marine Pollution Bulletin, 2018, 135: 801-807.
[4] 张琼, 包鹏, 彭永臻, 等. 低温条件对SBR工艺亚硝酸氧化菌种群结构的影响 [J]. 环境工程, 2019, 37(3): 75-81.
[5] ZHANG H, FENG J, CHEN S, et al. Disentangling the drivers of diversity and distribution of fungal community composition in wastewater treatment plants across spatial scales[J]. Frontiers in Microbiology, 2018, 9: 1291.
[6] 彭永臻, 郭建华. 活性污泥膨胀机理、成因及控制[M]. 北京: 科学出版社, 2012.
[7] 郭泓利, 李鑫玮, 任钦毅, 等. 全国典型城市污水处理厂进水水质特征分析[J]. 给水排水, 2018, 44(6): 12-15.
[8] ZHANG B, XU X Y, ZHU L. Structure and function of the microbial consortia of activated sludge in typical municipal wastewater treatment plants in winter[J]. Scientific Reports, 2017, 7(1): 17930.
[9] LIU T, LIU S F, ZHENG M S, et al. Performance assessment of full-scale wastewater treatment plants based on seasonal variability of microbial communities via High-Throughput Sequencing[J]. Plos One, 2016, 11(4): 152998.
[10] ZHANG B, YU Q W, YAN G Q, et al. Seasonal bacterial community succession in four typical wastewater treatment plants: correlations between core microbes and process performance[J]. Scientific Reports, 2018, 8(1): 4566.
[11] WANG P, YU Z S, QI R, et al. Detailed comparison of bacterial communities during seasonal sludge bulking in a municipal wastewater treatment plant[J]. Water Research, 2016, 105: 157-166.
[12] 端正花, 潘留明, 陈晓欧, 等. 低温下活性污泥膨胀的微生物群落结构研究[J]. 环境科学, 2016, 37(3): 1070-1074.
[13] 李松亚, 费学宁, 焦秀梅. 污泥膨胀关键菌-微丝菌的研究进展[J]. 水处理技术, 2018, 44(3): 11-16.
[14] YANG Q X, ZHAO H L, DU B B. Bacteria and bacteriophage communities in bulking and non-bulking activated sludge in full-scale municipal wastewater treatment systems[J]. Biochemical Engineering Journal, 2017, 119: 101-111.
[15] PURNOMO A S, PUTRA S R, SHIMIZU K, et al. Biodegradation of heptachlor and heptachlor epoxide-contaminated soils by white-rot fungal inocula[J]. Environmental Science Pollution Research International, 2014, 21(19): 11305-11312.
[16] WEI Z Y, LIU Y Y, FENG K, et al. The divergence between fungal and bacterial communities in seasonal and spatial variations of wastewater treatment plants[J]. Science of the Total Environment, 2018: 969-978.
[17] NIU L H, LI Y, XU L L, et al. Ignored fungal community in activated sludge wastewater treatment plants: diversity and altitudinal characteristics[J]. Environmental Science Pollution Research, 2017, 24(4): 4185-4193.
[18] 洪颖, 姚俊芹, 马斌, 等. 基于高通量测序的SBR反应器丝状膨胀污泥菌群分析[J]. 环境科学, 2018, 39(7): 3279-3285.
[19] 张崇淼, 牛全睿, 徐丽梅, 等. 膨胀污泥中丝状菌的分离鉴定与特性分析[J]. 环境科学, 2017, 38(6): 2477-2485.