0 引 言
湖泊作为水资源的重要载体之一,其水体富营养化问题频发[1,2]。湖泊水环境污染的主因可分为外源和内源污染2类,有研究认为内源污染的影响远大于外源流入[3]。在适当条件下,底泥中的氮、磷等营养物质将通过与上覆水体之间的迁移转化过程,重新释放到水体中,造成二次污染[4,5]。在此过程中,微生物群落与底泥中氮、磷等营养元素的相互作用关系起到关键性作用[6]。
底泥微生物是水体底泥(沉积物)中一切难以用肉眼观察的微小生物的总称,严格意义上包括细菌、古菌、真菌、病毒、原生动物和显微藻类等[7]。底泥微生物群落在碳循环(纤维素及有机物分解作用)、氮循环(矿化及硝化反硝化作用)、腐殖质分解和合成、磷和硫等其他元素的价态转化过程中起到不可替代的作用,是底泥污染物降解的主要动力,也是物质能量循环的主要驱动者[8-10]。
生态位能够反映生物种群在生态系统中的时空占位及功能关系,是研究生态系统结构和功能的重要理论方法[11]。生态位理论中所涉及的参数有生态位宽度、生态位重叠指数和生态响应速率等,这些参数可从不同角度反映生物种群的生态位特征[12,13]。因此,采用生态位原理研究湖泊底泥微生物具有重要理论和现实意义。
本文选择淮河流域典型淡水湖泊——八里河作为研究区域,对湖泊底泥微生物进行四季的连续采样分析,通过优势度指数计算确定了底泥微生物的优势属,并基于生态位理论研究了湖泊底泥微生物优势属的生态位特征,以期对淡水湖泊水生态系统管理提供指导,并为同类型湖泊底泥微生物研究提供参考。
1 研究区域与研究方法
1.1 研究区域概况
八里河位于安徽省阜阳市境内淮河与沙颍河交汇处,原为沙颍河流域安徽段的最大支流,后经人工开挖形成湖泊,地理坐标为116°14′E—116°19′E,32°33′N—32°36′N(图1)。八里河流域总面积约为500 km2,多年平均降雨量为965.6 mm,蒸发量为920.5 mm,多年平均气温为15.1 ℃,无霜期为221 d,日照为2213.3 h。
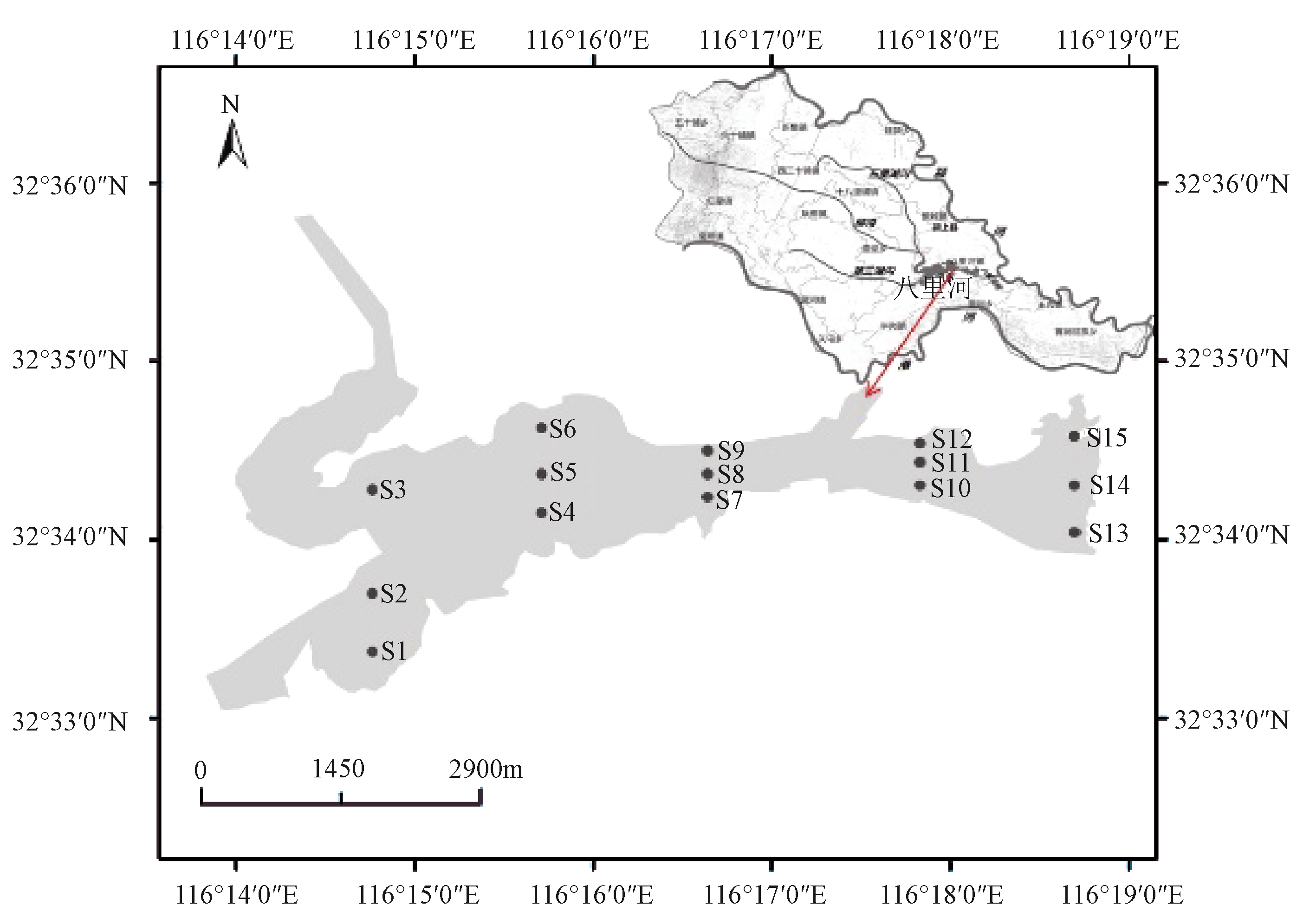
图1 八里河与采样点分布
Figure 1 Lake Balihe and the sampling sites distribution
1.2 实验方法
本实验在八里河湖区沿水流方向均匀布设了15个底泥微生物采样点,采样点分布如图1所示。在2017年7月(夏季)、2017年10月(秋季)、2018年1月(冬季)和2018年4月(春季)分别对各采样点进行了表层底泥样品的采集并及时提取微生物基因组DNA。
DNA的提取采用DNeasy®PowerSoil®Kit,提取程序参考试剂盒说明书。委托具有CMA检测资质的北京诺禾致源科技股份有限公司进行细菌和古菌V4~V5区域的16S rRNA扩增子测序,测序基于IonS5TMXL高通量测序平台,利用单端测序(Single-End)的方法,构建小片段文库进行单端测序[14]。测序数据初步处理后,对OTU聚类和物种进行注释,最后获得分类学信息并统计各分类水平下的样本群落组成。
1.3 计算方法
优势度指数Y、生态位宽度Bi、生态位重叠指数ΔOik和生态响应速率R[15]的计算公式分别如式(1)—(4)所示。
![]() (1)
(1)
式中:ni为第i种在1次采样中各采样点的总个体数;N为该次采样中各采样点总菌个体数;fi为第i种在各采样点出现的频率。
![]() (2)
(2)
式中:Pij=nij/N为第i种在第j个资源状态下个体数占该种所有个体数的比例,其中,nij为第i种在第j个资源状态(采样点)下的个体数;r为资源状态总数。
![]() (3)
(3)
式中:![]() 其代表种i与种j的资源利用曲线的重叠指数。当种i和种k生态位完全重叠时,ΔOik=1,反之,ΔOik=0。在i=k的情况下,比较ΔOik的大小可以说明不同种的生态习性变化,差值为正,说明该种处于发展期;差值为负,说明该种处于衰退期;差值为0,说明该种是中性的;
其代表种i与种j的资源利用曲线的重叠指数。当种i和种k生态位完全重叠时,ΔOik=1,反之,ΔOik=0。在i=k的情况下,比较ΔOik的大小可以说明不同种的生态习性变化,差值为正,说明该种处于发展期;差值为负,说明该种处于衰退期;差值为0,说明该种是中性的;![]() 为种群i占有其他种群的资源量;
为种群i占有其他种群的资源量;![]() 为种群i被其他种群占用的资源量。
为种群i被其他种群占用的资源量。
R=Bi/ΔOik(i=k)(4)
2 八里河微生物优势属
2.1 细菌优势属
利用式(1)计算八里河底泥微生物细菌各属的优势度指数,并以优势度指数Y>0.02为标准对4个季节的细菌优势属进行筛选,共筛选出5门13个细菌优势属,如表1所示。其中,变形菌门和厚壁菌门优势属数量较多,分别为5个和4个。
表1 八里河底泥细菌优势属及其分布季节
Table 1 Dominant genus and the distribution seasons of sediment bacteria in Lake Balihe

编号门属季节1变形菌门(Proteobacteria)γ变形菌(Gammaproteobacte-ria)△▲▽▼2δ变形菌(Deltaproteobacteria)▲▽▼3伯克氏菌(Burkholderiaceae)△▲▼4铁矿沙单孢菌(Arenimonas)△5脱硫酸盐橡菌(Desulfatiglans)▲▽▼6厚壁菌门(Firmicutes)消化链球菌科(sp)(Rombout-sia)△7梭菌(Clostridiales)△8八叠球菌(Sporacetigenium)△9乳酸杆菌(Lactobacillus)▽10拟杆菌门(Bacteroidetes)黄杆菌(Flavobacterium)△11拟杆菌(Bacteroides)▲12放线菌门(Actinobacteria)双叉杆菌(Bifidobacterium)▽13酸杆菌门(Acidobacteria)酸杆菌(Acidobacteria)△▲▽▼
注:△代表春季,▲代表夏季,▽代表秋季,▼代表冬季。
在优势属数量的季节变化上,春、夏、秋、冬各有细菌优势属8,6,6,5种,春季的细菌优势属多样性较高。从不同优势属的季节分布来看,厚壁菌门、拟杆菌门和放线菌门所属的7个属均只在单个季节呈现优势状态,这些属均未在冬季表现出优势,且厚壁菌门的优势属多分布在春季;变形菌门中的4个属在包括夏季和秋季的多个季节呈现优势状态;γ变形菌和酸杆菌门在4个季节都是优势属。
表2为八里河4个季节细菌优势属出现频率及优势度指数。可知:八里河4个季节的底泥细菌优势属的优势度指数为0.022~0.112,除了乳酸杆菌(93%)和双叉杆菌(67%)以外,其他优势属对应季节的出现频率均为100%。 比较优势度指数的变化趋势,4个季节均表现为优势属1和13,优势度指数顺序为春>冬>夏>秋;3个季节表现为优势属2、3和5,趋势各不相同,其中优势属5的优势度指数在秋季达到最大值。所有优势属优势度指数的平均值表现出春季最大、秋季最小的趋势。
表2 细菌优势属出现频率和优势度指数
Table 2 Frequency and dominance index for the dominant genera of bacteria
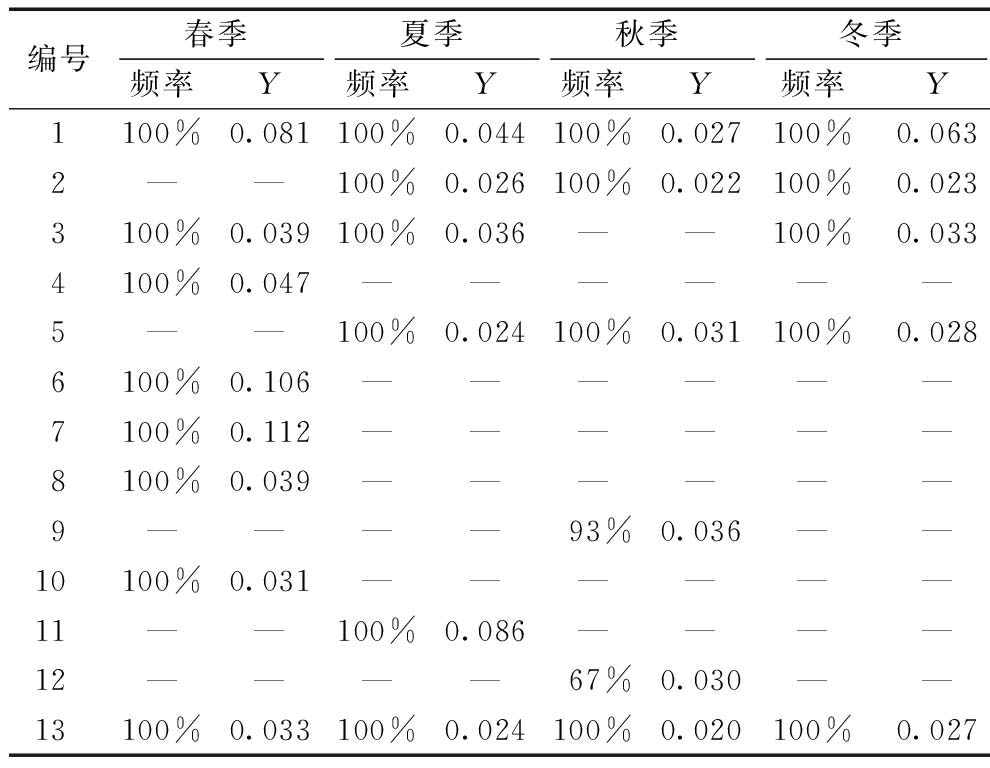
编号春季夏季秋季冬季频率Y频率Y频率Y频率Y1100%0.081 100%0.044 100%0.027 100%0.063 2——100%0.026 100%0.022 100%0.023 3100%0.039 100%0.036 ——100%0.033 4100%0.047 ——————5——100%0.024 100%0.031 100%0.028 6100%0.106 ——————7100%0.112 ——————8100%0.039 ——————9————93%0.036 ——10100%0.031 ——————11——100%0.086 ————12————67%0.030 ——13100%0.033 100%0.024 100%0.020 100%0.027
2.2 古菌优势属
用2.1节中相同标准对4个季节的古菌优势属进行筛选,共筛选出4门8个古菌优势属,明显少于细菌优势属数量[16],如表3所示。其中,广古菌门的优势属数量最多,为4个。优势属数量的季节变化上,春、夏、秋、冬季各有细菌优势属7,8,8,8种,季节分布相对均匀。仅有Nitrosoarchaeum(优势属6)在春季没有成为优势属。
八里河4个季节的底泥古菌优势属的优势度介于0.028~0.574(表4),所有的优势属在相应季节15个采样点的出现频率达到100%。分析优势度指数随季节的变化趋势,优势属2、3、4、5、8的优势度指数按照季节排列为:春、冬>夏、秋,呈现明显的U形。
表3 八里河底泥古菌优势属及其分布季节
Table 3 Dominant genus and the distribution seasons of sediment Archaea in Lake Balihe
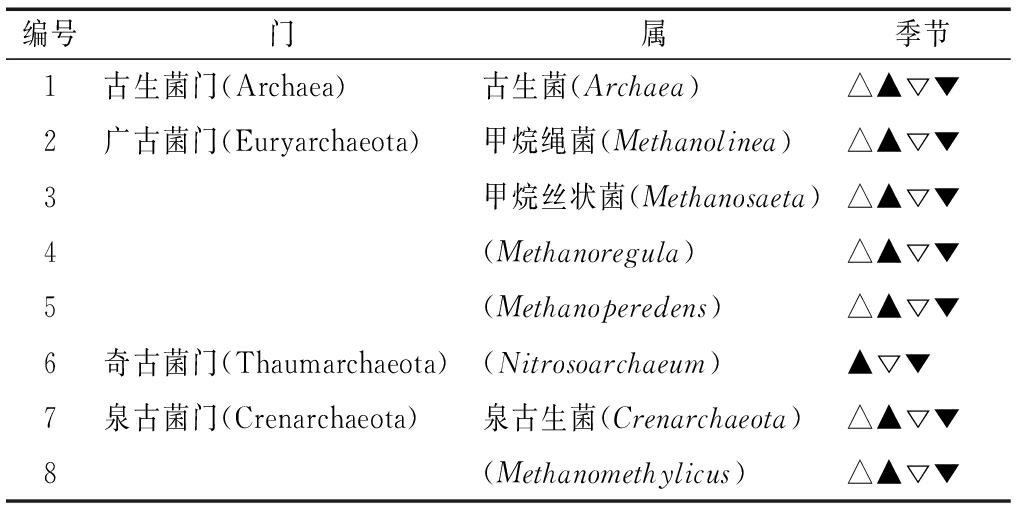
编号门属季节1古生菌门(Archaea)古生菌(Archaea)△▲▽▼2广古菌门(Euryarchaeota)甲烷绳菌(Methanolinea)△▲▽▼3甲烷丝状菌(Methanosaeta)△▲▽▼4(Methanoregula)△▲▽▼5(Methanoperedens)△▲▽▼6奇古菌门(Thaumarchaeota)(Nitrosoarchaeum)▲▽▼7泉古菌门(Crenarchaeota)泉古生菌(Crenarchaeota)△▲▽▼8(Methanomethylicus)△▲▽▼
注:△代表春季,▲代表夏季,▽代表秋季,▼代表冬季。
优势属1则相反,春季和冬季的优势度指数小于夏季和秋季,呈现明显的倒U形。同时,优势属1的优势度指数在夏、秋、冬3个季节显著大于其他优势属。优势属7优势度指数季节顺序为春>夏>秋>冬,优势属6为夏>秋>冬,随季节呈下降趋势。
表4 古菌优势属出现频率和优势度指数
Table 4 Frequency and dominance index for the dominant genera of Archaea

编号春季夏季秋季冬季频率Y频率Y频率Y频率Y1100%0.148100%0.485100%0.574100%0.4142100%0.289100%0.183100%0.142100%0.2043100%0.234100%0.072100%0.091100%0.0394100%0.111100%0.074100%0.029100%0.1225100%0.041100%0.031100%0.050100%0.0816——100%0.063100%0.042100%0.0377100%0.084100%0.045100%0.029100%0.0298100%0.055100%0.032100%0.028100%0.060
3 八里河微生物优势属生态位
3.1 细菌优势属生态位
生物种群的生态位越宽,说明该种更倾向于泛化种,具有更强的竞争力;反之,生态位越窄则更倾向于特化种,在竞争中处于劣势[17]。根据式(2)计算得到八里河底泥细菌各优势属的生态位宽度如表5所示。
表5 细菌优势属生态位宽度Bi、生态位重叠指数ΔOik和生态响应速率R
Table 5 Niche breadth Bi, niche overlap index ΔOik and ecological response rate R for the dominant genera of Bacteria
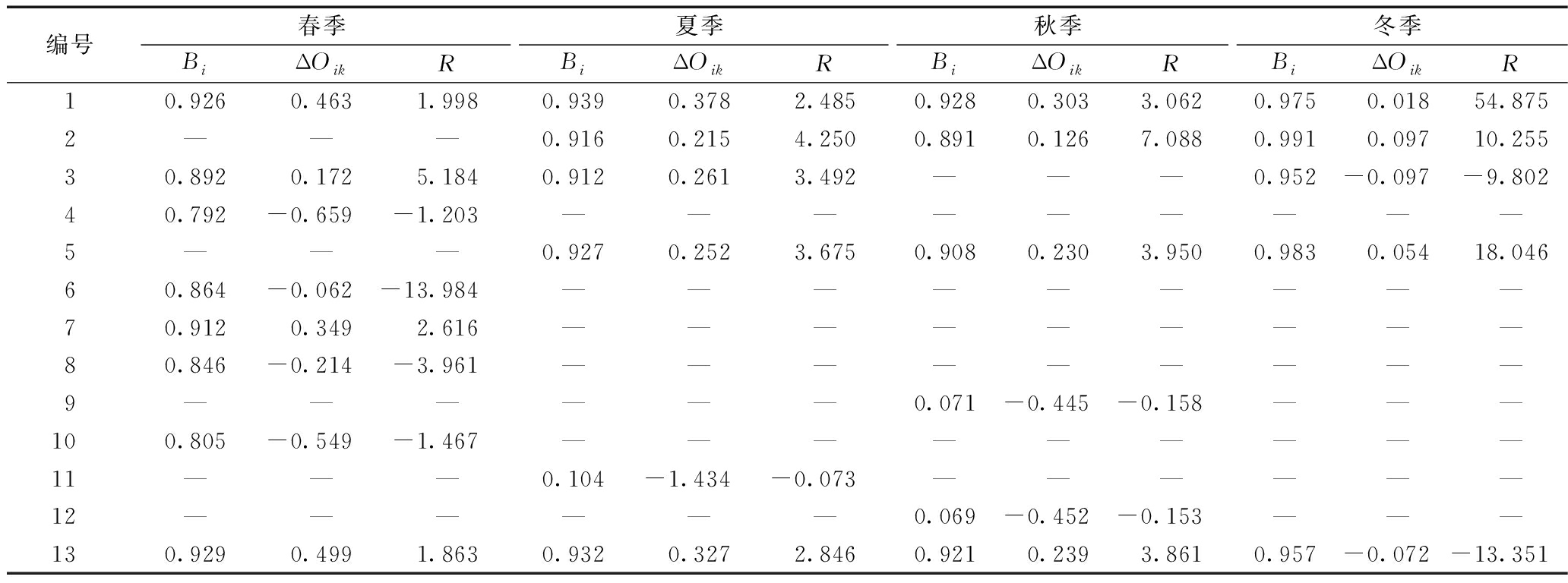
编号春季夏季秋季冬季BiΔOikRBiΔOikRBiΔOikRBiΔOikR10.926 0.4631.9980.939 0.3782.4850.928 0.3033.0620.975 0.01854.8752———0.916 0.2154.2500.891 0.1267.0880.991 0.09710.25530.892 0.1725.1840.912 0.2613.492———0.952 -0.097-9.80240.792 -0.659-1.203—————————5———0.927 0.2523.6750.908 0.2303.9500.983 0.05418.04660.864 -0.062-13.984—————————70.912 0.3492.616—————————80.846 -0.214-3.961—————————9——————0.071 -0.445-0.158———100.805 -0.549-1.467—————————11———0.104 -1.434-0.073——————12——————0.069 -0.452-0.153———130.929 0.4991.8630.932 0.3272.8460.921 0.2393.8610.957 -0.072-13.351
将所筛选的13个细菌优势属分为以下4类:
第Ⅰ类:由γ变形菌和酸杆菌组成,它们在各个季节均作为优势属出现,且各个时期生态位宽度>0.9,表现出对环境的强大适应能力、生存能力以及对资源的利用能力。
第Ⅱ类:由δ变形菌、伯克氏菌和脱硫酸盐橡菌组成,它们在1年的3个季节中作为优势属出现,生态位宽度处于0.891~0.991,与第Ⅰ类菌持平。在特定季节的生存能力弱于第Ⅰ类菌。
第Ⅲ类:由铁矿沙单孢菌、消化链球菌科、梭菌、八叠球菌、黄杆菌组成,仅在某一个季节成为优势属,生态位宽度为0.792~0.912,略低于第Ⅰ类和第Ⅱ类菌,在特定季节具有较强的生存能力和资源利用能力。第Ⅳ类:由乳酸杆菌、拟杆菌、双叉杆菌组成,仅在1个季节、特定位点成为优势属,生态位宽度为0.069~0.104,显著低于其他菌,对环境适应能力弱。
由表5可知:春季,酸杆菌、γ变形菌具有较大的正ΔOik,表明这2个菌有着最大的发展空间,铁矿沙单孢菌具有最大的负ΔOik,处于快速衰退阶段;夏季,除了拟杆菌外,其他各优势属菌的ΔOik均为正值,处于快速发展阶段;秋季,乳酸杆菌和双叉杆菌有较大的负ΔOik,处于快速衰退阶段,脱硫酸盐橡菌、γ变形菌、δ变形菌和酸杆菌ΔOik小于夏季,发展缓慢;在冬季,各菌的正、负ΔOik的值均明显小于其他3个季节,发展和衰退情况不明显。
3.2 古菌优势属生态位
根据季节和优势属的生态位宽度可将以上筛选的8个优势属菌分为3类:
第Ⅰ类:由古生菌、泉古生菌和Methanomethylicus组成,在各个季节均作为优势属出现,且各个时期生态位宽度>0.75,这一类优势属对环境适应能力强,利用资源能力高。
第Ⅱ类:由甲烷绳菌、甲烷丝状菌、Methanoregula和Methanoperedens组成,在各个季节均作为优势属出现,其夏季的生态位宽度为0.436~0.653,小于第Ⅰ类菌,其他季节差别不明显。在夏季生存能力、利用资源能力较弱。
第Ⅲ类:由Nitrosoarchaeum组成,仅在3个季节成为优势属,优势度为0.715~0.867,其在春季适应能力很差,对环境有一定要求。
春季,泉古生菌、Methanomethylicus具有较大的正ΔOik,发展速度最快,甲烷绳菌具有最大的负ΔOik,处于迅速衰退阶段;夏季,除了泉古生菌、Methanomethylicus和古生菌外,其他各优势属菌的ΔOik均为负值,处于衰退阶段;秋季和冬季,大部分菌的正、负ΔOik的值均明显小于其他3个季节,发展和衰退情况不明显,详见表6。
表6 古菌优势属生态位宽度Bi、生态位重叠指数ΔOik和生态响应速率R
Table 6 Niche breadth Bi, niche overlap index ΔOik and ecological response rate R for the dominant genera of Archaea
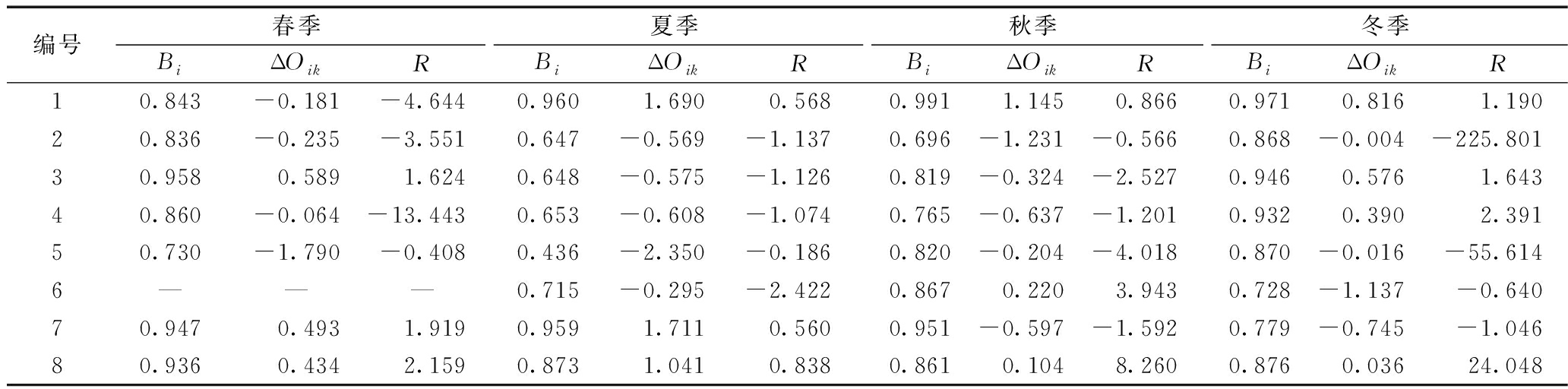
编号春季夏季秋季冬季BiΔOikRBiΔOikRBiΔOikRBiΔOikR10.843-0.181-4.6440.9601.6900.5680.9911.1450.8660.9710.816 1.19020.836-0.235-3.5510.647-0.569-1.1370.696-1.231-0.5660.868-0.004-225.80130.9580.5891.6240.648-0.575-1.1260.819-0.324-2.5270.9460.5761.64340.860-0.064-13.4430.653-0.608-1.0740.765-0.637-1.2010.9320.3902.39150.730-1.790-0.4080.436-2.350-0.1860.820-0.204-4.0180.870-0.016-55.6146———0.715-0.295-2.4220.8670.2203.9430.728-1.137-0.64070.9470.4931.9190.9591.7110.5600.951-0.597-1.5920.779-0.745-1.04680.9360.4342.1590.8731.0410.8380.8610.1048.2600.8760.03624.048
4 结 论
1)八里河底泥微生物细菌和古菌优势属分别为5门13属和4门8属,细菌优势属主要集中在变形菌门(5属)和厚壁菌门(4属),古菌则以广古菌门(4属)为主。
2)细菌优势属春季多样性略高,优势属种类季节差异较大,且多数(7属)只在单个季节(除冬季外)呈优势;古菌优势属数量和种类季节差异均较小,仅有奇古菌门的Nitrosoarchaeum在春季不占优势。
3)结合生态位宽度和优势度指数,可按照生存及其对环境的适应能力强弱将所筛选出的细菌和古菌优势属分别划分为4类和3类。
4)春季各细菌优势属的发展和抑制情况明显,尽管冬季的优势属发展和抑制程度均较轻,但夏、秋和冬季多数细菌优势属具有发展空间;古菌优势属除广古菌门的Methanolinea和Methanoperedens在4个季节均受抑制外,其他均在4个季节交替呈发展或抑制状态。
[1] 冯玉琦. 我国水环境的现状、存在问题及治理方略[J]. 农业与技术, 2003, 23(2): 12-15.
[2] 马经安, 李红清. 浅谈国内外江河湖库水体富营养化状况[J]. 长江流域资源与环境, 2002, 11(6): 575-578.
[3] ANNA E, TERENCE S, SARA S L, et al. Microbial community structure in polluted Baltic Sea sediments[J]. Environmental Microbiology, 2010, 8(2): 223-232.
[4] TANG X Q, WU M, YANG W J, et al. Ecological strategy for eutrophication control[J]. Water, Air, & Soil Pollution, 2012, 223(2): 723-737.
[5] 张维理, 徐爱国, 冀宏杰, 等. 中国农业面源污染形势估计及控制对策Ⅲ. 中国农业面源污染控制中存在问题分析[J]. 中国农业科学, 2004, 37(7): 1026-1033.
[6] 王佳. 浑河底泥微生物群落结构时空变化及其与水环境因子间的关联研究[D]. 西安: 西安建筑科技大学, 2015.
[7] YANG J, ZHANG Y Y, LIU L M, et al. Microbial community and urban water quality[J]. Bulletin of the Chinese Academy of Sciences, 2012, 26(1): 76-83.
[8] 李玫, 廖宝文, 章金鸿. 底泥微生物在红树林生态系统中的作用[J]. 广州环境科学, 2006(4): 21-25.
[9] WAINRIGHT S C. Sediment-to-water fluxes of particulate material and microbes by resuspension and their contribution to the planktonic food web[J]. Marine Ecology Progress, 1990, 62(3): 271-281.
[10] 何晨凤, 张芳娟, 梁晓倩, 等. 添加酸改性赤泥对模拟人工湿地生态系统的影响[J]. 环境工程, 2018, 36(7): 51-55,61.
[11] 徐春燕, 俞秋佳, 徐凤洁, 等. 淀山湖浮游植物优势种生态位[J]. 应用生态学报, 2012, 23(9): 2550-2558.
[12] 李德志, 石强, 臧润国, 等. 物种或种群生态位宽度与生态位重叠的计测模型[J]. 林业科学, 2006, 42(7): 95-103.
[13] 王翠红, 张金屯. 汾河水库及河道中优势硅藻生态位的研究[J]. 生态学杂志, 2004, 23(3): 58-62.
[14] 艾士奇, 赵一全, 孙志远, 等. 复合菌系降解纤维素过程中微生物群落结构的变化[J]. 生物工程学报, 2018, 34(11): 1794-1808.
[15] 郭坤, 杨德国, 彭婷, 等. 湖北省长湖浮游植物优势种生态位分析[J]. 湖泊科学, 2016, 28(4): 825-834.
[16] CHEN J, JIANG X W, GU J D. Existence of novel phylotypes of nitrite-dependent anaerobic methane oxidation bacteria in surface and subsurface ocean sediments of the South China Sea[J]. Geomicrobiology Journal, 2015, 32(1): 1-10.
[17] SAGAR T, WILSON P. Niches of common bryophytes in a semi-arid landscape[J]. The Bryologist, 2009, 112(1): 30-41.