0 引 言
随着近几十年来纺织印染行业发展,纺织印染污泥产生量也急剧增加[1],污泥的运输和处理费用约占总运行费用的60%[2]。印染污泥的有机物含量高,含有许多未降解的染料、助剂、表面活性剂和重金属等[3,4],若不能妥善处理会给人体健康和环境带来极大危害。通过将污泥中泥、水分离,以减少污泥体积,从而可降低污泥运输和处置成本。但污泥胶体体系稳定,水很难从污泥悬浮液中分离出来。
污泥脱水一般采用化学调理或机械脱水方式,污泥含水率可降低至80%,无法满足后续污泥处置要求。因此需对污泥进行预处理以分解部分污泥絮体和微生物细胞,释放结合水,从而改善污泥脱水特性。污泥预处理方法有:添加酸和表面活性剂[5]、芬顿试剂预处理[6]、真菌处理[7]、超声波[8]和微波辐射[9]。其中,微波辐射具有“热”和“无热”效应,被认为是改善污泥脱水性的有效工具。此外,一些研究者采用外加酶方法处理污泥[10],如Bonilla等[11]研究了中性纤维素酶、中性蛋白酶2种酶对造纸废水污泥脱水性能的影响,经处理后EPS 结构及污泥絮体结构得到破坏,改善了污泥脱水性能。生物酶法处理污泥具有缩短污泥水解时间、后续处理方便、不产生二次污染等优点;但由于EPS复杂的空间结构有时会对酶进行包裹,阻碍酶与底物的接触,影响水解性能。Wang等[12]对活性溶菌酶和失活溶菌酶改善污泥脱水性能机理进行研究,发现二者都能显著提高污泥脱水性能,且作用效果相当。
经证明,微波及其混合处理工艺可能导致污泥增溶[13]、可溶性有机物释放[14]和污泥厌氧消化的增强[15]。但是,微波-溶菌酶联合调理印染污泥的研究却鲜有报道。本文采用微波与溶菌酶联用对印染污泥进行预处理,对各影响因素进行正交实验,通过分析不同处理条件下污泥的胞溶效果,研究预处理对污泥脱水性能的影响,探讨胞外聚合物溶出量变化对污泥脱水性能的指征作用,以确定联合预处理的最优条件,对印染污泥的处理和处置提供一种经济、高效的新方法。
1 实验部分
1.1 材 料
实验污泥取自江苏苏州盛泽镇盛泽喷织污水处理有限公司生化池。污泥样品置于4 ℃恒温冷藏柜中保存。印染污泥样品基本性质见表1。
表1 印染污泥的基本性质
Table 1 Basic properties of the printing and dyeing sludge

pHρ(TS)/(g/L)ρ(VSS)/(g/L)毛细吸水时间/sw(蛋白质)/[mg/g(TSS)]w(多糖)/[mg/g(TSS)]ρ(SCOD)/(mg/L)6.84.132.7728.627.529.31235.44
1.2 分析方法
TSS、VSS、COD采用标准测定方法测定[16]。蛋白质采用考马斯亮蓝法测量[17]。多糖采用硫酸-蒽酮法[18,19]测量。通过QM/TM型稳态/瞬态荧光光谱仪测定上清液中可溶性有机物变化,其激发波长λex为220~400 nm,发射波长λem为285~500 nm,波长间隔为5 nm。采用S-4800型扫描电镜观察污泥形貌,将样品进行前处理固定脱水后,均匀涂抹在表面平整、干净透明的薄玻璃片上,再将其干燥后进行喷金处理,然后置于扫描电镜下以放大倍数为10 K进行观察。
上清液中多糖、蛋白质增长率计算如式(1)所示:
增长率![]() (1)
(1)
式中:m0为原印染污泥含量,mg/g(TSS);m为预处理后污泥含量,mg/g(TSS)。
1.3 正交实验
微波与溶菌酶联用对印染污泥的预处理受诸多因素影响。本实验采用L18(35)正交实验方法,根据表2列出的实验因素及水平,得到正交实验结果如表3所示。根据表3的试验条件(酶解温度、加酶量、酶解时间及微波时间、功率)考察预处理后污泥上清液中蛋白质、多糖和SCOD浓度,并进行极差分析,确定各因素对印染污泥脱水性能的影响程度,以确定微波与溶菌酶联用促进印染污泥脱水的最优条件。
2 结果与讨论
2.1 不同因素水平对污泥水解效果的影响
污泥中SCOD可以反映污泥的液化效果,为此首先对污泥SCOD溶解率指标进行分析,以确定污泥水解最佳条件。如表4所示,各因素对SCOD溶出影响的显著性主次关系为微波时间>酶解温度>酶解时间>加酶量>微波功率,即最佳处理条件为微波时间150 s,酶解温度45 ℃,酶解时间3 h,加酶量0.09 g/g(TSS),微波功率800 W。
表2 微波与酶联用正交实验因素水平
Table 2 Microwave and enzyme orthogonal test factors level table
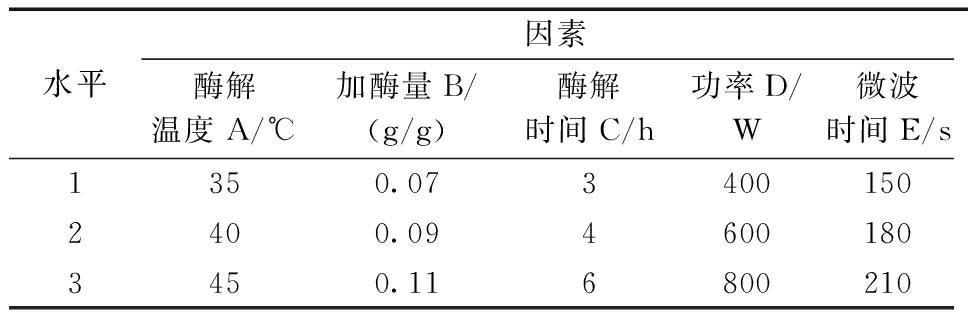
水平因素酶解温度A/℃加酶量B/(g/g)酶解时间C/h功率D/W微波时间E/s1350.0734001502400.0946001803450.116800210
表3 微波与酶联用正交实验结果
Table 3 Orthogonal test results of microwave and enzyme
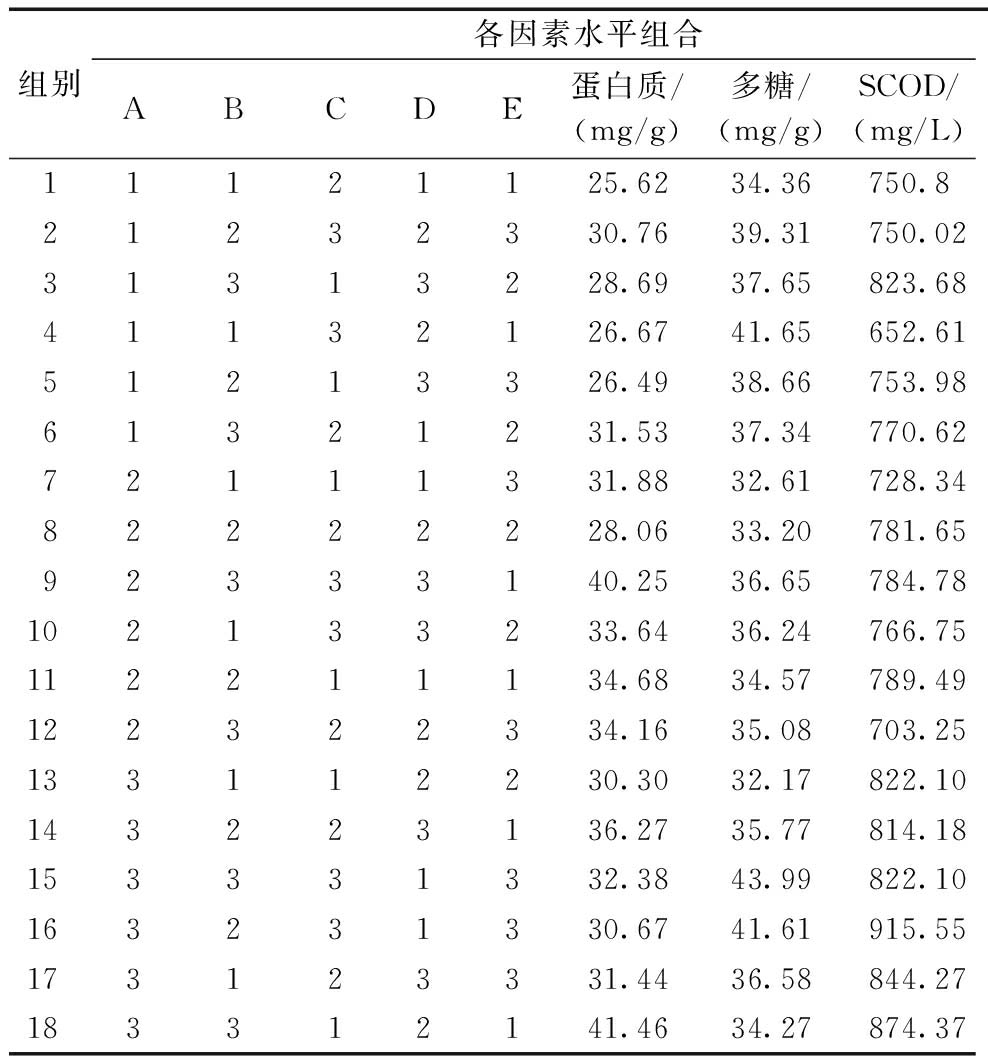
组别各因素水平组合ABCDE蛋白质/(mg/g)多糖/(mg/g)SCOD/(mg/L)11121125.6234.36750.821232330.7639.31750.0231313228.6937.65823.6841132126.6741.65652.6151213326.4938.66753.9861321231.5337.34770.6272111331.8832.61728.3482222228.0633.20781.6592333140.2536.65784.78102133233.6436.24766.75112211134.6834.57789.49122322334.1635.08703.25133112230.3032.17822.10143223136.2735.77814.18153331332.3843.99822.10163231330.6741.61915.55173123331.4436.58844.27183312141.4634.27874.37
表4 印染污泥溶出SCOD的极差分析
Table 4 Extreme analysis of the dissolution of SCOD in printing and dyeing sludge
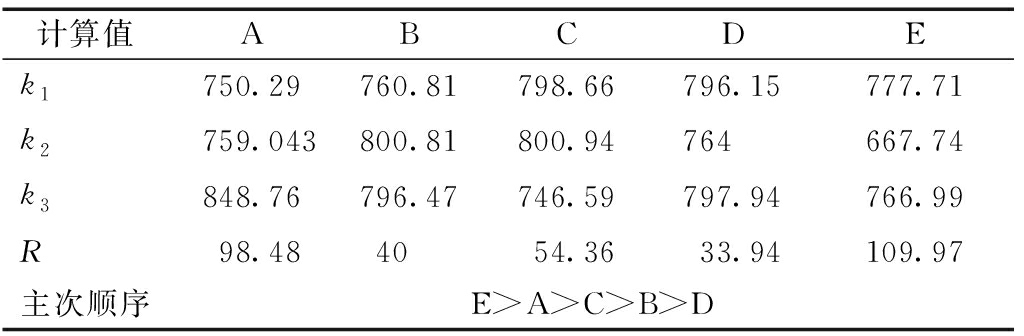
计算值ABCDEk1750.29760.81798.66796.15777.71k2759.043800.81800.94764667.74k3848.76796.47746.59797.94766.99R98.484054.3633.94109.97主次顺序E>A>C>B>D
注:Ki(i=1,2,3)为各因素每一种水平对应的反应后污泥SCOD溶解率之和;ki(i=1,2,3)为各因素每一种水平所对应的SCOD平均值,即ki=Ki/6;R为水解后污泥SCOD的极差,即各因素的ki最大值与最小值之差。
2.2 不同因素水平对水解产物溶出量的影响
表5和表6分别显示了污泥中糖和蛋白质水解后溶出累积量。通过考察不同因素水平对各产物累积量的影响,可以控制一定的反应条件,减少能耗,达到资源利用的最大化。
表5 印染污泥蛋白质溶出的极差分析
Table 5 Extreme analysis of protein dissolution in printing and dyeing sludge
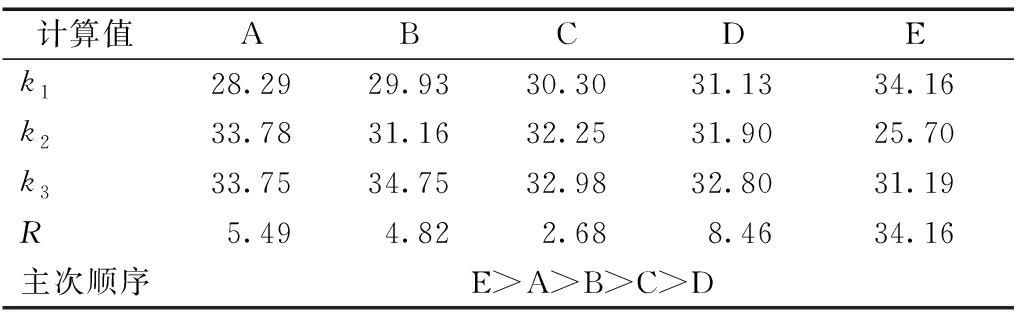
计算值ABCDEk128.2929.9330.3031.1334.16k233.7831.1632.2531.9025.70k333.7534.7532.9832.8031.19R5.494.822.688.4634.16主次顺序E>A>B>C>D
表6 印染污泥多糖的溶出极差分析
Table 6 Analysis of dissolution difference of printing and dyeing sludge polysaccharides
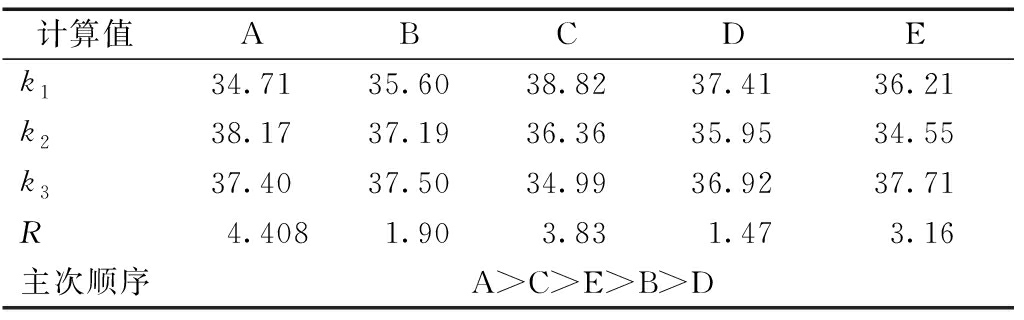
计算值ABCDEk134.7135.6038.8237.4136.21k238.1737.1936.3635.9534.55k337.4037.5034.9936.9237.71R4.4081.903.831.473.16主次顺序A>C>E>B>D
由表5可知:延长微波时间、增加酶解温度都有利于固相污泥中的蛋白质转移到液相。酶解温度在40 ℃和45 ℃时蛋白质溶出量相差不大。由表6可知:温度升高有利于多糖类物质的溶出,有氧条件下污泥水解液中的小分子糖类易降解,被污泥中的活性微生物再次利用,因此反应时间的延长反而不利于糖的积累。污泥蛋白质、多糖和SCOD的溶出量随着溶菌酶量投加量增加而增加,在0.11 g/g(TSS)和0.09 g/g(TSS)之间无显著差异。当底物浓度足够时,溶菌酶分子的增多有利于底物水解;但当溶菌酶浓度很高时,蛋白质增加明显,而多糖和SCOD增量较少,这可能是由于底物大都被水解而溶菌酶未完全利用。综合考虑经济性和高效性,得出微波与溶菌酶联用对印染污泥的最佳条件为酶解温度40 ℃,加酶量0.09 g/g(TSS),酶解时间3 h,微波功率400 W,微波时间150 s。
2.3 不同预处理方式对印染污泥的溶胞作用
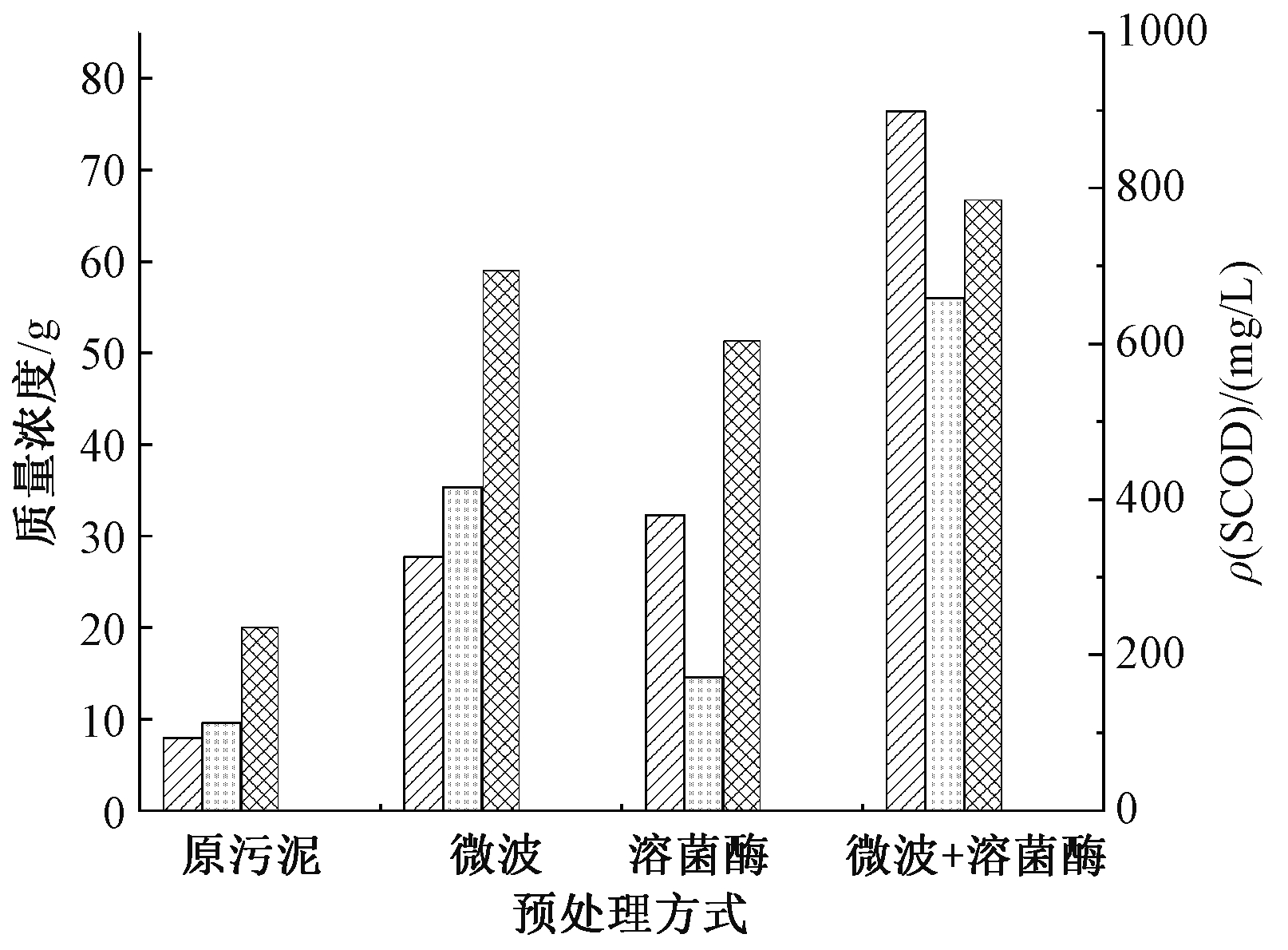
图1为印染污泥采用微波、溶菌酶及微波与溶菌酶联用3种方式处理后蛋白质、多糖及SCOD的溶出情况。可知:3种预处理方式对污泥溶解、微生物胞溶均具有促进作用。上清液中的SCOD浓度均明显升高;微波处理和溶菌酶解单独处理后上清液中多糖与蛋白质浓度相比于原污泥的增长率分别为609%、306%,二者联用后浓度增长率为1353%。说明相比于单独处理,微波和溶菌酶在促进污泥絮体破裂,有机物溶出有明显协同作用。微波辐射使污泥内部双电层脱稳,EPS的结构和功能被破坏,大量颗粒有机物释放出来,增大了底物与酶活性位点的接触面积和接触程度,促进酶的水解作用。同时,溶菌酶可水解细胞壁表面的肽聚糖等物质,破坏细胞壁,还能使大颗粒有机物进一步水解成小分子单体,提高污泥水解效率。
三维荧光光谱可用于快速确定可溶性有机物中的荧光化合物,结果如图2所示。可知:主要出现2个峰,峰D位于激发/发射波长(Ex/Em)为280~295/355~370 nm,主要是色氨酸和酪氨酸蛋白质类物质,E峰为355~360/440~450 nm,为腐殖酸类物质。三维荧光光谱的荧光强度通常反映EPS中有机化合物的变化。微波处理后D峰荧光强度增强,主要是色氨酸类蛋白质溶出增加;溶菌酶处理和二者联合处理后D、E峰的位置发生迁移,发射波长明显红移,表明化学官能团的变化存在于污泥EPS中[20],这可能归因于加入酶的催化氧化后引起具有荧光特性的化学物质的结构改变,例如含羰基的取代基、羟基、烷氧基和氨基转移到更长的波长。预处理破坏了聚合物主链(如结合的EPS)和微生物细胞中的连接,这说明荧光峰的红移是由微波破坏EPS结构,酶降解诱导的可溶性EPS中酪氨酸和色氨酸蛋白样物质的溶出导致。
![]() 蛋白质;
蛋白质; ![]() 多糖;
多糖; ![]() SCOD。
SCOD。
图1 污泥预处理前后溶出的多糖、蛋白质及SCOD的量
Figure 1 The amount of polysaccharides, proteins and SCOD dissolved before and after sludge pretreatment
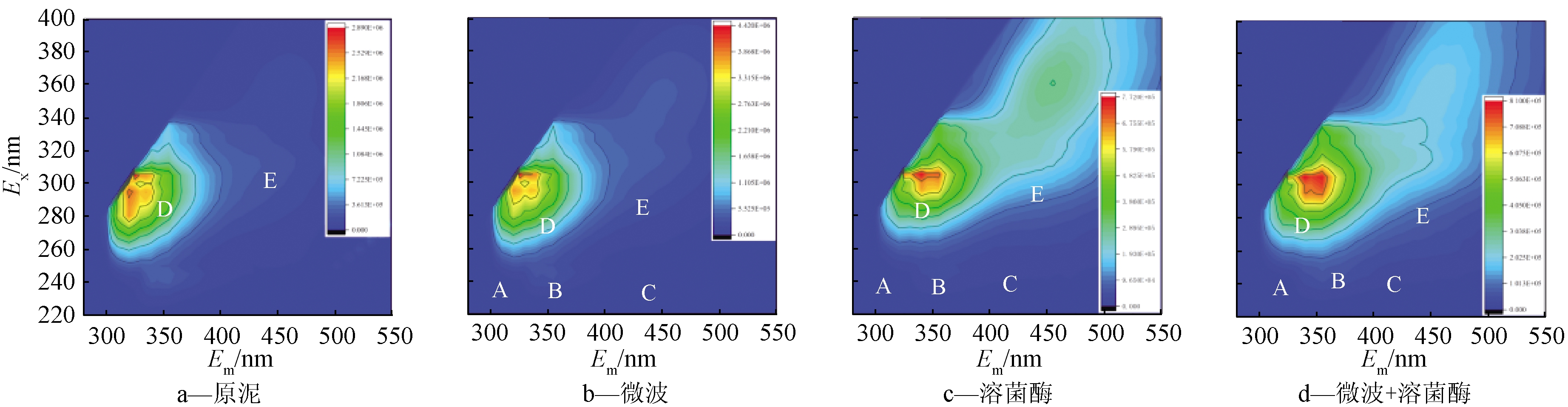
图2 污泥预处理前后EPS三维荧光光谱
Figure 2 Three-dimensional fluorescence spectrum of EPS before and after sludge pretreatment
2.4 预处理方式对印染污泥脱水性能的影响
图3为印染污泥预处理前后的污泥SEM图谱。可知:与原污泥相比,微波处理后的污泥表面双电层结构遭到破坏,污泥颗粒脱稳、絮凝,出现颗粒粗大化现象,絮体遭到破坏,絮体变小。溶菌酶处理后,表面疏松,絮体体积比微波处理后大,因为溶菌酶是一种阳离子聚合物,中和带负电的污泥颗粒,降低污泥颗粒间的排斥性,从而使污泥聚集,减少水分子运动阻力。微波和溶菌酶协同处理后污泥絮体呈明显的网状结构,结构破坏更明显。联合预处理导致污泥菌胶团破裂,絮体结构松散,边界清晰。菌胶团的破裂,导致胞内蛋白质,多糖等物质溶出,由图1、2可证实。污泥内部结合水是微生物内部的水分,而去除内部水分必须破坏细胞结构。图1、2中显示污泥上清液中含有大量蛋白质、多糖等物质,EPS的稳定状态及细胞结构得到破坏,重新聚集,内部结合水流出,转化为自由水,从而有利于污泥脱水。
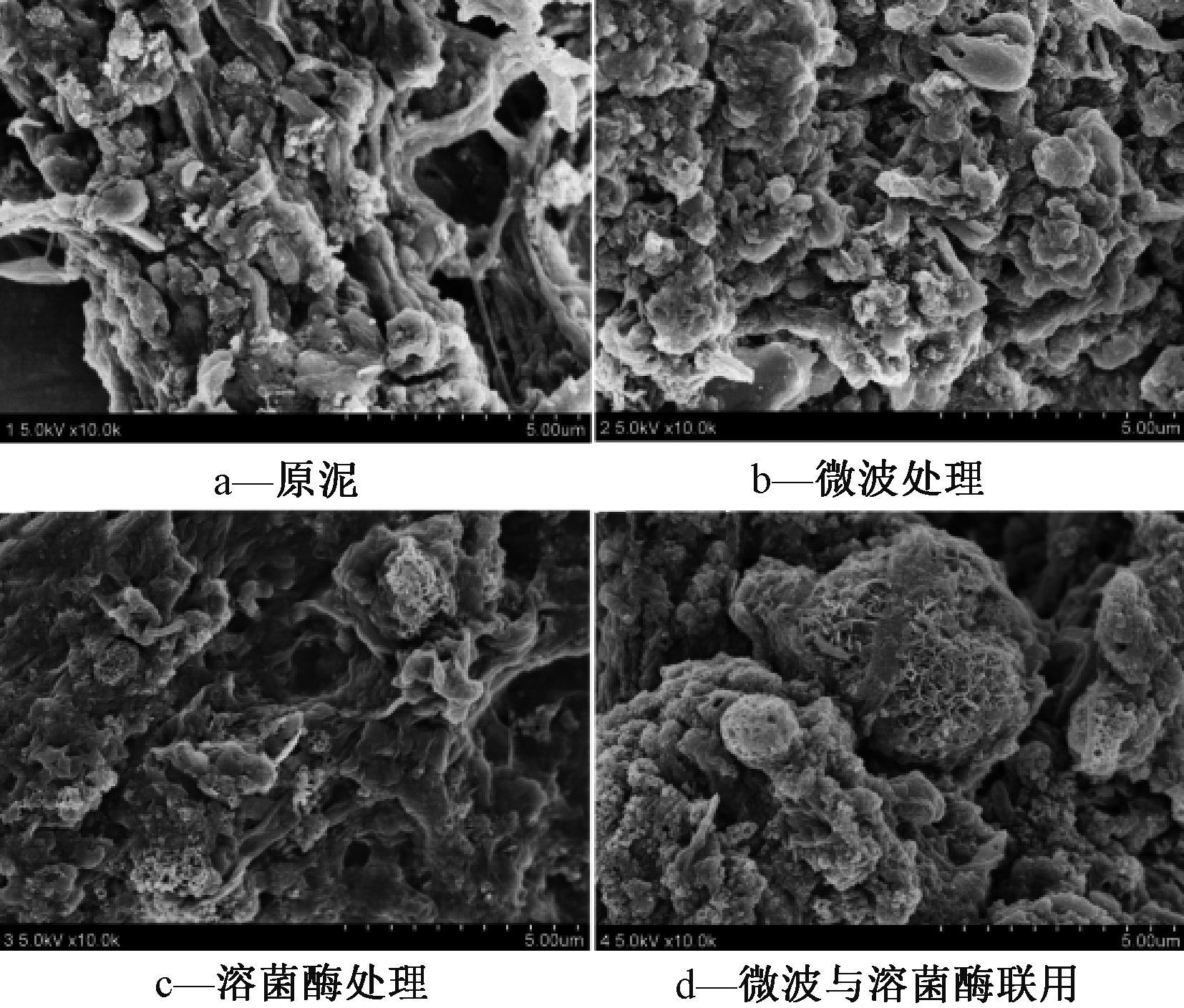
图3 印染污泥微波、溶菌酶、微波+溶菌酶联用处理前后SEM
Figure 3 SEM images of printing and dyeing sludge pretreated by microwave, lysozyme, microwave and lysozyme
![]() —原印染污泥;
—原印染污泥; ![]() —微波预处理;
—微波预处理; ![]() —酶预处理;
—酶预处理; ![]() —微波+酶联合处理。
—微波+酶联合处理。
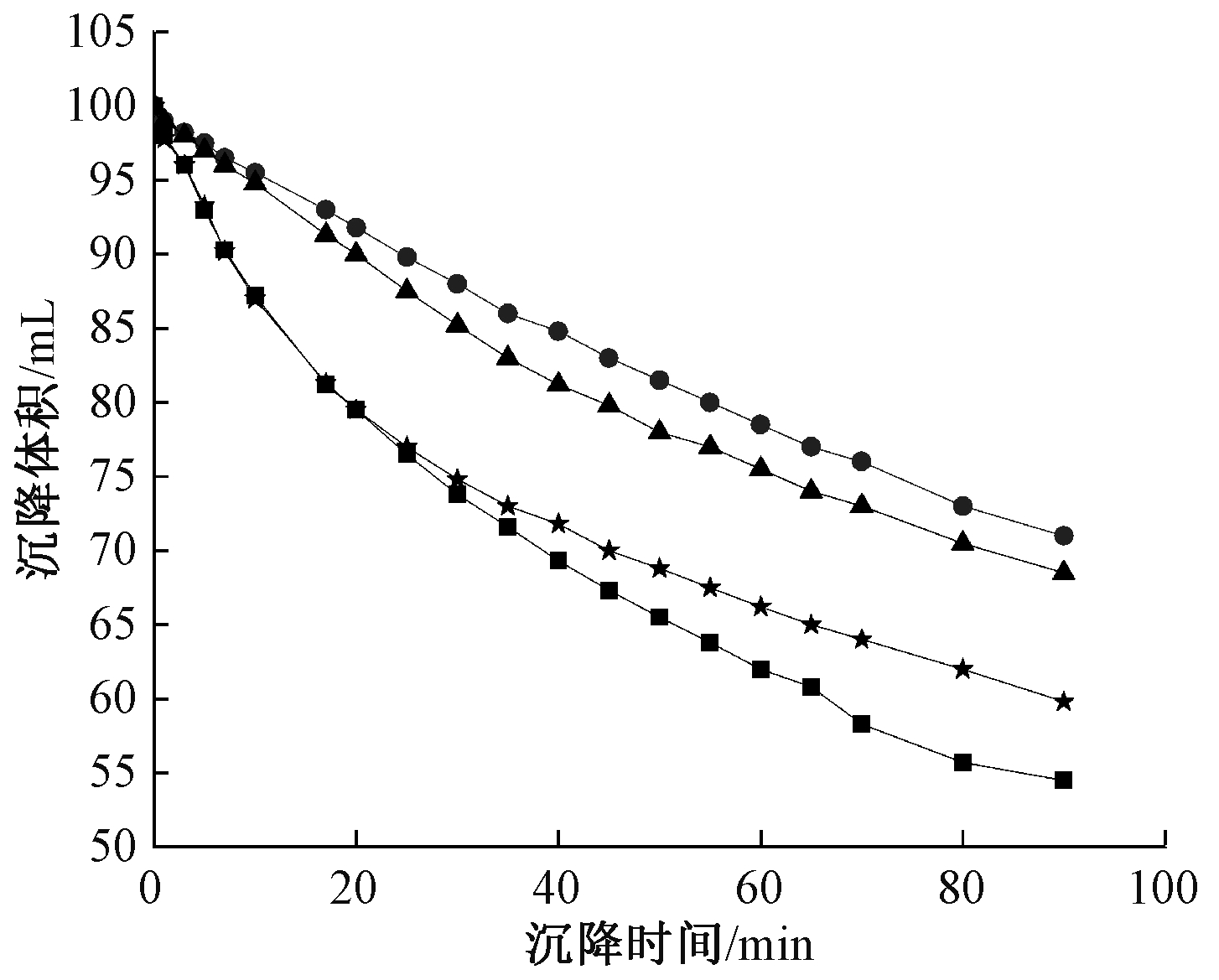
图4 预处理前后污泥沉降曲线
Figure 4 Sludge sedimentation curves before and after pretreatment
![]() CST值预处理方式;
CST值预处理方式; ![]() —CST降低率。
—CST降低率。
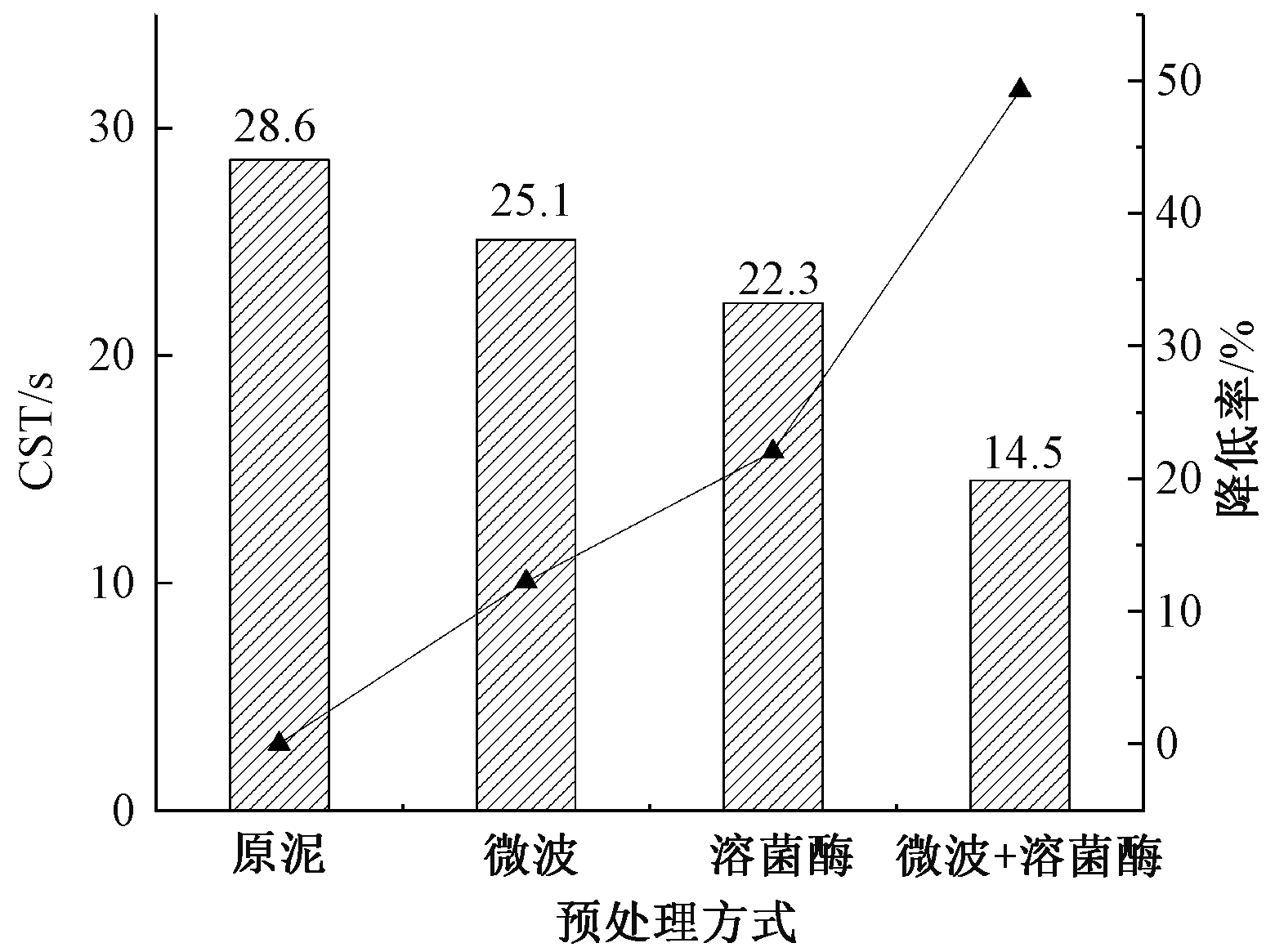
图5 预处理前后污泥的CST及变化率
Figure 5 CST and changing rates of sludge before and after pretreatment
图4、5分别为预处理前后印染污泥的沉降性和CST的变化。CST是评价污泥脱水性能的重要指标之一,经过微波处理、溶菌酶处理、溶菌酶和微波联合预处理后,污泥的CST降低率分别为12.2%、22.0%、49.30%,微波和溶菌酶联合处理后脱水性能优于二者单独处理。污泥的沉降性能变化趋势与CST相一致,联合预处理后污泥的沉降性能最佳,说明经过联合预处理后,蛋白质和SCOD等物质大量溶出,促进颗粒内部结合水释放,转化为自由水,从而有效改善污泥的脱水性能。
3 结 论
1)由污泥处理前后的污泥絮体和三维荧光变化可知:通过正交试验优化微波和溶菌酶联用处理印染污泥,在微波功率为400 W,微波时间为150 s,酶解温度为40 ℃,加酶量为0.09 mg/g(TSS),酶解时间为3 h条件下,污泥的破解和有机物溶出量达到最大。
2)污泥分别经过微波、溶菌酶和二者联用预处理后,对污泥絮体结构破坏都有一定的促进作用,且联合预处理比单独处理更具有优势。
3)污泥经过微波和溶菌酶联合预处理后,污泥表面双电层结构遭到破坏,污泥颗粒脱稳、污泥絮体破坏重新组成稳定的网状结构,便于胞内结合水转化为自由水释放,提高污泥脱水性能。
[1] LIU J J C. Control aniline pollutants from printing and dyeing industries[J]. China Environ. News, 2015(17): 55-56.
[2] QI Y, THAPA K B, HOADLEY A F A. Application of filtration aids for improving sludge dewatering properties: a review[J]. Chemical Engineering Journal, 2011, 171(2):373-384.
[3] SARAYU K, SANDHYA S. Current technologies for biological treatment of textile wastewater: a review[J]. Applied Biochemistry and Biotechnology, 2012, 167(3):645-661.
[4] RAJAGOPAL R, DANIEL I M, SINGH G. A critical review on inhibition of anaerobic digestion process by excess ammonia[J]. Bioresource Technology, 2013, 143(17):632-641.
[5] CHEN Y G, YANG H Z, GU G W. Effect of acid and surfactant treatment on activated sludge dewatering and settling[J]. Water Research, 2001, 35(11):2615-2620.
[6] TONY M A, ZHAO Y Q, FU J F, et al. Conditioning of aluminium-based water treatment sludge with Fenton’s reagent: effectiveness and optimising study to improve dewaterability[J]. Chemosphere, 2008, 72(4):673-677.
[7] AHMADUN F R, MOLLA A H. Enhancement of bioseparation and dewaterability of domestic wastewater sludge by fungal treated dewatered sludge[J]. Journal of Hazardous Materials, 2007, 147(1/2):350-356.
[8] FENG X, DENG J C, LEI H Y, et al. Dewaterability of waste activated sludge with ultrasound conditioning[J]. Bioresource Technology, 2009, 100(3):1074-1081.
[9] ZHU Y P, LIU H B, FU B, et al. Effect of synergistically adding protease and EDTA-2Na on waste activated sludge hydrolysis[J]. Chinese Journal of Environmental Engineering, 2013, 7(8):3158-3164.
[10] PEI H Y, HU W R, LIU Q H. Effect of protease and cellulase on the characteristic of activated sludge[J]. Journal of Hazardous Materials, 2010, 178(1/2/3):397-403.
[11] BONILLA S, TRAN H, ALLEN D G. Enhancing pulp and paper mill biosludge dewaterability using enzymes[J]. Water Research, 2015, 68:692-700.
[12] WANG Y W, WEI Y S, LIU J X. Effect of H2O2 dosing strategy on sludge pretreatment by microwave-H2O2 advanced oxidation process[J]. Journal of Hazardous Materials, 2009, 169(1/2/3):680-684.
[13] WANG Y W, XIAO Q C, LIU J B, et al. Pilot-scale study of sludge pretreatment by microwave and sludge reduction based on lysis-cryptic growth[J]. Bioresource Technology, 2015, 190:140-147.
[14] MEHDIZADEH S N, ESKICIOGLU C, BOBOWSKI J, et al. Conductive heating and microwave hydrolysis under identical heating profiles for advanced anaerobic digestion of municipal sludge[J]. Water Research, 2013, 47(14):5040-5051.
[15] WALTER W G. Standard methods for the examination of water and wastewater (11th ed.)[J]. American Journal of Public Health and the Nations Health, 1961, 51(6):940.
[16] 路苹, 于同泉, 王淑英, 等. 蛋白质测定方法评价[J]. 北京农学院学报, 2006, 21(2):65-69.
[17] 钟方晓, 任海华, 李岩. 多糖含量测定方法比较[J]. 时珍国医国药, 2007, 18(8): 126-127.
[18] 王黎明, 夏文水. 蒽酮-硫酸法测定茶多糖含量的研究[J]. 食品科学, 2005, 26(7):185-188.
[19] ZHANG T, WANG Q, KHAN J, et al. Free nitrous acid breaks down extracellular polymeric substances in waste activated sludge[J]. RSC Advances, 2015, 54(5):43312-43318.