0 引 言
近年来全球甲醇生产力迅速提高,到2016年底总量已超过1亿t。中国的甲醇生产力约为7000万t/a,其中煤制甲醇占70%[1]。煤制甲醇生产是1个能源和水密集型行业,其废水排放总量在2014年为46.2万t/a,到2015年达到80万t/a,造成了相当大的环保压力[2, 3]。此外,煤制甲醇循环水系统经常遭受介质泄漏污染。泄漏会造成循环冷却水中COD增高,不仅恶化水质、降低换热器效率[4, 5],更会加剧杂菌等生物污垢(biofouling)快速生长,严重时还会造成生物污垢黏附堵塞循环水回路管道和形成微生物腐蚀(MIC)等[6-8],增加了系统运行维护费用,威胁系统运行安全[9]。
污垢的分析方法主要有电镜分析和光谱分析。Blanpain-Avet等[10]采用拉曼光谱(micro raman spectroscopy,MRS)分析板式换热器热壁上的乳清蛋白污垢。张一江等[11]分别用红外光谱(fourier-transform infrared,FTIR)、扫描电镜(scanning electron microscopy,SEM)和X射线衍射光谱研究了碳酸钙垢的晶型,发现L-半胱氨酸改性聚环氧琥珀酸(LCY-PESA)对钙垢有晶格扭曲作用,将方解石变为球霰石。Germ n等[12]研究序批式膜生物反应器中膜的生物沉积机制,采用激光扫描共聚焦显微镜(confocal laser scanning microscopy,CLSM)发现聚偏二氟乙烯膜表面和内部均匀沉积着多糖和蛋白质,并采用扫描电镜(SEM)和透射电镜(transmission electron microscopy,TEM)分析了膜表面微生物。
n等[12]研究序批式膜生物反应器中膜的生物沉积机制,采用激光扫描共聚焦显微镜(confocal laser scanning microscopy,CLSM)发现聚偏二氟乙烯膜表面和内部均匀沉积着多糖和蛋白质,并采用扫描电镜(SEM)和透射电镜(transmission electron microscopy,TEM)分析了膜表面微生物。
笔者从宁夏银川某煤制甲醇厂循环冷却水系统中收集到甲醇轻微泄漏后的水样,其呈泡沫状,肉眼可见有微小块状污垢,通过显微镜观察、扫描电镜和化学显色法进行分析,从中分离出1株疑为生物污垢生成的优势菌进行了生物学分析。本研究试图寻找甲醇厂循环水系统中生物污垢产生的原因,并为从生物角度降低和控制其生物污垢提供实验和理论依据。
1 实验部分
1.1 实验材料
污垢取自宁夏银川某煤制甲醇厂循环冷却水系统格栅处,为微小块状物质。
甲醇降解菌取自重庆大学城市建设与环境工程实验室,为假单胞菌属(Pesudomonas sp.)菌株。
1.2 培养基
单一碳源培养基(液体):酵母浸粉10.0 g,蛋白胨7.5 g,磷酸二氢钠7.5 g,柠檬酸0.5 g,蒸馏水1000 mL,pH为6.0,1×105 Pa灭菌20 min,20 mL经过灭菌的甲醇。固体培养基则加入琼脂粉20 g。
富集培养基:牛肉膏3.0 g,蛋白胨10.0 g,氯化钠 5.0 g,蒸馏水1000 mL, pH 7.0,用于甲醇降解菌的活化。
1.3 污垢的观察与鉴定方法
首先将取得的污垢放到光学显微镜下进行观察。然后将污垢在0.1 mol/L NaOH溶液中煮沸30 min,用超纯水漂洗至中性,105 ℃下进行干燥。利用SEM[13]观察污垢干燥产物的微结构。将污垢浸泡于2.5% 戊二醛溶液4 h后,然后用磷酸盐溶液清洗3次;再依次加入50%、70%、80%、90%、100%乙醇(2次)对产物进行10 min脱水。将干燥产物涂于玻璃片上冷冻干燥后喷金,用SEM观察其形态。
采用蒽酮显色法[14]对污垢主要成分进行分析。取干燥产物0.1 g于25 mL容量瓶中,加入15 mL 60%硫酸,冰浴消化2 h;用60%硫酸定容并用漏斗过滤,得到消化液。取5 mL消化液于试管中,加入0.5 mL 2%蒽酮试剂并摇匀,加入5 mL浓硫酸,观察颜色变化。
1.4 污垢产生菌的分离方法
将污垢物质接种到单一碳源培养基(液体)中,轻微振荡,在28 ℃条件下恒温静置培养1周。将发酵液表面的凝胶膜贴到单一碳源培养基(固体)上,28 ℃培养2~3 d,重复以上步骤直至平皿上菌落分布清晰(菌落数为30~50个)。挑取形态清晰的单菌落,采用平板划线法进行纯化,重复3次以上菌落形态一致,即认为是单菌落。
挑取单菌落富集培养24 h后接种到单一碳源培养基(液体)中,混匀后在28 ℃条件下恒温静置培养7 d。挑取培养基表面产生的薄膜,用蒸馏水清洗干净,在0.1 mol/L NaOH溶液中煮沸20 min,观察薄膜是否完全溶解。
1.5 菌株的鉴定方法
对菌株16S rDNA进行鉴定。挑取至少3次划线纯化的单菌落,洗脱至30 μL无菌超纯水种作为模板,采用通用引物27F(5′-AGAGTTTGATCCTGCCT CAG-3′)和1492R(5′-TACGGCTACCTTGTTACGAC TT-3′)对菌株的16S rDNA进行扩增。PCR反应体系共50 μL,组成为:无菌水17 μL、2×Taq Master Mix 25 μL、引物27F和1492R各2 μL、模板4 μL。扩增程序为:95 ℃ 5 min;94 ℃ 50 s,56 ℃ 45 s,72 ℃ 1 min 30 s,35个循环;72 ℃ 10 min;15 ℃ 5 min。PCR扩增产物的纯化和测序由南京金斯瑞生物科技有限公司完成。将得到的序列提交到GenBank中,与GenBank核酸序列数据库中已有的相关序列进行比较,并用MEGA 5.1软件构建系统发育树。同时利用BIOLOG微生物自动分析系统,通过菌株对GEN-Ⅲ板上95种碳源的利用情况进行鉴定,在GEN-Ⅲ板中培养24 h后在读数仪上读取结果。
1.6 细菌纤维素的测定方法
细菌纤维素的测定采用称重法[15]。膜取出后,用蒸馏水冲洗以去除膜表面培养基及杂质;再将膜浸泡于0.1 mol/L的NaOH溶液,100 ℃煮沸20 min,去除液膜中的菌体和残留培养基,然后用蒸馏水多次冲洗至pH值约为7.2。80 ℃干燥至恒重并进行称重。
1.7 菌株产纤维素影响因素实验方法
试验分别在pH为4.0~9.0(梯度为1.0)、甲醇含量5~50 mL/L(梯度为5)的条件下,将菌株B3以6%(体积分数)接种量接入单一碳源培养基(液体)中,28 ℃、180 r/min培养8 d后测纤维素产量。然后在甲醇浓度为20 mL/L的单一碳源培养基(液体)中(pH为6.0),以接种菌株B3为对照组,接种甲醇降解菌为实验组,测定培养10 d内对照组和实验组的纤维素产量。
2 结果与讨论
2.1 污垢的鉴定
污垢的光学显微(×40)观察结果见图1。可知:该污垢中除固体物质外,还存在大量细菌,表明该污垢可能由细菌产生。

图1 污垢的光学显微观察(×40)
Figure 1 Results of fouling optical microscopic observation(×40)
在扫描电镜(×30000)下观察经碱处理并洗涤干净后的干燥产物,如图2所示。产物中无菌体残留,但留有杂质,物质中微纤维相互缠绕呈致密的空间网状结构附着在杂质上,纤维丝的直径为30~70 nm,与细菌纤维素的结构特征高度相似[16]。
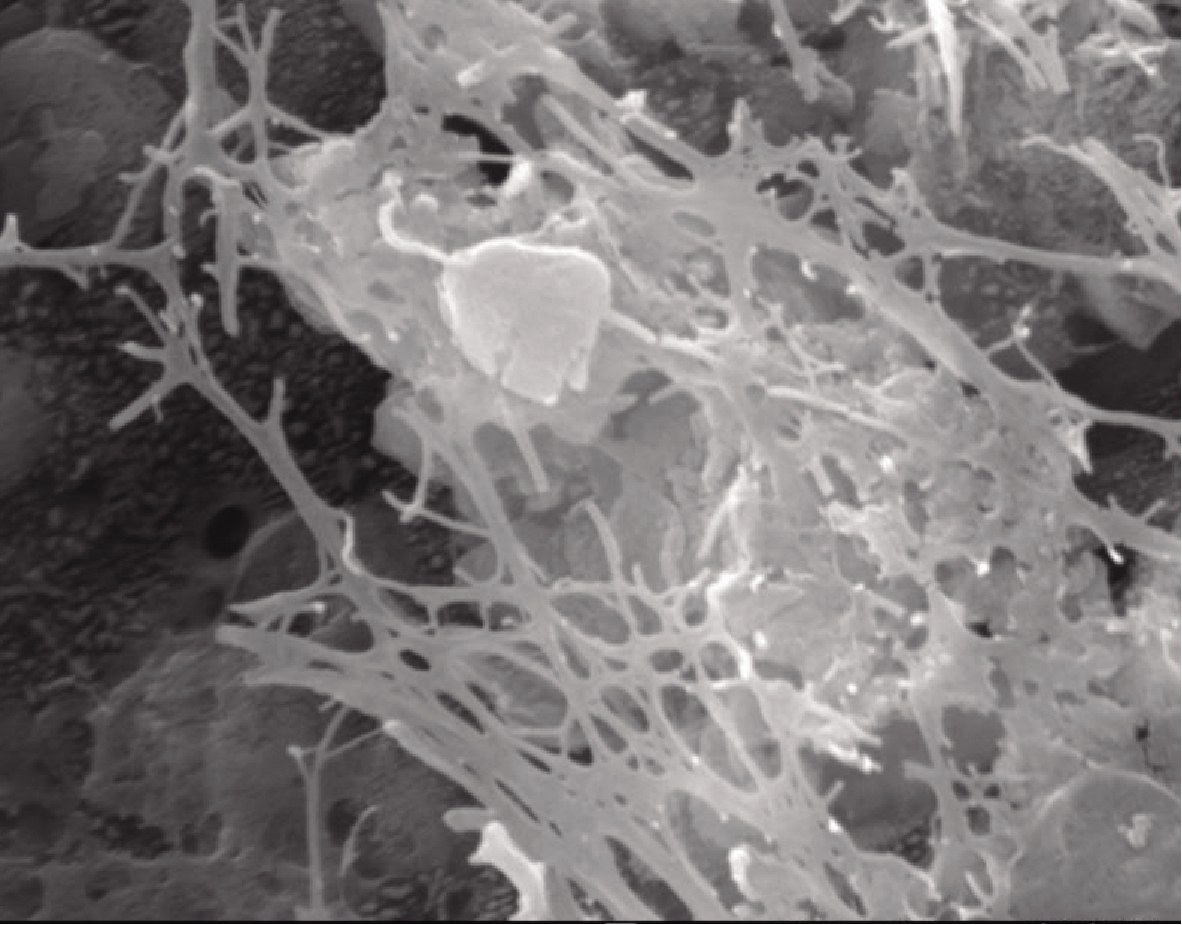
图2 污垢的电镜观察(×30000)
Figure 2 Results of fouling electron microscopic observation(×30000)
取污垢物质在0.1 mol/L NaOH溶液中煮沸20 min后,用蒸馏水冲洗干净并在80 ℃条件下进行干燥。取其干燥产物经蒽酮显色法处理后呈蓝绿色(图3),且浓度越高颜色越深,证明该物质为纤维素[14]。

注:左侧:原样;右测:稀释5倍。
图3 蒽酮显色实验结果
Figure 3 Results of the anthrone colorimetric method
2.2 细菌鉴定及碳源利用分析
2.2.1 16S rDNA序列分析
从污垢物质发酵产生的凝胶膜中分离得到1株优势菌,命名为B3。以菌株B3的基因组DNA为模板,以27F和1496R为引物进行PCR扩增,凝胶电泳成像后进行测序,其16S rDNA的序列与GenBank中已有的多株Gluconacetobacter xylinus菌株相似性都为99%,并在16S rDNA基因序列同源性的基础上用邻接法(neighbor-joining method,NJ)构建系统发育树如图4所示。

图4 菌株B3和相关属菌种的的系统发育树
Figure 4 Phylogenetic tree of B3 and the related bacterial species
2.2.2 BIOLOG碳源利用分析
菌株B3对95种碳源利用情况见表1。将该结果与Biolog数据库中数据进行匹配,与Gluconacetobacter xylinus的匹配度最高;且SIM值为0.509>0.5,表明该结果是可靠的。
由表1可知:菌株B3对糖类和氨基酸类利用广泛,可利用糊精、D-麦芽糖、蔗糖、果胶等多种糖类,而不能利用果糖(D-果糖和L-果糖)和D-半乳糖;可利用氨基乙酰-L-脯氨酸、L-丙氨酸、L-精氨酸、L-谷氨酸等多种氨基酸,则无法利用D-丝氨酸和L-丝氨酸;可利用D-葡糖酸、L-乳酸、柠檬酸、甲酸等常见羧酸,可在8% NaCl溶液中生存,具有高耐盐能力。
表1 菌株B3对BIOLOG-GEN Ⅲ板中95种不同碳源的利用情况
Table 1 The utilization of the 95 different carbon sources in BIOLOG-GEN Ⅲ plate by B3

碳源结果碳源结果碳源结果碳源结果碳源结果碳源结果阴性对照(+)糊精+水苏糖(+)阳性对照+pH 6+pH 5(+)蔗糖+D-松二糖(+)D-蜜二糖+β-甲酰-D-葡糖苷+D-水杨苷+N-乙酰-D-葡糖胺+D-棉子糖-α-D-乳糖-N-乙酰-D-半乳糖胺-1% NaCl+4% NaCl+8% NaCl+N-乙酰-β-D-甘露糖胺(+) D-果糖(+)N-乙酰神经氨酸-D-半乳糖-3-甲酰葡糖-D-果糖-α-D-葡糖+D-甘露醇+次黄苷/肌苷-1% 乳酸钠+梭链孢酸-D-丝氨酸-L-果糖-L-鼠李糖-D-阿拉伯糖醇-肌醇+甘油/丙三醇+D-葡糖-6-磷酸(+)D-山梨醇+D-天冬氨酸-氨基乙酰-L-脯氨酸+醋竹桃霉素-利福霉素SV-二甲胺四环素-D-果糖-6-磷酸(+)L-丙氨酸+D-丝氨酸-L-精氨酸+L-天冬氨酸+L-谷氨酸+明胶-L-焦谷氨酸(+) L-丝氨酸-林肯霉素/洁霉素-盐酸胍+硫酸四癸钠-L-组氨+D-半乳酸醛糖(+)L-半乳糖醛酸内酯- D-葡糖酸+D-葡糖醛酸(+)葡糖醛酰胺-果胶+奎宁酸-糖质酸(+)万古霉素-四唑紫(+)四唑蓝-黏酸/黏液酸(+)丙酮酸甲酯(+)D-乳酸甲酯-L-乳酸+柠檬酸+α-酮-戊二酸(+)p-羟基-苯乙酸(+)L-苹果酸+溴-丁二酸+吡啶羧酸-氯化锂+亚碲酸钾+D-苹果酸-γ-氨基-丁酸(+)α-羟基-丁酸-β-羟基-D,L丁酸(+)α-酮-丁酸-乙酰乙酸(+)吐温 40-乙酸(+)甲酸+氨曲南-丁酸钠-溴酸钠(+)丙酸-D-麦芽糖+D-海藻糖+D-纤维二糖+龙胆二糖+
注:阳性,+;边界值,(+);阴性,-。
2.3 菌株产纤维素影响因素分析
2.3.1 pH对菌株B3产纤维素的影响
在单一碳源培养基(液体)体系中进行了pH值对纤维素产量的影响实验,结果如图5所示。可知:pH值对菌株B3产纤维素的影响较大,其最适pH值为5.0,纤维素产量达到0.20 g/L。pH值提高至7以上时,纤维素产量快速降低;当pH值>8时,纤维素产量降低至0.09 g/L,低于最大值的50%。这与一些研究中细菌纤维素的合成受pH值影响较大的结果[17, 18]相一致。
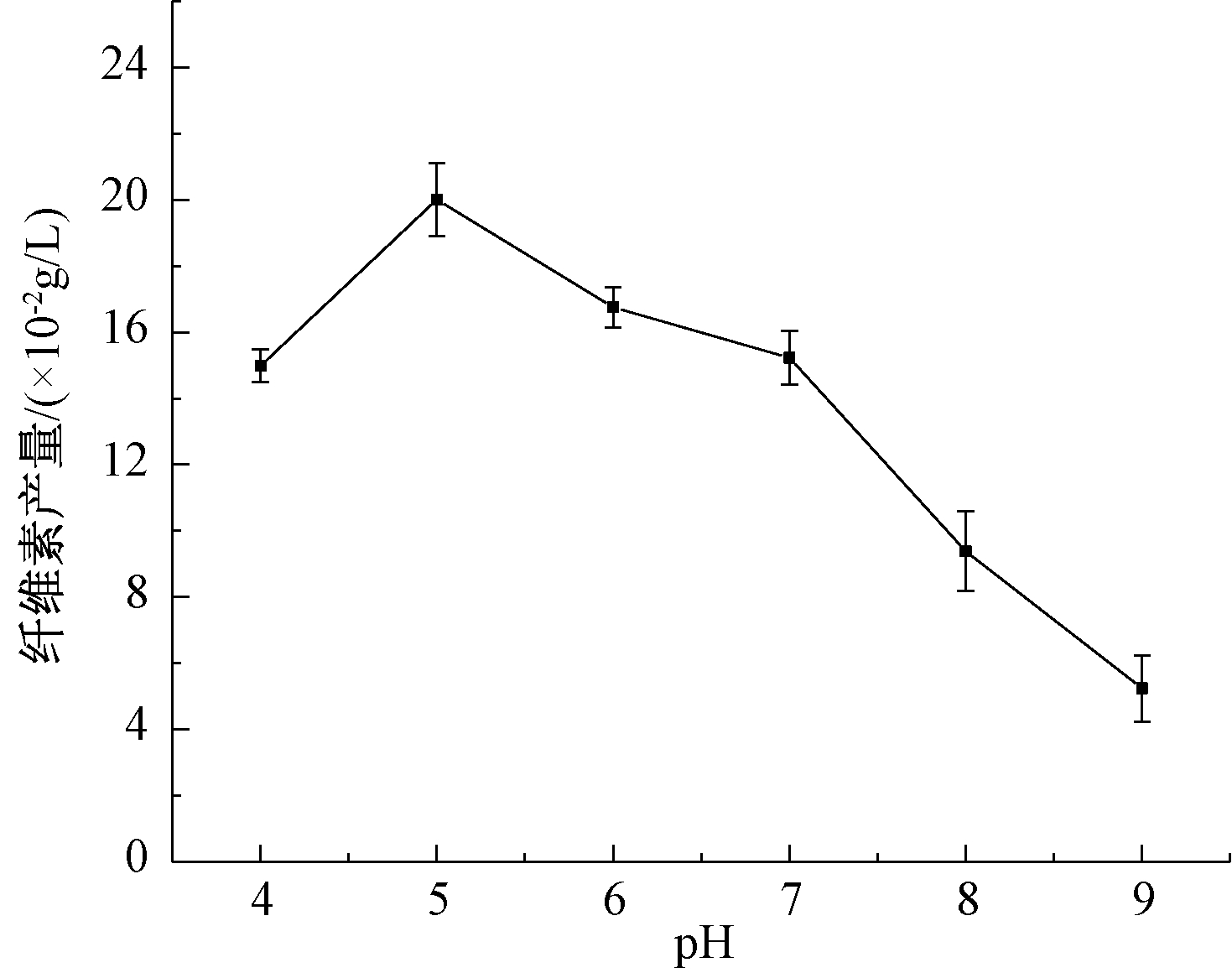
图5 pH值对纤维素产量的影响
Figure 5 Effect of pH on cellulose production
2.3.2 甲醇浓度对菌株B3产纤维素的影响
甲醇浓度对菌株产纤维素能力的影响实验结果如图6所示。可知:甲醇浓度对菌株B3产纤维素能力有较大影响,当浓度为15~25 mL/L时纤维素产量较高,而浓度<15 mL/L或>25 mL/L,菌株产纤维素能力急速下降,且浓度>50 mL/L时菌株B3几乎失去了产纤维素的能力,表明此浓度为该菌株对甲醇的耐受浓度。结果表明,甲醇作为碳源可促进细菌的生长和繁殖[19],但其浓度过高具有抑制作用[20]。
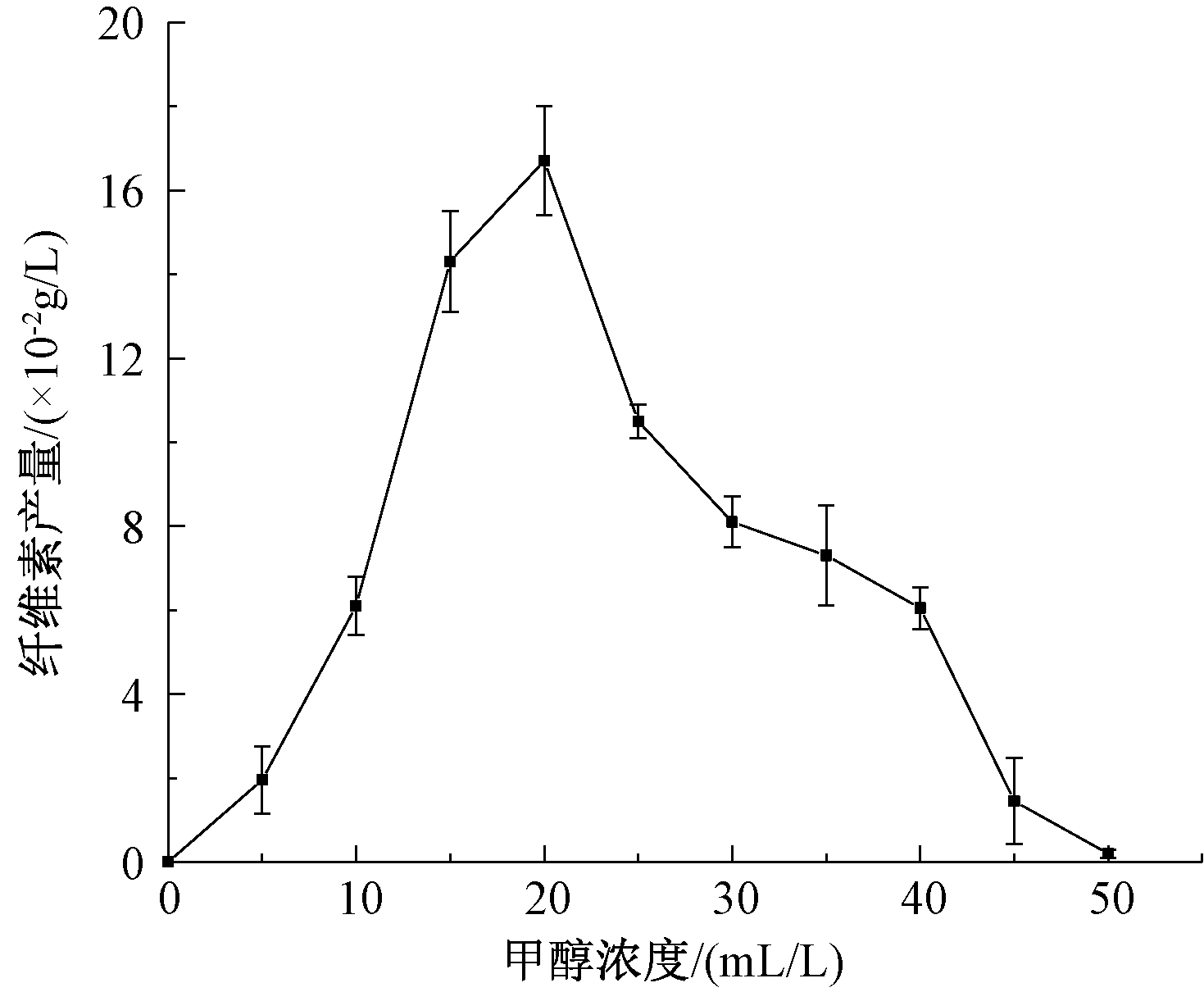
图6 甲醇浓度对纤维素产量的影响
Figure 6 Effect of methanol concentration on cellulose production
2.3.3 甲醇降解菌对菌株B3产纤维素的影响
将菌株B3以6%的接种量接种于甲醇浓度为20 mL/L的单一碳源液体培养基(pH为6.0)中作为对照组,实验组另接种体积分数6%的甲醇降解菌,测定培养10 d内对照组和实验组的纤维素产量,结果见图7。可知:对照组菌株B3产纤维素在培养8 d后到达稳定期,纤维素产量为0.198 g/L。而实验组中与其他的甲醇降解菌共同培养后,由于对甲醇碳源的竞争作用,菌株B3产纤维素的能力受到抑制,纤维素产量降低至0.123 g/L,降低了37.9%,这表明通过微生物对营养的竞争作用来抑制菌株产纤维素的能力具有极大的可行性。
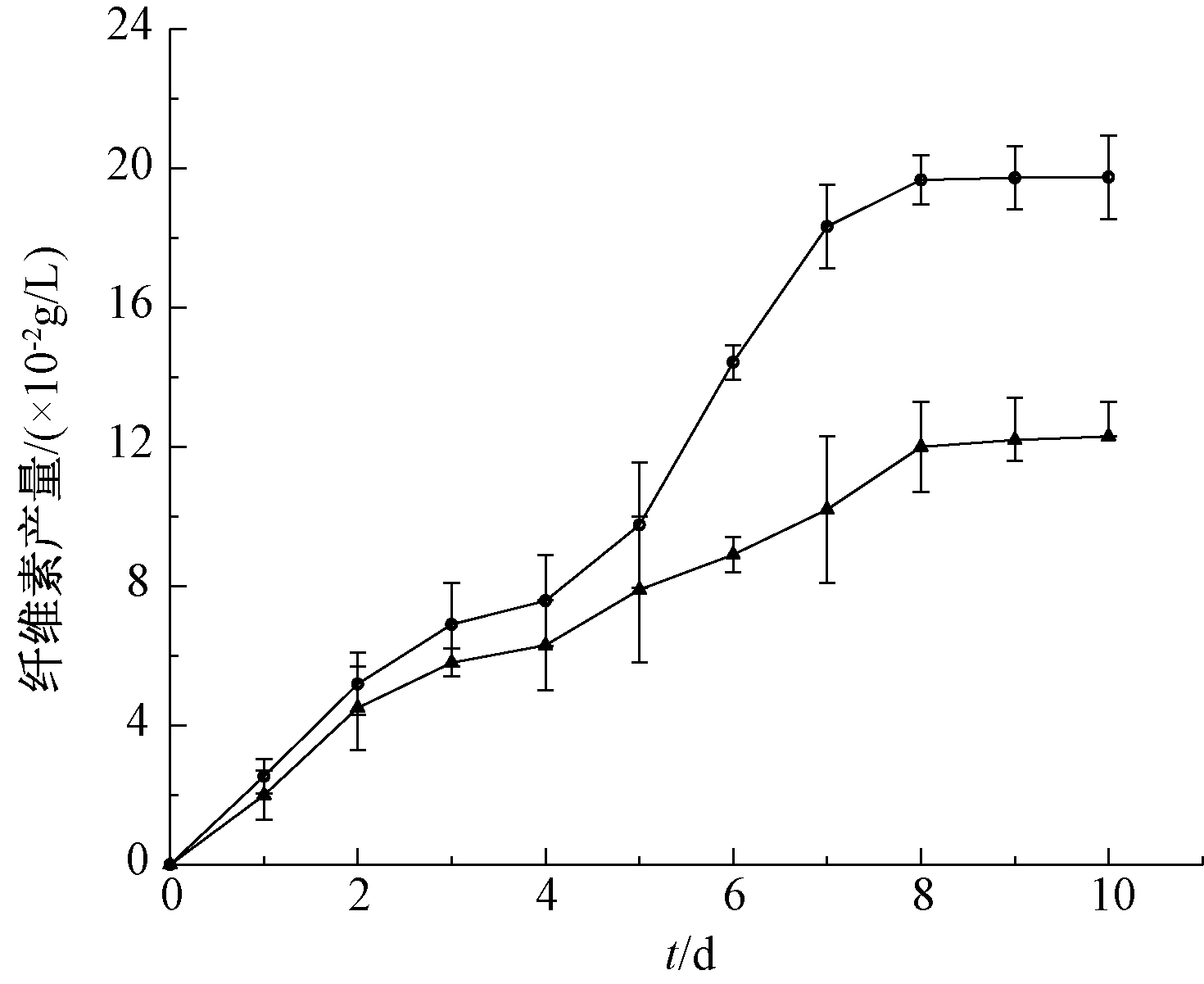
![]() —对照组;
—对照组; ![]() —实验组。
—实验组。
图7 甲醇降解菌对菌株B3产纤维素的影响
Figure 7 Effect of methanol-degrading bacteria on cellulose production
3 结 论
通过对甲醇厂循环水系统中生物污垢的检测分析得出如下结论:
1)泄漏后的甲醇生产厂的泡沫和块状物质增多,其块状物经观察和鉴定主要为细菌向外分泌的细菌纤维素,经分离优势菌株为木葡糖酸醋杆菌(G. xylinus)。
2)pH值和甲醇浓度均对木葡糖酸醋杆菌(G. xylinus)的产纤维素能力有较大影响,但实际运行中的循环水系统甲醇浓度通常较适合该菌产生纤维素,因此很难控制系统中细菌纤维素污垢的出现,一旦系统泄漏很容易造成循环水系统泡沫和堵塞。
3)当木葡糖酸醋杆菌(G. xylinus)与其他甲醇降解菌共同培养时,由于种群间对碳源甲醇的竞争作用,该菌的产纤维素能力明显受抑制,纤维素产量迅速降低,表明采用生物竞争排除法来控制煤制甲醇循环水冷却水系统的细菌型纤维素污垢具有可行性。
[1] 薛金召,汪希领,王先锋,等.我国甲醇新兴应用领域前景分析[J].化工进展,2016, 35(增刊1):144-151.
[2] 王中银.我国现代煤化工市场现状与预测[J].煤炭加工与综合利用, 2015(6):8-10.
[3] WEN Z G, MENG F X, DI J H, et al. Technological approaches and policy analysis of integrated water pollution prevention and control for the coal-to-methanol industry based on best available technology[J]. Journal of Cleaner Production, 2016, 113: 231-240.
[4] ZHONG H Y, LIU F, LU J J, et al. Effect of diesel leakage in circulating cooling water system on preponderant bacteria diversity and bactericidal effect of biocides[J]. Environmental Technology, 2015, 36(9): 1147-1159.
[5] 王惠,姚光源,王宁,等.城市中水回用于冷却水生物黏泥滋生影响因素研究[J].工业水处理, 2018, 38(2):79-81,84.
[6] LIU W S, CHIEN S H, DZOMBAK D A, et al. Scaling control for heat exchangers in recirculating cooling systems using treated municipal wastewater[J]. Industrial & Engineering Chemistry Research, 2014, 53(42): 16366-16373.
[![]() Z N, MINNOS B, ILHAN-SUNGUR E, et al. Biofilm formation on copper and galvanized steel surfaces in a cooling-water system[J]. IUFS J Biol, 2009, 68(2): 105-111.
Z N, MINNOS B, ILHAN-SUNGUR E, et al. Biofilm formation on copper and galvanized steel surfaces in a cooling-water system[J]. IUFS J Biol, 2009, 68(2): 105-111.
[8] RAO T S, KORA A J, CHANDRAMOHAN P, et al. Biofouling and microbial corrosion problem in the thermo-fluid heat exchanger and cooling water system of a nuclear test reactor[J]. Biofouling, 2009, 25(7): 581-591.
[9] DATIR S K, KAKADE C R, PRASAD N, et al. Microbial corrosion of a process water cooling system in a nuclear power generating unit[J]. Innovations in Corrosion & Materials Science, 2015, 5(1): 53-61.
[10] BLANPAIN-AVET P, HÉDOUX A, GUINET Y, et al. Analysis by Raman spectroscopy of the conformational structure of whey proteins constituting fouling deposits during the processing in a heat exchanger[J]. Journal of Food Engineering, 2012, 110(1): 86-94.
[11] 张一江,柳江华,陈智慧,等. L-半胱氨酸改性聚环氧琥珀酸的合成及其阻垢缓蚀性能[J]. 化工学报, 2016, 67(10): 4344-4355.
[12] GERM N B, IV
N B, IV N M A, V
N M A, V CTOR A B, et al. Membrane biofouling mechanism in an aerobic granular reactor degrading 4-chlorophenol[J]. Water Science & Technology, 2014, 6(8):1759-1767.
CTOR A B, et al. Membrane biofouling mechanism in an aerobic granular reactor degrading 4-chlorophenol[J]. Water Science & Technology, 2014, 6(8):1759-1767.
[13] YANG Y, JIA J J, XING J R, et al. Isolation and characteristics analysis of a novel high bacterial cellulose producing strain Gluconacetobacter intermedius CIs26[J]. Carbohydrate Polymers, 2013, 92(2): 2012-2017.
[14] 李合生.植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[15] 马霞,王瑞明,关凤梅,等.细菌纤维素生产菌株的分离和菌种初步鉴定[J].工业微生物,2005,35(3):23-26.
[16] HUANG Y, ZHU C L, YANG J Z, et al. Recent advances in bacterial cellulose[J]. Cellulose, 2014, 21(1): 1-30.
[17] KUO C H, CHEN J H, LIOU B K, et al. Utilization of acetate buffer to improve bacterial cellulose production by Gluconacetobacter xylinus[J]. Food Hydrocolloids, 2016, 53: 98-103.
[18] YAN H Q, CHEN X Q, SONG H W, et al. Synthesis of bacterial cellulose and bacterial cellulose nanocrystals for their applications in the stabilization of olive oil pickering emulsion[J]. Food Hydrocolloids, 2017, 72: 127-135.
[19] CAO G, ZHANG Y B, CHEN L, et al. Production of a bioflocculant from methanol wastewater and its application in arsenite removal[J]. Chemosphere, 2015, 141: 274-281.
[20] 陈银川. 甲醇废水发酵产细菌纤维素及其膜应用研究[D]. 上海:东华大学, 2014.