0 引 言
氮素是造成水体污染的主要原因之一,受人类活动影响,全球出现不同程度水体氮污染问题,如何有效去除水体中含氮物质成为国内外水处理领域学者关注的热点和难点[1,2]。生物脱氮法以其安全、高效、经济等特点被视为最具发展前景的污水脱氮有效方法[3,4]。传统生物脱氮途径和工艺要经好氧硝化和缺/厌氧反硝化2个相对独立过程,硝化菌和反硝化菌生长环境不同,导致硝化和反硝化过程不能同时进行,使脱氮效果和处理成本存在诸多缺点和不足。近年来,很多学者开始广为关注具有异养硝化-好氧反硝化功能的细菌[5],这类细菌具有同步硝化和反硝化的特性为生物脱氮提供了新途径。
目前,国内外研究人员已在土壤[6]、污泥[7-9]、污废水[10-12]、养殖废水[13]、海水及沉积物[14,15]、水库沉积物[16]、垃圾渗滤液[17,18]等样品中发现和筛选出多种异养硝化-好氧反硝化菌,并对其脱氮性能和影响因素进行较全面研究,而关于含水层介质样品中异养硝化-好氧反硝化菌分离和脱氮性能研究还鲜有报道。浅层地下水与地表水、包气带发生直接联系,极易受含氮污染物影响。已有研究发现,长三角地区多地浅层地下水存在不同程度的“三氮”污染问题[19-21],浅层地下水氮污染防治和环境修复工作变得尤为紧迫。与传统脱氮菌相比,异养硝化-好氧反硝化菌在脱氮方面具有较大优势,这为浅层地下水氮污染修复提供了一种可能路径。
本研究从苏州某受氮污染浅层含水层介质中分离纯化到1株具有异养硝化-好氧反硝化功能的细菌,对该菌株进行形态学观察、生理生化特性和基因序列分析,并评估其异养硝化、好氧反硝化脱氮性能,考察不同环境因素条件对脱氮性能影响,以期为异养硝化-好氧反硝化菌在污水处理和浅层地下水修复工程中的实际应用提供新菌源。
1 实验部分
1.1 材 料
菌株分离自苏州市某受氮污染浅层含水层原状未扰动介质,样品采自地表以下2.5 m左右淤泥质粉质黏土含水层,呈青灰色或灰色,具流塑性,富含腐殖质和云母片。样品现场采集后用无菌采样管密封保存,放入低温冷藏箱运回实验室做后续处理。
1.2 培养基
反硝化富集培养基(g/L):KNO3,2.0;柠檬酸三钠,5.0;MgSO4·7H2O,0.2;KH2PO4, 1.0;去离子水,1 L;微量元素,2 mL;pH值调为7.0~7.5。
微量元素溶液(g/L):EDTA·2Na,57.1;ZnSO4·7H2O,3.9; CaCl2·2H2O,7.0;MnCl2·4H2O,5.1;FeSO4·7H2O,5.0;(NH4)6Mo7O24·4H2O,1.1;CuSO4·5H2O,1.6;CoCl2·6H2O,1.6。pH=7.0。
反硝化培养基(g/L):KNO3,0.72,其余成分同反硝化富集培养基;反硝化固体培养基则加入2%琼脂。
异养硝化培养基(g/L):NH4Cl,0.38;柠檬酸三钠,3.62;维氏盐溶液,50 mL。
维氏盐溶液(g/L):K2HPO4·3H2O,6.5;MgSO4·7H2O,2.5;NaCl,2.5;FeSO4·7H2O,0.05;MnSO4·H2O,0.04。
1.3 菌株的分离和鉴定
1.3.1 菌株分离和筛选
取10 g新鲜介质样品接种于90 mL灭菌反硝化富集培养基,28 ℃培养3 d;然后取5 mL菌液接种富集3 d,重复操作3次;富集完成后取1 mL菌液稀释涂平板,28 ℃培养3 d后挑取不同形态菌落多次分离纯化,得到62株菌。备选菌株接种于装有5 mL反硝化培养基试管(37 ℃,180 r/min振荡培养3 d),吸取少量菌液,滴加格里斯试剂、二苯胺试剂和奈氏试剂筛选反硝化菌株,记为XK51,并接种至斜面培养基保存备用。
1.3.2 菌株形态和生理生化鉴定
进行优选菌株XK51固体培养基划线培养,长出单菌落后观察其形态,生理生化特性参考《常见细菌系统鉴定手册》[22],项目包括:革兰氏染色、接触酶、氧化酶、甲基红试验、伏-普试验、硝酸盐还原、葡萄糖发酵、蔗糖发酵、明胶液化、纤维素分解,菌落形状、大小、颜色、运动性和需氧性等。
1.3.3 分子生物学鉴定
采用DNA试剂盒提取XK51的16S rDNA并以其为扩增模板,采用细菌通用正向引物(27F)和反向引物(1492R)进行扩增[17],构建50 μL反应体系:模板DNA 1 μL,dNTP(0.2 mmol/L)4 μL,引物(0.5 μmol/L)各2 μL,10×Buffer 5 μL,MgCl2 3 μL,Taq酶(2.5 U/μL)0.25 μL,超纯水32.75 μL。PCR 反应条件:95 ℃预变性5 min,然后进入热循环(94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,共30个循环)。PCR产物经1%琼脂糖凝胶电泳,初检扩增产物,纯化1.5 kb左右片段委托生物公司测序。测序结果提交GenBank,在NCBI里进行Blast比对分析,通过MEGA软件用 NJ法构建系统发育树。
1.4 脱氮性能研究
1.4.1 异养硝化特性分析
菌株接种异养硝化培养基,28 ℃、120 r/min培养1 d后制得种子液,以1%接种量接入培养基,初始氮源![]() mg/L,ρ(DOC)=1000 mg/L,相同条件培养72 h,每隔6~12 h 取样检测
mg/L,ρ(DOC)=1000 mg/L,相同条件培养72 h,每隔6~12 h 取样检测![]() 及OD600。
及OD600。
1.4.2 好氧反硝化特性分析
将1%种子液接种反硝化培养基,好氧培养条件ρ(DO)=6.9~7.8 mg/L,初始氮源![]() 培养60 h,每隔6~12 h取样检测
培养60 h,每隔6~12 h取样检测![]() DOC及OD600;72 h后添加碳源(不新增氮源)至132 h,隔12 h取样检测
DOC及OD600;72 h后添加碳源(不新增氮源)至132 h,隔12 h取样检测![]() 和
和![]()
1.4.3 不同反应条件对脱氮性能影响
研究碳源、氮源底物浓度、温度、pH对菌株异养硝化或好氧反硝化性能影响。碳源包括琥珀酸钠、柠檬酸三钠、苹果酸钠、葡萄糖和蔗糖,C/N=10,ρ(DOC)=1000 mg/L,培养24 h;氮源底物![]() 分别为5,20和100 mg/L,C/N=10,培养72 h;温度分别为10,20,25,30,35和40
分别为5,20和100 mg/L,C/N=10,培养72 h;温度分别为10,20,25,30,35和40 ![]() 碳源为柠檬酸三钠,C/N=10,培养24 h;pH分别为4、5、6、7、8和
碳源为柠檬酸三钠,C/N=10,培养24 h;pH分别为4、5、6、7、8和![]() mg/L,碳源为柠檬酸三钠,C/N为10,28 ℃培养24 h。培养基分装灭菌后120 r/min摇床培养,结束测定
mg/L,碳源为柠檬酸三钠,C/N为10,28 ℃培养24 h。培养基分装灭菌后120 r/min摇床培养,结束测定![]() 或TN。
或TN。
1.5 分析方法
SG6型溶氧仪测定温度(T)、溶解氧(DO),PHPJ-260型pH计测定pH、氧化还原电位![]() 分别采用纳氏试剂光度法、紫外分光光度法、N-(1-萘基)乙二胺光度法、过硫酸钾氧化-分光光度法测定,IL550型TOC分析仪测定DOC,UV2100型分光光度计在波长600 nm处测定吸光度值OD600。氮脱除率η、氮脱除速率R按式(1)—(2)计算[6]:
分别采用纳氏试剂光度法、紫外分光光度法、N-(1-萘基)乙二胺光度法、过硫酸钾氧化-分光光度法测定,IL550型TOC分析仪测定DOC,UV2100型分光光度计在波长600 nm处测定吸光度值OD600。氮脱除率η、氮脱除速率R按式(1)—(2)计算[6]:
η=(C1-C2)/C1×100%(1)
R=(C1-C2)/(t2-t1)×100%(2)
式中:η为氮脱除率,%;R为氮脱除速率,mg/(L·h);C1、C2分别为t1、t2时刻相应氮浓度,mg/L。
每组实验设3组平行,实验结果数据使用SPSS 19.0和Origin 8.0软件进行统计分析与绘图。
2 结果与讨论
2.1 菌株形态特征、生理生化特性与鉴定
XK51经平板培养后形成直径3~5 mm不规则形菌落,菌落表面光滑,隆起,边缘整齐,呈黄褐色,不透明。革兰氏染色为阴性,生理生化特性见表1。采用半固体穿刺法测定菌株需氧和运动性,发现其能沿着穿刺线穿透培养基扩散生长,表明XK51为兼性菌,能够在好氧和缺厌氧条件下生长。
表1 菌株XK51的生理生化特征
Table 1 Chemical and physical characteristics of XK51

项目结果项目结果革兰氏染色-蔗糖发酵+接触酶+明胶液化+氧化酶+纤维素分解-甲基红-氨氮转化+伏-普测定-亚硝酸盐还原+葡萄糖发酵+硝酸盐还原+
注:“+”—阳性,“-”—阴性。
将菌株16S rDNA基因序列与GenBank数据库近缘种序列进行同源性分析,经过Blast比对绘制系统发育树,如图1所示。可知:XK51与多株Pseudomonas Putida同源性达到99%以上,可初步确定其为假单胞菌属恶臭假单胞菌(Pseudomonas Putida)。

图1 菌株XK51的系统发育树
Figure 1 Phylogenrtic tree of strain XK51
2.2 菌株好氧反硝化性能
菌株XK51的好氧反硝化特性如图2所示。可知:以KNO3为唯一氮源时,菌株好氧反硝化生长迟缓期很短(0~6 h),6~18 h快速进入对数增长期,生长稳定期较短(18~24 h),而衰亡期较长(24~60 h)。由图2a可知:在0~6 h,6~12 h,12~18 h,18~60 h,4个阶段菌株的氮脱除率η分别为59.2%、61.2%、22.7%和61.5%,氮脱除速率R分别为27.3,11.5,1.7,0.5 mg/(L·h)。60 h培养结束时其氮脱除率η为95.3%,氮平均脱除速率R为4.4 mg/(L·h),高于牟东阳等[8]的研究结果[4.1 mg/(L·h)],也远高于汪旭晖等[9]、梁贤等[12]、黄菲菲[18]的研究结果[1.8~2.1 mg/(L·h)]。
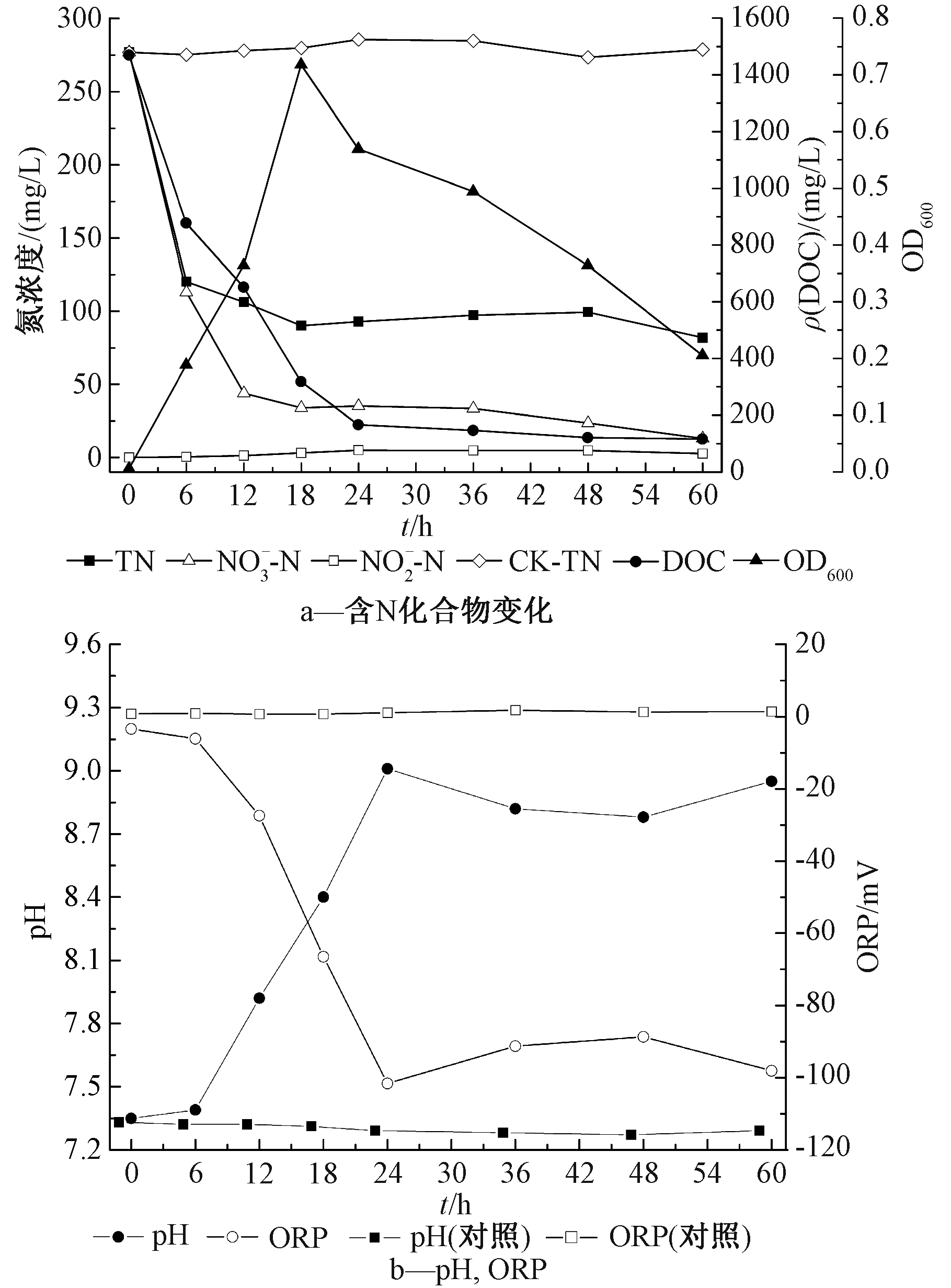
图2 菌株XK51的好氧反硝化特性和培养期间pH及ORP变化情况
Figure 2 Aerobic denitrification ability and changes of pH vs ORP of XK51
由图2a可知:TN在0~18 h变化过程和![]() 相似,ρ(TN)在较短时间内下降明显,而18 h后变化很小。根据离心后不含菌体培养液和未离心培养液总氮含量差值进行氮物质平衡分析,发现有部分硝酸盐转化为菌体生长合成的内源氮,这部分内源氮约占TN去除量的35.0%,其余氮则通过好氧反硝化过程以含N2形式脱除。在实验过程中没有出现明显亚硝酸盐累积现象,
相似,ρ(TN)在较短时间内下降明显,而18 h后变化很小。根据离心后不含菌体培养液和未离心培养液总氮含量差值进行氮物质平衡分析,发现有部分硝酸盐转化为菌体生长合成的内源氮,这部分内源氮约占TN去除量的35.0%,其余氮则通过好氧反硝化过程以含N2形式脱除。在实验过程中没有出现明显亚硝酸盐累积现象,![]() 仅为0.47~2.67 mg/L,这与牟东阳等[8]研究中出现明显亚硝酸盐累积现象
仅为0.47~2.67 mg/L,这与牟东阳等[8]研究中出现明显亚硝酸盐累积现象![]() mg/L]不同,与肖继波[23]、孙巍等[24]的研究结果一致。
mg/L]不同,与肖继波[23]、孙巍等[24]的研究结果一致。
由图2b可知:菌株培养液pH 和 ORP在其生长不同阶段呈现不同特征,在迟缓期(0~6 h)内pH 和 ORP变化很小,而在对数增长和稳定生长期间(6~24 h)则变化明显,pH由7.39快速增至9.01,ORP由-6.1 mV降至-101.6 mV,说明该好氧反硝化过程在短期内快速耗氧并产碱见式(3)和(4)。而进入衰亡期,细菌脱氮明显减缓,同时培养液复氧使pH出现小幅下降,ORP出现微幅上升现象。
![]() (3)
(3)
![]() (4)
(4)
2.3 菌株异养硝化性能
菌株XK51的异养硝化特性如图3所示。可知:以NH4Cl为唯一氮源时,0~12 h为XK51生长迟缓期,![]() 由100.28 mg/L缓慢降低至72.00 mg/L;12~24 h为对数增长期,
由100.28 mg/L缓慢降低至72.00 mg/L;12~24 h为对数增长期,![]() 快速降至21.45 mg/L,这阶段氨氮脱除率η为70.2%,脱除速率R为4.2 mg/(L·h),高于牟东阳[8]、孙庆花等[14]的研究结果[1.6~2.6 mg/(L·h)],但低于汪旭晖等[9]的研究结果[8.4 mg/(L·h)];24~60 h为生长稳定期,
快速降至21.45 mg/L,这阶段氨氮脱除率η为70.2%,脱除速率R为4.2 mg/(L·h),高于牟东阳[8]、孙庆花等[14]的研究结果[1.6~2.6 mg/(L·h)],但低于汪旭晖等[9]的研究结果[8.4 mg/(L·h)];24~60 h为生长稳定期,![]() 降低至2.44 mg/L,氨氮脱除速率R为0.5 mg/(L·h);60~72 h为菌株衰亡期,氨氮脱除速率明显减慢。72 h培养结束,氨氮最终脱除率η为98.5%,氨氮平均脱除速率R为1.4 mg/(L·h)。
降低至2.44 mg/L,氨氮脱除速率R为0.5 mg/(L·h);60~72 h为菌株衰亡期,氨氮脱除速率明显减慢。72 h培养结束,氨氮最终脱除率η为98.5%,氨氮平均脱除速率R为1.4 mg/(L·h)。

![]()
![]() —CK-TN;
—CK-TN; ![]() —DOC;
—DOC; ![]() —OD600。
—OD600。
图3 菌株XK51的异养硝化特性
Figure 3 Heterotrophic nitrification ability of strain XK51
由图3可知:培养过程中几乎未检测出![]() 而在12~60 h检测到一定浓度
而在12~60 h检测到一定浓度![]() 积累,
积累,![]() 为4.60~10.38 mg/L,72 h后添加碳源(不加氮源),
为4.60~10.38 mg/L,72 h后添加碳源(不加氮源),![]() 由6.43 mg/L降低至0.89 mg/L(文中未列出),说明进入衰减期细菌能充分利用外加碳源在异养硝化的同时进行反硝化。氨氮和碳源同时去除是异养硝化区别于自养硝化最明显特征[16],以上分析验证和确认XK51可同时进行异养硝化及同步硝化-反硝化。培养期间未出现明显亚硝酸盐和硝酸盐累积现象,原因可能是菌体能够优先选择氮转化过程中最便捷的代谢方式,或因菌株具有较高反硝化活性可迅速利用消耗掉硝化产生的中间产物[16]。
由6.43 mg/L降低至0.89 mg/L(文中未列出),说明进入衰减期细菌能充分利用外加碳源在异养硝化的同时进行反硝化。氨氮和碳源同时去除是异养硝化区别于自养硝化最明显特征[16],以上分析验证和确认XK51可同时进行异养硝化及同步硝化-反硝化。培养期间未出现明显亚硝酸盐和硝酸盐累积现象,原因可能是菌体能够优先选择氮转化过程中最便捷的代谢方式,或因菌株具有较高反硝化活性可迅速利用消耗掉硝化产生的中间产物[16]。
2.4 不同反应条件对菌株脱氮性能的影响
2.4.1 碳源对菌株脱氮影响
图4为不同碳源对菌株脱氮的影响。可知:XK51在5种碳源中均能生长,但差异明显。以柠檬酸三钠为唯一碳源时XK51培养24 h后生长最好,总氮脱除率和碳源利用率分别为78.6%和57.8%;其次为葡萄糖,其总氮脱除率、碳源利用率分别为22.7%和35.4%;琥珀酸钠、蔗糖和苹果酸钠的碳源利用和氮脱除效果最差,总氮脱除率、碳源利用率分别为0.1%~9.9%和12.4%~14.2%。碳源利用率排序为:柠檬酸三钠>葡萄糖>琥珀酸钠>蔗糖>苹果酸钠。菌株XK51最佳碳源为柠檬酸三钠,这与孙庆花[15]、刘天琪等[25]的研究一致。
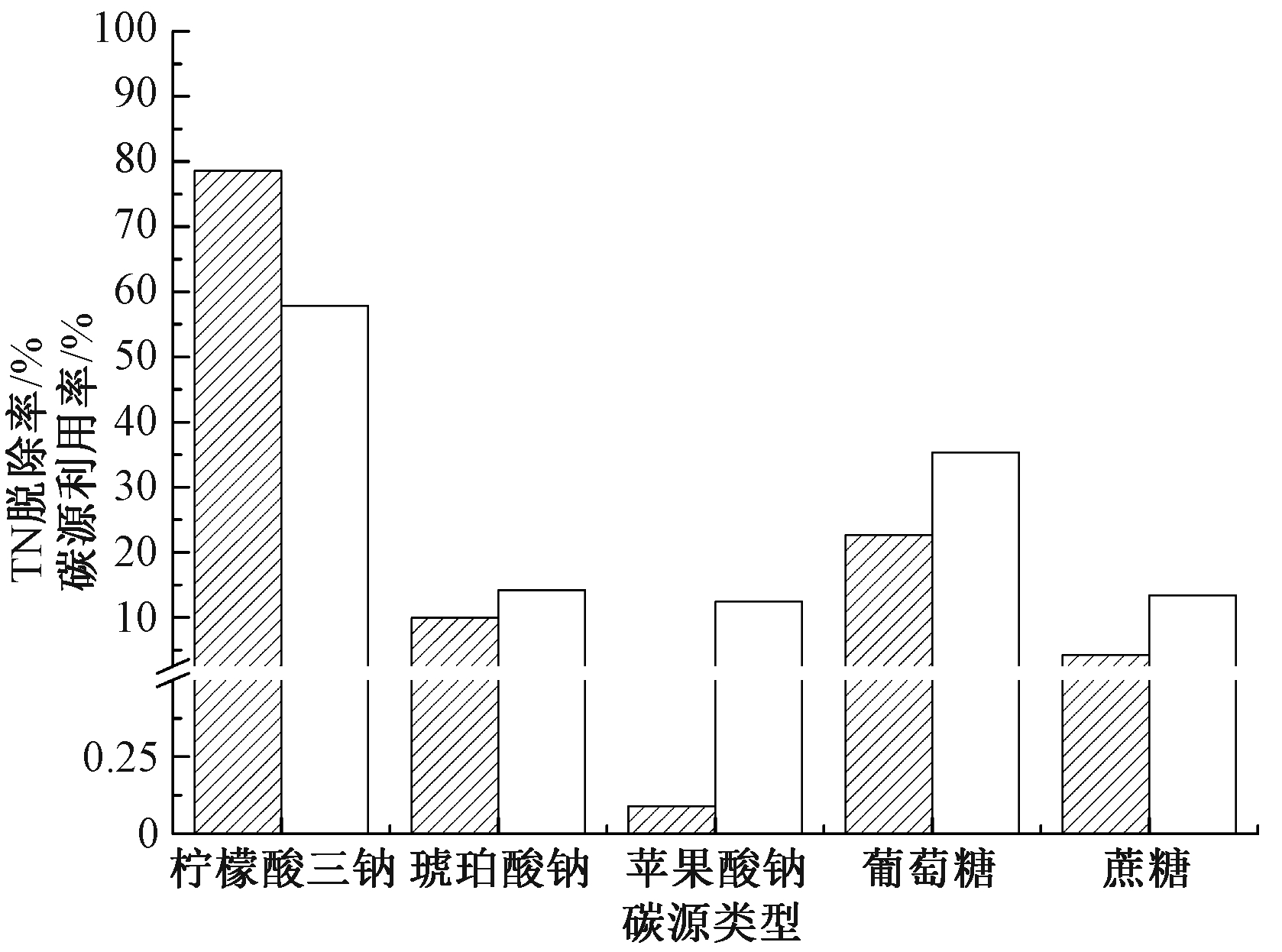
![]() TN脱除率;
TN脱除率; ![]() 碳源利用率。
碳源利用率。
图4 碳源对菌株XK51脱氮性能的影响
Figure 4 Effect of carbon resources on nitrogen removal of strain XK51
2.4.2 氮源底物浓度对菌株脱氮影响
不同底物浓度对菌株脱氮影响如图5所示。可知:以NH4Cl为唯一氮源,C/N相同而氮底物浓度不同的条件下,培养72 h后3组氨氮脱除率并无显著差异,而碳源利用率则差异明显。低浓度(5 mg/L)、中浓度(20 mg/L)、高浓度(100 mg/L)底物的氨氮脱除率分别为97.5%、96.1%、98.5%,碳源利用率分别为83.6%、95.4%和89.6%,碳源利用排序为:中浓度底物>高浓度底物>低浓度底物。
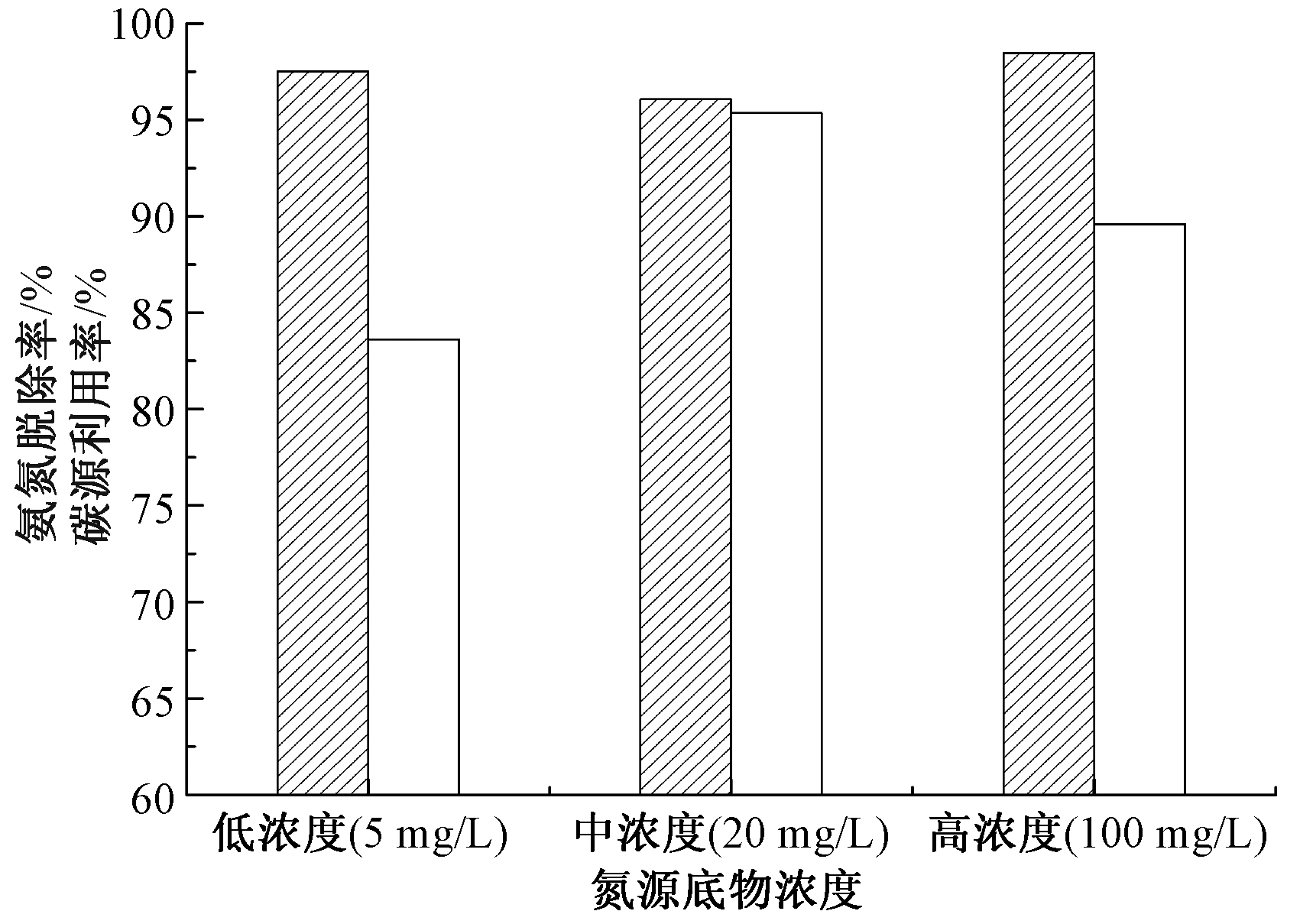
![]() 氨氮脱除率;
氨氮脱除率; ![]() 碳源利用率。
碳源利用率。
图5 不同氮源底物浓度对菌株XK51脱氮性能的影响
Figure 5 Effect of ammonia concentrations on nitrogen removal of XK51
2.4.3 温度对菌株脱氮影响
由图6所示,不同温度条件下XK51生长和脱氮率差异较显著,10~30 ℃随着温度上升其脱氮率和OD600逐渐升高,24 h后脱氮率由21.4%增至89.1%;30~40 ℃间随着温度上升脱氮率和OD600渐趋下降,脱氮率由89.1%降低至33.2%。温度能显著影响微生物体内酶活性[17],表明温度升高导致XK51体内酶生物活性降低并影响脱氮能力。因此,XK51生长较适宜温度为28~35 ℃,最适温度值为30 ℃,<15 ℃或>35 ℃时脱氮速率会明显降低。
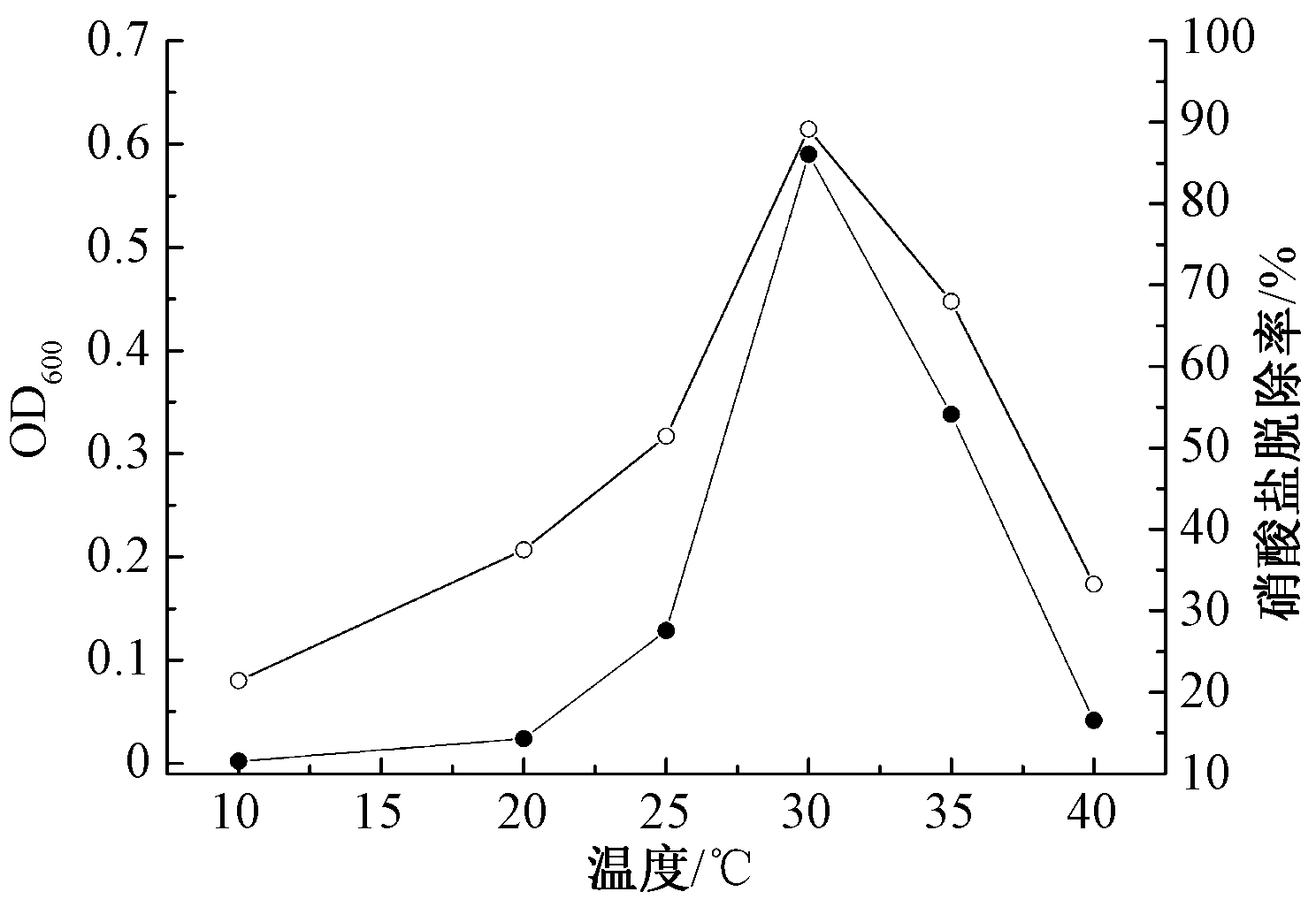
![]() —OD600;
—OD600; ![]() —硝酸盐脱除率。
—硝酸盐脱除率。
图6 不同培养温度对菌株XK51脱氮性能的影响
Figure 6 Effect of ammonia concentrations on nitrogen removal of XK51
2.4.4 初始pH对菌株脱氮影响
不同初始pH对菌株脱氮影响如图7所示。可知:不同初始pH条件对XK51生长和脱氮率影响较为显著。当4≤pH≤7时,随着pH增大,XK51脱氮率和OD600逐渐升高,培养24 h后脱氮率由pH=4时的13.0%增加到pH=7时的88.5%;而当7≤pH≤9时,随着pH增大,XK51脱氮率和OD600渐趋下降,脱氮率由88.5%降低至56.1%。XK51生长较适宜pH为6.5~8.0,最适pH为7.0,<6.5或>8时脱氮率会明显降低,这与孙巍[24]、苏婉筠等[26]研究报道的恶臭假单胞菌适宜生长的pH为6.5~7.5的研究结果一致。
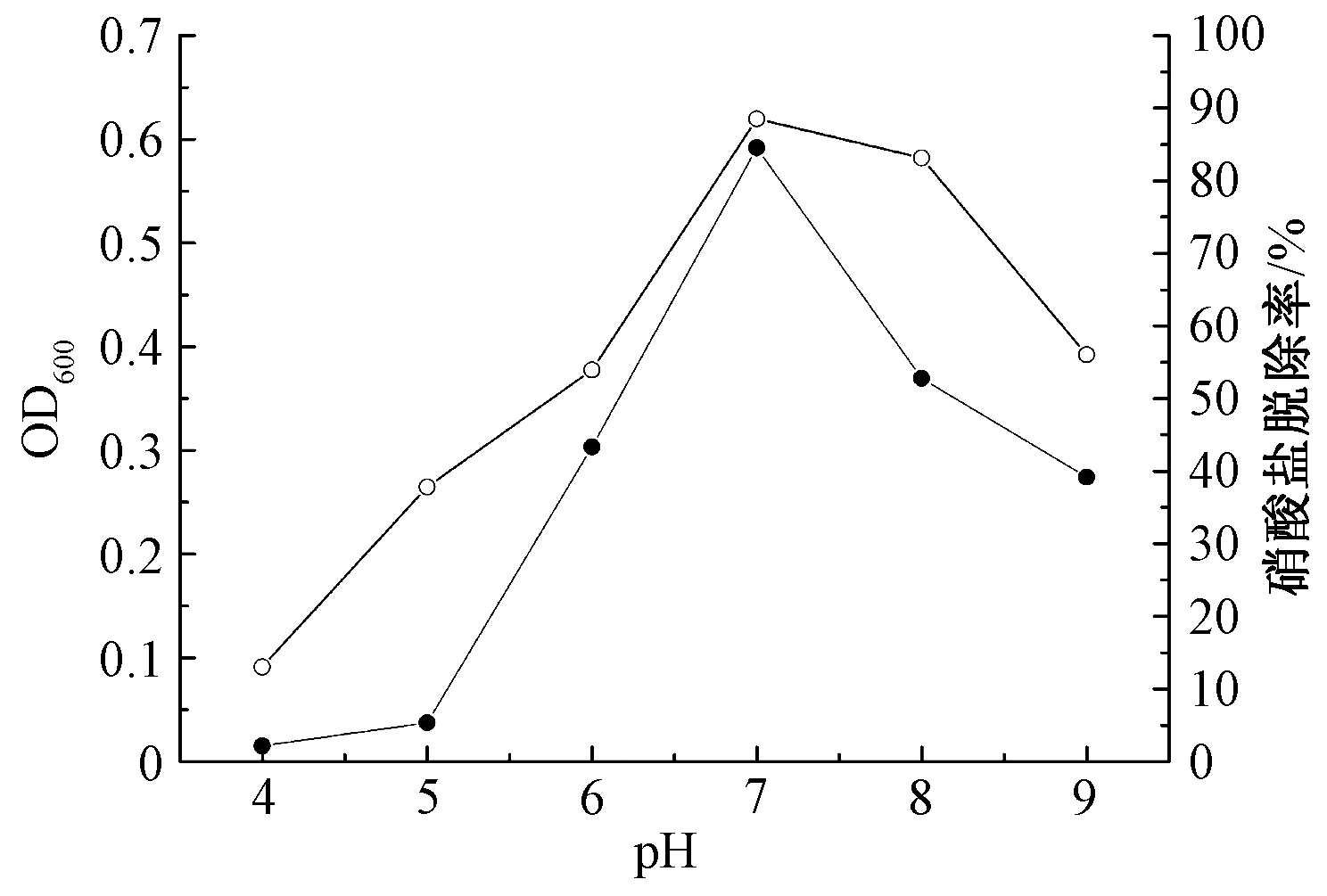
![]() —OD600;
—OD600; ![]() —硝酸盐脱除率。
—硝酸盐脱除率。
图7 不同pH值对菌株XK51脱氮性能的影响
Figure 7 Effect of pH values on nitrogen removal characteristics of XK51
3 结 论
1)从浅层含水层原状介质中分离纯化和筛选出1株高效异养硝化-好氧反硝化细菌,经形态学、生理生化特性及16S rDNA序列分析确定其属于假单胞菌属恶臭假单胞菌,命名为Pseudomonas Putida XK51。
2)XK51具有高效兼性反硝化能力,能够在好氧或缺厌氧条件下快速反硝化脱氮,最大氮脱除速率Rmax为27.3 mg/(L·h),硝酸盐脱除率η为95.3%,平均氮脱除速率R为4.4 mg/(L·h),且反硝化脱氮过程中未出现明显的亚硝酸盐累积现象。
3)XK51具有较高异养硝化能力,最大氮脱除速率Rmax为4.2 mg/(L·h),氨氮脱除率η为98.5%,平均氮脱除速率R为1.4 mg/(L·h),几乎未检测到亚硝酸盐和硝酸盐,菌株可同时进行异养硝化及同步硝化反硝化。
4)XK51最佳碳源为柠檬酸三钠;较适宜生长温度为28~35 ℃,最适温度值为30 ℃;较适宜生长pH为6.5~8.0,最适pH为7.0。
[1] LEI Y, WANG Y Q, LIU H J, et al. A novel heterotrophic nitrifying and aerobic denitrifying bacterium, Zobellella taiwanensis DN-7, can remove high-strength ammonium[J]. Applied Microbiology and Biotechnology, 2016, 100(9):4219-4229.
[2] YI X, HE T X, LI Z L, et al. Nitrogen removal characteristics of Pseudomonas putida Y-9 capable of heterotrophic nitrification and aerobic denitrification at low temperature[J]. BioMed Research International, 2017, 10:1-7.
[3] 田雪雪, 程玉立, 张圆圆, 等. 一株异养硝化-好氧反硝化功能菌的分离鉴定及其脱氮特性[J]. 环境工程学报, 2017,11(2):1269-1275.
[4] 周晓黎, 孙迎雪, 沈丹丹, 等. 一株施氏假单胞菌Pseudomonas stutzeri DN-LWX19的脱氮性能[J]. 环境工程学报, 2015, 9(1):247-252.
[5] 王秀杰, 王维奇, 李军, 等. 异养硝化菌Acinetobacter sp.的分离鉴定及其脱氮特性[J]. 中国环境科学, 2017,37(11):4241-4250.
[6] 王田野, 魏荷芬, 胡子全, 等. 一株异养硝化好氧反硝化菌的筛选鉴定及其脱氮特性[J]. 环境科学学报, 2017,37(3):945-953.
[7] QING H, DONDE O O, TIAN C C, et al. Novel heterotrophic nitrogen removal and assimilation characteristic of the newly isolated bacterium Pseudomonas stutzeri AD-1[J]. Journal of bioscience and bioengineering, 2018, 126(3):339-345.
[8] 牟东阳, 靳鹏飞, 彭永臻, 等. 1株异养硝化-好氧反硝化细菌DK1的分离鉴定及其脱氮特性[J]. 环境科学, 2017,38(11):4763-4773.
[9] 汪旭晖, 杨垒, 任勇翔, 等. 异养硝化细菌Pseudomonas putida YH的脱氮特性及降解动力学[J]. 环境科学, 2019, 40(4): 1892-1899.
[10] SUN Y L, FENG L, LI A, et al. Ammonium assimilation: an important accessory during aerobic denitrification of Pseudomonas stutzeri T13[J]. Bioresource Technology, 2017, 234:264-272.
[11] MA F, SUN Y, LI A, et al. Activation of accumulated nitrite reduction by immobilized Pseudomonas stutzeri T13 during aerobic denitrification[J]. Bioresource Technology, 2015, 187:30-36.
[12] 梁贤, 任勇翔, 杨垒, 等. 异养硝化-好氧反硝化菌YL的脱氮特性[J]. 环境科学, 2015,36(5):1749-1756.
[13] 袁梦冬, 辛玉峰. 一株异养硝化-好氧反硝化菌的分离鉴定及脱氮活性[J]. 北华大学学报(自然科学版), 2012,13(3):339-343.
[14] 孙庆花, 于德爽, 张培玉, 等. 1株海洋异养硝化-好氧反硝化菌的分离鉴定及其脱氮特性[J]. 环境科学, 2016,37(2):647-654.
[15] 孙庆花, 于德爽, 张培玉, 等. 海洋菌株y3的分离鉴定及其异养硝化-好氧反硝化特性[J]. 环境科学, 2016, 37(3):1089-1097.
[16] 黄廷林, 白士远, 张海涵, 等. 一株贫营养异养硝化-好氧反硝化细菌的分离鉴定及脱氮特性[J]. 环境工程学报, 2015, 9(12):5665-5671.
[17] 邹艳艳, 张宇, 李明智, 等. 一株异养硝化-好氧反硝化细菌的分离鉴定及脱氮活性研究[J]. 中国环境科学, 2016, 36(3):887-893.
[18] 黄菲菲. 异养硝化-好氧反硝化菌的筛选与脱氮性能研究.[D].南京:南京理工大学,2013.
[19] 黄剑锋,张依章,张远,等. 太湖西苕溪流域地表水、地下水硝酸盐污染特征及来源[J]. 环境科学研究,2012,25(11):1229-1235.
[20] 潘田,张幼宽. 太湖流域长兴县浅层地下水氮污染特征及影响因素研究[J]. 水文地质工程地质,2013,40(4):7-13.
[21] 郭卉,虞敏达,何小松,等. 南方典型农田区浅层地下水污染特征[J]. 环境科学,2016,37(12):4680-4689.
[22] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
[23] 肖继波, 江惠霞, 褚淑祎. 不同氮源下好氧反硝化菌Defluvibacter lusatiensis str.DN7的脱氮特性[J]. 生态学报, 2012, 32(20):6463-6470.
[24] 孙巍, 宋玉文, 洪维祎, 等. 一株高效异养硝化好氧反硝化菌的分离鉴定与脱氮特性[J]. 龙岩学院学报, 2017,35(5):88-94.
[25] 刘天琪, 金若菲, 周集体, 等. 异养硝化-好氧反硝化菌ADN-42的脱氮特性[J]. 环境工程学报, 2015, 9(2):989-996.
[26] 苏婉昀, 高俊发, 赵红梅. 异养硝化-好氧反硝化菌的研究进展[J]. 工业水处理, 2013, 33(12):1-5.