与传统人工湿地技术相比较,生态浮岛技术具有成本低廉、易于施工、运行周期短、净化效果好等优势,在污染水体的生态防治领域具有良好的应用与推广前景[1]。然而传统的生态浮岛受到材料耐性差、技术不成熟的限制,使得传统生态浮岛技术对微污染水体的处理效果不理想[2]。近年来,国内外对生态浮岛技术的研究主要集中在生态浮岛植物选择,结构设计,以及如何增加水体中溶解氧含量来提高生态浮岛技术的去除效果等方面,曝气-生态浮岛联合技术等相关研究成为热点。
Lauren等[3]将美人蕉种在设有预切孔的塑料小桶内并固定于泡沫板上,且每组浮板的植物种植数量成倍数增长,并在下方进行曝气。最后得出加入曝气技术的生态浮岛能够节省50%的植物覆盖面积,且TN去除率比传统生态浮岛技术提高64%,TP去除率要提高47%。
王芳等[4]采用PVC管件和塑料种植筐制成浮床框架,并在框架下方悬挂玉米芯、稻草、煤渣沸石等制成沉箱用于培养微生物,并在水箱底部进行微量曝气,TN去除率可达95.51%。陈亚男等[5]将塑料花盆与PVC管制成浮床,在浮床下方交错悬挂软性生物填料与硬质生物填料培养微生物菌胶团,并在铺设浮岛区域的前端向水体中曝气充氧,最终COD去除率可达![]() 去除率可达18.3%。
去除率可达18.3%。
以往的曝气方式都是使用气泡石曝气或者在硬质管上打孔向水中通气。这几种方法曝气方式都会使水体中的气泡体积大,上浮溢散到空气中的速度快,气泡在水体中停留时间短,从而使水里溶解氧含量少,同时气泡上浮速度太快会使水体搅动过于剧烈,不易于水生植物根际圈的稳定和生物填料的挂膜,造成污染物去除效果不理想[6,7]。
微纳米曝气技术通过改良传统的曝气设备,将具有微米级的多孔橡胶曝气管制成曝气盘来取代传统气泡石和通气管进行曝气,所产生的气泡体积小,气泡直径可达0.3~2 mm,水体中停留时间长并在短期内能够显著提高水体中溶解氧含量,而且对水体的搅动程度小,已在河道增氧、水产养殖等领域得到较好应用,但对微纳米曝气与生态浮岛联合技术的研究较少。本次将微纳米曝气技术引入生态浮岛,通过实验探究该技术如何有效提升水体中硝化细菌与聚磷菌的增长数量,提高生物填料挂膜的稳定性,以证明微纳米曝气-生态浮岛联合技术对微污染水体中N、P元素的去除效果要优于传统浮岛技术[8]。
1.1.1 微纳米橡胶曝气管的结构
微纳米橡胶曝气管采用高分子抗菌橡胶材质,通过热压挤出工艺制成具有超微细孔的微纳米级多孔结构,具有抗菌性,能够防止微生物在表面繁殖聚集堵塞曝气管。其工作原理为:开始曝气时,空气泵将空气压入橡胶曝气管中,由于整个曝气管为橡胶材质,具有一定弹性。曝气管体积发生膨胀,组成管壁的橡胶颗粒被气体撑开,每个橡胶颗粒间的距离变大产生微纳米气体通道,使整个橡胶曝气管变成微纳米级多孔结构,此时空气会随着多孔通道进入水体中,产生微纳米级气泡,以达到微纳米曝气技术目的;当停止曝气时,发生形变的橡胶颗粒开始恢复形状,曝气管的多孔通道逐渐封闭并收缩至原有状态。微纳米橡胶曝气管的结构见图1。
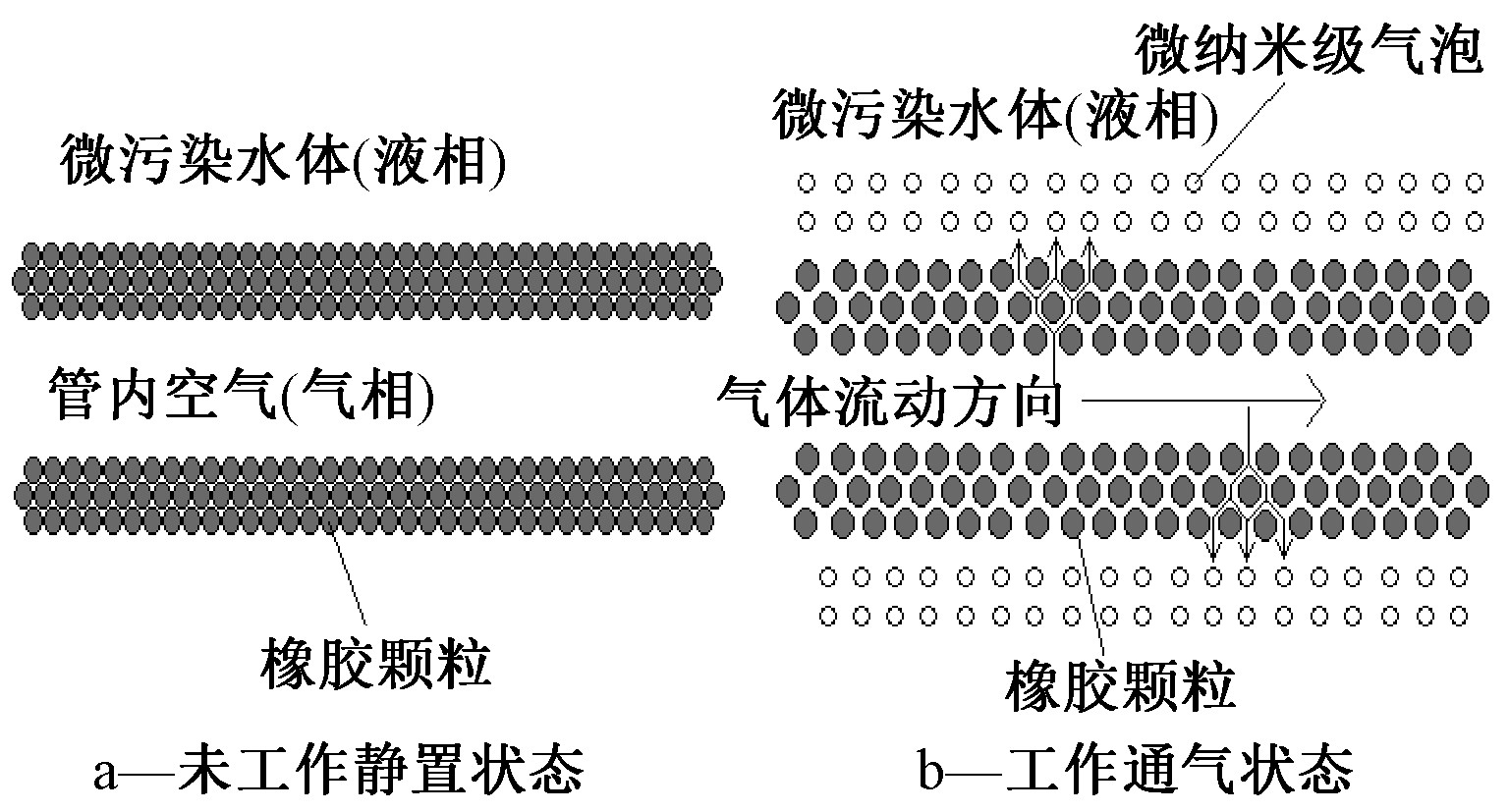
图1 微纳米橡胶曝气管结构
Figure 1 Structure of micro-nano rubber aeration tube
1.1.2 微纳米曝气-生态浮岛系统的构建
微纳米曝气-生态浮岛系统主要由上、中、下3层组成。其中,上层为浮床与植物种植区,中层为生物填料悬挂区与植物根系区,见图2a;下层为曝气区域与处理水箱,见图2b。
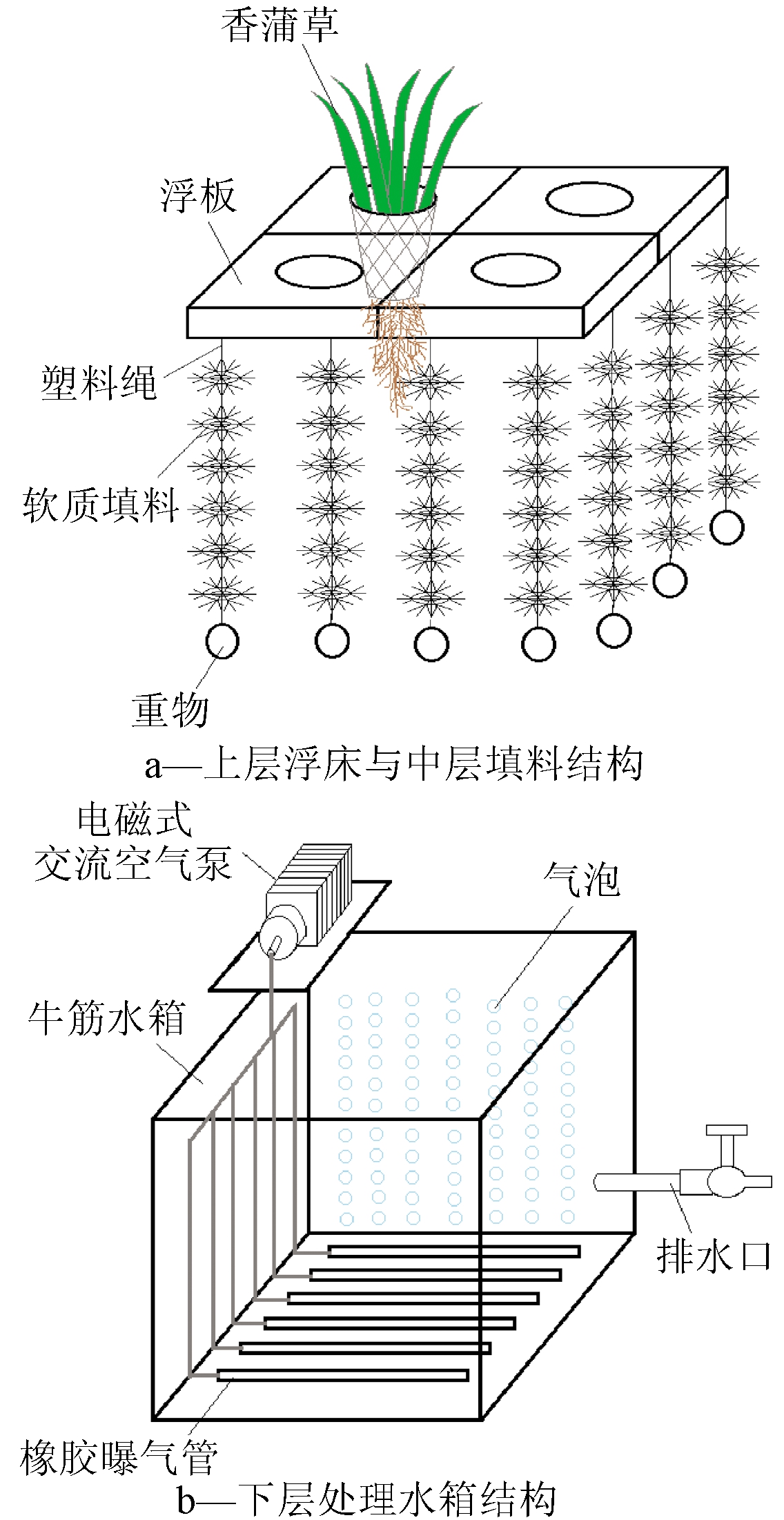
图2 微纳米曝气-生态浮岛系统结构
Figure 2 Structure of micro-nano aeration-ecological floating wetland
由图2a可知:上层浮床由4块浮板构成,每块浮板长度为350 mm×350 mm,采用吹塑工艺制成中空型,浮板中心设有塑料种植网兜,亲水植物种植在种植网兜上。每个种植网兜种有4~5棵亲水植物。植物高度为500~800 mm。每个浮板上系有4根高分子塑料绳。中层采用高分子塑料绳悬挂软质生物填料。软质生物填料材料为涤纶丝,生物填料之间用塑料套管隔开。每根塑料绳上悬挂10片软质生物填料。每个浮板下端系有40片生物软质填料,整个浮岛下端共160片软质生物填料,形成生物膜吸附区,塑料高分子绳下端系有重物以防止生物填料上浮。
由图2b可知:下层处理水箱材料由牛筋塑料制成,水箱容积为700 L,长×宽×高为1200 mm×1200 mm×80 mm,水箱侧面设有排水口,排口距离地面120 mm。水箱底部固定有6根曝气管,曝气管材料为微纳米级橡胶曝气管,每根曝气管管长700 mm,管径尺寸为φ16 mm×10 mm。采用电磁式交流空气泵进行曝气,功率为35 W,气量为40 L/min,产生的微纳米级气泡直径为0.3~2 mm,空气泵位于处理水箱箱口处。
由于本实验所用的微污染水体取自白塔堡河,位于辽宁中部地区,属于温带季风性气候,经沿河岸实地考察,河岸两边生长的植物主要有香蒲草、芦苇、水葫芦等。因此,试验选用香蒲草作为浮岛栽种植物,植物的培育方法为:首先将香蒲草截成长500~800 mm,保留植株的完整根系,并将植株上干枯、腐烂的叶片摘去以防止影响水箱中待测水体水质。再将整个植株在清水中清洗干净去除泥沙等杂质并在清水中浸泡5 d,每天换水1次。最后在水中加入生根粉浸泡12 h。浸泡后再用清水清洗1次并植入塑料种植网兜,每个网兜直径为150 mm,在每个网兜内种植4~5株经上述处理的香蒲草,植株与网兜之间的空隙用海绵块填补以固定植株。
实验用水选择沈阳市浑南地区白塔堡河水,水质属于GB 3838—2002《地表水环境质量标准》劣Ⅴ类,选取![]() 指数作为水质去除效果标准进行测定,水质详见表1。
指数作为水质去除效果标准进行测定,水质详见表1。
为探究微纳米曝气-生态浮岛联合技术对微污染水体![]() 的处理效果,在曝气水箱旁边设置1个无曝气对照组。实验周期以20 d为1周期,每4天对2个水箱进行1次取样,水样采取位置选在浮床水面下方250 mm处。
的处理效果,在曝气水箱旁边设置1个无曝气对照组。实验周期以20 d为1周期,每4天对2个水箱进行1次取样,水样采取位置选在浮床水面下方250 mm处。
表1 白塔堡河水水质指标
Table 1 Water quality index in the Baitabao River mg/L(pH除外)
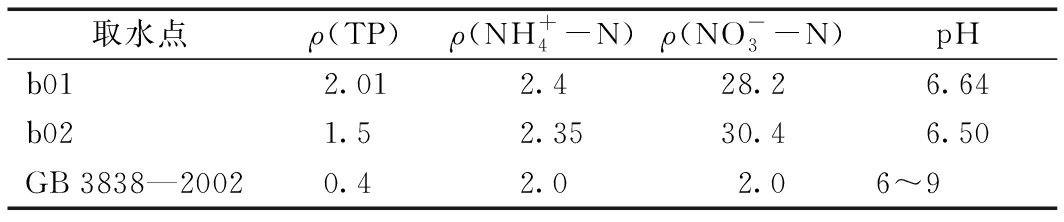
取水点ρ(TP)ρ(NH+4-N)ρ(NO-3-N)pHb012.012.428.26.64b021.52.3530.46.50GB 3838—20020.42.02.06~9
水质测定方法采用国家标准,各项污染物检测方法见表2。
表2 污染物检测方法
Table 2 Pollutants’ detection method

污染物名称检测方法编号TP钼酸铵分光光度法GB 11893—1989NH+4-N纳氏试剂比色法GB 7479—1987NO-3-N酚二磺酸分光光度法GB 7480—1987pH玻璃电极法GB 6920—1986
污染水体的![]() 去除率ω计算公式为:
去除率ω计算公式为:
(1)
式中:c1为![]() 等污染物的初始浓度,mg/L;c2为治理后污染物浓度。
等污染物的初始浓度,mg/L;c2为治理后污染物浓度。
微纳米曝气-生态浮岛联合技术与无曝气对照组对![]() 去除效果见图3。可知:在实验开始的前13 d内,2组实验的
去除效果见图3。可知:在实验开始的前13 d内,2组实验的![]() 含量呈下降趋势,且下降速率较快;而在后期的14~20 d并没有明显变化。这是由于前期水生植物的预处理过程中处于饥饿状态,所以在前期亲水植物能够充分吸收水体中的
含量呈下降趋势,且下降速率较快;而在后期的14~20 d并没有明显变化。这是由于前期水生植物的预处理过程中处于饥饿状态,所以在前期亲水植物能够充分吸收水体中的![]() 且吸收速率较快。而在中后期由于亲水植物吸附已达到临近饱和状态,使得后期
且吸收速率较快。而在中后期由于亲水植物吸附已达到临近饱和状态,使得后期![]() 去除速率减慢。在实验开始的前5 d内,曝气组水体的
去除速率减慢。在实验开始的前5 d内,曝气组水体的![]() 含量下降速率要明显高于对照组。这是由于在整个实验过程中曝气组一直处于曝气状态,使得曝气组的溶解氧含量高于对照组,而水生植物兼具光合作用与呼吸作用,夜间呼吸作用占主导地位消耗水中溶解氧,将有机物转化为CO2和水。使得曝气组的生长环境更适于亲水植物的生长[9-11]。同时2组实验在浮板下方都悬挂生物填料,溶解氧含量的增高有助于硝化细菌的生长与繁殖,使得实验前期对于水体中
含量下降速率要明显高于对照组。这是由于在整个实验过程中曝气组一直处于曝气状态,使得曝气组的溶解氧含量高于对照组,而水生植物兼具光合作用与呼吸作用,夜间呼吸作用占主导地位消耗水中溶解氧,将有机物转化为CO2和水。使得曝气组的生长环境更适于亲水植物的生长[9-11]。同时2组实验在浮板下方都悬挂生物填料,溶解氧含量的增高有助于硝化细菌的生长与繁殖,使得实验前期对于水体中![]() 的去除有显著作用且速率大于对照组。后期即使在植物吸附达到饱和阶段,由于浮板下方的生物膜也已经培养成熟,可对水体中剩余
的去除有显著作用且速率大于对照组。后期即使在植物吸附达到饱和阶段,由于浮板下方的生物膜也已经培养成熟,可对水体中剩余![]() 进行吸附去除。且曝气组由于溶解氧含量高于对照组,使得在后期对于
进行吸附去除。且曝气组由于溶解氧含量高于对照组,使得在后期对于![]() 的去除也高于对照组。曝气组经过20 d处理后,水体
的去除也高于对照组。曝气组经过20 d处理后,水体![]() 为0.01 mg/L,去除率达到99.8%;对照组
为0.01 mg/L,去除率达到99.8%;对照组![]() 为0.03 mg/L,去除率达到98.7%。
为0.03 mg/L,去除率达到98.7%。
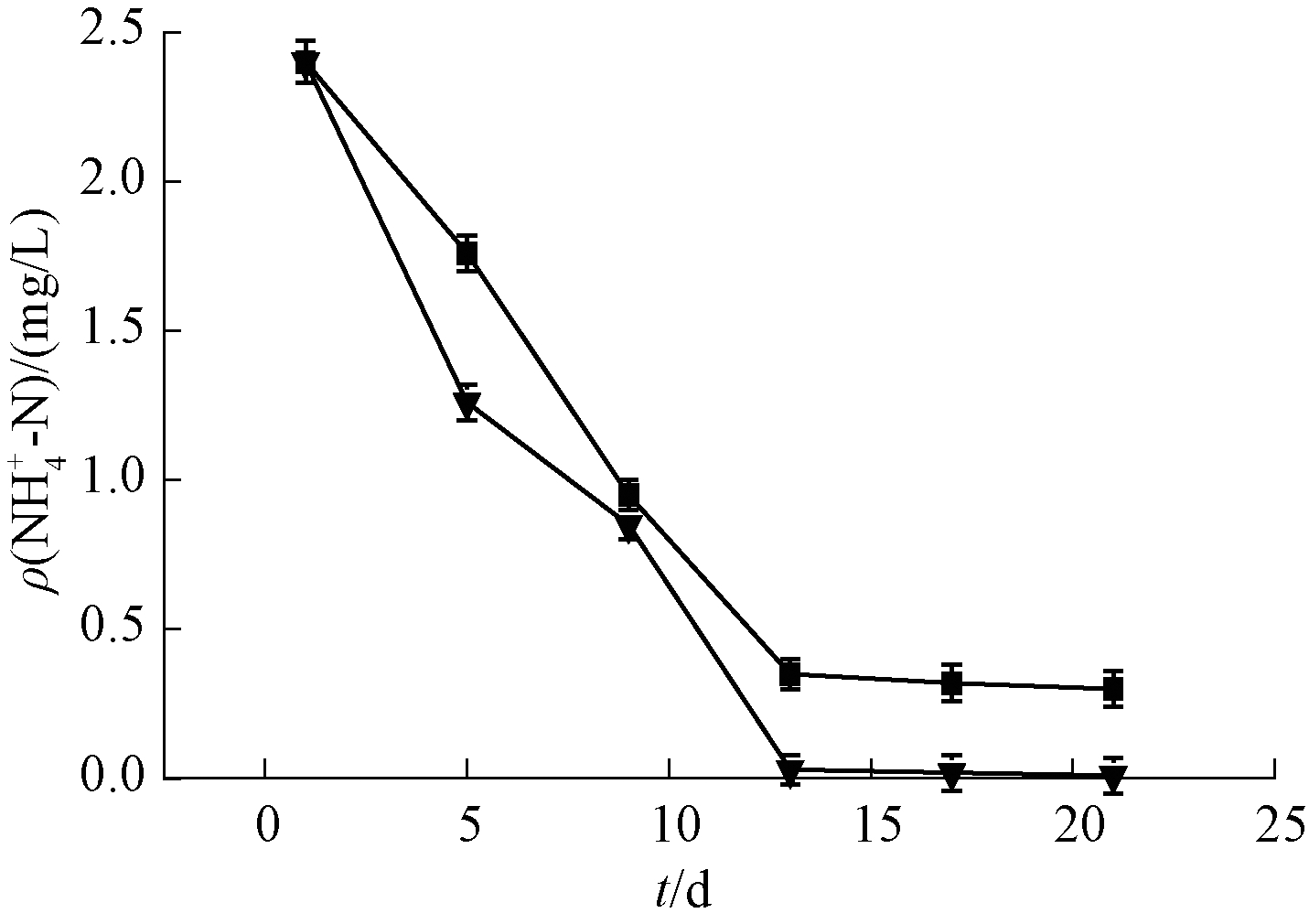
![]() —曝气组
—曝气组![]() 对照组
对照组![]()
图3 实验曝气组、对照组![]() 含量
含量
Figure ![]() contents in experimental aeration group and the control group
contents in experimental aeration group and the control group
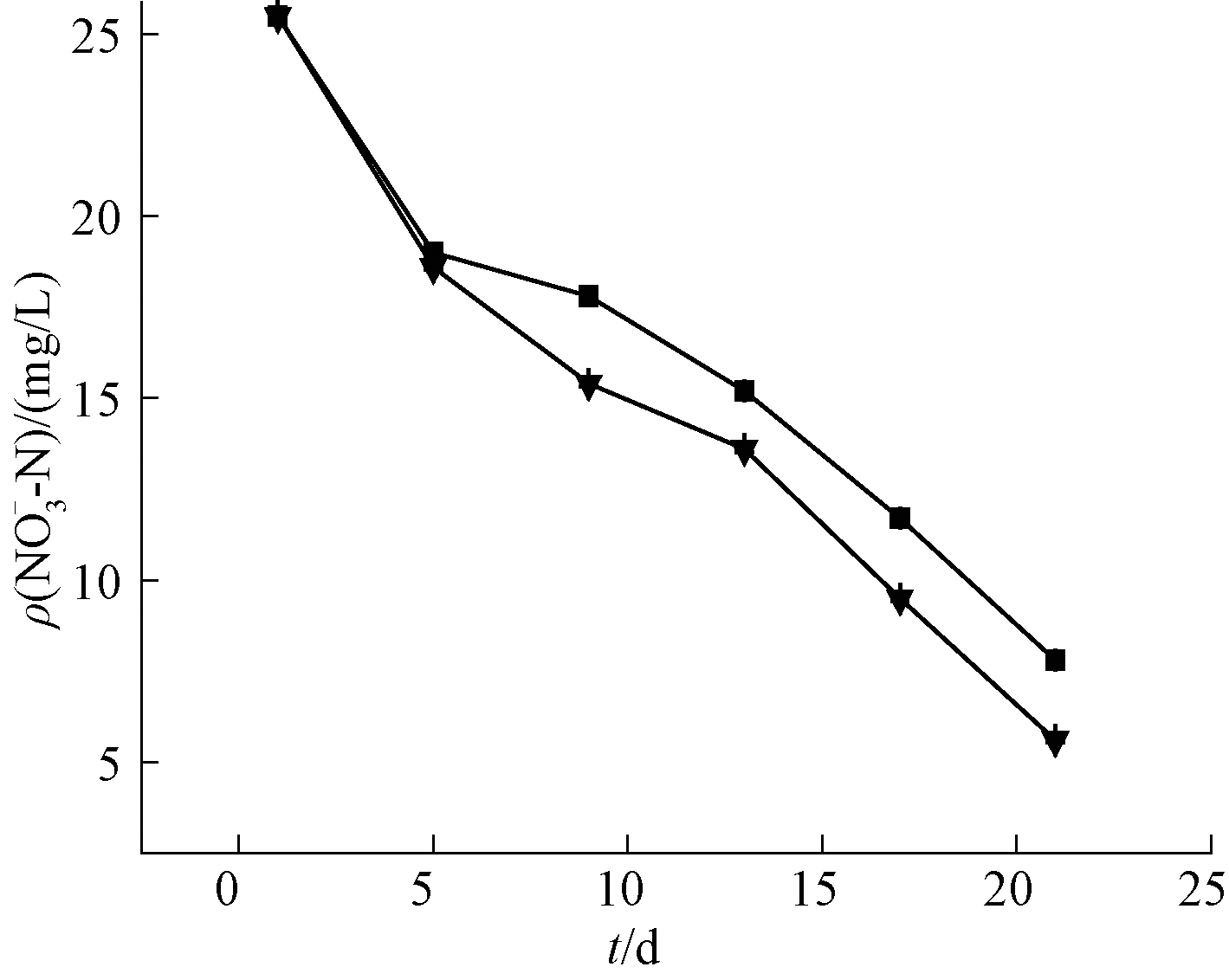
微纳米曝气-生态浮岛联合技术与无曝气对照组对![]() 的去除效果如图4所示。可知:2组实验的
的去除效果如图4所示。可知:2组实验的![]() 含量在总体上均呈降低趋势,并且曝气组的降低速率要明显快于对照组速率。分析原因,由于曝气组水体溶解氧含量高,使得水体中的
含量在总体上均呈降低趋势,并且曝气组的降低速率要明显快于对照组速率。分析原因,由于曝气组水体溶解氧含量高,使得水体中的![]() 被硝化细菌氧化为
被硝化细菌氧化为![]() 而
而![]() 为植物营养生长阶段的主要N元素来源,吸收的
为植物营养生长阶段的主要N元素来源,吸收的![]() 多被储存于植物的液泡内,浓度高也不会对植物造成较大影响。而对照组的溶解氧含量低,使得对照组水体的
多被储存于植物的液泡内,浓度高也不会对植物造成较大影响。而对照组的溶解氧含量低,使得对照组水体的![]() 含量高于曝气组,亲水植物在生长过程中若
含量高于曝气组,亲水植物在生长过程中若![]() 含量过高会对植物产生毒害作用[12,13]。因此,曝气组的
含量过高会对植物产生毒害作用[12,13]。因此,曝气组的![]() 去除速率明显高于对照组,经20 d处理后对照组的
去除速率明显高于对照组,经20 d处理后对照组的![]() 为7.8 mg/L,去除率达到69%,曝气组
为7.8 mg/L,去除率达到69%,曝气组![]() 为5.6 mg/l,去除率达到78%。
为5.6 mg/l,去除率达到78%。
![]() —曝气组
—曝气组![]() 对照组
对照组![]()
图4 实验曝气组、对照组![]() 含量
含量
Figure ![]() contents in experimental aeration group and the control group
contents in experimental aeration group and the control group
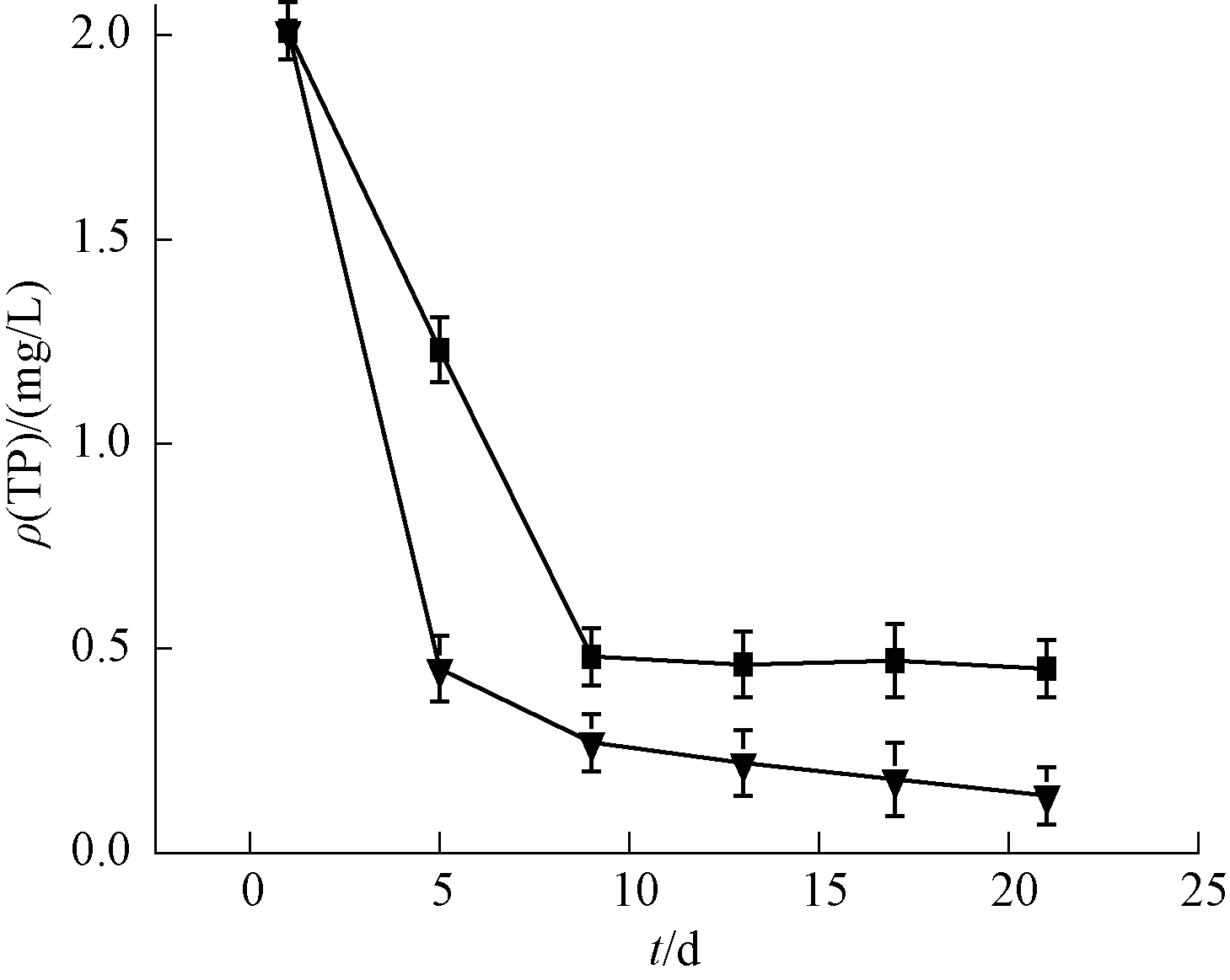
微纳米曝气-生态浮岛联合技术与无曝气对照组对TP的去除如图5所示。可知:2组实验水体TP含量在总体上呈下降趋势,但曝气组的去除效果要明显高于对照组。在实验前5 d内曝气组的ρ(TP)已经降低至0.5 mg左右,而对照组的ρ(TP)降低至0.5左右时需要近10 d的时间。同时在实验中后期可看出:虽然后期2组实验均趋于稳定趋势,但曝气组的TP含量仍旧在逐渐减少,由0.5 mg降低至0.15 mg左右,但对照组的TP含量一直保持在0.45 mg左右。分析原因,在实验前期亲水植物的预处理已剪去主要茎叶,亲水植物在生长过程中,除了需要N元素组成植物细胞的细胞质外,还需要P元素组成细胞内的DNA、RNA等遗传物质[14,15]。新长出的叶茎及根部的P含量要远高于成熟的叶茎。由于前期水体中P含量较高,植物在前期生长根系及茎叶等需要大量P元素,使得前期去除效果较为迅速,而且曝气组实验的水体溶解氧浓度较高,植物生长靠单个植物细胞的分裂与增殖,需要大量能量,而能量的主要来源需要靠植物的有氧呼吸。而水中溶解氧不足会使植物代谢减慢甚至死亡。在多种条件的作用下使得前期曝气组的P含量降低速率较快[16]。而在后期植物生长趋于稳定时,P元素的去除主要依赖于填料上微生物的吸附作用,而聚磷菌吸附磷的效果与水体中溶解氧含量有关。聚磷菌在好氧条件下将水中的P氧化成各种磷酸盐储存在体内。使得曝气组在后期即使植物的吸收达到饱和状态,还可以继续吸收水体中P元素,使其含量降低至0.14 mg/L,TP去除率达到93.03%,而对照组由于前期植物生长消耗大量溶解氧,后期溶解氧不足造成聚磷菌吸附P元素能力降低,只能维持在0.45 mg/L左右,去除率仅为77.61%。
![]() —曝气组TP;
—曝气组TP; ![]() —对照组TP。
—对照组TP。
图5 实验曝气组、对照组TP含量
Figure 5 TP contents in experimental aeration group and the control group
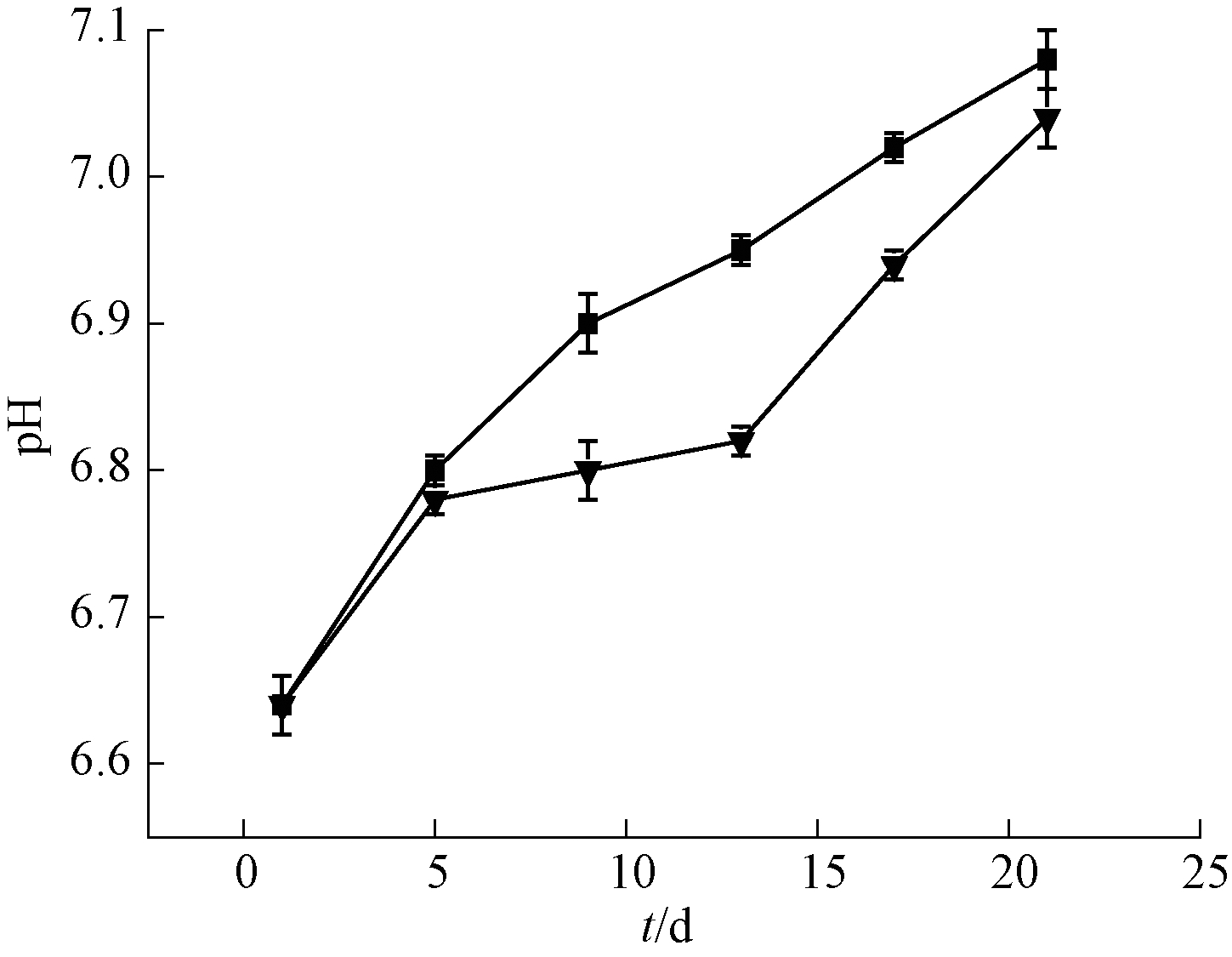
微纳米曝气-生态浮岛联合技术与无曝气对照组对水体中pH的影响如图6所示。可知:在初始阶段2组实验水体的pH值均在6.64左右,水体呈弱酸性,弱酸性水体虽然适合香蒲草的生长,但是藻类同样适合生长在酸性环境中。由于水体中N、P元素、有机污染物在前期含量高,使得藻类在前期繁殖迅速,藻类在繁殖过程中会分泌大量的酸性胞外酶与多糖类物质,此类物质是造成前期水体环境呈酸性的主要原因。水体中溶解氧含量较低抑制了水生植物的生长,经过20 d的处理后,由于水生植物的生长与填料上微生物的挂膜消耗了水中污染物,使得藻类的增殖速度减弱,减少了酸性物质的分泌,使得后期2组实验的水体pH值均达到7.0左右,水质酸碱度呈中性状态。由此可见,微纳米曝气-生态浮岛联合技术能够在去除水中N、P元素与有机污染物的同时,有效抑制藻类的过量生长。
![]() —曝气组pH;
—曝气组pH; ![]() —对照组pH。
—对照组pH。
图6 实验曝气组、对照组pH变化
Figure 6 pH variation in experimental aeration group and the control group
通过实验可看出:相对于传统的生态浮岛技术,微纳米曝气-生态浮岛联合技术可以在短时间内对![]() 具有较高的去除率,在20 d内曝气组的
具有较高的去除率,在20 d内曝气组的![]() 去除率为99.8%;TP去除率为
去除率为99.8%;TP去除率为![]() 去除率为78%,均达到GB 3838—2002排放标准且效果高于对照组。
去除率为78%,均达到GB 3838—2002排放标准且效果高于对照组。
通过曝气技术增加水体中的溶解氧含量,能够促进植物的好氧呼吸,而且微纳米曝气产生的气泡体积小,不会剧烈搅动水体,有助于植物的生长与根际圈的稳定。在浮板下方悬挂的生物填料能够在短时间内大量聚集好氧硝化细菌与聚磷菌,在微纳米曝气技术下产生的微米气泡会长时间附着于生物填料表面,使生物膜不易脱落,挂膜状态稳定。
该联合技术可以将水体中的![]() 在短时间内氧化为
在短时间内氧化为![]() 降低水体毒性,为亲水植物的生长提供良好环境,在植物吸附能力达到饱和状态时还能利用微生物作用继续进行吸附去除。同时还能有效改善水体的酸碱环境,使实验用水由弱酸性改良至中性,有效抑制藻类的过量繁殖等不良影响。
降低水体毒性,为亲水植物的生长提供良好环境,在植物吸附能力达到饱和状态时还能利用微生物作用继续进行吸附去除。同时还能有效改善水体的酸碱环境,使实验用水由弱酸性改良至中性,有效抑制藻类的过量繁殖等不良影响。
通过本实验证明微纳米曝气-生态浮岛联合技术具有处理周期短,对水体的搅动程度小,短期内可大量聚集硝化细菌与聚磷菌,生物膜挂膜稳定,且模块化组合性强,易于实地施工,造价成本低,利于推广。
[1] 卢进登,帅方敏,赵丽娅,等. 人工生物浮床技术治理富营养化水体的植物遴选[J]. 湖北大学学报(自然科学版), 2005,27(4):402-404.
[2] 周小平,王建国,薛利红,等. 浮床植物系统对富营养化水体中氮、磷净化特征的初步研究[J]. 应用生态学报, 2005,16(11):2199-2203.
[3] LAUREN M. GARCIA C.Aeration and plant coverage influence floating treatment wetland remediation efficacy[J].Ecological Engineering, 2018,122:62-68.
[4] 王芳,张汇文,吴国华,等.生物质碳源组合型生态浮床系统脱氮效果研究[J]. 环境工程学报,2014,8(8):3099-3106.
[5] 陈亚男,郭宗楼,郑水生,等.新型立体浮床处理河道微污染源水的挂膜特征[J].环境工程学报,2013,7(2):477-482.
[6] 邴旭文,陈家长. 浮床无土栽培植物控制池塘富营养化水质[J]. 湛江海洋大学学报, 2001,21(3):29-34.
[7] 谢建华,杨华. 不同植物对富营养化水体净化的静态试验研究[J]. 工业安全与环保,2006,32(6): 23-25.
[8] 潘俊,魏炜,孙舶洋.一种光感主动式立体人工浮岛:中国,CN208071435U[P].2018-11-09.
[9] 孙连鹏,冯晨,刘阳,等. 强化生态浮床对珠江水中氮污染物去除研究[J]. 中山大学学报(自然科学版),2009,48 (4):93-97.
[10] 卢萃云,庞志华,林芳敏,等. 曝气充氧和人工造流技术修复河道污染水体 [J]. 环境工程学报,2012,6(4):1135-1141.
[11] LI M, WU Y J,YU Z L. Nitrogen removal from eutrophic water by floating-bed grown water spinach (Ipomoea aquatica Forsk) with ion implantation[J]. Water Research, 2007,41(14):3152-3158.
[12] SOOKNAH R D, WILKIE A C. Nutrient removal by floating aquatic macrophytes cultured in anaerobically digested flushed dairy manure wastewater[J]. Ecological Engineering, 2004, 22(1): 27-42.
[13] BATTY L C, ATKIN L, MANNING D A. Assessment of the ecological potential of mine-water treatment wetlands using a baseline survey of macroinvertebrate communities[J]. Environmental Pollution,2005, 138(3): 412-419.
[14] HALLER W T. Evaluation of the Ke IP in 800 a quatie weed harvester, Orange Lake, Florida 1995[J].Aquaties,1996, 18 (3): 10-15.
[15] NAKAMURA K, SHIMATANI Y. Water purification and environmental enhancement by artificial floating island[J]. Proceedings of Asia Waterqual in Korea[J]. IANQ, 1997,888-895.
[16] VAILLANT N, MONNET F, SALLANON H, et al. Treatment of domestic wastewater by an hydroponic NFT system[J]. Chemosphere,2003, 50(1): 121-129.
[17] HOEGER S. Sehwimmkam Pen Germany’s article floating islands[J]. Journal of Soil and Water Conservation,1988, 43(4): 304-306.