0 引 言
重金属可导致生物体不同的紊乱,威胁人类健康和生命,由于其不可生物降解的特性、毒性和倾向,即使在痕量水平也被认为是严重的有害污染物,可在生物体中积累[1, 2]。重金属污染已成为全世界最严重的环境问题之一[3, 4]。铜是人体内必不可少的元素之一,也是常见的一类重金属污染物质。人体内摄入过量的铜元素会导致严重的黏膜刺激,毛细血管损伤,肝和肾损害,胃和肠道刺激性,肾损伤等不良反应。为了尽量减少不可避免的健康风险,世界卫生组织(WHO)严格规定铜的最大浓度限值为2 mg/L[5]。
吸附是最常用的去除重金属的方法之一,吸附效果主要取决于吸附剂与吸附设备,而吸附剂是关键因素。应用吸附方法去除重金属在尽可能降低操作成本的同时,应考虑2个重要因素,即再生和再利用。已经开发的各种类型的重金属吸附剂,尽管成本低廉且去除效率良好,然而存在难以回收的技术缺陷[6, 7]。随着纳米技术的快速发展,基于纳米Fe3O4的磁性纳米吸附材料,因其具有较大的比表面积和容易分离等特点,被越来越广泛地应用于各种分离过程。在单一材料中,纳米MnO2具有成本低廉、无毒、比表面积大、吸附能力强,以及在酸性条件下具有良好的化学和物理稳定性等优点,作为用于合成复合吸附剂的替代原料备受关注[8-10]。笔者前期的研究表明,在纳米Fe3O4表面包裹一层新生态纳米MnO2形成的磁性纳米吸附材料Fe3O4/MnO2,相比传统纳米Fe3O4,吸附活性更高、吸附容量更大、对重金属有更好的吸附性能[11]。
通常而言,吸附剂的改性是实现提高吸附剂吸附效率的主要方法之一。聚合物、碳和生物分子通常用于涂覆吸附剂以获得理想的吸附效率[12]。聚丙烯酰胺(PAM)由于其絮凝和吸附桥接的特性,是水处理中广泛使用的高分子量聚合物之一,PAM表面上的极性基团颗粒可用于吸附剂改性。本实验制备了1种磁性复合吸附剂PAM@Fe3O4/MnO2,用于含铜模拟废水的处理,探讨不同影响因素对铜离子去除效率的影响,并且对吸附剂进行了表征分析,以探究吸附剂的物理特性、表面结构和官能团组成,同时对吸附机理进行了初步分析。最后,通过脱附再生实验考察了纳米PFM的可重复利用性能,为实际应用中提供有效的数据支持。
1 材料与方法
1.1 实验水样
实验水样采用模拟水样。硫酸铜储备液的配制:室温下称取3.9281 g CuSO4·5H2O(分析纯),先用烧杯溶于200 mL蒸馏水中,加入1∶1硝酸5 mL,再将溶液转移并稀释至1000 mL容量瓶中定容摇匀,该溶液中的Cu2+浓度为1000 mg/L。根据实验要求稀释制得相应浓度Cu2+溶液。
1.2 PFM吸附剂的制备
第1步,采用水热合成法制备磁性纳米Fe3O4/MnO2;第2步,通过PAM对纳米Fe3O4/MnO2进行包覆制备PFM,首先取100 mL、5 g/L的聚丙烯酰胺溶液倒入250 mL锥形瓶中,再向锥形瓶中缓慢滴加1 mol/L的NaOH至pH为11,再加入0.5 g纳米Fe3O4/MnO2分散均匀后,将锥形瓶放入恒温振荡器中保持25 ℃振荡3 h。振荡完毕后通过外界磁场作用进行固液分离,弃去上清液,放入真空干燥箱于60 ℃下真空干燥12 h,最终得到磁性复合吸附剂PFM。以上所用试剂均为分析纯。
1.3 吸附实验
取50 mL一定浓度的重金属模拟废水,利用1.0 mol/L的HCl溶液和1.0 mol/L的NaOH溶液调节溶液pH值,置于锥形瓶内再加入一定量吸附剂后放入恒温振荡器中,进行25 ℃恒温振荡实验。利用纳米PFM的铁磁性,通过钕铁硼强磁铁对混合液进行磁固相萃取,取上清液经稀释后用火焰原子吸收法测定重金属浓度。
1.4 吸附剂表征
采用型号为PPMS-9T的振动样品磁强计(USM)对所制备的磁性材料的磁性和饱和磁化强度进行分析;采用Nicolet 6700型傅里叶变换红外光谱仪(FT-IR)对磁性材料表面的官能团和分子结构的进行分析;采用X’pert Pro型X射线衍射仪(XRD)对磁性材料的晶型结构进行分析。
2 结果与讨论
2.1 吸附剂投加量对吸附效果的影响
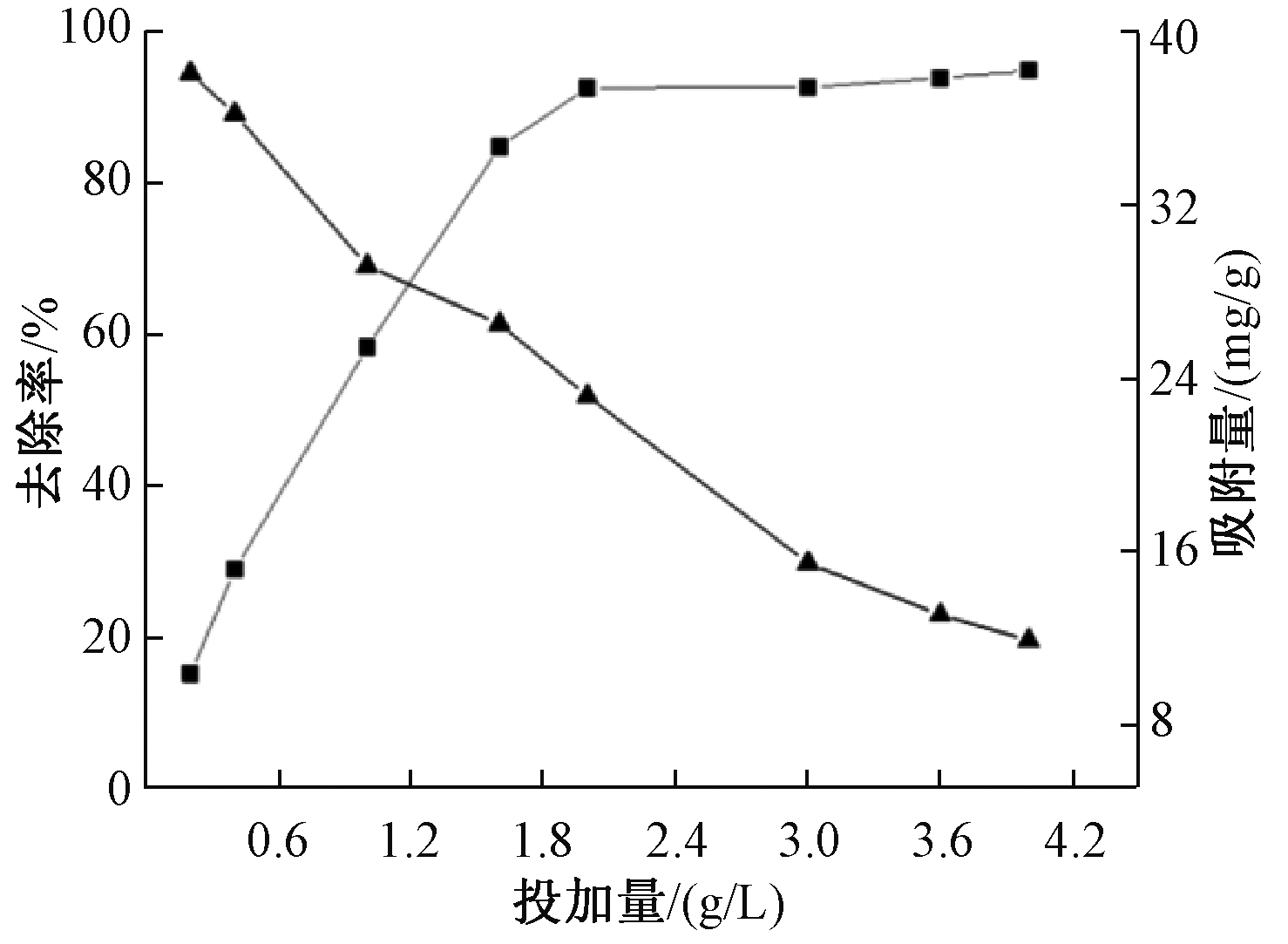
控制溶液pH为6.0、吸附时间为1 h,取50 mg/L的Cu2+溶液50 mL。改变纳米PFM的用量,考察其对Cu2+去除率的影响,结果如图1所示。
![]() —去除率;
—去除率; ![]() —吸附量。
—吸附量。
图1 吸附剂投加量对Cu2+的去除率和吸附量的影响
Figure 1 Effect of adsorbent dosage on removal rate and adsorption capacity of Cu2+
由图1可知:随着纳米PFM用量的增加,对Cu2+的去除效果越明显。在投加量为1.6 g/L时,对Cu2+的去除率迅速升至85%,吸附量达到26.5 mg/g,此后去除率增长缓慢。适量吸附剂的加入增加了吸附活性位点,使得更多的Cu2+被吸附,此后,再继续加大吸附剂的投加量,去除率几乎没有变化并趋于稳定,此时纳米PFM对Cu2+的吸附达到了动态平衡。同时,过多的吸附剂投加量还可能会导致纳米PFM的团聚现象,减少材料表面的活性吸附位点并导致材料产生浪费。纳米PFM的吸附量则随着投加量的增加而逐渐降低,这是由于聚丙烯酰胺拥有絮凝性和黏合性,通常应用于水处理的絮凝剂、增稠剂、纸张增强剂以及液体的减阻剂等,因此经聚丙烯酰胺改性的纳米PFM也具备一定的凝聚和吸附架桥作用,当溶液中纳米PFM增多时,纳米PFM之间更易形成聚集体而沉降,降低了吸附剂的吸附效果。
2.2 溶液初始浓度对吸附效果的影响
控制溶液pH为6.0、吸附时间为1 h,投加0.08 g(1.6 g/L)纳米PFM于50 mL Cu2+溶液中,通过改变Cu2+溶液的浓度,考察其对Cu2+去除率的影响,结果如图2所示。在其他单因素条件相同的情况下,溶液中铜离子初始浓度对Cu2+的去除率影响较大。在初始ρ(Cu2+)为10,20 mg/L时,去除效果明显,分别达到98.88%、97.84%,然而吸附剂的吸附量却分别只有6.18,12.23 mg/g,这是因为吸附剂投加过量导致。随后当溶液中Cu2+初始浓度升高至50 mg/L时,吸附剂吸附量为17.3 mg/g,去除率为55.4%。在初始ρ(Cu2+)为80 mg/L时,吸附剂吸附量达到最大值17.89 mg/g。实验表明,在纳米PFM投加量为1.6 g/L时,其对Cu2+初始浓度在50~80 mg/L的含铜废水的吸附量最大。

![]() —去除率;
—去除率; ![]() —吸附量。
—吸附量。
图2 不同初始浓度对Cu2+的去除率和吸附量的影响
Figure 2 Effect of different initial concentrations on removal rate and adsorption capacity of Cu2+
2.3 吸附时间对吸附效果的影响
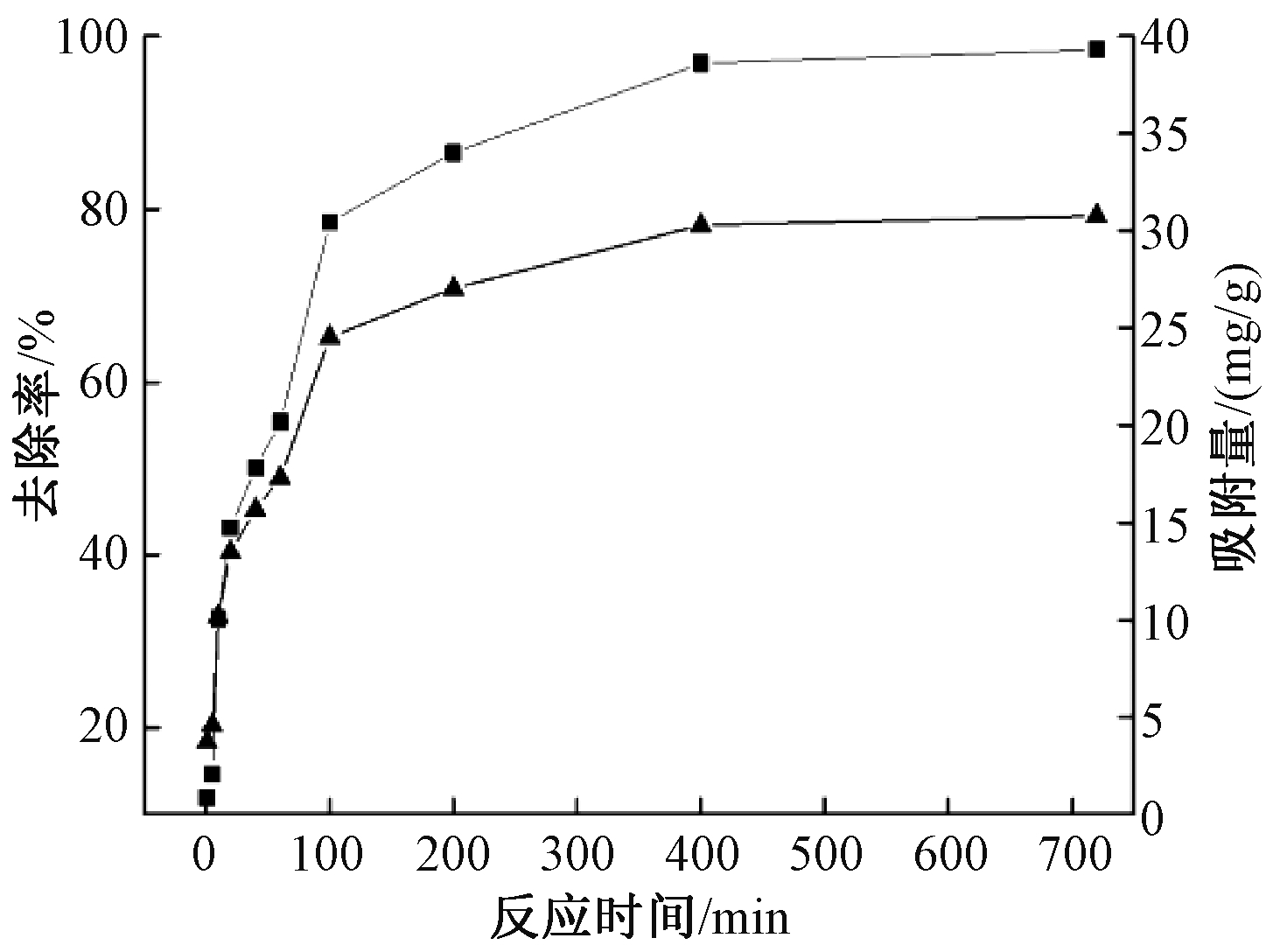
控制溶液pH在6.0,将0.08 g(1.6 g/L)纳米PFM投入50 mL的Cu2+溶液中,使Cu2+浓度维持在50 mg/L不变,改变吸附质与吸附剂的接触时间,考察其对Cu2+去除率的影响,结果如图3所示。吸附剂纳米PFM对Cu2+的去除率及吸附量均随着反应时间的增加而增大。当反应时间为60~100 min时,去除率由55%增至78%。
![]() —去除率;
—去除率; ![]() —吸附量。
—吸附量。
图3 反应时间对Cu2+的去除率和吸附量的影响
Figure 3 Effect of reaction time on removal rate and adsorption capacity of Cu2+
在反应初期(0~200 min),去除率和吸附量迅速增加,之后去除率和吸附量的增速逐渐减缓并趋于平稳。在反应初期,吸附剂表面存在大量的吸附活性位点,吸附速率很快,而随着反应时间的推移,吸附位点也相应饱和,吸附速率变慢,去除率曲线的增长趋势放缓并最终趋于稳定。纳米PFM在反应400 min后,吸附达到饱和,此时吸附剂去除率达到97%,吸附量为30 mg/L,此后吸附量和去除率基本保持不变。
2.4 纳米PFM的再生利用
优异的吸附剂除了要拥有较大的吸附容量与较好的吸附率,还应具有良好的循环使用性能,吸附剂的稳定性及其可重复利用性是考察吸附剂能否在实际中应用的重要指标。本实验中的吸附剂是经过磁性纳米材料改性而得,具有良好的磁性,能通过外界磁场作用快速实现固液分离,这为吸附剂的提取与再生使用提供了便利与前提保证。
脱附再生实验过程如下:1)将0.08 g的纳米PFM投入50 mL质量浓度为50 mg/L的含铜溶液中,在150 r/min的转速下振荡反应1 h;2)通过磁固相萃取分离出纳米PFM;3)向磁性分离出的纳米PFM中加入10 mL质量分数为1 mg/L的NaOH溶液,室温下振荡接触1 h,再经蒸馏水清洗干净后烘干备用。这一过程重复5次。吸附剂的再生次数及其对Cu2+的去除率影响如图4所示,在经过吸附-碱性脱附循环5次后,纳米PFM对Cu2+的去除率仍保持在50%左右,重复利用5次过后,吸附效果由55%逐渐降低至50%,吸附效果下降不明显。这证明纳米PFM具有良好的再生性质,在对去除水环境中重金属离子方面应用前景广阔。
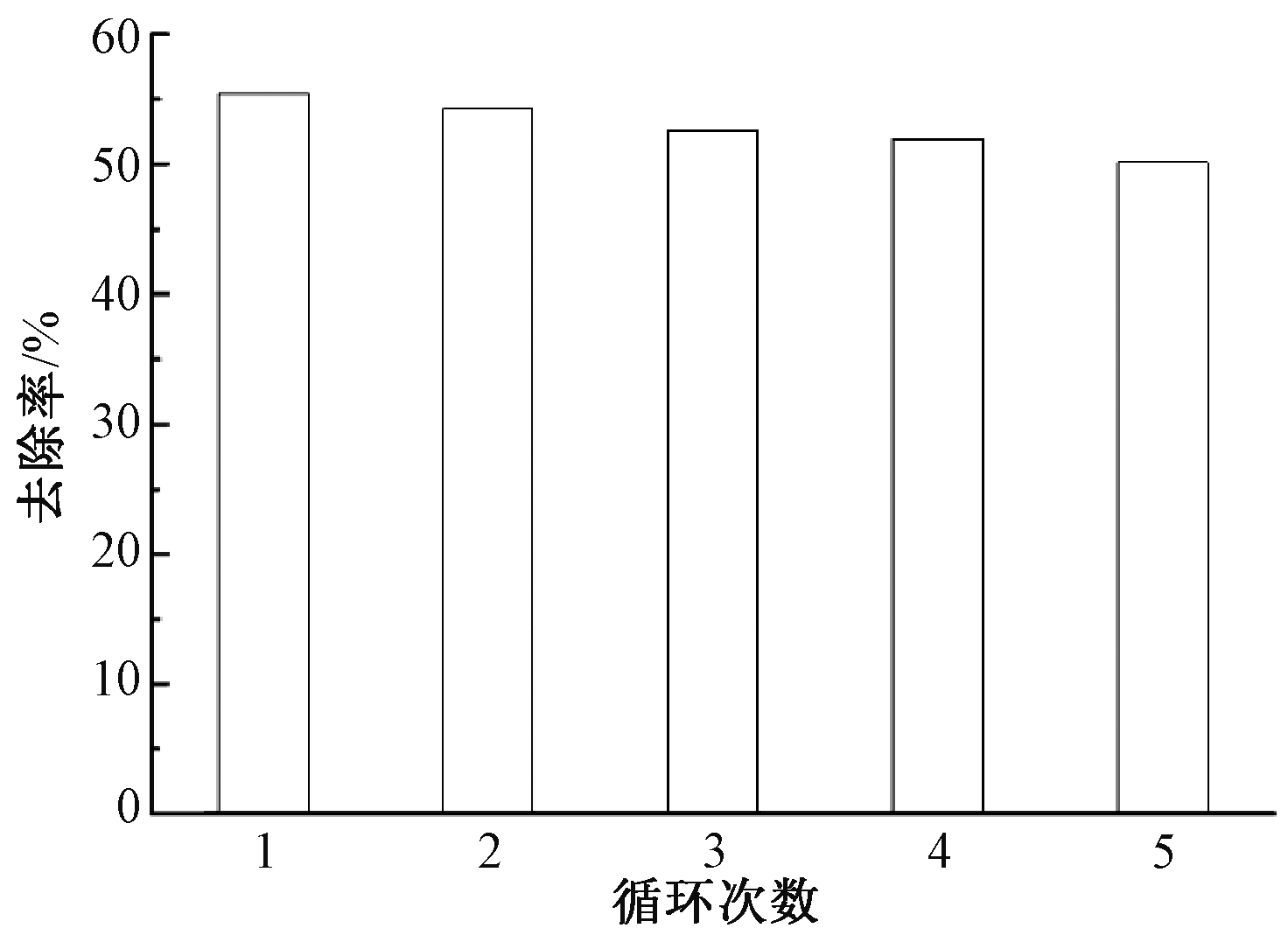
图4 循环次数对Cu2+去除率的影响
Figure 4 Effect of reuse cycles on the removal rate of Cu2+
2.5 纳米PFM的振动样品磁强计表征分析(VSM)
图5为纳米PFM的磁滞回线图。可知:纳米PFM的剩磁和矫顽力均为0,这表明该种磁性纳米材料也显示出超顺磁性,能够在外界磁场的磁性作用下实现固液分离和回收利用。从磁滞回线可看出:纳米PFM的饱和磁化强度为0.32 emu/g。

图5 纳米PFM的磁滞回线图
Figure 5 Hysteresis loop diagram of the prepared nano-PFM
矫顽力是专属于磁性材料磁晶上的特异性指标,其随着材料尺寸的减小而减小。因此,在磁性纳米级材料上磁晶各向的异性变得非常弱,磁矩不会在多个易磁化方向上进行随机的跳跃性动作,这种随机取向使得材料在宏观层面表现为超顺磁性[13]。纳米Fe3O4/MnO2和纳米PFM既具有铁磁性材料在较小外界磁场作用下能产生较大饱和磁化强度的性能,又保留了外界磁场消失后剩磁为零的使用条件,因此这2种磁性纳米材料均具备超顺磁性和铁磁性的优势。
2.6 纳米PFM的X射线衍射表征分析
使用XRD仪来对吸附剂的晶型结构进行表征,图6所示为纳米PFM的XRD图谱。
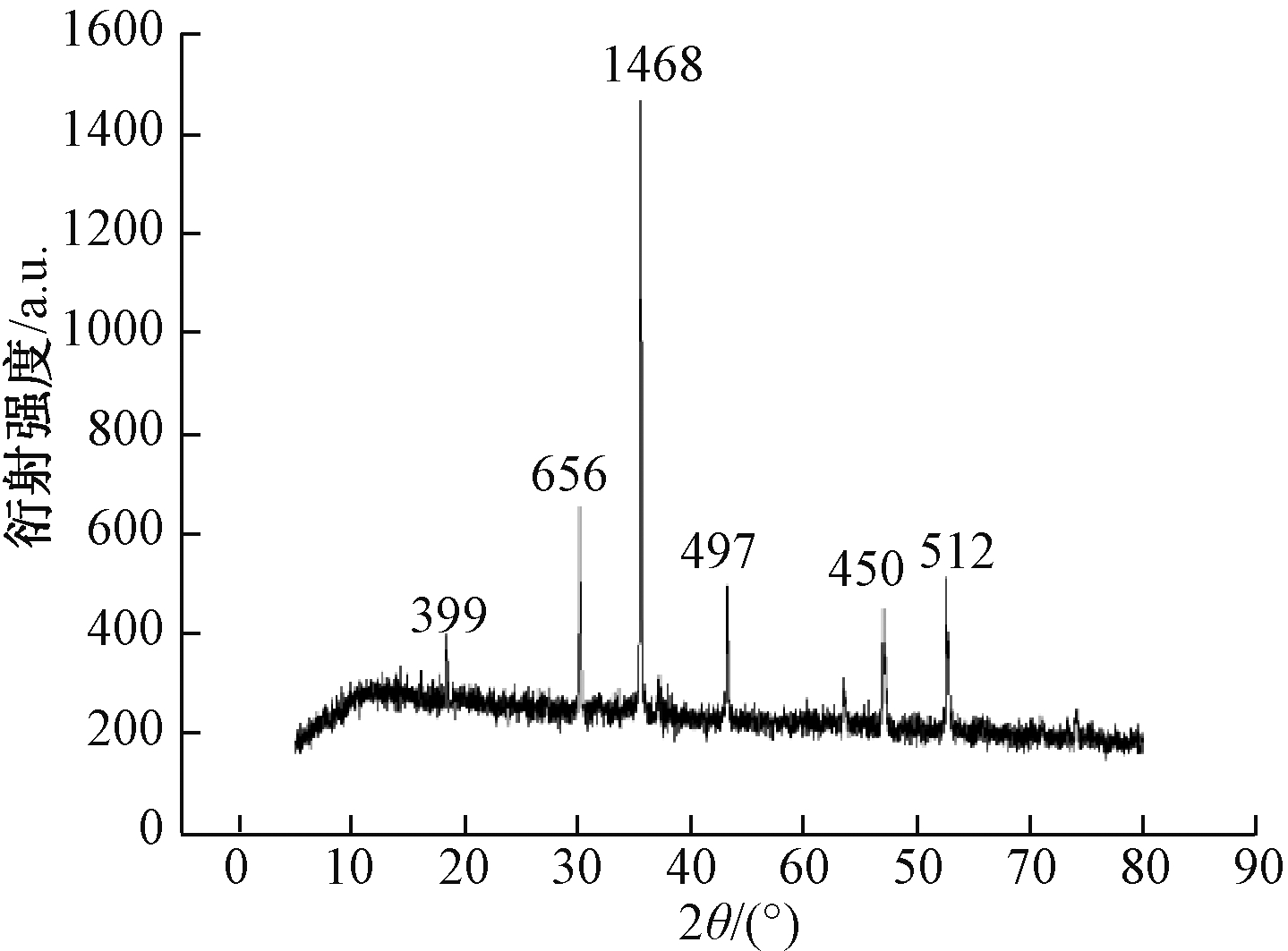
图6 纳米PFM的XRD图
Figure 6 XRD pattern of the prepared nano-PFM
由图6可知:纳米PFM的衍射峰出现于2θ为18.37°、30.16°、35.51°、43.16°、57.02°、62.61°处,其中第1强峰位于35.51°处,与纳米Fe3O4/MnO2的第1强峰处基本一致,改性后的纳米PFM未改变纳米Fe3O4/MnO2中Fe3O4离子的晶型结构,而是附着于纳米Fe3O4/MnO2表面,相当于对纳米Fe3O4/MnO2表面进行了改性。由于聚丙烯酰胺为亲水性物质,改性后的纳米PFM增强了其与溶液中金属离子接触的表面积,有利于对金属离子的吸附。
2.7 纳米PFM的傅里叶变换红外光谱表征分析
纳米PFM的FT-IR分析如图7所示。通过分析光谱图可知,619 cm-1处为Fe3O4的铁氧吸收峰,在3410 cm-1处为O—H表面的羟基振动伸缩峰[14]。纳米PFM红外光谱图中,2027,2361 cm-1附近出现了2个新的吸收峰,对应为聚丙烯酰胺中亚甲基的伸缩振动。羰基的伸缩振动峰由改性前的1560.2 cm-1移至改性后的1632 cm-1处,聚丙烯酰胺中酰胺键的羰基出现,纳米Fe3O4/MnO2成功改性为纳米PFM。
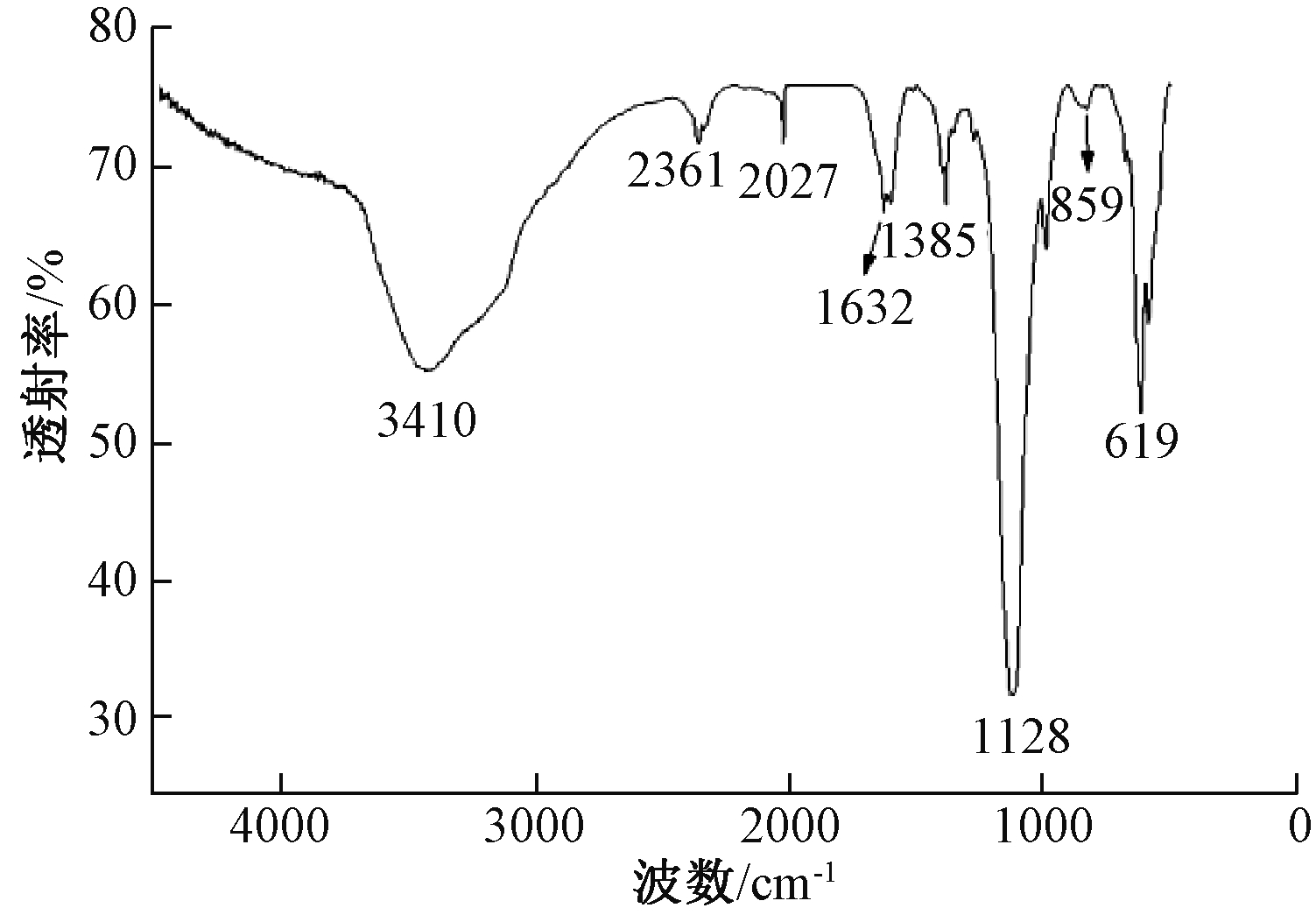
图7 纳米PFM的FT-IR图
Figure 7 FT-IR diagram of the prepared nano-PFM
3 结 论
1)通过水热法分别合成了纳米Fe3O4/MnO2和纳米PFM,并通过XRD、FT-IR证明了纳米PFM的成功制备。
2)通过批量实验探究了制备的纳米PFM对Cu2+的吸附性能:在Cu2+浓度50 mg/L,pH为6.0,吸附剂量1.6 g/L的条件下,400 min后可达到吸附平衡,吸附容量为30.29 mg/g,Cu2+去除率可达到97%。
3)脱附再生实验表明,纳米PFM具有良好的可重复利用性,并且振动样品磁强计(VSM)分析表明纳米PFM具备超顺磁性和铁磁性的优势,可通过外加磁场使吸附剂与溶液迅速分离,便于吸附剂的再生利用。纳米PFM是一种环境友好且重复利用性高的吸附剂,具有良好的应用前景。
[1] GUMPU M B, SETHURAMAN S, KRISHNAN U M, et al. A review on detection of heavy metal ions in water: an electrochemical approach[J]. Sensors and Actuators B: Chemical, 2015, 213(3):515-533.
[2] TAVAKOLI O, GOODARZI V, SAEB M R, et al. Competitive
removal of heavy metal ions from squid oil under isothermal condition by CR11 chelate ion exchanger[J]. Journal of Hazardous Materials, 2017, 334:256-266.
[3] ALHARBI O M L, BASHEER A A, KHATTAB R A, et al. Health and environmental effects of persistent organic pollutants[J]. Journal of Molecular Liquids, 2018, 263:442-453.
[4] 许晓玲,呼世斌,刘晋波,等. 施用污泥堆肥对土壤中重金属累积和大豆产量的影响[J]. 环境工程,2018,36(3):108-111.
[5] IHSANULLAH, ABBAS A, AL-AMER A M, et al. Heavy metal removal from aqueous solution by advanced carbon nanotubes: critical review of adsorption applications[J]. Separation and Purification Technology, 2016, 157:141-161.
[6] YANG B, YU C X, YU Q N, et al. N-doped carbon xerogels as adsorbents for the removal of heavy metal ions from aqueous solution[J]. RSC Advances, 2015, 5(10):7182-7191.
[7] 王丹丹,郑庆荣,侯艳军, 等. 五台山北麓土壤重金属含量的空间分布与污染评价[J]. 环境工程, 2018, 36(3):164-168.
[8] 冯林强, 罗汉金,方伟,等. 纳米二氧化锰/还原态氧化石墨烯复合材料催化臭氧降解苯酚的研究[J]. 环境工程,2016,34(7):56-60.
[9] FANG L, HONG R, GAO J, et al. Degradation of bisphenol A by nano-sized manganese dioxide synthesized using montmorillonite as templates[J]. Applied Clay Science, 2016, 132/133:155-160.
[10] 李廷梅,于鲁冀,叶露阳,等. 改性玉米芯表面特征及其对氨氮的吸附作用研究[J]. 环境工程,2018,36(1):42-46.
[11] LIU Z M, LI X, ZHAN P, et al. Removal of cadmium and copper from water by a magnetic adsorbent of PFM: adsorption performance and micro-structural morphology[J]. Separation and Purification Technology, 2018, 206:199-207.
[12] YANG Q X, SONG H M, LI Y P, et al. Flower-like core-shell Fe3O4@MnO2 microspheres: synthesis and selective removal of Congo red dye from aqueous solution[J]. Journal of Molecular Liquids, 2017, 234:18-23.
[13] SHENG T C, ZHANG Z, HU Y C, et al. Adsorption of phosphorus by using magnetic Mg-Al-, Zn-Al- and Mg-Fe-layered double hydroxides: comparison studies and adsorption mechanism[J]. Environmental Science and Pollution Research, 2019, 26(7):7102-7114.
[14] SALUNKHE A B, KHOT V M, RUSO J M, et al. Synthesis and magnetostructural studies of amine functionalized superparamagnetic iron oxide nanoparticles[J]. RSC Advances, 2015, 5(24):18420-18428.