0 引 言
氮氧化物(NOx)是大气中主要的污染物之一, NOx形式多样,通常包括NO、NO2、N2O3、N2O4等,其中最主要的是NO和NO2[1-3],主要来源于燃煤电厂、工业锅炉/炉窑以及汽车尾气[4]。排放在空气中的NOx可以通过一系列的物理变化和化学变化,形成酸雨、光化学烟雾,加剧温室效应,破坏臭氧层、生态环境,危害人体健康[5, 6]。
目前,NOx减排控制措施主要分为2类:1) 燃烧控制技术,即从源头入手,采用各种手段抑制或还原燃烧过程中产生的NOx,以达到降低其排放的目的;2) 烟气脱硝技术,即脱除烟气中的NOx,主要技术有液体吸收法、固体吸附法、选择性非催化还原法(SNCR)、直接催化分解法、选择性催化还原法(SCR)[5, 7]。其中,SCR技术是目前应用最广泛的烟气脱硝技术,该技术是指在某种特定催化剂作用下,用氨等还原剂选择性地将NOx还原成无毒无害的N2和H2O[7, 8]。催化剂是SCR 技术的核心,V2O5-WO3/TiO2 具有较高的NOx 脱除效率和选择性,是目前工业上应用最为普遍的SCR商业催化剂。然而该催化剂仍具有一些不可避免的问题:活性组分V2O5具有生物毒性,对人体有害;温度窗口较高,一般为300~400 ℃,低温(<300 ℃)活性差[3, 9]。 因此开发新型安全无毒的非钒SCR脱硝催化剂尤为重要。
研究发现,铜基分子筛催化剂在NH3-SCR 反应中具有较好的低温脱硝性能,但分子筛制备工艺复杂,且成本较高[7, 10-15]。而TiO2 载体作为商业化脱硝催化剂的主要载体,具有热稳定性好、抗SO2中毒性能好和价格低、易成型等优点。因此,本文以TiO2 为载体、CuO 为活性组分、WO3为助剂,通过溶胶-凝胶法和浸渍法制备xCuO-yWO3/TiO2,研究CuO、WO3负载量和制备方法对xCuO-yWO3/TiO2催化剂NH3-SCR脱硝性能的影响。
1 实验部分
1.1 催化剂的制备
1)溶胶-凝胶法制备xCuO-yWO3/TiO2-SG催化剂。
将一定质量的Cu(NO3)2·3H2O、WCl6以及3.6 g的钛酸四丁酯溶解于30 mL的乙醇中,并逐滴加入2.3 mL 98%的醋酸以及1.0 mL 36.5%的盐酸。将溶液于30 ℃下搅拌4 h转移至120 mm培养皿中,并在40 ℃、55%RH下挥发6 h,于65 ℃下老化24 h并在350 ℃下焙烧5 h,获得xCuO-yWO3/TiO2-SG催化剂(x,y分别为样品中ω(CuO)和ω(WO3),SG表示制备方法为溶胶-凝胶法)。
2)浸渍法制备2CuO-6WO3/TiO2-IM催化剂。
将0.1813 g的偏钨酸铵、0.05929 g Cu(NO3)2·3H2O以及1 g 商业锐钛矿型TiO2溶解于30 mL的去离子水中,并于30 ℃下搅拌4 h后,在110 ℃下烘干24 h,最后置于350 ℃下焙烧5 h。获得2CuO-6WO3/TiO2-IM催化剂(其中ω(CuO)和ω(WO3)分别为2%、6%,IM表示制备方法为浸渍法)。
1.2 催化剂活性评价
催化剂的NH3-SCR脱硝活性测试评价采用微型常压固定床反应装置。催化剂的用量为0.12 g(40~60目),反应气体组成(体积分数)为:0.05% NO,0.05% NH3,5% O2,5% H2O和0.01% SO2(需要时通入),N2作为平衡气,气体总流量300 mL/min,体积空速约120000 h-1,反应温度:150~350 ℃,采用FTIR(MKS6030HS)气体分析仪在线连续监测进出口气体中各气体组分的浓度。NOx转化率、N2选择性计算公式如下:
NOx转化率![]()
(1)
N2选择性={1-2φ(N2O)outlet/[φ(NOx)inlet+
φ(NH3)inlet-φ(NOx)outlet-φ(NH3)outlet]}×100%
(2)
式中:φ(NOx)=φ(NO)+φ(NO2);inlet、outlet分别为气体进口、出口。
1.3 催化剂表征
比表面积是影响催化剂脱硝性能的一项重要参数,采用美国micromeritics ASAP 2460物理吸附仪,在77 K 条件下测试N2吸附等温线。催化剂样品在测试前,先在350 ℃下真空脱气预处理,然后在77 K 条件下进行测量。通过Brunauer-Emmett-Teller (BET) 公式,计算获得催化剂样品的比表面积,通过Barrett-Joyner-Halenda(BJH)方法计算获得催化剂的孔容和平均孔径。
通过X射线衍射仪(XRD)分析测试样品的晶体结构,采用日本Rigaku公司的 SmartLab 9 kW型X射线衍射仪。测试条件为:采用Cu靶辐射射线,管电压40 kV,管电流40 mA,扫描速度10°/min,扫描范围10~90°。
通过氢气程序性升温还原(H2-TPR)分析催化剂样品的氧化还原能力。采用美国Micromeritics公司的AutoChem 2920型化学吸附仪。利用H2作为还原剂,通过测定不同温度下催化剂样品消耗的氢气量,绘制TCD Signal/Temperature曲线,表征催化剂的氧化还原能力。样品用量为0.1 g,首先将催化剂样品在350 ℃、50 mL/min Ar气氛下预处理1 h,降温至50 ℃,然后切换为10% H2/Ar(总流量为50 mL/min)气体,从50 ℃ 以10 ℃/min的速率程序升温至1000 ℃,记录TCD信号。
通过氨气程序性升温脱附(NH3-TPD)分析催化剂样品的酸性和对NH3的吸附能力。本测试在微型常压固定床反应装置进行,采用FTIR(MKS6030HS)气体分析仪在线连续监测NH3浓度。样品用量为0.1 g,首先将催化剂样品在350 ℃、50 mL/min N2气氛下预处理1 h,降温至100 ℃,然后切换为0.05% NH3,N2为载气(总流量为100 mL/min),直至催化剂样品上NH3吸附饱和,切换为N2吹扫30 min,然后从100 ℃以10 ℃/min的速率程序升温至500 ℃,记录NH3浓度。
通过X射线光电子能谱(XPS)定量分析固体催化剂表面元素价态分布和含量,采用Thermo Fisher Scientific公司EscaLab 250Xi 型X射线光电子能谱仪。所获得的数据通过软件进行分峰拟合处理,从而得到催化剂样品表面上各元素的价态分布。
2 结果和讨论
2.1 催化剂的活性评价
采用溶胶-凝胶法制备不同WO3含量的2CuO-yWO3/TiO2-SG催化剂活性和选择性如图1所示。可知:当WO3的掺杂量达到6%时,NOx转化率在250~300 ℃明显提高,最高可达到97.53%,同时具有较好的N2选择性。进一步提高WO3的掺杂量,发现NOx转化率和N2选择性都明显降低。说明采用溶胶-凝胶法制备的2CuO-yWO3/TiO2-SG催化剂中,WO3的最佳掺杂量为6%。
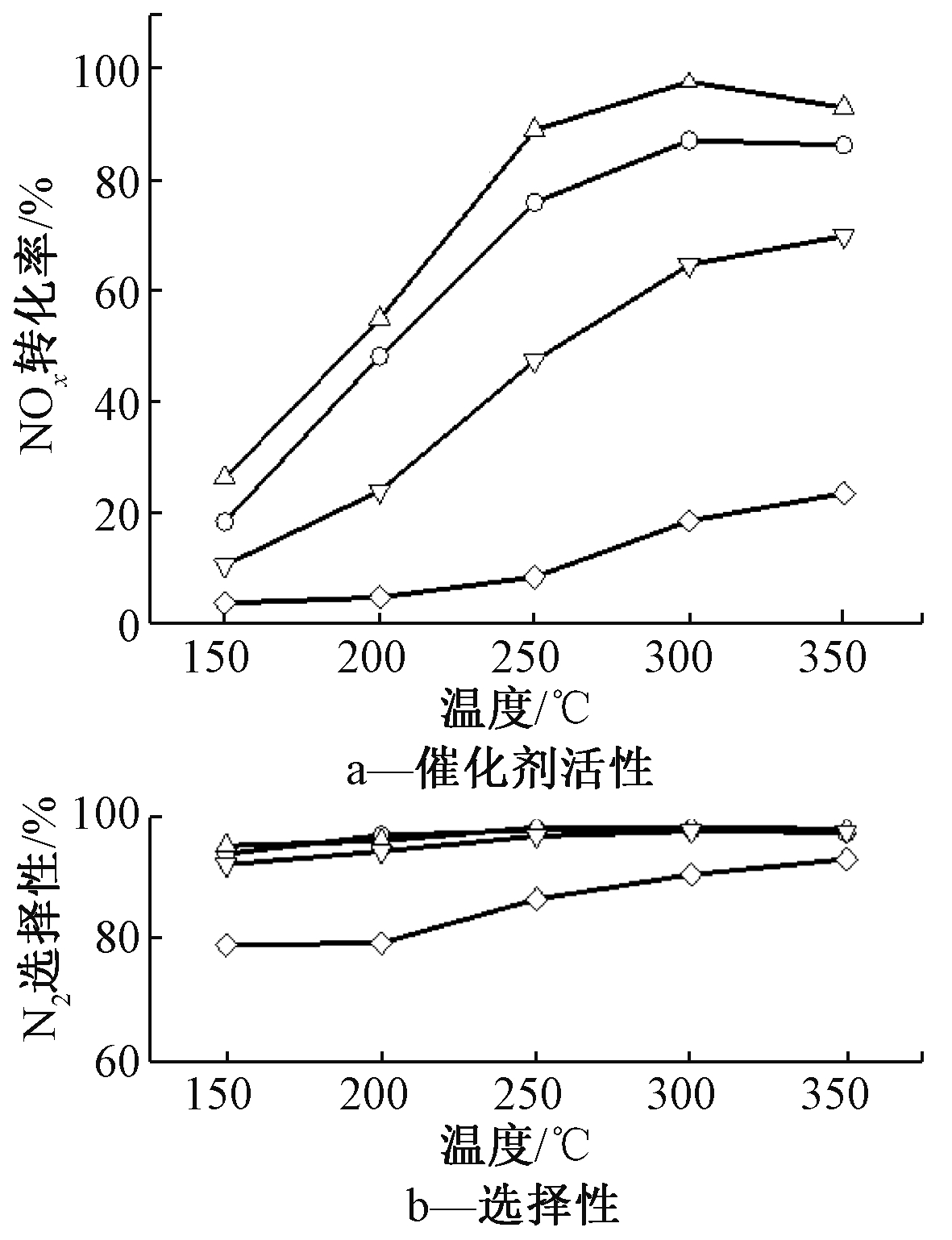
![]() — 2CuO-4WO3/TiO2-SG;
— 2CuO-4WO3/TiO2-SG; ![]() — 2CuO-6WO3/TiO2-SG;
— 2CuO-6WO3/TiO2-SG; ![]() — 2CuO-8WO3/TiO2-SG;
— 2CuO-8WO3/TiO2-SG; ![]() — 2CuO-10WO3/TiO2-SG。
— 2CuO-10WO3/TiO2-SG。
注:反应条件为:0.05% NO,0.05% NH3,5% O2,N2平衡气,体积空速为120000 h-1。
图1 WO3含量对2CuO-yWO3/TiO2-SG催化剂活性和选择性的影响
Figure 1 The effect of WO3 content on NOx conversion and N2 selectivity of 2CuO-yWO3/TiO2-SG catalysts at different temperatures
通过以上研究固定WO3的掺杂量为6%,改变CuO的掺杂量,筛选出CuO的最佳掺杂量。采用溶胶-凝胶法制备不同CuO含量的xCuO-6WO3/TiO2-SG催化剂活性和选择性如图2所示。可知:当CuO的掺杂量为3%时,NOx转化率和N2选择性轻微降低。进一步从节约成本考虑,在溶胶-凝胶法制备的xCuO-6WO3/TiO2-SG催化剂中,CuO的最佳掺杂量为2%。综上,通过溶胶-凝胶法制备的xCuO-yWO3/TiO2-SG催化剂中,2CuO-6WO3/TiO2-SG催化剂具有相对最佳的活性和选择性。

![]() — 6WO3/TiO2-SG;
— 6WO3/TiO2-SG; ![]() — 1CuO-6WO3/TiO2-SG;
— 1CuO-6WO3/TiO2-SG; ![]() — 2CuO-6WO3/TiO2-SG;
— 2CuO-6WO3/TiO2-SG; ![]() — 3CuO-6WO3/TiO2-SG。
— 3CuO-6WO3/TiO2-SG。
注:反应条件为:0.05% NO,0.05% NH3,5% O2,N2平衡气,体积空速为120000 h-1。
图2 不同CuO含量对xCuO-6WO3/TiO2-SG催化剂的活性和选择性的影响
Figure 2 The effect of CuO content on NOx conversion and N2selectivity of xCuO-6WO3/TiO2-SG catalysts at different temperatures
通过溶胶-凝胶法和浸渍法制备的2CuO-6WO3/TiO2催化剂活性和选择性如图3所示。可知:具有相同的CuO和WO3含量情况下,溶胶-凝胶法制备的2CuO-6WO3/TiO2-SG催化剂具有更高的反应活性和选择性,温窗更宽。由活性评价结果得出,溶胶-凝胶法制备的2CuO-6WO3/TiO2-SG催化剂具有较好的NH3-SCR脱硝性能。
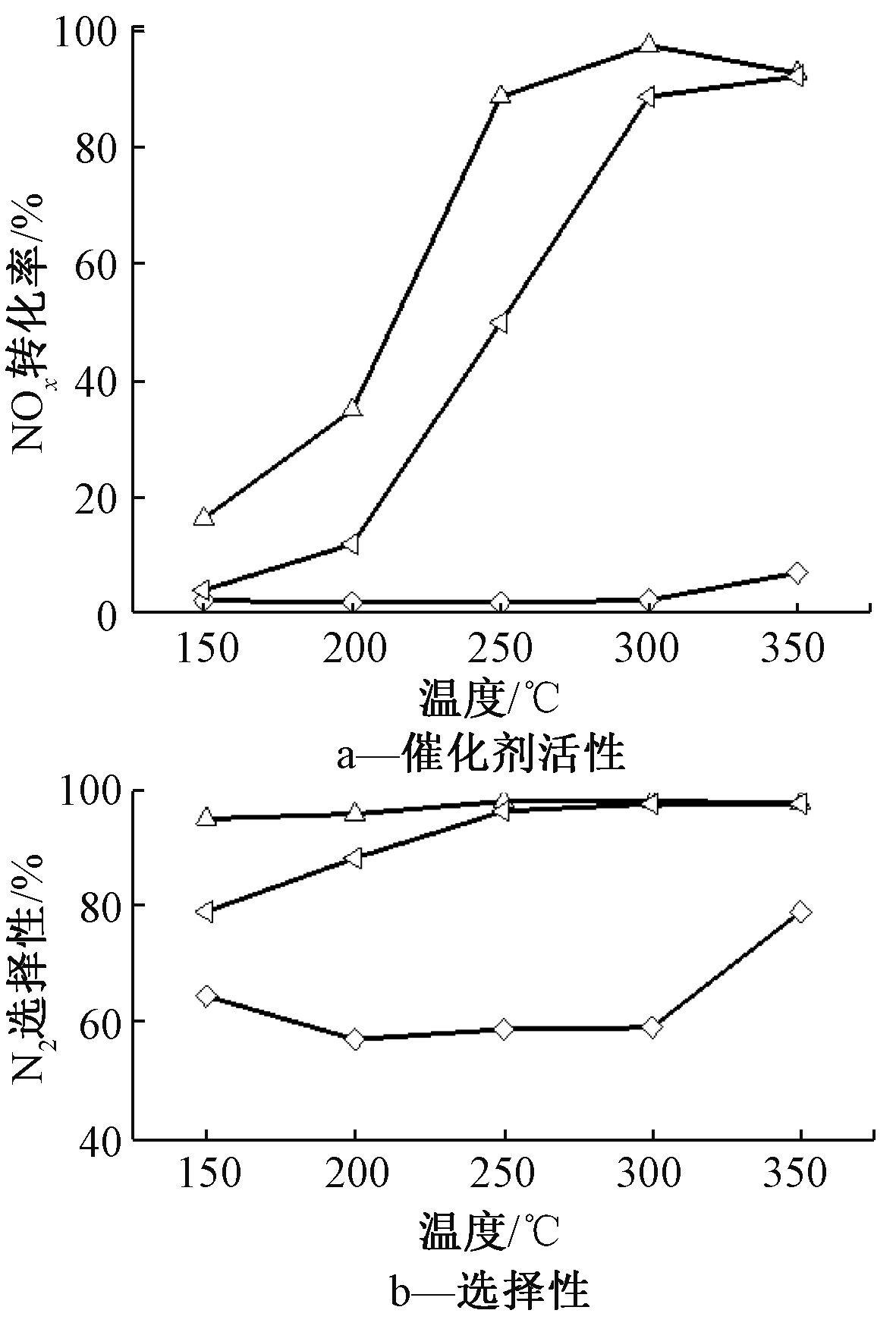
![]() — 2CuO-6WO3/TiO2-SG;
— 2CuO-6WO3/TiO2-SG; ![]() — 2CuO-6WO3/TiO2-IM;
— 2CuO-6WO3/TiO2-IM; ![]() — 6WO3/TiO2-SG。
— 6WO3/TiO2-SG。
注:反应条件为:0.05% NO,0.05% NH3,5% O2,N2平衡气,体积空速为120000 h-1。
图3 不同的制备方法对2CuO-6WO3/TiO2催化剂活性和选择性的影响
Figure 3 The effect of different preparation methods on NOx conversion and N2 selectivity of 2CuO-6WO3/TiO2 catalysts at different temperatures
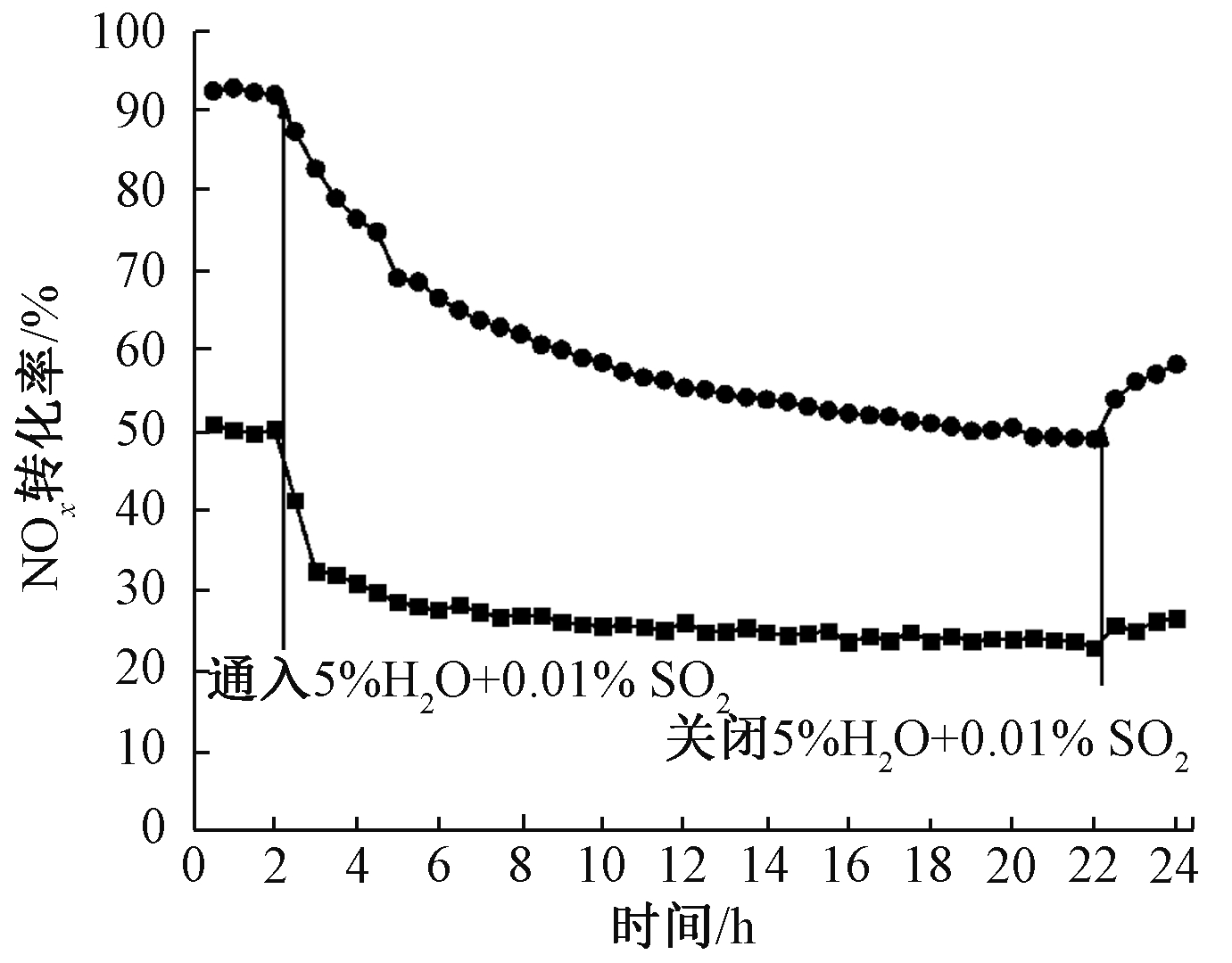
![]() — 2CuO-6WO3/TiO2-IM;
— 2CuO-6WO3/TiO2-IM; ![]() — 2CuO-6WO3/TiO2-SG。
— 2CuO-6WO3/TiO2-SG。
注:反应条件为:0.05% NO,0.05% NH3,5% O2,5% H2O和0.01% SO2, N2平衡气,体积空速为120000 h-1。
图4 250 ℃ 时,H2O和SO2对2CuO-6WO3/TiO2-SG 和 2CuO-6WO3/TiO2-IM催化剂活性的影响
Figure 4 Effects of H2O and SO2 on the activity of 2CuO-6WO3/TiO2-SG and 2CuO-6WO3/TiO2-IM at 250 ℃
由于H2O和SO2是烟气中的典型组分,且影响NH3-SCR催化剂活性。因此,继续研究在250 ℃时,H2O和SO2对2CuO-6WO3/TiO2-SG 和 2CuO-6WO3/TiO2-IM催化剂活性的影响,如图4所示。可知:同时通入H2O和SO2后,2CuO-6WO3/TiO2-SG 和 2CuO-6WO3/TiO2-IM催化剂的NOx转化率明显下降,但2CuO-6WO3/TiO2-SG催化剂活性仍高于2CuO-6WO3/TiO2-IM催化剂。关闭H2O和SO2后,催化剂活性轻微地恢复。H2O和SO2使催化剂中毒的原因可能是:H2O和NH3在催化剂表面存在竞争吸附;SO2和NH3反应形成的(NH4)2SO4附着在催化剂表面,占据其活性位并堵塞孔道;SO2和CuO反应形成CuSO4。
2.2 催化剂性能表征
2.2.1 BET
催化剂的比表面积是影响其催化性能的一项重要参数,表1列出了2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM及6WO3/TiO2-SG催化剂的比表面积、孔径和孔体积。可知:溶胶凝胶法制备的2CuO-6WO3/TiO2-SG催化剂,相对于浸渍法制备的2CuO-6WO3/TiO2-IM,其比表面积和孔容明显增大,而孔径明显降低。比表面积的增大有助于暴露更多的活性位,同时孔容增加有助于提高催化剂对反应气体的吸附,两者均有助于促进NH3-SCR反应特别是低温NH3-SCR反应[16],因此,溶胶凝胶法制备的2CuO-6WO3/TiO2-SG催化剂低温活性明显提高。
表1 2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM及6WO3/TiO2-SG催化剂的BET结果
Table 1 Surface area, pore volume and pore diameter of 2CuO-6WO3/TiO2-SG, 2CuO-6WO3/TiO2-IM and 6WO3/TiO2-SG catalysts
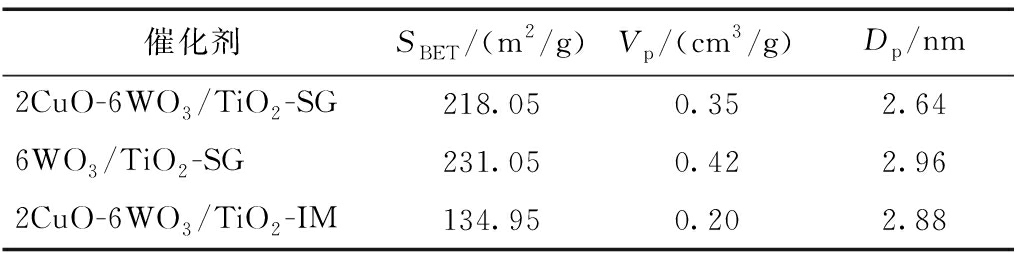
催化剂SBET/(m2/g)Vp/(cm3/g)Dp/nm2CuO-6WO3/TiO2-SG218.050.352.646WO3/TiO2-SG231.050.422.962CuO-6WO3/TiO2-IM134.950.202.88
为进一步研究上述3种催化剂的比表面积和孔隙率,测定了N2吸附-脱附等温线,并对其进行了孔径分布分析,结果见图5。
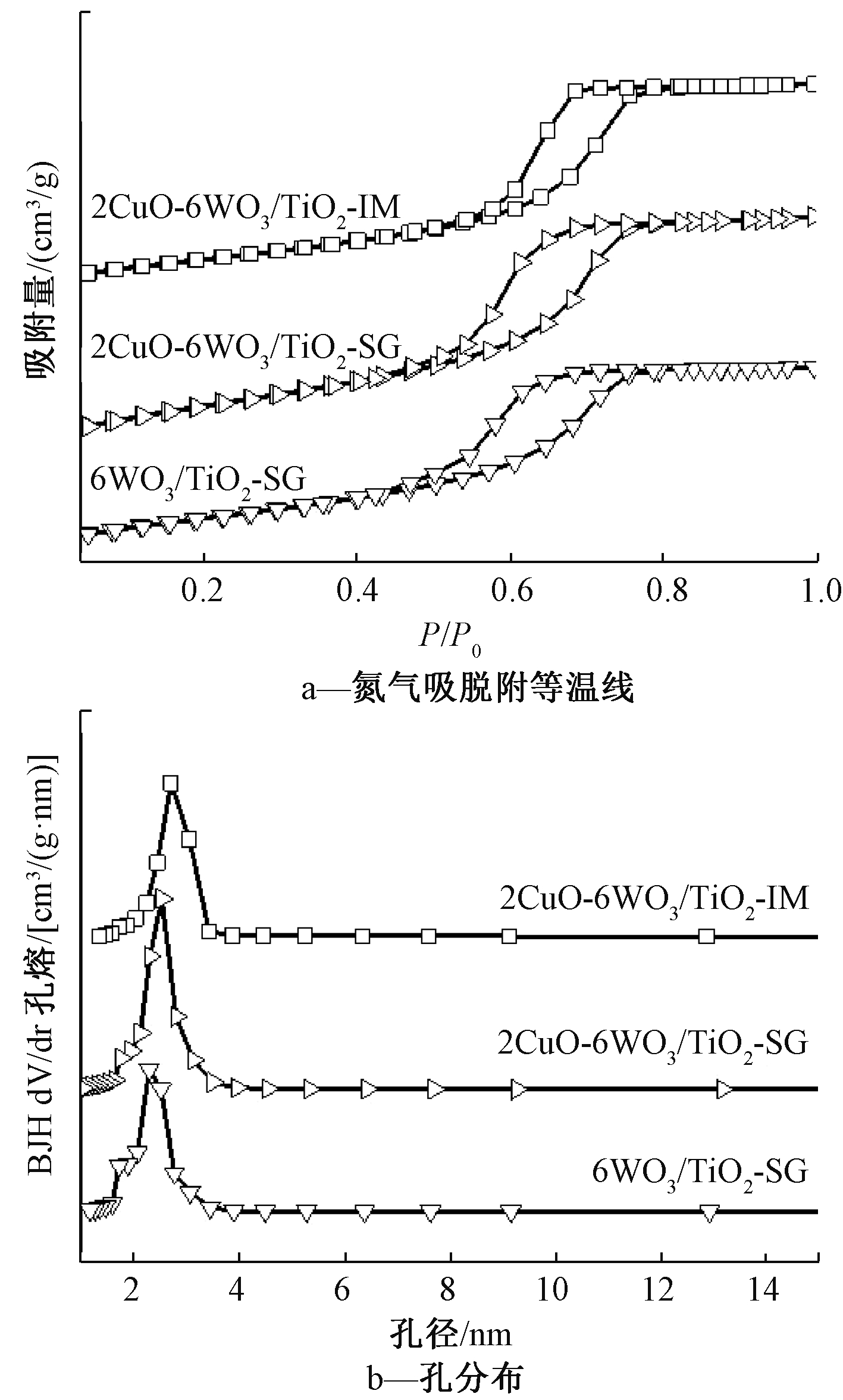
图5 2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM及6WO3/TiO2-SG催化剂的氮气吸脱附等温曲线和孔分布曲线
Figure 5 Nitrogen adsorption-desorption isotherms and pore distribution curve of 2CuO-6WO3/TiO2-SG, 2CuO-6WO3/TiO2-IM and 6WO3/TiO2-SG
如图5a所示:溶胶-凝胶法制备的2CuO-6WO3/TiO2-SG,N2吸附量都有明显的提升。且所有的测试样品氮气吸脱附等温曲线形状基本一致,都为含有H3型回滞环Ⅳ型氮气吸脱附等温曲线,说明样品结构具有介孔结构,这种介孔结构通过图5b的孔分布曲线进一步得到了验证。溶胶凝胶法制备的2CuO-6WO3/TiO2-SG和6WO3/TiO2-SG催化剂,与浸渍法制备的2CuO-6WO3/TiO2-IM催化剂相比孔径明显降低,且产生了部分微孔结构,这与表1的结果基本一致。
2.2.2 XRD
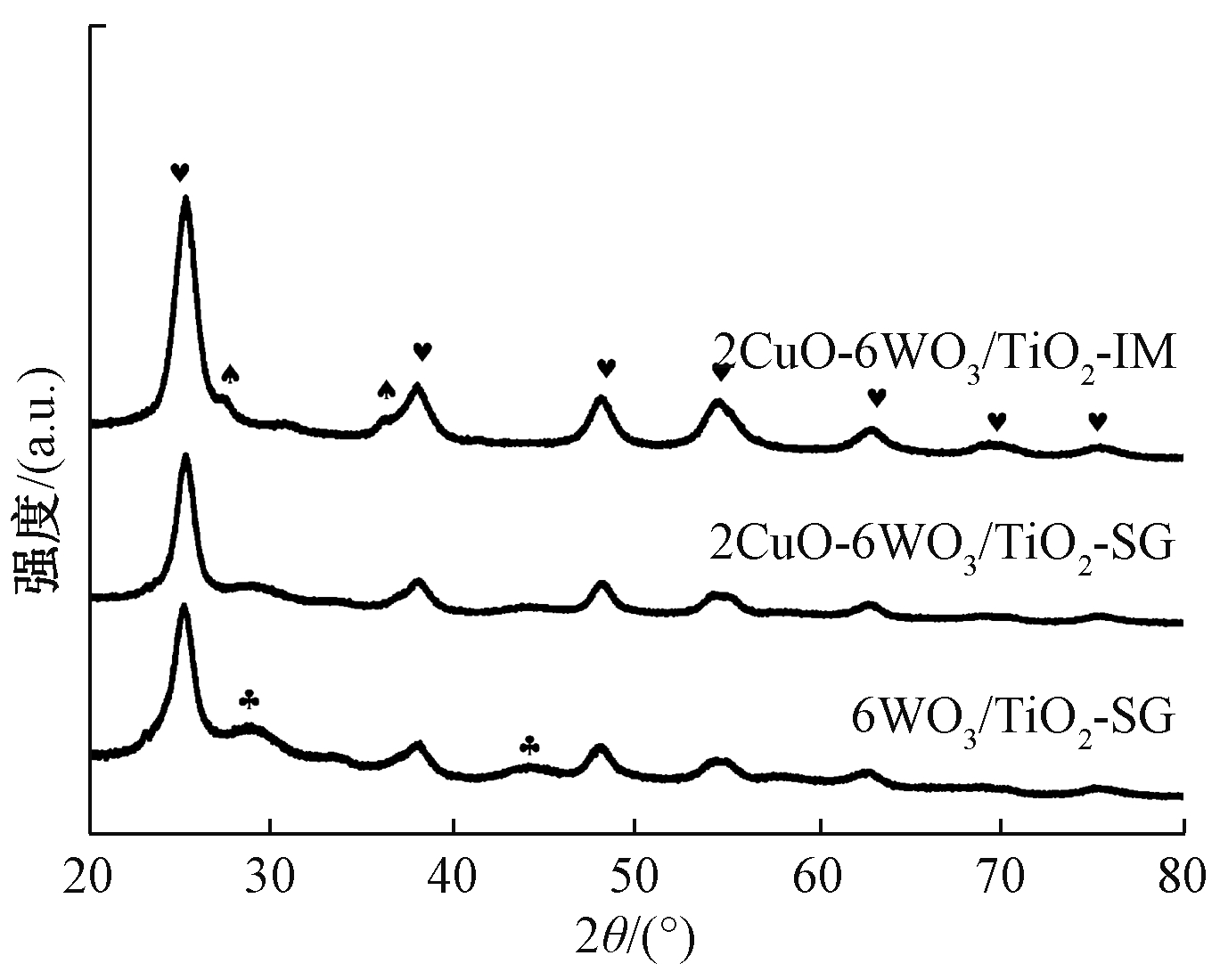
2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM及6WO3/TiO2-SG催化剂的XRD图谱如图6所示。可知:3种催化剂样品主要形成四方晶型锐钛矿TiO2晶体结构(PDF#21-1272),浸渍法制备的2CuO-6WO3/TiO2-IM催化剂上产生了部分金红石相的TiO2晶体(PDF#21-1276),溶胶凝胶法制备的6WO3/TiO2-SG催化剂上产生了WO3晶体(PDF#20-1324)。随着CuO的掺杂,WO3晶体峰消失,说明Cu的掺杂促进钨氧化物种的分散。所有掺杂CuO的催化剂中都没有检测到CuO晶相,可能的原因是CuO的含量太低,仅在催化剂表面形成单层的CuO化合物物种,抑或是CuO高度分散在催化剂表面,未形成晶格体系或者Cu离子进入WO3晶格体系内,形成Cu—O—W共键,因此未检测到CuO晶相的峰[17]。
![]() —锐钛矿 TiO2;
—锐钛矿 TiO2;![]() —金红石 TiO2;
—金红石 TiO2;![]() —WO3。
—WO3。
图6 2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM及6WO3/TiO2-SG催化剂的XRD图谱
Figure 6 XRD patterns of 2CuO-6WO3/TiO2-SG, 2CuO-6WO3/TiO2-IM and 6WO3/TiO2-SG
2.2.3 H2-TPR
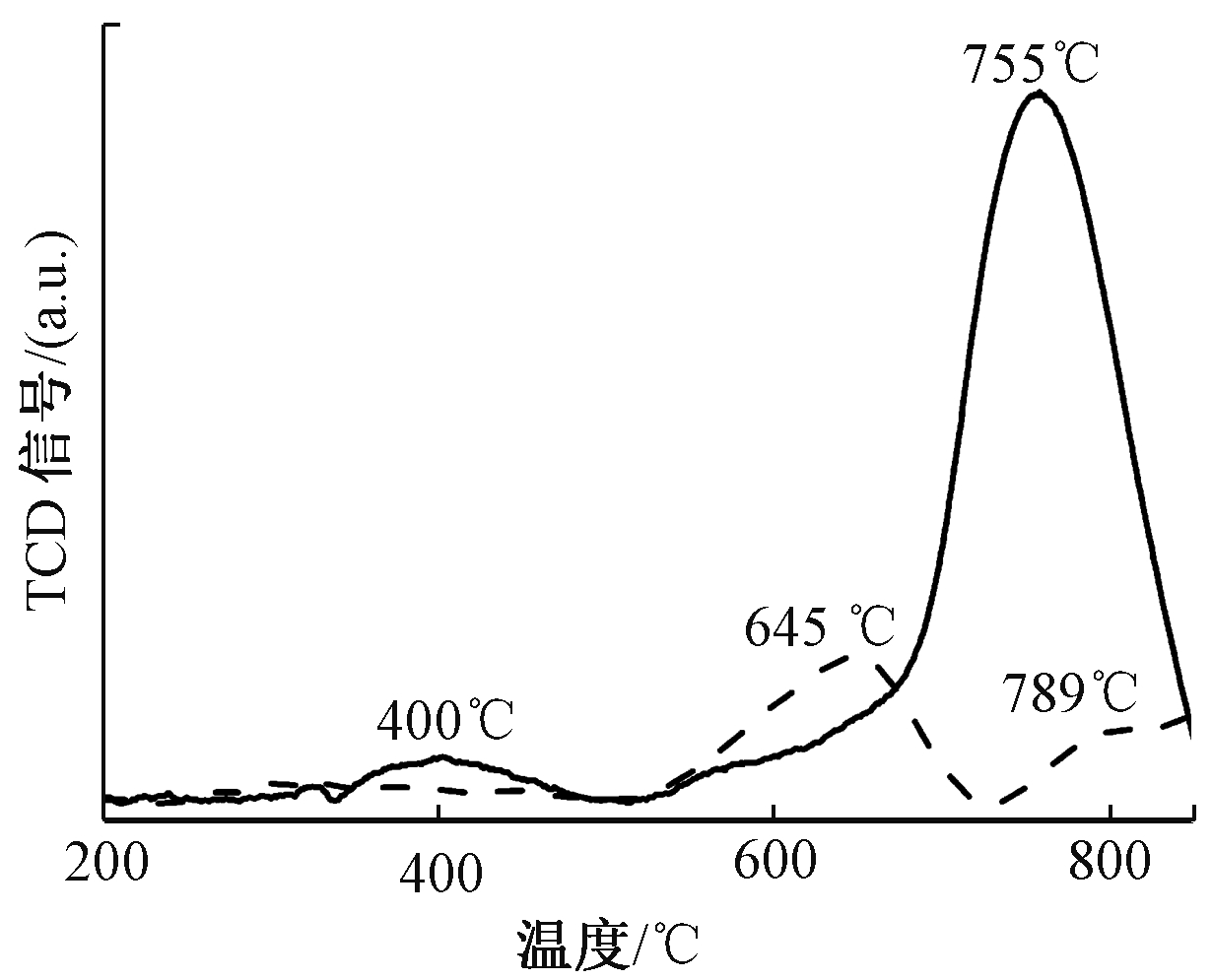
H2-TPR一般用来研究催化剂的氧化还原能力,图7为2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM 2种催化剂的H2-TPR曲线。可知:浸渍法制备的2CuO-6WO3/TiO2-IM 催化剂H2-TPR 谱图上未出现明显的Cu氧化物物种的峰,主要原因是活性组分Cu 负载量较少。其分别在645,789 ℃处出现了2个峰,可归属为WO3→WO2的还原峰[18]。溶胶凝胶法制备的2CuO-6WO3/TiO2-SG催化剂上,在400 ℃处,出现1个还原峰,此峰可归属于CuO和WO3的共还原峰,同时在755 ℃处出现非常强的WO3→WO2的还原峰[19, 20]。以上结果说明,溶胶凝胶法制备的2CuO-6WO3/TiO2-SG催化剂还原峰向低温偏移,同时峰强度明显增强,既还原能力增强,从而促进了NH3-SCR反应。
—— 2CuO-6WO3/TiO2-IM; —— 2CuO-6WO3/TiO2-SG。
图7 2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM催化剂的H2-TPR曲线
Figure 7 H2-TPR profiles of 2CuO-6WO3/TiO2-SG and2CuO-6WO3/TiO2-IM
2.2.4 NH3-TPD
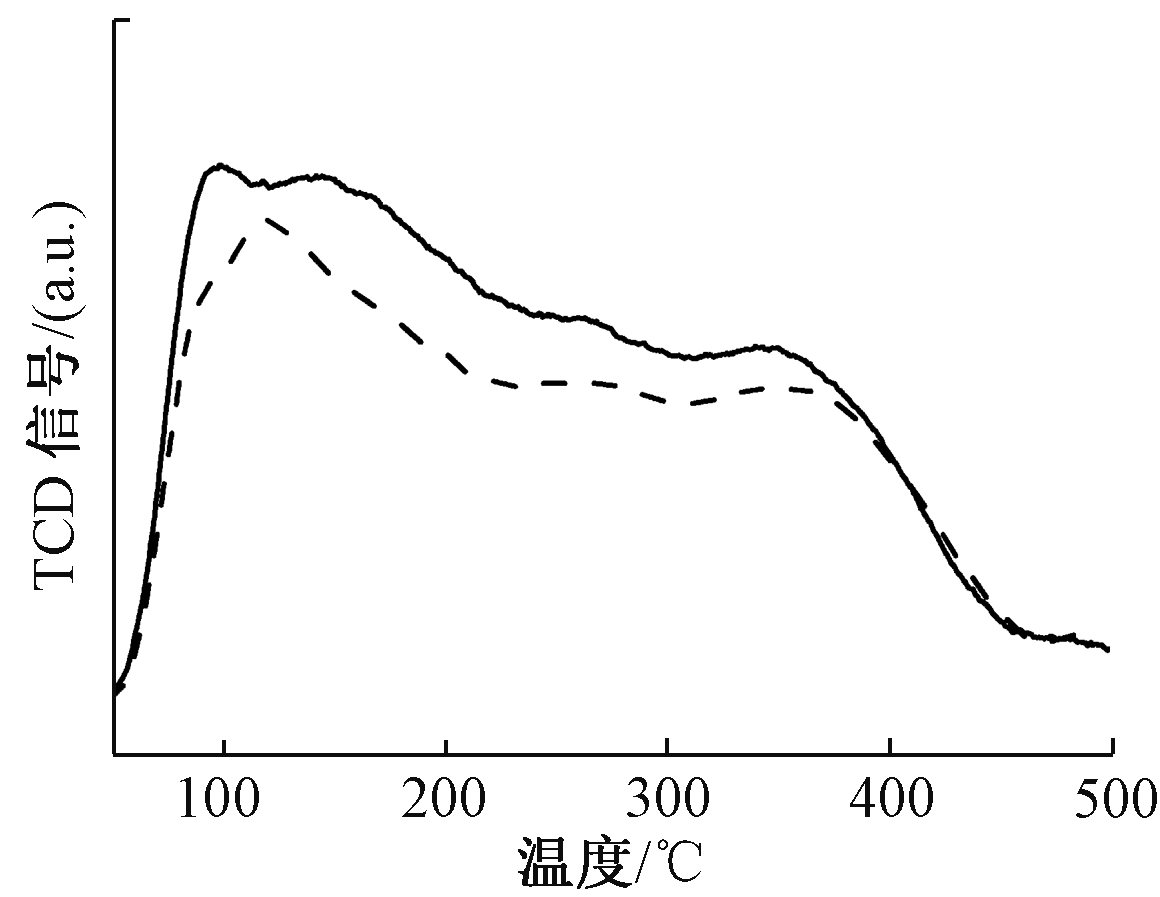
NH3是NH3-SCR反应中重要的反应物,通过NH3-TPD可研究催化剂对NH3的吸附能力及表面酸强度[21, 22]。图8为2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM 2种催化剂的NH3-TPD曲线。可知:溶胶凝胶法制备的2CuO-6WO3/TiO2-SG催化剂NH3的脱附峰强度明显高于浸渍法制备的2CuO-6WO3/TiO2-IM催化剂,对脱附峰进行积分,积分面积可反映NH3的脱附量。浸渍法制备的催化剂脱附峰面积为4.54 (a.u.),溶胶凝胶法制备的催化剂脱附峰面积为5.37 (a.u.),明显大于浸渍法制备。以上结果说明溶胶-凝胶法制备的催化剂促进了NH3的吸附,提高了催化剂表面的酸强度,从而有助于提高催化剂的NH3-SCR活性,这与活性评价结果一致。
—— 2CuO-6WO3/TiO2-IM; —— 2CuO-6WO3/TiO2-SG。
图8 2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM催化剂的NH3-TPD曲线
Figure 8 NH3-TPD profiles of 2CuO-6WO3/TiO2-SG and2CuO-6WO3/TiO2-IM
2.2.5 XPS
为了分析 2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM 2种催化剂O 和W的表面价态含量,对其进行 XPS 表征,并对XPS光谱图进行了分峰拟合,结果如图9所示。O 1s的XPS谱图通常被分为:结合能位于529~530.4 eV的晶格氧(O2-)标记为Oβ;位于531.4~531.6,531.8~532.9 eV的化学吸附氧(O22-或O-)标记为Oα[23, 24]。由图9a可知:2CuO-6WO3/TiO2-SG和2CuO-6WO3/TiO2-IM催化剂中化学吸附氧的浓度[Oα/(Oα+Oβ)]分别为30.6%、16.3%,说明通过溶胶-凝胶法制备的催化剂表面富含丰富的化学吸附氧。由于表面化学吸附氧具有较好的移动性,较为活跃,因此高浓度的表面化学吸附氧有助于NH3-SCR反应的进行。图9b为W 4f的XPS图谱,其中35.8,35.9 eV处的峰归属于W 4f2/7,而37.8,37.9 eV处的峰归属于W 4f2/5,但都是属于W6+的峰[16, 23]。与2CuO-6WO3/TiO2-IM催化剂相比,2CuO-6WO3/TiO2-SG催化剂表面W 4f的峰向低结合能移动,表明溶胶-凝胶法促进了W和Cu、Ti之间的相互作用,使得部分电子发生了转移。这种强相互作用可以诱导更多的表面空位来激活氧和更多的表面羟基参与到SCR反应中。
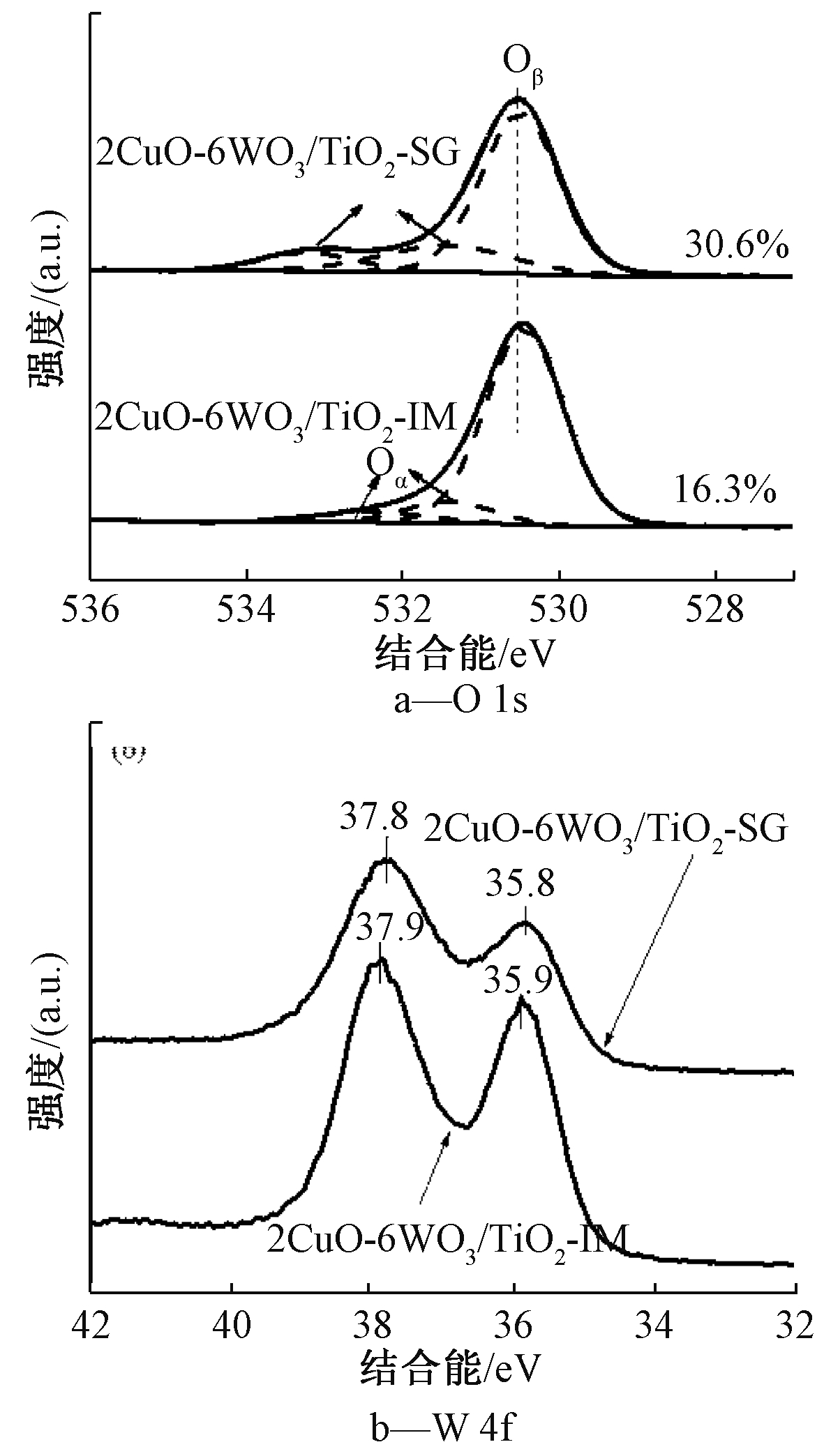
图9 2CuO-6WO3/TiO2-SG、2CuO-6WO3/TiO2-IM催化剂的O 1s和W 4f的XPS光谱图
Figure 9 XPS spectra of O 1s and W 4f over 2CuO-6WO3/TiO2-SG, 2CuO-6WO3/TiO2-IM
3 结 论
采用溶胶-凝胶法制备的xCuO-yWO3/TiO2-SG催化剂,应用于NH3 选择性催化还原NO 反应,发现当CuO和WO3负载量分别为2%和6%时,NH3-SCR反应活性最佳,与浸渍法制备的2CuO-6WO3/TiO2-IM相比,低温活性明显提高。活性评价结果表明:催化剂的比表面积、表面酸性、氧化还原能力和表面吸附氧是影响催化剂脱硝性能的重要因素。通过BET、H2-TPR、NH3-TPD、XPS表征分析,发现溶胶-凝胶法制备的2CuO-6WO3/TiO2-SG催化剂,与浸渍法制备的2CuO-6WO3/TiO2-IM相比,比表面积明显增大,表面化学吸附氧和酸性位增多,氧化还原能力增强。因此,NH3-SCR活性明显提高。
[1] 郝吉明, 马广大, 大气污染控制工程[M]. 2版. 北京: 高等教育出版,2002.
[2] 崔海峰, 谢峻林, 李凤祥, 等. SCR烟气脱硝技术的研究与应用[J]. 硅酸盐通报, 2016, 35(3): 805-809.
[3] 郭坤, 宋常, 张闻涛. 超声波浸渍法制备V2O5-WO3-TiO2选择性催化还原脱硝催化剂[J]. 环境工程, 2016, 31(2): 76-79.
[4] 钟秦. 燃煤烟气脱硫脱硝技术及工程实例[M]. 北京: 化学工业出版社, 2007.
[5] 杨玲, 李茂, 李建军. SCR催化剂的研究进展[J]. 四川化工, 2012(15): 26-29.
[6] 王玉云, 沈岳松, 纵宇浩, 等. Co、Ni掺入对Pd-Rh型催化剂三效净化C3H8、CO、NO的影响[J]. 环境工程, 2015, 33(2): 62-68.
[7] 郭丽颖, 朱林, 庄柯, 等. 钨对高钒燃气脱硝催化剂的改性及SCR反应历程研究[J]. 环境工程, 2019, 37(5): 160-166,172.
[8] 张强. 燃煤电站SCR烟气脱硝技术及工程应用[M]. 北京: 化学工业出版社, 2002.
[9] 努热曼古丽·图尔荪, 古丽戈娜, 张文河,等. CuxO(CuO-Cu2O)纳米球催化剂制备及对CO2电化学还原性能影响的研究[J]. 环境工程, 2016, 34(3): 102-106.
[10] ZHANG H X, ZHANG H B, WANG P C, et al. Organic template-free synthesis of zeolite mordenite nanocrystals through exotic seed-assisted conversion[J]. RSC Advances, 2016, 6: 47623-47631.
[11] YU T, HAO T, FAN D Q, et al. Recent NH3-SCR mechanism research over Cu/SAPO-34 catalystp[J]. The Journal of Physical Chemistry C, 2016, 118(13): 6565-6575.
[12] XIE L J, LIU F D, REN L M, et al. Excellent performance of one-pot synthesized Cu-SSZ-13 catalyst for the selective catalytic reduction of NOx with NH3[J]. Environmental Science & Technology, 2014, 48: 566-572.
[13] WANG C, WANG J, WANG J Q, et al. The effect of sulfate species on the activity of NH3-SCR over Cu/SAPO-34[J]. Applied Catalysis B: Environmental, 2017, 204: 239-249.
[14] CORMA A, LI Z B, NAVARRO M T, et al. Synthesis of nano-SSZ-13 and its application in the reaction of methanol to olefins[J]. Catalysis Science & Technology, 2016, 6(13): 5856-5863.
[15] HAN S, CHENG J, YE Q, et al. Ce doping to Cu-SAPO-18: enhanced catalytic performance for the NH3-SCR of NO in simulated diesel exhaust[J]. Microporous and Mesoporous Materials, 2019,276: 133-146.
[16] NING P, SONG Z X, LI H, et al. Selective catalytic reduction of NO with NH3 over CeO2-ZrO2-WO3 catalysts prepared by different methods[J]. Applied Surface Science, 2015, 332: 130-137.
[17] LI K R, WANG Y J, WANG S R, et al. A comparative study of CuO/TiO2-SnO2, CuO/TiO2 and CuO/SnO2 catalysts for low-temperature CO oxidation[J]. Journal of Natural Gas Chemistry, 2009, 18: 449-452.
[18] PENG Y, LI J H, CHEN L, et al. Alkali metal poisoning of a CeO2-WO3 catalyst used in the selective catalytic reduction of NOx with NH3: an experimental and theoretical study[J]. Environmental Science & Technology, 2012, 46: 2864-2869.
[19] KANG M, PARK E D, KIM J M,et al. Cu-Mn mixed oxides for low temperature NO reduction with NH3[J]. Catalysis Today, 2006, 111: 236-241.
[20] MA Z R, WENG D, WU X D, et al. A novel Nb-Ce/WOx-TiO2 catalyst with high NH3-SCR activity and stability[J]. Catalysis Communications, 2012, 27: 97-100.
[21] SHAN W P, GENG Y, CHEN X L, et al. A highly efficient CeWOx catalyst for the selective catalytic reduction of NOx with NH3[J]. Catalysis Science & Technology,2016, 6: 1195-1200.
[22] LI X S, LI K Z, PENG Y,et al. Interaction of phosphorus with a FeTiOx catalyst for selective catalytic reduction of NOx with NH3: influence on surface acidity and SCR mechanism[J]. Chemical Engineering Journal, 2018, 347: 173-183.
[23] LIU Z M, SU H, CHEN B H, et al. Activity enhancement of WO3 modified Fe2O3 catalyst for the selective catalytic reduction of NOx by NH3[J]. Chemical Engineering Journal, 2016, 299: 255-262.
[24] ZHANG Q L, ZHANG Y Q, ZHANG T X, et al. Influence of preparation methods on iron-tungsten composite catalyst for NH3-SCR of NO: the active sites and reaction mechanism[J]. Applied Surface Science, 2019, 36: 144190.