0 引 言
甲烷是继CO2后造成温室效应的主要贡献者,其增温潜能是CO2的25倍[1-3]。生活垃圾填埋场已被证明是由人类活动引起的最重要的甲烷释放源,控制填埋场甲烷的排放对缓解温室效应具有重要意义。封闭的垃圾填埋场内的环境与海底相似,缺氧且氧化还原电位低,广泛存在甲烷厌氧氧化过程[4]。
目前普遍认为环境中存在3种厌氧甲烷氧化过程。第1种为耦合硫酸盐型厌氧甲烷氧化,Hinrichs等[5]对海底沉积物进行序列分析,首次发现了由硫酸盐还原菌和厌氧甲烷氧化古菌协同完成的厌氧甲烷氧化过程;第2种为耦合硝酸盐型厌氧甲烷氧化,2006年Raghoebarsing等[6]通过同位素示踪手段证实了该过程,2008年Ettwing等[7]发现在厌氧甲烷氧化过程中,即使不存在古菌,也可利用亚硝酸盐进行厌氧氧化,该过程的主导微生物为NC10门菌;第3种为金属还原型厌氧甲烷氧化,2009年Beal 等[8]发现了海洋深层沉积物中耦合锰和铁还原的厌氧甲烷氧化。此外,2017年Valenzuela等[9]利用同位素实验手段表明,可能有耦合腐殖质还原的厌氧甲烷氧化过程。
填埋场稳定化过程分为5个阶段[10],即初始调整阶段、过渡阶段、酸化阶段、甲烷发酵阶段和成熟阶段。第1阶段,填埋气的主要成分是N2;第2阶段,N2含量大大减少,H2开始出现并增加至最大含量;第3阶段H2含量达到最大,填埋场进入酸化阶段;第4阶段产甲烷菌将有机酸以及H2转化为CH4;第5阶段,填埋场进入成熟阶段,垃圾的孔隙增大,填埋气中可能会进入空气,从而又导致N2的含量增加。N2作为大气和填埋场稳定化过程中出现的大量气体,广泛存在于填埋场厌氧甲烷氧化过程中。而H2作为CH4发酵过程的底物,不仅直接参与产甲烷过程,而且直接或间接影响甲烷氧化。
本研究重点考察了H2和N2对甲烷厌氧氧化过程的影响,并探讨了微生物群落结构的变化和响应趋势,为填埋场甲烷气体的减排提供理论基础和技术支撑。
1 实验部分
1.1 实验材料
本实验所用土样取自吉林大学实验楼前草坪,采集的土样过2 mm筛进行预处理,以去除较大石块和黏土;对新鲜土壤直接测定pH、ORP等理化指标。取部分土样于-20 ℃保存用于分子生物学测试。
1.2 实验方法
称取15 g土样置于138 mL培养瓶中,用异丁基胶塞进行密封。分别用N2和H2置换培养瓶中的空气以制造不同的气体氛围,向培养瓶中加入5 mL甲烷,作为培养瓶中初始甲烷含量,然后置于30 ℃生化培养箱中进行培养,定期测量培养瓶中CH4和CO2含量变化。
1.3 分析方法
土样pH采用pH计测量;ORP采用ORP仪进行测量;土壤![]() 采用纳氏试剂分光光度法测定;
采用纳氏试剂分光光度法测定;![]() 采用KCl溶液提取分光光度法测定;CH4、CO2采用岛津GC-2010气相色谱仪进行分析;采用Illumina MiSeq高通量测序技术对微生物群落结构和多样性进行分析。
采用KCl溶液提取分光光度法测定;CH4、CO2采用岛津GC-2010气相色谱仪进行分析;采用Illumina MiSeq高通量测序技术对微生物群落结构和多样性进行分析。
2 结果与讨论
2.1 土壤理化性质
从土壤理化指标(表1)可看出:相对于对照组而言,在N2和H2氛围下,经过CH4长期驯化后,土壤pH、ORP和![]() 均呈现降低趋势;而
均呈现降低趋势;而![]() 则呈升高趋势。测得的土壤理化性质,与典型生活垃圾填埋场研究中的理化性质相比,pH差距不大,氮素含量相对偏低[11];由理化性质推测体系中可能存在好氧硝化、缺氧反硝化、厌氧甲烷氧化以及有机质的矿化作用,需要后续根据微生物分析进行判断。
则呈升高趋势。测得的土壤理化性质,与典型生活垃圾填埋场研究中的理化性质相比,pH差距不大,氮素含量相对偏低[11];由理化性质推测体系中可能存在好氧硝化、缺氧反硝化、厌氧甲烷氧化以及有机质的矿化作用,需要后续根据微生物分析进行判断。
表1 土样理化性质
Table 1 Physical and chemical properties of soil samples

土样pHORP/mVω(NH+4-N)/(mg/kg)ω(NO-2)/(mg/kg)ω(NO-3)/(mg/kg)对照7.552451.5320.06511.076实验6.00372.3720.07440.462
2.2 CH4和CO2动态变化
图1a和图1b是N2氛围下的CH4和CO2随时间变化趋势,图1c和图1 d是H2氛围下的CH4和CO2随时间变化趋势。由图1a和1b可知:在N2氛围下,发生了明显的CH4氧化过程,伴随着产物CO2的生成。而在H2氛围中,CO2有降低的现象,说明在此过程中H2可能参与了反应,而CH4含量也有所上升,证明可能发生了H2还原CO2过程(图1c和1d)。已有研究表明,H2还原CO2是甲烷的一个生成途径(4H2+CO2→CH4+2H2O),大多数产甲烷菌都可以完成该途径,这类产甲烷菌一般被称为氢营养型产甲烷菌,这类产甲烷菌具有以氢气作为电子供体,还原CO2产生CH4的能力[12]。
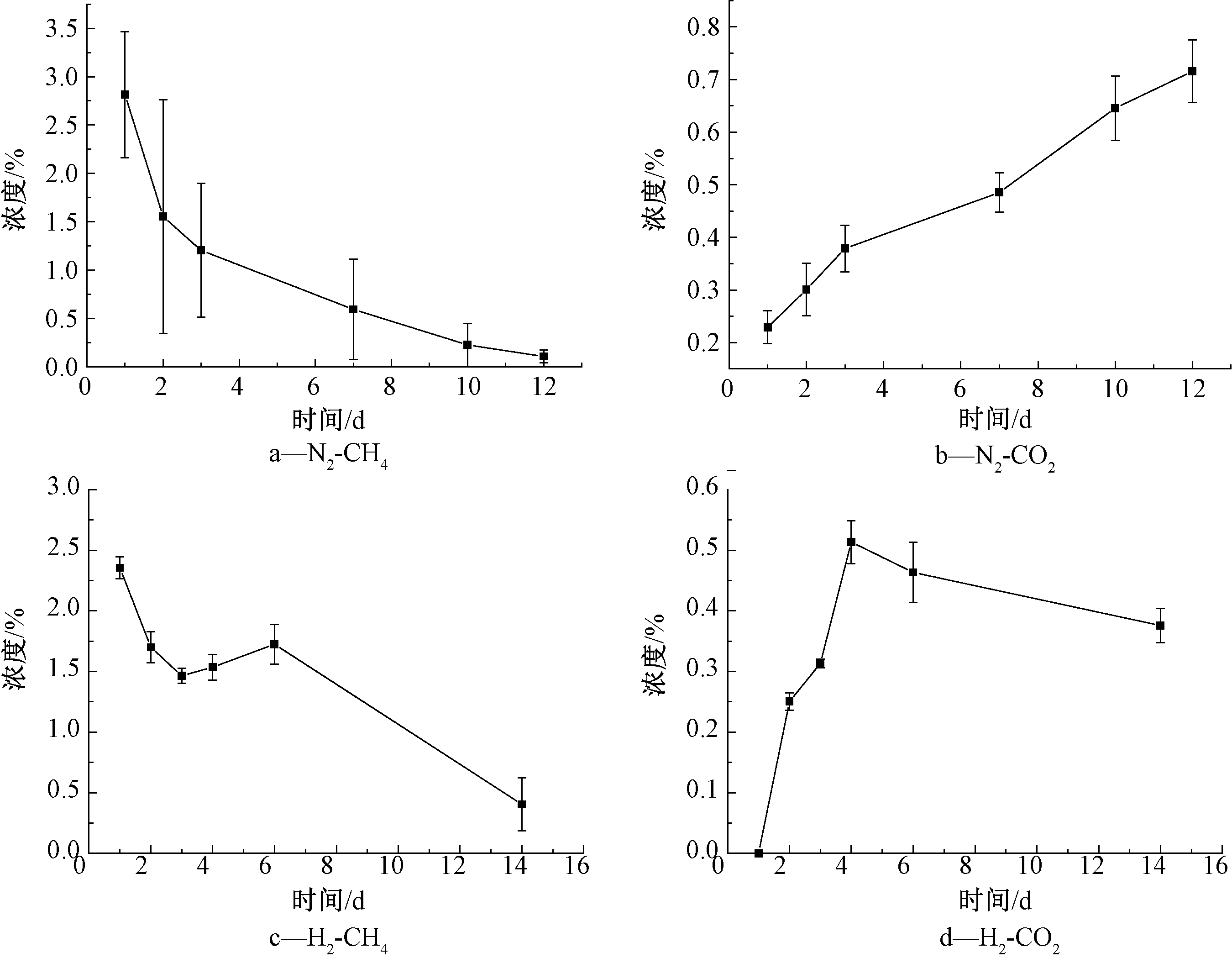
图1 N2、H2气氛下CH4和CO2浓度随时间变化
Figure 1 The relationship between methane, carbon dioxide content and reaction time in nitrogen/hydrogen atmosphere
2.3 微生物群落响应
从高通量测序结果分析,对照样品和实验样品土壤在细菌门水平的相对丰度如图2a所示。可知:对照样本和实验样本的主要微生物类群为Proteobacteria变形菌门、Bacteroidates拟杆菌门、Chloroflexi绿弯菌门、Gemmatimonadetes芽单胞菌门、Actinobacteria放线菌门、Acidobacteria酸杆菌门、Nitrospirae硝化螺旋菌门、Firmicutes厚壁菌门。其中,在对照样本中优势菌门为Proteobacteria、Bacteroidates、Chloroflexi、Gemmatimonadetes,其丰度之和为82.15%;在实验样本中优势菌门为Actinobacteria、Proteobacteria、Acidobacteria、Chloroflexi,其丰度之和为90.51%。实验样本中Actinobacteria大幅度增加,是对照样本的8.4倍,Acidobacteria相对丰度从4.24上升至18.79%,Bacteroidates相对丰度从22.18%下降至1.3%。本实验结果与王晓琳[13]在城市生活垃圾微生物多样性的检测接近,但本实验中和氮循环有关的Actinobacteria大幅增加,与其有显著差别,是由于本实验以N2作为厌氧环境,对氮素循环有重要作用。Firmicutes在厌氧降解和产甲烷阶段有重要作用[14],Proteobacteria中存在很多固氮的细菌,具有氨氧化能力,Chloroflexi中的大多数菌属都具有反硝化能力。
土壤细菌目水平的相对丰度如图2b所示。可知:对照样本和实验样本中相对丰度<1%的物种分别占21.13%和10.76%。对照样本优势菌目为Flavobacteriales黄杆菌目、Xanthomonadales黄单胞菌目、Anaerolineales厌氧绳菌目、Desulfobacterales脱硫杆菌目等,丰度之和为54.63%;实验样本优势菌目为Rhizobiales根瘤菌目、Frankiales弗兰克氏菌目、Soilrubrobacterales土壤红杆菌目、Acidimicrobiales酸微菌目、Micrococcales微球菌目等,丰度之和为47.68%。
土壤细菌科水平的相对丰度如图2c所示。可知:在对照样本和实验样本中的微生物菌群相差较大,在实验样本中Pseudonocardiaceae假诺卡氏菌科、Gemmatimonadaceae芽单胞菌科、Nitrosomonadaceae亚硝化单胞菌科、Methylococcaceae甲基球菌科均大幅增加。其中,Pseudonocardiaceae常在填埋场被检测到,具有反硝化和参与有机质降解的作用[15]。
实验样品和对照样品相比,从门、目、科3个水平的微生物相对丰度变化可知,Acidobacteria菌群增加明显,Acidobacteria类微生物在参与铁循环以及代谢单碳化合物发挥作用[16];Nitrosomonadaceae在氮循环过程中把NH3转化为![]() 和Nitrosomonadaceae等具有硝化、反硝化及固氮作用的菌群相对丰度增加,促进了氮的循环过程;实验样品中也出现了具有甲烷氧化功能的Methylococcale菌群,Methylococcale属于第1类X型甲烷氧化菌,同时具有一定的固氮能力[17,18]。
和Nitrosomonadaceae等具有硝化、反硝化及固氮作用的菌群相对丰度增加,促进了氮的循环过程;实验样品中也出现了具有甲烷氧化功能的Methylococcale菌群,Methylococcale属于第1类X型甲烷氧化菌,同时具有一定的固氮能力[17,18]。
进一步在门、目、科3个水平上进行物种间差异性分析,评估物种丰度差异的显著性水平,获得样本间显著性差异物种。各个样品的物种构成差异如物种分布(图2右)所示。
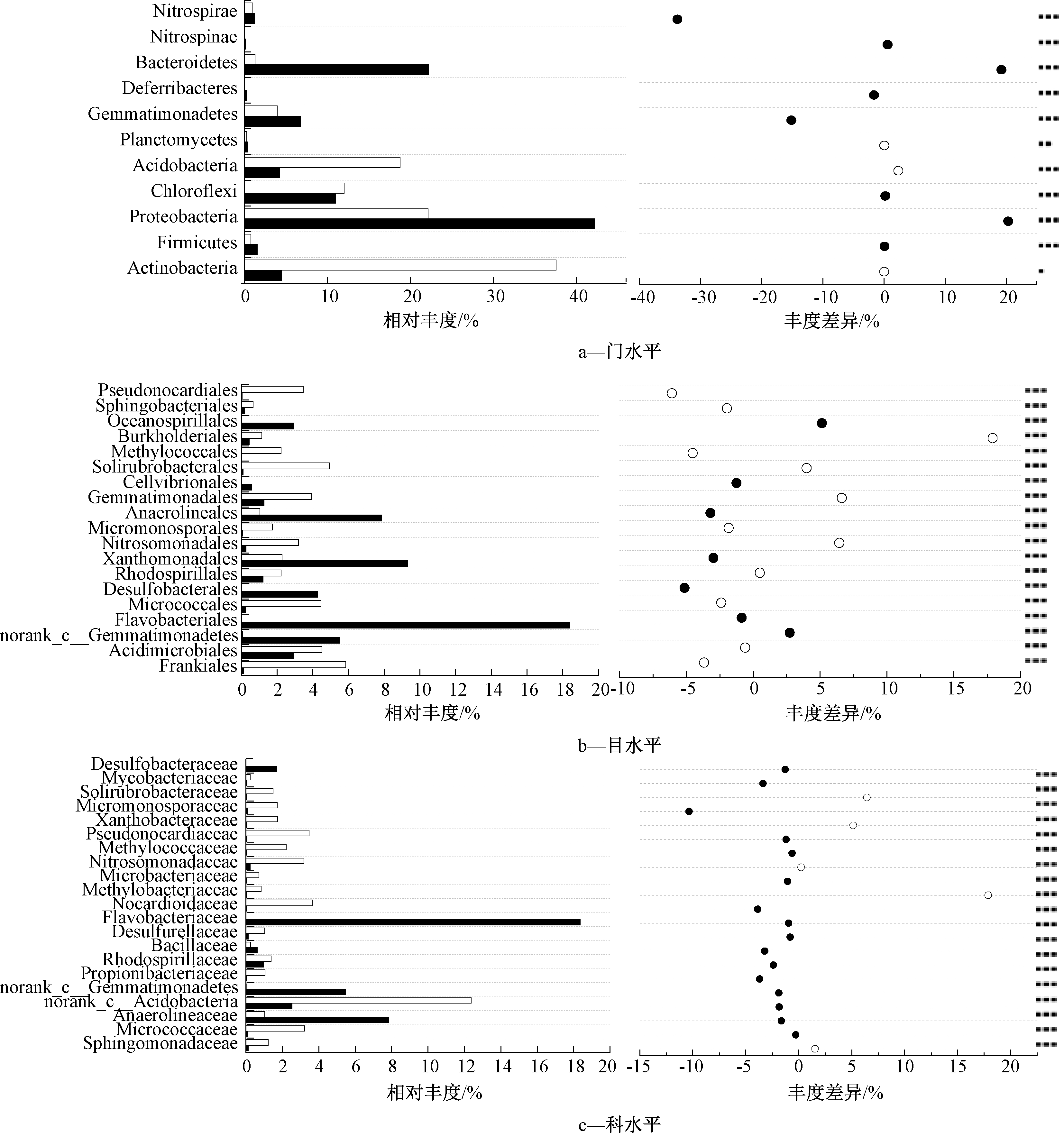
注:P值:*0.01<P≤0.05,**0.001<P≤0.01,***P≤0.001。
图2 不同水平微生物群落结构差异
Figure 2 Difference of microbial community structure
在门水平上可知:Proteobacteria、Bacteroidates、Actinobacteria、Acidobacteria具有显著性差异(P<0.05),实验样本中Actinobacteria、Acidobacteria所占比例增大,而Proteobacteria、Bacteroidates所占比例减小(图2a)。在目水平上,norank-c-Acidobacteria、Rhizobiales、Soilrubrobacterales、Micrococcales、Frankiales、Propionibacteriales等比例增加(图2b);实验样本中,Flavobacteriales相对丰度明显减少,此菌群严格好氧,因此实验样本中不存在;Frankiales、Propionibacteriales相比于对照组相对丰度增加,此类菌群在固氮和发酵代谢过程中起作用[15]。在科水平上,对照样本以Flavobacteriaceae、Anaerolineaceae等为主,实验样本以norank-c-Acidobacteria、Geodermatophilaceae、Pseudonocardiaceae、Gemmatim-onadaceae等为主(图2c);其中在实验样本中出现Nitrosomonadaceae具有NH3为![]() 的作用[19]。
的作用[19]。
从物种差异结果分析可知:对照样本和实验样本微生物结构具有显著差异,实验样本中具有硝化、反硝化及固氮作用的菌群如Soilrubrobacterales、Nitrosomonadales、Gemmatimonadales、Propionibacteriales等增加,表明实验体系内部发生了氮的循环过程。
2.4 CH4氧化与碳氮循环
图3所示为实验过程中C和N循环的耦合过程。可知:CH4在Ⅰ型甲烷氧化菌Methylococcale的作用下被氧化成CO2,CO2又在H2和甲烷厌氧菌还原成CH4;N2被Gemmatimonadales、Rhizobiales等具有固氮作用的细菌转化为NH3,然后在Nitrosomonadales等的硝化作用下,将NH3转化为硝酸盐和亚硝酸盐等,具有反硝化作用的细菌又可进行反硝化作用生成N2。可见,好氧菌(如甲烷氧化菌、硝化菌)对O2的消耗有利于反硝化和厌氧甲烷氧化过程的进行,对反硝化型厌氧甲烷氧化起到积极促进作用。
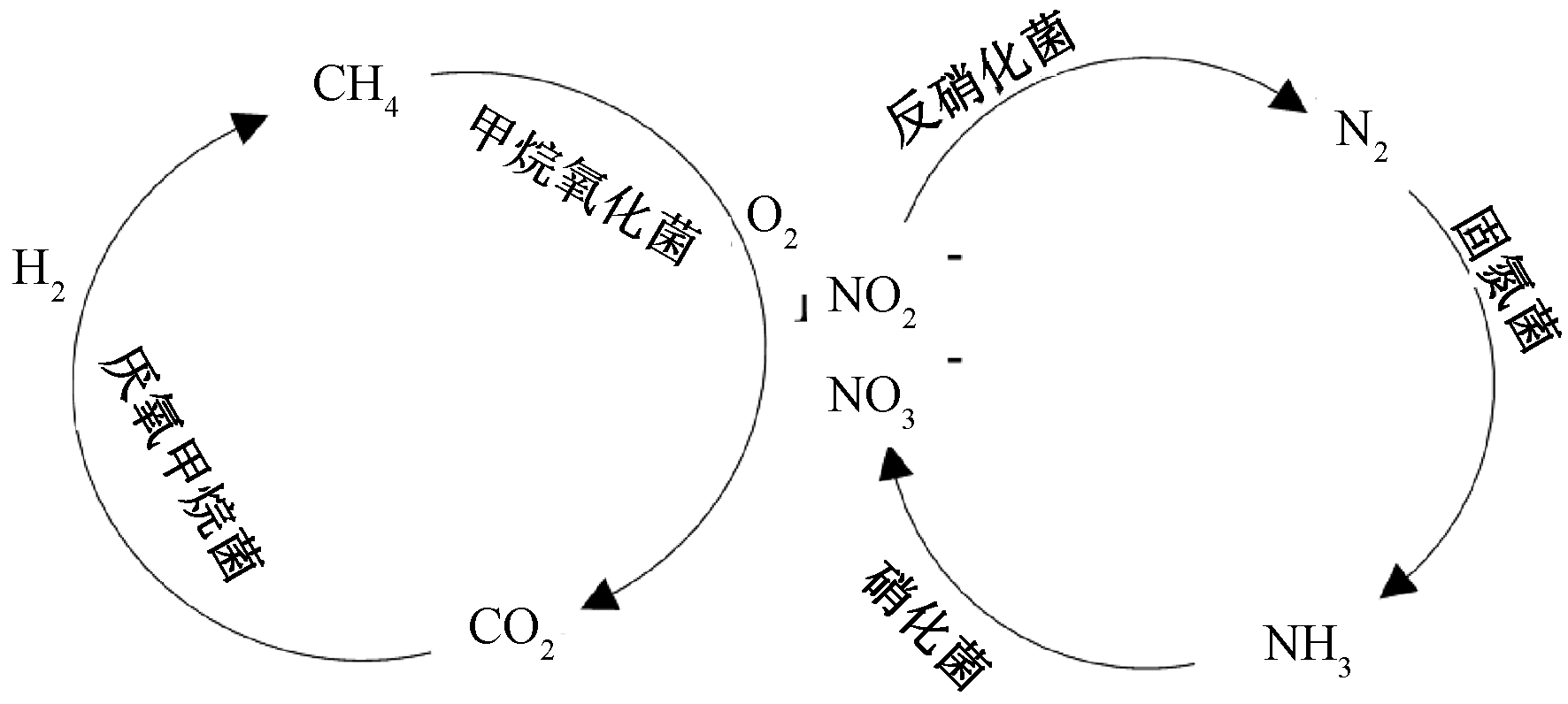
图3 碳氮循环示意
Figure 3 Carbon and nitrogen cycle diagram
3 结 论
1)在N2氛围下, CH4的厌氧氧化过程耦合了固氮、硝化、反硝化的循环过程;而在H2氛围下,微生物分解CH4为CO2后,在产甲烷菌的作用下,H2会进一步利用CO2重新生成CH4,从而导致CH4含量的上升。
2)微生物分析结果表明,经过培养的土壤样品和原土壤样品的微生物组成有较大差异,在实验过程中起主要作用的微生物有Methylobacter Ⅰ型甲烷氧化菌;分解有机物的Actinobacteria菌含量大量增加,此外,Soilrubrobacterales、Nitrosomonadales等硝化反硝化作用的菌群也大幅度增加。
[1] VAKSMAA A, GUERREROCRUZ S, ALEN T A V, et al. Enrichment of anaerobic nitrate-dependent methanotrophic ‘Candidatus Methanoperedens nitroreducens’ archaea from an Italian paddy field soil[J]. Applied Microbiology & Biotechnology, 2017, 101(18):7075-7084.
[2] AMOS R T, BEKINS B A, COZZARELLI I M, et al. Evidence for iron-mediated anaerobic methane oxidation in a crude oil-contaminated aquifer[J]. Geobiology, 2012, 10(6):506-517.
[3] 张超平, 蒋建国, 冯勇, 等. 生物反应器填埋场的发展及应用研究[J]. 环境工程, 2012, 30(1):95-99.
[4] 李玲丽. 复合人工湿地脱氮途径及微生物多样性研究[D]. 重庆:重庆大学, 2015.
[5] HINRICHS K U, HAYES J M, SYLVA S P, et al. Methane-consuming Archaebacteria in marine sediments[J]. Nature, 1999, 398(6730):802-805.
[6] RAGHOEBARSING A A, POL A, VAN D P K T, et al. A microbial consortium couples anaerobic methane oxidation to denitrification[J]. Nature (London), 2006, 440(7086):918-921.
[7] Denitrifying bacteria anaerobically oxidize methane in the absence of Archaea[J]. Environmental Microbiology, 2008, 10(11):3164-3173.
[8] BEAL E J, HOUSE C H, ORPHAN V J. Manganese-and iron-dependent marine methane oxidation[J]. Science, 2009, 325(5937):184-187.
[9] VALENZUELA E I , PRIETO-DAV , ALEJANDRA, et al. Anaerobic methane oxidation driven by microbial reduction of natural organic matter in a tropical wetland[J]. Applied & Environmental Microbiology, 2017,AEM.00645-17.
, ALEJANDRA, et al. Anaerobic methane oxidation driven by microbial reduction of natural organic matter in a tropical wetland[J]. Applied & Environmental Microbiology, 2017,AEM.00645-17.
[10] 王罗春, 赵由才, 陆雍森. 垃圾填埋场稳定化及其研究现状[J]. 城市环境与城市生态, 2000,13(5):36-39.
[11] 何芝, 赵天涛, 邢志林, 等. 典型生活垃圾填埋场覆盖土微生物群落分析[J]. 中国环境科学, 2015, 35(12):3744-3753.
[12] 李媛, 岳秀萍, 韩钰洁, 等. 产甲烷厌氧污泥降解含氮杂环化合物动力学与微生物种群的分析[J]. 环境工程学报, 2016,10(7):3884-3890.
[13] 王晓琳. 城市生活垃圾填埋场微生物多样性与甲烷、氨气减排研究[D]. 北京:北京林业大学, 2016.
[14] SONG L Y,WANG Y Q,ZHAO H P,et al.Composition of bacterial and archaeal communities during landfill refuse decomposition processes[J]. Microbiological Research, 2015,181:105-111.
[15] ANDRES M GOMEZ, ANTHONY C YANNARELL, GERALD K SIMS, et al. Characterization of bacterial diversity at different depths in the Moravia Hill landfill site at Medellín, Colombia[J]. Soil Bidogy and Biochemistry, 2011,43(6):1275-1284.
[16] 王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2):14-20.
[17] 曹淑贞, 沈媛媛, 王风芹, 等. 土壤甲烷氧化菌群落结构研究进展[J]. 生物学杂志, 2017,34(6):78-82.
[18] 蔡朝阳, 何崭飞, 胡宝兰. 甲烷氧化菌分类及代谢途径研究进展[J]. 浙江大学学报(农业与生命科学版), 2016, 42(3):273-281.
[19] 宋瑞静, 于静洁, 王少坡, 等. 厌氧氨氧化技术应用研究进展[J]. 环境工程, 2014,32(增刊1):237-242.