0 引 言
AM真菌与植物共生形成丛枝结构,增大了植物根系及根系表面积,强化了双方之间的营养物质交换[1,2],密切影响宿主植物的生长和发育[3,4]。氮素是玉米生长发育所必需的营养元素之一,可影响玉米的生长发育、产量、品质以及抗逆性等,因此快速、准确地监测氮素含量已成为现代农业研究的热点。利用高光谱数据进行植被氮元素含量估测是农业遥感研究的重要方向,接种AM真菌以促进植物生长也是微生物修复的一个重要作用,陈书琳等[5]将高光谱技术与微生物修复作用相联系,通过植被叶绿素[6,7]含量的估测,发现AM真菌对寄主植物氮和磷吸收的贡献超过80%[1]。
本试验将估测重点放在叶片全氮含量上。国内外关于高光谱监测植被氮素含量的研究较多[8-10]。王树文[1]等采用敏感波段和植被指数构建了不同阶段冬小麦的叶片氮素含量定量监测模型。吴伟斌等[12]选择与氮含量相关系数较高的高光谱特征变量作为自变量,分别采用线性、指数、对数和抛物线表达式建立氮含量的回归模型,取得较好的估测结果。本文以玉米作为研究对象,分析了不同的接菌处理对其生长、全氮含量与光谱特征参数相关性的影响,并采用逐步回归分析法建立了玉米叶片全氮含量的估测模型,意在为接菌条件下的植被氮素估测建立高拟合度的模型,为实现以高光谱遥感技术动态高效监测微生物修复效果提供参考。
1 材料与方法
1.1 供试材料与设计
供试土壤为黑黏土,取自内蒙古自治区呼伦贝尔市宝日希勒矿区,沙土为普通河沙土,经过1 mm筛,用高压灭菌锅灭菌2 h,杀灭土壤中的土著菌根真菌后风干备用。将m(沙土)∶m(黏土)以3∶1配比,使土壤基质更适宜植物生长。其中,黑黏土的基本理化性状为:速效磷的含量为2.68 mg/kg,速效钾的含量为75.62 mg/kg,pH值为7.42,EC值为294 μS/cm。沙土的基本理化性状为:速效磷的含量为6.13 mg/kg,速效钾的含量为50.38 mg/kg,pH值为7.48,EC值为52.5 μS/cm。试验用盆尺寸为20 cm(口径)×16 cm(底径)×22 cm(高)。供试玉米种子为品糯28号,供试菌种为摩西管柄囊霉(Funneliformis mosseae)。
试验共设置2个处理,分别是空白对照(CK)和接种AM真菌处理(M),每个处理设置9次重复,共18盆。试验于2018年5月1日种植,采用穴播的方式播种,将50 g菌剂均匀撒在穴中,然后进行正常的播种种植。采用NH4NO3、KH2PO4、K2SO4作为底肥,使土壤中氮、磷、钾的含量分别达到100,10,150 mg/kg。每盆播种玉米种子3棵,出苗后定苗为1株。土壤湿度为田间持水的70%~80%,所有处理在中国矿业大学(北京)的日光温室中培养。
1.2 数据采集方法
1.2.1 光谱数据的采集
分别将玉米叶片分为上、中、下3层,对应新、中、老3种不同叶位的叶片。使用地物光谱仪对3个不同叶位的叶片进行光谱数据采集,使用SVC HR-1024i型全波段地物光谱仪采集叶片光谱反射率信息,测量时间为2018年7月6日。光谱测定中使用仪器内置光源,为消除环境变化对仪器的影响,每隔0.5 h用白板进行1次校正。每片叶子选取3个采样点,每个采样点采集3个光谱数据,取其平均作为1个样本结果。
1.2.2 生理生化指标的测定
对玉米叶片进行光谱数据采集后,同时用SPAD-502型便携式叶绿素仪在光谱采样点进行叶绿素含量测定,每个采样叶片上同样采集测定3次,取平均值作为叶片叶绿素含量。将地上部分的叶片分为上、中、下3层进行收获,同时收获其地下根系,80 ℃烘干至恒重测定玉米干重。采用曲利苯兰染色[13],使用常规方法测定根系的菌根侵染率[14]。叶片营养元素含量测定,先进行H2SO4-H2O2消煮,用凯氏定氮法测定叶片全氮含量,用电子感耦合等离子体发射光谱仪测定叶片全磷和全钾含量。
1.3 数据处理
试验光谱数据使用SVC HR-1024i PC进行重采样等初步处理。采用九点加权移动平均法[15]对实测光谱进行去噪处理。光谱数据的均值及光谱特征参数计算、其他理化指标的均值和标准误的计算均采用 Microsoft Excel 2010,同时采用 SPSS 22.0对数据进行统计分析。对光谱特征参数和全氮含量进行双变量相关性分析。对指标各处理数据采用单因素方差分析。根据方差结果采用最小显著差数法(LSD)进行多重比较,显著性差异水平为 0.05。
1.4 逐步回归分析法
逐步回归分析是多元统计分析的一种,它以高光谱数据或者其变换形式作为自变量,以植被的生理参数为因变量,建立多元回归线性模型[16-18]。逐步回归筛选并剔除引起多重共线性的变量,减少了因为自变量过多而造成剩余标准差过大的可能性,逐个引入与某一指标关系最密切的因子,从而筛选出一种较好的函数表达式,保证反演模型的稳定与准确。试验利用与全氮含量显著相关的光谱特征参数作为输入变量,全氮含量作为输出变量,利用 SPSS 软件建立逐步回归模型,将验证数据输入,验证模型精度。
1.5 光谱特征参数选取
根据前人研究成果[8-12],选取表1中16个估测植物氮含量常用的光谱特征参数,进行相关性分析及不同处理下玉米叶片全氮含量反演建模。
表1 估测植物氮含量的常用光谱特征参数
Table 1 Common spectral characteristic parameters to estimating TN Content

特征参数公式比值植被指数SR(533,565)=R533/R565光化学植被指数PRI=(R570-R531)(R570+R531)红边位置指数REP内插REP=700+40×(R670+R780)2-R700 R740-R700归一化叶绿素指数NPCI=(R680-R430)(R680+R430)归一化叶绿素比值指数NPQI=(R415-R430)(R415+R430)简单比色素指数SRPI=R430/R680归一化色素差值指数PSNDc=(R800-R470)(R800-R470)植被色素比率PPR=(R550-R440)(R550+R450)结构不敏感色素指数SIPI=(R800-R445)(R800-R680)双峰冠层植被指数DCNI=(R800-R445)(R800-R680)×(R800-R680+0.03)改善角度植被指数MCARI=[R700-R670-0.2(R700-R550)]×R700R760转换叶绿素吸收植被指数TCARI=3(R700-R670)-0.2×(R700-R550)×R700R760 归一化氮指数NDNI=lg1R1510-lg1R1680 ÷lg1R1510-lg1R1680 植被衰减指数PSSRI=(R680-R500)R750GM1GM1=R750/R550GM2GM2=R750/R700
注:Ri为i对应波段的反射率,即R533是波长为533 nm时的反射率。
2 结果与分析
2.1 接种AM真菌对玉米生长的影响
接种AM真菌后,玉米的生物量和叶片含水率提高,且均达到显著差异[19],其中,生物量显著提高了19.2%。对照组的菌根侵染率为0,接菌组则达到95.56%,见表2。
表2 接种AM 真菌对玉米生物量、叶片含水量和菌根侵染率的影响
Table 2 Effects of AM fungi inoculation on maize biomass, leaf water content and mycorrhizal infection rate
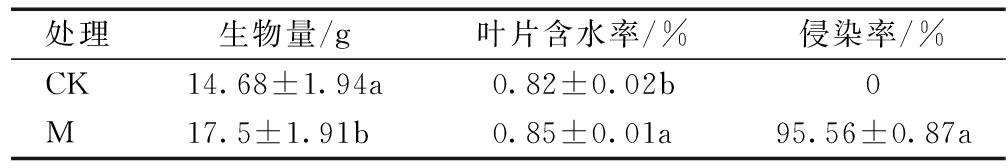
处理生物量/g叶片含水率/%侵染率/%CK14.68±1.94a0.82±0.02b0M17.5±1.91b0.85±0.01a95.56±0.87a
注:同一个处理下的小写字母表示在0.05水平上有显著差异, 数值为均值±标准误差。
相同处理下,叶绿素含量呈现老叶>中叶>新叶,且老叶均与新叶呈显著差异。叶片全磷含量呈现老叶<中叶<新叶,且老叶与新叶在CK和M 中均差异显著。叶片全氮含量为中叶>新叶>老叶,相同处理下不同叶位差异均不显著。全钾含量为中叶>老叶>新叶,CK中不同叶位差异不显著,M中新叶与老叶、中叶呈显著差异。
接种AM真菌后,各对应叶位下叶绿素、全素含量均升高。接种AM后就叶绿素而言,各叶位均呈显著差异。其中,老叶较CK叶绿素含量提高了22.1%,中叶提高了27.8%,新叶提高了16.7%,即接种AM真菌对中叶的叶绿素含量提升效果更明显。就叶片营养元素含量而言,接种AM真菌后,全磷含量各叶片类型均达到显著差异,特别是中叶M较CK显著提高了116%,全氮和全钾中叶显著升高,分别提高了10%和20%,见表3。
表3 接种AM真菌对不同叶位玉米叶片生长的影响
Table 3 Effects of AM fungi inoculation on leaf growth of maize at different leaf positions
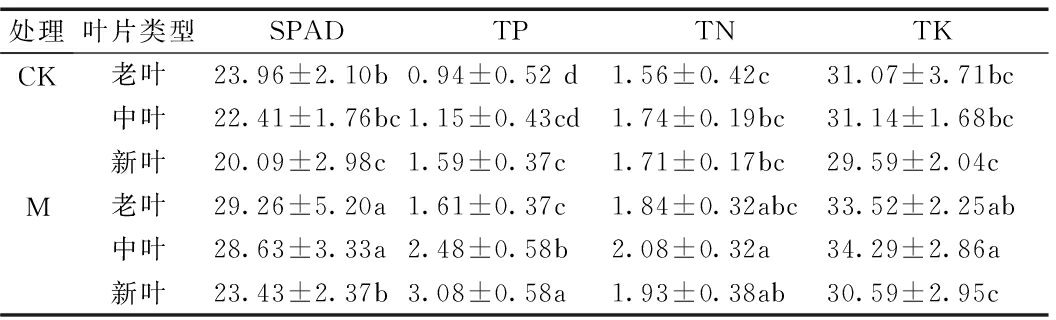
处理叶片类型SPADTPTNTKCKM老叶23.96±2.10b0.94±0.52 d1.56±0.42c31.07±3.71bc中叶22.41±1.76bc1.15±0.43cd1.74±0.19bc31.14±1.68bc新叶20.09±2.98c1.59±0.37c1.71±0.17bc29.59±2.04c老叶29.26±5.20a1.61±0.37c1.84±0.32abc33.52±2.25ab中叶28.63±3.33a2.48±0.58b2.08±0.32a34.29±2.86a新叶23.43±2.37b3.08±0.58a1.93±0.38ab30.59±2.95c
注:小写字母表示同一指标下各数值在0.05水平上有显著差异;数值格式为均值±标准误差。
2.2 不同处理下光谱特征参数与叶片全氮含量的相关性分析
用全氮含量对16个特征参数分别进行相关分析,得到CK和M的相关系数,如表4所示。CK与M的各相关系数整体相近,其中,PRI、PSNDc、PSSRI 2组数据均达到0.65以上的极显著相关,SR、REP、SRPI、PPR、SIPI、GM2 2组数据也达到极显著相关,相关系数在0.49以上。CK和M 2组数据在显著性上体现出一致性,但两者之间的相关系数存在一定差异,可能是由于接种AM真菌对玉米生长的促进作用导致玉米叶片氮含量上升,进而影响了光谱反射率导致光谱特征参数的改变[6]。
表4 不同处理下叶片全氮含量与各光谱特征参数的相关系数
Table 4 Correlation coefficients between TN content and spectral characteristic parameters
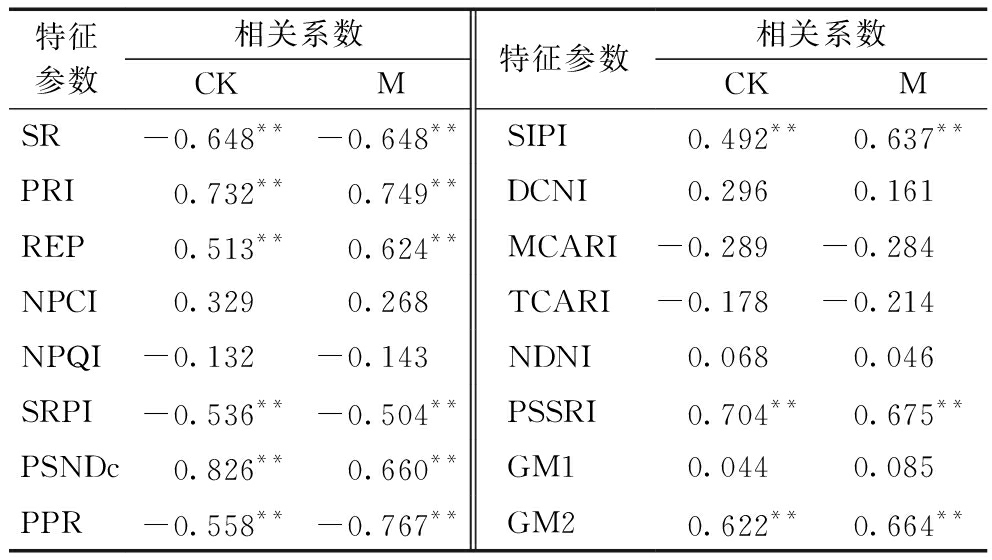
特征参数相关系数CKM特征参数相关系数CKMSR-0.648**-0.648**SIPI0.492**0.637**PRI0.732**0.749**DCNI0.2960.161REP0.513**0.624**MCARI-0.289-0.284NPCI0.3290.268TCARI-0.178-0.214NPQI-0.132-0.143NDNI0.0680.046SRPI-0.536**-0.504**PSSRI0.704**0.675**PSNDc0.826**0.660**GM10.0440.085PPR-0.558**-0.767**GM20.622**0.664**
注:*表示在0.05 水平上显著相关;**表示在0.01 水平上显著相关。
2.3 不同处理下玉米叶片全氮含量的估测模型及精度检验
基于CK和M在相关性上的差异,故将得到的光谱数据分为对照和接菌2组,分别进行氮含量的模型建立。每组共计27条光谱曲线,每组随机选取20组数据建立逐步线性回归模型,剩余的7组数据作为验证集对模型精度进行检验。将2.2节中与氮含量呈极显著相关的9个光谱特征参数作为自变量,将叶片全氮含量作为因变量进行逐步线性回归,得到的模型如表5所示。
CK得到3个反演模型,当有3个特征参数入选时,模型的R2最高为0.8361,均方根误差RME为0.1269,同时相对误差和F值都为3个模型中最小,模拟精度最高。M得到4个反演模型,当GM2、SR和PRI这3个特征参数入选时,模型的R2最高为0.893,同时均方根误差RMSE为1.1211,较其他3个模型更小,模拟精度最高。
表5 基于逐步回归分析法的玉米叶片全氮含量估测模型
Table 5 Estimation model of TN content in maize leaves based on stepwise linear regression analysis
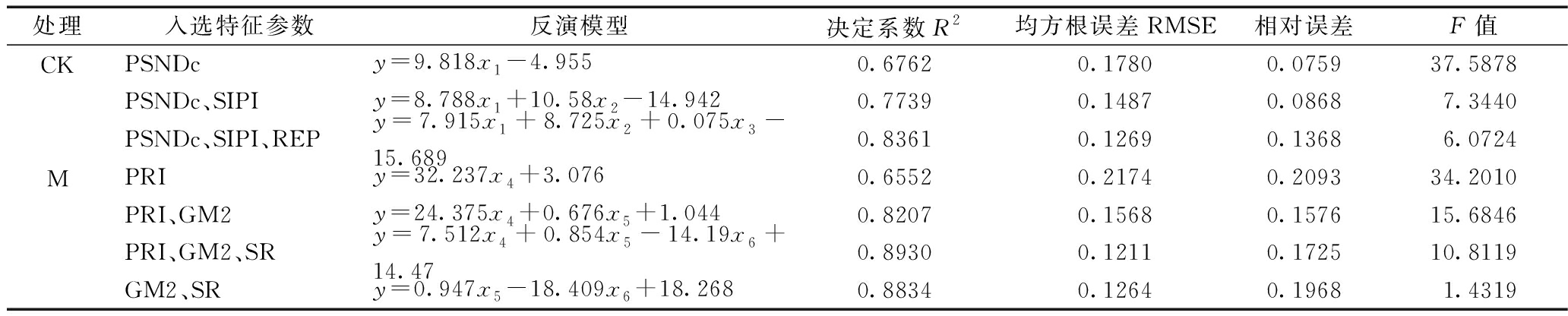
处理入选特征参数反演模型决定系数R2均方根误差RMSE相对误差F值CKPSNDcy=9.818x1-4.9550.67620.17800.075937.5878PSNDc、SIPIy=8.788x1+10.58x2-14.9420.77390.14870.08687.3440PSNDc、SIPI、REPy=7.915x1+8.725x2+0.075x3-15.6890.83610.12690.13686.0724MPRIy=32.237x4+3.0760.65520.21740.209334.2010PRI、GM2y=24.375x4+0.676x5+1.0440.82070.15680.157615.6846PRI、GM2、SRy=7.512x4+0.854x5-14.19x6+14.470.89300.12110.172510.8119GM2、SRy=0.947x5-18.409x6+18.2680.88340.12640.19681.4319
注:x1为PSNDc;x2为SIPI;x3为REP;x4为PRI;x5为GM2;x6为SR;y为玉米叶片全氮含量。
分别对所建立的所有模型进行精度检验,结果如表6所示。 CK 中以PSNDc和SIPI为自变量所构建的模型的估测精度更高,R2达到0.95;建模时决定系数最高的以3个特征参数为自变量的模型,其检验决定系数为0.888。M中的验证精度普遍偏低,以GM2、SR 为自变量时验证精度最高,R2为0.4208,以建模时决定系数最高的3个特征参数为自变量的模型,其检验R2为0.4048。结合估测模型和检验模型的结果,认为在建模决定系数相近的情况下,选取验证结果更好、参数更少的y=8.788x1+10.58x2-14.942和y=0.947x5-18.409x6+18.268分别作为CK和M的估测模型。
表6 模型精度检验结果比较
Table 6 Comparison of model accuracy test results
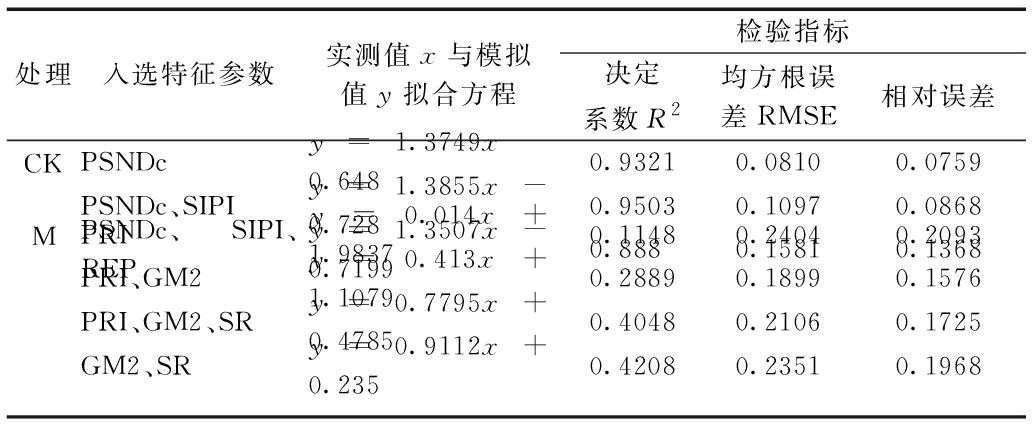
处理入选特征参数实测值x与模拟值y拟合方程检验指标决定系数R2均方根误差RMSE相对误差CKPSNDcy=1.3749x-0.6480.93210.08100.0759PSNDc、SIPIy=1.3855x-0.7280.95030.10970.0868PSNDc、SIPI、REPy=1.3507x-0.71990.8880.15810.1368MPRIy=0.014x+1.98370.11480.24040.2093PRI、GM2y=0.413x+1.10790.28890.18990.1576PRI、GM2、SRy=0.7795x+0.47850.40480.21060.1725GM2、SRy=0.9112x+0.2350.42080.23510.1968
3 结 论
1)接种AM真菌可提高玉米生物量及叶片含水量。玉米叶片根据其叶片位置的不同,其叶绿素含量,以及叶片营养元素含量具有规律性变化。其中,叶绿素含量与全磷均呈现老叶>中叶>新叶,全氮含量为中叶>新叶>老叶,全钾含量为中叶>老叶>新叶。接种AM真菌后,不同叶位的叶片M较CK在叶绿素含量和营养元素含量上均有不同程度的提高,其中,中叶的提升作用最为显著。
2)不同处理下,在备选的16个光谱参数中,各光谱特征参数与玉米叶片全氮含量的相关系数不同,即不同的特征参数对接菌和对照的敏感程度不同,但2种处理均达到极显著相关的光谱参数相同,分别为PRI、PSNDc、PSSRI、SR、REP、SRPI、PPR、SIPI、GM2,共9个。
3)使用逐步回归分析法可以较好地估测玉米叶片全氮含量。无论是CK还是M,当入选光谱参数较多时,估测模型的决定系数相对更高,但R2最高的模型其检验结果的R2并非最大,这样的检验结果可能是由于数据量较小导致。结合估测模型和检验模型的结果, CK组选择入选参数为PSNDc、SIPI时所建模型, M组选择入选参数为GM2、SR的估测模型。2个模型为R2相近的情况下验证结果更好、参数更少的模型,其模型R2分别为0.7739和0.8834,检验结果R2分别为0.9503和0.4208。
[1] GUTJAHR C, PARNISKE M. Cell biology: control of partner lifetime in a plant-fungus relationship[J]. Current Biology, 2017, 27(11):R420-R423.
[2] 王浩,方燕,刘润进,等.丛枝菌根中养分转运、代谢、利用与调控研究的最新进展[J].植物生理学报,2018,54(11):1645-1658.
[3] PATTARAWADEE S N, SOMBUN T,SUPRANEE N. Comparative potentials of native arbuscular mycorrhizal fungi to improve nutrient uptake and biomass of Sorghum bicolor Linn[J]. Agriculture and Natural Resources, 2016, 50(3): 173-178.
[4] HERNANDEZ R R, ALLEN M F. Diurnal patterns of productivity of arbuscular mycorrhizal fungi revealed with the Soil Ecosystem Observatory [J]. New Phytologist, 2013, 200(2): 547-557.
[5] 陈书琳,毕银丽. 遥感技术在微生物复垦中的应用研究[J]. 国土资源遥感, 2014, 26(3): 16-23.
[6] 陈书琳,毕银丽,齐礼帅,等. 接种菌根大豆叶绿素含量差异的光谱特征分析[J]. 中国矿业大学学报,2015,44(1):170-175.
[7] 毕银丽,孙江涛,YPYSZHAN Zhakypbek,等. 不同施磷水平下接种菌根玉米营养状况及光谱特征分析[J]. 煤炭学报, 2016, 41(5): 1227-1235.
[8] JIN LIANG, HU KELIN, TIAN MINGMING, et al. Diagnosis of nitrogen content in upper and lower corn leaves Bbased on hyperspectral data [J]. Spectroscopy and Spectral Analysis, 2013, 33(4): 1032-1037.
[9] 余克强,赵艳茹,李晓丽,等. 高光谱成像技术的不同叶位尖椒叶片氮素分布可视化研究[J]. 光谱学与光谱分析,2015,35(3): 746-750.
[10] LIU H Y, ZHU H C. Hyperspectral characteristic analysis for leaf nitrogen content in different growth stages of winter wheat[J]. Applied Optics, 2016, 55(34): 151-161.
[11] 王树文,牛羽新,马昕宇,等.基于高光谱的抽穗期寒地水稻叶片氮素预测模型[J].农机化研究,2019,41(3):158-164.
[12] 吴伟斌,李佳雨,张震邦,等. 基于高光谱图像的茶树LAI与氮含量反演[J]. 农业工程学报,2018,34(3):195-201.
[13] PHILLIPS J M, HAYMAN D S. Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British MycolSociety, 1970, 55(1): 158-161.
[14] GIOVANNETTIM,MOSSE B. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots[J]. New Phytologist, 1980, 84(3): 489-500.
[15] 范云豹,赵文吉,宫兆宁,等. 基于高光谱信息的芦苇和香蒲地上干生物量反演方法研究[J]. 湿地科学,2016,14(5):654-664.
[16] 王渊,黄敬峰,王福民,等. 油菜叶片和冠层水平氮素含量的高光谱反射率估算模型[J]. 光谱学与光谱分析,2008,28(2): 273-277.
[17] 邹小波,张小磊,石吉勇,等. 基于高光谱图像的黄瓜叶片叶绿素含量分布检测[J]. 农业工程学报,2014,30(13):169-175.
[18] 余蛟洋,常庆瑞,由明明,等. 基于高光谱和BP神经网络模型苹果叶片SPAD值遥感估算[J]. 西北林学院学报,2018,33(2):156-165.
[19] 雷志勇, 龚云丽, 杜善周,等. 接种丛枝菌根真菌对露天矿区不同配比沙土与黏土的培肥效应分析[J]. 环境工程, 2019, 37(1): 172-175,112.