0 引 言
铬广泛应用于电镀、采矿、制革、钢铁和汽车制造、水泥、金属加工、纺织、油漆颜料和染料生产、木材防腐等行业,由于多年粗放式生产及相应原料、排放物或废弃物的管理不善,导致铬大量进入环境中并对人体健康和生命安全产生严重威胁。铬在土壤中主要以Cr(Ⅲ)和Cr(Ⅵ)2种价态存在。Cr(Ⅲ)在大部分自然条件下不溶解,能以较稳定的形式存在于土壤环境中,Cr(Ⅵ)在大部分土壤环境中都以溶解态的![]() 和
和![]() 等含氧阴离子的形式存在,迁移性强,具有较高的氧化能力和穿透生物膜的特性,其毒性是Cr(Ⅲ)的10~100倍,且具有致癌、致畸和致突变作用,被美国环境保护局(EPA)列为“A”类人类致癌物[1, 2]。
等含氧阴离子的形式存在,迁移性强,具有较高的氧化能力和穿透生物膜的特性,其毒性是Cr(Ⅲ)的10~100倍,且具有致癌、致畸和致突变作用,被美国环境保护局(EPA)列为“A”类人类致癌物[1, 2]。
目前针对六价铬污染土壤的修复思路主要是通过改变铬在土壤中的存在形式,将Cr(Ⅵ)还原成Cr(Ⅲ),降低铬在环境中的迁移能力和生物可利用性。国内外报道的常用六价铬修复材料也主要是基于还原性原理采用还原性材料,其中包括铁系、硫系、铁硫系、有机系以及微生物菌剂等,不同修复材料作用机理和最终生成产物的稳定性不尽相同。本文从修复材料与六价铬的反应机理、影响因素及实际工程应用效果方面进行综述,分析各类材料的特点及其适用条件和存在问题,以便更好地指导土壤修复实践工作的开展。
1 铁系修复材料
零价铁和亚铁盐等铁基修复材料是最早应用于六价铬污染土壤修复的稳定化材料,与Cr(Ⅵ)的反应机理主要是还原、沉淀、吸附和絮凝等作用,有其适用条件和局限性。
1.1 零价铁
零价铁(ZVI)通常包括纳米零价铁和普通零价铁,是一种具有标准氧化还原电位(E0=-0.44 V)的活性金属,可有效还原Cr(Ⅵ)等氧化性污染物[3]。在零价铁还原Cr(Ⅵ)的体系中,最终反应产物为Fe(Ⅲ)和Cr(Ⅲ),分别以Cr(OH)3或Cr2O3、FeOOH或Fe2O3,以及Fe(Ⅲ)-Cr(Ⅲ)的氢氧化物形式存在[3-5]。
ZVI对Cr(Ⅵ)的还原效率与铁的浓度、pH、溶液共存离子以及温度等因素有关。一般情况下,ZVI还原Cr(Ⅵ)的速率较快(Cr(Ⅵ)半衰期约为5 min),其与Fe的浓度成正比,随着pH的增高而降低,pH>8时还原反应几乎停止[6-8]。此外,Liu等[9,10]研究了腐植酸![]() 和Ca2+对ZVI还原Cr(Ⅵ)的影响,结果表明,腐植酸和Ca2+对Cr(Ⅵ)的还原无明显影响,
和Ca2+对ZVI还原Cr(Ⅵ)的影响,结果表明,腐植酸和Ca2+对Cr(Ⅵ)的还原无明显影响,![]() 可以明显增强Cr(Ⅵ)的还原效率;而Ca2+与碳酸氢盐同时存在时,对ZVI还原Cr(Ⅵ)有抑制作用[11]。
可以明显增强Cr(Ⅵ)的还原效率;而Ca2+与碳酸氢盐同时存在时,对ZVI还原Cr(Ⅵ)有抑制作用[11]。
ZVI作为Cr(Ⅵ)还原材料主要应用于地下水修复可渗透反应墙(PRB)技术中,直接用于土壤修复的案例比较少,主要是因为其在中碱性条件下溶解度较低,稳定效果欠佳[12-13]。在此基础上,学者开始采用纳米零价铁来强化其作用效果,纳米零价铁粒径小,比表面积大,其对Cr(Ⅵ)的还原速率是普通零价铁的50~70倍[14-17],但是纳米零价铁颗粒极不稳定,易团聚且易被土壤悬浮颗粒物表面所吸附,从而使反应效率大大降低[18]。目前已有研究者提出经羧甲基纤维素修饰后的纳米零价铁对Cr(Ⅵ)具有更优的六价铬修复效果[19],但还未见工程化应用。在工程应用中,Li等[20]采用可食用植物油或混有表面活性剂的油将纳米零价铁包裹在油滴中,利用油膜作用避免其与水或其他介质反应,保持反应活性,但是这将影响土壤特殊水土体系中其与目标污染物的接触及实际的反应速率。因此,纳米零价铁虽然对修复Cr(Ⅵ)较普通零价铁有一定的优势,但目前存在问题需要解决,并且对其作为纳米材料在土壤修复中使用的环境风险暂无足够的认知。
1.2 亚铁盐
硫酸亚铁、氯化亚铁等亚铁盐常被用作Cr(Ⅵ)污染土壤修复材料,其与Cr(Ⅵ)反应后Cr(Ⅲ)更易以混合沉淀的形式析出,生成稳定的铁铬共沉淀,其反应机理如下[21]:
xCr(Ⅲ)+(1-x)Fe(Ⅲ)+3H2O→
(CrxFe(1-x))(OH)3(s)+3H+
(1)
Fe(Ⅱ)还原Cr(Ⅵ)的效率受体系pH、溶解氧和固相矿物等条件的影响。溶液体系中研究表明,Fe(Ⅱ)在pH≤4.7时以自由离子的形式存在,因此在水处理工艺中,常使Cr(Ⅵ)在酸性条件下反应,在碱性条件下沉淀,以达到去除水中Cr(Ⅵ)的目的[22]。同样在土壤体系中,pH偏酸性条件下有利于Fe(Ⅱ)还原Cr(Ⅵ)。溶解氧存在也会影响Fe(Ⅱ)对Cr(Ⅵ)的还原。当体系pH值为碱性时,相同条件下Cr(Ⅵ)氧化Fe(Ⅱ)的速率要大于溶解氧氧化Fe(Ⅱ)的速率[23],说明控制相对碱性条件可以有效减弱溶解氧对Cr(Ⅵ)氧化Fe(Ⅱ)的影响。Qin等[24]研究发现,溶解氧浓度在3~4 mg/L的条件下,使用10~50倍的硫酸亚铁可使Cr(Ⅵ)完全还原生成Cr(Ⅲ)。Dermatas等[25]研究发现,由于固液两相之间质量传递过程较之水相之间较慢,导致固相Cr(Ⅵ)与Fe(Ⅱ)溶液的接触时间和混合程度在整个反应初期作用非常关键。
铁系材料应用于六价铬污染土壤修复实际工程项目时,面临的关键技术问题在于含硫酸盐的还原材料使用会对后续土壤开发利用产生不利影响,过量的![]() 会严重腐蚀建筑根基,并且会导致钙矾石的生成从而造成体积膨胀等负面效应。为避免
会严重腐蚀建筑根基,并且会导致钙矾石的生成从而造成体积膨胀等负面效应。为避免![]() 的影响,实际工程尝试用FeCl2替代FeSO4。在Fe(Ⅱ)浓度一定的条件下,FeCl2比FeSO4还原Cr(Ⅵ)的效果好,分析原因可能是Cl-的存在有效提升了整个还原反应动力学[26]。此外,亚铁盐材料作为Cr(Ⅵ)还原材料的另外一个问题在于亚铁盐还原效率相对硫系材料低,通常一个Fe2+只能提供一个电子,因此实际修复工程中采用硫系材料时材料的添加量通常都较高[27]。
的影响,实际工程尝试用FeCl2替代FeSO4。在Fe(Ⅱ)浓度一定的条件下,FeCl2比FeSO4还原Cr(Ⅵ)的效果好,分析原因可能是Cl-的存在有效提升了整个还原反应动力学[26]。此外,亚铁盐材料作为Cr(Ⅵ)还原材料的另外一个问题在于亚铁盐还原效率相对硫系材料低,通常一个Fe2+只能提供一个电子,因此实际修复工程中采用硫系材料时材料的添加量通常都较高[27]。
针对铁系材料应用于六价铬污染土壤修复后的稳定性问题,主要考虑生成产物的溶解性和可迁移性。还原产物的稳定性是选用修复材料的重要考量因素之一。材料设计时应尽量避免生成溶解性Cr(Ⅲ),如低分子有机酸络合态Cr(Ⅲ),研究表明,其能快速且广泛地被再氧化为高毒性Cr(Ⅵ)[28]。含铁类还原剂与Cr(Ⅵ)反应后生成的主要产物为Cr(OH)3沉淀和铁铬混合沉淀(CrxFe(1-x))(OH)3[21, 29],其中Cr(OH)3属于两性氢氧化物,在强酸和强碱环境下均可溶,而(CrxFe(1-x))(OH)3的溶解度较Cr(OH)3稳定,但一定程度上也与Fe/Cr比例和环境pH有关[27, 30]。此外,六价铬污染土壤修复后的稳定性问题还与不同土壤体系有关[31],研究表明,当土壤体系中存在锰氧化物时,其生成产物(CrxFe(1-x))(OH)3溶解速率和Cr(Ⅵ)的产生速率都明显增快,因此,当土壤中含有较多的锰氧化物等氧化性物质存在时,不适合采用还原试剂对该土壤进行六价铬的还原稳定化修复处理。
2 硫系材料
硫元素在不同的氧化还原条件下可呈现不同氧化状态,如S2-、[S2]2-、S0、S4+、S6+,其对Cr(Ⅵ)的还原能力各有差异,通常情况下,低价硫系材料效果优于中低价硫系材料。
2.1 低价硫系材料
低价硫系材料主要包括硫化钠和多硫化钙(CPS)等,其中硫化钠为危险化学品,其使用受到一定限制。以CPS为例,其与Cr(Ⅵ)反应生成Cr(OH)3和单质硫沉淀(式(2))[31],可使土壤在较长时间范围内处于还原状态,比普通硫化物的还原能力更为持久,因此CPS被认为是具有极大修复潜力的六价铬修复材料[32]。
15S(s)+3Ca2++2H2O
(2)
CPS在不同pH条件下存在形式有所差异。当pH为12时,S约占CPS组分的10%,其中![]() 占比
占比![]() 占比4%;其他占比1%。当pH为中性7时,S的占比降至1%左右;当pH<8时,HS-和H2S为主要成分[34]。当在中性和碱性pH且有氧条件下,CPS可被氧化为亚硫酸盐、硫代硫酸盐或亚硫酸盐、硫酸盐的混合物;同时土壤中的Fe(Ⅲ)亦可被CPS有效还原[35]。
占比4%;其他占比1%。当pH为中性7时,S的占比降至1%左右;当pH<8时,HS-和H2S为主要成分[34]。当在中性和碱性pH且有氧条件下,CPS可被氧化为亚硫酸盐、硫代硫酸盐或亚硫酸盐、硫酸盐的混合物;同时土壤中的Fe(Ⅲ)亦可被CPS有效还原[35]。
CPS广泛应用于处理各种铬污染介质,尤其是应用于铬污染土壤中。卢鑫[36]等对比了CPS、硫化钠及焦亚硫酸钠3种硫化物还原剂对某铬污染土壤的处理效果,研究表明,CPS对Cr(Ⅵ)稳定效果最佳,当CPS投加摩尔比为3时,浸出Cr(Ⅵ)和总Cr浓度均能满足GB/T 14848—1993《地下水质量标准》Ⅲ类标准中规定的限值,效果远优于硫化钠和焦亚硫酸钠。Chrysochoou等[32]发现当n(Cr(Ⅵ))∶n(CPS)=2∶1时,180天后,CPS仍对Cr(Ⅵ)具有还原能力。
CPS应用在铬污染土壤中面临的主要问题在于其具有强碱性,pH约为11.5,对Cr(Ⅵ)起到还原稳定化作用同时,会使整个土壤环境的pH值升高,在一定程度上将导致土壤结构的破坏。因此,在实际工程中,建议配合酸性物质组分一起使用来维持土壤pH值环境。
2.2 中低价硫系材料
中低价硫系材料通常包括连二亚硫酸钠(Na2S2O4)、硫代硫酸钠(Na2S2O3)、焦亚硫酸钠(Na2S2O5)、亚硫酸氢钠(NaHSO3)等。以Na2S2O4为例,Na2S2O4可以通过2个方面来实现对Cr(Ⅵ)的还原作用:一方面是Na2S2O4可以将环境中的Fe(Ⅲ)还原为Fe(Ⅱ),Fe(Ⅱ)用于Cr(Ⅵ)的还原(式(3));另一方面Na2S2O4的分解产物如![]() 和
和![]() 等,可以将Cr(Ⅵ)还原为Cr(Ⅲ)(式(4))[37,38]:
等,可以将Cr(Ⅵ)还原为Cr(Ⅲ)(式(4))[37,38]:
![]()
(3)
![]()
(4)
Chen等[37]研究表明,Na2S2O4还原Cr(Ⅵ)的效果受到环境中Fe(Ⅲ)含量的限制,并且Na2S2O4的分解产物还原Cr(Ⅵ)的效率随着pH的升高而降低。因此为了达到更好的还原效果,许多研究者将Na2S2O4与Fe(Ⅱ)或Fe(Ⅲ)联合使用[39,40]。Beukes等[41]研究发现,亚硫酸氢钠在pH 2~5时对Cr(Ⅵ)的还原速度比Fe(Ⅱ)快;在pH>5时,亚硫酸氢钠与Cr(Ⅵ)反应速率迅速降低;中性和碱性条件下几乎无还原能力。刘增俊等[42]研究了Na2S2O4对不同类型铬污染土壤的3 d短期及1.5年长期的稳定化效果,结果表明,Na2S2O4在5%投加比下对不同类型土壤均具有很好的稳定化效果,并且具有较好的长期稳定性。
硫系材料还原产物主要以Cr(OH)3沉淀形式存在,其容易形成溶解态的三价铬产物,溶解态三价铬产物迁移性和稳定性不如含铁类还原剂还原产物(CrxFe(1-x))(OH)3,但从电子转移角度考虑,相同投加比的硫系材料的还原效率大于铁系还原剂。因此,在实际土壤修复工程中可采用硫系和铁系还原剂混合使用的方式来增强还原产物的稳定性,同时起到保证一定的还原效果和控制适宜的土壤pH值范围的双重效果。
3 铁硫系材料
铁硫系(Fe-S)材料通常包括天然硫铁矿和黄铁矿等矿物级原材料以及各种合成的Fe-S材料。
合成Fe-S材料通常在无氧条件下进行,可通过物理化学和生物方法合成得到(表1)[43-47]。Fe-S材料首先生成的是[FeS]或四方硫铁矿,[FeS]无毒,是硫复铁矿、黄铁矿等稳定硫铁矿物的前体物质。此外,[FeS]是1种重要的酸可挥发性硫化物,可以提供Fe(Ⅱ)和S(Ⅱ)2种电子供体,对多种重金属和有机物均有修复效果,因此引起了广泛关注。
表1 Fe-S材料的合成方法
Table 1 Synthesis methods of Fe-S materials
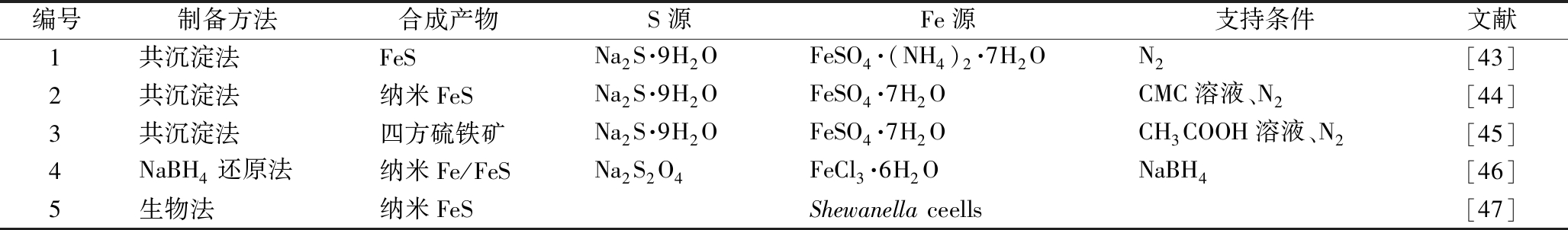
编号制备方法合成产物S源Fe源支持条件文献1共沉淀法FeSNa2S·9H2OFeSO4·(NH4)2·7H2ON2[43]2共沉淀法纳米FeSNa2S·9H2OFeSO4·7H2OCMC溶液、N2[44]3共沉淀法四方硫铁矿Na2S·9H2OFeSO4·7H2OCH3COOH溶液、N2[45]4NaBH4还原法纳米Fe/FeSNa2S2O4FeCl3·6H2ONaBH4[46]5生物法纳米FeSShewanellaceells[47]
Fe-S材料对Cr(Ⅵ)的还原作用已有很多研究。Patterson等[48]使用非晶态FeS悬浮液还原Cr(Ⅵ)溶液(50~500 μmol/L),在N2保护,pH分别为5、7和8的条件下反应3 d,Cr(Ⅵ)的还原效率为85%~100%。Mullet等[49]研究了四方硫铁矿(machinawite,FeS)对Cr(Ⅵ)的还原能力,设计Cr(Ⅵ)溶液浓度为10-4~6×10-3 mol/L,分别在pH为5和7的条件下反应,结果表明,pH为5时每克FeS可去除240 mg Cr(Ⅵ),pH为7时每克FeS可去除130 mg Cr(Ⅵ)。Graham等[50]研究了黄铁矿(pyrite,FeS2)在无氧条件下对Cr(Ⅵ)的还原,认为0.28~2.10 m2/L的黄铁矿能够在1 d内完全还原7~120 μmol/L的Cr(Ⅵ),但还原速度随着pH的上升而降低。Li等[51]使用合成FeS2还原Cr(Ⅵ),当Cr(Ⅵ)∶FeS2为1∶0.9时可有效去除溶液中的Cr(Ⅵ),其对Cr(Ⅵ)的还原动力学在pH为5.0~10.0时不断增大,而在pH为10.0~13.0内不断减小。此外,O2存在与Cr(Ⅵ)还原有竞争关系,O2存在可氧化FeS2而降低还原效率。
FeS在低pH条件下溶解度增加,从而释放出还原性Fe(Ⅱ)(见式(5))。Mullet等[49]研究发现,当n(Cr)∶n(Fe)>1∶3时,体系中以Fe(Ⅱ)和Cr(Ⅵ)的反应为主(见式(6));当体系中n(Cr)∶n(Fe)固定为1.4±0.2,pH值>4时,形成了Fe(Ⅲ)-Cr(Ⅲ)的氢氧化物沉淀(CrxFe1-x)(OH)3(s)(见式(7)),其中x可取值0~1。
FeS+H+→Fe2++HS- pKsp=3.54
(5)
3Fe(Ⅱ)+Cr(Ⅵ) →3Fe(Ⅲ)+Cr(Ⅲ)
(6)
x Cr(Ⅲ)+(1-x) Fe(Ⅲ)+3H2O→
(CrxFe1-x)(OH)3(s)+3H+
(7)
S2-还原Cr(Ⅵ)的详细机制应考虑反应过程中产生的含硫化合物中间体。Patterson等[48]研究表明,F-S材料还原Cr(Ⅵ)的中间产物以硫代硫酸盐为主,还有微量的亚硫酸盐和硫代硫酸盐。此外,研究表明,当Cr(Ⅵ)溶液初始浓度为0~500 μmol/L时,pH为7.0时,溶液中TS浓度最高,pH为8.0时,溶液中TS含量最低。这可能是因为中性pH条件下,硫代硫酸盐有分解阻力,而高pH和S条件下对Cr(Ⅵ)的还原作用较强。
Fe-S材料还原Cr(Ⅵ)的产物通常为(CrxFe1-x)(OH)3沉淀,其可以弥补含铁类材料还原效率低以及硫系材料还原产物稳定性差的不足,但在实际材料应用中,无论是天然还是合成硫铁系材料,都存在一定局限性。天然硫铁矿等材料在中、碱性条件下溶解度都较低,而修复中通常面对的铬污染土壤大多呈碱性,因此难以起到有效的还原作用。合成硫铁系材料的主要问题和其他合成材料一样,其产业化规模化应用还无法实现,还有很多问题需要进一步解决。因此,目前在实际工程应用中将Fe-S材料直接用于Cr(Ⅵ)土壤修复工程项目的报道还较少。
4 有机类修复材料
当土壤环境中有机物含量较高时,Cr(Ⅵ)能够被有机物还原为Cr(Ⅲ)而减轻其毒性,因此目前对于有机类材料的研究主要关注有机类材料本身对六价铬的还原作用及还原机理。比如,Wittbrodt等[52]研究发现,腐植酸的不同化学组分对Cr(Ⅵ)的还原能力不同,土壤腐植酸对Cr(Ⅵ)的修复与环境pH及腐植酸的化学组成有关,酸性pH条件下有助于腐植酸对Cr(Ⅵ)的还原。Huang等[53]研究发现,含有芳香基团和含氧官能团多的F1组分对Cr(Ⅵ)还原的速率较快且效果最好。Szulczwski等[54]研究表明,腐植酸中含有的硫醇或硫化物成分,与Cr(Ⅵ)反应的还原机理与L-半胱氨酸和Cr(Ⅵ)反应的还原机理相似。
一般情况下,小分子的有机还原剂对Cr(Ⅵ)的还原效率要高于腐植酸等大分子,Nakayasu等[55]研究发现腐植酸对Cr(Ⅵ)的修复多为络合作用,而小分子有机酸单宁酸(TA)和没食子酸(GA)等通过还原和络合的作用修复六价铬,且TA和GA还原Cr(Ⅵ)的速率要远大于腐植酸。其他还原剂如糖类等也被用作Cr(Ⅵ)的还原剂[56]。因此,目前对于有机材料的研究多倾向于将有机材料与其他材料进行复合或改性来提高材料的有效性,如Parlayici等[57]利用新型壳聚糖、腐植酸和石墨烯复合材料组合来提高对Cr(Ⅵ)的修复效果;Singaraj等[58]使用腐植酸负载氧化铁材料有效提高对Cr(Ⅵ)的还原或吸附作用。
由于有机类材料通常还原能力较弱,因此,有机类修复材料在实际工程的应用中主要是作为还原性微生物碳源营养物质。在低浓度铬污染土壤中,其可以单独使用,强化还原性微生物对铬的解毒作用;在中高浓度铬污染土壤中,将其与其他还原性材料混合使用,利用化学还原剂降低铬污染浓度的同时强化微生物协同修复,实现对铬污染场地土壤的高效、绿色修复。因此,有机类材料在铬污染土壤修复应用中具有较大潜力。
5 微生物菌剂修复材料
微生物菌剂被认为是一种环境友好的Cr(Ⅵ)修复材料。其中,真核细胞主要是通过还原性有机生物分子的化学转化(胞内或胞外还原)、生物吸附或者胞内生物积累等来实现对Cr(Ⅵ)的还原或吸附[59]。厌氧微生物可以用铬酸盐作为末端电子受体或利用氢化酶或还原细胞色素C将胞质间的铬酸盐还原,Chun等[60]利用CH4作为电子供体,在厌氧还原途径利用CH4发酵产生的中间体来实现对Cr(Ⅵ)的还原。Michel等[61]对比了Desulfovibrio和Dessulfomicrobium中的细胞色素C,发现具有负氧化还原电位的还原细胞色素C3相较于其他类型的还原细胞色素C具有更强的Cr(Ⅵ)还原活性。好氧微生物主要通过细胞还原物质或还原酶对铬酸盐进行还原。Suzuki等[62]从耐铬菌Pseudomonas ambigua G-1中分离出1种对Cr(Ⅵ)有依赖性的NAD(P)H还原酶,可将Cr(Ⅵ)还原为Cr(Ⅲ),同时也发现在无还原酶作用的情况下,NADH可将Cr(Ⅵ)还原为Cr(Ⅴ),证明了Cr(Ⅵ)还原为Cr(Ⅲ)的反应可能经过了两步反应。极端条件Cr(Ⅵ)还原微生物也不断被发现,其为微生物处理碱性铬污染土壤提供可能。
目前,关于微生物菌剂直接应用于实际修复工程中的报道较少,这主要是因为微生物在扩大生产工艺中容易失活,同时应用过程面临各种环境条件的考验,因此目前在工程化应用的道路上面临着比较大的挑战。为此,为了菌剂能更好地应用于土壤环境,目前菌株的固定化对实际工程的应用也是一个重要思路[63]。此外,从产物的稳定性来评判该类材料,其长期稳定性有待考察,很多研究表明微生物所生成的Cr(Ⅲ)产物是可溶的。Huang等[64]也发现,使用菌株Aeromonas hydrophila还原Cr(Ⅵ)的产物有机-Cr(Ⅲ)是可溶的,这在一定程度上说明虽然微生物可以将Cr(Ⅵ)还原为Cr(Ⅲ),但产物稳定性相对较差,依旧对环境有潜在的威胁。
6 结 论
多种类型的修复材料可以将Cr(Ⅵ)还原为Cr(Ⅲ)并生成Cr(Ⅲ)沉淀,以起到对铬的固定作用,这些还原剂包括含铁系材料(零价铁、亚铁盐等)、硫系材料(多硫化钙、连二亚硫酸钠等)、铁硫系材料(硫铁矿、Fe-S合成材料等)、有机类材料(低分子有机酸、腐植酸)以及微生物菌剂等。本文综述了国内外关于这些材料对Cr(Ⅵ)的修复原理、影响因素、实际应用效果、存在问题以及修复后的长期稳定性等多方面关键性论文和著作,并结合在实际修复工程中遇到的实际问题,对Cr(Ⅵ)修复材料进行了分析总结。
目前国内外对于以上材料均有了一定的基础研究和认识,笔者认为后期对于修复材料的研究更应该关注的问题可以归纳为以下几个方面:
1)目前铬污染土壤修复多采用化学材料进行还原固定,修复后仅对Cr(Ⅵ)的浸出浓度等指标进行评价,对于修复材料本身所可能引起的二次环境影响还未进一步关注到,人们对还原剂使用的实际工程经验及使用后可能会造成的环境风险仍缺乏认识,需进一步开展相关研究。
2)目前缺少对还原产物稳定性的长期跟踪监测研究,并且对修复材料使用后形成的还原产物的稳定性关注度有限,对铬污染场地修复后长期安全性缺乏行之有效的评价方法。
3)目前对修复后Cr(Ⅵ)再氧化机理的深入研究不够,可从材料选取及应用的根本上来分析Cr(Ⅵ)再氧化现象,研究材料与Cr(Ⅵ)生成产物的稳定性以及所处环境因素的变化,识别Cr(Ⅲ)再氧化的驱动因子,以更好地指导修复实践工作的开展。
[1] SHAHID M, SHAMSHAD S, RAFIQ M, et al. Chromium speciation, bioavailability, uptake, toxicity and detoxification in soil-plant system: a review[J]. Chemosphere, 2017, 178: 513-533.
[2] DHAL B, THATOI H N, DAS N N, et al. Chemical and microbial remediation of hexavalent chromium from contaminated soil and mining/metallurgical solid waste: a review[J]. Journal of Hazardous Materials, 2013, 250/251: 272-291.
[3] FU F L, DIONYSIOU D D, LIU H, et al. The use of zero-valent iron for groundwater remediation and wastewater treatment: a review [J]. Journal of Hazardous Materials, 2014, 267: 194-205.
[4] WILKIN R T, SU C M, FORD R G, et al. Chromium removal processes during groundwater remediation by a zerovalent iron permeable reactive barrier [J]. Environmental Science & Technology, 2005, 39(12): 4599-4605.
[5] ZHANG R Y, ZHANG N Q, FANG Z Q. In situ remediation of hexavalent chromium contaminated soil by CMC-stabilized nanoscale zero-valent iron composited with biochar[J]. Water Science & Technology, 2018, 77(5/6):1622-1631
[6] ALOWITZ M J, SCHERER M M. Kinetics of nitrate, nitrite, and Cr(Ⅵ) reduction by iron metal [J]. Environmental Science & Technology, 2002, 36(3): 299-306.
[7] ZHOU N, GONG K D, HU Q, et al. Optimizing nanocarbon shell in zero-valent iron nanoparticles for improved electron utilization in Cr(Ⅵ) reduction [J]. Chemosphere, 2020, 242: 125-235.
[8] ZHU F, LI L W, REN W T, et al. Effect of pH, temperature, humic acid and coexisting anions on reduction of Cr(Ⅵ) in the soil leachate by nZVI/Ni bimetal material [J]. Environmental Pollution, 2017, 227: 444-450.
[9] LIU T Z, RAO P H, IRENE M C. Influences of humic acid, bicarbonate and calcium on Cr(Ⅵ) reductive removal by zero-valent iron [J]. Science of the Total Environment, 2009, 407: 3407-3414.
[10] LIU T Z, IRENE M C. Influences of humic acid on Cr(Ⅵ) removal by zero-valent iron from groundwater with various constituents: implication for long-term PBR performance [J]. Water Air and Soil Pollution, 2011, 216: 473-483.
[11] IRENE M C, CHESTER S C, KEITH C K. Hardness and carbonate effects on the reactivity of zero-valent iron for Cr(Ⅵ) removal [J]. Water Research, 2006, 40: 595-605.
[12] 王旌,罗启仕,张长波,等.铬污染土壤的稳定化处理及其长期稳定性研究[J].环境科学,2013,34(10):4036-4041.
[13] WANG Q, CISSOKO N, ZHOU M, et al. Effects and mechanism of humic acid on chromium(Ⅵ) removal by zero-valent iron(Fe0) nanoparticles [J]. Physics and Chemistry of the Earth, Parts A/B/B, 2011, 36(9/10/11): 442-446.
[14] PETALA E, DIMOS K, DOUVALIS A, et al. Nanoscale zero-valent iron supported on mesoporous silica: characterization and reactivity for Cr(Ⅵ) removal from aqueous solution [J]. Journal of Hazardous Materials, 2013, 261: 295-306.
[15] LI X Q, CAO J S, ZHANG W X. Stoichiometry of Cr(Ⅵ) immobilization using nanoscale zerovalent iron (nZVI): a study with High-resolution X-Ray photoelectron spectroscopy (HR-XPS) [J]. Industrial & Engineering Chemistry Research, 2008, 47: 2131-2139.
[16] CAO J S, ZHANG W X. Stabilization of chromium ore processing residue (COPR) with nanoscale iron particles [J]. Journal of Hazardous Materials, 2006, 132(2/3): 213-219.
[17] SHJEPCEVIC N, KERKEZ D, TOMASEVIC P D, et al. Use of two different approaches to the synthesis of nano zero valent iron for sediment remediation [J]. Global NEST Journal, 2019, 21(4): 455-460.
[18] COMBA S, SETHI R. Stabilization of highly concentrated suspensions of iron nanoparticles using shear-thinning gels of xanthan gum [J]. Water Research, 2009, 43(15): 3717-3726.
[19] WANG Q, QIAN H J, YANG Y P, et al. Reduction of hexavalent chromium by carboxymethyl cellulose-stabilized zero-valent iron nanoparticles [J]. Journal of Contaminant Hydrology, 2010, 114: 35-42.
[20] LI F, VIPULANANDAN C,MOHANTY K K. Microemulsion and solution approaches to nanoparticle iron production for degradation of trichloroethylene[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2003,223:103-112.
[21] GRÖHLICH A, LANGER M, MITRAKAS M, et al. Effect of organic matter on Cr(Ⅵ) removal from groundwaters by Fe(Ⅱ) reductive precipitation for groundwater treatment [J]. Water, 2017, 9(6): 389.
[22] CARLOS E B D, VIOLETA L L, BRYAN B. A review of chemical, electrochemical and biological methods for aqueous Cr(Ⅵ) reduction [J]. Journal of Hazardous Materials, 2012, 223/224: 1-12.
[23] BUERGE I J, HUG S J. Kinetics and pH dependence of chromium(Ⅵ) reduction by iron(Ⅱ) [J]. Environmental Science & Technology, 1997, 31(5): 1426-1432.
[24] QIN G, MCGUIRE M J, BLUTE N K, et al. Hexavalent chromium removal by reduction with ferrous sulfate, coagulation, and filtration: a pilot-scale study [J]. Environmental Science & Technology, 2005, 39(16): 6321-6327.
[25] DERMATAS D, CHRYSOCHOOU M, MOON D H, et al. Ettringite-induced heave in chromite ore processing residue (COPR) upon ferrous sulfate treatment [J].Environmental Science & Technology, 2006, 40: 5786-5792.
[26] WEAMAN J C, BERTSCH P M, SCHWALLIE L. In situ Cr(Ⅵ) reduction within coarse-textured, oxide-coated soil and aquifer systems using Fe(Ⅱ) solutions [J]. Environmental Science & Technology, 1999, 22: 938-944.
[27] ZHANG T T, XUE Q, LI J S, et al. Effect of ferrous sulfate dosage and soil particle size on leachability and species distribution of chromium in hexavalent chromium-contaminated soil stabilized by ferrous sulfate [J]. Environmental Progress & Sustainable Energy, 2019, 38(2): 500-507.
[28] JAMES B R, BARTLETT R J. Behavior of chromium in soils. VI. Interactions between oxidation-reduction and organic complexation[J]. Journal of Environmental Quality, 1983, 12(2): 173-176.
[29] LI D, GUI C X, JI G Z, et al. An interpretation to Cr(Ⅵ) leaching concentration rebound phenomenon with time in ferrous-reduced Cr(Ⅵ)-bearing solid matrices [J]. Journal of Hazardous Materials, 2019, 378:120734.
[30] PAPASSIOPI N, PINAKIDOU F, KATSIKINI M, et al. A XAFS study of plain and composite iron(Ⅲ) and chromium(Ⅲ) hydroxides[J]. Chemosphere, 2014, 111: 169-176.
[31] PAN C, LIU H, CATALANO J G. Rates of Cr(Ⅵ) generation from (CrxFe(1-x))(OH)3 soilds upon reaction with manganese oxide[J]. Environmental Science & Technology, 2017, 51: 12416-12423.
[32] CHRYSOCHOOU M, JOHNSTON C P, DAHAL G. A comparative evaluation of hexavlent chromium treatment in contaminated soil by calcium polysulfide and green-tea nanoscale zero-valent iron [J]. Journal of Hazardous Materials, 2012, 201/202: 33-42.
[33] DAHLAWI S M, SIDDIQUI S. Calcium polysulphide, its applications and emerging risk of environmental pollution: a review article [J]. Environmental Science and Pollution Research, 2017, 24: 92-102.
[34] CHRYSOCHOOU M, TING A. A kinetic of Cr(Ⅵ) reduction by calcium polysulfide [J]. Science of the Total Environment, 2011, 409: 4072-4077.
[35] CHRYSOCHOOU M, JOHNSTON C P. Polysulfide speciation and reactivity in chromate-contaminated soil [J]. Jouurnal of Hazardous Materials, 2015, 281: 87-94.
[36] 卢鑫,罗启仕,刘馥雯,等.硫化物对电镀厂铬污染土壤的稳定化效果及其机理研究[J].环境科学学报,2017,37(6):2315-2321.
[37] CHEN C J, LIN T H, CHEN C P, et al. The effectiveness of ferrous iron and sodium dithionite for decreasing resin-extractable Cr(Ⅵ) in Cr(Ⅵ)-spiked alkaline soils [J]. Journal of Hazardous Materials, 2009, 164: 510-516.
[38] ISTOK J D, AMONETTE J E, COLE C R, et al. In site redox manipulation by dithionite injection: intermediate-scale laboratory experiments [J]. Ground Water, 1999, 37(6): 884-889.
[39] LI Y Y, CUNDY A B, FENG J X, et al. Remediation of hexavalent chromium contamination in chromite ore processing residue by sodium dithionite and sodium phosphate addition and its mechanism [J]. Journal of Environmental Management, 2017, 192: 100-106.
[40] LUGWIG R D, SU C M, LEE T R, et al. In site chemical reduction of Cr(Ⅵ) in groundwater using a combination of ferrous sulfate and sodium dithionite: a field investigation [J]. Environmental Science & Technology, 2007, 41: 5299-5305.
[41] BEUKES J P, PIENAAR J J, LACHMANN G. The reduction of hexavalent chromium by sulphite in wastewater:an explanation of the observed reactivity pattern [J]. Water SA, 2000, 26(3): 393-396.
[42] 刘增俊,夏旭,张旭,等.铬污染土壤的药剂修复及其长期稳定性研究[J].环境工程,2015,33(2):160-163.
[43] LIU J R, VALSARAJ K T, DEVAI I, et al. Immobilization of aqueous Hg(Ⅱ) by mackinawite (FeS) [J]. Journal of Hazardous Materials, 2008, 157: 432-440.
[44] XIONG Z, HE F, ZHAO D Y, et al. Immobilization of mercury in sediment using stabilized iron sulfide nanoparticles [J]. Water Reserch, 2009, 43: 5171-5179.
[45] COLES C A, RAO S R, YONG R N. Lead and cadmium interactions with mackinawite: retention mechanisms and the role of pH [J]. Environmental Science & Technology, 2000, 34: 996-1000.
[46] KIM E J, KIM J H, AZAD A M, et al. Facile synthesis and characterization of Fe/FeS nanoparticles for environmental applications [J]. ACS Applied Materials & Interfaces, 2011, 3: 1457-1462.
[47] YU Y Y, CHENG Q W, SHA C, et al. Size-controlled biosynthesis of FeS nanoparticles for efficient removal of aqueous Cr(Ⅵ) [J]. Chemical Engineering Journal, 2020, 379: 122404.
[48] PATTERSON R R, BOURSIQUOT S. Reduction of hexavalent chromium by amorphous Iron Sulfide [J]. Environmental Science & Technology, 1997, 31: 2039-2044.
[49] MULLET M, BOURSIQUOT S, EHRHARDT J J. Removal of hexavalent chromium from solution by mackinawite, tetragonal FeS [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2004, 244(1/2/3): 77-85.
[50] GRAHAM A M, BOUWER E J. Oxidative dissolution of pyrite surfaces by hexavalent chromium_surface site saturation and surface renewal[J]. Geochimica Et Cosmochimica Acta, 2012, 83: 379-396.
[51] LI Y Y, LIANG J L, HE X, et al. Kinetics and mechanisms of amorphous FeS2 induced Cr(Ⅵ) reduction [J]. Journal of Hazardous Materials, 2016, 320: 216-225.
[52] WITTBRODT P R, PALMER C D. Reduction of Cr(Ⅵ) in the presence of excess soil fulvic acid [J]. Environmental Science & Technology, 1995, 29: 255-263.
[53] HUANG S W, CHIANG P N, LIU J C, et al. Chromate reduction on humic acid derived from a peat soil-exploration of activated sites on Has for chromate removal [J]. Chemosphere, 2012, 87: 587-594.
[54] SZULCZEWSKI M D, HELMKE P A, BLEAM W F. XANES spectroscopy studies of Cr(Ⅵ) reduction by thiols in organosulfur compounds and humic substances [J]. Environmental Science & Technology, 2001, 35: 1134-1141.
[55] NAKAYASU K, FUKUSHIMA M, SASAKI K, et al. Comparative studies of the reduction behavior of chromium(Ⅵ) by humic substances and their precursors [J]. Environmental Toxicology and Chemistry, 1999, 18(6): 1085-1090.
[56] RAO C P, SARKAR P S, KAIWAR S P, et al. Chromate reductase activity: characterization of Cr(Ⅵ) to Cr(Ⅲ) conversion [J]. Proceedings of the Indian Academy of Sciences (Chemical Sciences), 1990, 102(3): 219-230.
[57] PARLAYICI S, AVCI A, PEHLIVAN E, et al. Fabrication of novel chitosan-humic acid-graphene oxide composite to improve adsorption for Cr(Ⅵ) [J]. Arabian Journal of Geosciences, 2019, 12(20): 615.
[58] SINGARAJ S G, MAHANTY B, BALACHANDRAN D, et al. Adsorption and desorption of chromium with humic acid coated iron oxide nanoparticles [J]. Environmental Science and Pollution Research, 2019, 26: 30044-30054.
[59] GARC A-HERN
A-HERN NDEZ M A, VILLARREAL-CHIU J F, GARZA-GONZ
NDEZ M A, VILLARREAL-CHIU J F, GARZA-GONZ LEZ M T. Metallophilic fungi research: an alternative for its use in the bioremediation of hexavalent chromium [J]. International Journal of Environmental Science and Technology, 2017, 14: 2023-2038.
LEZ M T. Metallophilic fungi research: an alternative for its use in the bioremediation of hexavalent chromium [J]. International Journal of Environmental Science and Technology, 2017, 14: 2023-2038.
[60] CHUN Y L, ZHANG Y, ZHANG Y, et al. Bioreduction of chromate in a methane-based membrane biofilm reactor [J]. Environmental Science & Technology, 2016, 50: 5832-5839.
[61] MICHEL C, BRUGNA M, AUBERT C, et al. Enzymatic reduction of chromate: comparative studies using sulfate-reduction bacteria [J]. Applied Microbiology Biotechnology, 2001, 55: 95-100.
[62] SUZUKI T, MIYATA N, HORITSU H, et al. NAD(P)H-dependent chromium(Ⅵ) reductase of Pseudomonas ambigua G-1: a Cr(Ⅴ) intermediate is formed during the reduction of Cr(Ⅵ) to Cr(Ⅲ) [J]. Journal of Bacteriology, 1992, 174(16): 5340-5345.
[63] LI M H, GAO X Y, LI C, et al. Isolation and identification of chromium reducing Bacillus Cereus species from chromium-contaminated soil for the biological detoxification of chromium [J]. International Journal of Environmental Research and Public Health, 2020, 17(6): 2118.
[64] HUANG X N, MIN D, LIU D F, et al. Formation mechanism of organo-chromium(Ⅲ) complexes from bioreduction of chromium(Ⅵ) by Aeromonas hydrophila [J]. Environment International, 2019, 129: 86-94.